Contents
Nicotinamide, Nicotinamide Riboside and Nicotinic Acid—Emerging Roles in Replicative and Chronological Aging in Yeast
www.ncbi.nlm.nih.gov/pmc/articles/PMC7226615/
要旨
ニコチンアミド、ニコチン酸、ニコチンアミドリボシドは、ヒトの食生活においてNAD+のビタミンB3前駆体である。NAD+は、様々な代謝酸化還元反応の補酵素としての重要な役割だけでなく、老化/長寿を含む多くの基本的な細胞プロセスに関与しているNAD+を消費する酵素のための義務的な副基質としての役割に由来する細胞生物学のための基本的な重要性を持っている。
老化の間、全身のNAD+レベルの低下が起こり、NAD+が必要とされるプロセスの効率が低下し、結果的に加齢に関連した生理的/機能的な衰えにつながるリスクに生物をさらすことになる。この文脈では、NAD+前駆体を用いた食事療法は、NAD+の減少を防ぎ、老化過程に共通するいくつかの代謝異常をこのような方法で減衰させるための有望な戦略であると考えられている。
NAD+前駆体の代謝と細胞寿命への影響は、増殖(複製老化)と非増殖細胞(慢性老化)の両方の老化過程を研究するために使用される最も確立されたモデル系の一つである酵母Saccharomyces cerevisiaeで行われた研究から大いに恩恵を受けている。
このレビューでは、ニコチンアミド、ニコチン酸、ニコチンアミドリボシドがNAD+代謝で果たす役割の重要な側面と、これらのNAD+前駆体のそれぞれがどのように複製老化と慢性老化の両方に影響を与えるさまざまな側面に貢献しているかを要約している。これらの知見は、NAD+代謝の複雑で動的な柔軟性を理解する上で有益であり、細胞の体力維持やNAD+前駆体に基づく栄養補助食品の開発に不可欠なものである。
キーワード
ビタミンB3,NAD+代謝、Sir2,老化、酵母
1. はじめに
ニコチンアミド・アデニン・ジヌクレオチド(NAD)は、細胞の生命エネルギーと代謝に必要な必須のピリジン化合物であり、エピジェネティックな改変、DNA損傷修復、老化/長寿などの主要な細胞プロセスの重要な調節因子でもある[1,2,3]。実際、解糖、TCAサイクル、酸化的リン酸化、β酸化などのいくつかの経路において、NADは酸化状態と還元状態の相互作用によって電子のアクセプター/ドナーとして機能する多くの酸化還元反応のコファクターである[1]。さらに、NAD+はいくつかのNAD+を消費する酵素にとって必須の共基質であり、その中でもサーチュインは進化的に保存されているIII型脱アセチラーゼのファミリーを代表している[4,5,6]。サーチュインは、標的タンパク質(ヒストンおよび非ヒストン基質)のNAD+切断および脱アセチル化をカップリングすることにより、細胞エネルギー代謝と、様々な栄養および環境刺激に応答する多様な生物の老化/寿命の調節との間の機能的なつながりを担っている[1,7,8]。
その結果、適切なNAD細胞内プールの維持は、酸化還元代謝を促進し、細胞全体の酸化還元状態を維持するために不可欠であり、またNAD+依存性の経路をサポートするためにも不可欠である。しかし、全体のNAD量を変化させないレドックス反応とは異なり、サーチュインが介在する脱アセチル化や、NAD+を消費する酵素が関与する他の細胞プロセスは、NAD+レベルに影響を与える。したがって、効率的な細胞のフィットネスを維持するためには、NAD+の一定の補充が必要であると考えられている。このような観点から、多くの生物では年齢に依存したNAD+量の減少が見られ、それが加齢に伴う代謝低下や加齢性疾患の発症に寄与していると考えられている[7,9,10]。さらに、いくつかのNAD+前駆体の補充は健康上の利点を有し、老化プロセスに関連する特定の欠乏を減衰させることができることが示されている[11,12,13,14,15]。これに関して、最近の会議(第3回NO-Ageシンポジウム 2019)で基礎研究者および臨床医によって発表されたNAD+前駆体の補充の結果に基づいたミニレビューが発表されている[16]。これらのNAD+前駆体、すなわちニコチン酸(NA)ニコチンアミド(NAM)ニコチンアミドリボシド(NR)は、ビタミンB3のグループに属し、酵母からヒトにまたがる種を超えてNAD+生合成に利用されている[1,12,17,18,19]。ビタミンB3は、日常の一部の食品(野菜、果物、肉、牛乳)に微量に含まれているため、食生活でも摂取可能であり、現在、健康的な老化防止効果のある栄養補助食品としての利用を目的として、栄養補助食品分野で大きな関心を集めている。
本レビューでは、NAD代謝と老化の理解に多大な貢献をしてきた出芽酵母サッカロミセス・セレビシエの研究を紹介する。前者については、NAD+前駆体への関心の高さから、特にNAD+の合成と恒常性に関わる複雑な反応ネットワークにおけるNA,NAM,NRの役割に注目している。本研究では、これらの前駆体が酵母の複製・老化に及ぼす影響についての研究結果をまとめた。これらの前駆体が酵母の複製老化に及ぼす影響をまとめたものである。これらのモデルは、繊維芽細胞のような分裂活性細胞の細胞老化と、筋細胞のような分裂後の休止期細胞の細胞老化をそれぞれシミュレートしている[20,21,22]。最後に、これらのNAD+前駆体、細胞代謝、酵母の長寿に関連する可能性のある制御回路について議論する。
哺乳類のNAD+代謝と酵母のNAD+代謝の比較については、いくつかの関連するレビューで詳細に分析されている[23,24,25,26,27]。
哺乳類のNAD+代謝については、哺乳類と酵母の比較検討が行われている。
2. ニコチン酸、ニコチンアミド、ニコチンアミドリボシド NAD+ホメオスタシスの鍵となる代謝物
酵母から哺乳類細胞に至るまで、NAD+はL-トリプトファンから始まるデノボ、または外因性に供給されるか、またはNAD+を消費する反応から回収された細胞内ピリジンである前駆体を利用するサルベージ経路のいずれかで生成される。NA、NAM、NRはこれらの前駆体の一つである[1,18]。酵母では、キヌレニン経路[18]とも呼ばれる de novo 合成は、Bn1-6 によって触媒される 6 つの酵素反応と自発的な環化反応を経てニコチン酸モノヌクレオチド (NaMN) の産生につながる (図 1)。NaMNは、NA/NAMサルベージ経路の収束点である。実際、NaMNは、ニコチン酸ホスホリボシルトランスフェラーゼNpt1によるホスホリボース部位のNAへの移動に続いて得ることができる。次に、NaMNは、ニコチン酸モノヌクレオチドアデニルトランスフェラーゼ(Nma1/Nma2)によってアデニル化され、ニコチン酸アデニンジヌクレオチド(Naアルツハイマー病)を生成する。最後に、Naアルツハイマー病はグルタミン依存性NAD+合成酵素Qns1によってアミド化され、NAD+を生成する(図1)[28]。NAから始まるNAD+生成までの経路は、一般にPriss-Handler経路として知られている[29]。NAは、高親和性パーミターゼTna1(NAのKMは約1.7μm)[30](図2)によって細胞内に取り込まれるか、ピラジンアミダーゼとニコチンアミダーゼPnc1(図1)によって媒介されるNAMの脱アミノ化を介して細胞内で生成される(図1)[31]。実際、哺乳類細胞とは異なり、S.cerevisiaeはNAMをニコチンアミドモノヌクレオチド(NMN)に変換する酵素であるニコチンアミドホスホリボシルトランスフェラーゼを持っていない。NAMはサーチュインが介在する脱アセチル化の細胞内産物である。実際、サーチュインはアセチル残基が除去されるごとに1分子のNAD+を消費し、O-アセチル-ADPリボースとサルベージ可能なNAMを生成し、これをNAD+合成に使用することができる[32,33]。S.cerevisiaeでは、Sirtuinsは5つのメンバー(Sir2,Hst1-4)から構成されている[9]。NAは標準的な酵母増殖培地で一般的に供給されるので、NAD+合成の大部分は、指数関数的に成長する酵母細胞におけるNA/NAMサルベージ経路に依存している[34]。
図1 酵母におけるNAD+合成 NAD+生合成に関わる経路の概略図
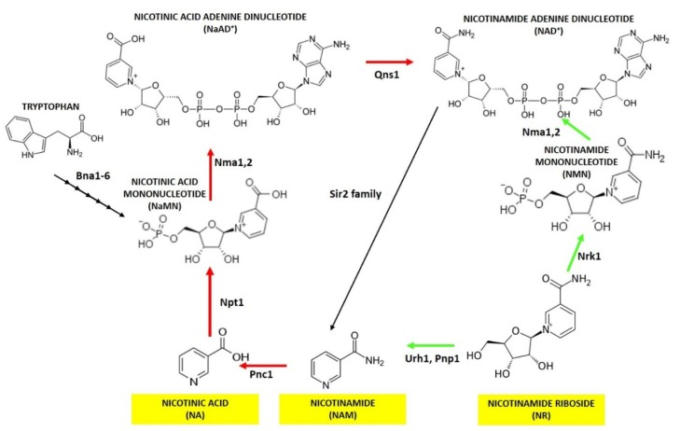
酵母では、トリプトファンから始まるde novo経路、またはニコチン酸(NA)ニコチンアミド(NAM)ニコチンアミドリボシド(NR)からのサルベージ経路でNAD+を得ることができる。NAD+生合成の各ステップを触媒する酵素名の略語が報告されている。プライス・ハンドラ経路は赤矢印、NR利用は緑矢印で示されている。
図2 酵母におけるNAとNRの代謝の簡易スキーム
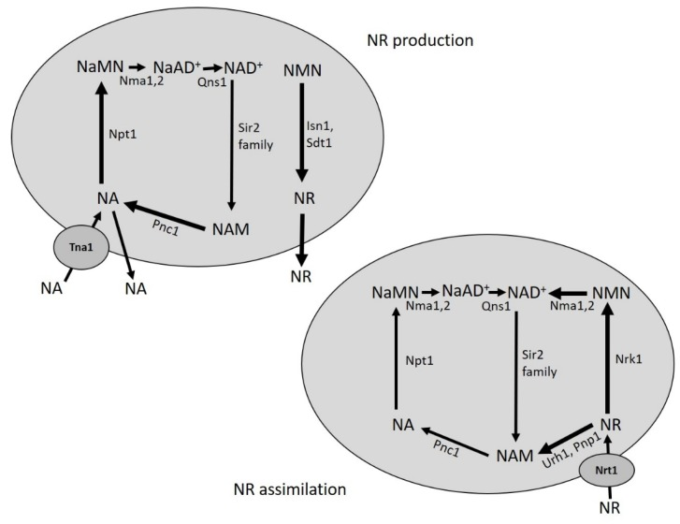
NAとNRは、構成的に生産され、成長培地中に放出され、酵母細胞によって回収される。NAとNRの取り込みはそれぞれTna1とNrt1に依存する。NAはPriss-Handler経路を促進し、NRはNrk1依存性およびUrh1/Pnp1依存性のサルベージ経路に入る。NAはNAMから細胞内で合成され、NRはNMNから合成される。酵素名の略称を報告する。詳細は本文を参照のこと。
細胞内では、Pnp1 と Urh1 が触媒する NR のリン酸化分解により、細胞内 NAM も生成され、NR のサルベージ経路と NA/NAM のサルベージ経路がつながっている(図 1)。Nrt1トランスポーター[36]によって細胞内に入ることができるNRもまた、ニコチンアミドリボシドキナーゼNrk1によるNRのリン酸化を必要とする別のサルベージ経路によってNAD+に変換される(図1および図2)[17]。最後のものは Nma1/Nma2 によって NAD+ に直接変換され、NMN と NaMN に対して二重の特異性を示す [37] (図 1)。NAとは異なり、NRは標準的な酵母増殖培地では欠乏しているが、それにもかかわらず、NRは細胞内のNAD+レベルを安定的に維持するためにNAに取って代わることができる[35]。さらに、de novo および NA/NAM サルベージ経路の両方に欠損した変異体は、成長のために NR の補給を必要とする [17]。注目すべきことに、NRとNAの両方が細胞外培地にも放出される(図2)[38,39]。これらのNAD+前駆体の輸出およびトランスポーター媒介の輸入は、細胞内NAD+プールの調節に寄与する細胞内コンパートメントと細胞外コンパートメントの間の双方向のフラックスを生じさせる[38,39]。このような動的な柔軟性は、成長条件の変化に、代謝ストレスに応答してNAD+の利用可能性を適応させるために有用であるかもしれない[38,39]。
最後に、ニコチン酸リボシド(NaR)は、Nrk1依存性およびNrk1非依存性の経路を介してNAD+前駆体として利用することができる別のヌクレオシドである[40,41]。前者では、NaR は NaMN を産生する Nrk1 によってサルベージされ、後者では Urh1 が NA を産生する NaR 利用の大部分を担っている(図 3)[41]。NaR はヌクレオチダーゼ Isn1 と Sdt1 によって NaMN から細胞内で生成される(図 3)[42]が、これらは NR 合成にも関与している(図 2 およびセクション 3.2 参照)。NRとは異なり、NaRは貧弱なサプリメントであり、細胞への輸入はメチルエステル修飾に依存する[41]。
図3 酵母におけるNaR代謝のスキーム

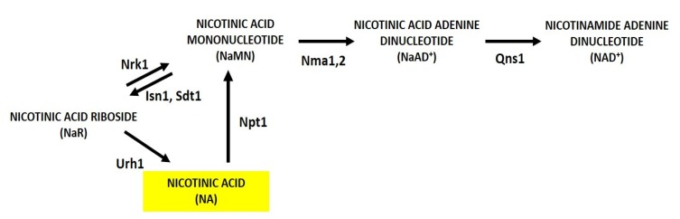
NaRはNrk1とUrh1に依存する2つのサルベージ経路を介してNAD+合成に利用され、それぞれNaMNとNAを生成する。NaRは、Isn1とSdt1によってNaMNから細胞内で生成される。酵素名の略称を報告する。
3. NAD+前駆体と複製寿命(RLS)
では、酵母の複製老化に対するNA,NAM,NRの効果をまとめ、分析する。S.cerevisiaeの非対称な細胞分裂(出芽)のため、複製老化は母細胞特異的であり、母が娘(芽)細胞を産生する能力が限られていることを特徴としている。母体が死ぬまでに養分の存在下で生成できる芽の数から、複製潜在能力または複製寿命(複製寿命(RLS))を測定することができる[43]。複製老化との関連では、NAD+を消費する酵素の中でも、サーチュインファミリーの創設メンバーであるSir2がアンチエイジング因子として重要な役割を果たしている。実際、Sir2の脱アセチラーゼ活性は複製寿命(RLS)を促進する[44,45]。Sir2はテロメア、成熟型遺伝子座(HMLおよびHMR)rDNA座での遺伝子サイレンシングに必要であり、ここでは低アセチル化されたクロマチン状態の確立と維持に関与している[46]。SIR2の機能喪失は、サイレンシングの減少およびrDNA座における組換えの増加と協調して複製寿命(RLS)の減少をもたらす[33,47]。このような組換えの増加は、複製加齢の間に報告されており、複製寿命(RLS)に悪影響を及ぼす因子であるゲノム不安定性に寄与している[48,49,50]。さらに、加齢に伴う H4 リジン 16 アセチル化の増加は、複製的に老化した細胞における Sir2 を標的とした脱アセチル化の欠如に関連した特定のサブテロメリック領域で発生し、その結果、サイレンシングが減少している[51]。その結果、NAD+前駆体の複製寿命への影響を評価する際には、Sir2のサイレンシング活性に注目が集まっている。
3.1. 複製寿命(RLS) に影響を与える NAD+ 前駆体 NA
NAは、前述したように合成酵母培地中に存在し、Tna1により細胞内に効率よく取り込まれる。しかし、NAは、機能的なde novo経路を有する細胞にとって必須の補足ではない。実際、細胞はNAを含まない合成培地で良好に成長するが、複製寿命(RLS)の減少とテロメリックサイレンシングの貧弱さを示す[35]。この成長条件では、細胞内のNAD+濃度は約1 mMであるのに対し、NAを含む合成培地では約2 mMであるため[35]、1 mMのNAD+は細胞が成長のための代謝要件に対処することを可能にするが、Sir2活性には制限的であることが示唆されている[35]。この仮説は、Sir2のNAD+のKMが29μMであることを考慮して提案されている[52]。この親和性は細胞内濃度1 mMのNAD+で満たすことができるが、一方ではNAD+の細胞内区画化(ミトコンドリア、サイトゾル、核)を考慮しなければならず、他方ではNAD+の大部分がタンパク質に結合していることを考慮しなければならない[53]。このように、遊離核NAD+の量は、Sir2活性のための十分な副基質要件を下回る可能性がある。成長培地中にNAが存在し、その結果、サルベージ経路の前駆体が利用可能になると、NAD+レベルが増加する。このような増加は Sir2 の機能を促進し、複製寿命(RLS) を拡張させる [54]。これに伴い、NAサルベージ酵素Npt1を欠失した細胞は、正常な成長、NAD+レベルの深刻な減少、Sir2を媒介とするサイレンシングの損失、および短い複製寿命(RLS)によって特徴付けられる[35,55,56,57]。さらに、npt1ヌル変異体はde novo経路の遺伝子のアップレギュレーションを示すが、サルベージ経路の遺伝子は影響を受けないことから、これらのヌル変異体はNA/NAMサルベージに欠損しており、NAD+生合成をde novo経路に依存していることが示唆される[58]。この経路は成長に必要な要件を満たすことができるが、ネガティブな複製寿命(RLS)に影響を与えるSir2機能の要件を満たすことはできない。興味深いことに、de novo パスウェイの遺伝子の転写は Hst1 の制御下にある(図 4a)。この NAD+ 依存性脱アセチラーゼは、NAD+ センサーや BNA 遺伝子の抑制の程度を調整する NAD+ レベルの調節因子としても作用することが提案されている [58] [58] npt1 ヌル変異体では、低 NAD+ レベルが Hst1 の活性を低下させ、BNA 遺伝子の抑制を解除するフィードバック機構が起こる [58] 。Hst1の低いNAD+結合親和性(94.2 µMのKM)は、de novo合成が起こることを保証し、成長要件を満たすために十分なNAD+レベルを回復させる。Hst1を介してNAD+ホメオスタシスを制御するこの追加的な制御回路の存在は、NPT1の過剰発現がNAD+レベルを増加させることなく、Sir2依存性複製寿命(RLS)の伸長を促進する理由を説明するのに貢献している可能性がある[56]。
図4 NAD+の主な生合成経路のスキーム
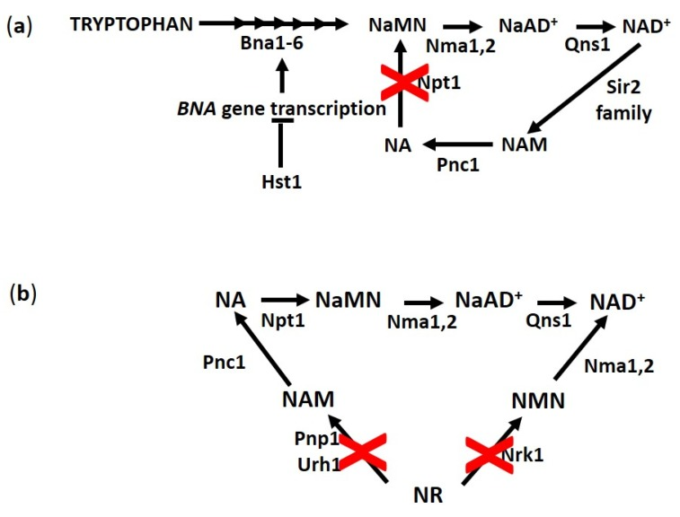
(a) Hst1は、酵母におけるde novo NAD+合成に必要なBNA遺伝子の転写をネガティブに制御している。NPT1の不活性化により、サルベージ経路を介したNAとNAMのリサイクルが阻害される。(b) Nrk1,Pnp1,Urh1を欠損した細胞は、NAD+合成にNRを利用できない。酵素名の略称を報告する。
3.2. NAD+の恒常性と長寿をつなぐ新しいビタミン「NR
NR は効率的な NAD+ 前駆体であり、そのリサイクルは NAD+ ホメオスタシスや 複製寿命(RLS) にとって重要であることが示されている [17,35,42]。NR は Nrk1 依存的経路と Urh1/Pnp1 媒介経路を介して同化される(図 2);これらのサルベージ経路は、外因性の NR と、サイトゾル内の Isn1 と Sdt1 のヌクレオチダーゼ活性によって NMN から生理的に生成された NR の利用に関与している(図 2)[38,42]。また、NRはPho8によってNMNから液胞でも産生されており、細胞質と液胞プールでのNRのコンパートメンテーションが存在することを示唆している(図2)。この文脈では、トランスポーターFun26は、2つのNRプールの間のバランスをとる機能を持つことが示唆されている[59,60]。これは、一方では、液胞で生成されたNRを必要に応じてNAD+合成をサポートする細胞質への輸送を可能にし、他方では、過剰になった細胞質のNRを液胞へ輸送することを可能にするかもしれない。このように、NRの同化、放出、再取り込みの制御は、細胞外と細胞内の両方のコンパートメントを包含する拡張された柔軟なNAD+プールに依存している。さらに、NMNアデニル転移酵素とNMNヌクレオチダーゼの活性のバランスが、特定のNAD+要求に応じて、ピリジンヌクレオチド代謝をジヌクレオチドへの「前進」またはヌクレオシドへの「後退」を駆動するための重要なポイントであるように思われる[60]。
NAD+レベルを調節する恒常性メカニズムのこのような動的な柔軟性において、 npt1変異体へのNR補給は、Sir2依存性のサイレンシング欠損を救済し、複製寿命(RLS)を延長させる [35]。同様に、NAフリー合成培地で培養した細胞へのNR補給は、Sir2依存性サイレンシング欠損を抑制するのに十分であり、複製寿命(RLS)を延長させる。この効果は、NRサルベージ経路に依存し、細胞内NAD+量の増加(約1mMから約2mM)を伴う[35]が、これは、NA供給について上述したように、十分なSir2活性の支持を提供する可能性がある。しかし、NAとNRの両方がNAD+レベルを高めることができるが、後者のビタミンは、より長期的な効果を示する。実際、NA補給後のNAD+量は培養成長の過程で減少するが、NR補給後は安定したままである[35]。このことは、NRの同化は、細胞の老化に伴って生理的に起こるNAD+の減少を防ぐことができることを示している[61,62]。
3.3. NAM:複製老化の問題点か資源か?
NAMは、Pnc1によってNAに変換された後、NAD+合成の基質として使用することができるサルベージ可能なビタミンである。これは、Urh1/Pnp1を介したNRの異化反応やSir2脱アセチラーゼ反応の副産物として生成することができる(図4a)。また、NAMは内因性の非競合的なSir2阻害剤でもあり、酵素反応をNAD+とアセチル化標的の改質にシフトさせる(図4a)[5,33,47]。その結果、細胞内のNAMレベルは、異なる細胞コンパートメントでのNAMの生成と消費のバランスの結果である。酵母増殖培地へのNAM補給(5mM)はSIR2活性を阻害し、その結果、SIR2不活性化のフェノコピーが得られる。Pnc1の過剰発現は、過剰なNAMをNAに変換することで、外因的に添加されたNAMの抑制性サイレンシング効果を無効化し、複製寿命(RLS)を増加させる[63]。このことは、外因的に輸入されたNAMは高濃度の局所的なNAMを生成し、それが核内のPnc1によってSir2を阻害することで除去されない場合、複製促進性の老化作用を持つことを示唆している。注目すべきは、Pnc1の過剰発現(5つのコピーを追加)だけでも、Sir2依存性の方法で複製寿命(RLS)を大幅に増強するのに十分であるということである[64]。
さらに、カロリー制限細胞で観察される複製寿命(RLS)の延長には、Pnc1とSir2の両方が必要とされている[64,65]。しかし、Sir2に依存しないCRに応答する老化経路が報告されている[66,67]。カロリー制限(CR)は、酵母から霊長類に至るまでの幅広い生物の寿命を延ばすことが知られており、栄養失調を起こさずに栄養摂取を制限する方法である。酵母では、CRは一般に、成長培地中のグルコース濃度を2%から0.5-0.2%に減少させることによって課される:2%のグルコースと同様に成長を維持する成長条件である[71,72]。この文脈では、グルコース濃度がSir2酵素活性に影響を与える可能性のあるメカニズムについて多くの研究が行われてきた。特に、CR が NAD+ レベルを増加させたり、NAD+ 代謝物の比率を変化させたりするなど、さまざまなモデルが提案されているが [64,73] 、明確なコンセンサスはまだ得られていない。
CR中のNAD+代謝物の定量は、グルコース制限がNAD+、NAM、NADHのレベルや比率に影響を与えず、Sir2活性の増加を促進することを示している[74]。このことは、異なる細胞内コンパートメントにおいて、NAD+/NADHレベルおよび他のNAD+中間体の局所的な変化が起こる可能性を排除するものではない。残念ながら、異なるコンパートメントにおける遊離ピリジンヌクレオチドの絶対レベルを決定することが困難であるため、現在までのところ、このような可能性を厳密に評価することはできない。しかしながら、NAD+代謝に関与する酵素のタンパク質コピー数の決定は、他の酵素のレベルが変化していないのに対し、グルコース制限された豊富な培地ではSir2とPnc1の両方がアップレギュレーションされ、グルコース制限された合成培地ではPnc1のみがアップレギュレーションされていることを示している[75]。さらに、CRによって誘導されたPnc1の発現の増加は、NAMの加水分解率の増加と相関しており、サルベージ経路に沿ったフラックスの増加を示唆している[64]。
NAM とそれに対応するサルベージ経路が Sir2 活性と同様に 複製寿命(RLS) にも重要な役割を果たしていることは、NAM のアイソステアである イソニコチンアミド(INAM)を用いて行った実験からも明らかになっており、これは NAM アンタゴニストであり、試験管内試験 および 生体内試験 では Sir2 アゴニストである。INAMはNAMの阻害を緩和することでSir2を活性化し、Sir2が介在するサイレンシングを増強する[61,76]。さらに、NA を含まない合成培地では、INAM 添加は NAM 阻害の緩和と NAD+ 量の増加が複合的に寄与して Sir2 活性を増加させ、複製寿命(RLS) の延長をもたらすことが示されている[61]。INAM 添加は細胞内 NAD+ 濃度を、外因性の NA または NR の存在下で決定されたレベルと同様のレベルにまで回復させる [35](上記の NA および NR のセクションも参照のこと)。INAMによるNAD+の増加は、サルベージ経路に沿ったフラックスの増加と一致するNpt1とPnc1を必要とする[61]。このようなフラックスの増加は、NRサルベージ経路のUrh1/Pnp1を介した分岐から提供されるNAMによっても促進される[61]。
全体として、NAMは、その細胞内濃度が十分に高い場合、外因性の補充の場合のように、Sir2の強力な阻害剤であるが、同時に、Sir2の十分な生物学的活性を確保するNAD+の効果的な前駆体でもあり、したがって、そのプロ複製的長寿の役割を支持するものである。
4. NAD+前駆体と経時寿命(CLS)
では、NAD+前駆体が慢性老化に与える影響を分析する。酵母細胞は、栄養分の枯渇により、分裂しない休止状態(定常期)で慢性的に老化する。クロノロジカルライフスパン(経時寿命(CLS))とは、休止状態の培養物のマイトシス後の生存率を指する。ジアクシスシフト後72時間後から、経時寿命(CLS)は、新鮮で豊富な培地に戻ったときに成長を再開し、コロニーを形成することができる細胞の割合によって推定される[77]。栄養の利用可能性の漸進的な変化により、経時的老化は大規模な 代謝再構成によって特徴づけられる:特に、グルコースが枯渇するディアウ クシスシフトでは、細胞はグルコース主導の発酵からエタノール/酢酸塩主導の呼吸へと移行する。この再構成により、細胞は生存に必要な特定の機能を獲得することができ、主にミトコンドリア呼吸の増加と糖新生の活性化が関与している。前者は慢性長寿に不可欠であり[78,79,80]、後者はトレハロースの産生をサポートし、その蓄積は経時寿命(CLS)の延長に有益である[79,81]。グルコース生成に関連して、最初の不可逆反応はホスホエノールピルビン酸カルボキシキナーゼ(Pck1)によって触媒される。Pck1の酵素活性は、その脱アセチル化/アセチル化状態によって制御されている。アセチル化(活性)状態が増加すると、グルコネオジェネシスが促進され、経時寿命(CLS)が延長される。Pck1 の脱アセチル化に関与する酵素は Sir2 である[81,82]。その結果、慢性的な老化の間、Pck1 の糖新生活性に対する Sir2 活性の負の制御は、経時寿命(CLS) にも負の影響を及ぼすことになる [83]。実際、複製寿命(RLS) とは異なり、Sir2 は 経時寿命(CLS) を促進しない[62,81,84,85]。
このように、NAD+前駆体が慢性老化に及ぼす影響は、一方では細胞の老化に伴って観察されるNAD+レベルの生理的な低下に直面するメカニズム[35,86]と、他方では経時寿命(CLS)に影響を及ぼす代謝経路が関与している可能性がある。
経時寿命(CLS)に対するNA、NR、NAMの影響
NA、NR、NAM およびそれらのサルベージ経路は、複製寿命(RLS) の調節に果たす役割について主に研究されてきたが、上述したように、慢性老化におけるそれらの関与のいくつかの側面が浮かび上がってきている。実際、NR利用が完全に阻害されたnrk1Δurh1Δpnp1Δ変異体(図4b)では、経時寿命(CLS)が有意に低下していることが示された。逆に、NAサルベージ経路(図4a)を介してNAD+合成を阻害するNpt1の欠如は、複製寿命(RLS)[35,61]について観察されてきたものとは異なる経時寿命(CLS)[38]に影響を与えない。さらに、短命のnrk1Δurh1Δpnp1Δ変異体へのNA補給は、その経時寿命(CLS)に影響を与えない[38]。このことは、NRサルベージ経路がNAよりも経時寿命(CLS)に重要であり、NRの同化が静止期の細胞生存に必要である可能性を示唆している。一貫して、NRは主に成長の後期指数相で産生される [38]。さらに、NRサルベージ経路は、CRによって誘発される経時寿命(CLS)の延長にも重要であると考えられる。実際、CRレジメンは経時寿命(CLS)と同様に複製寿命(RLS)を増加させる可能性がある[22]。nrk1Δurh1Δpnp1Δ変異体の短命表現型は、CRの影響を受けない[38]。
慢性的に老化した細胞における休止プログラムの確立は、長期生存の確保に寄与する内因性防御機構の活性化にも関与する。これに関連して、CR下で増殖した細胞の経時寿命(CLS)延長は、強化された熱ストレス耐性を伴う[87,88]。nrk1Δurh1Δpnp1Δ変異体では、CRによる熱ストレス耐性は消失している[38]。
また、最近では、時 代的老化(ディアウイックシフト)の開始時に NAM を補給すると、Sir2 活性を阻害して 経時寿命(CLS) の延長を決定することが報告されている [62]。NAMを補給した細胞は、慢性的に老化したSir2Δ細胞をフェノコピーしている。これらの細胞はどちらも、経時寿命(CLS) の延長を確実にする同じ代謝変化を示す。特に、Sir2の欠乏やNAMによるSir2阻害は、Sir2を標的とした脱アセチル化の欠如により、Pck1のアセチル化活性型が増加することと相関している[62,81,82]。この結果、トレハロースの蓄積量の増加に伴い、糖新生が亢進する。さらに、NAM 媒介の Sir2 阻害、および SIR2 の不活性化は、より効率的な呼吸活性と関連しており、その特徴は、非リン酸化呼吸が減少し、有害なスーパーオキサイドアニオンの負担が減少することと相関している[62]。これらの特徴はすべて、長期生存率の向上に寄与している[79,80]。さらに、Sir2の欠乏は、重度のCRで得られる経時寿命(CLS)の延長をさらに悪化させる。NAMを補充した細胞もまた、このような極端なCR状態ではsir2∆細胞の経時寿命(CLS)をフェノコピーする[62]。この経時寿命(CLS)延長効果は、アセチル化Pck1レベルの上昇と同時に起こり[83]、慢性老化の間の細胞標的Pck1に対するSir2活性の重要性をさらに支持している。
特に、Sir2の欠損はNR分岐へのピリジンヌクレオチドの流れを促進し、NRの放出を増加させることが報告されている[38]。慢性加齢期の細胞生存にはNRの同化が必要であると考えられるため、今後、SIR2不活性化による代謝アウトカムとNR代謝の関係を明らかにするための研究が必要である。
5. 酵母培養によるNRの生産
NRは、米国の食品医薬品局(FDA)および欧州食品安全機関(European Food Safety Authority)[89]により、一般的に安全と認められている(GRAS)と認定されている。NRは、NIAGEN(Chromadex Incorporated、カリフォルニア州アーバイン、米国)というブランド名でサプリメントとして入手可能になっている。S.cerevisiaeはGRAS属の生物であるため、他のより高価な合成方法を避けて、安全な発酵プロセスを経てNRを入手する大きな機会を提供することができる。この文脈では、培地への NR の輸出量が増加する変異体 nrk1Δurh1Δpnp1Δを出発点として[38,42]、NR トランスポーターをコードする NRT1 を不活化すると、培地中に約 4.06 ± 0.9 µM の NR が蓄積され、野生型では 0.12 ± 4 µM の NR が蓄積されることになる[39]。NA 添加を含む生育および培地組成のさらなる最適化により、細胞外の NR レベルが 28.2 ± 8.5 µM にまで上昇し、2 段階のプロセス(冷メタノールでの可溶化および SP-sephadex カラムでの分離)で精製された [39]。これらの結果から、安価なビタミン(NA)を利用して、精製回収が容易なNRを得ることができる可能性が示唆された。
6. 結論
NAD+代謝は厳密に制御されているだけでなく、非常にダイナミックで柔軟性に富んでいる。これらの特徴は、異なるNAD+生合成経路(デノボ経路とサルベージ経路)が、いくつかの重要な中間体のレベルで複雑なネットワークに統合されていることに起因している。これにより、NAD+の不均衡を防ぎ、細胞が老化を含む環境・生理的条件の変化に応じて代謝要件に対処することを保証する。実際、老化の間には、全身的なNAD+の低下が起こり、時間の経過とともに生物の体力を低下させる原因となっている[9,10]。酵母からヒトに至るまでのNAD+前駆体であるNA, NAM, NRは、このようなNAD+代謝・恒常性を支える重要な機能を果たしており、ここで紹介する様々な側面から明らかになったように、酵母の複製的・経時的な老化に直接影響を与えている。
特に、NAとNRの役割を調べていくと、細胞内と細胞外のプールにこれらのNAD+前駆体のコンパートメント化が存在しているという興味深い側面が浮かび上がってくる[56,59]。さらに、このコンパートメント化は、細胞内酵素活性を調節するための更なる手段である可能性を排除することはできない。実際、Pnc1が介在する経路に沿って、サルベージ可能なNAMはNAに変換され、分泌される[39]。NAMはSir2の内因性非競合的な阻害剤であるため[5,33]、NAの輸出は、一方ではNAサルベージ経路を介した適切なフラックスを可能にし、他方では、老化の調節因子としてよく知られているこのSirtuinの脱アセチラーゼ活性を細かく制御することができる。この文脈では、外因性NAMがSir2を阻害するのに十分な濃度で細胞に供給されると、複製老化および慢性老化においてSir2が果たす反対の役割に応じて、2つの反対の結果が得られる。前者では Sir2 の阻害は短い 複製寿命(RLS) をもたらし、後者では 経時寿命(CLS) の延長をもたらす [62,81,84]。
NA と NR については、特に NR の同化は、複製老化と慢性老化の両方において酵母細胞の生存を促進するのに有効であると考えられている。さらに、NRはGRASとして認識されており、栄養補助食品(NIAGEN)として経口的に生物学的に利用可能である。これは、実験動物モデルで観察されたNRの潜在的な利点をヒトに評価する機会を提供している。前臨床研究[14,90,91]から有望な結果が得られており、いくつかの臨床試験では成人におけるNR補給の安全性、耐性、および有効性が決定されているか、または現在決定されている[11]。公表された臨床データは、NRが安全で忍容性が高いことを示している [92,93,94,95]。しかしながら、肥満の男性では、肥満に関連したいくつかの障害された生理機能(耐糖能、ミトコンドリア機能)[95,96,97]について、NR補給後の改善が観察されていないため、女性および他の疾患を有する患者を含む可能性のある大規模な臨床試験が必要である。
最後に、酵母で得られた、複製老化および慢性老化に対するNAM、NAおよびNRの異なる寄与についての情報を考慮に入れると、健康上の利益を達成するためにそれらを差別化して使用することができるという仮説を立てることができる。特に、NAMとNRは分裂後の細胞に対して、NAとNRは活発に分裂している細胞に対して、有望な戦略を提供する可能性がある。これらのNAD+前駆体が、ヒトの細胞タイプや組織に応じて有益な効果を持つか、有害な効果を持つかを理解するためには、さらなる研究が必要である。
