Contents
Nicotinamide Mononucleotide: Exploration of Diverse Therapeutic Applications of a Potential Molecule
www.ncbi.nlm.nih.gov/pmc/articles/PMC6359187/
要旨
ニコチンアミドモノヌクレオチド(NMN)は、ニコチンアミドアデニンジヌクレオチド(NAD+)生合成の中間体としての役割が最もよく知られているヌクレオチドである。
NMNの生合成経路は真核生物と原核生物で異なるが、真核生物ヒトの場合は主にニコチンアミドを利用したサルベージ経路とニコチンアミドリボシドのリン酸化経路の2つの経路がある。適切なトランスポーターが利用できないため、NMNはニコチンアミドリボシドの形で哺乳類細胞内に入り、その後NMNとNAD+への変換が行われる。
この特定の分子は、前臨床試験でいくつかの有益な薬理活性を示しており、その治療への応用が示唆されている。NMNの薬理活性には、主にNAD+生合成への関与を介して、細胞の生化学的機能、心臓保護、糖尿病、アルツハイマー病、肥満に伴う合併症などが含まれている。
最近では、この分子の抗老化作用が発見されたことで、この分子の研究に貴重なエッセンスが加わった。本稿では、哺乳類および原核細胞におけるNMNの生合成とその吸収機構、およびマウスモデルでの薬理活性の報告を中心に解説する。
キーワード
老化、アルツハイマー病、糖尿病、虚血性前処理、ニコチンアミドモノヌクレオチド、肥満
1. はじめに
ニコチンアミドモノヌクレオチド(NMN)またはニコチンアミド-1-ウム-1-β-D-リボフラノシド5′-リン酸塩は、リン酸基とリボースとニコチンアミドを含むヌクレオシドとの反応によって自然に形成される生理活性ヌクレオチドの一種である[1]。一般的には、α型とβ型の2つの異性体が存在する。β型異性体はこの2つの間の活性型であり、分子量は334.221 g/molである[2]。NMNは様々な種類の食品に豊富に含まれている[3]。ブロッコリーやキャベツなどの野菜には0.25-1.12および0.0-0.90mgのNMN/100gm、アボカドやトマトなどの果物には0.36-1.60および0.26-0.30mgのNMN/100gm、生の牛肉には0.06-0.42mgのNMN/100gmが含まれている[3]。また、NMNはMethanobacterium thermoautotrophicumのNadM、Haemophilus influenzaのNadR、Francisella tularensisのNadM/Nudixのような原核生物の酵素の基質としても利用されている[4]。
ヒトの細胞では、NMNは細胞エネルギー源として利用可能である。少し前までは、この分子はニコチンアミド・アデニン・ジヌクレオチド(NAD+)生合成の中間体としての活性しか知られなかった。このNAD+生合成過程において、NMNはニコチンアミドモノヌクレオチドアデニルトランスフェラーゼ1や核内由来のNMNAT1,ミトコンドリア由来のNMNAT3などの酵素の重要な基質として働き、ヒトのNAD+への酵素変換を助けている[5]。最近、前臨床研究では、心臓・脳虚血、アルツハイマー病、食事療法や加齢に伴う2型糖尿病、肥満など、NAD+の欠乏と関連した多様な薬理活性が示されている[6,7,8]。Camacho-Pereiraらは、NAD+依存性アセチラーゼ(SirtuinsポリADP-リボースポリメラーゼ(PARPNADase(CD38)などのNAD+消費酵素の増加レベルが加齢に伴うNAD+の減少に寄与することを示している[9]。哺乳類細胞では、細胞表面NADase酵素の一種であるCD38がNAD+を分解してニコチンアミドと(環状-)ADP-リボースを形成する[10]。一方、NAD+の支出は、PARPがDNA修復に役立つ分岐型ADP-リボースポリマーを生成するのを助ける[11]。NAD+を消費する酵素の別のグループであるサーチュイン(SIRT 1-7)は、NAD+を消費することで異なる機能を果たす。サーチュインの最も一般的なNAD+媒介機能である脱アセチル化とは別に、デスキニラーゼ、デマロニラーゼ、リポアミダーゼ、デグルタリラーゼ酵素活性などの他の機能も注目すべきもので、エネルギー不足の細胞適応や代謝機能の改善に役立つ[12]。NMNの投与は、これらのNAD+消費酵素によるNAD+の欠乏を補うことができる。
NMNは、他のNAD+前駆体-ニコチンアミドリボシド(NRニコチン酸、ニコチンアミド[13]のような類似の特性を共有している。NMNとは異なり、ニコチン酸、ニコチンアミドは、それらの治療的応用の点でいくつかの欠点を有する。ニコチンアミドは、肝毒性またはフラッシングを引き起こす可能性があり、最近の前臨床研究では、NMNと比較してより短い期間、ラットの体内に存在することが示唆されている[14,15]。ナイアシンやニコチン酸は、即時放出製剤として投与された場合、皮膚紅潮などの副作用と関連しているが、徐放製剤では肝毒性を引き起こす可能性がある[16]。NAD+前駆体のうち、NRおよびNMNは、これら2つの代謝物については好ましくない副作用がほとんど報告されていないため、例外である[17]。さらに、ニコチンアミドリボシドもNMNと同様に経口的に生物学的に利用可能である。これらを考慮すると、NMNは現在進行中の臨床試験(NCT03151239, UMIN000021309, UMIN000030609, UMIN000025739)で支持されている好ましい治療法の選択肢として提案される可能性がある。
ここでは、NMNの生合成経路と吸収について議論した後、臨床的に報告されている薬理学的特性とその基礎となる作用機序を総合的に分析している。このことは、これらの成功した前臨床結果をヒトの疾患の治療に転用する可能性についての洞察を提供するものである。
2. 生合成と吸収機構
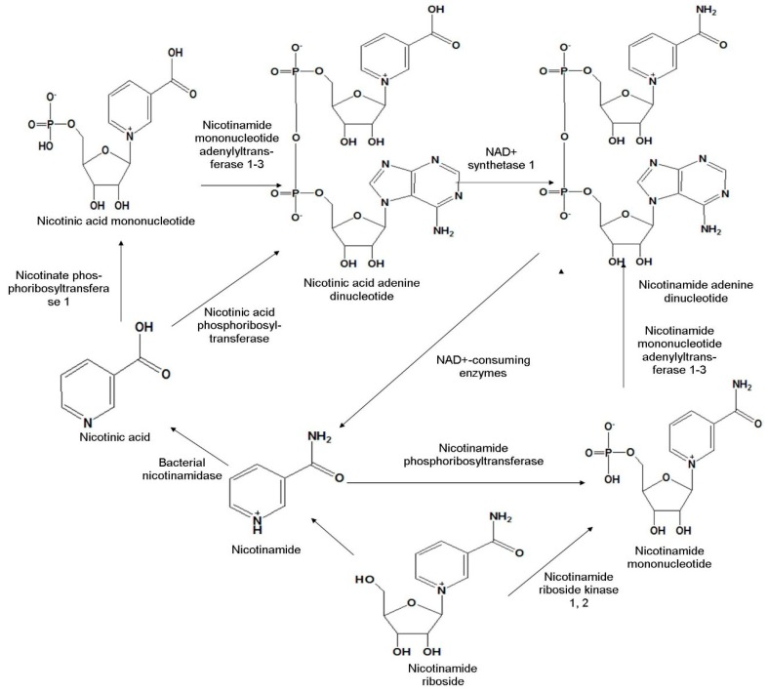
NMNはNAD+生合成の中間産物であるため、NMN合成を正しく理解するためにはまずNAD+の生合成に注目する必要がある。この特定の生合成経路は、NAD+の欠乏を補うメカニズムを明らかにするために重要である。NAD+は哺乳類細胞では、-1)トリプトファンからのde novo経路-合成、-2)ニコチンアミドまたはニコチン酸からのサルベージ経路-合成、-3)NRの変換の3つの異なる経路で合成されている[18]。これらのうち、後者の 2 つの経路については、ここでは NMN が中間的な副産物であるため、本レビューではこの 2 つの経路について論じることにする(図 1)。
図1 哺乳類細胞におけるニコチンアミドモノヌクレオチドの生合成経路
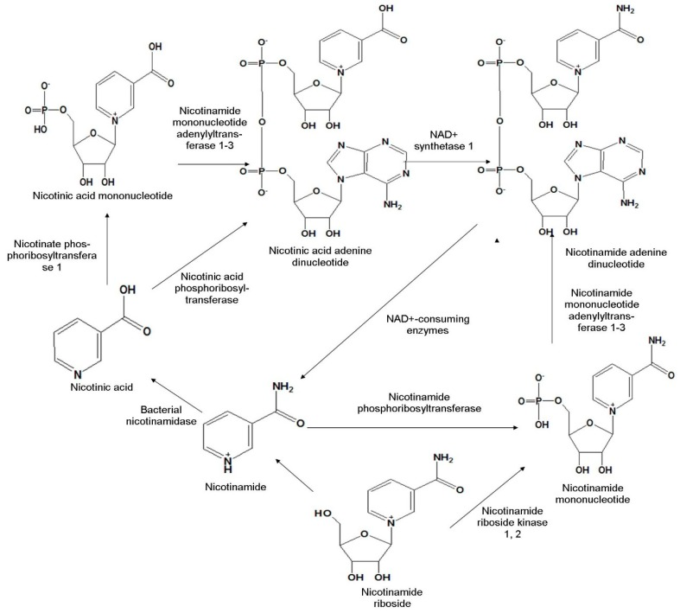
サルベージ経路は、哺乳類細胞ではほとんどが優勢である[19,20]。この経路では、NAD+の中間分解生成物、例えばニコチン酸およびニコチンアミドは、新しいNAD+を生成するために再利用される。最も一般的には、この経路は、ニコチン酸のニコチン酸ホスホリボシルトランスフェラーゼ1によるニコチン酸モノヌクレオチドへの変換に続いて、ニコチンアミドモノヌクレオチドアデニルトランスフェラーゼ1,3の存在下でニコチン酸アデニンジヌクレオチドへのアデニル化を含む。 時には、ニコチン酸は、ニコチン酸ホスホリボシルトランスフェラーゼによってニコチン酸アデニンジヌクレオチドに直接変換される。その後、NAD+合成酵素1の助けを借りてNAD+に変換される。このNAD+は、NAD+を消費する酵素によってニコチンアミドに分解され、次いでニコチンアミドホスホリボシルトランスフェラーゼの触媒活性によってNMNに変換される。ニコチンアミドホスホリボシルトランスフェラーゼ1とニコチンアミドホスホリボシルトランスフェラーゼは共にホスホリボシルピロリン酸からのホスホリボシル残基の移動を触媒している(図1)[21,22]。
Bieganowskiらは、酵母およびヒト細胞を用いた研究において、ニコチンアミドリボシドキナーゼ(NRK1およびNRK2)の助けを借りてリン酸化することでNMNに変換される別のNAD+前駆体分子NRを発見した[1]。形成されたNMNはその後、酵素的にNAD+に変換される(図1)。
原核生物の細菌、例えば、特定の遺伝子型を有する大腸菌(Escherichia coli)からの溶解物を使用することは、NMNを生産するための簡単で費用対効果の高い方法であることが示されている[23]。細菌では、NAD+生合成は少し異なる方法で行われる。ほとんどの細菌は、de novo経路とサルベージ経路の両方に依存しているのに対し(例えば、Bacillus anthracis一部の細菌は経路のいずれかに依存しているのに対し(例えば、Helicobacter pylori)[24]。いくつかの細菌、例えば、結膜症の原因菌であるグラム陰性好気性細菌Francisella tularensisは、NAD+合成のためのわずかに異なる経路に従う。ここでは、ニコチン酸モノヌクレオチドのNMNへのアミド化は、まずNMN合成酵素の助けを借りて行われ、その後NMNアデニルトランスフェラーゼによるNAD+へのアデニル化が行われる[24]。
Nostoc punctiformeとSynechocystisを除いて、ほとんどのシアノバクテリアはNMNを介さないNAD+産生の生合成経路をたどっている[25]。N. punctiformeでは、ニコチンアミドリボシドはPnuC様トランスポーターに取り込まれ、リボシルニコチンアミドキナーゼによるNMNへの変換、ニコチンアミドヌクレオチドアデニルトランスフェラーゼによるNAD+への変換が連続して行われる。一方、Synechocystisが辿る経路はヒトと類似している。ここでは、ニコチンアミドホスホリボシルトランスフェラーゼとニコチンアミドモノヌクレオチドアデニルトランスフェラーゼの触媒活性により、ニコチンアミドがNMNに変換され、その後NAD+に変換される[25]。
生合成に続く問題は、経口投与後の NMN の吸収機構である。生合成後、NAD+ は腸壁を介して容易に吸収される。マウスモデルの助けを借りて、腸から血液循環への NMN の吸収は 2-3 分以内に始まり、15 分以内に完全に組織に吸収されることがわかった。その後、肝臓、骨格筋、皮質などの組織ですぐにNAD+として変換されて貯蔵される。この肝NAD+含有量の増加は約30分間持続する[3]。NMNを6ヶ月間投与した後、このスパイクしたNAD+濃度は肝臓と褐色脂肪組織で観察されるが、骨格筋と白色脂肪組織では観察されない[3]。哺乳類細胞に入る前に、NMNは脱リン酸化を受けてNRを産生する。ピロホスファターゼと5′-テクトヌクレオチダーゼ活性を持つ細胞外受容体CD73がこの反応を行う。哺乳類細胞は、平衡化ヌクレオシドトランスポーター(Equilibrative Nucleoside Transporters)またはENTを有しており、これはNRの進入を促進する。新たに形成されたNRは、その後、哺乳類細胞内で外因性NAD+前駆体として作用する(図2)。これに続いて、ユビキタスに発現するNRK1は、NMNへのNRのその後の変換を助けます[26]。
図2 哺乳類細胞におけるNMNの吸収の模式図
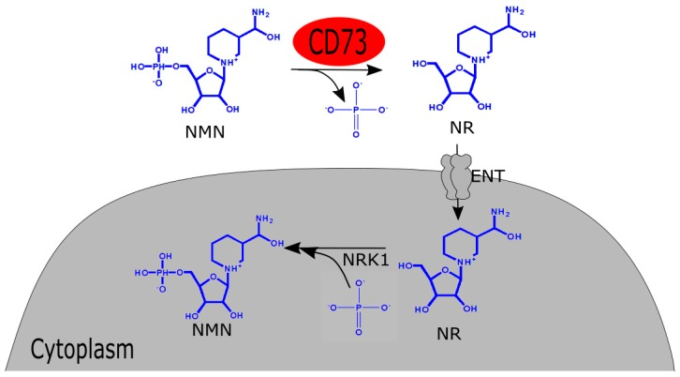
NMN:ニコチンアミドモノヌクレオチド;NR:ニコチンアミドリボシド;NRK 1:ニコチンアミドリボシドキナーゼ1;ENT. 平衡化ヌクレオシド輸送体。
原核生物と真核生物のNMN生合成経路の違いやNMNの迅速な吸収パターンを考慮すると、NMNはNAD+のターンオーバーに最も重要な意味を持つ代謝物の一つとして推察される。
3. 薬理活性
NMNは、現代の治療法に新たな地平を切り開く可能性がある。この生体分子は、心筋や脳虚血、アルツハイマー病などの神経変性疾患、糖尿病などの前臨床疾患モデルにおいて、多くの有益な薬理活性を示している[6,7,27]。最近では、マウスモデルでの抗老化作用、寿命延長作用が発見されたことから、NMNは治療薬候補としての魅力を増している[28]。その薬理作用の大部分はNAD+合成を促進することで行われるが、NAD+を直接高用量で投与すると不眠、疲労、不安などの副作用を示すことがあり、またNMNに比べて細胞膜への浸透性が悪いことから、NAD+の合成を促進することで薬理作用を発揮する。
3.1. 虚血-再灌流障害
虚血性イベントにより、心筋細胞または心筋細胞内の酸素量およびアデノシン三リン酸(ATP)レベルが減少する。さらに悪化すると、これらの心筋細胞は壊死する [30]。再灌流は、再酸素化プロセスとしても知られており、以前に虚血を受けた組織に血液を再供給するイベントである。再灌流により、血液が組織細胞に再侵入し、微小血管損傷によるカルシウム(Ca2+)過負荷と活性酸素の産生を引き起こす。これらの連続した事象が重度の組織損傷を引き起こす [31]。再灌流に続く虚血は、虚血性前処理またはIPCとして知られる人体のメカニズムによって打ち消される致命的な状態である[32]。IPCは体内の内因性メカニズムであり、複数のシグナル伝達メディエーターを刺激することで、この状態を回復させるのに役立つ[33]。IPCはsirtuin1(SIRT1)の活性化を誘導する[34]。SIRT1は、酸素フリーラジカルの生成に関与するFoxO転写因子のリジン残基の脱アセチル化を引き起こすNAD依存性クラスIIIヒストン脱アセチル化酵素タンパク質である。したがって、虚血や再灌流による酸化ストレスや傷害から身体を守るための対抗機序を提供する。SIRT1はその脱アセチラーゼ活性のために細胞内NAD+に依存している[35]。山本らは、NAD+サルベージ経路の律速酵素であるニコチンアミドホスホリボシルトランスフェラーゼとSIRT1の活性化を介したIPCとの関連を調べた[7]。ニコチンアミドホスホリボシルトランスフェラーゼ+/-マウスを用いて、ニコチンアミドホスホリボシルトランスフェラーゼが虚血・再灌流後の心筋損傷を減衰させる正の役割を持つことを明らかにした。ニコチンアミドホスホリボシルトランスフェラーゼはNAD+産生の律速酵素であるため、500mg/kgのNMNを虚血発症30分前または再灌流期間中6時間ごとに24時間投与すると、リン酸緩衝生理食塩水対照と比較して梗塞サイズがそれぞれ44%および29%減少し、虚血・再灌流傷害が有意に改善された。しかし、この介入を心臓特異的KOマウスに対して繰り返したところ、NMNの介入は成功しなかった。このことから、NAD+生合成の中間産物であるNMNは、SIRT1を活性化する能力を持っており(図3)IPCの作用を模倣して虚血再灌流障害を改善していると考えられる[7]。
図3 SIRT1を介したNMNの薬理活性のメカニズム
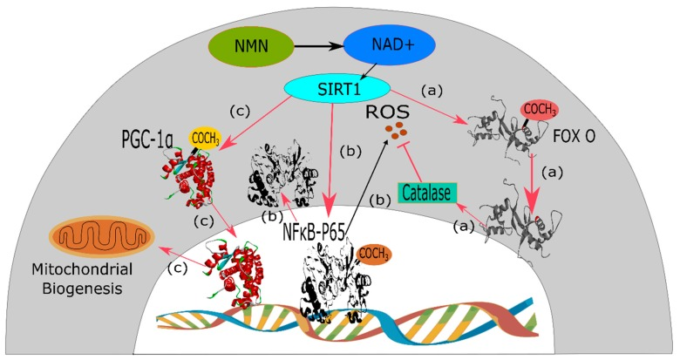
NMNは細胞内でNAD+に変換され、SIRT1を介して生理機能を発揮する。
(a) SIRT1はFOXO転写因子のリジン残基を脱アセチル化し、カタラーゼ酵素を刺激して活性酸素を抑制し、虚血再灌流障害につながる連鎖反応を抑制する。
b)正常な状態では、NFκB転写因子複合体のp65サブユニットは、そのアセチル化された形態で、インスリン抵抗性の原因でもある活性酸素を発現する。SIRT1は、その固有の脱アセチル化活性により、p65-NFκBを脱アセチル化し、その結果、2型糖尿病の発生の原因となる活性酸素の産生を抑制する。
(c) SIRT1はまた、タンパク質PGC-1αを脱アセチル化し、ミトコンドリアの生合成に関与するタンパク質の発現を刺激し、アルツハイマー病の治療に利用することができる。
この SIRT1 を介したメカニズムとは別に、この心保護活性に関与することが示されている別の経路は、虚血の発生に応じて NMN を提供するタイミングに応じて解糖またはアシドーシスを刺激することである[36]。虚血発症前にNMNを投与すると解糖が亢進して虚血発症時のATP産生が促進され、心保護が促進される。対照的に、再灌流中にNMNが与えられると、主に心臓の乳酸とピルビン酸が寄与するアシドーシスを誘発して心臓を保護する。これにより、ミトコンドリアの透過性遷移孔が遮断されるため、心臓の保護が確実に行われる[37]。
また、NMNは前臨床試験で脳虚血の治療にも有効であることが示されている。Parkらの最近の研究では、一過性前脳虚血マウスにNMNを62.5 mg/kgの用量で導入し、海馬のNAD+レベルの枯渇、ポリADP-リボシル化(PAR)の蓄積など、虚血後のイベントの異なるバイオマーカーの発現を調べた。再灌流後の神経学的転帰と海馬CA1神経細胞死は対照群と比較して有意に改善した。同時に、PARの生成とNAD+の異化は減少し、体温は変化せず、NMN治療のみがこの虚血性脳損傷に対する保護効果を担っていることが証明された[27]。
現在のシナリオを見ると、臨床試験データが不十分であり、薬物動態および薬力学的研究が不足しているため、虚血再灌流傷害から心臓と脳を保護するための利用可能な介入戦略は限られている[38]。また、この状態に至る複雑なイベントが連続して起こるため、冠動脈バイパスグラフト手術や経皮的冠動脈インターベンションなどのさまざまな外科的介入の利点も制限されている[39]。NMNは前臨床研究で成功を収めており、本疾患の代替治療戦略として機能する可能性がある。
3.2. 神経疾患。アルツハイマー病と脳内出血
NMNはアルツハイマー病の根本的な原因であるミトコンドリアの形態異常、酸素消費率(OCR)の低下、NAD+含量の低下などを治療する能力があることがLongらによって示されている[8]。現在、メマンチンやコリンエステラーゼ阻害薬のガランタミンのような薬理学的介入は、対症療法を目的としたものにすぎない。さらに、これらの薬理学的介入は食欲不振や徐脈などの副作用を引き起こすため、NMNはこの疾患の病因を直接標的としているため、重要な役割を果たすことができる[40]。NAD+は、酸素がミトコンドリアによって消費される好気性呼吸における触媒活性のために認識されている[41]。アルツハイマー病の老化と病態生理の両方のために、NAD+の利用可能性が減少し、脳や筋肉細胞のミトコンドリアによるOCRの低下につながる[8]。ここでも、ミトコンドリアのダイナミクスは、ミトコンドリアの分裂と融合に完全に依存している。その結果、ミトコンドリアはより多くの断片化、すなわち分裂の増加と融合の減少を受ける傾向があり、ミトコンドリアの異常な形態と機能につながる[42,43]。Longらによる発表された研究では、ミトコンドリアOCRアッセイのためにADキメラAPP(スイ)/PS1(ΔE9)(AD-Tg)マウスにNMNを導入し、ミトコンドリアの形態を評価するために、神経細胞のミトコンドリアにタグ付けされた蛍光タンパク質(CaMK2a-mito/eYFP)を持つマウスに導入した[8]。NMNは、効率的に血液脳関門を横断し、ミトコンドリアのNAD+の欠乏を補うことによって、AD-Tg-vehicleおよび非トランスジェニックビヒクル処理群と比較して、トランスジェニックAD-Tgマウスのミトコンドリアの最大OCRを増加させるのに有効であることが判明した。また、非トランスジェニックマウスと比較して、AD-Tg-NMN処理マウスでは、最大OCRの増加に加えて、非トランスジェニックマウスと比較して、ADP(状態3の呼吸開始のための)の添加後のOCRを有意に増加させることに成功したが、基底OCRは同程度であった。NMNはまた、サルベージ経路によるNAD+生合成を介してSIRT1を活性化し、順番に、ミトコンドリアの生合成に責任がある標的タンパク質PGC-1α(図3)の脱アセチル化を刺激した[44]。CaMK2a-mito/eYFPマウスでも、NMN処理群ではミトコンドリアの断片化が減少し、ミトコンドリアの長さが増加した。
アミロイドβオリゴマー(アミロイドβまたはA-βとしても知られる)は、アルツハイマー病患者の脳内にアミロイド斑を形成する神経毒性タンパク質の一種である[45]。また、海馬の長期増強(LTP)の抑制にも関与している[46]。NMNはアミロイドβオリゴマーのLTP誘導をベースラインより140%抑制することに成功した。また、アミロイドβオリゴマー注入ADモデルラット(用量500 mg/kg、腹腔内投与)では、海馬スライス培養(OHC)においてNMNがアミロイドβオリゴマー誘導細胞死を65%減少させ、認知機能の改善を示した[45]。この結果は、アルツハイマー病におけるNMNの潜在的な治療効果が証明された先行研究を裏付けるものである。今後、投与量の検討や臨床試験が進めば、アルツハイマー病の治療薬として期待されている。
脳内出血(ICH)は脳卒中の約10~15%を占めるもう一つの神経疾患であり、NMNは病状を改善することができる[47]。ICHによる損傷は2つの段階に分かれており、まず、血腫形成による隣接組織への機械的損傷が起こり、その後、血腫による病理学的変化(細胞毒性、興奮毒性、神経炎症を引き起こす炎症経路の活性化など)を介した二次的損傷が起こる。コラゲナーゼ誘発性ICHマウスモデルを用いた研究では、ICH発症30分後に300mg/kgのNMNを腹腔内投与したところ、NMN投与によりICH発症2時間後と6時間後の脳内NAD+濃度が上昇し、筋萎縮性側索硬化症や虚血性脳卒中からの保護効果が得られることが示された。さらに、NMN治療は、脳の患部における浮腫、神経細胞死、活性酸素量、神経学的炎症、細胞間接着分子-1の発現、好中球浸潤、ミクログリア活性化の減少によって測定される有意な改善をもたらした。この介入は血腫の体積とヘモグロビン含量の減少には至らなかったが [49] 、ICHが介在する状態を改善することに成功したので、NMNがICHの治療に使用できることを示唆している。
3.3. 糖尿病
また、NMNは糖尿病の治療薬としても利用できる可能性を示している。インスリン抵抗性は、酸化ストレス、増強された炎症反応、脂質代謝障害に起因して発生する2型糖尿病の特徴であり、そのすべてがNAD+ [6]によって改善することができる。高脂肪食と老化は、糖尿病のこの特定のタイプの素因に寄与し、共通のメカニズムの一つは、NAD+ [6]の減少である。主に飽和脂肪からなる高脂肪食は、ニコチンアミドホスホリボシルトランスフェラーゼレベルを低下させ、最終的に肝臓と白色脂肪組織のNAD+を減少させることができる[6]。一方、加齢は膵臓、白色脂肪組織、骨格筋、肝臓のNAD+レベルの低下に若年層に比べて大きな影響を与えている[6]。このNAD+は、様々な生理的障害に対するセーフガードとして機能する。脂質過酸化生成物からの酸化ストレスに対する保護因子であるグルタチオンSトランスフェラーゼは、NAD+によって回復する[50]。さらに、免疫・炎症性メディエーター核内因子κB(NF-κB)の2つの標的であるインターロイキン1β(IL-1β)およびS100カルシウム結合タンパク質A8およびA9の発現は、NAD+によってダウンレギュレーションされる[51]。このNF-κBもまた、インスリン抵抗性を引き起こす原因となっている。NAD+によるSIRT1の活性化はNF-κBのp65成分の脱アセチル化を促進し(図3インスリン抵抗性を防ぐことができる[52]。吉野らは、高脂肪食と加齢により誘発される2型糖尿病を元に戻すために、高脂肪食を与えた雌の糖尿病マウスと雄の糖尿病マウスにNMNを500mg/kg/日で7日間と10日間連続して腹腔内投与した。その結果、雌雄ともにインスリン不耐症が有意に改善したが、雌の方が改善した[6]。加齢性糖尿病の場合には、同一用量のNMNの単回投与と11回連続腹腔内投与で、それぞれ糖尿病オスマウスとメスマウスの耐糖能が改善された。糖尿病でない正常マウスでは、NMNはグルコースの恒常性を阻害しなかったが、高齢の糖尿病マウスでは、グルコースのみでのエネルギー利用と高脂血症の改善が確認された。また、膵島細胞からのIL-1βの抑制により細胞外ニコチンアミドホスホリボシルトランスフェラーゼ濃度を上昇させ、β細胞からのインスリン分泌を回復させることで、炎症を媒介とした膵島細胞機能障害を改善した[53]。
3.4. 肥満とその関連合併症
NMNは用量依存的に加齢に伴う体重増加を減少させることができ、マウスを用いた研究[3]で裏付けられている。この研究では、NMNの100および300 mg/kgの用量を12ヶ月間にわたって投与したところ、成長と食欲を損なうことなく、対照群と比較して、それぞれ4%および9%の体重減少が認められた。肥満と糖尿病の病態は相互に関連している。肥満は、ミトコンドリアの機能不全を引き起こす生化学的経路の変化を介して負の健康効果を発揮する。機能不全の筋肉と肝臓のミトコンドリアによるNAD+とNADHレベルの変化によるATP産生の減少は、インスリン抵抗性と2型糖尿病につながる[54,55,56]。NAD+はミトコンドリアを刺激してATPを生成することで、細胞のエネルギーレベルを補充するのに役立つ[57]。前述したように、SIRT1は、肥満により阻害されているミトコンドリアの生合成を改善するための補因子としてNAD+を利用している(図3)[58]。最近の研究では、高脂肪食(高脂肪食)誘発肥満マウスにNMNを投与し、トレッドミル運動とNAD+含量の改善能力を評価し、比較するために、平均15m/minで45分間、週6日、6週間継続した。毎日体重500mg/kgの用量で17日間NMN治療を行ったところ、運動は筋肉のみでNAD+を増加させたのに対し、高脂肪食誘発肥満によって以前に減少していた筋肉と肝臓の両方のNAD+含量を増加させることに成功した[59]。また、NMN治療はグルコース不耐症などの代謝障害を改善し、運動と同様に肝クエン酸合成酵素活性を低下させた[59]。上記の議論に照らすと、非アルコール性脂肪肝疾患のような他の多くの肥満に関連したメタボローム合併症に対するこの効果はまだ探索されていないが、NMNが肥満に関連した特定の代謝合併症を改善することができることが推察される[59]。
3.5. 老化
ジェロサイエンスは、加齢とそれに伴う疾患との関係を扱う分野である[60]。老化の過程には、いくつかの加齢に関連した合併症が伴う。老化は、膵臓、骨格筋、肝臓、皮膚、脂肪組織、脳などの複数の臓器におけるNAD+の枯渇により、前述したように、ミトコンドリアによるエネルギー産生が低下することを特徴とする人間の自然現象である[3,61,62]。ミトコンドリア機能の低下とは別に、加齢はDNA損傷、認知障害、サーチュイン遺伝子の不活性化などの生物学的変化にも関連しており、これらはNAD+によって修復することができる[63]。加齢に伴うNAD+数の枯渇、特に核起源のNAD+数の枯渇は、酸化的リン酸化のPGC-1α/β非依存性経路のミトコンドリア制御の混乱を説明し、疑似hypoxiaを導くことにもなる。これは、NAD+の量を増加させることによって逆転させることができる[64]。NAD+は、高齢マウスの筋幹細胞のような細胞を再生する能力が報告されている。NAD+のもう一つの前駆体であるNRは、神経新生を誘導し、メラノサイト幹細胞の減少を食い止め、マウスの寿命をわずかに延ばす能力があることが報告されている[65]。NAD+の前駆体であるNMNは、これらの有益な効果も提供することができる。
NAD+レベルの低下は、加齢に伴うDNA損傷にも関連している。NAD+は様々なタンパク質のnudixホモロジードメインに結合している。nudixホモロジードメインの具体的な機能はまだ発見されていないが、Deleted in Breast Cancer protein1 (DBC1)がこのドメインを保有しており、DNA修復タンパク質PARP1を阻害することが研究で示されている[66]。NAD+はDBC1のnudixドメインに結合するため、PARP1の阻害が逆転する。加齢に伴い、NAD+レベルが低下し、PARP1はDNA修復能力を失う。この現象を、ガンマ線によるDNA損傷を受けた老齢マウス(30ヶ月齢)と若齢マウス(6ヶ月齢)を用いて評価した。マウスには500mg/kg/日の腹腔内NMNを1週間投与した。実験期間終了後、NMNは肝内NAD+濃度を増加させ、DNA損傷の修復におけるPARP1活性を増加させることが明らかになった[67]。
加齢とともに、目や骨などのさまざまな細胞や組織の病態生理的変化が明らかになってきた。NMNは100 mg/kg/日と300 mg/kg/日の用量で、これらの異常の原因となっているrd8変異を含むトランスジェニックマウスC57BL/6N株の眼底の斑点を減少させるのに有効であることが明らかになった[3]。また、NMNを12ヶ月間投与した場合には、用量依存的に涙の産生量が増加し、300mg/kg/日の投与では、マウスの生涯の最大涙産生量に匹敵する涙の産生量を増加させることができた[3]。このことから、加齢による光学異常を回復させる能力があることが明らかになった。また、加齢に伴う生理的変化の特徴である骨密度の低下は、NMNによって用量依存的に有意に回復した[3]。
血管系の衰えもまた、老化の過程でよく見られる現象である。これはフリーラジカルによる酸化ストレスを伴う。NMNはマウスモデルで試験したところ、これらの条件を逆転させるのに有効であることが判明した。De Picciottoと彼の共同研究者はNMNの有効性を分析するためにこの特殊な分野の研究を行った[69]。血管機能は頸動脈内皮依存性拡張(EDD)の観点から評価され、一方、血管酸化ストレスの分析には一酸化窒素介在性EDDが用いられた。高齢のコントロールマウス(26~28ヶ月)では、若いコントロールマウス(4~8ヶ月)と比較して、これらのパラメータの両方で機能が低下していた。C57B1/6の雄性マウスに300mg/kg/日のNMNを8週間経口投与したところ、頸動脈のEDDと一酸化窒素のEDDの両方が若いコントロールマウスと同様に正常レベルに回復した。また、酸化ストレスマーカーであるニトロチロシンの豊富さ、エラスチンの減少、血管SIRT1活性の低下など、高齢マウスの条件はすべてNMN投与によって逆転した。さらに、動脈をNMNで48時間インキュベートすると、マンガンスーパーオキシドジスムターゼが50%増加し、NAD+レベルが3倍に増加したため、酸化ストレスが減少した[69]。
骨格筋、白色脂肪組織、肝臓、免疫機能などの代謝器官における特定の遺伝子の発現も、加齢とともに低下し始める。Millsらはマイクロアレイを用いた評価を行った結果、骨格筋の300の遺伝子のうち76.3%、白色脂肪組織の360の遺伝子のうち73.1%、肝臓の513の遺伝子のうち41.7%がNMN処理によって発現が上昇していることを明らかにした[3]。これだけでなく、免疫代謝系、特に白色脂肪組織の免疫細胞の発現増加、好中球の減少やリンパ球、サイトカイン活性、白血球活性の増加などの血液学的状態の改善は、高齢化したマウスへの NMN 投与の成果である[3,70]。前述したように、体重の増加やエネルギー代謝や運動機能の低下、加齢によるインスリン不感症やトリグリセリド値の上昇などの肥満に関連した合併症も加齢と関連している。これらの条件は、12ヶ月間のNMN介入によって逆転した[3]。
前臨床試験でのNMNの成功を受けて、慶應義塾大学医学部(東京)とワシントン大学医学部(セントルイス)の研究者たちは、NMNの第I相臨床試験のための共同研究プログラムを開始した[28]。この研究の目的は、臨床モデルにおけるNMNの安全性とバイオアベイラビリティーを評価することであった。この研究から得られたポジティブな結果は、待望の老化治療戦略に新たな方向性をもたらす可能性がある。
4. ニコチンアミドモノヌクレオチドとニコチンアミドリボシド どちらが良いのか
NAD+前駆体の中でも、これまではNMNとNRのみが薬物動態や薬理学的に優れた性質を示していた。そのため、この2つの中間体は現在、臨床試験に広く利用されている。しかし、まだ疑問が残っている。どちらが優れているのか?両方の中間体を支持する研究者は、彼らの支持する引数を持っている。NRは通常のヒトの食事から入手可能であり、他の中間体への変換を必要としないため、細胞への浸透が容易である。NMNは人間の消費の安全性を証明はまだであるが、NR投与の安全性の研究がある。肥満患者を対象とした糖代謝およびインスリン感受性の改善効果を評価するために 2000 mg/日の NR 補給を 12 週間実施した試験では、NR は糖代謝およびインスリン感受性の改善には至らなかったが、NR 投与は安全であった[71]。一方、NMNはそれ自体にかなりの強力な利点を持っている。フリードライヒ失調症(Friedreich’s Ataxia: FRDA)というまれな遺伝性小児心疾患の治療効果を評価したところ、NR治療が失敗したところでNMNが成功した[72,73]。この疾患では、ミトコンドリアタンパクであるフラタキシンのアセチル化が亢進し、SIRT3活性が低下することで心肥大が生じる。FXN-KOマウスに500mg/kg NMNを1週間に2回、6週間投与したところ、通常の生理食塩水処理の対照マウスと比較して拡張期機能の改善と収縮期機能の正常化がみられた。この正の効果は、フラタキシンに対するSIRT3の脱アセチラーゼ活性を増加させることによって媒介される[72]が、別の研究では、FXN KOマウスに10mg/kgのNRを5週間投与しても、SIRT3活性も心機能も改善されなかった[73]。
βアミロイドプラークが主な原因と考えられているアルツハイマー病の認知機能障害を治療する場合、NMNはアミロイドβプラークの産生を減少させることで、その負担を軽減するのに十分な効果があった。3xTgAD/Polβ+/-マウスに6ヶ月間、飲料水に12mMを投与したところ、アミロイドβ蓄積への影響はないものの、DNA損傷、神経炎症、海馬ニューロンのアポトーシスが有意に減少し、脳内SIRT3活性が増加して認知機能が改善することが観察された[74]。これに対し、NMN 100 mg/kg を 28 日間皮下投与したところ、脳内のアミロイドβ蓄積を減少させることで、シナプスの消失、炎症が減少し、神経行動が改善された。その背景にあるメカニズムは、NMNによるアミロイド原性アミロイド前駆体タンパク質(APP)の阻害と非アミロイド原性APPの刺激であった[75]。
NMNとNRの効率性の境界線を明確にすることは非常に困難である。両者は、いくつかの重複する活性を共有していると結論付けるのが妥当であり、また、それ自体の正の影響と負の影響もある。
5. 今後の展望
我々の生物学的システムにおける NAD+ の前駆体分子として、NMN は様々な疾患状態の治療に重要な役割を果たすことができる。NAD+は、ベンズ(a)アントラセンやベンズ(a)ピレンへの暴露などの遺伝毒性ストレスに応答して細胞の生存を刺激することが明らかになった[76]。遺伝毒性による細胞死の原因は、NAD+を利用してNAD+を減少させるNAD+依存性ミトコンドリアDNA修復酵素PARP-1の過剰活性化である。また、アポトーシス誘導因子(AIF)のミトコンドリア膜から核への転座を引き起こす[77,78,79]。NAD+を供給することで、細胞の生存率を大幅に向上させることができる。NMNが細胞の生存を改善するためにNAD+の代用として機能しうるかどうかは、重要な研究分野となりうる。
この特定のメカニズムは、1型糖尿病につながるβ細胞の破壊にも関与している[80]。膵島のβ細胞がβ細胞毒素、すなわちストレプトゾシンや酸化ストレスにさらされている場合、PARP-1は、DNA鎖切断を元に戻すために細胞内のNAD+ストレージを利用している。その結果、ATP産生とタンパク質合成は、ベータ細胞死を誘発する減少している[81,82]。NMNはATP不足を補うために使用される可能性があり、したがって、ベータ細胞が生き残ることを可能にする。
前述の2つの研究分野とは別に、アポトーシス、DNA修復、ストレス抵抗性、代謝、内分泌シグナル伝達を制御するモノ-ADPリボシルトランスフェラーゼやサーチュイン酵素のような酵素とNAD+の関連も関心のある分野であり得る[13]。NAD+代謝は、これらの生物学的プロセスに関連する異常の潜在的な標的となり得るので、NMNは治療上の利益をもたらし得る。
6. 結論
NMNは、科学者たちが長年探し求めてきた前臨床試験で有意な有益な薬理活性を示しているが、臨床的・毒性学的にはまだ十分なデータが得られていない。また、NMNの製造コストが高いため、最終的な価格が上昇し、患者の立場からすると負担が大きい。これらの欠点があるにもかかわらず、NMNはアルツハイマー病、糖尿病、心血管疾患の治療薬として使用される可能性のある化学物質である可能性がある。NMNのいくつかのカプセル製剤は、すでに市場で利用可能である。先進的な臨床研究と新たな薬理学的応用の探求により、NMNは「オールインワン」の介入戦略となり、医学における治療アプローチの新時代を切り開くことができるであろう。