Contents
www.ncbi.nlm.nih.gov/pmc/articles/PMC6412771/
オンラインで2019年2月23日に公開。
要旨
ナイアシン(別名「ビタミンB3」または「ビタミンPP」として知られている)は、ニコチンアミド・アデニン・ジヌクレオチド(NAD)とニコチンアミド・アデニン・ジヌクレオチドリン酸(NADP)という補酵素を生成する2つのビタマー(ニコチン酸とニコチンアミド)を含んでいる。
この2つの補酵素は、エネルギー生産に不可欠な酸化反応に必要なだけでなく、非酸化シグナル伝達経路に関与する酵素の基質となり、遺伝子発現、細胞周期進行、DNA修復、細胞死などの生物学的機能を制御している。中枢神経系では、ビタミンB3が神経細胞の発達と生存に重要な役割を果たすことが古くから認識されている。
ここでは、ナイアシンおよびその誘導体の神経保護作用に関する文献データを概観し、特に神経変性疾患(アルツハイマー病、パーキンソン病、ハンチントン病)やその他の神経病理学的疾患(虚血性外傷、頭痛、精神疾患)におけるナイアシンの関与に焦点を当てる。
キーワード
中枢神経系、食事、NAD(P)、神経変性疾患、ナイアシン、ニコチンアミド、ニコチン酸、ビタミンB3
1. はじめに
ナイアシン(別名「ビタミンB3」または「ビタミンPP」として知られている)は、ニコチン酸(ピリジン-3-カルボン酸)とニコチンアミド(ニコチン酸アミド)という2つのビタミンの総称であり、生物学的に活性な補酵素、ニコチンアミドアデニンジヌクレオチド(NAD)とそのリン酸アナログ、ニコチンアミドアデニンジヌクレオチドリン酸塩(NADP)[1](図1)を生み出している。この2つの補酵素は、エネルギー生産に重要な酸化還元反応に参加する。特に、ピリジン環は、水素化物イオン(:H-、プロトン1個と電子2個に相当)を受け入れて供与し、電子キャリアとして機能する。それにもかかわらず、NADとNADPは細胞質で異なる代謝的役割を果たしている:NADH/NAD+の比は小さい(約8×10-4)ため、酸化的異化を促進するが、NADPH/NADP+の比は高い(約75)ため、生合成反応に強い還元環境を提供する[2,3]。
図1
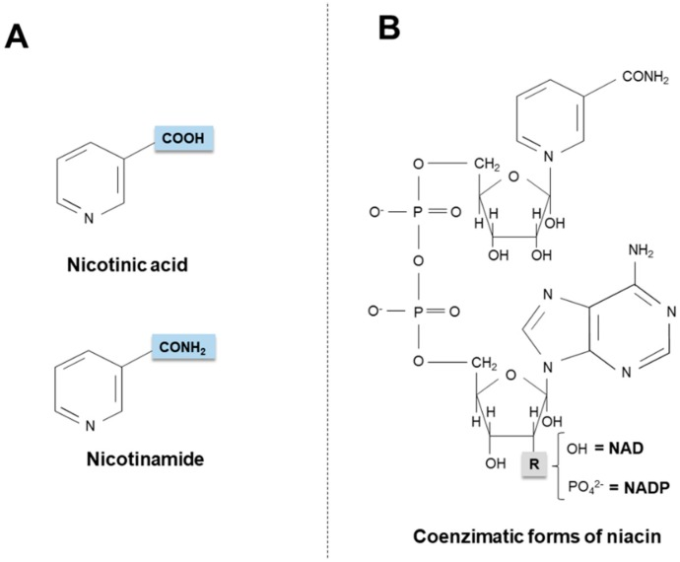
ナイアシンビタマーの化学構造(A)と活性補酵素型(B)。NAD:ニコチンアミド・アデニン・ジヌクレオチド。NADP:ニコチンアミド・アデニン・ジヌクレオチドリン酸塩。
細胞内NADプールの維持は、酸化還元代謝を燃料とするだけでなく、NAD依存性の非酸化還元シグナル伝達経路をサポートするためにも重要である。NADは確かに、このようにニコチンアミドとADP-リボシル生成物にNADを分解して、遺伝子発現、細胞周期の進行、インスリン分泌、DNA修復、アポトーシスと老化を調節する細胞シグナルカスケードで重要な役割を果たしているADP-リボシルトランスフェラーゼの基質である[4,5,6]。最後に、NADはプリンリン作動性P2Y1およびP2Y11膜サブタイプ受容体の内因性アゴニストとしても認識されており、内臓平滑筋の神経伝達を阻害し[7]、免疫細胞を活性化する[8,9]とされている。
2. ナイアシンのソース
ヒトは内因性と外因性の両方の供給源からナイアシンを得る。食事中のトリプトファン(Trp)のわずか2%しかナイアシンに変換されないが、主に肝臓で発生し、多段階の経路(を参照)を経てナイアシンに変換される[10]。食事は、ニコチン酸、ニコチンアミド、Trp、およびナイアシンの活性型補酵素としてビタミンを提供する。
2.1. 外因性のソース
ナイアシンは動物性および植物性食品に含まれている。肉や魚では、ビタミンはNAD(P)として存在し、その量は加工食品に比べて未加工食品では高い(補酵素の酵素加水分解は食品調製中に起こる可能性がある)。
成熟した穀物(特にトウモロコシ)では、ナイアシンは大部分がナイアシン配糖体として、またごく一部がペプチド結合型ナイアシンとして存在しており、総称して「ナイアシノゲン」と呼ばれている。ナイアシノゲンと複合化している場合、腸内酵素がナイアシンを遊離させることができないため、ナイアシンの利用率は低い(30%程度)。
一旦摂取されると、遊離ナイアシンは胃に吸着されるが、小腸ではより速く吸収される。腸球ブラシ境界膜を横切る輸送のメカニズムはまだ完全には解明されていない。いくつかのトランスポーターは、実際に、腸内ナイアシンの取り込みに関与しているように見える。その中でも最も一般的なのは、ヒト有機アニオントランスポーター-10(hOAT-10,尿酸塩やp-アミノヒプル酸塩の輸送を媒介するプロトン駆動型キャリア)[12]であり、生理的濃度でのナイアシンの取り込みに関与している[13]。とナトリウム共役モノカルボン酸トランスポーター(SMCT1またはSLC5A8,乳酸、ピルビン酸と短鎖脂肪酸のトランスポーターニコチン酸[14,15]の高薬理学的用量で特異的に活性化される。
NADとNADPは、それが必要に応じて補酵素形態に変換され、その後、組織に輸送されるニコチンアミドに、腸粘膜と肝臓のグリコヒドロラーゼによって、迅速に加水分解される。ニコチンアミドが脳に自由に出入りすることは注目すべきことであり、次の節で述べるように、このような性質は神経生物学的に重要な意味を持っている。
2.2. 内因性合成
ナイアシンは、食事中のTrpから始まり、キヌレニン経路(キヌレニン経路)(図2)を介して合成され、主に肝臓で、より少ない範囲ではあるが肝外組織(特に免疫細胞の活性化時)で発生する[17,18,19]。
図2 トリプトファン、ニコチンアミド、ニコチン酸からのNAD(P)の新規合成
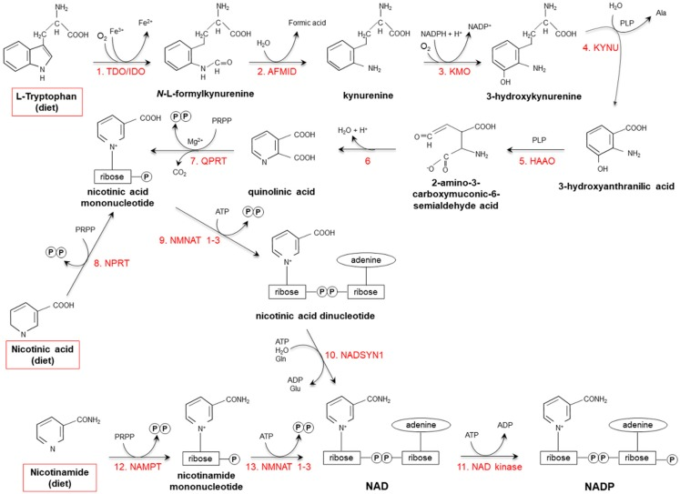
- (1) 鉄ポルフィリンメタロプロテインであるトリプトファン2,3ジオキシゲナーゼ(TDO、肝臓)とインドラミン-ピロール2-3ジオキシゲナーゼ(IDO、肝外組織)は、トリプトファン(Trp)のピロール部位を酸化し、N-L-ホルミルキヌレニンを形成する。
- (2)アリールホルムアミダーゼ(AFMID)が加水分解的にホルミル基を除去してキヌレニンを生成し、
- (3)キヌレニン-3モノオキシゲナーゼ(KMO)というミトコンドリアのフラボ酵素によって3-ヒドロキシル化されて3-ヒドロキシキヌレニンになる。
- (4)キヌレニン分解酵素B(KYNU、ビタミンB6依存性酵素)と
- (5)3-ヒドロキシアントラニルジオキシゲナーゼ(HAAO、非ヘム鉄依存性ジオキシゲナーゼ)の作用は、2-アミノ-3-カルボキシムコニック-6-セミアルデヒド酸、
- (6)自発的に凝縮し、キノリン酸を形成するために再配列する不安定な生成物の生産につながる。その後、
- (7)キノリン酸が脱炭酸され、キノリン酸ホスホリボシルトランスフェラーゼ(QPRT)によりニコチン酸モノヌクレオチドに変換される。また、ニコチン酸モノヌクレオチドは、
- (8)ニコチン酸ホスホリボシルトランスフェラーゼ(NPRT)の作用を介して、「サルベージ経路」を介して生成される。
- (9)ニコチンアミド/ニコチン酸-モノヌクレオチド-アデニル転移酵素(NMNAT1-3)および(10)NAD合成酵素(NADSYN1)のその後の作用は、
- (11)リン酸化されてNADPを産生するNADの生成を導く。NADはまた、
- (12)ニコチンアミドリンホリボシルトランスフェラーゼ(NAMPT)および
- (13)ニコチンアミド/ニコチン酸モノヌクレオチドアデニルトランスフェラーゼ(NMNAT1-3)の作用を介してニコチンアミドから直接導出することができる。
赤枠:NAD(P)の食餌前駆体。Ala:アラニン;Gln:グルタミン;Glu:グルタミン酸;PLPピリドキサールリン酸;PRPP:5-ホスホリボシル-1-ピロリン酸。
最初の反応を触媒するトリプトファン2,3ジオキシゲナーゼ(TDO)は、速度制限酵素である。いくつかの栄養、ホルモンおよび生理学的病理学的要因は、この同化経路の効率に影響を与える。ビタミンB6,リボフラビン、鉄およびヘム(特定の酵素のためのすべての必須補酵素ならびにビタミンB1およびTrp自体の欠乏は、反応速度を遅くする[18,20]。全体的に
- タンパク質を多く含む食事(特に、トウモロコシやソルガムなどのロイシンを多く含む食品の摂取)はナイアシン生合成を減少させる;
- 不飽和脂肪酸を多く含む食事はナイアシン生合成を増加させるが、飽和脂肪酸は影響を及ぼさない;
- デンプンを含む食事はショ糖を多く含む食事に比べて形質転換率が高い;
- カロリー制限はナイアシン生合成を大幅に抑制する[18,21,22,23,24,25,26]。
ホルモンの中では、エストロゲン、グルコルチコイド、サイロキシンが最も特徴的なキヌレニン経路の調節因子である。エストロゲンは TDO 活性を高め、妊娠中や経口避妊薬を服用している女性では酵素活性が三倍になる [27,28]。グルココルチコイドは、グルカゴンによって増強され、インスリンやアドレナリンによって阻害されるメカニズムを介して TDO を誘導することで、de novo 合成を刺激する [18,29,30]。TDO活性に対するチロキシンの効果は、いくつかの研究では正の作用が示唆されているが、他の研究では何の効果も観察されていないため、まだ議論の余地がある[31,32,33,34]。
個人差があるため、ヒトの健康な個体では、Trpは平均60:1の変換効率でナイアシンに変換されると推定されている[35]。したがって、ナイアシン摂取量はナイアシン換算値(NE;1mg NE = 1mg ナイアシンまたは60mg Trp)で表される。成人の推奨食事摂取量は、男性では16mg NE/日、女性では14mg NE/日、許容上限摂取量は35mg/日となっており、フラッシングが重大な副作用であることに基づいている[36]。
3. ビタミンの異化
NADの細胞内制御は、生合成レベルだけでなく異化レベルでも保証されており、後者の場合、NADはリサイクルされるか、代謝されて尿を介して排除される(図3)[37,38,39]。
図3
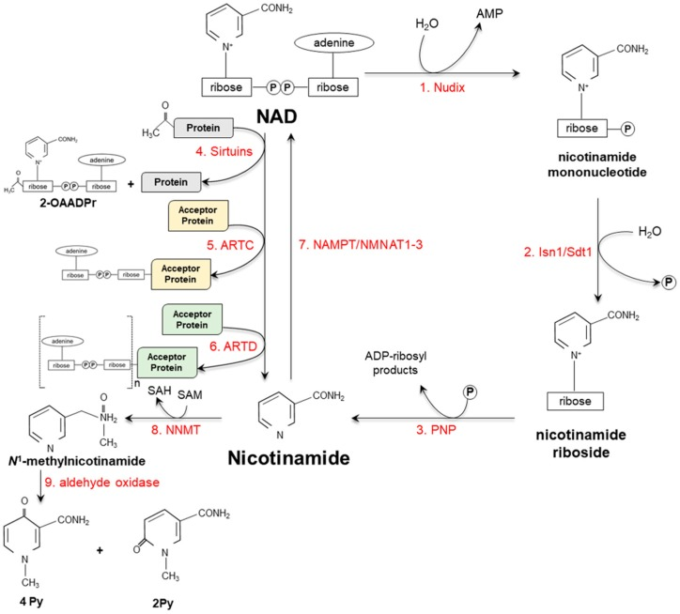
異なる異化経路を模式的に示している。
- NADはNudix(ヌディックス)ファミリーに属する特定のピロリン酸分解酵素の作用によりニコチンアミドモノヌクレオチドに加水分解され、ニコチンアミドモノヌクレオチドが脱リン酸化される。
- ニコチンアミドモノヌクレオチドは、その後、Isn1およびSdt1細胞内ヌクレオチダーゼによって脱リン酸化され、これは、プリンヌクレオシドホスホリラーゼ(PNP)によってニコチンアミドに切断された対応するリボシドを放出する
- あるいは、NADはサーチュイン
- ADP-リボシルトランスフェラーゼ(ARTC)
- ジフテリア毒素様ADP-リボシルトランスフェラーゼ(ARTD)
- の基質となる。ニコチンアミドは、特定の酵素
- によってNADに再変換されるか(図2も参照またはニコチンアミド-N-メチルトランスフェラーゼ(NNMT)によってN1-メチルニコチンアミド
- にメチル化され、次いで
- アルデヒドオキシダーゼによってN1-メチル-4-ピリドン-3-カルボキサミド(4-Py)およびN1-メチル-2-ピリドン-5-カルボキサミド(2-Py)に酸化される。
2-OAADPr. O-アセチル-ADPリボース;NAMPT:ニコチンアミドホスホリボシルトランスフェラーゼ;NMNAT:ニコチンアミド/ニコチン酸モノヌクレオチドアデニルトランスフェラーゼ;SAH:S-アデノシルホモシステイン;SAM:S-アデノシルメチオニン。
リサイクル経路では、NADは、異なるADP-リボシルトランスフェラーゼの作用によりニコチンアミドに代謝される。サーチュイン(SIRT)は、NAD依存性の脱アセチル化酵素であり、サイレント情報調節因子2のようなタンパク質の高度に保存されたファミリーに属するモノ-ADP-リボシル転移酵素である[40,41,42]。脱アセチル化の際、NADは加水分解され、標的タンパク質のε-アセチルリジン残基がADP-リボース部位に転写されてO-アセチルADPリボース(図3)が形成される。SIRT は広範囲のタンパク質を脱アセチル化し、その活性、安定性、局在性を調節する。対象とするタンパク質に応じて、これらの酵素は転写、細胞周期の進行、ゲノムの安定性、細胞死、ミトコンドリアの生合成など、いくつかの生物学的プロセスに影響を与える[42,44,45]。ADP-リボシルトランスフェラーゼ(ARTC)およびジフテリア毒素様ADP-リボシルトランスフェラーゼ(ARTD)は、それぞれ膜タンパク質の特定のアミノ酸(アルギニン、システイン、アスパラギン、ヒスチジン)のモノおよびポリADP-リボシル化を触媒し(図3このようにして、自然免疫および細胞間のクロストーク、細胞周期、細胞死およびエネルギー代謝を制御する [46,47,48]。
最後に、NAD(P)は2つのADPリボースサイクラーゼ、すなわちCD38とCD157によってニコチンアミドに加水分解され、これらのサイクラーゼはまた、リアノジン受容体媒介カルシウム放出の内因性活性化因子である環状ADPリボースを放出し[49,50,51,52]、癌、神経変性、自己免疫疾患などの病理学的疾患に関与していることが示唆されている[53,54,55,56]。
リサイクルされない場合、ニコチンアミドは、S-アデノシルメチオニン(SAM)をメチル供与体とする細胞内ニコチンアミドN-メチルトランスフェラーゼ(NNMT)によってメチル化され、酸化代謝物として排除される(図3)。酵素活性の変化は、神経変性疾患、肥満、2型糖尿病、癌などのいくつかの病態と関連している[57,58,59,60,61,62,63,64]。ニコチンアミドの副生成物の他に、ニコチン酸とグリシンの共役(ニコチン尿酸)やそのメチル化(1-メチルニコチン酸)に由来する副生成物が尿中に存在することが知られている[65,66,67]。
NAD分解につながるNAD依存性の生物学的イベントの多重性のために、細胞は細胞内のNAD(P)プールを補充する必要がある;例えば、NAD生合成の阻害は、数時間以内に細胞内のNAD含有量を減少させる[68]。
4. 重度のビタミン欠乏症
重度のナイアシンおよび/またはTrp欠乏は、下痢、皮膚炎、認知症などの様々な臨床症状を引き起こし、総称して「ペラグラ」または「3つのD病」として知られている[69];この疾患は先進国では稀なものになったが、開発途上国では依然としてパンデミックしている[70]。ペラグラは、トウモロコシを主に食べる人[71]、栄養失調の男性やアルコール依存症の男性[26]に多く見られるが、ビタミンB3欠乏症につながる他の危険因子として、神経性食欲不振[72]、エイズ[73]、がん[74]、化学療法[75]、クローン病[76]などの吸収不良性疾患が挙げられる。
光感受性が高い:皮膚炎は、DNA修復障害につながるポリ(ADP-リボース)ポリメラーゼ活性の欠損に由来する。患者は、ナイアシンを服用すると消失する精神症状(すなわち、うつ病、妄想行動、自殺および攻撃的傾向)を示すことがある[77,78];これらの症状のいくつかは、Trpに由来するセロトニンの欠損にも関連している[78]。
5. ナイアシンの薬理作用
ニコチン酸(15-20mg/日)とニコチンアミド(300mg/日)は、生理学的な量で補充された場合、伝統的なペラグラ[77,78]の治療に有効である;それにもかかわらず、より高い濃度では、抗脂質異常症から抗炎症作用に至るまで、別々の追加の薬理作用を示す。ナイアシンの脂質変化効果の最初の証拠は1955年にさかのぼり、Altschulと共同研究者らが3000mg/日のニコチン酸(ニコチンアミドではなく)でヒトの血清コレステロールを低下させる能力を報告したときです[79]。抗高脂血症薬としてのニコチン酸の有益な効果を示す実験データのすべての成長している体。それは、ニコチン酸が有効であることがよく確立されている。
- 遊離脂肪酸の動員と脂肪分解を阻害する;
- 肝トリグリセリド合成と非常に低密度リポタンパク質(VLDL)の分泌を減少させる
- 低密度リポタンパク質(LDL)へのVLDLの変換を阻害する。
- 血清高密度リポタンパク質(HDL)レベルを増加させ、
- 小さい、密な粒子から大きい、低密度の粒子へのLDL変換を誘発し、
- 血清リポタンパク質濃度を低下させ、および
- アポリポタンパク質A1を増加させる[80,81]。
現在までのところ、その基礎となるメカニズムはまだ推測の域を出ていない;特に、ニコチン酸は(食事で達成されたレベルよりも高いレベルで)脂肪組織で高度に発現している2つのG0/Gi共役膜受容体であるGPR109AとGPR109Bに結合して活性化することが報告されている;それにもかかわらず、これらの受容体は肝臓には存在しないか、または低レベルでしか存在しない[82]。したがって、ニコチン酸は、受容体依存性および-依存性のメカニズムを介して脂質低下効果を発揮する可能性が考えられる。
上述のポジティブな効果のために、2008年にニコチン酸はトレバクリン®、トレダプティブ®、またはペルゾント®として1.0gの用量で市販された(抗フラッシング剤のラロピプラムとの併用);この処方製品は、スタチンを投与されている混合性脂質異常症および/または一次高コレステロール血症の成人の治療に使用されてきた[83]。しかし、低HDL/高トリグリセリドのメタボリックシンドロームにおけるアテローム血栓症治療。グローバルヘルスアウトカムへの影響(AIM-HIGH)試験[84]とHeart Protection Study 2-HDLの治療による血管イベントの発生率の低下(HPS2-THRIVE)試験[85,86]の結果では、ナイアシンの長期使用による臨床上の有益性(すなわち、心臓発作および脳卒中のリスクの低下)は報告されていない。有効性の欠如は、再発する重篤な副作用(胃腸、筋骨格系、および皮膚関連)の発症とともに、EU市場からの薬剤の撤退につながっている。
試験管内試験および生体内試験の研究では、ニコチン酸(またはその分子標的の活性化)は、様々な細胞や組織で有意な抗炎症、抗酸化および抗アポトーシス活性を発揮することが実証されている[87] したがって、2型糖尿病[88,89]、肥満[90,91]、アテローム性動脈硬化症[92]、腎臓および肺の損傷[93,94,95]、および痛覚過敏[96]を含むいくつかの病態の管理のために潜在的に有益である。
また、高用量のニコチンアミドは、特定の薬理学的活性、特に癌管理に関連する活性を発揮することができる。実際、いくつかの実験研究や臨床研究で、ニコチンアミドが放射線や化学療法に対して腫瘍を感作する能力が示されている[97,98,99,100]。このような活性は、ポリ(ADP-リボース)依存性アポトーシスカスケードの活性化、およびミオシン軽鎖キナーゼの阻害に依存しており、その結果、微小血管の流れが促進され、薬物送達および腫瘍の酸素化が改善される [97,98,99,100]。
6. 中枢神経系におけるナイアシン
皮膚炎や下痢以外にも、ナイアシン/トリプトファン欠損症状には、認知症やうつ病などの神経系疾患や、神経変性疾患で観察される症状に類似した他の症状も含まれている。この証拠は、試験管内試験および生体内試験での研究の蓄積とともに、中枢神経系(中枢神経系)の成長および維持におけるナイアシン(特にニコチンアミド)の重要性を強調している[101,102]。
ニコチンアミドの生合成は哺乳類の脳で活発に行われており、キヌレニン経路由来のニコチンアミド前駆体がナノモル~低マイクロモル濃度で存在している[103,104,105]。その中でもキノリン酸(脳の異なる領域に不均一に存在し、ニコチンアミドとは異なり血液脳関門を通過できない)は明らかな神経活性を示す[106]:N-メチル-d-アスパラギン酸(NMDA)受容体アゴニストとして作用し、興奮性神経障害や酸化ストレスを引き起こす[107]。さらに、脳内(特に大脳皮質)のキノリン酸濃度は加齢と正の相関があり、加齢に伴うニューロンのシナプス脱落に寄与している[108]。最後に、神経炎症、神経変性、気分障害は血漿や脳脊髄液中のキノリン酸濃度の上昇を伴う[10,109,110]。
キヌレニン経路 酵素の中でも TDO 活性は、健康なヒトの健常な脳ではむしろ低く[111]、神経新生を制御し、出生前・出生後の発達や不安関連行動にも影響を与えている[112]。TDO活性は病理学的条件下で増強され、実際、神経変性疾患や腫瘍の進行中に高い活性が認められている[113,114]。また、インドラミン-ピロール2-3ジオキシゲナーゼ(IDO)も脳内で発現しており、その活性は病理学的条件、特にうつ病、加齢、神経炎症性疾患で増加している[115,116,117]。
他のビタミン(アスコルビン酸、カルシトリオールおよびレチノイン酸)[118,119,120,121,122]と同様に、ニコチンアミドは、胚性幹細胞または神経前駆細胞の分化を促進することにより、神経発生に影響を与え、ミトチン化後のニューロン[123,124]。試験管内試験でのビタミン補給は、未分化幹細胞の神経前駆細胞への進行を促進し、さらに効率的なGABA作動性ニューロンへと成熟する;この誘導作用は時間依存的であり、ビタミンを早く(0日目)に受け取ると効果がより顕著になる[124]。したがって、NNMTの活性低下(したがって、その代謝産物であるN1-メチルニコチンアミドの低レベル)は、幹細胞の多能性を調節するために必要である:NNMTの基質であるSAMとニコチンアミドの蓄積は、実際には、SAMがヒストンメチル化やヒトの発生初期に発生する代謝変化を制御するエピジェネティックなイベントの調節に利用可能にすることによって、ナイーブからプライミングされた幹細胞への移行を促進する[125]。
プロ分化作用のほかに、ニコチンアミドはまた、特に酸化ストレス条件下で、神経細胞の生存を促進し、この効果は、以下を含む複数のメカニズムを介して達成される。
- シトクロムcの放出およびカスパーゼ3-および9様活性の抑制
- カスパーゼ3介在性フォークヘッド転写因子(FOXO3a)の分解の阻害
- プロテインキナーゼB(Akt)依存性FOXO3aのリン酸化の維持 [126]
などである。中枢神経系の血管の完全性もまた、脳内のNADレベルと正の相関があり、その代謝の微調整制御が行われている。例えば、脳内のニコチンアミドホスホリボシルトランスフェラーゼ(NAMPT)のヘテロ接合性欠失は、局所虚血性脳卒中誘発性神経細胞死および脳損傷を悪化させる[127]一方で、成体マウスのプロジェクションニューロンでの選択的ノックダウンは、運動機能障害、神経変性、および死をもたらす[128]。
最後に、NAD代謝の変化はワレリアン変性の重要な特徴である。これは、破砕された神経線維で発生し、損傷の遠位の軸索の変性につながるプロセスであり、加齢に伴う神経変性疾患や化学療法誘発性末梢神経障害の初期のイベントを代表するものである[129]。プロアクソン死タンパク質SARM1の作用を必要とする経路を介して軸索内Ca2+の増加を誘導することにより、ニコチンアミドモノヌクレオチドの蓄積は、実際に軸索の完全性の喪失に関与している[130]。また、ニコチンアミドモノヌクレオチドの変性促進作用は、後根神経節軸索のビンクリスチン誘発性変性の際にも報告されている[131]。したがって、ニコチンアミド/ニコチン酸-モノヌクレオチド-アデニル転移酵素(NMNAT)1-3の活性の増加は、ニコチンアミドモノヌクレオチドレベルを制限するか、またはSIRT1を活性化することで、軸索を変性から保護することになる[132,133]。
7. アルツハイマー病
アルツハイマー病(AD)は世界で約3,000万人が罹患する神経変性疾患であり、その主な特徴はアミロイドβ(Aβ)斑と神経原線維のもつれの存在である[134]。
トリプトファン/ナイアシンの欠乏が神経変性疾患の原因となる神経症状を引き起こすとしても[135,136,137]、ナイアシンとADの発症との因果関係は確立されていない(表1)。
表1 神経変性におけるナイアシンの役割に関する主な知見
| エフェクター | 主な結果 | 参照。 | |
|---|---|---|---|
| アルツハイマー病 | ナイアシン | ADと食事中のナイアシン摂取量との逆相関 | [ 135 ] |
| NAD + | 高い脳レベルはミトコンドリア機能を回復し、認知機能低下に拮抗します | [ 138、139 ] | |
| Nam/Namモノヌクレオチド | APPおよびPSEN-1の発現とROSレベルの低下を介してAβ誘発性神経毒性から保護します | [ 140、141 ] | |
| Namリボシド | 海馬ニューロンのDNA損傷、神経炎症、細胞死を軽減します | [ 142 ] | |
| SIRT1 | ADの非アミロイド形成経路をサポートします ADの神経炎症、酸化ストレス、ミトコンドリア機能障害を軽減します |
[ 143 ] [ 144、145 ] |
|
| NMNAT1-3 | ニコチンアミドモノヌクレオチドレベルの低下とSIRT1活性化を介して軸索変性から保護します | [ 132、133 ] | |
| NMNAT2 | 神経変性の前にダウンレギュレートされた活動; 活動の回復はタウオパチーに対して神経保護 的であるAD患者における低遺伝子発現 |
[ 146 ] [ 147 ] |
|
| パーキンソン病 | ナイアシン | 摂取量の増加は線条体ドーパミン合成を強化し、最適なNAD + / NADH比を回復し ます高レベルは遷移金属イオンを隔離します 低用量はM1(炎症誘発性)からM2(抗炎症性)プロファイルへのマクロファージ極性化に影響を与えます |
[ 148 ] [ 149、150 ] [ 151 ] |
| NAD + | PD患者のレベルの低下 | [ 148 ] | |
| NADPH | MPTP +によって誘発される酸化ストレスとグリアを介した神経炎症を抑制します | [ 152 ] | |
| NNMT | PD患者の脳脊髄液および中脳ドーパミンニューロンの高レベル ミトコンドリア複合体の低活性に関連する高活性1; ミトコンドリア複合体1に対するMPP +依存性毒性を打ち消し、ニューロンのオートファジーを活性化します。神経 突起の分岐、シナプトフィジンの発現、ドーパミンの放出を誘導します。 |
[ 153、154 ] [ 154、155 ] [ 156 ] |
|
| ハンチントン病 | NAD | 低レベルはショウジョウバエHDモデルの病気の進行と相関します | [ 157 ] |
| Nam | ショウジョウバエHDモデルのpolyQタンパク質の毒性から保護し ますBDNFタンパク質レベルを回復し、アセチル化PGC-1αを増加させ、運動障害 を改善します神経細胞死と酸化ストレスのPARP-1依存性阻害を介して運動異常を防ぎます |
[ 158 ] [ 159 ] [ 160、161、162 ] |
|
| SIRT1 | 変異ハンチンチン毒性からニューロンを救う 疾患発症の根底にある病理学的メカニズムを改善する |
[ 163、164 ] |
食事性ナイアシンは、プロスペクティブな集団ベースの研究によって示唆されたように、ADと加齢に関連した認知機能の低下から保護する可能性がある:65歳以上の住民6158人の地理的に定義されたコミュニティを考慮したシカゴ健康と老化プロジェクト(CHAP)研究は、認知症のためのいくつかの食事(抗酸化栄養素、脂肪、葉酸、ビタミンB6,B12,B1およびB2)と非食事(年齢、教育、人種、ApoEε4)の危険因子を補正した後、ADとナイアシンの摂取量との間の逆相関を発見した[135]。
既存の疫学的証拠はまだ限られており、決定的ではないが、ナイアシン(特にニコチンアミド)はADに関連している可能性があり、特に重要な生物学的プロセス(エネルギー代謝、ミトコンドリア機能、カルシウム恒常性、生存、細胞死など)を媒介することによって、NADは寿命を延ばす効果を持っていることを念頭に置いている;これは神経伝達、学習、記憶を含む脳機能において特に重要である。シナプス可塑性の基礎となるNAD+の枯渇とミトコンドリア機能不全は、通常、加齢とAD発症で発見されている[138,165];したがって、ADのマウスモデルでは、NAD+脳内濃度を増加させることで、ミトコンドリア機能を回復させ、認知機能の低下に対抗することができる[138,139]。ニコチンアミドおよび/またはニコチンアミドモノヌクレオチドはまた、AD関連遺伝子(アミロイド前駆体タンパク質とプレセニリン1)と活性酸素種(活性酸素)の発生の発現を減少させ、ニューロンの生存率を向上させることによって、アミロイド毒性を打ち消す:試験管内試験(器官型海馬スライス培養)と生体内試験(ADモデルラット)の両方の研究は、実際にAβ誘発性神経毒性に対するビタミンB3の保護効果を強調している[140,141]。また、ビタミンは、導入されたDNA修復欠損を持つ新規ADマウスモデルでリン酸化タウ病理を減少させることができる:ニコチンアミドリボシド治療は、大幅にDNA損傷、神経炎症や海馬ニューロンの細胞死を減少させ、このようにAD [142]のためのNAD +サプリメントの治療の可能性を示唆している。したがって、ニコチンアミドのNAD+への変換を触媒する酵素をコードするNmnat2の発現は、認知症のマウスモデルでは、神経変性に先立ってダウンレギュレーションされており、酵素活性の回復はタオパシーに対する神経保護であることが示されている[146]。Nmnat2の低レベルもアルツハイマー病患者で発見されており、その酵素活性はタウタンパク質のクリアランスに関連している[147]。
最後に、NAD+利用可能性の変動は、SIRT1活性を調節し、老化や加齢に伴う疾患を遅らせることによっても、ADの病態を軽減することができる[166,167]。いくつかの研究では、AD予防におけるSIRTの重要な役割が強調されている:特に、SIRT1の脱アセチラーゼ活性は、ADの非アミロイド性経路をサポートし[143]、神経炎症、酸化ストレス、ミトコンドリア機能不全のような現象を打ち消し、ADを助長し、悪化させることが示されている[144,145]。
8. パーキンソン病
パーキンソン病(PD)は、黒質内のドーパミン作動性ニューロンの変性を特徴とする進行性障害であり、その主な特徴は、α-シヌクレインタンパク質の異常な凝集、ミトコンドリア呼吸複合体1の阻害、酸化ストレスおよび神経炎症である。PD症例の5~10%しか遺伝的素因に帰することができないため、いくつかの環境因子が散発型PDにおいて役割を果たしている可能性がある[149]。その中でもビタミンB3は、ある種の早期発症PDの症状を緩和することができるため、予防的・治療的に有望な因子である(表1)。実際、パーキンソン病患者ではNAD+レベルが低下し、逆にナイアシンの摂取量を増やすことで線条体でのドーパミン合成が増加し、ミトコンドリア複合体1の活性に必要な最適なNAD+/NADH比を回復させることができる[148]。ナイアシンの高レベル摂取はまた、通常、凝集した誤ったタンパク質の発生とともに蓄積する遷移金属イオン(鉄を含む)を隔離することもできる[149,150]。ナイアシンの低用量投与はマクロファージの分極をM1(プロ炎症性)からM2(抗炎症性)フェノチープへと変化させ、外因性NADPHは酸化ストレスおよびグリア媒介性神経炎症を抑制するが、ビタミンB3の最適レベルは酸化ストレスおよび神経炎症を抑制するために必要である。
神経細胞は、神経細胞の恒常性維持に重要な役割を果たしていると思われるNNMTを発現する脳の唯一の細胞である[153]。数多くの研究にもかかわらず、NNMTとPD神経病因発症との正確な因果関係は依然として不明である。一部の著者は、NNMTのレベルがパーキンソン病患者の脳脊髄液および中脳ドーパミンニューロンで上昇していることから、NNMTをPDの危険因子として言及している[153,154]。NNMT活性の高さはミトコンドリア複合体1の活性低下と関連しており、神経変性の引き金となるミトコンドリア機能障害との関連性を示している[154,155]。N1-メチルニコチンアミド(NNMTの作用によって生成される代謝物)は、ドーパミンニューロンにダメージを与える毒素であるN-methy-l-4-フェニルピリジニウム(MPP+)と構造的に類似していることは注目に値する[168]。逆に、他の研究では、この酵素は(i)ミトコンドリア複合体1に対するMPP+媒介毒性を打ち消し、(ii)エネルギー源と細胞の恒常性のバランスをとるためにニューロンのオートファジーを活性化し、(iii)ニューロンの分岐、シナプトフィシンの発現、およびドーパミンの蓄積と放出を誘導することにより、ニューロンの形態と分化を調節することができることが実証されている[156]。同様に、pink1遺伝子の変異を特徴とする家族性PDにおいて、NADの補充またはNADを消費する酵素[PARP-1,DNA修復に関与するポリADP-リボースポリメラーゼなど]の不活性化は、ミトコンドリアの欠陥を救済し、神経細胞を変性から保護することを示唆している。
9. ハンチントン病
ハンチントン病(HD)は、典型的な進行性の運動障害(顔や体の不随意運動、歩行、姿勢、バランスの異常精神障害(認知症およびその他の認知障害を特徴とする常染色体優性神経変性疾患である[170]。HDは、第4染色体上に位置するハンチンチン(htt)をコードする遺伝子のCAGの拡大によって引き起こされる;通常、htt遺伝子は最大35回のCAGリピートを含むが、HDでは36回以上のCAGリピートを持ち、異常に長いポリグルタミンリピート(polyQ)を持つ変異タンパク質を生成し、中位の棘のある神経細胞と大脳皮質の選択的な線条体変性を引き起こす[170]。ニューロンでは、変異型httタンパク質が凝集し、プロテオスタシスネットワーク、ミトコンドリア機能とエネルギーバランス、転写調節、シナプス機能、軸索輸送を損なうことで、細胞の完全性に致命的なダメージを与える[171]。
メタボローム研究から、キヌレニン経路 酵素の代謝物(Trp、キヌレニン、キノリン酸、3-ヒドロキシキヌレニンなど)の含有量と活性が、実験的な HD モデルやヒト患者において病理学的に変化することが明らかになってきた [109,110]。さらに、ショウジョウバエのHDモデルでは、病気の進行はNADレベルの低下と関連していることがわかっており、ナイアシン(またはその誘導体)の食事療法や薬理学的な補給がHD患者に有用である可能性が示唆されている[157]。実際、いくつかの研究では、HDにおけるビタミンB3の有益な効果が提唱されている(表1)。例えば、ニコチンアミドはショウジョウバエのHDモデルではポリQタンパク質の毒性から保護されており[158]、トランスジェニックマウスモデルでは、脳由来神経栄養因子(BDNF)タンパク質レベルの回復、ミトコンドリア生合成のマスターレギュレーターであるアセチル化ペルオキシソーム増殖因子活性化レセプターγコアクチベーター1α(PGC-1α)の増加、運動障害の改善などが報告されている[159]。ニコチンアミドの効果は、変異型htt凝集の阻害に依存するのではなく、むしろHDで発生するエネルギーバランス障害の回復に必要なNADレベルの補充に依存している。
ニコチンアミドの神経保護作用に関するさらなる知見は、ニコチンアミドが3˗ニトロプロピオン酸誘発HDモデルラットの運動異常を用量依存的に抑制することを示した最近の研究から得られた。このような効果は、酸化ストレスの防止(すなわち、マロンジアルデヒドと亜硝酸塩の減少、グルタチオンの増加)と同様に、線条体における神経細胞死の抑制と関連していると考えられ、PARP-1依存性のメカニズムを介して最も可能性が高い [160]。したがって、PARP-1は3-ニトロプロピオン酸誘導性神経毒性に応答して活性化され[161]、PARP-1をトリガーとするアストロサイトの死はニコチンアミドによって阻止される[162]。PARP-1と同様に、SIRTはHD神経変性に関与している。特に、SIRT1は障害されているが、これは変異型httがSIRT1に直接結合して阻害する能力を持っているためである可能性が高いです;その後のハイパーアセチル化と特定の遺伝子の不活性化は、脱アセチラーゼの生存を促進する作用を阻害することにつながる[172]。したがって、SIRT1活性の増加はニューロンを変異型httの毒性から救い、HD発症の基礎となる病理学的メカニズムを改善する[163,164]。
他の研究では反対の効果が報告されているため、これらの知見はいずれもやや議論の余地がある。NaiaらはYAC128トランスジェニックモデル(ヒト全長変異htt遺伝子を発現)を用いて、ニコチンアミド(SIRT1阻害剤)とレスベラトロール(SIRT1活性化剤)の効果を試験管内試験と生体内試験の両方で比較した[173]。両化合物は、YAC128胚から分離された線条体および皮質ニューロンにおいて、ヒストンH3アセチル化を修飾し、ミトコンドリア機能障害を抑制することができたが、生体内試験のHDモデルでは、レスベラトロールのみがエネルギーの恒常性とミトコンドリア機能、および運動協調性を改善した。逆に、生体内でニコチンアミド(特に高濃度)を補給しても、運動行動の改善は見られず、さらに野生型対照マウスでは運動能力が悪化した。この有害な作用は、他の神経変性疾患でも証明されている:ラクタシスティン病ラット(PDの生体内試験モデル)では、1ヶ月間のニコチンアミド補給はSIRT1の阻害と神経栄養因子および抗アポトーシス因子の過剰発現をもたらしたが、それにもかかわらず、ドーパミン作動性ニューロンの変性を悪化させた[174]。
したがって、これらのデータは、症状の進行を遅らせるための治療法を提案する前に、神経変性の病態メカニズムを完全に理解する必要があることを強調している。
10. その他の神経疾患
神経変性以外にも、ビタミンB3の中枢神経系への影響は、(i)虚血性外傷、(ii)頭痛、(iii)精神疾患など、他の神経病理学的疾患でも研究されている(表2)。
表2 他の神経疾患におけるナイアシンの役割に関する主な知見
| エフェクター | 主な結果 | 参照。 | |
|---|---|---|---|
| 虚血性および外傷性傷害 | ナイアシン | TBI依存の行動障害を軽減し、機能回復を改善します | [ 175、176、177、178、179、180 ] |
| ナム | 脳梁および酸化ストレスにおける神経学的欠損、海馬アポトーシス、軸索損傷およびミクログリア活性化を低減します。NAD(P)コンテンツを復元します。MAPKシグナル伝達とカスパーゼ3切断を抑制します | [ 181 ] | |
| ナムモノヌクレオチド | ポリADPリボシル化タンパク質とNAD +異化作用を減少させることにより、海馬の損傷を改善し、神経学的転帰を改善します | [ 182 ] | |
| ナム/ PARP-1拮抗薬 | 前処理は、再酸素化中のATP含有量とニューロンの回復を改善します | [ 183 ] | |
| ニアスパン (ナイアシン) |
局所的な脳血流を増加させます。angpt / Tie2、AktおよびeNOS経路を介して血管新生を促進します。TACEおよびNotchシグナル伝達を介して動脈形成を促進します。機能障害を改善する | [ 184、185 ] | |
| ナイアシンとセレン | Aktのリン酸化とNrf2の発現の増加を介して、皮質細胞の損傷を軽減します。酸化ストレスを軽減します。 | [ 186 ] | |
| ナムプラスプロゲステロン | 機能回復を増やします。病変のキャビテーションと組織の喪失を減らします。炎症性および免疫遺伝子の発現を調節する | [ 187、188 ] | |
| NAMPT | 活動の低下は 虚血後の脳損傷を悪化させるヘテロ接合性遺伝子の欠失は、光血栓症誘発性の限局性虚血後の脳損傷を悪化させる 遺伝子の過剰発現は梗塞サイズを減少させる |
[ 189、190 ] [ 190 ] [ 191 ] |
|
| 頭痛 | ナイアシン | ミトコンドリアのエネルギー代謝を回復 します収縮した骨格筋の血流と酸素化を改善します |
[ 192、193 ] |
| ニコチン酸 | 頭蓋内血管を拡張し、頭蓋外血管を収縮させます。プロスタグランジンD2の皮膚生合成を増加させます。9a、11b-プロスタグランジンF2の血漿含有量を上昇させる | [ 194、195、196 ] | |
| 精神障害 | ナイアシン | 神経精神病患者の食事摂取量が少ない | [ 197 ] |
| ナム | ビタミンレベルと統合失調症の正の相関 双極性II型患者の安定と落ち着きを維持するのに効果的な慢性サプリメント |
[ 198 ] [ 199 ] |
10.1. 虚血性および外傷性傷害
脳細胞が数秒以上酸素を奪われると、重篤な損傷が生じ、脳梗塞または虚血性脳卒中を経て細胞死に至る。一過性の虚血エピソード後の再灌流中には、他の重大な損傷(酸化ストレス、白血球浸潤、ミトコンドリア機能不全、血小板活性化および凝集、補体活性化、および血液脳関門障害を含む)も起こり、神経学的機能障害に寄与する [200]。
神経組織の再酸素化は、NADH過酸化として知られる事象であるNAD+/NADHリサイクルを劇的に損なう[201]。長年にわたり、虚血性脳損傷におけるビタミンB3の潜在的な神経保護および神経回復的役割は、試験管内試験および生体内試験モデルで広範囲に実証されてきた。海馬スライスを用いて、Shettyら[183]は、NADHの過酸化が神経細胞の回復力低下と相関しており、NAD+レベルを高めることで回復することを実証した。ニコチンアミド(NAD+の利用可能性を高めるために)またはPARP-1アンタゴニスト(NAD+の消費を減少させるために)で脳組織を前処理すると、確かに、再酸素化の間、ミトコンドリアの機能不全を防ぎ、ATP含有量を改善し、神経細胞の回復を刺激する[183]。ニコチンアミドは、虚血再灌流傷害の後に提供された場合にも有効であるようである。例えば、心停止後に単回の高用量または低用量のビタミンB3を反復投与されたラットでは、神経学的欠損、海馬のアポトーシス、軸索損傷、冠状体の微小グリアの活性化が減少していることが示されている[181]。これらの効果の基礎となるニコチンアミド依存性のメカニズムには、脳組織におけるマイトジェン活性化プロテインキナーゼシグナル伝達およびカスパーゼ3切断の抑制とともに、NAD(P)含量の回復および酸化ストレスの減少が含まれている[181]。これらのデータは、ニコチンアミドが脳梗塞の大きさを有意に減少させ、異なるラット系統で神経学的欠損を改善することを示す以前の報告と一致している[202,203,204,205,206]。興味深いことに、虚血性障害の数時間後にナイアシンを投与した場合にも神経回復効果が認められる。中大脳動脈閉塞後24時間後に投与された場合、ナイアスパン(ナイアシンのFDA承認の徐放製剤)は、局所脳血流を増加させ、血管新生を促進し(アンジオポエチン1/Tie2,Aktおよび内皮NOS経路を介して動脈新生を促進し(腫瘍壊死因子α変換酵素およびNotchシグナル伝達を介して機能障害を改善する[184,185]。
NAMPTはビタミンB3の効果に決定的に関与している。その重要な役割の証明には以下のようなものがある。
- (i)NAMPT活性の低下は虚血後の脳損傷を有意に悪化させる[189,190]、
- (ii)ヘテロ接合体のNampt欠失は光血栓症誘発性局所虚血後の脳損傷を悪化させる[190]、
- (iii)Nampt過剰発現は梗塞サイズを縮小させる[191]。
したがって、NAMPT基質であるニコチンアミドモノヌクレオチドを静脈内注射すると、FK866(NAMPT阻害薬)の有害な効果が回復し[189]、ポリADPリボシル化タンパク質やNAD+異化作用を減少させることで、海馬の損傷を改善し、神経学的転帰を改善することがわかった[182]。
虚血性脳損傷に対するナイアシンの有効性の証拠は、外傷性脳損傷(TBI)を含む他の脳損傷におけるナイアシンの有効性を調査することを強く促した。皮質挫傷(TBIの実験モデル)後にナイアシンを投与されたラットは、行動障害の減少と長期にわたる機能回復の改善を示した [175,176,177,178,179,180]。
脳損傷の種類にかかわらず、ビタミンB3を他の「天然化合物」と組み合わせて投与すると、より大きな有益な効果が観察されている。ニコチンアミドとプロゲステロンの併用投与は、機能回復を促進し、損傷を受けた大脳皮質と反応性アストロサイトの両方で病巣陥没と組織損失を減少させるだけでなく、Ccr1(ケモカイン(C-Cモチーフ)受容体1Clec4e(C型レクチンドメインファミリー4)などの炎症性および免疫応答に関与する遺伝子の発現を調節する。メンバー3Fn1(フィブロネクチン1Hmox1(ヘムオキシゲナーゼ1Hspb1(ヒートショックプロテインb1Igf1・2(インスリン様成長因子1・2Il1β(インターロイキン1β)。Il16および18(インターロイキン16および18Mmp8および9(マトリックスメタロペプチダーゼ8および9Niacr1(ナイアシン受容体1)およびPtgs2(プロスタグランジンエンドペルオキシド合成酵素2)[187,188]。虚血再灌流傷害の試験管内試験モデルでは、ナイアシンとセレンの組み合わせ(臨床的に適切な用量で)は、Aktリン酸化と核内因子エリスロイド2関連因子2の発現を増加させ、グルタチオンの酸化還元サイクルを刺激し、過酸化水素レベルを減少させることにより、相乗的に皮質細胞傷害を減衰させる[186]。
10.2. 頭痛の症状
成人人口の50%以上を占める頭痛は、世界的に最も広範な障害の原因の一つである。片頭痛と緊張型頭痛(最も一般的な一次性頭痛のタイプ)の基礎となる病因機序は、ほとんどが重ね合わせ可能である:実際、頭痛は頭蓋内血管収縮に続く頭蓋外血管拡張および血管周囲侵害受容神経の活性化をもたらす三叉血管複合体の活性化によって引き金となる。脳脊髄液および/または頭蓋内静脈の圧力変化も関与している[207,208]。
マグネシウム、カルニチン、コエンザイムQ10,ビタミン(B2,B12,D)およびαリポ酸などのいくつかの栄養素は、頭痛片頭痛発作を打ち消すことができる予防化合物として使用することができる[209]。ビタミンB3(特にニコチン酸)は、経口投与、筋肉内投与または静脈内投与された場合、頭痛管理において治療効果を有する[210,211,212,213,214,215]。ナイアシンは中枢レベルと末梢レベルの両方で作用することで有益な効果を発揮する可能性が提案されている;特に、ナイアシンは頭蓋内血管を効果的に拡張し、その後頭蓋外血管を収縮させ、それと並行して末梢血管拡張と皮膚洗浄につながる化合物の放出を促進することが提案されている。セロトニンの血漿中濃度が頭痛の発症と逆相関することを考慮して、ナイアシンは中枢レベルではキヌレニン経路のフィードバック阻害を介してセロトニンのTrp依存性合成を増加させることで作用する[194]。末梢レベルでは、ニコチン酸の薬理学的用量は、健康なボランティアにおいて、プロスタグランジンD2の皮膚生合成を増加させ[195]、その副産物である9a,11b-PGF2の血漿中濃度を増加させる[196]。
また、ミトコンドリア制御ネットワークの変化が片頭痛の病態生理に重要な役割を果たしていることにも言及すべきである[192,193]。したがって、ナイアシンは、複合体Iの基質の利用可能性を高め、乳酸塩濃度を低下させることで、ミトコンドリアのエネルギー代謝を回復させ、骨格筋の痛み、特に緊張型頭痛における血流と酸素供給を改善する可能性がある。
10.3. 精神疾患
多くの精神疾患が食生活に影響されることが示されており、うつ病、不安、統合失調症、双極性障害、精神的苦痛を含む精神疾患の予防および/または治療のための栄養ガイドラインの開発につながっている。例えば、140人の被験者(対照群73人と統合失調症患者67人)を対象とした疫学研究では、ナイアシンを含む特定の栄養素の食事摂取量が有意に少ないことが明らかにされている[197]が、対照群101人と統合失調症患者128人を対象とした1年間の症例対照研究では、疾患とニコチンアミドレベルとの直接的な関係が明らかにされている[198]。
気分障害に関与する主な病因は、セロトニン合成からキヌレニン形成へのTrpのシャントの結果としてキヌレニン経路で産生される代謝物であるようである[216]。実際、うつ病患者の脳では、キヌレニン経路 の活性化によりセロトニン神経伝達が障害されている。IDO 活性は炎症性や酸化性の条件下で誘導され、キヌレニン経路 はアストロサイトやミクログリア(炎症性メディエーターの産生にも関与)で主に活性化されているため、キヌレニン経路 のバランスが崩れるとグリア-ニューロンネットワークが障害され、精神的ストレスに対する中枢神経系のプライミングが行われることが提案されている[217]。ヒトの死後の研究では、統合失調症患者の前頭前野で高レベルのキヌレン酸(水酸化ではなくキヌレニンのトランスアミノ化に由来する、図2参照)が発見されている;キヌレン酸はNMDAとニコチン性アセチルコリン受容体の両方のアンタゴニストであり、その遮断は疾患に関連した認知障害に関与していることから、この知見は臨床的に関連しているかもしれない[218]。統合失調症と同様に、キヌレニン前駆体の変化も双極性障害で観察されているが、この場合はニコチンアミドレベルがより良い予後因子である;実際、ニコチンアミドレベルの上昇は双極性障害患者の死因としての自殺と相関している(他の原因で死亡した双極性障害者と比較して1.3倍に増加する)[219]。
キヌレニン経路の免疫関連の不均衡は、大うつ病性障害(MDD)に関連する樹状突起の萎縮と無気力症の原因にもなりうる。対照群(20名の健常者)と患者(29名の未治療者でMDDの診断・統計マニュアルIV基準を満たした者)を比較したところ、MDD群では神経保護指数(神経保護作用のあるキヌレン酸と神経毒性のあるキノリン酸の比率)が低下しており、これは無気力症と負の相関があり、海馬と扁桃体の体積と正の相関があることが明らかになった[220]。これらのデータによると、tdoノックアウトマウスでは、野生型マウスと比較して、海馬と中脳のTrpとセロトニンのレベルが高く、神経新生の増加と不安関連行動の改善に関連していることが示されている[221]。
これらの知見は、ビタミンB3またはその関連製品の抗うつ効果の可能性を示唆している。双極性Ⅱ型障害の患者において、11年以上にわたってニコチンアミドの補充(1gを1日3回)を行ったところ、患者の安定と平穏を維持するのに有効であることが証明された[199]。単一の症例報告は弱く、結果を一般化することはできないが、精神障害を占める潜在的な付加的機序の理解の一助となるかもしれない。
11. 結論
ビタミンB3が神経細胞の健康に重要な役割を果たしていることは、エビデンスの増加に伴って明らかになってきている。ナイアシンのバイオアベイラビリティが神経細胞の生存と機能に重要であることが明らかになってきている。
いくつかの分子機構がビタミンB3(図4)の影響を受けており、多くの場合、厳密には互いにリンクしているため、この食物代謝物の正確な作用機序を定義することは困難である。さらなる研究が必要であるが、ビタミンの最適な食事摂取が神経細胞の健康をサポートし、神経変性を遅らせることが推測される。
図4 中枢神経系におけるナイアシンの生理病理学的条件下での有益な効果を支える主な分子機構
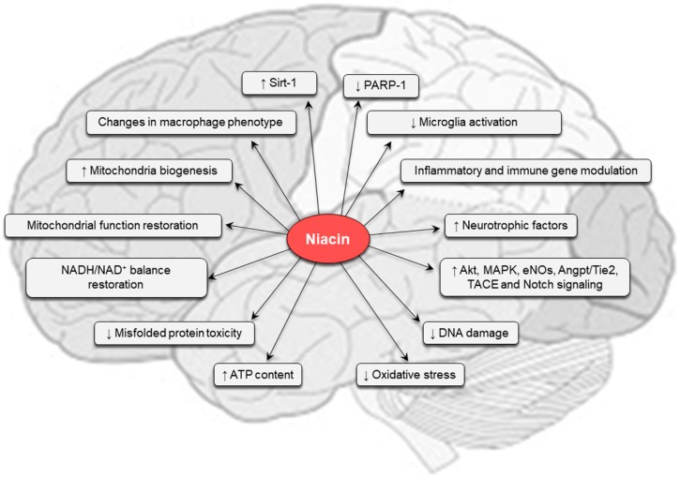
詳細は本文を参照のこと。Akt:プロテインキナーゼB、Angpt:アンジオポエチン1,eNOS:内皮一酸化窒素合成酵素、MAPK:マイトジェン活性化プロテインキナーゼ、PARP-1:ポリリボースポリメラーゼ-1,SIRT1:サーチュイン-1,TACE:腫瘍壊死因子α変換酵素。
