Contents
Neuroprotective Effects of Choline and Other Methyl Donors
www.ncbi.nlm.nih.gov/pmc/articles/PMC6950346/
要旨
最近のエビデンスは、心身の健康が遺伝子と環境の複雑な相互作用によって影響を受けていることを示唆している。環境因子は、エピジェネティックなメカニズムによって神経細胞の遺伝子発現と機能を調節することが示されている。人生の多感な時期に栄養素を含むこれらの要因にさらされることは、脳の発達をプログラムし、精神的健康に長期的な影響を及ぼす可能性がある。
研究では、メチルドナーを含む早期の栄養介入が生涯を通じて認知機能を改善することが示されている。コリンは、微量栄養素と正常な脳の成長と発達のために必要とされるメチルドナーである。それは、細胞膜の構造的および機能的な整合性を維持する上で極めて重要な役割を果たしている。
また、アセチルコリンの合成を介して脳内のコリン作動性シグナリングを調節する。その代謝物を介して、それは開発のさまざまな段階で記憶と認知機能に関連する遺伝子のメチル化を調節する経路に参加している。コリン関連機能は、いくつかの神経変性疾患において調節障害が認められており、コリンが生涯にわたる精神的健康に影響を与える役割を果たしていることが示唆されている。
キーワード:脳、コリン、認知症、エピジェネティクス、メチルドナー、栄養、神経保護
1. はじめに
新たなエビデンスは、乱用薬物への反復暴露、ストレス因子、身体活動や食事などの生活様式因子などの環境因子が、精神的な健康と幸福に実質的な影響を与えることを示唆している。これらの因子は遺伝子と相互作用し、エピジェネティックなメカニズムによって遺伝子の発現と機能を調節する [1]。遺伝子メチル化の変化による遺伝子発現の調節障害は神経疾患で実証されており[2,3]、加齢や一部の神経変性疾患でも報告されている[4]。それは、これらの疾患の治療のためのエピジェネティックベースのアプローチが正常に神経変性疾患を含む多くの疾患の管理のための前臨床試験で使用されているので、着手する有望な手段であることが示唆されている[5]。
正常な胎児の成長と発達における微量栄養素コリンと他のメチル-ドナーの役割はよく研究されている[6,7]。最近、コリンは、S-アデノシルメチオニン(SAM)[8,9]、そのようなDNAやヒストンメチル化などの主要なエピジェネティックメカニズムのための主要な細胞のメチル-ドナーの可用性に影響を与えることによって、神経細胞の遺伝子発現を変調し、脳機能を変更するゲノムのエピジェネティックな修飾子として浮上した。
SAM合成は、葉酸、VitB6,VitB12,メチオニン、コリン、ベタインなどの食事成分や栄養素の利用可能性に依存している[10]。SAMはまた、認知能力および能力の増強因子としても作用することが示されている[11]。このことは、メチル供与体に分類されるこれらの栄養素が、加齢に伴う認知機能の改善や、アルツハイマー病のようないくつかの神経変性疾患における認知機能の改善につながるのではないかという疑問を投げかけている。早期に効果的な栄養戦略の同定と実施は、その後、生涯を通じて認知機能と精神的健康を最適化する可能性がある[12]。
コリンは、適切な臓器の機能に必要な必須微量栄養素だけでなく、胎児の脳[13,14]の正常な発達と成長のために必要な神経保護剤ではない。発展途上の脳[15]の正常な機能におけるその極めて重要な役割に加えて、コリンの補給は、人生の後半[16]で加齢に関連したメモリの低下を緩和する可能性がある。
動物およびヒトの研究では、コリンの出生前または周産期の補給は、胎児の長期的な健康と人生の後半に病気への脆弱性に影響を与えることが示されている。例えば、げっ歯類におけるコリンの出生前または周産期の補給は、ストレスを減衰させ、変調された行動[17,18]と成人の子孫のメモリと認知機能[19,20]を改善した。そのようなVitB6,VitB12,葉酸とメチオニンなどのコリンと他のメチル-ドナーのサプリメントは、老化[21,22]と加齢に伴う認知機能の低下を減衰させる可能性がある。
コリンはまた、ダウン症[23,24,25]やレット症候群[26]、アルツハイマー病(アルツハイマー病)などの神経変性疾患[27]など、遺伝的に関連する神経発達障害に関連する症状を緩和することが示されている。発達や老化した脳の機能に対するコリンのこれらの様々な効果は、多くの場合、認知機能に関連する主要遺伝子のヒストンマークの変化やDNAメチル化の変化などのエピジェネティックな変化と相関していた[28]。
このことは、環境因子として、また微量栄養素としてのコリンが、作用のエピジェネティックなメカニズムを介して、神経保護効果と早期の生活の間に脳の発達をプログラムしていることを示唆している[29,30]。
このレビューでは、我々は、神経保護剤としての微量栄養素コリンの役割に焦点を当て、早期発達時の食事コリンと認知能力の改善の母親のサプリメントとの間のリンクを示した研究結果を要約する。また、老化脳の認知機能の低下を遅らせるか、または防ぐために、他のメチル-ドナーとの組み合わせで、この微量栄養素の潜在的な使用を示唆した知見を要約し、そのようなアルツハイマー病などのいくつかの神経変性疾患になる。このレビューの最後に、メチルドナーの不十分な補充が神経発達と認知機能に及ぼす悪影響について述べる。
2. コリンと他のメチル供与体の生理機能
米国国立科学アカデミー研究所の食品栄養委員会は、ヒトの体重1kgあたり1日7.5mgのコリンの適切な摂取量(AI)を推奨している[31]。米国小児科学会は、コリン、VitB6,VitB12を含むいくつかの栄養素を脳の成長と発達に不可欠なものとして特定した。米国食品医薬品局は、乳児の最適値として100Kcalあたり7mgのコリンを推奨している[32]。
この推奨にもかかわらず、1日のコリン必要量を満たしていない人もいれば、推奨値を超えて摂取量を増やしている人もいる。AIは個人差があり、この変動は年齢、性別、遺伝的要因、環境要因などのいくつかの要因の影響を受ける[33,34,35]。例えば、コリンの摂取量の増加は、胎児の成長と発達をサポートし、人生の後半で子孫の神経認知機能を向上させるために妊婦に必要である[12,32]。閉経前の女性は閉経後の女性に比べてコリンの摂取量が少ない。これは、エストロゲンがそのエストロゲン応答性要素(RE)に結合することにより、女性のホスホチジルエタノールアミン-N-メチルトランスフェラーゼ(PEMT)の発現を誘導するという事実によって説明される。PEMTはコリンのde novo合成のための反応を触媒する[36]。閉経後のエストロゲンレベルの低下、または肝内PEMT遺伝子の遺伝的多型(SNP)の存在は、女性が年齢を重ねるにつれてコリンが枯渇し、疾患に対する感受性を高める素因となる [37]。成人期におけるコリンの枯渇はまた、非アルコール性脂肪肝、肝障害、筋肉障害、リンパ球アポトーシス、DNA障害などの臓器または細胞の機能障害と関連している[38,39,40]。
コリンや他のメチル供与体は、脳のレベルで顕著な役割を果たしている。ヒトと動物モデルで実施されたいくつかの研究は、そのような出生前、周産期または出生後早期の生活などの脳の発達の敏感な期間中にコリンの枯渇または補充が神経管欠陥の病因に寄与することを実証した[41,42]。神経管欠損症のリスクの増加は、5,10メチレンテトラヒドロ葉酸デヒドロゲナーゼ(MT高脂肪食1)対立遺伝子(rs2236225)葉酸代謝[43]で役割を果たしている酵素の遺伝的変異にリンクされている。妊娠の第三期中にコリンの増加母体の摂取量は、妊娠中の女性の子癇前症を減らすことにコリンの潜在的な役割を示唆している抗血管新生因子FMS様チロシンキナーゼ1の胎盤発現の減少にリンクされている[44]。ストレスの文脈では、同じ研究グループは、母体のコリン補給が、胎盤と臍帯血中のコルチコトロピン放出ホルモン遺伝子(Crh)とグルココルチコイド遺伝子(Nr3c1)を含むいくつかのストレス関連遺伝子のプロモーターのメチル化を変化させたことを示した。これらの分子変化は、臍帯血中のストレスホルモンであるコルチゾールのレベルの低下と相関していた [45]。コリンレベルの変化はまた、老化に伴う認知機能の変化[46,47]、アルツハイマー病[48,49]、出生前アルコール暴露の動物モデルにおける行動の変化[17,50,51,52]、およびレット症候群[26,53]やダウン症[25,54,55]などの神経発達障害の症状と関連している。
コリンは、国立科学アカデミー医学研究所の食品栄養委員会(FNB)によって必須微量栄養素として分類されている。コリンは、卵、豆類、魚、ナッツ類、種子、全粒粉、いくつかの肉や野菜など、私たちが必要とするものを得るための様々な食品から自然に派生している[34]。コリンの内因性合成は、主に肝臓と脳を含む身体の他の組織で発生する。コリンのde novo合成は、SAMをメチル供与体として使用したホスホチジルエタノールアミン(PE)の逐次メチル化を介したPEMTの酵素活性によって触媒される[56]。肝臓でのコリンオキシダーゼによる代謝物ベタインへのコリンの酸化は、メチル化経路で使用されるメチル供与体であるメチオニンとSAMの形成に役割を果たしている。SAMは、遺伝子のDNAメチル化やヒストンメチル化を触媒する重要な酵素であるDNAメチル化酵素(DNMT)やヒストンメチル化酵素(HMT)の主要なメチル供与体と考えられている(図1)。コリンの一部は、コリンアセチルトランスフェラーゼ(ChAT)の酵素活性によりアセチルコリン(Ach)にアセチル化される。前述したコリンのデノボ合成では、この微量栄養素のヒトの一日の必要量を満たすには十分ではない。したがって、食事から摂取するか、すべての年齢の人間のための推奨される1日の摂取量に従ったサプリメントとして摂取することが不可欠である。用量、および摂取頻度と関係する人口の面でコリンのサプリメントは、健康の専門家によって評価され、決定されるべきである。
図1 コリンとその代謝物の脳内での重要な生理機能をまとめた
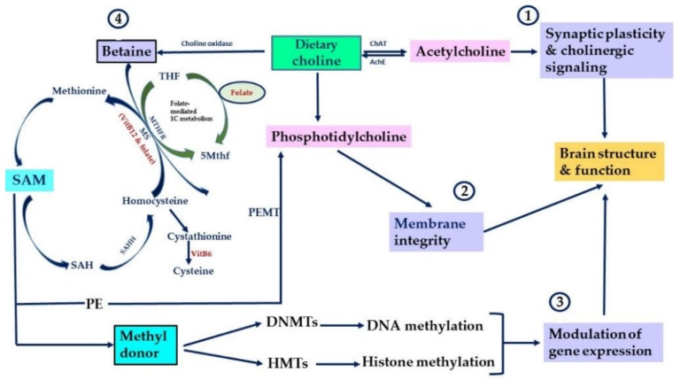
コリンとその代謝物の脳内での主な生理機能をまとめた。コリンは、コリンアセチルトランスフェラーゼ(ChAT)を介して Ach に変換される。コリンは、コリンアセチルトランスフェラーゼ(ChAT)を介して Ach に変換される。コリンはコリンオキシダーゼを介してベタインに変換される。ベタインは、DNA メチルトランスフェラーゼ(DNMT)やヒストンメチルトランスフェラーゼ(HMT)の主要なメチル供与体である SAM の形成に寄与する。コリンはベタインを介して、葉酸介在性の 1C 代謝に参加する。メチル基を供与した後、SAMはDNMTsの阻害剤であるS-アデノシルホモシステイン(SAH)に変換される。SAHは、S-アデノシルホモシステインヒドロラーゼ(SAHH)によってホモシステインに加水分解される。ホモシステインは、メチオニン合成酵素(MS)による5-メチルテトラヒドロフォラエ(5 Mthf)からのメチル基の移動を介してメチオニンに戻すことができる。MSはその活性のためにVitB12と葉酸を必要とする([9]から改変)。
遊離コリンとその代謝物のレベルは、摂取後にヒトとげっ歯類の脳内で増加する[57,58]が、この親水性分子が特定のトランスポーターを介して脳に輸送されていることを示唆している。脳はコリンを合成することはできないが、3つの供給源からその必要性を得る。(1) コリン輸送体を介して血液脳関門を通過する遊離コリン、その後コリンはホスホチジルコリン(PC)として神経細胞膜に保存され、Ach生合成のために、(2)アセチルコリンエステラーゼ(AchE)によるAch分解、および(3)ホスホチジルコリン特異的ホスホリパーゼの活性によるPCの加水分解 [59]。ChATとPEMTの酵素活性がいくつかの神経細胞の末端で検出されたことから、神経細胞はコリンを合成してAch生合成に利用する能力を持っていることが示唆された[60,61,62,63]。
コリンは、PC、PE、スフィンゴミエリン(SM)などのいくつかの膜リン脂質の前駆体である。これらのコリン含有リン脂質は、神経細胞膜を含む細胞膜の構造的および機能的な完全性を維持している。また、これらのリン脂質は、細胞シグナル伝達、ニューロンの骨髄化および分裂など、正常な脳の発達および機能に不可欠な他の生理学的プロセスにも関与している[64,65,66]。Achの前駆体としてのコリンは、様々な脳領域におけるコリン作動性神経伝達を制御している。Achは、学習、注意、記憶に役割を果たす神経伝達物質である(図1)。
コリン作動性神経伝達は、アルツハイマー病などの多くの神経変性疾患で調節障害があることが示されており、この調節障害は、これらの患者でしばしば見られる神経認知障害に寄与している可能性がある[67]。死後の研究では、老化や衰退したヒトの脳の膜リン脂質のレベルの低下を明らかにした[68]。PCなどのコリン含有リン脂質の変化が神経細胞の膜破壊と関連している可能性が示唆されており、これがアルツハイマー病におけるコリン作動性ニューロンの変性に寄与している可能性が示唆されている[69]。この膜リン脂質の喪失が神経変性の原因か結果かはまだ明らかになっていない。
3. 発達を通しての神経細胞可塑性の調節因子としてのコリンおよび他のメチル供与体
コリンはエタノールアミンの窒素原子に3つのメチル基が結合している。そのメチル基を間接的に供与し、コリンオキシダーゼによるベタインへの酸化を介してSAMの形成のための葉酸介在性1C代謝に参加している。SAMは、DNAメチル化を触媒するDNMTやヒストンメチル化を触媒するHMT、遺伝子発現を調節する2つの重要なエピジェネティックメカニズム[8](図1)にメチル基を供与する。いくつかの研究では、開発の重要な期間中に、成人期に脳内のコリンレベルの変化が学習、記憶、行動、認知機能[29]に関連する主要遺伝子のエピジェネティックマークの変化に関連付けられていることが示されている。このことは、幼少期のコリン栄養が脳の発達をプログラムし、作用のエピジェネティックなモードを介して脳機能に長期的な効果を誘導することを示唆している。このことはまた、この微量栄養素が神経保護剤であり、生涯にわたって脳の認知機能を改善する可能性があることを示唆している。
研究は、食事の成分が私たちのエピゲノムと相互作用し、長期的な効果を持つ可能性があることを示している[70,71]。このセクションでは、発育初期にコリンを補給することで、後の人生での脳認知機能に有益な効果があることを紹介する。また、加齢に伴う認知機能の低下を遅らせるために、アルツハイマー病などの神経変性疾患のいくつかのサプリメントとして、この微量栄養素と他のメチルドナーの潜在的な使用を実証したいくつかの知見をまとめる。
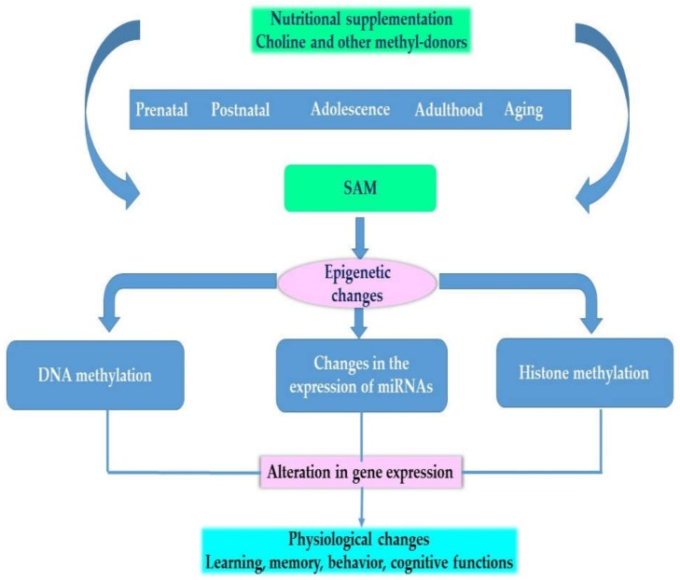
図2は、発生の異なる段階でのコリンやその他のメチル供与体のエピゲノムへの影響や表現型への影響の概要を示している。
図2 コリンや他のメチル供与体の生理作用
3.1. コリン、他のメチル供与体と発育脳
早期発達期の脳は可塑的であり、その正常な機能のために急速な成長と分化を経るため、幼少期の食事成分の摂取は精神的健康に長期的な影響を及ぼす可能性がある[70]。1炭素代謝は栄養状態に影響される[72]。コリン、ベタイン、メチオニン、葉酸、VitB6およびVitB12などの1C代謝および葉酸サイクルの構成要素は、正常な神経発達および神経認知機能にとって極めて重要である[73]。コリン、ベタイン、メチオニン、葉酸などのこれらの成分のいくつかは、神経細胞の遺伝子発現を調節するためのメチル化経路で役割を果たしているユニバーサルメチルドナーSAMの形成に参加している[74]。
動物実験では、出生前、周産期または思春期などの生活の敏感な期間中にコリンの補給または枯渇は、人生の後半で成人の子孫の神経細胞活動と脳機能に影響を与えることが示されている。認知機能のコンテキストでは、出生前または周産期のコリン補給は、人生の後半にメモリ関連のタスクで動物のパフォーマンスを改善した[46,47,75,76]。他の研究では、脳内のコリンと他のメチルドナーの作用のエピジェネティックなメカニズムを調査した。コリンは、DNAメチル化、ヒストンメチル化、または特定のマイクロRNAの発現の変化などのエピジェネティックなメカニズムによって遺伝子の発現と機能を変調することが示されている[8]。In vitroの研究では、コリン枯渇がマウス胎児の脳の海馬の発達を変化させ、培養神経前駆細胞(NPC)の増殖を減少させたことを示した[77]。この枯渇は、マウス胎児の海馬におけるグローバルおよび遺伝子特異的なメチル化の変化と相関している[78,79]。In vivoでの研究では、胚発生日E17でコリン欠乏は、そのようなG9aヒストンメチル化酵素とその関連する抑制マークH3K9me1とH3K9me2などのヒストン修飾酵素の発現を減少させたことを示した脳室下ゾーンと脳室ゾーンでは、これらのヒストン抑制マークのグローバルレベルでは変化がなく、全体のマウス胎児の脳では、これらのヒストン抑制マークの変化と海馬の心室ゾーン。胎児期のこれらの抑制マークの誘導は、シナプス可塑性、学習、記憶の調節因子であるカルビンジン遺伝子(Calb1)のプロモーターのRE1サイト上の抑制エレメント-1サイレンシング転写因子(REST)の結合の減少と相関しており、NPCでの発現の増加をもたらした[80]。
げっ歯類を用いて行われた他の研究では、メチルドナーの欠乏が学習と記憶に及ぼす影響を評価した。思春期に葉酸、メチオニン、コリンを欠乏させた食事を3週間与えたマウス(FMCDマウス)では、新規物体認識や恐怖消失などの特定のテストで障害が認められた[81]。分子レベルでは、FMCDマウスでは、シナプス可塑性に関与する海馬のGria1遺伝子発現の低下を伴うGria1プロモーターのハイペルメチル化が認められた[81]。これらの結果は、感受性の高い発達期である思春期のメチルドナー欠損は、学習や記憶に障害をもたらし、そのメチル化状態を変化させることでマウス海馬におけるGria1遺伝子の発現を変化させていたことを示している。
ヒストンマークの変化またはヒストンメチル化の変化の文脈では、胎児-新生児期の鉄欠乏は、ラット海馬における脳由来神経栄養因子(Bdnf)プロモーターのメチル化の変化を誘導し、そのようなH3K9me3などの抑制的なヒストンマークの上昇を引き起こしたが、Bdnfに沿って活性化ヒストンマークH3K4me3の減少を引き起こした[82]。ヒストンマークのこれらの変化は、海馬の可塑性に関与する遺伝子であるBdnf発現の低下と相関していた。鉄欠乏ラットへの妊娠コリン補給(妊娠日GD11-GD18から)は、Bdnf遺伝子に沿ったこれらの観察されたエピジェネティックな変化を逆転させた[82]。
ダウン症やレット症候群などの遺伝学的に関連した神経疾患の症状に対するコリンの効果も研究された。ダウン症のマウスモデル(Ts65Dn)は、前脳基底部コリン作動性ニューロンの枯渇と注意、認知、記憶に関連する機能の障害、アルツハイマー病でしばしば見られる症状によって特徴づけられる。このマウスモデルの母体の周産期コリン補給は、成人の子孫にこれらの機能を改善した[83]。レット症候群は、否定的に認知と運動機能を調節することが知られているコリン作動系に影響を与える別の神経発達障害である。レット症候群(RTT)のマウスモデルにおける産後の母親のコリン補給は、成人の子孫[84]で運動器活動、運動協調と行動を改善した。
いくつかの人間の研究では、小児期に子孫の認知機能にメチルドナーの妊娠コリンや母親の摂取量の有益な効果を実証した。これらの効果は、メモリ、注意と問題解決の改善として明らかにされ、子供の学齢期の年[85,86,87]まで続いた。他の研究では、神経発達のアウトカム[12]に小児期のいくつかの段階で母親のコリン摂取量の効果の決定的な結果を報告した。Wallace 2018は、ヒトにおけるコリン摂取が生涯を通じて認知機能に及ぼす影響について、優れたレビューにまとめている[12]。
3.2. コリン、他のメチル供与体、老化脳
私たちがさらされている栄養素の質と量は、私たちの長期的な幸福と精神的健康を形作る可能性がある。遺伝子と栄養素の相互作用は非常に複雑であり、エピジェネティックなメカニズム[21,88]によって制御されることが示されている。成熟した脳の機能における微量栄養素コリンおよび他のメチルドナーの役割は、動物モデルおよびヒトで研究されてきた。例えば、コリンは、老化に伴う認知障害や記憶力の低下[89,90,91]、アルツハイマー病などの神経変性疾患に苦しむ個人に多く見られる症状を軽減または遅延させることで、神経保護効果を発揮することが示されている。その後、個別化された栄養学に基づいたアプローチは、精神的な健康を後押ししたり、加齢に伴うこれらの衰弱性疾患の進行を遅らせるために、人生の早い段階で採用される可能性があるか?ここでは、老化とそのようなアルツハイマー病などの神経変性疾患の脳の認知機能、メモリと学習を変調する際のメチル-ドナーの潜在的な役割を文書化した動物と人間の研究から得られた知見のいくつかを要約する。
いくつかの研究では、アルツハイマー病の脳におけるDNAメチル化の全体的な減少が報告されている。この変化は、アミロイド前駆体タンパク質(APP)遺伝子プロモーターのメチル化低下と関連しており、APPの発現が増加し、脳の特定領域におけるβアミロイド斑の沈着が増加することが報告されている[92]。βアミロイド斑は酸化ストレスと炎症の強力な誘発因子である。他の研究では、APP遺伝子プロモーターのメチル化状態の変化は認められなかった。興味深いことに、アルツハイマー病症例では、大脳皮質、海馬、頭頂部のいくつかの領域で、SAHレベルの上昇を伴うSAMレベルの有意な低下が報告されている[93]。SAH の上昇は、アルツハイマー病 の脳の低メチル化のこの状態を引き起こす要因である可能性がある DNMT 活性の主要な阻害剤であることが知られている。葉酸とVitB複合体を含む栄養サプリメントの使用は、メモリの進行性の低下を遅らせ、アルツハイマー病患者[94,95]で特定のタスクでの全体的なパフォーマンスを改善した。これらの知見は、葉酸やVitB複合体などのこれらのメチルドナーは、アルツハイマー病症状の重症度を軽減したり、遅延させるために高齢者人口のサプリメントとして個別の方法で使用することができることを示唆している。
コリンアルホセレートまたはグリセロホスホコリン(GPC)およびCDP-コリンなどのコリン含有化合物は、限られた臨床研究で使用されており、有望な神経保護効果および加齢に伴う認知症に対する役割が示されている[96]。コリン含有化合物もまた、動物モデルにおいて有望な結果を示している。例えば、GPCはラット海馬においてAch放出を誘導し、注意力、学習、記憶に関連する脳のこの領域の正の構造変化を引き起こすことが示されている[97]。ラットの食事中のCDP-コリンの長期補充は、高齢ラットの空間記憶欠損の発達を予防することが示されている[98]。ヒトにおけるCDP-コリンおよび他のコリン含有化合物の認知機能への影響は、さらに調査されるべきである。アルツハイマー病のAPP/PS1(PS1=Presenelin1)マウスモデルにおける長期の食事性コリン補給(2.5ヶ月から10ヶ月間)は、アミロイドプラークの蓄積を減少させ、マウス海馬におけるAPPの処理を減少させた。さらに、コリン補給はミクログリアマーカーの活性化レベルを低下させ、これらの細胞におけるα7ニコチン性アセチルコリン受容体(α7nAchR)の発現を低下させ、ミクログリアの活性化を減少させた。行動レベルでは、長期食餌性コリン補給は、これらのマウスのモリス水迷路で評価される空間記憶を改善した [99]。これらの結果は、長期的な食餌性コリンの摂取が、このマウスモデルのアルツハイマー病に関連する表現型を緩和したことを示唆している。アルツハイマー病様の病態を緩和するために、ヒトにおけるコリンを含む食事法の潜在的な使用は、さらに調査されるべきである。
最近の研究では、アルツハイマー病のマウスモデルにおける脳機能に対するコリンの世代交代効果が実証された[100]。葉酸の代謝はコリンの代謝とリンクしている。メチルテトラヒドロ葉酸還元酵素 (MTHFR) は、テトラヒドロ葉酸 (Thf) を 5-メチルテトラヒドロ葉酸 (5Mthf) に変換するだけでなく、それを SAM の前駆体であるメチオニンに変換することによってホモシステインの低レベルを維持する [101]。アルツハイマー病のマウスモデルでのコリン補給は、マウスの第一世代と第二世代の認知機能を改善し、彼らの脳内のホモシステインのレベルを低下させた。ホモシステインのレベルの上昇は、アルツハイマー病発症のリスクの増加にリンクされている[102]。コリン補給に応答して、ADマウスモデルで観察されたこれらの変化は、炎症、ヒストンマークの変化と神経細胞死[100]に関連する主要な遺伝子の発現の変化と相関していた。
別の研究では、認知機能と脳生化学[103]の変化にメチルドナー葉酸の遺伝的および栄養的貢献の両方を示した。MTHFR遺伝子変異体(Mthfr+/-)または「軽度のMthfr欠損」を有するマウスは、海馬のBdnf遺伝子発現の低下を伴う生後10ヶ月間の大脳皮質および海馬における短期記憶機能の障害、不安の増加およびコリン代謝の障害を示した。Mthfr+/+マウスに低栄養の葉酸を与えた場合、SAMレベルとAchの低下、シナプスマーカー(シンパトフィシンなど)Bdnf、エピジェネティック酵素(DNMTs、HDACs)大脳皮質または海馬の1C代謝の酵素の発現の変化が見られた[103]。これらの知見は、コリンや葉酸などの1C代謝の成分が正常な認知機能に不可欠であることを示唆している。
限られたヒトの研究では、コリンや他のメチルドナーの摂取量を増やすことで、認知機能や記憶の一部の側面を改善することができるという有望な結果が示されている。例えば、コリン、VitB12,VitB6および葉酸を含むいくつかのメチルドナーの組合せの使用は、初期のアルツハイマー病を持つ患者で有望な結果を持っていた。これらの患者は記憶力の改善とコリン作動性シグナル伝達の強化を示した[104]。著者らは、メチルドナーのこの組み合わせの使用は、これらの患者の脳における膜の完全性の強化と改善されたコリン作動性シグナル伝達に貢献する本質的な前駆体を提供している可能性があると主張した[104]。
同様に、ウリジン、オメガ3脂肪酸(DHA)とコリンで構成されている栄養補助食品 “SOUVENAID “は、初期のアルツハイマー病患者の記憶スコアを改善し、異なる脳領域でのシナプスと神経伝達の増加につながった[105,106]。それは、患者のこの集団におけるこれらの栄養素の組み合わせは、脳のPC合成の増加に貢献し、積極的にシナプス前およびシナプス後膜の構造的および機能的な完全性に影響を与えた可能性があることがこれらの2つの研究で述べられている[105,106]。
別の研究は、コリン、葉酸、およびホモシステインなどの栄養素のレベルを比較することを目的とした アルツハイマー病 患者と軽度の認知障害を持つ患者の血液と 脳脊髄液。アルツハイマー病患者は脳脊髄液ホモシステインレベルが高いが、血漿コリンレベルが低いのに対し、軽度認知障害患者は対照群と比較して脳脊髄液葉酸が低く、脳脊髄液ホモシステインが高いことが示された[107]。これらの結果は、アルツハイマー病患者がコリンや葉酸などのリン脂質合成に関与する栄養素のレベルの低下を示すことを示している。
アルツハイマー病患者に多く見られる認知症のバイオマーカーの検出は、現在、この疾患の前臨床診断や予後診断に不可欠なツールと考えられている[108]。ヒトでの研究では、健常な対照群と比較して、アルツハイマー病患者の血液中の10種類の脂質(10種類のうち8種類はコリンを含む脂質)が減少していることが示された。これらの10種類の脂質は、2~3年以内に軽度の認知障害やアルツハイマー病を正確に(90%以上)予測することが検証されている[12,109]。これらの結果は、介入のためのこれらの疾患の早期診断のために、バイオマーカーの使用を検討し、さらに調査すべきであることを示唆している。
循環からの脳へのコリンの取り込みは加齢とともに著しく減少する[90]ため、高齢者の特定の要件を満たすためには、高齢者集団におけるコリン取り込みを増加させるための選択的かつ個別化されたアプローチが必要であるかもしれない。加齢に伴う脳からのコリン取り込み量の減少は、Ach合成のためのコリンの脳内需要に追いつくための代償メカニズムとして、神経細胞膜内のPCの分解を誘発することになるだろう[90]。加齢に伴うコリンの減少は、神経変性疾患における膜リン脂質の変性や、影響を受けた脳領域におけるコリン作動性ニューロンの活動の損失または減少と関連している[48,49]。したがって、高齢者またはアルツハイマー病の初期段階の患者における他のメチルドナーとのコリン補給は、老化した脳によるコリン取り込みの増加に寄与し、Ach合成のためのコリンレベルを増加させる可能性がある。加齢に伴う認知障害の症状の軽減または遅延、およびアルツハイマー病などの神経変性疾患におけるコリンおよび他のメチル供与体の潜在的な役割を探るためには、さらなる研究が必要である。
表1は、動物モデルおよびヒトにおけるメチル供与体の脳機能への影響をまとめたものである。
表1 発達と老化の脳のメチルドナー補充または欠乏の結果
| 説明 | 結果 | 参考文献 |
|---|---|---|
| 出生前および出生後のコリン補給 | 子孫の記憶関連タスクの改善 | [ 46、47、75、76 ] |
| 葉酸、メチオニン、コリンの欠乏症(FMCDマウス) | 学習と記憶の障害 Gria1プロモーターの高メチル化 |
[ 81 ] |
| 鉄欠乏(ID)ラットにおける妊娠中のコリン補給 | 海馬Bdnfプロモーターのメチル化の変化 | [ 82 ] |
| ダウン症のマウスモデルにおける周産期のコリン補給 | 子孫の認知機能の改善 | [ 83 ] |
| ADのAPP / PS1マウスモデルにおけるコリンの長期栄養補助食品ADのマウスモデルにおける コリン補給 |
α7nAchR発現の 低下におけるアミロイド斑の蓄積の低下ミクログリアの活性化の低下 空間記憶の 改善認知機能の改善と世代を超えたホモシステインのレベルの低下 |
[ 99、100 ] |
| Mthfr + / +マウスにおける低食餌性葉酸 | シナプスマーカー、Bdnfおよびエピジェネティック酵素の発現の変化 | [ 103 ] |
| 初期のAD患者におけるコリン、VitB12、VitB6および葉酸の補給 | 改善された記憶と強化されたシナプスシグナル伝達 | [ 104 ] |
| 初期のAD患者におけるSOUVENAIDの補給 | 改善されたメモリスコア | [ 105、106 ] |
4. メチル供与体の不摂生による副作用
動物実験では、メチルドナーの過剰または不十分な摂取は、神経発達や認知に悪影響を及ぼすことが示された。例えば、高レベルの葉酸(対照群の10倍のレベル)の出生前補充は、構造的、行動的、分子的変化をもたらした[110]。胚発生日E17.5では、葉酸の上昇はラットの皮質層の異常発達をもたらした。ホスホコリン、コリン、およびその代謝物ベタインのレベルは、胚性肝臓で有意に減少し、脳内のAchレベルに変化が見られた[110]。生後3週間で、ラットは海馬の大きさの減少、歯状回の厚さの変化、短期記憶の障害を示した。分子レベルでは、葉酸の過剰な補充は、de novoメチル化反応を触媒し、脳の発達と神経細胞の成熟に役割を果たしている重要なエピジェネティック酵素であるDnmt3a mRNAの発現を変化させた。このようなDnmt3a発現の変化は大脳皮質と海馬の両方で検出されたが、維持メチル化酵素であるDnmt1とde novoメチル化酵素であるDnmt3bのmRNA発現には変化がなかった[110]。
別の動物研究では、思春期におけるメチルドナーの過剰摂取の悪影響が実証されている[111]。神経回路が完全にそのような海馬と前頭前野、メモリ、執行機能と認知柔軟性の役割を果たす脳領域などのいくつかの脳領域で成熟していないので、思春期は脆弱な発達段階である。産後の日(PD30-60)でラットに過剰な葉酸(対照群の4倍のレベル)のサプリメントは、内分泌かく乱と記憶の変化をもたらした。これらのラットは、海馬における甲状腺ホルモン受容体(TRα1とTRα2)の発現の低下を伴う周辺部の甲状腺ホルモントリヨードサイロニンT3とテトラヨードサイロニンT4のレベルの低下を示した。末梢および脳内のこれらの内分泌変化は、Morris Water Maze [111]によって実証されたように、学習および空間記憶課題の障害と相関していた。
ヒトの研究では、乳児の人生の最初の年に神経発達に妊娠中の葉酸補充の効果を評価した[112]。葉酸サプリメントの推奨用量以上の妊娠中に取った女性の乳児は、乳児発達テスト[112]のベイリースケールを使用して評価されるように、人生の最初の年に遅延した精神運動発達を示した。読者は、認知機能[113]に対するヒトの食事介入の効果を要約した優れた最近のレビューに指示されている。
上記にまとめたこれらの選択された研究は、神経発達の重要な段階でのメチルドナーの補充の用量と期間が最適化するためにかなり重要な要素であることを示している。これに関する現在の臨床文献や研究は限られており、決定的なものではなく、栄養素の補充、特にメチルドナーの補充が神経発達や認知機能に及ぼす影響については、まだ課題がある。メチル供与体は、SAMの利用可能性に影響を与え、DNAメチル化またはヒストンメチル化などのエピジェネティックなメカニズムを調節し、神経細胞の遺伝子発現および活動に影響を与える。これらの栄養素の補充の効果は、望ましくない結果を防ぐために、人生のさまざまな段階での摂取の安全性を確保するために、動物およびヒトでさらに調査されるべきである。その上で、発達の異なる段階や神経変性疾患における栄養素の最適かつ安全な摂取量を決定しなければならない。そのようなメチル-ドナーの補充などの栄養素の補充や摂取のための食事の推奨事項への国民の遵守は、その後、強く強調し、より良い精神衛生上の不十分な栄養素の摂取量の悪影響を防止したり、軽減するために医師や栄養機関によって患者に伝えられるべきである。教育プログラムは、その後、強く食品源と生涯にわたる健康におけるコリンと他のメチルドナーの有益な効果についての公衆と医療専門家の意識を高めるためにサポートされるべきである。健康におけるコリンの重要性といくつかの集団におけるその摂取量についての意識を高める必要性は 2018年のコリン科学サミットで議論された。我々は、さらなる情報のために、このサミットの議論の成果についての優れた現在のレビューを読者に参照する[32]。
5. 結論
コリンや他のメチル供与体は、正常な神経発達や神経認知機能に役割を持つことが示されている。コリンは現在、エピジェネティックなメカニズムによって記憶、学習、認知機能に関連する重要な遺伝子の発現を調節する神経保護剤と考えられている。
この微量栄養素は、初期の脳の正常な成長と機能のために重要であるだけでなく、脳機能を後押しし、老化とアルツハイマー病などの神経変性疾患の認知機能の低下を遅らせるか、または緩和することに有望な効果を持っている可能性がある。
また、メチル供与体の不適切な摂取は、神経発達や認知に悪影響を及ぼすことが示されている。コリンやその他のメチル供与体の脳機能への影響や、摂取のための最適な用量については、すべての年齢層にわたってさらに調査する必要がある。精神衛生上の栄養素の役割を理解し、彼らは生涯にわたって私たちの遺伝子とどのように相互作用するかは非常に重要である。
このことは、認知機能の改善と人生の後半のより良い精神的健康を達成するために、人生の早い段階で十分なメチルドナーの補充を含む栄養学に基づいた個別化されたアプローチの採用を促進する可能性がある。治療薬と組み合わせたこのアプローチはまた、認知機能に対する加齢や神経変性疾患の悪影響を軽減するための実行可能なオプションとして、高齢者において慎重に研究されるべきである。
