Contents
Neuropathology of COVID-19 (neuro-COVID): clinicopathological update
www.ncbi.nlm.nih.gov/pmc/articles/PMC7861505/
Jerry J. Lou,1,2,* Mehrnaz Movassaghi,1,* Dominique Gordy,1 Madeline G. Olson,1 Ting Zhang,1 Maya S. Khurana,2 Zesheng Chen,1 Mari Perez-Rosendahl,2 Samasuk Thammachantha,3 Elyse J. Singer,4 Shino D. Magaki,1 Harry V. Vinters,1,4 and William H. Yong, MD1,2
要旨
新型コロナウイルス感染症(COVID-19)は、21世紀初頭の最大の公衆衛生危機として浮上している。その原因物質である重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)は、アンジオテンシン変換酵素2受容体またはいくつかの他の受容体を介して細胞に入るエンベロープ型一本鎖ポジティブセンスリボ核酸ウイルスである。
COVID-19は主に呼吸器系に影響を与えるが、脳を含む他の臓器も関与しうる。欧米の臨床研究では、無気力症や意識障害などの比較的軽度の神経学的機能障害が頻発する(~70~84%)一方で、脳卒中(~1~6%)や髄膜脳炎などの重度の神経学的障害はあまり一般的ではない。感染した患者集団の合併症を考えると、SARS-CoV-2感染が脳卒中の発生にどの程度寄与しているかは明らかではない。
まれに、急性播種性脳脊髄炎、ギラン・バレー症候群、急性壊死性脳症の臨床的に定義された症例がCOVID-19患者で報告されている。検討された184例の患者における一般的な神経病理学的所見は、ミクログリア活性化(42.9%)と一部のミクログリア結節(33.3%)リンパ系炎症(37.5%)急性低酸素-虚血性変化(29.9%)アストログリア症(27.7%)急性/亜急性脳梗塞(21.2%)自然出血(15.8%)微小血栓(15.2%)などである。当院の施設症例では、時折下垂体前部梗塞を認めることもある。COVID-19凝固障害、敗血症、急性呼吸窮迫がこれらの所見の多くに関与している可能性が高い。
中枢神経系リンパ系の炎症が認められる場合、しばしば最小限から軽度であり、免疫組織化学的に最もよく検出され、ある研究では、対照の敗血症症例と区別がつかなかった。一部の症例では、ミクログリアの結節や神経貪食が認められ、延髄に病変を生じやすいウイルス性髄膜脳炎を強く支持している。ウイルスはヒトの大脳、小脳、頭蓋神経、嗅球、および嗅上皮で逆転写酵素ポリメラーゼ連鎖反応、免疫組織化学、または電子顕微鏡で検出可能である。
現存する症例のレビューには、選択の偏りや、いくつかの症例では臨床情報が限られているなどの限界がある。また、脳細胞へのウイルスの直接感染の影響や、SARS-CoV-2が長期にわたって持続し、慢性的な症状を引き起こすかどうかについては、まだ多くのことが明らかになっていない。
キーワード
中枢神経系、COVID-19,SARS-CoV-2,脳、下垂体
1. はじめに
2019年後半、中国の武漢で肺炎と急性呼吸窮迫を伴う新規感染症が出現した。示唆されたヒトコロナウイルスは 2003年の重症急性呼吸器症候群(SARS)アウトブレイクの背後にある根本的なウイルス剤であるSARSコロナウイルス(SARS-CoV)に遺伝的に関連していたが、それとは異なるものであった。国際ウイルス分類学委員会は、この新型コロナウイルスを「重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)」1 と指定し、世界保健機関(WHO)は、この関連疾患を「新型コロナウイルス感染症(COVID-19)」と呼んでいる1。
COVID-19のパンデミックは、無症状の患者が容易に蔓延したため、世界中で急速に流行し、2020年12月末までに7,900万人以上のヒト感染が確認され、170万人以上が死亡した2。これらの数字は、実際の感染者数を大幅に過小評価していると考えられている。COVID-19は肺への感染が最もよく知られているが、心臓、腎臓、神経系など他の臓器にも影響が及ぶことが多い。
このレビューでは、組織ベースのCOVID-19の神経病理学的解析の概要を説明するとともに、SARS-CoV-2ウイルス学についての簡単な考察を行い、その病態を理解するための文脈を提供するとともに、検査結果に偏りが生じる可能性のある診断検査の制限についても説明する。神経系は低酸素症や凝固障害などの全身合併症による二次的な影響を受け、一次感染によるものと思われるが、脳、脊髄、神経系の他の構成要素へのウイルスの浸潤については、まだ多くのことが解明されていない。
2. SARS-CoV-2ウイルス学
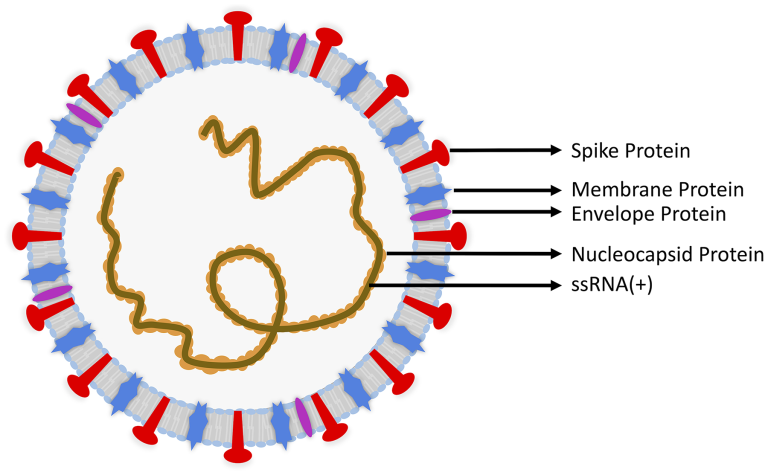
SARS-CoV-2 は、ヒトの病原体として登場した最新のコロナウイルスである。α-コロナウイルス(α-CoV)β-コロナウイルス(β-CoV)γ-コロナウイルス(γ-CoV)およびδ-コロナウイルス(δ-CoV):コロナウイルスは、4つの世代に細分化された一本鎖、陽性反応リボ核酸(RNA)ウイルスである。 3 SARS-CoV-2 は、SARS-CoV(~79%の相同性)および中東呼吸器症候群コロナウイルス(MERS-CoV)(~50%の相同性)と遺伝的類似性を共有しているβ-コロナウイルスで、サイズは通常 60~140 nm4-6 である。 7 SARS-CoV-2 ゲノムは、ウイルスの複製に関与する 16 の非構造タンパク質と、エンベロープ、膜、ヌクレオカプシド、スパイク糖タンパク質からなる 4 つの構造タンパク質をコードしている(図 1)3,8,9。SARS-CoV-2 の突然変異率は、1 年あたりの部位あたり 0.84~1.12×10-3 置換数7,11 と推定されており、これはヒト免疫不全ウイルス(HIV)12 やインフルエンザ A よりも低い13 。ヌクレオカプシドおよびスパイク蛋白に対する抗体は、免疫組織化学的研究に使用されてきた。
図1 Severe Acute Respiratory Coronavirus 2(SARS-CoV-2)の構造
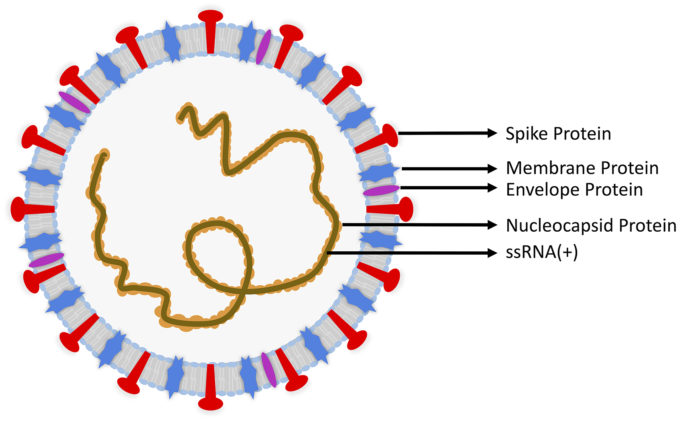
スパイク(S)タンパク質(赤)エンベロープ(E)タンパク質(紫)膜(M)タンパク質(青)ヌクレオカプシド(N)タンパク質(橙)の4つの構造を持っている。
3. ACE2と他の受容体がSARS-CoV-2の侵入を媒介する
SARS-CoV-2 のヒト細胞への侵入は、レニン-アンジオテンシン系(RAS)の重要な調節因子であるアンジオテンシン変換酵素 2(ACE2)受容体とスパイク蛋白質の相互作用によって媒介されると一般的に考えられている14 。 -21 ACE2 受容体の発現は、大脳、小脳、脳幹、網膜、嗅粘膜で報告されている。ACE2 受容体に加えて、試験管内試験 研究では、SARS-CoV-2 は、Basigin(BSG; CD147)26 ニューロピリン-1(NRP1)27 膜貫通型セリンプロテアーゼ 2 および 4(TMPRSS2/4)28,29 およびカテプシン L(CTSL)などの他の細胞受容体を用いて侵入する可能性があることが示されている9。 9 ACE2受容体の発現は、オリゴデンドロサイト、ニューロンではTMPRSS2/4,ミクログリアではCTSL、内皮細胞ではNRP1で最も高くなっている。したがって、原則として、中枢神経系(CNS)の広範な細胞は、感染を促進する様々な受容体を持っていると考えられる。
4. COVID-19の臨床検査には大きな限界がある
時間の経過とともにウイルス価が上昇する疾患の自然経過のため、SARS-CoV-2の検査では患者の感染を完全に排除することはできず、神経病理医による外科的または剖検例の管理を複雑にしている。また、重症でウイルス負荷の高いCOVID-19患者の剖検を評価することに偏りがあるかもしれない。一般的に使用されている COVID-19 逆転写酵素ポリメラーゼ連鎖反応(RT-PCR)アッセイの分析感度は、鼻咽頭サンプル中の検出限界が 6.25 copies/μL と低く、優れている30 。臨床現場では、RT-PCR の感度は 83.3% またはそれ以下である可能性があり、感染期、サンプルタイプ、採取手順、および検査プラットフォームによって影響を受ける可能性がある31,32 。
COVID-19 RT-PCR 検査は、感染の初期段階で偽陰性の結果をもたらす可能性がある。症状があり、胸部コンピュータ断層撮影(CT)所見が疑われ、RT-PCR 検査が最初に陰性であった患者の逐次検査では、COVID-19 RT-PCR 陽性は最初の検査から平均 5.1 ± 1.5 日後に発生する32 。鼻咽頭スワブで RT-PCR 検査結果が陰性であったが、SARS-CoV-2 脳脊髄液(脳脊髄液)検査が陽性であった患者が報告されている33 。ゲノム RNA の RT-PCR 検出は生存可能なウイルスには特異的ではないが、感染細胞に転写されたサブゲノム RNA の同定は、臨床検査ではウイルス培養の代わりに能動的に複製するウイルスの存在を記録するために使用されている34 。
血清学的検査は接触者追跡、疫学、ワクチン研究に使用されているが、抗体の発現遅延を考慮すると、一次診断に使用することはより困難である36-40 。2 段階 ELISA 法は、フローアッセイよりも定量的で信頼性が高く、スケーラビリティーは容易であるが定性的なものである。
5. COVID-19の全身性病態生理
28 感染が進行すると、SARS-CoV-2 は肺内皮細胞に感染し、上皮内皮バリアを破壊する。41,42 重度の COVID-19 では、内皮細胞の炎症およびサイトカインストームによる二次的な微小血栓形成を反映して凝固障害が起こる可能性がある。COVID-19に関連した高凝固性は、静脈血栓塞栓症と動脈閉塞を誘発する41 。これらの全身的な異常の相互作用は、おそらく中枢神経系で見られる病理学的変化に寄与している(図2)。
図2 COVID-19の病態および神経学的機能障害をモデル化したフローチャート
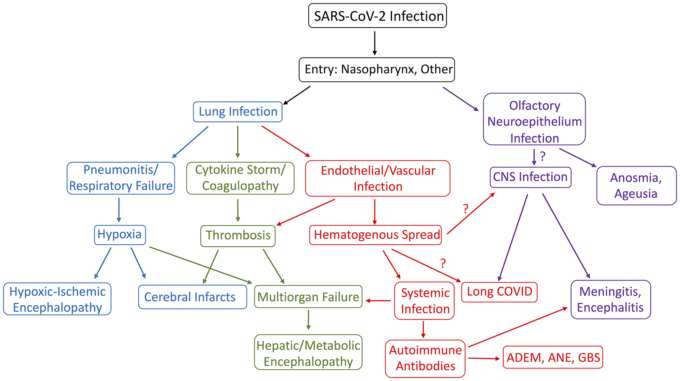
ADEM=急性播種性脳脊髄炎、ANE=急性壊死性脳症、GBS=ギラン・バレー症候群。
6. COVID-19 神経学的症状
COVID-19に関連する神経学的症状は、めまい、頭痛、意識障害または無感覚などの軽度の症状から、脳卒中、ギランバレー症候群(GBS)急性出血性壊死性脳症、髄膜脳炎、および脳静脈血栓症などの重度の障害まで多岐にわたる。報告された神経学的徴候や症状の頻度は変動するが、関係なく実質的なものである。中国の初期のレトロスペクティブ研究では、COVID-19患者214人のうち36.4%がめまい(16.8%)頭痛(13.1%)意識障害(7.5%)味覚障害(5.6%)および無感覚(5.1%)を含む神経学的症状を有していた。フランスの研究では、COVID-19集中治療室(ICU)患者58人(84%)のうち49人に神経学的徴候が認められ、その徴候には動揺(69%)錯乱(65%)皮質脊髄路徴候(67%)および性機能不全症候群(33%)が含まれていたと報告されている47。英国の紹介センターの研究では、敗血症性または超感染性脳症、急性播種性脳脊髄炎(ADEM)を含む自己免疫性脳炎、およびGBSの症例も報告されている48。
7. COVID-19に関連する特定の神経疾患
嗅覚・味覚機能障害
前述の中国での研究では、COVID-19患者の味覚機能障害と嗅覚機能障害の頻度はそれぞれ6%未満であった44 。ヨーロッパの前向き研究では、COVID-19患者385人の88.8%に味覚機能障害が、417人のCOVID-19患者の85.6%に嗅覚機能障害が認められた45。カリフォルニア州の研究では、COVID-19患者59人のうち71%が老衰を記録し、68%が無嗅覚を報告した。長期の追跡調査は一般的に不足しているが、ある研究では、家庭検疫されたCOVID-19患者の30日目における嗅覚機能障害の消失率は87%、味覚機能障害の消失率は82%であったと報告されている52 。嗅覚機能障害と回復の正確な根拠はまだ解明されていないが、鼻粘膜の嗅神経上皮および嗅球にSARS-CoV-2ウイルスが存在することが報告されている53,54 。
脳卒中
脳卒中はCOVID-19に関連する最も一般的な衰弱性神経障害であり、男性および高齢者に好発する。ニューヨークで行われた2件のレトロスペクティブ研究では、COVID-19で入院または救急部を受診した患者1,916人の1.6%、およびCOVID-19で入院した患者3,556人の0.9%が放射線学的に確認された虚血性梗塞を有していたことがそれぞれ報告されている。ニューヨークの第3回レトロスペクティブ研究では、3,218人のCOVID-19患者のうち1.1%が脳卒中であったことが明らかになった。中国のCOVID-19患者214例を対象としたレトロスペクティブな研究では、6例(2.8%)の脳卒中が報告されている。44 アメリカの小規模な症例シリーズでは、50歳未満のCOVID-19患者5例で大血管虚血性脳卒中が報告されており、そのうち4例には脳卒中の既往歴はなかった58。59 救急外来を受診した患者や入院した患者のうち、虚血性梗塞を起こしたのは1486人のインフルエンザ患者の0.2%にすぎず、年齢、性別、人種を調整してもCOVID-19患者に比べて有意に少なかった。
ニューヨークの別の研究では、神経画像検査を受けたCOVID-19患者755人中33人(4.4%)に、外傷、脳転移、腫瘍切除と関連のない頭蓋内出血の証拠が認められた60。60 髄質出血を起こした5人の患者のうち、4人は頭蓋内出血の前の72時間に部分トロンボプラスチン時間または抗ファクターXaが高値であった60。
60 高齢、心血管疾患、脳血管疾患、糖尿病、慢性呼吸器疾患、高血圧、肥満、喫煙、および癌は、重度のCOVID-19病変または予後不良の危険因子である。61-67 カナダの研究では、血液型AおよびABの重篤なCOVID-19患者は、人工呼吸、継続的な腎代替療法、および長期の集中治療室入院を必要とする可能性が高かった。68 前述のCOVID-19の予後因子の多くは、COVID-19の呼吸不全や血液凝固症との関連で、動脈硬化や動脈硬化と関連しており、脳卒中の一因となる可能性があることに気づかないわけにはいかない。
ギラン・バレー症候群
GBSは、まれな免疫介在性の末梢神経の脱髄疾患であり、しばしばウイルス感染後に発症する。COVID-19患者における一般的な呈示症状としては、対称性弛緩性四肢麻痺、運動失調、顔面脱力、呼吸不全、下肢麻痺などが挙げられる。鼻咽頭スワブのRT-PCRはSARS-CoV-2に陽性であったが、脳脊髄液は陰性であった。GBSの症状はCOVID-19の症状発現後5日目から 10日目の間に出現する傾向がある。GBSの30例以上が報告されている。提案されているメカニズムの1つは、自己免疫性亢進反応であり、インターロイキン(IL)-6などの炎症性メディエーターの放出を誘発し、自己免疫性脱髄または軸索損傷を引き起こす。また、いくつかのケースでは、SARS-CoV-2はガングリオシドを標的とする抗体の産生を誘発し、末梢神経障害を引き起こす可能性がある72,77。COVID-19関連ミラー・フィッシャー症候群(MFS)眼球運動失調、運動失調を伴うGBSの一種であるCOVID-19関連ミラー・フィッシャー症候群(MFS)多発性頭蓋神経障害を伴うGBSの一種である頭蓋多発性神経炎(PNC)などが報告されている78。
髄膜炎および脳炎
COVID-19に関連した髄膜炎の報告はまれであるが、1例では、疑いがある場合には髄液検査の必要性が強調されている。24歳の日本人男性が頭痛、全身倦怠感、発熱を呈し、典型的なCOVID-19症状の発症から9日後に精神状態の変化、一過性の全身性発作、頸部硬直を呈した。脳磁気共鳴画像法(MRI)では、側脳室に沿って、海馬を含む内側側頭葉に過緊張が認められた。SARS-CoV-2 RNAは鼻咽頭スワブではRT-PCRでは検出されなかったが、脳脊髄液では検出された。33 COVID-19患者で行われた剖検では、いくつかの症例で髄膜脳炎が示唆されており、これらについては8.79節で議論する。
その他の疾患
ブラジルの研究では、以前は健康であった3人の41歳未満のCOVID-19患者で中心静脈血栓症(CVT)が報告されており、この年齢層でもCOVID-19の高凝固状態を認識する必要があることが強調されている80。急性出血性壊死性脳症は、両側の視床病変を含む多焦点対称性脳病変を特徴とするまれな合併症であるが、COVID-19との関連はまれである81,82。この合併症は、頭蓋内サイトカインストームに関連した血液-脳バリアーの破壊によって引き起こされる可能性がある。COVID-19に関連したADEM様疾患および自己免疫性脳炎の症例が報告されている。
8. COVID-19の神経病理学的所見と神経病変
COVID-19神経病理学のスペクトルを調べるために、我々は、SARS-CoV-2のRT-PCRで分析した101例と免疫組織化学(IHC)で分析した83例を含む184例の患者の組織ベースの神経病理学的解析を行った20の論文をレビューした(表1)(25,53,90-99,79,83-89)。組織学的所見の範囲は広く、その一部は神経学的所見の不均一性を反映している。最も頻度の高い所見(表1)には、過小評価されている可能性の高いサブセットのミクログリア小結節を伴うミクログリア活性化、血管周囲リンパ球症(図3a)実質リンパ球浸潤、および下垂体リンパ球性炎症を含むリンパ球性炎症、低酸素-虚血性変化(図3b)アストログリア症、急性/亜急性脳梗塞、原発性出血、およびミクロトロンビが含まれる。検出されたリンパ系炎症および微小グリア結節の有病率は、免疫組織化学的研究を行った論文では高く、そうでない論文では低いことに注意すべきである。
図3 代表的なCOVID-19の病理組織学
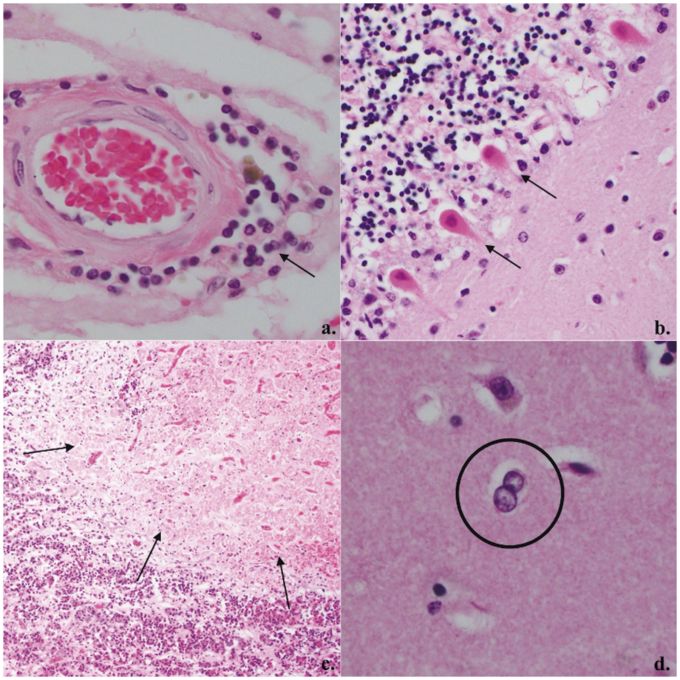
a.軽度の血管周囲リンパ性炎症、400X(矢印);b.急性低酸素-虚血性変化と互換性のあるプルキンエ細胞における好酸球増多、200X(矢印);c.前脳下垂体の亜急性梗塞、100X(矢印);d.基底核におけるアルツハイマー型II型アストロサイト、400X(丸)。
表1 COVID-19脳組織における神経病理学的所見
| RT-PCRによるウイルスの存在 | 53.5%(54/101) |
|---|---|
| IHCによるウイルスの存在 | 27.7%(23/83) |
| ミクログリアの活性化 | 42.9%(79/184) |
| ミクログリア結節* | 33.3%(14/42) |
| リンパ系の炎症 | 37.5%(69/184) |
| 血管周囲 | 33.7%(62/184) |
| 実質 | 23.9%(44/184) |
| 軟髄膜 | 23.4%(43/184) |
| 急性低酸素-虚血性変化 | 29.9%(55/184) |
| アストログリオーシス | 27.7%(51/184) |
| 急性/亜急性脳梗塞 | 21.2%(39/184) |
| 自発的出血 | 15.8%(29/184) |
| マイクロトロンビ | 15.2%(28/184) |
| アルツハイマーII型アストログリオーシス | 2.7%(5/184) |
| ニューロノファジー | 2.2%(4/184) |
| 神経細胞の喪失 | 2.2%(4/184) |
| 梗塞の出血性形質転換 | 2.2%(4/184) |
| 脱髄の病巣 | 1.6%(3/184) |
| 血管好中球プラグ | 1.6%(3/184) |
| 血管周囲の好中球 | 1.1%(2/184) |
| 実質の好中球浸潤 | 1.1%(2/184) |
| 軟髄膜組織球 | 0.5%(1/184) |
| 急性化膿性髄膜炎 | 0.5%(1/184) |
一部の組織学的所見は、レビューされた研究の焦点が多様であるため、過少に報告されている可能性がある
*ミクログリア結節の有病率を集計した研究のみを含む。症例シリーズの中で微小グリア性結節について言及しているが、頻度を列挙していない研究は除外した。
SARS-CoV-2は中枢神経系組織で検出可能である。
SARS-CoV-2による中枢神経系への感染経路として、嗅覚ニューロンを介した逆行性感染、免疫細胞の浸潤、血液脳関門を越えた侵入の少なくとも3つが提案されている。COVID-19患者では無呼吸と老年期障害が多いことから、SARS-CoV-2は嗅神経上皮(鼻腔粘膜に存在する)のニューロンに感染し、そこから嗅球、そして他の脳領域に感染して脳内に侵入するという説が有力視されている。この嗅覚経路は、SARS-CoV 102やMERS-CoVなどの他のコロナウイルスによっても利用されている。103 COVID-19の患者では、嗅覚野にMRIの高強度を示すことが多い。106 技術的な感度の問題に加えて、炎症性条件下では、ACE2受容体や他の受容体の発現レベルが生理的条件下とは異なることが考えられる。Morbiniらは、COVID-19患者の嗅球内にSARS-CoV-2粒子が存在することの超構造的証拠を報告している。107 リンパ球や単球を含む白血球はACE2受容体を発現している。最後に、第三の理論は、脳炎性血液媒介コロナウイルスが血管壁細胞への感染を介して血液脳関門から侵入するという、これまでによく報告されてきた作用を拡張したものである110。
組織学的には,通常のヘマトキシリンおよびエオシン染色スライドでは,ウイルスの介在物も,ウイルスの直接感染として認識できる特異的な細胞変化も報告されていない.しかし、SARS-CoV-2 は RT-PCR、IHC、および電子顕微鏡検査によって脳内で検出されている。脳内では、101 例中 54 例(53.5%)が RT-PCR で SARS-CoV-2 が陽性であり、83 例中 23 例(27.7%)が IHC で陽性であった(表1)。RT-PCRで検出されたウイルスのコピー数が少ない症例もあり、脳細胞ではなく脳内血管内の血液や血球からウイルスが検出される可能性があった。しかし、IHCにより、剖検脳細胞内のウイルス抗原の存在が確認されている。注目すべきは、SARS-CoV-2スパイクタンパクに対する抗体は、ヌクレオカプシドタンパクを標的とした抗体よりもウイルス抗原の検出に効果的であった25,87,93(補足表A)。重要なことに、抗スパイク抗体と抗ヌクレオカプシド抗体の両方を用いた染色は、スパイクタンパク質が検出されない一方でヌクレオカプシドタンパク質が検出された例がいくつかあるため、どちらか一方のみを用いた染色よりも感度が高い可能性がある。この所見が、抗体の質に関連する技術的な問題なのか、関連するエピトープの本質的なアクセス性の問題なのか、あるいはその両方なのかは、未解明である。ウイルスの染色は、散在した皮質神経細胞や内皮細胞に局在しており、93,脳幹の頭蓋神経根や延髄の孤立した細胞(細胞型は不明)にも局在している。この免疫染色パターンは、拡散性の細胞質陽性と核周囲陽性からなり、小さな集中した病巣はウイルス包接体を表している可能性がある。最後に、SARS-CoV-2に適合するウイルス粒子が、嗅球および前頭葉組織の電子顕微鏡検査で確認されている54,86。これまでに、SARS-CoV-2がIHC、RT-PCR、または電子顕微鏡によって検出された中枢神経系に関連する領域には、角膜、結膜、嗅上皮、嗅球、嗅結核、前頭葉、小脳、延髄、頭蓋神経、および三叉神経節が含まれる。ほとんどの研究では、脳の限られた領域を研究しているか、大脳皮質組織の起源を特定していない。中枢神経系における直接感染の頻度と範囲をより明確にするためには、さらなる研究が必要である。症状が数ヶ月間持続する「Long-COVID」の患者もいるため、SARS-CoV-2が脳内でどのように持続するのか、またどのようにして持続するのかについては、今後評価する必要がある。
慢性炎症性・反応性グリアの変化
25 リンパ性炎症は、多くの場合、最小限または軽度である傾向があるが、特に延髄では珍しいものではなく、IHCが検出に使用されている場合には、25。25 IHCを使用していない多くの研究では、リンパ系炎症は存在しないか、まれであると報告されている;これは私たちの経験やアジアや米国の同僚の経験と一致している(個人通信)。これらの反応性変化のかなりの部分は、直接の感染に対する反応ではなく、全身的な問題(例:敗血症)や他の神経病理(梗塞、出血など)による二次的なものかもしれない。25 さらに、COVID-19患者と比較して、敗血症患者(COVID-19ではない)の対照脳では、ミクログリア活性化、血管周囲リンパ球症、および下垂体リンパ球浸潤が、COVID-19患者と同程度に観察されている。
92 いくつかの症例では、ミクログリア結節周囲の実質性リンパ球の集積、下垂体リンパ球性炎症、さらにはニューロンファジーを含む、ウイルス性髄膜脳炎に適合する所見が見られる。Matschkeらの研究では、SARS-CoV-2で免疫陽性の16例中4例が延髄の少なくとも3つの領域で高出力野あたり10~49個のCD8+細胞傷害性Tリンパ球を認めた25。25 3つの研究では、組織球およびリンパ球実質浸潤に関連した髄質のニューロンファジーが報告されている25,90,95。von Weyhernらは、脳幹における神経細胞の消失と軸索変性を伴う血管周囲および実質リンパ球症の6例を報告しているが、これはSARS-CoV-2ウイルス性脳炎の診断に十分であると著者らは判断している。神経学的症状を呈するCOVID-19患者の大多数はRT-PCRによる脳脊髄液中のSARS-CoV-2 RNAの検出は認められないが、111~113人のCOVID-19患者のうち少なくとも4人ではこの傾向に反する例外が報告されている33,114。 -COVID-19の患者1人の脳脊髄液から抗SARS-CoV-2抗体が検出され、ウイルス感染に対する免疫反応を示唆している。93 したがって、組織学的に文書化可能なSARS-CoV-2脳炎および/または髄膜炎の症例は、脳幹を侵す傾向がある。脳幹微小グリア脳炎の症例の大部分を報告しているのはわずか数例であるため、特定のウイルス株、治療法、遺伝的背景、あるいは検出方法が、大多数の研究で明らかに脳幹微小グリア脳炎が存在する、あるいは存在しない原因となっているのかという疑問が生じている。
自己免疫介在性の炎症が起こることもある。自己免疫性脳炎、ADEM、急性壊死性脳症も臨床的に報告されているが、病理組織学的評価は限られている。ADEM様の病理学的評価は1例の剖検例で報告されている。
微小血栓、梗塞、出血、および「好中球性プラグ」
117,118 IL-6は凝固系を活性化し、血管伝染性を増加させる119 。これは、ウイルス性内皮症120との組み合わせで、COVID-19に関連した凝固障害の原因となる可能性がある。SARS-CoV-2は、IHCおよび電子顕微鏡検査により脳内皮細胞内で検出されている86,93。また、IL-1βは、好中球や血小板を含む血管「好中球性プラグ」や、好中球の細胞外トラップ(脱酸素核酸(DNA)を豊富に含むメッシュ状の物質で、微生物を巻き込んで殺す抗菌剤でコーティングされている)を誘発する上で重要な役割を果たしている。これらの「好中球性プラグ」は、剖検に来たCOVID-19患者の脳だけでなく、肺、心臓、腎臓、肝臓でも発見されている(94)。肺炎やARDSによる低酸素血症や動脈硬化症の既往も脳梗塞の一因である可能性が高い。脳梗塞に加えて、COVID-19の剖検では下垂体梗塞(図3c)の症例が時折見られる。COVID-19患者の亜急性期脳梗塞には多数の髄外巨核球が認められた。
アルツハイマー型II型アストロサイトーシス
肝性脳症に特徴的なアルツハイマー型II型アストロサイトーシス(図3d)が報告されている。
報告書では、アルツハイマー型II型アストロサイトの頻度が20人あたり5人以上の閾値に達するかどうかは明記されていない。肝性脳症のためにAgarwalらが提案したカットオフである高出力場123Solomonらの論文では、アルツハイマー型II型アストロサイトを有する症例の4人中4人が慢性肝疾患またはアルコール使用障害を有していた87。現在、敗血症や超感染性脳症とされている症例に対する肝性脳症の相対的な寄与度は、まだ明らかにされていない。
9. 結論
中枢神経系の全身的な機能障害やウイルス感染は、COVID-19に関連した幅広い神経病理学的変化を引き起こす可能性がある。神経病理学的所見の発生率は、どの組織でどのような研究が行われ、どのような補助研究が行われたか(または行われなかったか)に大きなばらつきがあることを考えると、注意して見るべきである。
炎症性変化は、いくつかのシリーズでは高い割合で報告されているが、他のシリーズでは報告されていないが、少なくとも免疫染色の使用によるものである;しかしながら、これらの研究のほとんどでは対照がないため、これらの所見の解釈には限界がある。選択または紹介バイアス、死亡者の併存疾患、治療法、患者の遺伝的背景、免疫状態、免疫状態、そしておそらくSARS-CoV-2のウイルス株もこの違いに寄与している可能性があり、将来的には解明する必要があるであろう。
観察された炎症性変化のうち、どの程度が自己免疫現象によるものなのか、あるいはどの程度が直接的なウイルス感染やその他の原因によるものなのかは、まだ解明されていない。ミクログリア結節の存在と検出可能なウイルスは、いくつかのケースではウイルス性髄膜脳炎を示唆している;おそらく呼吸器および心血管系のコントロールセンターの障害を伴う髄質への偏向は、COVID-19患者の心肺機能がすでに弱っていることが多いために悪化する可能性がある。
嗅覚感染経路の証拠はあるが、嗅球ではウイルスがほとんど検出されないことを考えると、これが中枢神経系感染の主要なメカニズムであるかどうかは不明である。脳内皮感染も存在するため、血行性感染経路が考えられ、おそらく一般的な感染経路であると思われる。
脳内のどこでウイルスが検出されるかについてのデータは、前頭葉と脳幹に焦点を当てた研究が行われているため限られている。現在確認されている感染範囲よりも広い範囲で感染が確認されても不思議ではない。ほとんどのサンプルが剖検から得られたものであることを考えると、ウイルス検出の感度は最適ではないことに留意すべきである。
最後に、炎症とウイルスの局在化が必ずしも一致しないことは注目すべきことであり、ウイルスが中枢神経系の免疫反応から逃れているのではないかという懸念がある。中枢神経系がウイルスの長期的な貯蔵庫となる可能性があるかどうか、また「Long-COVID」の一因となるかどうかはまだ不明である。最後に、血管性痴呆や神経変性疾患のリスクの増加は、後になってから対処する必要があるかもしれない仮説的な懸念である。