Neuropathological Mechanisms Ass有機塩素iated with Pesticides in Alzheimer’s Disease
www.ncbi.nlm.nih.gov/pmc/articles/PMC7355712/
オンラインで公開2020年3月25日
要旨
環境毒性物質は神経変性疾患に関与しており、農薬曝露はアルツハイマー病の環境危険因子として疑われている。いくつかの疫学的解析では、農薬と散発性アルツハイマー病の発生率との関連性が確認されている。
一方、アルツハイマー病の試験管内試験モデルや動物モデルでは、神経病理学的なメカニズムが明らかにされている。本論文では、農薬によるアルツハイマー病の誘発の背景にある神経病理学的メカニズムについて考察する。提案されたメカニズムは、ニューロンにおける一般的な酸化ストレス誘導から、アミロイドベータ(アミロイドβ)と高リン酸化タウ(リン酸化タウ)が関与するよりアルツハイマー病に特異的なプロセスまで多岐にわたる。また、体細胞突然変異、エピジェネティックな調節、成人の神経新生の障害、微生物相の異常など、より推測的または間接的なメカニズムについても議論されている。
環境農薬曝露の慢性毒性メカニズムは複雑に交差し、相互に増強する可能性があり、単純な因果関係の解読を困難にしている。
キーワード
アルツハイマー病、アミロイドβ(アミロイドβ)殺菌剤、グリコーゲン合成酵素キナーゼ-3,農薬、タウ
1. はじめに
アルツハイマー病[1,2]は、世界的に最も普及している加齢性認知症の原因である[3]。晩発型アルツハイマー病は大部分が散発的であり、家族性疾患の原因とされる遺伝子変異を持つ患者は全患者の5%未満である[1,4]。アルツハイマー病患者と動物モデルの脳は、典型的には2つの特徴的な病理学的特徴を示す。脳内神経原線維絡み(IFT)は、微小管結合タンパク質タウの過リン酸化形態に富む[5]一方、細胞外アミロイド斑は、アミロイド前駆体タンパク質(APP)のタンパク質分解処理によって生成されたアミロイドβ(アミロイドβ)ペプチドの不溶性凝集体で構成されている[6]。典型的なアミロイド原性APPの処理は、古典的なβ-セクレターゼ、βサイトAPP切断酵素1(BACE1)[7]、およびγ-セクレターゼ[8]の逐次的な作用によって行われ、これらはアミロイドβペプチド、主にアミロイドβ1-40およびアミロイドβ1-42を生成する。これら、特に後者は神経毒性があり、凝集を起こしやすい。δ-およびη-セクレターゼを含む代替的なβ-セクレターゼは、アミロイドβ生成物の複雑さを追加する[9]。一方で、A Disintegrin and Metalloproteinase 10 (ADAM10) [10]のようなα-セクレターゼによる初期切断は、アミロイドβ1-40およびアミロイドβ1-42を生成しない非アミロイド性処理と呼ばれるものを促進する[11]。
病理学的特徴は、疾患の病因を示唆している。このように、アミロイドカスケード仮説[12,13]は、アミロイドβ1-42(および関連ペプチド)の産生とその後のアミロイドプラークの形成がアルツハイマー病の病因であると仮定し、アミロイド-βオリゴマー仮説は、不溶性アミロイドプラーク内のものと比較して可溶性アミロイドβオリゴマーのより大きな神経毒性を強調している[14]。生体内では、タウとアミロイドβの両方がアルツハイマー病の病理に寄与しており[14,15]、これら2つが関与する病理学的特徴の発達と進行は、非常に絡み合っている[2,16]。家族性および若年性アルツハイマー病 [4,19,20]の原因となるAPPおよびプレセニリン(PS)(γセクレターゼの触媒成分である[17,18])の変異は、常にアミロイドβ産生の増加を引き起こす。アルツハイマー病 遺伝学と分子病理学の広範な進歩にもかかわらず、大多数の患者に認められる晩発型、散発型、または特発型の アルツハイマー病 の決定的な誘因や病因は、ほとんどつかみどころのないままである。他の散発性晩発性神経変性疾患と同様に、散発性アルツハイマー病の発症は遺伝子と環境の相互作用に広く起因する可能性がある[21,22]。アポリポ蛋白E4(APOE4)ε4対立遺伝子は遅発性アルツハイマー病の有力な遺伝的危険因子であるが[23]、環境因子はより多様であり、病理学的プロファイルの観点からはあまり定義されていない。
環境毒性物質は神経変性疾患と広範囲に関連している[24,25]。脳細胞や組織における金属の恒常性調節障害や有害金属の蓄積は、アルツハイマー病を含む様々な神経変性疾患と関連している[26,27]。鉛(Pb)は神経毒性があり、アミロイドβの生成とクリアランスを妨げることが知られており[28]、鉛への暴露はアルツハイマー病 [29]に関与しているが、ケースコントロール研究では、組織への鉛蓄積とアルツハイマー病 [30]との間の明確な関連性は明らかにされていない。銅(Cu)はアミロイドβ凝集動態に影響を与え [31] 、アルツハイマー病患者はCu代謝を変化させている [32]。アルミニウム(Al)への慢性的な暴露はアルツハイマー病リスクを増加させることが示されているが[33]、この考え方はまだ論争の的となっている[34]。有機神経毒はまた、パーキンソン病(PD)[35]における1-メチル-4-フェニル-1,2,3,6-テトラヒドロピリジン(MPTP)と、グアム島でパンデミックしている筋萎縮性側索硬化症/パーキンソン病性認知症複合体[36]におけるβ-N-メチルアミノ-L-アラニン(BMAA)との神経変性との関連も広範囲に認められており、一般的な報道ではおそらく最も顕著なものである。
殺虫剤、除草剤、殺菌剤を含む農薬は、神経細胞の健康に影響を与える有機環境毒性物質の大規模かつ多様なグループである [25,37,38,39,40,41]。過去5年間で、農薬曝露とアルツハイマー病との関連はかなり強化され、一方で農薬関連神経病理の基礎的理解は向上してきた。この簡単なレビューでは、農薬曝露とアルツハイマー病の間のリンクを要約して論じている。病気の病因に関する情報、特に最近得られた細胞モデルおよび動物モデルからの機序的洞察が強調されている。
2. 農薬曝露とアルツハイマー病の疫学的リンク
農薬曝露とアルツハイマー病との間の疫学的な関連はかなり強い[25,37,39,41]が、特に男性の有機リン酸塩の職業的曝露については[39,41]であるが、論争がないわけではない[42]。オレンジ剤への戦時中の曝露は、アルツハイマー病のような神経障害を含む多くの疾患と強く関連している(調整オッズ比(aOR):95%;信頼区間(CI):1.64,1.12-2.41)[43]。生涯の環境曝露に関しては、Maastricht Aging Studyの横断的およびプロスペクティブデータでは、農薬への曝露が軽度認知障害のリスクを増加させることが明らかになった(横断的、自己報告によるaOR、95%CI:4.94,1.53-16.1)が、通常はアルツハイマー病の前兆と考えられている[44]。キャッシュ郡の研究(登録者3084人、アルツハイマー病患者344人)はまた、職業用殺虫剤(その大部分は有機リン酸塩および有機塩素)への暴露からの偶発的アルツハイマー病の有意なリスクを示した(ハザード比(HR)95%CI:1.42,1.06-1.91)[45]。選ばれたアンダルシアの保健地区におけるアルツハイマー病の平均有病率を用いた生態学的研究では、農薬使用の多い地域に住む集団(17,429例、アルツハイマー病患者2185人)はアルツハイマー病リスクが増加していることが示された(OR、95%CI:2.1,1.96-2.25)[46]。米国のアルツハイマー病患者と対照参加者を対象とした症例対照研究では、1,1-クロロ-4-[2,2,2,2-トリクロロ-1-(4-クロロフェニル)エチル]ベンゼン(DDT)の代謝物である1,1-ジクロロ-2,2-ビス(4-クロロフェニル)エテン(DDE)の血清中および脳内濃度がアルツハイマー病患者(対照79例およびアルツハイマー病症例86例)で上昇し、アルツハイマー病リスクの増加と関連していた(DDEレベルの最上位3位までの場合、OR、95%CI:4.18,2.54-5.82)。 18, 2.54–5.82) [47]. 一方、Canadian Study of Health and Aging [48]のデータは、代わりに、血漿中農薬(ポリ塩化ビフェニル(PCB)および有機塩素(OC))代謝物レベルの上昇を伴うアルツハイマー病の有病率の減少(2023人の参加者、アルツハイマー病患者399人)を示した[49]。コホート(513人、アルツハイマー病患者108人)のより最近の分析では、事後分析でDDEレベルが時間の経過とともに高い認知機能低下と関連していることが示されたが、PCBおよび有機塩素農薬と認知症およびアルツハイマー病のリスクとの関連性はないことが肯定された[50]。
報告された疫学的関連性のシステマティックレビューやメタアナリシスが発表されている [38,51,52]。2016年の過去の報告のメタアナリシス(3件のコホート研究と4件の症例対照研究を含む)では、農薬曝露はアルツハイマー病と正の関連があると結論づけられている(OR、95%CI:1.34,1.08-1.67)[51]。神経変性疾患に関する複数の薬剤への職業暴露に関する19件の研究(アルツハイマー病に関する13件)の2019年の別の、より最近のメタアナリシスでも、農薬への職業暴露はアルツハイマー病のリスクを増加させると結論づけている(加重相対リスク(RR)95%CI:1.50,0.98-2.29)[52]。上記のメタアナリシスに含まれていない最近のコホートデータは、ギリシャのHellenic Longitudinal Investigation of Aging and Diet study [53]から得られたもので、自己申告による農薬曝露と認知機能との関連を示唆している[54]。興味深いことに、同じコホートでは農薬とパーキンソン病の間の関連は明らかにされなかった [55]。したがって、全体として、疫学的解析からの結果は、農薬曝露が散発性アルツハイマー病の重要な環境リスクであることを概ね支持するものである。
3. 細胞培養および動物モデルにおける農薬とアルツハイマー病マーカーの誘導
高濃度で提示された農薬は急性細胞毒性と神経毒性を引き起こすだろう [39,40]。しかし、遅発性散発性アルツハイマー病の場合、疾患に関連するのは、おそらく慢性的な低用量の環境/職業的曝露であろう。原理的には、農薬は2つの主要な病因因子であるアミロイドβとタウの調節を介してアルツハイマー病の発症を促進したり、アルツハイマー病の進行を促進したりする可能性がある。例えば、ミトコンドリア電子輸送鎖(ETC)を阻害する殺虫剤ロテノンは、培養ラット神経細胞においてタウの過リン酸化とアミロイドβ凝集を誘発する[56]とラットのタウパシーを誘発する[57]。ピレスロイド系殺虫剤であるデルタメトリンやカルバメート系殺虫剤であるカーボフランをラットに投与した場合も同様に、グリコーゲン合成酵素キナーゼ-3β(GSK-3β)の活性化とプロテインホスファターゼ-2A(PP2A)の阻害を伴うタウの高リン酸化を誘発した[58]。別のピレスロイド系殺虫剤であるシペルメトリンもまた、ラットではGSK-3β依存的にアミロイドβとリン酸(p)-tauの増加を刺激した[59]。同様に、アセチルコリンエステラーゼを阻害する有機リン酸系殺虫剤クロルピリホス[60]も、GSK-3βの活性化を介してSN56基底前脳コリン作動性ニューロン[61]とマウス[62]のアミロイドβとタウ、およびリン酸化タウをアップレギュレートしている[61]。DDTはまた、APPとBACE1の上昇を介してAPPSweトランスジーンを導入したH4グリオーマ細胞のアミロイドβレベルを上昇させる一方、アミロイドβクリアーATP結合カセットトランスポーターA1(ABCA1)のレベルを低下させ、アミロイドβ分解インスリン分解酵素(IDE)の活性を阻害する[63]。また、トリアジン系除草剤[64]やピラゾール系殺虫剤により、様々な細胞株でアミロイドβ産生が上昇することも示されている[65]。
アミロイドβおよびリン酸化タウに関して、農薬誘発神経毒性およびアルツハイマー病様病理を実証した多くの報告があるが、これらのモデルには限界があり、所見の解釈には注意が必要である。比較的高用量で実験観察が行われたいくつかのケースでは、環境に関連した残留濃度に関連した慢性的な影響ではなく、急性毒性反応が優勢であった可能性がある。この点で、アルツハイマー病トランスジェニックマウスモデルにおける殺菌剤の残留量を用いた最近の報告は注目に値する。Lafonら[66]は、J20マウス(変異型hAPPSw/Indを保有)を、3つの殺菌剤、シプロジニル、メパニピリム、およびピリメタニルのカクテルに,0.1μg/Lの残留量で9ヶ月間、飲料水に曝露した。その結果、アミロイドβ凝集が亢進し、グリア症、神経細胞の喪失が認められた。ヵ月後には、殺菌剤はまた、脳アミロイド血管症を思わせる方法で血管アミロイド凝集体を増加させた [67,68]。殺菌剤はアミロイド凝集、グリア症、神経細胞の衰退を悪化させた。興味深いことに、殺菌剤はアミロイド斑に結合し、試験管内試験ではアミロイドβ1-42によるフィブリル形成を促進するようである。さらに、残留殺菌剤は、それぞれの転写物に有意な変化はなかったが、アミロイドβ分解酵素ネプリリシンの転写物を減少させる一方で、BACE1タンパク質レベルを上昇させた[69]。TgF344-アルツハイマー病トランスジェニックラット(APPSweおよびPS1∆E9を保有)へのクロルピリホス投与の効果を調査した別の報告 [70] では、エジプトの農業労働者のコホートから確立されたヒト由来の職業暴露パラダイムに基づいて投与が行われた [71,72,73]。著者らは、雌ではなく雄のラットでのみ顕著な認知障害と行動障害の増強を観察したが、これはクロルピリホスが雄の神経変性を加速させることと一致する。著者らは、アミロイドとタウの病理学的変化に有意な変化は見られなかった。その代わり、観察された持続的な病理学的変化は、ミクログリアの数と活性化の増加である[70]。
全体として、そして使用される方法、モデルおよび殺虫剤の多様性にもかかわらず、試験管内試験および動物ベースの研究の両方が、アルツハイマー病の病理を開始または強化する可能性がある細胞および分子メカニズムの範囲を示唆している。これらのメカニズムについては、でさらに議論する。
4. 農薬の潜在的な神経病理学的メカニズム
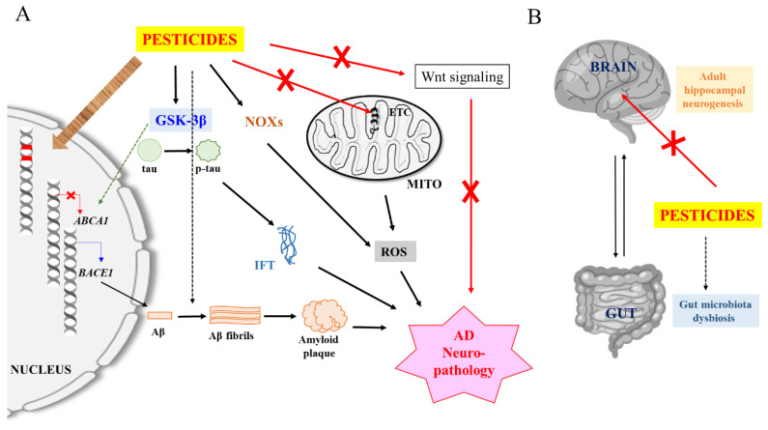
農薬曝露の基礎となる神経毒性および神経病理学的メカニズムには、酸化ストレス[74]および神経炎症[75]というより一般的な有害プロセスが含まれている可能性がある。一方で、特定のアミロイドβおよびタウ関連の経路やイベントも誘発されたり、関与したりする可能性がある。これらのプロセスは、加齢脳におけるアミロイドβ産生およびタウリン酸化プロセスと大きく絡み合っている(図1A参照)。
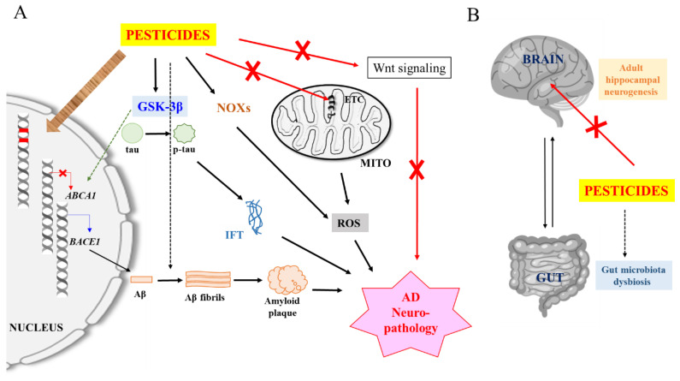
図1 農薬誘発性アルツハイマー病神経病理学の模式図および一般化された図
A)ミトコンドリア電子輸送鎖(ETC)成分の農薬阻害およびNADPHオキシダーゼ(NOX)の活性化は、ミトコンドリアおよび神経細胞を損傷する活性酸素種(ROS)を産生する。損傷したミトコンドリアと活性酸素は、神経炎症を引き起こす可能性がある(簡単のためにここでは示していない)。グリコーゲン合成酵素キナーゼ-3β(GSK-3β)の農薬活性化は、βサイトAPP切断酵素1(BACE1)の発現およびアミロイドβ産生を促進する一方で、アミロイドβクリアランスを減少させ、タウをリン酸化して細胞内フィブリルタングル(IFT)形成を促進する)。一部の農薬もまた、アミロイドβフィブリル形成を促進する可能性がある。農薬は、アルツハイマー病において障害されているWntシグナル伝達を阻害する可能性があり、その再活性化がアルツハイマー病疾患の表現型を改善する。また、農薬および/または活性酸素は、エピジェネティックなメカニズムを介してDNA変異を引き起こし、アルツハイマー病関連遺伝子の発現に影響を与える可能性がある。
B)農薬は海馬成体の神経新生を阻害し、腸内細菌叢の異常を介してアルツハイマー病病態に影響を与える可能性がある。詳細は本文を参照のこと。
4.1. 酸化ストレスと神経炎症の誘導
ロテノンなどの農薬は分裂毒性があり、ミトコンドリアのETCを阻害する [76]。DDTおよびDDEも同様にETCおよび酸化的リン酸化(OXPHOS)を阻害する[77]。この阻害には2つの重要な結果がある。第一は、OXPHOSの生成物であるATPの減少である。これは、細胞や組織のエネルギー代謝をかなり損なう可能性がある。エネルギー代謝の変化は、農薬に曝露された農家で文書化されている[78]。脳神経細胞はエネルギー需要の点で特に顕著であり[79]、酸化的リン酸化によるATP産生の障害は、グルコース利用のための酸化的リン酸化から解糖への代謝シフト、好気性解糖[80,81]として知られる代謝リプログラミング現象につながる可能性があり、これはアルツハイマー病脳やミトコンドリア障害を伴う他の神経変性疾患で顕著である。この明らかな生存メカニズムは、APP/PS1 ADマウスモデルで認知パフォーマンスを悪化させた乳酸生産、[82]の結果アミロイドβは、ニューロンとミクログリアのような代謝スイッチをトリガする可能性があり、後者のために、それは最終的にミクログリアの機能不全につながる[83]。興味深いことに、職業性有機リン酸塩への暴露はミクログリアの機能障害を引き起こす[70]。アミロイドβの産生と蓄積が亢進した加齢脳では、慢性的な低用量農薬曝露は、このようにして神経細胞とグリアの両方の機能障害を相乗的に促進する可能性がある。
第二に、機能不全のETCによる活性酸素種(ROS)特にスーパーオキサイドの増加であり、これにより酸化ストレスが生じる。酸化ストレスは、パラコート、有機塩素、有機リン酸塩などの多数の殺虫剤を含む多くの環境毒性物質によって発揮される重要な病理学的メカニズムである[74,84]。これは、いくつかの農薬(例えば、パラコート、DDE、クロルピリホス)がニコチンアミド・アデニン・ジヌクレオチド・ホスフェート(NADPH)オキシダーゼ[85,86,87]を誘発し、活性酸素の急性放出が神経細胞の死と変性を引き起こす可能性がある場合には特にそうである[88]。損傷して活性酸素を発生するミトコンドリアは、特にミクログリアにおいて、NACHT、LRR、PYDドメイン含有タンパク質3(NLRP3)のインフラマソームによって開始される炎症反応を引き起こす [89,90,91,92]。その結果、プロ炎症性サイトカインIL-1βが産生され、神経細胞の健康と機能が損なわれる。アルツハイマー病は、農薬を含むであろう多くの要因[93]からの寄与の結果である慢性的な全身性炎症の疾患として知られている。
4.2. アミロイドβおよびタウの発現、修飾およびクリアランスの増強
様々な殺虫剤は、Camらによって環境中の「アルツハイマー病」[65]、すなわちアミロイドβ[59,61,62,63,64,65,66]のレベルを上昇させることによって作用する可能性がある。著者らは、より長いアミロイドβペプチド(アミロイドβ42/アミロイドβ43)の産生を増強するために、細胞ベースのアッセイを用いて大規模な化合物ライブラリーをスクリーニングし、9つのピラゾール系殺虫剤を同定した。これらの殺虫剤は、健常者および家族性アルツハイマー病(家族性アルツハイマー病)患者由来の誘導多能性幹細胞(iPSCs)から分化した様々な細胞株および神経細胞において、β-およびγ-セクレターゼ依存性の方法で細胞外アミロイドβ42の増加を誘導することが明らかになった。農薬によるアミロイドβの誘導は通常、BACE1およびγ-セクレターゼの発現または活性の増加の結果として起こり[59,63,65,66]、多くの場合、IDEやネプリリシンなどのアミロイドβ分解酵素のレベルの抑制によるアミロイドβクリアランスの減少と組み合わせて起こる[62,63,66]。これらの殺虫剤は、しばしばタウとリン酸化タウのレベルの上昇を誘発する [57,58,59,61,94]。
農薬によるアミロイドβとリン酸化タウの上昇の根本的なメカニズムは何か?これらの病理学的プロセスの重要な中枢的調節因子はGSK-3βであると考えられており、このGSK-3βは2つのGSKアイソフォーム(GSK-3αとGSK-3β)のうちの1つであり、広く発現し、老化した脳でアップレギュレーションされており[95]、アルツハイマー病の重要な病理学的因子である[96,97]。GSK-3βはTyr216の自己リン酸化を受けて構成的に活性化されているが、AKTキナーゼを介してSer9のリン酸化によって阻害され、プロテインホスファターゼ2A(PP2A)によるSer9の脱リン酸化によって再活性化される可能性がある[98]。GSK-3βは核内因子κB(NFκB)依存的な方法で BACE1 発現を制御している。ヒトスウェーデン変異体APPを発現する20E2株において、阻害剤AR-A 014418によるGSK阻害はアミロイドβ産生を減少させ、これはNFκBの活性化を介したBACE1遺伝子プロモーターのGSK-3β(GSK-3αではない)の調節によるものである[99] GSK-3βはまた、その基質の一つであるPS1の局在化を調節する[100]。重要なことに、GSK-3βは主要なタウキナーゼでもある[98,101,102]。ロテノンはGSK-3βのTyr216でのリン酸化を促進し、Ser9でのリン酸化を阻害することで活性化している[103]。異なるクラスの農薬がどのようにしてGSK-3βを活性化するのか、そのメカニズムについては十分に調査されていないが、GSK-3β活性の増加は、ほとんどの農薬が及ぼすアミロイドβとリン酸化タウの病理学的な作用の根底にある可能性が高いことは明らかである。もう一つの興味深い点は、アミロイドβとリン酸化タウの病理は相互に関連しており、そのような関連性の一つは、アミロイドβ42がGSK-3αとの相互作用を介してタウの高リン酸化を刺激するという形で発生しているということである[105]。
上記に関連したさらなる潜在的な関連は、農薬によるWnt/β-カテニンシグナル伝達経路の潜在的な抑制である[106,107,108]。パラコートへの暴露はマウスの神経前駆細胞におけるWnt経路遺伝子のレベルを変化させ[106]、ロテノンはショウジョウバエのPDモデルにおけるWntシグナル伝達を障害し[107]、デルタメトリンはゼブラフィッシュの遊泳膀胱の発生におけるWntシグナル伝達経路遺伝子をも減少させた[108]。Wntシグナル伝達はアルツハイマー病で障害されることが知られており[109,110,111]、Wnt/β-カテニンシグナル伝達経路の活性化はBACE-1発現を抑制する[112]。Wntシグナル伝達の活性化は、APP/PS1 アルツハイマー病トランスジェニックマウスの記憶喪失を救済し、シナプス機能障害を改善することが示されている[113,114]。よく知られている定型的なWntシグナル伝達経路では、その受容体FrizzledへのWntの結合およびβ-カテニンの安定化につながる下流のプロセスは、GSK-3βの阻害を伴う[115]。殺虫剤の中には、殺虫剤ニクロサミドのようにWnt受容体Frizzledに作用してWntシグナル伝達を阻害するものもあると考えられるが、これはまだ明らかになっていない。
4.3. アミロイド生成の促進
アミロイドβ産生以外にも、殺虫剤は、アミロイドプラーク形成だけでなく、アミロイドβのオリゴマー化やフィブリル形成などのアミロイド産生の側面を促進する可能性がある。この点に関する証拠は乏しいが、この可能性はLafonら[66]によって最近実証されており、この中ではシプロジニル、メパニピリム、およびピリメタニルの殺菌剤カクテルがアミロイドプラークと結びつき、上記の第3節で詳細に述べたように、アミロイドβフィブリル形成を試験管内試験で促進するようである。ラット海馬、黒質突起および脊髄座のニューロン培養物をロテノン(0.5nM以下)に曝露すると、α-シヌクレインおよびアミロイドβのタンパク質凝集体が形成されることがわかった[56]。アミロイドβペプチドはα-シヌクレインの凝集を誘発することが知られており[117]、α-シヌクレインの播種機構[118]を介して異型アミロイド共会合体が形成される可能性がある。このような共会合が実際に培養ニューロンや動物の脳内で農薬によって引き起こされるかどうかは、まだ実証されていない。
5. 農薬の投機的神経病理学的メカニズム
上記のセクションでは、様々な実験モデルで明確に示され、実証的な裏付けがある農薬の神経毒性と神経病理学的メカニズムを概説してきた。本節では、より推測的で間接的な農薬関連のアルツハイマー病の病因機序に焦点を当てる(図1A,B参照)。
5.1. DNA損傷と体細胞変異
有機塩素 などの農薬は遺伝毒性があり、酸化的損傷 [121] または DNA との直接相互作用 [122] を介して DNA 損傷 [119,120] を誘発することが知られている。農薬の遺伝毒性は通常、その発がん性の可能性 [123,124] との関連で考慮され、特に神経幹細胞(NSC)や神経前駆細胞(NPC)などの分裂細胞に突然変異的な損傷を与える急性曝露の場合に考慮される。しかしながら、慢性的な低線量被曝はまた、末期に分化した非分裂ニューロンにおいて累積的に発生する非致死的な突然変異をもたらす可能性がある。これらの突然変異は、ニューロンの健康と機能を大きく損なわせる可能性があり、ほとんど定義されていない。興味深いことに、低対立遺伝子頻度の脳ニューロンにおける体細胞変異や変異は、老化や神経変性疾患と関連している [125,126,127]。この体細胞モザイクは、特に、アルツハイマー病脳で実証されている。APPバリアントは、何千ものイントロンレスバリアント「ゲノムcDNA」としてヒトニューロンにモザイク状に発生することが示されている[128]。アルツハイマー病の病因に重要なペプチジルプロリルシス-トランス異性化酵素NIMA-interacting 1(PIN1)[129]の機能喪失変異や、タウの高リン酸化に寄与するシグナル伝達経路遺伝子もまた、アルツハイマー病脳で同定されている[130]。したがって、農薬の慢性的な遺伝毒性によって生じる低頻度の突然変異や変異が散発性アルツハイマー病の病因に寄与している可能性が考えられる。
5.2. エピジェネティックなメカニズム
DNA 配列への変化だけでなく、農薬はエピジェネティックに遺伝子発現に影響を与える可能性がある [131,132]。農薬曝露がDNAメチル化の変化と関連しているという証拠がある[133,134,135]。この点で特に関連性があるのは、パラオキソナーゼ-1(PON1)をコードする遺伝子など、アルツハイマー病の病因に影響を与えるタンパク質をコードする遺伝子であろう [136,137]。農薬はまた、micro(mi)RNAの発現に影響を与えることが知られている[138,139,140]。特に、パラオキソナーゼはWntシグナル伝達の構成要素に影響を与えるmiRNAを調節することが知られている[138]が、アルツハイマー病 [110,113]に直接関連すると考えられる。
5.3. 成人の神経新生への影響
農薬への曝露は発達障害と広範囲に関連しており[141]、出生前および出生後の神経幹細胞および神経前駆細胞に影響を与えることが知られている[142,143]。早期の農薬への曝露はニューロンとグリアの両方に影響を与え、学習と記憶を損なうが [144]、農薬はまた、特に海馬の神経発生部位において、成人の神経新生のおそらくより多くのアルツハイマー病に関連するプロセスに影響を与える可能性がある [145]。海馬の側脳室の脳室下帯(SVZ)および歯状回(DG)の顆粒下帯における成体神経新生は、げっ歯類動物モデルで広範囲に実証されており、機能的には記憶の符号化および行動の修正と関連している[145,146]。これに関して、マウスのペルメトリン農薬への新生児曝露は、生涯にわたる恐怖と空間学習障害を引き起こし、シナプスの海馬形態を変化させることが示されている[147]。成体マウスのピレスロイドへの反復曝露もまた、海馬小胞体(ER)ストレスと学習障害を引き起こす[148]。
ここで特に関連性があるのは、成体の神経新生がアルツハイマー病 [149,150]と関連していることであり、障害された成体の神経新生はアルツハイマー病の初期イベントである可能性がある [151]。考えられるのは、アルツハイマー病の病因に対する神経細胞の脆弱性は前駆細胞の早期の欠損によって悪化する可能性があり、一方、成人の神経新生は疾患状態に対する神経細胞の欠損に対する代償的反応である可能性があるということである。ヒト歯状回サンプルの最近の比較分析では、海馬の神経新生は正常成人では顕著であるが、これはアルツハイマー病患者の脳では大幅に減少していることが示された[152]。成人の神経新生の障害は、特にAPPswe/PS1ΔE9 アルツハイマー病トランスジェニックマウスにおけるアルツハイマー病神経病理を悪化させる[150]。この関連では、パラコートは、具体的に3週間の化合物の腹腔内投与は、神経前駆細胞の増殖を阻害し、海馬で新たに生成された細胞の発達運命を変更し、海馬依存性の学習と記憶[153]を損なうように、成人マウスの海馬の神経新生を阻害することが示されている。除草剤グルホシン酸アンモニウム(GLA)の妊娠中の母親への周産期暴露は、新生児マウスのSVG神経新生を阻害し、培養マウス初代神経幹細胞の神経グリア分化を変化させた [154,155]。農薬、成人の神経新生とアルツハイマー病との間の上記の関係を考えると、農薬による成人の神経新生の破壊または阻害がアルツハイマー病の病理を開始するか、そうでなければ促進する可能性があると合理的に推論することができた。
5.4. 脳-腸軸の機能障害
脳の健康は腸の健康、より具体的には腸内マイクロバイオームの健康に影響される [156]。トリプトファン代謝と微生物産物を含む腸管神経系、迷走神経、免疫系を介した腸内細菌叢と脳との間の双方向のコミュニケーションは、しばしばマイクロバイオータ-腸-脳軸と呼ばれるものを構成している[157]。腸内細菌叢は神経炎症を調節し、したがって、アルツハイマー病に役割を持っているであろう [158,159]。腸内細菌叢の異常はアルツハイマー病で起こることが知られており[160]、その誘導はADモデルで病気の進行を悪化させる可能性がある[161]。
この概念の証拠は、例えば、アルツハイマー病のアミロイドと神経原線維性タングル(日常生活動作PAPT)トランスジェニックマウスモデルを用いた最近の報告によって提供されている[162]、それによって野生型マウスから日常生活動作PAPTマウスへの糞便性微生物叢の移植はプラークとNFT形成を改善し、グリア活性化を減少させ、認知機能障害を緩和した[163]。
殺菌剤プロパモカルブ[164]、グリホサート系除草剤[165]、カルバメート系殺虫剤アルジカルブ[166]、クロルピリホス[167,168]などの広範囲の殺虫剤は、すべて腸内細菌叢を変化させ、さまざまな程度の腸内環境異常を引き起こすことが知られており、現在、多くの報告で示されている。プロパモカルブをマウスに3-300mg/Lの濃度で28日間飲用水から暴露すると、糞便および糞便内容物中の微生物相が細菌叢または属レベルで変化した[164]。
マウスのグリリン酸塩への亜慢性暴露は、不安や抑うつ様行動を増加させ、腸内微生物叢の組成を変化させ、特にコリネバクテリウム(Corynebacterium)ファーミキュテス(Firmicutes)バクテロイデテス(Bacteroidetes)ラクトバチルス(Lactobacillus)を減少させた[165]。ラットの産後後期の離乳前段階での低用量クロルピリホス曝露の解析では、神経伝達パラメータの変化と腸内細菌叢異常の誘導が、属・種の両方のレベルで示されている[167]。
これらの関連性を考えると、農薬誘発性腸内細菌叢異常症が少なくともアルツハイマー病の発症に間接的な役割を果たしている可能性が考えられる。
6. エピローグ
上記の段落では、農薬曝露と アルツハイマー病 の関連性に関する最近の研究が取り上げられ、議論された。疫学的研究では、環境および職業上の農薬曝露とアルツハイマー病との関連性がますます肯定されている。実験室での実験はまた、より良くアルツハイマー病を誘発または-促進する可能性がある農薬によって誘発される潜在的な神経毒性と神経病理学的メカニズムを定義している。より古典的で一般的なメカニズムとしては、慢性的な酸化ストレス、神経炎症、アミロイドβ/リン酸化タウ神経病理学などが挙げられ、これらは老化したニューロンに悪影響を与える。これらのメカニズム以外にも、体細胞突然変異、エピジェネティックな調節、成人の神経新生障害、腸内細菌叢の異常など、より推測的または間接的なメカニズムが存在する。これらのメカニズムは、古典的に認識されているメカニズムと広範囲にクロストークしていることは明らかであり、アルツハイマー病の神経病理学は、しばしば相互に強化し、相乗効果をもたらす要因、経路、結果が絡み合った網目状のものである。推測的/間接的なメカニズムは、散発性アルツハイマー病は病因学的に複雑であるという共通の考え方をさらに証明している。しかし、農薬のような環境リスク因子のグループの観点から、アルツハイマー病と治療的に関連性があり有用であるかもしれないものは、神経病理学的メカニズムの絡み合った網の主要なコンポーネントとして、効果的に強調され、したがって潜在的に利用される可能性がある。