Neuromechanisms of SARS-CoV-2: A Review
www.ncbi.nlm.nih.gov/pmc/articles/PMC7308495/
要旨
最近の研究では、重症急性呼吸器コロナウイルス2(SARS-CoV-2)の神経侵襲性が示唆されている。特筆すべきことに、神経侵襲性は、コロナウイルス疾患2019(COVID-19)の病態生理に関与している可能性がある。
いくつかの研究では、シナプス連結経路が、コロナウイルスが中枢神経系(中枢神経系)にアクセスすることを可能にする可能性があることが示されている。しかし、中枢神経系におけるSARS-CoV-2の存在、中枢神経系への直接的な影響、および苦しんでいる症状への寄与に関連したエビデンスは、依然としてまばらである。
ここでは、SARS-CoV-2が神経系に侵入することを示唆する文献をレビューする。また、ウイルスの影響を受ける可能性のある神経回路と、COVID-19の進行におけるそれらの可能性のある役割についても記述する。
さらに、COVID-19の神経学的症状を理解し、診断し、治療するためのいくつかの戦略を提案する。
序論
重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)と呼ばれる高病原性コロナウイルスが、2019年12月に中国の武漢で出現した。それ以来、急速に世界的に広がっている。
SARS-CoV-2はコロナウイルス疾患2019(COVID-19)を引き起こし、急速で激しい呼吸器症状や肺不全を引き起こす可能性がある。
ゲノム解析の結果、本ウイルスは重症急性呼吸器症候群コロナウイルス(SARS-CoV)や中東呼吸器症候群コロナウイルス(MERS-CoV)と同じクラッドであるβ型コロナウイルスに属し、SARS-CoVと高度に相同性の高い配列を共有していることが明らかになった(Yu et al. その感染力の高さから、COVID-19の患者数は世界的に増加し続けている。
疫学研究は、COVID-19を有する患者が、頭痛、虚血性脳卒中、意識障害、および脳炎/髄膜炎などの広範な神経学的合併症を含む多くの症状を呈することを示している(Gautier and Ravussin, 2020; Giacomelli et al 2020; Mao et al 2020; Poyiadji et al 2020; Wang D. et al 2020)(表1)。
さらに、多くの個体におけるアノスミア(嗅覚脱失)、低オスミア、加齢臭、および味覚障害などの嗅覚および味覚障害の存在は、頭蓋神経の関与を示唆している(Gautier and Ravussin, 2020; Giacomelli et al. SARS-CoV-2による神経系(NS)構造物、特に脳幹の関与の可能性も示唆されている(Li Y. C. et al.
古い論文(Andries and Pensaert, 1980; Matsuda et al. 2004; Li et al. 2012, 2013)に基づくこの仮説によると、コロナウイルスは最初に末梢神経末端に侵入し、その後シナプス接続ルートを介して中枢神経系(中枢神経系)に向かって進行する。
異なるウイルス(例えば、単純ヘルペスおよび帯状疱疹)が末梢神経細胞を介して感覚神経節または中枢神経系(中枢神経系)に移動し、そこで(通常、休眠再活性化後に)広範な損傷を引き起こすことを考えると、これは驚くべきことではないだろう(Oaklander, 2001; WatsonおよびOaklander, 2002; Dworkin et al 2008; DasilvaおよびDossantos, 2012)。
興味深いことに、電子顕微鏡を用いた研究では、同じく一本鎖RNAβコロナウイルスである血球凝集性脳脊髄炎ウイルス。
その結果、コロナウイルスのトランスシナプス交換には、膜状コーティングを介したエンド/エキソサイトーシスが利用されている可能性があることが明らかになった。同じ研究から、トランスシナプス経路が、ウイルスを含むより大きな粒状物質に適応され得ることが示された。
表1 今回のレビューに含まれた研究を考慮して、COVID-19で神経症状を呈した患者の割合
主な神経症状 割合
- 急性脳血管疾患 2.8%
- 急性出血性壊死性脳症 症例報告
- 失調0.5%
- アゲウシア 1.7%
- アゲウシアとアノスミア(嗅覚脱失) 8.5%
- アゲウス症と低オスミア 3.4%
- めまい9.4%;16.8%。
- ディスガイア 8.5%
- Dysgeusia and anosmia 3.4%
- 羞恥心・低汗症 3.4%
- 頭痛3.4%、6.5%、13.1%
- ハイポスミア5.1%
- 意識障害 7.5%
- 虚血性脳卒中 2.8%
- 髄膜炎・脳炎 症例報告
- 神経痛 2.
- 発作 0.5%
- 嗅覚障害 5.1%
- 味覚障害 5.6%
- 視力障害 1.4%
- 嘔吐 3.6%
印象的なことに、コロナウイルスは、動物およびヒトの両方で腸疾患を引き起こすことも報告されている。したがって、COVID-19の病態生理における腸管神経系(ENS)の関与も考慮しなければならない。
本批判的レビューは、現在の文献を包括的に評価し、COVID-19のENSへの影響に関する利用可能な証拠を検討することを目的とする。
このプロセスに関与する可能性のある神経回路と考えられる病態生理学的メカニズムを分析する。最後に、これらの現象を研究するための異なるアプローチが提案される。
SARS-CoV-2の神経侵襲とCOVID-19に伴う主な神経症状の解釈
COVID-19関連肺炎と診断された138人の入院患者にみられた主な徴候および症状を探索した研究では、すべての患者が持続的な嗅覚および味覚の障害を報告した。
驚くべきことに、味覚の変化は入院前の方が頻度が高かった(91%)のに対し、入院後は味覚と嗅覚の変化は同程度の頻度であった。
これらの症状の種類や時間経過に関連する疫学的な不均一性は、COVID-19が性別や年齢などの因子によって個人に異なる影響を与える可能性を示唆している。
さらに、発症が早いことから、これらの味覚および嗅覚の変化は、COVID-19を有する人を特定し、ウイルスの拡散を制限するための有用かつ直接的なスクリーニングの機会を提供する。
COVID-19と診断された入院患者214人のコホートにおいて神経学的症状も分析され、無神経症の発生率は5.1%、老年症の発生率は5.6%であった。
アノスミア(嗅覚脱失)は、以前にもSARS-CoVや他のコロナウイルスと関連していた。さらに、SARS-CoV-2はSARS-CoVと同様に嗅神経から侵入し、脳に到達することが提案されている。
COVID-19の経過における味覚および嗅覚の変化の根底にあるメカニズムは、アンジオテンシン変換酵素2(ACE2)受容体が果たす役割に関係していると考えられる。 この受容体は、SARS-CoV-2がヒト細胞に結合して侵入するために使用されることが実証されている。
口腔粘膜および鼻粘膜の上皮細胞におけるACE2受容体の広範な発現は、これらの部位においてSARS-CoV-2によって引き起こされるウイルス関連の損傷が、ACE2受容体の機能に対するウイルスの作用と関連していることを示唆している。
しかしながら、ヒトおよびげっ歯類における嗅覚経路を介したACE2の特異的発現はまだ議論されておらず、いくつかの研究で探索されている。 さらに、このプロセスにおけるFurinおよび膜貫通プロテアーゼセリン2、ACE2は、SARS-CoV-2の細胞内への侵入に責任がある。このプロセスは、ウイルススパイクである糖タンパク質のこの細胞受容体への結合に依存する。
このプロセスはまた、Furinによるウイルススパイクタンパク質の切断、および細胞膜に局在し、ウイルスの取り込みを促進する膜貫通プロテアーゼセリン2(TMPRSS2)のような宿主細胞のセリンプロテアーゼによるスパイクタンパク質のプライミングの発生をも含む。
嗅覚経路の異なる細胞成分におけるACE2、TMPRSS2、およびFurinの分布に関する証拠は不足しているが、嗅覚と中枢神経系との密接な関係は、COVID-19患者における神経学的症状の発生とともに、中枢神経系の関与を暗示している。
SARS-CoV-2の中枢神経系への経路における嗅覚経路の関与の可能性は、異なるメカニズムを提案してきた複数の著者によって探求されてきた。したがって、COVID-19の頭蓋神経機能に関連する古典的な感覚経路の役割を理解することは極めて重要である。
それにもかかわらず、SARS-CoV-2がENSに関連するものを含めて中枢神経系に到達するために取り得る代替経路を決定することもまた重要である。SARS-CoV-2 RNAおよびそのウイルス粒子は、COVID-19患者の糞便中で発見されており、症状の終了後も持続的なウイルスRNAの脱落が認められる。これらの知見は、糞便-口腔感染経路の存在を示唆している。
SARS-CoVおよびMERS-CoVウイルスは、下水中に数日間生存したままであり、糞便-口腔伝搬によって拡散する可能性がある。SARS-CoV-2もこの経路で感染することが示唆されている。 さらに、ACE2受容体への結合もまた、COVID-19の病態生理を分析する際に考慮されなければならない感染性の重要な決定因子である可能性がある。
小腸および結腸上皮細胞、特に腸球は、ACE2受容体を強く発現し、肺よりもさらに高い発現レベルを示す。さらに、同じ研究では、大腸神経節もこの受容体を発現していることが示された。
さらに、COVID-19を有する患者の糞便中にウイルスmRNAが検出されており、SARS-CoV-2が呼吸器感染だけでなく、腸内感染を引き起こす可能性があることを示唆している。したがって、COVID-19に対するENSの寄与を探ることも同様に重要である。
ENSおよびいわゆる腸-脳軸の関与の可能性は、以下でさらに議論される。
SARS-CoV-2の神経侵入に関連する可能性のあるメカニズム
COVID-19の呼吸器効果が、SARS-CoV-2の神経侵襲性と少なくとも部分的に関連している可能性を示唆する証拠もある。上述したように、COVID-19の患者において神経学的症状が報告されている。
より重要なことに、コロナウイルスは、呼吸器系に限定されるのではなく、中枢神経系にも侵入し、これは、重大な脳損傷、様々なタイプの神経疾患、およびその結果として呼吸機能にも影響を与え得る髄質心肺中心の損傷と関連し得るという強い証拠がある。いくつかの過去の研究はまた、感染した個体からのサンプル中の脳神経細胞に位置するSARS-CoV粒子の存在を示した。
これまでの実験モデルは、COVID-19に関連する神経機構を理解するのに役立つかもしれない。しかしながら、SARS-CoVおよびMERS-CoVの中枢神経系への伝播を実証した研究の結果を評価するには注意が必要である。
これらの研究では、ACE2(SARS-CoVの場合)やDPP4(MERS-CoVの場合)を用いたトランスジェニックマウスを用いているが、野生型マウスの脳へのウイルス伝播は認められていない。したがって、これらのトランスジェニックモデルは、SARS-CoVまたはMERS-CoVによる野生型マウスにおける感染に関連する問題、例えば、マウス組織へのSARS-CoVのトロピズムを低下させるマウスおよびヒトACE2タンパク質の構造の違いなどを解決する。この問題を解決するために、トランスジェニックモデルが生成された。
その研究では、ヒトACE2コード化配列を担持したベクターを、ヒトサイトケラチン18。SARS-CoV感染時に、K18-hACE2トランスジェニックマウスは、嗅覚経路を介したウイルスの広がりを示し、それは皮質下および皮質領域に達した。
トランスジェニックマウスを用いて行われたいくつかの研究では、経鼻的に投与された場合、SARS-CoVおよびMERS-CoVの両方が脳組織にアクセスし、脳幹および視床などの特定の脳領域に急速に広がる可能性があることが示された。この感染経路は、嗅覚経路に関与する可能性がある。
驚くべきことに、大部分の頭蓋神経の一次求心性物質を受け取り、髄質心肺センターを取り囲む領域である脳幹は、SARS-CoVおよびMERS-CoVに最も感染している脳領域の一つであるようである。
このことは、SARS-CoV-2による感染もまた、多くの中枢神経系領域に大きな変化を引き起こし、それはおそらく頭蓋神経の一次求心性神経に関与する経路を介して到達するであろうことを示唆している。
それにもかかわらず、コロナウイルスが中枢神経系に感染する具体的な経路は完全には解明されていない。特に、SARS-CoVやMERS-CoVでは感染した脳の非神経細胞からウイルス粒子が検出されていないことを考慮すると、リンパ系/血行性の伝播の可能性は低いように思われる。
この観察はまた、コロナウイルスの中枢神経系へのアクセスが、シナプス結合した神経回路を介して、末梢(例えば、頭蓋)神経に関与するという仮説を支持する。
SARS-CoV-2の末梢から中枢神経系への移行に関連する潜在的な神経回路
嗅覚経路はSARS-CoV-2が中枢神経系に到達する最も有力な経路の一つと考えられている。証拠はまばらであるが、現在の文献はこの方向性を示している。
嗅覚経路は鼻腔上部の嗅上皮、すなわち嗅粘膜から始まる。嗅覚受容体は、その細胞体の一方の端から樹状突起が出現し、反対側の端から軸索が出現する小型の双極性ニューロンである。
嗅覚受容体の非骨髄化された非常に細い軸索は、一連の小さな束に集まっており、それは石膏骨の篩状板にある穴を横切り、嗅球で終わる。これらの小さな束は、総称して嗅神経を構成している。
他の哺乳類の神経とは異なり、嗅覚受容体は生涯を通じて入れ替わり、新しい受容体は基底上皮にある未分化基底細胞から発生する。これは、COVID-19に関連する嗅覚症状の持続期間を考慮すると、重要であるかもしれない。
嗅覚経路の1次ニューロンと2次ニューロンの間のシナプスは、それぞれの側の嗅球で、特に嗅球体で発生する(図1)。この経路の第2次ニューロンの軸索は、嗅道への中央ルートをたどる。
嗅球の主要な中枢突起は、嗅核、嗅結球、翼状皮質、扁桃体、扁桃周囲皮質、島皮質、および傍海馬回の前部。特に興味深いのは、視床リレーが存在しないこと(他の重要な接続は嗅覚経路によって確立されているが)と、この経路には2つのニューロンしか存在しないことである。しかし、その皮質のターゲットは、COVID-19のコンテキストでは重要であるかもしれない。
SARS-CoV-2によって誘導された嗅覚経路の皮質標的の活性の可能な変化は、少なくとも部分的には、COVID-19患者によって報告された神経学的症状を説明することができる(図2)。
例えば、皮質中隔扁桃体は、視床下部の前頭前核および前頭前核に接続されている。一方、扁桃体の中心核は視床下部の外側部分に接続されている。扁桃体には視床下部への突起が2つあり、尾状核に続く長い束「stria terminalis」と、「ventral amygdalofugal」と呼ばれる短い経路がある。
さらに、体温調節における視床下部の重要な役割や自律神経系への接続を考慮すると、嗅神経の視床下部への接続を覚えておくことが重要である。したがって、これらの経路に沿ったニューロンやシナプスに影響を及ぼす SARS-CoV-2 の感染は、これらの本質的な機能を損なう可能性がある。
さらに、味覚は前頭葉での味覚だけではない様々な刺激の統合に依存している。当然のことながら、一次嗅覚野は、直接突起を介して前頭葉に情報を送るか、視床背内側核のリレーを介して前頭葉に情報を送る。
これらの接続はすべて、嗅覚経路と多くの皮質および皮質下層構造との間のクロストークを理解する上で重要であり、したがって、SARS-CoV-2に対するそれらの潜在的な重要性を理解する上で重要である。
いくつかの研究では、SARS-CoV-2の末梢から中枢神経系への広がりにおける嗅覚経路の関与の可能性や、COVID-19患者で頻繁に見られる嗅覚障害に対する嗅粘膜に位置する細胞の寄与を分析している。
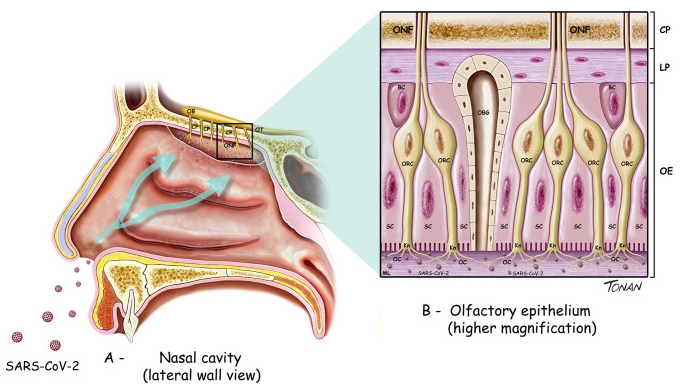
図1

嗅球と嗅覚経路の一部に見られる細胞の種類を示す図。
(A) OB、嗅球、OT、嗅管、ONF、嗅神経線維、CP、エスモイド骨の十字板。
B)ONF、嗅神経線維;CP、篩骨の篩状板;LP、前頭葉扁桃;OE、嗅上皮;BC、基底細胞;SC、支持細胞;OBG、嗅ボーマン腺;ORC、嗅受容体細胞;Kn、嗅ノブ;OC、嗅繊毛。
図2

嗅覚皮質の主な接続を示す図。
ウイルス性のスケッチは、障害領域に関連する可能性のある症状を表している。においの喪失は、おそらく最も明白な症状である(1および2)。
しかし、直接的および間接的な接続を介して、嗅覚経路は、いくつかの神経学的症状に関連している可能性がある。例えば、嗅覚経路と扁桃体核との接続は、情動障害に関連している可能性がある。
さらに、嗅覚経路の直接的または間接的な接続に関連している可能性のある他の中枢神経系の変化および神経学的症状が図示されている。
例えば、いくつかの視床下部核、特に視床上核(3)への間接的な接続は、神経内分泌制御に影響を与え、それにより下垂体(4)の機能に影響を与える可能性がある。
さらに、海馬(5)への接続は記憶障害を引き起こす可能性がある。
一方、一部の視床核への間接的な接続は感覚・運動障害(6)と関連し、前頭皮質や島皮質(7)への接続は認知障害と関連している可能性がある。また、脳幹との間接的な接続も自律神経系の障害をもたらす可能性がある(8)。
驚くことではないが、ACE受容体は、この図に示された領域のいくつかで発見されている。
利用可能な脳トランスクリプトームデータベースからのデータを分析することにより、1つの興味深い研究は、ヒトおよびマウスの脳におけるACE2の発現を評価した。この研究はまた、嗅覚系の主要な構造とともに、ACE2の発現を精査した。印象的なことに、ACE2の分布はマウスとヒトの脳の両方で類似していた。
しかし、マウスの嗅球ではACE2の発現が高いのに対し、ヒトの脳では、毛様皮質での発現が高いことが明らかになった。ヒトの嗅球におけるACE2の発現に関するデータはないが、これらの知見は、少なくとも間接的にはSARS-CoV-2による中枢神経系への侵入が嗅覚系を介して起こる可能性を示唆するものである。
また、嗅神経、嗅球、および嗅覚経路の他の構成要素の固有の特性が、SARS-CoVまたはSARS-CoV-2の中枢神経系への播種におけるこの経路の重要性を説明するのに役立つ可能性が示唆されている。
嗅覚経路のいくつかのユニークな特徴には、粘膜、この場合は嗅上皮における嗅覚受容体細胞の存在、嗅糸球体でシナプスする第1および第2ニューロンのみの存在、同側の中央突起、および視床リレーの不在が含まれる。
さらに、ヒトの脳では、一部の視床下部核においてACE2の高発現が認められた(Chen R. et al. すでに述べたように、視床下部は嗅覚経路に間接的に関連している可能性がある。
それにもかかわらず、SARS-CoV-2が嗅覚経路を介して中枢神経系に到達する具体的なメカニズムはまだ明らかにされていない。
興味深いことに、同じ研究では、脳室や黒質などの重要な脳領域だけでなく、扁桃体、海馬、視床下部核、前頭皮質など、嗅覚経路に直接または間接的に関連する領域でもACE2が高発現していることが示された。これらの領域および接続のいくつかは、図2に示されている。
ある研究では、SARS-CoV-2が呼吸器系の異なる領域(例えば、鼻腔、咽頭、鼻咽頭、喉頭、気管)に付着する可能性があることが示唆された。ウイルスが鼻腔に付着すると、嗅上皮に到達し、嗅上皮に位置する嗅神経細胞に感染し(図1)、嗅神経および関連する神経回路を介して中枢神経系に到達することができる。
しかしながら、他の研究により、嗅粘膜から中枢神経系へのSARS-CoV-2のより詳細な情報が提供されている。
ヒト嗅神経上皮からのRNA-seqライブラリーの解析を通じて、1つの研究では、嗅粘細胞、小胞細胞、ボウマン腺、および水平基底細胞におけるACE2およびTMPRSS2の両方の発現が報告された。
別の研究では、in-situハイブリダイゼーションを用いて、嗅上皮におけるTMPRSS2 mRNAの発現を解析したが、TMPRSS2 mRNAは、ustentacular細胞では高レベルで存在し、成熟した嗅覚受容体ニューロンでは非常に低く(全く存在しない場合)、水平基底細胞では低いレベルで存在することが示された。
同じ研究では、免疫組織化学によってACE2の発現を評価したところ、吻側細胞ではACE2の発現が確認されたが、受容体ニューロンまたは基底細胞では確認されなかった。
Fodoulianらによると、嗅覚上皮におけるACE2およびTMPRSS2に対する他の陽性細胞ではなく、ustentacular細胞が、SARS-CoV-2誘発性嫌悪感の発生源の主要な候補である。
この仮説を支持するのは、SARS-CoV-2によって誘発された嗅覚異常の発生が早いこと、ustentacular細胞にはTMPRSS2とACE2の転写産物が多量に存在すること、そして嗅神経上皮の完全性を維持する上でustentacular細胞が重要な役割を果たしていることである。
嗅覚細胞が失われると、神経上皮全体が崩壊し、無嗅覚を引き起こす。例えば、3-メチルインドール、抗甲状腺剤メチマゾール、硫酸ニッケルNiSO(4)など、ustentacular細胞に影響を与える化学物質の影響による一過性の嗅覚障害がある。
別の研究では、ヒトおよびマウスのバルクおよび単細胞RNA-Seqデータセットを分析し、SARS-CoV-2感染に関連する細胞侵入分子を発現する嗅上皮および嗅球の両方の細胞型を決定した。
嗅覚ニューロンおよび嗅球にACE2およびTMPRSS2遺伝子が存在しないこと、支持細胞、幹細胞および血管周囲細胞に存在することと対照的であることに基づいて、著者らは、COVID-19患者に見られるアノスミア。したがって、COVID-19患者における嗅覚障害の存在を解釈する際には、嗅覚ニューロンの直接感染を伴わない別のメカニズムを考慮しなければならない。
別の研究では、免疫組織化学および遺伝子解析を用いて、ヒトおよびマウスの両方の組織の呼吸器粘膜、嗅粘膜、および嗅球におけるACE2、TMPRSS2、およびFurinの存在を決定したが、ACE2が呼吸器粘膜、嗅粘膜、および嗅球において広く発現していることが示された。
ACE2、TMPRSS2、およびFurinは、呼吸器粘膜(呼吸器上皮および下皮腺など)および嗅粘膜、特に嗅上皮およびボウマン腺の支持細胞において共発現していた。しかし、嗅粘膜の嗅球受容体ニューロンは、ACE2には陽性であったが、TMPRSS2およびFurinにはほとんど陰性であった。
嗅球細胞はACE2を強く発現し、Furinは弱く、TMPRSS2は発現しなかった。本研究の著者らは、嗅神経束におけるACE2とTMPRSS2の共発現を考慮すると、嗅覚伝達は神経細胞の機能不全によって障害される可能性があると結論づけた。
それにもかかわらず、SARS-CoV-2は嗅覚受容体神経細胞にACE2を発現しているようだが、TMPRSS2やFurinは発現していないことから、嗅覚受容体神経細胞に直接ダメージを与えることは考えにくいことが示唆された。
著者らによれば、嗅覚受容体ニューロンによるTMPRSS2およびFurinの発現がないことは、COVID-19患者における麻酔症状の早期回復を決定する可能性があるという。しかしながら、この概念は、さらに探索されなければならない。逆に、Fodoulianらは、ヒト水平基底細胞が低レベルでACE2およびTMPRSS2を発現することを実証した。
水平基底細胞は、成人期を通じて分裂し、感覚ニューロンを継続的に置換する前駆細胞である。このことは、感染した水平基底細胞から分化した嗅覚ニューロンがSARS-CoV-2に感染し、経シナプス経路を介して、このウイルスが嗅球を通って移動して嗅野に到達する可能性を示唆している。
重要なことは、SARS-CoV-2の中枢神経系への侵入経路を探る際には、嗅覚系だけでなく、他の経路も考慮しなければならないということである。
例えば、中枢グリア物質および脳脊髄液。これは、SARS-CoV-2が中枢神経系に到達するために潜在的に使用される可能性のある追加の経路を提供するので、重要である。
さらに、このプロセスに対する他の感覚経路の寄与の可能性を詳細に評価しなければならない。
風味知覚は、顔面神経、舌咽神経、および迷走神経の完全性に依存する。これらの神経のそれぞれは、擬似単極性ニューロンを包含している。これらのニューロンの細胞体は、顔面神経のgeniculate ganglion、迷走神経のnodose ganglion、舌咽神経のpetrosal ganglionのように、特定の末梢神経節内に位置している。
しかし、これら3つの神経の1次神経と2次神経の間のシナプスは、髄質にある孤道核(NST)という1つの核で発生しており、脳幹の主な内臓核と考えられている。NSTから、神経線維は同側の中隔路を通って視床の腹側後頭頂核。
最後に、これらのニューロンは、島状部や前頭前部オペルクルムの内側表面に位置する味覚野に到達するが、SARS-CoV-2の中枢神経系の標的となる可能性がある。
SARS-CoV-2による脳幹核の侵襲の可能性については、NSTと曖昧核(NA)の重要性を強調しなければならない。NSTは呼吸器の化学受容体と機械受容体の両方から感覚入力を受ける。
一方、NAとNSTからの求心性線維は気道平滑筋、血管、腺を刺激する。これらの神経解剖学的関係は、NSTとNAが髄膜心肺センターに近接していることと相まって、COVID-19患者の死亡は髄膜心肺センターの損傷と関連している可能性を示唆している。
さらに、最初の症状から呼吸困難になるまでの期間の中央値が5日前後で、その後入院まで7日、集中治療まで8日という先行知見を考慮すると、COVID-19の潜伏期間は、ウイルスが脳幹に位置する心肺センターの神経細胞に侵入し、損傷を与えるのに十分な期間であることが示唆されている。
一方、鼻腔(呼吸粘膜)や口腔からの一般感覚入力は、三叉神経の一次求心性神経によって行われる。三叉神経細胞は擬単極性に分類され、その細胞体は三叉神経節(ガッサー神経節)に位置している。三叉神経経路では、第一次ニューロンと第二次ニューロンの間のシナプスは、脳幹の広い領域に広がる三叉脳幹感覚核複合体(TBSNC)で発生する。
これらのニューロンはその後、視床のVPM核に到達し、そこでニューロンとシナプスを形成し、一次感覚野に到達する(S1)。これらの解剖学的記述から、SARS-CoV-2が中枢神経系レベルで作用する経路が少なくとも4つあることが示唆されている。
特に興味深いのは、TBSNC/NSTと心肺センターの近接性であり、これらはすべて髄質に位置する。ENSに関しては、運動機能に関与するニューロンの多くは髄膜神経叢内に存在するが、一部の一次求心性ニューロンは粘膜下神経叢内に存在する。
感覚-運動制御に関与するすべてのNSと同様に、ENSにも一次求心性ニューロンが存在する。腸管ニューロンは、上行性介在ニューロン(オピオイドペプチドを含む)および下行性コリン作動性ニューロンからの入力を受けるを考慮して、COVID-19におけるこのシステムの可能性のある役割については、別途議論する。
SARS-CoV-2メカニズムとCOVID-19消化器症状に対するENSの潜在的な貢献
消化器症状は、COVID-19に入院して診断された患者の~10%で報告されており、腹痛が起こることもあるは、COVID-19を有する入院患者73人のうち53%が便中にウイルス性RNAを有していたことを明らかにした。
これらの患者の約23%は、呼吸器サンプルがウイルスRNA陰性になった後も、便に陽性の結果が残っていた。上皮細胞感染の最近の試験管内試験(in vitro)研究では、SARS-CoV-2がヒト腸管腸管細胞に生産的に感染することが実証された。
この研究では、共焦点および透過型電子顕微鏡によって示されたように、ヒト腸管オルガノサイトは、SARS-CoVおよびSARS-CoV-2の両方に容易に感染した。60時間後、SARS-CoV-2は大量のアポトーシス細胞の産生を誘導した。同じ研究では、成熟腸球が300倍のACE2を発現することも示された。
以前に記載したように、ACE2受容体への結合は、COVID-19感染性の重要な側面であると考えられてきた。
2003年のSARS-CoV株と比較した場合のSARS-CoV-2ヒトACE2の使用におけるより高い有効性を予測する構造in silico解析は、この考えを支持する。さらに、生物物理学的および構造的証拠は、SARS-CoV-2 Sタンパク質のACE2に対するより高い親和性を実証した。
しかしながら、増殖性腸球前駆細胞は、腸管感染の主要な標的であるように思われた。
この知見は、低レベルのACE2であっても、少なくともこれらのタイプの細胞においては、ウイルスの侵入に十分である可能性があることを示唆している。さらに、mRNA配列解析によって示されるように、SARS-CoV-2感染は、I型およびIII型インターフェロン応答に起因する幅広いサイトカインおよびインターフェロン刺激遺伝子(ISG)の発現を引き起こす。
注目すべきことに、SARS-CoVによるこれらの遺伝子の誘導は、はるかに低いレベルで起こった。同じくオルガノイドを使用したさらなる研究は、免疫蛍光を通して、ヒト腸管オルガノイドにおけるACE2の発現、およびTMPRSS2タンパク質の存在を示した。
カブトコウモリのSARS-CoVsに対する高い配列相同性に基づいて、SARS-CoV-2のコウモリ起源が提案されている(Zhou P. et al. この情報は、コウモリの腸細胞を研究するためのモデルを確立するZhou J.らの研究を支持した。このモデルを用いて、著者らはヒトとコウモリのオルガノイドを比較した。
Rhinolophus sinicus batsの腸細胞に由来する腸管細胞は、ヒトのホモログに類似したACE2およびTMPRSS2タンパク質を示した。
また,生産性の高いSARS-CoV-2感染症にも感受性を示した.同じ研究では、下痢をしたCOVID-19患者の便から感染性ウイルスが分離された(Zhou J. et al. これらの知見を総合すると、ヒト腸管がSARS-CoV-2感染の代替ルートとして機能していることが強く示唆される。
SARS-CoV-2感染の病態生理に対する腸管系の寄与を完全に理解するためには、腸-脳軸の重要性を考慮する必要がある。
いわゆる腸-脳軸は、中枢神経系に影響を及ぼす多くの疾患において非常に重要であり、いくつかの最近の研究では、このコミュニケーションの臨床症状への関連性、さらには多くの疾患の発症への関連性が示されている。このコミュニケーションは、中枢神経系の特定の中枢を刺激することを可能にするであろう。
さらに、Parkerらは、ENSから中枢神経系へのニューロンを介したウイルス伝達が、前向性経路および逆行性経路の両方によって可能であり、両方の経路が通常は同じ脳部位に到達することを示した。
上述したように、古典的な研究では、子豚の口腔内に接種すると、HEVは最初に上気道、肺、小腸に到達することが示されている。また、潜伏期間中、下迷走神経節やENSの腸神経叢など一部の末梢神経節で免疫蛍光によりウイルス抗原が検出された。
その後、HEVは脳幹に広がり、後に中枢神経系の他の領域でも検出された。実際、このウイルスは、腸からの逆行性運動ニューロン輸送を利用したルートで脊髄にアクセスした。
感染は腸神経叢でも検出され、HEVの経シナプス移動を介して感染することが実証された。このことから、コロナウイルスが腸球に感染すると、ENS細胞も感染して中枢神経系にウイルスを伝達することが示唆されている。
別の可能性としては、ロタウイルスのような他の腸管ウイルスによる感染と同様に、このウイルスがNSTの迷走神経刺激を引き起こすということも考えられる。
これらの場合、腸球が感染した後、ロタウイルスにコードされたタンパク質は、腸管の腸球体細胞によるセロトニン(5-HT)の分泌を刺激し、これにより、中枢神経系の領域に投射される腸管神経節および迷走神経のニューロンを刺激する。
したがって、ENSと中枢神経系をつなぐ広大なネットワークがSARS-CoV-2 NS感染にも関与している可能性があり、COVID-19と診断された患者によって報告された消化器症状と関連している可能性があると推測したくなる。しかし、COVID-19におけるENS細胞の特異的な関与を示す証拠はほとんどなく、さらなる調査が必要である。
COVID-19における神経・免疫の役割
COVID-19患者に見られる著しい肺損傷は、部分的に、「サイトカイン放出症候群」または「サイトカインストーム」として知られるサイトカイン調節異常と関連している。
このいわゆる「サイトカインストーム」は、自然免疫系および適応免疫系が、感染を制御しようとして、異常なレベルのサイトカインおよび他の因子を放出するときに起こり、組織損傷または急性臓器不全さえも導く(Yang et al. いくつかの研究は、COVID-19を有する重症患者に対するこの炎症反応を相関させている。
COVID-19の重症および中等症症例におけるプロおよび抗炎症性サイトカインであるインターロイキン受容体-2(IL-2R)、インターロイキン-6(IL-6)、腫瘍壊死因子α。
特筆すべきことに、SARS-CoVおよびSARS-CoV-2の両方は、免疫調節活性を有するウイルスタンパク質をコードし、宿主のインターフェロン応答を修飾し、インフラマソームと称される多タンパク質複合体の活性化を可能にすることができる。
神経免疫経路は双方向に機能し、求心性ニューロンが末梢で免疫シグナルに反応し、求心性ニューロンが脳と末梢との間の相互作用を促進する。
この炎症性反射が議論されており、SARS-CoV-2の神経学的側面が浮上してきている。COVID-19に関連する症状における中枢神経系の関与を指摘するデータの増加は、神経免疫応答が宿主免疫および肺の炎症をどのように調節し得るかについて、我々のグループに問い合わせを促した。
驚くべきことに、Leyva-Gradoらは、インフルエンザの鼻腔内マウスモデルを用いて、嗅球を介して中枢神経系に到達したウイルスの侵入が脳幹のサイトカインを調節していることを観察した。さらに、嗅球の切開はTNF-αとIL-1βの減少を引き起こすことが以前に実証されている。
COVID-19の重症例における炎症反応の悪化の証拠は、嗅覚および味覚機能障害を有する患者がより重度の肺機能障害を有していることを示唆している。
ある研究では、患者の45%が神経症状を呈し、リンパ球数が低下していたことが示された。また、著者は、神経症状を呈した重症患者のサブグループもリンパ球数の低下を示したことを指摘している。
このリンパ球減少は一過性のものと思われ(長期的な免疫抑制リスクを除く)、これらの細胞においてウイルスが検出可能であったことから、おそらくウイルスによる感染細胞の破壊によるものと思われる。興味深いことに、リンパ球減少は、患者の異なるグループまたはサブグループについて記載されているように、COVID-19の重症度マーカーとして採用されている。
最後に、COVID-19は、自己免疫疾患であるギラン・バレ症候群の1例と関連しており、ウイルス誘発免疫応答およびその長期的な結果を理解することの重要性を強調している。
COVID-19に関連する神経症状に関する重要な考察と追加説明
COVID-19に関連する神経学的徴候/症状に関する追加の説明は、全身性炎症反応の発生であるかもしれない。サイトカインの不十分な活性化経路および血小板反応による血栓症を伴う高凝固性などの間接的な機序も起こり得る。さらに、びまん性血管炎に起因するであろう軸索性末梢神経障害およびミオパシーの存在は、以前にSARS-CoVで確認されている。
最近、COVID-19患者において末梢神経系の変化に関連した症状が報告されているにもかかわらず、COVID-19に関連した神経障害は確認されていない。
しかしながら、この疾患の自然経過を考慮することは重要であり、これはCOVID-19の異なるステージの間に見られる臨床的、生化学的、および画像学的特徴の間にミスマッチをもたらす可能性がある。
例えば、ある論文では、COVID-19と診断された若年患者が髄膜炎/脳炎、発作、意識障害を呈し、脳磁気共鳴画像(MRI)で異常所見を呈した症例が報告されている(Moriguchi et al. 本症例報告では、ポリメラーゼ連鎖反応(PCR)によりCOVID-19が確認され、脳脊髄液(脳脊髄液)ではSARS-CoV-2が陽性であったが、鼻咽頭スワブでは陽性ではなかった(Moriguchi et al. これらの所見は、記載された臨床症状にもかかわらず、COVID-19の真の神経学的関与をより詳細に調査し、同定する必要があることを示している。
別の症例報告では、急性出血性壊死性脳症がCOVID-19を有する患者に認められた。しかし、COVID-19患者で見つかったいくつかの神経学的症状についての詳細な研究と適切な説明は、今後行われるべきである。
SARS-CoV-2の神経侵襲性を研究するための戦略
SARS-CoV-2の中枢神経系への影響を研究するためにいくつかの方法が提案されているかもしれない。課題としては、COVID-19の適切な動物モデルの開発が挙げられる。
マウスのACE2はヒトのACE2タンパク質に比べて構造的な違いがあり、SARSコロナウイルスはマウス組織に対するトロピズムが弱い。したがって、トランスジェニックモデルはCOVID-19の経路を研究するための重要なツールである。
hACE2(ヒトアンジオテンシン変換酵素2)トランスジェニックマウスにおけるSARS-CoV-2の病原性の評価は、これらのキメラ動物において軽度の疾患のみを示し、野生型マウスにおいてはウイルス増殖の欠如を示し、この動物モデルにおけるSARS-CoV-2感染および複製に対するhACE2の重要性を強調している。
しかしながら、上述のように、以前にMERSおよびSARS-COVで見出されたように、トランスジェニックマウスで見出された疾患のパターンは、野生型マウスで見出されたパターンとは異なる。
宿主およびhCoVゲノムの両方の遺伝的制御システムと並んで、ヒトの病原性表現型を模倣するための遺伝的に牽引可能な哺乳動物モデルの開発は、ウイルス/宿主遺伝学と病原性の結果との関係の理解を促進し得る。
SARS-CoV-2に対する可能性のある治療薬としてマイクロRNA(miRNA)を考慮すると、宿主-細胞内miRNAとウイルス遺伝子の間の可能性のある相互作用を同定することを目的とした計算研究が行われた。
この研究では、生合成、入口、複製、感染などのメカニズムに関与するウイルス遺伝子が、宿主細胞型miRNAの標的となりうることが示された。
しかしながら、ウイルスに対するこのmiRNAベースの治療戦略の2つの側面を考慮しなければならない:ウイルス標的領域内の1つのヌクレオチド突然変異は、宿主細胞型miRNAとの相互作用を混乱させ、その結果、ウイルスの回避をもたらす可能性があり、そして、これらの分子の重要な生理学的機能に起因して、宿主細胞型miRNAのレベルを操作する際には注意が必要である。
miRNAレベルの操作は予期せぬ副作用を引き起こす可能性がある。もう一つの重要な問題は、ウイルスが特定の脳領域(例えば、髄質心肺センター)のニューロンにどの程度の損傷を引き起こすかということである。
この目的のためには、初代細胞培養が最も実行可能なアプローチであろう。免疫組織化学は、死後分析を用いてヒトと動物の所見を比較するためにも重要であろう。
しかし、これはSARS-CoV-2に対する特異的な抗体を使用する場合にのみ考慮することができる。もう一つのより現代的なアプローチは、COVID-19を研究するために成体幹細胞(ASC)から分化したオルガノイドを使用することである。
オルガノイドは、ASCから成長した三次元構造であり、それらを生じさせるASCが由来する器官のいくつかの特徴を再現している。最近の研究では、ヒト小腸オルガノイド(hSIO)において腸球がSARS-CoVおよびSARS-CoV-2に感染し得ることが示され、COVID-19に関連する病態生理学的メカニズムを研究するためのこの方法の実現可能性が実証された。
生体内試験(in vivo)ヒト研究に関しては、拡散テンソルイメージング(DTIまたはDTI-MRI)は、COVID-19の病態生理を研究するために使用され得る有望で極めて安全な神経画像化ツールである。
この技術は、COVID-19患者の脳だけでなく、ヒトに相当する特徴的な症状を呈するヒトSARS-CoV-2に感染した実験モデルの脳を検査するために容易に使用することができる。
DT-MRIは、生体内試験(in vivo)で中枢神経系組織の微細構造を完全に解析できる唯一の非侵襲的手法と考えられている。全体として、DT-MRIでは、主要な脳管の微細構造における水分子の大きさと方向を推定することが可能である。
これにより、研究者は様々な条件下でのこれらの構造の変化を評価することができる。脳幹路で起こる変化の詳細な研究に成功している。
したがって、DT-MRIは、COVID-19による脳幹と皮質路で起こる変化を研究するために使用するための堅牢なツールとなるだろう。DTI研究は、研究者がCOVID-19患者で潜在的に損傷を受けている特定のトラクトを研究することを可能にするだろう。
例えば、この方法では、嗅覚経路の大部分だけでなく、三叉神経とその周辺枝(例えば、眼科枝、上顎枝、下顎枝)、および馬尾核を含む三叉神経路とその核だけでなく、主感覚核および中脳核も含む三叉神経経路全体を研究することが可能である。
また、DTIにより、NSTやNA、髄質心肺センターとの関係も研究できるようになる。
さらに、COVID-19に関連する異なる神経経路、特にCOVID-19患者の特定のトラクトと健常者の同じトラクトを比較した場合に起こりうる変化を評価することができる。
COVID-19に関連する神経侵襲に関連し、本レビューで議論されているすべてのトラクトは、嗅覚系を含むDTI(Wiegell et al 2003;Granziera et al 2006;Lutz et al 2008;Wilcox et al 2013)で評価することができる。
DT-MRIなどの神経画像化技術は、特に人工知能(AI)データマイニングとの相性が良いようであり、これにより、COVID-19のより重篤な形態の発症に関与する危険因子の診断および予測が改善される可能性がある。
この分野の研究を加速させ、それによってCOVID-19に対抗するためのより強固な科学的証拠を提供するために、ホワイトハウスは、研究機関や技術企業と協力して、2020年3月16日にCOVID-19に関する研究のためのグローバル・コールを発表した(Alimadadi et al. AIは、合理的な精度でより迅速な診断方法を開発し、医療従事者のウイルスへの曝露を減らして汚染リスクを低減するために、さまざまな分野の研究に利用される可能性がある。
このアプローチは、COVID-19と闘うための効果的な治療法のためのスクリーニングの迅速化とコストの削減、およびその病原体の理解を深める上で決定的なものとなり得る。
古典的な実験と他の技術との組み合わせは、SARS-CoV-2の神経侵入の可能性と関連する意味合いを決定するために極めて重要である。
結論
COVID-19がヒトNSに及ぼす影響については、これまで十分な検討がなされていない。COVID-19のNSへの関与の程度を明らかにし、SARS-CoV-2の影響を受ける可能性のある神経回路を明らかにすることが重要であり、急務である。
末梢神経系、特に頭蓋神経とENS、そしてCOVID-19の影響を受ける中枢神経系と関連する神経回路網の関与を確認する必要がある。さらに、体内でのウイルスの拡散の方向性と時間経過を明らかにする必要がある。
異なる技術や研究分野の統合を促進する必要がある。