Contents
Neurological involvement in the respiratory manifestations of COVID-19 patients
pubmed.ncbi.nlm.nih.gov/33582654/
2021年2月14日
要旨
重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)による新型コロナウイルス感染症(COVID-19)の特異的な特徴は、現在の生物学的知見に挑戦している。2020年2月の早い段階で、SARS-CoV-2は他の多くのコロナウイルスと同様の神経侵襲性を有する可能性があることを示唆した。それ以来、様々な神経学的症状がSARS-CoV-2感染と関連しており、それは神経画像検査および/または脳脊髄液検査で一部の患者で支持された。現在までに,COVID-19患者の脳に関する剖検研究がPubMed/MEDLINEで少なくとも27件検索でき,そのうち134例中78例で脳幹に神経病理学的変化が観察され,脳幹からSARS-CoV-2核酸が16/49例(32.7%),ウイルス性タンパク質が18/71例(25.3%)で検出された。COVID-19患者の呼吸器症状の特徴を明らかにするために,本レビューでは,SARS-CoV-2感染による呼吸不全の原因となる神経原性機序についての既存のエビデンスを評価した。神経学的関与を認識することは,SARS-CoV-2感染症の予防,治療,予後に重要な指針となる。
序論
2020年に入ってから、重症急性呼吸器症候群CoV-2(SARS-CoV-2)と呼ばれる新たに出現したコロナウイルス(CoV)が世界中のヒトの間で急速に蔓延し、新型コロナウイルス感染症(COVID-19)と呼ばれる病気につながっている。SARS-CoV-2は急性で致死性の高い肺炎を引き起こすだけでなく、免疫系、循環器系、消化器系、泌尿器系、神経系など多くのシステムに感染する。
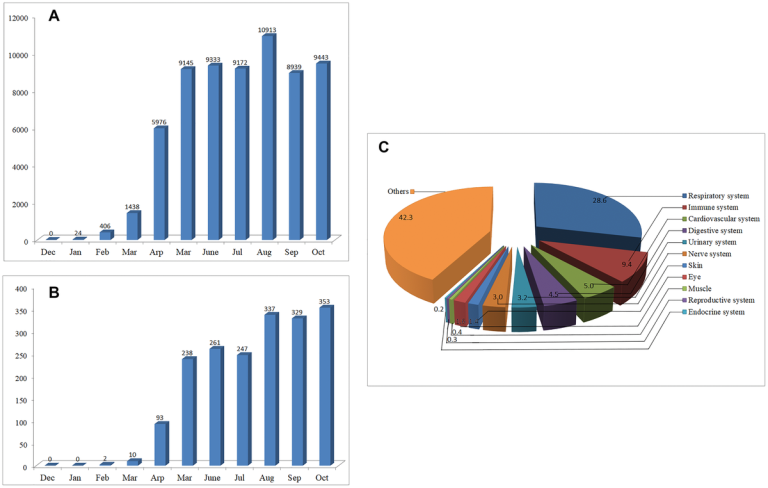
2020年1月時点では、PubMed/MEDLINEでCOVID-19に関する論文は24件しか見つかりなかったが、その後数ヶ月で論文数は指数関数的に増加した(図1A)。2020年10月31日までに、COVID-19に関する64,000件以上の論文を検索することができ、COVID-19のパンデミックが国民の大きな懸念を喚起していることを示している。公開されたデータのうち、57.7%が臓器関与に関連している。呼吸器系、免疫系、心血管系、消化器系、泌尿器系、神経系に関する論文がそれぞれ28.6%、9.4%、5.0%、4.5%、3.2%、3.0%を占めている。残りの42.3%は主に疾患の予防・治療、ウイルス構造、ワクチン、疫学的特徴などに焦点を当てている(図1B)。
2019年12月01日から 2020年10月31日までのCOVID-19に関する論文数の推移
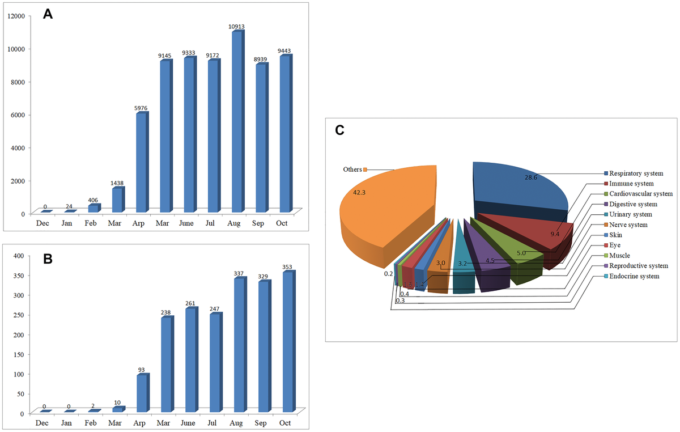
A)COVID-19に関する論文数の月次推移
B) COVID-19の神経内科に関する論文数の月別推移
C)身体の異なるシステムに関する掲載記事の割合。
COVID-19の予防、治療、またはさらなる研究の手がかりを提供するために 2020年2月の早い段階で、SARS-CoV-2が他の多くのCoVと同様の神経侵襲性を有する可能性があることを示唆した[1,2]。2020年2月時点では、COVID-19の神経学または神経科学に関する論文は2本しか見つからない。しかし 2020年10月31日までに、このトピックに関する1900以上の論文を検索することができ、そのほとんどが2020年4月以降に発表されたものである(図1C)。
COVID-19の神経学的関与は、現在では「COVID-19神経科学」または「COVID-19神経学」と呼ばれ、ますます注目を集めている[3, 4]。その根底にあるメカニズムを解明することは、SARS-CoV-2感染症の死亡率を低下させるための効果的な治療戦略の策定に役立つ。本論文では、SARS-CoV-2の神経侵襲に関する既存のエビデンスをレビューし、COVID-19患者の呼吸器症状におけるその可能性をさらに探求する。
SARS-CoV-2の神経侵襲に関するエビデンス
これまでに、SARS-CoV-2 感染後にはさまざまな神経学的症状が報告されている。一部の患者における神経学的関与は、神経画像所見 [5-8] および脳脊髄液(脳脊髄液)中の SARS-CoV-2 RNA の陽性検出 [9-30] によって裏付けられている。さらに、COVID-19で死亡した一部の患者の脳からは、SARS-CoV-2 RNAおよび/またはウイルス性タンパク質が検出された[31-37]。
SARS-CoV-2感染に関連した神経学的症状に関する最初の臨床報告は 2020年2月の早い段階でmedRxivにプレプリントとして掲載され 2020年4月にJAMAに掲載された[5]。この報告によると、患者の36.4%が様々な神経学的症状を呈していた。その後、Romero-SánchezらはスペインのCOVID-19患者841人を評価し、57.4%が様々な神経学的症状を呈していたことを明らかにした[6]。Pinnaらは、米国シカゴのCOVID-19患者650人の臨床記録を分析し、7.7%の患者に神経学的症状が認められたことを明らかにした[7]。同様に、KaradaşらはトルコのアンカラでCOVID-19患者239人の連続した入院患者を評価し、83人(34.7%)の患者で神経症状を検出した[8]。
COVID-19に関連した神経症状は3つのカテゴリーに分類される。1)頭痛、めまい、意識障害、てんかん、急性脳血管事故などの中枢神経系(CNS)の関与、2)嗅覚障害、知覚低下、視覚障害、神経痛などの末梢神経系(PNS)の関与、および3)骨格筋損傷である[38]。Agarwalらは、米国ワシントン州のCOVID-19患者404人の臨床データを分析した[39]。その結果、中枢神経系の病変で最も多かったのは意識障害(21.3%)で、次いで頭痛(20.3%)めまい(7.7%)であった。最も一般的な末梢神経系障害は筋肉痛(32.4%)で、次いで味覚障害(6.7%)嗅覚障害(4.5%)であった。COVID-19患者の約24.5%が急性神経学的症状を示し、その中で最も多かったのは精神状態の変化(21.3%)で、次いで重症ミオパチー(2.0%)脳卒中(0.7%)および発作(0.5%)であった[39]。
興味深いことに、COVID-19患者の多くで神経学的症状が初期症状または唯一の症状であることが報告されており [13,24,40-42]、神経系がSARS-CoV-2の主要標的の1つである可能性があることが示されている。多くの神経学的症状、特にCOVID-19の重症患者で報告された症状は、全身性炎症反応、低酸素血症、または多臓器不全に起因する可能性がある[43]。しかし、脳炎、無感覚症、低汗症などの特殊な神経学的症状は、SARS-CoV-2の中枢神経系への直接的な侵入に関連している可能性がある。
Moriguchiら[24]およびXiangら[30]がCOVID-19患者の脳脊髄液中にSARS-CoV-2の最初の証拠を提供して以来、これまでに少なくとも26例がSARS-CoV-2の脳脊髄液陽性検出を示すことが報告されている[9-30]。興味深いことに、いくつかの症例では、SARS-CoV-2 RNAが神経組織で検出されたが、脳脊髄液では検出されなかった[31,36]。脳脊髄液検査は脳脊髄液採取時期、感染の重症度、または検出方法の感度に関連しているため、脳脊髄液検査の陰性結果は中枢神経系にSARS-CoV-2が存在しないこととは一致しない[43-45]。
他のいくつかの神経向性ウイルスに関する先行研究では、中枢神経系へのウイルスの侵入が髄腔内抗体の増加と関連していることが示されている [46-47]。SongらはCOVID-19患者6人の脳脊髄液サンプルを分析したが、その中には脳症3人、難治性頭痛2人、発作1人が含まれていた [48]。驚くべきことに、すべての患者の脳脊髄液でSARS-CoV-2に特異的な抗体が観察された。ヒトアンジオテンシン変換酵素2(ACE2)を発現する動物モデルを用いて、さらに、中枢神経系に感染した場合にのみ、抗体が脳脊髄液に出現または増加することを発見した。実際、SARS-CoV-2に特異的な抗体は、6件の症例/症例シリーズの報告で、COVID-19患者30人の脳脊髄液で検出されている[26, 49-53]。Songらの報告[48]によると、血液脳関門が無傷の患者の脳脊髄液中の抗SARS-CoV-2抗体は、ウイルスの中枢神経系への直接的な侵入と密接に関連している。
SARS-CoV-2の神経侵入を支持して、Paniz-Mondolfiらは 2020年4月21日に1人のCOVID-19患者の脳内にSARS-CoV-2が存在することを示す最初の剖検証拠を報告した[31]。それ以来、SARS-CoV-2が中枢神経系に侵入し、さまざまな脳領域に感染しうることを示す剖検研究が増えている[32-37]。これまでに、SARS-CoV-2のRNAおよび/またはウイルス性タンパク質は、嗅粘膜/神経/眼球 [32-33]、三叉神経節 [32-33]、延髄 [32,37]、大脳 [35]、小脳 [36] で検出されている。
ほとんどの減少した患者の低酸素血症および高凝固状態と一致して、COVID-19患者の脳では、脳血管事故[35,48,54-59]および/または低酸素病変[54,56,58,60-62]が広く観察されている。しかし、脳血管障害および/または低酸素性障害を有する患者の脳内でSARS-CoV-2 RNAおよび/またはウイルスタンパク質が検出されたことから、これらはSARS-CoV-2の神経浸潤と矛盾するものではない[37, 48, 54, 56, 59-60]。さらに、多くの剖検研究では、特定の脳領域で重度の微小膠原病および/またはリンパ球浸潤が観察された[35,54,58]、特に脳幹において[37,54,56-57,62-63]。
中枢神経系におけるSARS-CoV-2の広範な存在は、明らかに異なる神経病理学的変化と同様に、COVID-19患者で記録された広範な神経学的機能障害のスペクトルとよく一致している。
SARS-CoV-2の神経侵入はCOVID-19患者の呼吸器症状と関連している。
呼吸不全は、SARS-CoV-2 感染によって誘発される高死亡率の主な原因である[64]。呼吸不全を発症したCOVID-19患者の約10%が人工呼吸器サポートのために集中治療室(ICU)への搬送を余儀なくされ,最大79%が死亡した[65-66].したがって,患者の命を救うための合理的な治療計画を立てるためには,そのメカニズムを明らかにすることが急務である.
CoVについて利用可能な臨床および実験データに基づいて、我々は以前に、SARS-CoV-2の神経侵襲性が、一部のCOVID-19患者の急性呼吸不全に一役買っている可能性を示唆した[1, 2]。このセクションでは、COVID-19患者の特異的な呼吸器症状について議論し、SARS-CoV-2感染によって誘発された呼吸不全における神経学的関与の既存の証拠をさらに評価する。
肺損傷だけではCOVID-19患者の呼吸機能を説明することはできない。
放射線学的研究では、COVID-19を有する入院患者のほとんどが胸部CT(コンピュータ断層撮影)検査で両側に多発性の末梢基底硝子体の不鮮明さを示していることが示されている[65, 67]。胸部CT上の肺病変の発生は、一般的にCOVID-19の進行の臨床的時間経過と一致している[68]。
Wangらの研究によると、COVID-19患者138人全員において、肺病変の程度は軽度か重度かにかかわらず同様であった[69]。この所見は、他のいくつかの研究でも確認されている [65, 70-71]。驚くべきことに、無症候性の患者では、症候性の患者と有意な差はなく、同様の画像異常を示すことが報告されている[72]。
明らかな肺の異常にもかかわらず、ほとんどのCOVID-19患者は軽度のインフルエンザ様症状しか示さなかった。患者の約37.8~67.8%が咳嗽を呈したが[73-74, 71]、ほとんどの患者で喀痰の産生は認められなかった。産生性咳嗽は軽症患者の12.1~35.9%、重症患者の22.2~48.8%にのみ認められた [69, 73-75]。しかし、COVID-19を有する軽症患者および重症患者の両方で低酸素血症が発現する可能性がある[70, 76-77]。興味深いことに、重症患者の29.4~62.4%および軽症患者の74.4~84.9%は呼吸困難を呈していなかった [73-75]。
SARS-CoV-2感染症の患者の多くは、意識を失ったり、臓器不全に近いはずの重度の低酸素血症で来院した。驚くべきことに、患者は呼吸困難を否定し、補助呼吸筋の使用のサインを示さなかった。この異常な臨床症状は「サイレント低酸素症」と呼ばれ、現在の基礎生物学に反している[78]。COVID-19患者の中には、対症療法を受けても「サイレント」低酸素血症が長期間続く場合があり、医療スタッフに改善の錯覚を与えていた。しかし,感染後10~14日目に突然低酸素血症が進行・悪化し,急性呼吸窮迫症候群,呼吸不全,多臓器不全,さらには死に至るケースもあった[65].
呼吸困難を呈する患者の半数以上は、集中治療を必要とする重症例に発展すると考えられている[65, 67, 69]。しかし、多くの重症患者は早期に侵襲的機械換気からの離脱に失敗し、ICU滞在時間が非常に長くなっているように思われる[65, 79]。重症患者のほとんどが肺炎から回復しているので、これは驚くべきことである。
また、いくつかの研究者は、ICU患者の50%以上が呼吸器系の機械的特性と低酸素血症の重症度との間に解離を示していることにも気づいている[80-81]。これらの患者では、呼吸器系のコンプライアンスと肺内のガス量の両方が正常範囲内であった。これは奇妙なことであり、他の形態の急性呼吸窮迫症候群ではほとんど報告されていない[80-81,82]。
呼吸器ウイルス感染は炎症性変化を引き起こし、呼吸器系に位置する感覚受容体を刺激し、低酸素血症は頸動脈および大動脈小体のグロムス細胞を刺激する。これらの感覚構造における結果としてのインパルスは、脳幹に位置する呼吸中枢に伝達され、それを介して処理される。脳幹からの収容要求は、その後、句膜神経と横隔膜に伝達され、換気を増加させる。一方、呼吸中枢の活動の増強は大脳皮質に伝わり、息切れの主観的感覚を生じる [83-84]。自己認識の重要な警告信号として、COVID-19患者における呼吸困難の発生率は、中東呼吸器症候群(MERS)-CoV(69%)呼吸器同期ウイルス(95%)インフルエンザウイルス(82%)など、他の多くの呼吸器ウイルスに感染している患者と比較して有意に低い[85-86]。
剖検研究では、COVID-19患者の肺は、ヒアリン膜形成、肺炎球の活性化、微小血管血栓、リンパ球の炎症、および蛋白質浮腫を伴うびまん性肺胞損傷を特徴とすることが示されている[87-88]。末端気管支および肺胞壁の滲出および線維化は、肺胞壁を越えた酸素の拡散不良を引き起こし、一方、肺微小血管の血栓形成の増加は低酸素血症を悪化させる可能性がある。しかし、これらの変化が呼吸困難の鈍化を引き起こすことを示す証拠はない[84]。Guanらが報告した症例シリーズ研究によると、入院治療またはICU入院を必要としたCOVID-19患者1099人のうち、胸部X線写真所見が正常であったのはそれぞれ23%と12%であった[74]。さらに、急性呼吸窮迫を呈した患者の中には、肺血栓塞栓症の証拠を示さないものもあった[23]。これらのデータは、SARS-CoV-2感染によって誘発される急性呼吸不全が肺の変化だけでは説明できないことを示している[89]。
呼吸不全は、呼吸中枢、神経、筋肉、胸郭、気道、肺を含む呼吸運動のあらゆる部分の障害によって引き起こされる可能性がある。以下で詳細に議論されるように、増加する証拠は、COVID-19患者の呼吸不全に末梢神経系および中枢神経系のいずれかまたは両方が関与していることを示している。
神経筋機能障害は一部のCOVID-19患者の呼吸器症状と関連している。
SARS-CoV-2感染後の末梢神経系の病変には、無呼吸、意識障害、ギラン・バレー症候群(GBS)重症筋無力症、筋肉痛、横紋筋融解症、筋消耗、および重症患者ミオパシーが含まれる [4,43]。Rifinoらは、神経学的症状を有するCOVID-19患者137人を対象としたレトロスペクティブ研究を実施し、末梢神経系病変を有する患者は、精神状態の変化や脳血管障害を有する患者と比較して、重度の急性呼吸窮迫症候群を発症する頻度が高いことを明らかにした [26]。COVID-19患者の急性呼吸不全には呼吸神経および/または筋肉が関与していることを支持する強い証拠が存在する。
横隔膜は主要な吸気筋であり、その異常は咳と痰に影響を与え、呼吸量の著しい減少をもたらす [90]。句膜神経はC3~C5レベルの脊髄運動ニューロンに由来し、C1~C2レベルを横断する脊髄下行経路によって制御されている。横隔膜を制御する神経回路の損傷は呼吸力学の急速な悪化を引き起こす[91]。これを裏付けるように、MaurierらはCOVID-19を有する58歳の女性患者を報告しているが、この患者は発症時に発熱、geusia、anosmiaを示し、急速に進行性の呼吸困難を呈している。特筆すべきは、この患者は心臓、胸膜、肺実質、肺の異常を示さず、クレアチニンリン酸キナーゼ値も正常であったことである。Borroniらは、焦点性横隔膜ミオクローヌスを有する2人のCOVID-19患者を報告している[93]。脳波(EEG)では、1例では中枢神経系の構造的損傷は認められなかったが、2例では脳内に横向きの周期性放電が認められた。興味深いことに、周期性放電はこの患者の横隔膜ミオクロニー運動と密接に関連していた。
横隔膜筋力低下はCOVID-19のGBS患者で広く報告されており、その中のかなりの数が重度の呼吸不全を発症していた [94]。Rajdevらは、COVID-19関連のGBSと診断された36歳の男性を報告した [95]。胸部画像検査では肺病変は回復していることが示されたが、彼は大腿骨麻痺による神経筋力低下のために急性呼吸不全を発症した。GBS患者は通常、横隔膜脱力症を併発しており、これが肺底部の無気孔症を引き起こし、肺コンプライアンスの低下と肺内シャントの増加をもたらす。これらの変化は肺感染症と相まって、COVID-19患者では肺容積の著しい低下と低酸素血症の急速な悪化を引き起こす可能性がある[94]。
横隔膜もまた、重篤な疾患や機械的換気のためにICU患者では頻繁に影響を受けていた[96-97]。急性呼吸不全の患者の多くには必要であるが、侵襲的な機械的換気は、呼吸筋の負荷を部分的または完全に解除し、脳幹の呼吸中枢を沈黙させ、横隔膜の不活性化につながる可能性がある[98-99]。
現在までに、SARS-CoV-2感染が急性神経筋機能障害と関連していることが多いことを示す大量の臨床データがある[5,38]。さらに、神経筋機能障害は、胸部画像所見が軽微なCOVID-19患者における急性呼吸窮迫症候群の重要な原因であることが報告されている[100]。
呼吸器関連神経ループの損傷は、一部のCOVID-19患者における呼吸器症状と関連している。
無感覚および味覚障害は最も一般的な末梢神経系症状である[43]が、SARS-CoV-2感染は化学感覚反射の感度を低下させる可能性があることを示唆している[101-102]。頸動脈/大動脈体および気管支肺C線維は、血液中のCO2,H+およびO2+をモニターする上で極めて重要な役割を果たしているため、これらの構造物の損傷が呼吸困難の感覚の欠如に関与していることが示唆されている[103]。
頸動脈および大動脈小体は動脈の特殊な感覚構造であり、ここにはSARS-CoV-2の細胞内受容体であるACE2も存在する[104]。SARS-CoV-2は、頸動脈および大動脈小体のグロムス細胞に直接侵入するか、または全身の炎症反応および/または血液中の高凝固状態により、間接的にその感覚機能を損傷する可能性がある。しかし、COVID-19患者の1%未満が血中にSARS-CoV-2の検出可能なレベルを示しており[105,106]、頸動脈・大動脈体への感染はまだ確認されていない[58]。
気管支肺C線維の感染は、肺や呼吸気道からの感覚伝達を阻害することで、他の呼吸器ウイルスによって誘発される呼吸不全に寄与することが以前に報告されている[103, 107-108]。しかし、これがSARS-CoV-2感染時に起こるかどうかは不明である。
メカノレセプターおよび化学レセプターは肺および下気道でモニタリングの役割を果たしているが、呼吸反射は主に脳幹にある呼吸中枢によってトリガーされ制御されている。脳幹は多くの重要な構造物で構成されており、呼吸、心拍数、血圧調節、消化などに欠かせない。これらの解剖学的なつながりにより、脳幹は末梢感染部位からSARS-CoV-2の中枢神経系標的に容易にアクセスできるようになっている[1, 109]。これを裏付けるように、Lukiwらは、ヒトの21の異なる脳領域の中で、脳幹におけるACE2の発現レベルが最も高いことを報告している[110]。
脳幹はSARS-CoV[111]やMERS-COV[112]に高感染していることが報告されている。動物実験では、SARS-CoVおよびヒトCoV OC43は、鼻からの曝露後に嗅球に侵入し、その後脳幹を含む中枢神経系に侵入することが示されている[111, 113]。SARS-CoVとSARS-CoV-2の高い類似性を考慮して、我々は以前、脳幹への潜在的な感染がCOVID-19患者の急性呼吸不全に一役買っている可能性を提案した [1-2]。
COVID-19における脳幹の関与に関する臨床的証拠
脳幹の病変の可能性に関連して、神経症状を有する18歳未満のCOVID-19患者を対象とした症例シリーズ研究では、2例(2/18)で構音障害や嚥下障害などの脳幹徴候が報告されている[114]。同様の所見は、いくつかの高齢患者でも報告されている[32, 35, 37]。しかし、COVID-19関連脳脊髄炎または脳症と診断された重症患者では、脳幹反射の欠如または障害がより一般的である[28, 50, 115]。
脳幹の病変は、いくつかのCOVID-19患者における神経画像所見で支持されている。Wongらは、SARS-CoV-2感染後に急性脳幹機能障害を発症した英国の40歳男性を報告している[116]。この症例ではMRIスキャンで脳幹の炎症性変化が明らかになった。Virhammarらは、急性壊死性脳症を発症した55歳女性を報告した[28]。この患者の脳脊髄液サンプルはSARS-CoV-2陽性であった。MRIスキャンでは、脳幹を含むいくつかの脳領域の異常変化が明らかになった。今日までに、脳幹の異常な画像変化は、GBS [117]、壊死性脳症 [10,28]、および脳脊髄炎 [118-121]を有するCOVID-19患者で広く報告されている。
前述したように、COVID-19を有する多くのICU患者は、たとえ肺感染症が回復していても、侵襲的機械換気を撤回することは困難である[65, 80-81]。これに関連して、Koutroumanidisらは、COVID-19関連脳症を有するICU患者13人中5人にアルファ昏睡の脳波パターンがあることを発見した[122]。アルファ昏睡は典型的には脳幹網状体に位置する病変と関連している [123]。したがって、COVID-19の重症患者におけるα昏睡の発生率が比較的高かったことは、脳幹の損傷が侵襲的機械換気が困難であった重要な理由である可能性を示唆している[122]。
考えられるメカニズムとして、嗅神経上皮内の神経終末は、SARS-CoV-2が脳幹に感染するためのエントリーポイントと考えられている[106]。一貫して、COVID-19関連の嗅覚機能障害のメカニズムは、急性風邪患者とは明らかに異なることが報告されており、少なくともある程度は中枢神経系レベルでの特異的な関与を反映している可能性がある[124]。
Eliezerらは、鼻閉塞を伴わない急性嗅覚機能低下を呈したCOVID-19の女性患者を報告している。この患者では、CTとMRIの解析により、嗅覚裂に両側性の炎症性閉塞が認められた[125]。死後脳MRI研究では、CoolenらがCOVID-19患者19人中4人に非対称な嗅球を報告した[126]。
レトロスペクティブなコホート研究では、Linらは、MRI検査を受けたCOVID-19患者51人のうち26人(51%)に、頭蓋神経異常(6人)および重篤な疾患に関連した微小出血(3人)を含む中枢神経系の急性または亜急性の所見が認められたと報告している。注目すべきは、4人の患者が嗅球シグナルの異常な増加を示したことで、嗅神経炎を示唆しており、これらの患者が経験したアノスミア(嗅覚脱失)に関連している可能性があることである [127]。
前向き研究では、LuらがMRIを用いてSARS-CoV-2感染から回復した60人の患者の脳を評価したところ、これらの患者では嗅覚皮質の体積が有意に増加していることがわかった[52]。注目すべきは、41人の患者(68.33%)がSARS-CoV-2感染中に神経症状を示し、30人(50%)は感染から3カ月後に回復したにもかかわらず神経症状が残っていたことである。
COVID-19における脳幹の関与に関する剖検証拠
最近、SARS-CoV-2感染後の脳幹の関与を示す説得力のある証拠が死後の研究で報告されている [44]。公開されている剖検研究では、134例中78例で脳幹に神経病理学的変化が観察されており、その中には脳幹に血管事故を起こした18例[54-55,58,128,129-130]、脳幹に低酸素障害を起こした15例[37,54,56,63]、および脳幹に微小膠原病/リンパ球浸潤を起こした65例[36-37,56-57,62-63]が含まれていた。これらの症例の中には、これらの神経病理学的変化のうち2種類以上を有するものもあった。脳幹からはSARS-CoV-2 RNAが16/49例(32.7%),ウイルス性タンパク質が18/71例(25.3%)で検出された。SARS-CoV-2の陽性検出率は、脳幹に微小膠原病および/またはリンパ球浸潤を認めた患者では、脳幹に血管事故または低酸素血症病変を認めた患者と比較してはるかに高かった[32,37,54,56,60-61,131]。
脳幹に関する最初の剖検研究は、Bulfamanteらによって2020年5月13日にオンラインで発表された[131]。この研究では、COVID-19で死亡した54歳の男性が、嗅神経から脳幹への経路に沿った神経組織に重度の変性を認めた。その後、von Weyhernらは 2020年4月にCOVID-19患者6人の脳幹についてより詳細な死後調査を行った[63]が、調査した4例すべてにおいて、脳幹に神経変性が広範囲に認められた。2つの研究では神経組織にSARS-CoV-2は検出されなかったが、脳幹の優勢な浸潤は低酸素血症や出血だけに起因するものではなかった。
SARS-CoV-2の脳幹への直接浸潤は 2020年6月の3件の剖検研究で報告されている[32, 60-61]。Meinhardtらは、ドイツのベルリンで32人のCOVID-19患者を対象に剖検研究を行い、23例中4例でSARS-CoV-2 RNAを脳幹内に検出した[32]。MenterらはスイスのCOVID-19患者21人を対象に剖検調査を行い、4例中4例で脳幹からSARS-CoV-2 RNAを検出した [60]。Solomonらは米国ボストンで18人の患者を対象に剖検調査を行い、18人中3人の患者の脳幹からSARS-RNAが検出された[61]。
10月5日、MatschkeらはLancet Neurology誌にCOVID-19患者43人の脳幹の剖検研究を発表した[37]。この患者のうち37人(86%)は、評価したすべての脳領域でアストログリア症および/またはミクログリア症を含む異常変化を示したが、ミクログリアの活性化とリンパ球浸潤は脳幹と小脳で最も重篤であった。SARS-CoV-2 RNAは、4人の患者の脳幹を含む40人中21人(53%)の脳で検出された。免疫組織化学染色の結果,SARS-CoV-2のヌクレオカプシドタンパク質が延髄の神経細胞や下脳幹に由来する頭蓋神経に存在していることが明らかになった。
いくつかの研究で、中枢神経系におけるSARS-CoV-2の存在は、さまざまな検出技術を用いて確認されている[31-32, 37]。しかし、いくつかのケースでは、PCR検査で得られた陽性の結果が、同じサンプルを用いたin situハイブリダイゼーションまたは免疫組織化学では裏付けられないことがあった [54, 61]。興味深いことに、PCR検査が陰性であったかなりの数の患者では、SARS-CoV-2は免疫組織化学で同じ脳領域で検出可能であった[37]。
SARS-CoV-2の脳幹感染は動物実験でも支持されている。北米で最も研究されている哺乳類であるシカマウスは、そのACE2受容体がSARS-CoV-2結合に重要な20の残基のうち17の残基を共有しているため、SARS-CoV-2に感染しやすい。COVID-19患者で報告されているように、SARS-CoV-2の経鼻接種は、シカマウスにおいて呼吸器感染、消化器感染、および神経学的感染を引き起こした[132]。感染したシカマウスの中枢神経系では、SARS-CoV-2抗原が嗅球や脳幹を含む様々な脳領域で検出されている。
したがって、剖検および動物実験の両方で、脳幹がSARS-CoV-2の主要な中枢神経系標的の1つであることが示されており、これがCOVID-19患者の一部で呼吸機能が異常に急速に悪化した主な理由である可能性がある。現在利用可能な証拠は、SARS-CoV-2が、嗅神経、三叉神経、舌咽神経、迷走神経を含む複数の神経経路を介して逆行性に脳幹に侵入することを示している[37,132]。
SARS-CoV-2の神経侵襲性を認めることの意義
1960年代後半に発見されて以来、CoVのヒトへの感染能力は国際的な医学界では無視されてきた[133]。SARS-CoVとMERS-CoVによって引き起こされた2つの予期せぬCOVIDパンデミックは、CoV感染症に対する人々の関心を想起させるが、CoVの神経侵襲的な性質は、過去20年間、まだ十分に注目されていない。SARS-CoVやMERS-CoVとは異なり,SARS-CoV-2の世界的な急速な感染拡大は,公衆衛生にとって緊急かつ深刻な脅威となっている.
SARS-CoV-2と対をなすものとして、SARS-CoV感染の病態はまだ十分に理解されていない[134]。同様に、SARS-CoV-2の包括的な理解も不足している。したがって、SARS-CoV-2の神経侵襲性を理解することは、SARS-CoV-2感染症の予防、治療、および予後にとって非常に重要である。
COVID-19の発生時には、神経症状を有するICU患者の死亡率が、神経症状を有しない患者よりも高いことが報告された[135]。同様に、SARS-CoV-2の神経侵入により、感染動物の死亡率が劇的に上昇したことが実験的に示されている[136]。このことを考えると、ヒトにおけるSARS-CoV-2感染は、治療を行わずに発症させてはならない。逆の例として、一部の病院ではICU患者の3分の2が自宅からの直接入院であったという報告がある[137]。
ワクチン接種が最善の選択肢と考えられている。しかし、有効なワクチンができる前に、マスクを着用することは、気道や肺から中枢神経系へのウイルスの侵入を防ぐため、SARS-CoV-2感染に対する簡単で効果的な対策であることは間違いない[138]。
ニューロン内のウイルスは、特に感染の初期段階では、免疫系のモニタリングから逃れることができることが知られている。最初に感染したニューロンは最終的にアポトーシスになるか、免疫細胞によって除去されるが、その前にウイルスの子孫が他の健康なニューロンに広がっている可能性がある。CoVの神経細胞間の伝達は、中枢神経系からウイルスを完全に排除することを困難にしている[139]。したがって、SARS-CoV-2の中枢神経系感染は、できるだけ早く抗ウイルス治療を行うべきである。
COVID-19患者で臨床的に使用されているクロロキンおよびヒドロキシクロロキンは、限定的な中枢神経系への浸透性を示すことが報告されている[140]。これらの薬剤はACE2のグリコシル化を阻害するため、ACE2とSARS-CoV-2のスパイク蛋白質との相互作用を阻害する。また,エンドサイトーシスとそれに続く小胞輸送は,エンドソームのアルカリ化によって阻止される[141].
COVID-19のパンデミック中、アダマンタン(メマンチンはアダマンタン誘導体)で治療された患者が臨床疾患を発症しなかったことに気付いた研究者もいた[142]。これらの患者では、アダマンタンは当初、多発性硬化症やパーキンソン病などの基礎となる神経障害の治療に使用されていた。アダマンタン類は、SARS-CoVタンパク質Eによって形成された細孔に結合し、SARS-CoV感染のリソソーム相を阻害することで抗ウイルス能力を有することが知られている。また、血液脳関門を貫通することから、中枢神経系でのSARS-CoV-2の複製に対する抗ウイルス作用が期待されている。
これまでの研究では、チューブリンの重合を阻害すると、感染した末梢神経に沿ったポリ骨髄炎ウイルスの逆行性軸索輸送が阻害されることが報告されている[143]。したがって、血液脳関門を伝染する能力を有する微小管関連阻害剤が、神経系におけるSARS-CoV-2感染を阻害する候補として考えられる可能性がある[106]。
中枢神経系での複製後、子孫ウイルスは宿主ニューロン細胞からエキソサイトーシスされ、エンドサイトーシスによって次のニューロンに侵入した[144]。COVID-19に対して利用可能な治療法の一つは、血漿中の抗SARS-CoV-2抗体の投与である。興味あることに、ウェストナイルウイルスに関する以前の研究では、中和抗体がウイルスがニューロンからニューロンへと拡散するのを防ぐことができることが示されている[145-146]。
現在までに、SARS-CoV-2の中枢神経系感染を阻止するために試験可能ないくつかの候補薬がある[140,147]。作用部位に応じて、神経向性ウイルスに対する薬剤は、それぞれウイルスの侵入、輸送、複製、放出を阻害するという少なくとも4種類に分けられる。SARS-CoV-2の神経毒性に関しては、脳感染症の治療には薬剤の中枢神経系への浸透能力が重要な要素となる。しかし,ある種の抗ウイルス薬だけでは感染を止めることができない場合があることに注意が必要である。例えば、ウイルスの輸送を阻害しても、ウイルスの再分布や複製を変えることはできない。したがって、中枢神経系におけるウイルスのライフサイクルの異なる段階を阻害するために、2種類以上の抗ウイルス薬を併用することが推奨される。
HCoV-OC43に関する実験的研究では、CoV RNAの存在は、生存していた感染マウスの脳内で急性毒性を示すことなく、少なくとも1年間持続する可能性があることが示されている[148]。このことは、CoVが宿主の中枢神経系内で持続感染を確立し、長期的な障害のリスクを有意に増加させることを示唆している[149]。この仮説と一致するように、急性SARS-CoV-2感染から回復した一部の患者では、神経精神医学的または神経認知障害が報告されている[150]。注目すべきは、髄膜炎・脳炎の最初の症例として確認され[24]、COVID-19で回復した日本人の若い男性が、逆行性健忘症を発症し、自身の感染時に何が起こったのかを思い出せないことが判明したことである[151]。
SARS-CoV-2感染による神経系への影響は長期に及ぶ可能性があるため、退院後の神経学的変化をフォローアップし、適切な神経リハビリテーション策を立案する必要がある。