Neuroinvasion, neurotropic, and neuroinflammatory events of SARS-CoV-2: understanding the neurological manifestations in COVID-19 patients
link.springer.com/article/10.1007%2Fs10072-020-04575-3
要旨
呼吸器ウイルスは、ヒトの上気道に感染し、特に脆弱な集団において重篤な疾患を引き起こす日和見病原体である。ウイルスの中には神経侵襲性を持ち、脳内の免疫反応を活性化させるものがある。これらの免疫イベントは神経保護作用を持つ場合もあれば、一部の神経変性疾患に見られるような長期的な損傷を引き起こす場合もある。
新しい「重症急性呼吸器症候群コロナウイルス2」(SARS-CoV-2)は、神経学的症状を含む「重症急性呼吸器症候群コロナウイルス」(SARS-CoV)や「中東呼吸器症候群コロナウイルス」(MERS-CoV)で報告されているものと臨床的に類似している呼吸器ウイルスの1つで、高度急性致死性肺炎コロナウイルス症2019(COVID-19)を引き起こしている。
SARS-CoV-2による神経障害の可能性を検討するためには、ウイルス感染に対する脳内免疫反応とその短期的・長期的な影響を理解する必要がある。SARS-CoVとSARS-CoV-2の類似点を考慮すると、SARS-CoV-2がヒトおよび動物モデルで示されたSARS-CoVと同様の短期および長期の神経障害を引き起こす可能性のある神経侵襲性および神経炎症イベントを有するのではないかという疑問が生じてくる。
SARS-CoV-2によって引き起こされる神経学的症状を説明するために、18%が脳症、脳炎および脳血管障害、急性骨髄炎、およびギラン・バレー症候群を含む神経学的症状および合併症を有していた765人のCOVID-19患者の文献レビューを提示する。
臨床研究では、COVID19患者で最も頻度の高い症状として無嗅覚または部分的な嗅覚の喪失が記述されており、嗅覚機能障害と初期の超絶的な免疫反応が予後因子である可能性が示唆されている。
序論
中枢神経系(中枢神経系)のウイルス感染に関するレビューにおいて、Koyuncuらは、ウイルス因子(特定の病原性遺伝子の変異)と宿主因子(免疫抑制、年齢、および併存疾患)に依存して、すべてのウイルスが適切な条件下で中枢神経系に到達しうると結論づけている[1]。
ウイルスによる呼吸器疾患は,高い罹患率と死亡率を特徴とし,公衆衛生上の重要な問題と考えられている[2,3,4].いくつかのヒト呼吸器ウイルス(コロナウイルスCoVを含む)は、神経侵襲性および神経刺激性であり、脆弱な集団における神経病理学的な結果をもたらす可能性がある。
ウイルス感染症患者に見られる神経学的症状は、中枢神経系のウイルス感染に対する免疫反応として、プロ炎症性および抗炎症性サイトカインを含む「サイトカインストーム」として知られているものによって引き起こされる。
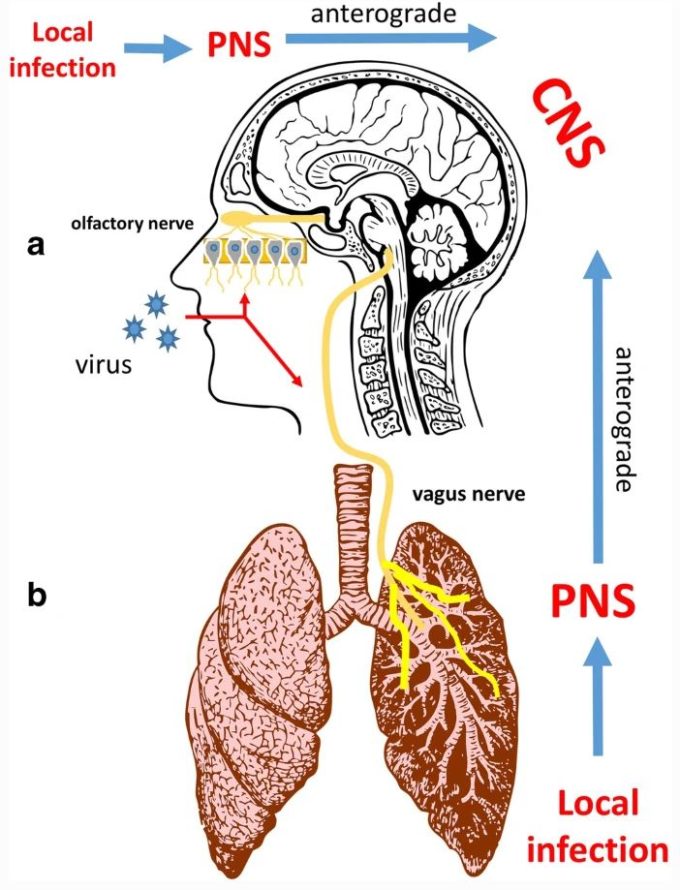
このような感染に対する過剰な反応は、髄膜炎、脳炎、髄膜脳炎、または死に至る可能性がある。SARS-CoV 2によるCoVID-19パンデミックは、気道感染を起こすヒト呼吸器ウイルスであり、神経侵襲性や神経刺激性の能力を示すSARS-CoVと同様に肺炎や呼吸不全を引き起こす可能性がある(図1)。
図1
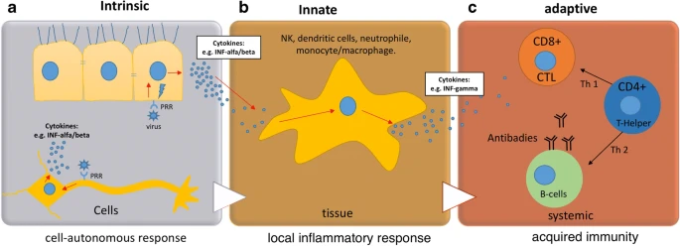
図1 ウイルス感染症の免疫制御 神経侵襲、神経炎症、ミクログリア活性化
中枢神経系は、外部の多層障壁、血液脳関門、および効果的な免疫反応により、ほとんどのウイルス感染から高度に保護された器官である。しかし、いくつかのウイルスは、神経系への侵入は宿主または病原体にとって選択的に有利ではないが、血行性または神経細胞の逆行性ルートを介して中枢神経系に侵入することができ、その結果、衰弱をもたらす直接的な免疫介在性の病理学的病理学的病理学をもたらす。
ウイルスは、組織内の神経終末に直接感染し、軸索輸送機械を用いて中枢神経系へのアクセスを得る(図2および3)[1]か、あるいは循環系の細胞に感染し、最終的に血液脳関門(BBB)を通って中枢神経系へと感染を運ぶことによって、中枢神経系または中枢神経系に感染する。
血行性ルートでは、いくつかのウイルスは、BBBの内皮細胞や脈絡叢叢の上皮細胞に感染し、したがって、血液-脳脊髄液関門を破り、神経細胞組織に侵入するか、または白血球をベクターとして使用して中枢神経系内に伝播する [1]。ウイルスがこれらの物理的障壁を抜け出して中枢神経系に侵入すると、最初の防御手段はミクログリアの活性化であると考えられている。
図2
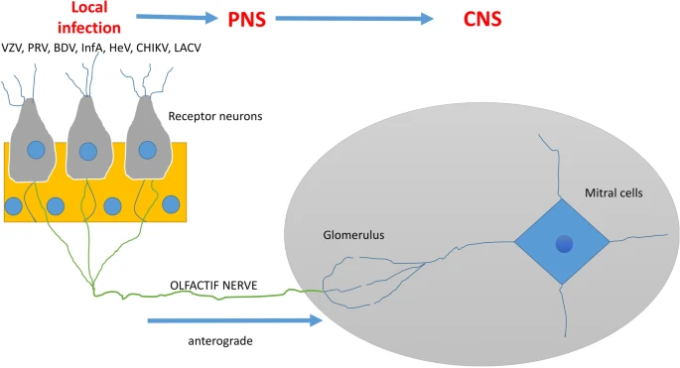
図2
いくつかのウイルスは、鼻の嗅覚上皮のニューロン受容体に感染して中枢神経系に広がり、嗅覚神経に沿った軸索輸送によって脳に到達する。
図3
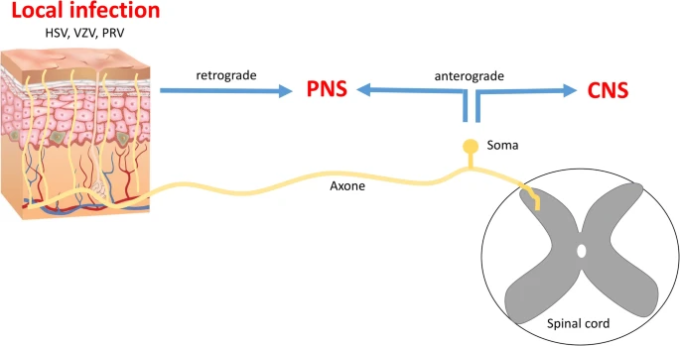
図3
呼吸器ウイルスの中には、肺から迷走神経を介して中枢神経系に広がるものもある。
ミクログリアは脳内に存在する単核食細胞であり,健康な中枢神経系の中では非常に異質な細胞である [5].これらの細胞は、脳の全細胞集団の約10%を占めている [6, 7]。活性化されたグリア細胞の存在は神経病理を示すものであり、脳損傷や神経炎症性イベントのマーカーと考えられている[8]。
しかし、神経炎症は、サイトカイン、神経栄養因子の分泌、細胞外マトリックスリモデリングのためのプロテアーゼの活性化などにより、二次的な損傷のメディエーターと考えられてきた。現在では、全身の自然免疫系の分子や、直接影響を受けた神経細胞集団が脳内のミクログリアを活性化し、神経炎症イベントを開始することがわかっている。
ミクログリアは、脳内の炎症反応や免疫反応を司る唯一の細胞ではないが、それにもかかわらず、環境の変化に迅速に反応することができる。最近では、脳内に常駐しているグリア細胞が、神経細胞の損傷を引き起こす攻撃的なエフェクター細胞に変化しうることを示す証拠が増えてきている[9]。
したがって、ミクログリアは、ウイルス感染に応答して放出されるプロ・抗炎症性サイトカインと抗炎症性サイトカインの相互作用によって、短期的な神経保護を与えるか、あるいは長期的な神経変性を引き起こす可能性がある。
ウイルス感染と神経炎症は神経変性疾患の引き金となる
ウイルスは、直接的な細胞溶解作用または二次的な炎症反応(間接効果)によって、脳機能障害や神経細胞の損傷を引き起こす可能性がある[10]。神経刺激性ウイルスは、中枢神経系へのアクセスを得るために宿主の免疫監視を逃れるメカニズムを開発してきた。
ウイルスに対する全身性および局所的な炎症反応は、神経細胞損傷の潜在的な原因となる。神経細胞の一次感染は急性細胞機能障害を引き起こし、致死的な脳脊髄炎を引き起こす可能性がある [11]。活性化されたミクログリアは、放出されたサイトカインおよびケモカインの主な寄与者であると考えられてきた。
しかし、最近では、神経細胞が、脳内の自然免疫応答を調節するために、免疫系に対する免疫受容体の役割を果たすことができる特定の分子を発現していることを示す証拠がある[12]。また、これらの分子は、神経細胞のネットワークやシナプスの神経可塑性や組織化にも大きな役割を果たしている。
ウイルス感染時に自然免疫受容体を用いて神経細胞が自律的に活性化されると、神経可塑性が損なわれ、その後の神経機能障害の引き金となる可能性がある。さらに、ウイルス感染によって誘発される炎症性イベントは、軸索輸送およびシナプス伝達に関連するタンパク質の発現の変化を含む、初期の神経変性疾患で観察されるものと類似性を示している([13][14])。
自己免疫性脳脊髄炎(多発性硬化症)の動物モデルでは、炎症は樹状突起棘を標的とし、シナプス変性を引き起こす[15]。さらに、シナプス機能障害は、典型的にはアルツハイマー病の発症初期にも起こる[16]。
したがって、ウイルス感染によって引き起こされる炎症反応は、特に、免疫反応を調節するエピジェネティックな違いや、個人の遺伝的構造や感染症への感受性の結果として、神経変性疾患のリスクを既に有している個人において、神経変性を引き起こす可能性がある[17]。
感染神経系における呼吸器ウイルスの特殊性
呼吸器同期ウイルス(RSV)[18, 19]、ヘニパウイルス([20, 21])、インフルエンザA・B([22])、エンテロウイルスD68[23]などの呼吸器ウイルスも血液中に存在することがあり、神経侵襲性であるため、血行性ルートを利用して中枢神経系に到達することがある。これらの呼吸器ウイルスは、嗅神経(図3)を利用して脳に到達することもある[1, 24, 25]。さらに、これらのウイルスのいくつかは、鼻腔内の侵害受容性神経細胞を標的とし、三叉神経を利用することにより、他の末梢神経を利用することができる[26、27]、または他のケースでは、気道の異なる器官の迷走神経の感覚線維を利用することができる[18、28]。
いくつかのウイルスは鼻嗅上皮のニューロン受容体に感染して中枢神経系に広がり、嗅神経に沿った軸索輸送を介して脳に到達する。
一部のウイルスは、嗅覚神経系の偽双極性感覚ニューロンに感染した後、前向性軸索輸送を経て中枢神経系に到達することで拡散する。
インフルエンザウイルス(IV)は、呼吸器感染症における最も関連性の高いウイルス病因因子である。いくつかの研究で、インフルエンザAが小児および成人の両方で神経学的合併症と関連しうることが示されている[29,29,31]。インフルエンザA感染に関連したいくつかの神経学的病態は、脳炎[32]、ギラン・バレー症候群[33、34]、熱性発作[35]、急性壊死性脳症、およびおそらく急性播種性脳脊髄炎(ADEM)[36]を含む文献で報告されている。
動物モデルでの研究では、インフルエンザウイルスの侵入経路は鼻腔内の嗅覚経路か肺の迷走神経の感覚神経細胞であることが示されている(図4)。このように、インフルエンザAウイルスは海馬や神経伝達の調節を変化させることで、長期的な後遺症として認知や行動に影響を与える可能性がある[18,37,38,39,40]。また、インフルエンザAウイルスに関連した研究では、パーキンソン病(PD)などの神経変性疾患を発症するリスクがあることが示されている[41]。
図4
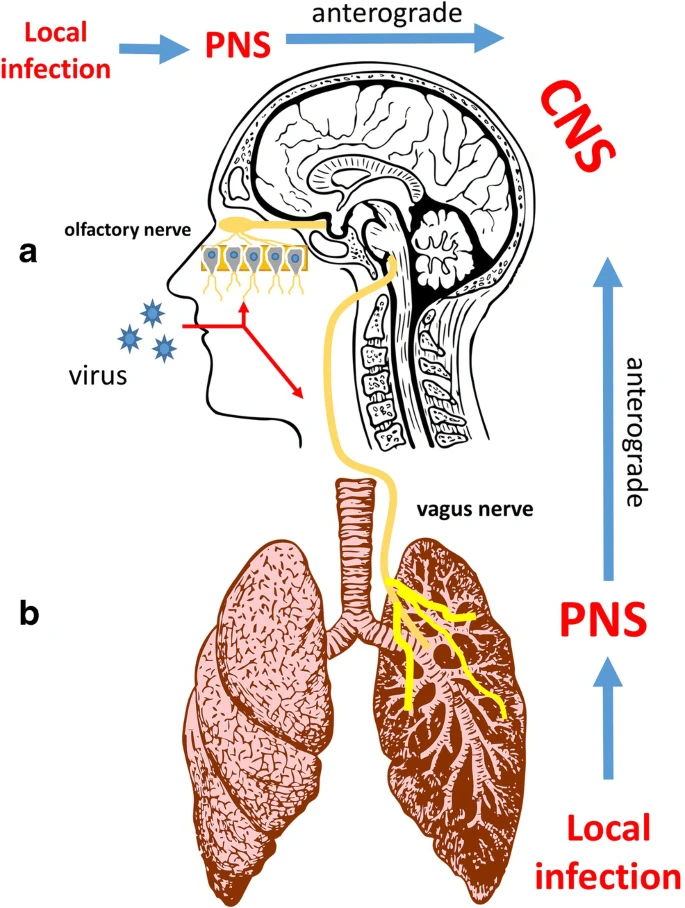
図4
a いくつかのウイルスは、鼻の嗅覚上皮のニューロン受容体に感染して中枢神経系に広がり、嗅覚神経に沿った軸索輸送によって脳に到達する。
コロナウイルスCoVは、コロナウイルス科およびニドウイルス科に属する非分割ポジティブセンスRNAウイルスのグループであり、4つの亜科を有する。AlphaCoV(ACoV)、BetaCoV(BCoV)、DeltaCoV(DCoV)、およびGammaCoV [42]。CoV-OC-43およびCoV-229Eは、ヒトにおいて病原性があると記載されており、2つのベータコロナウイルス(BCoV)のパンデミックの原因となっている:中東呼吸器症候群(MERS-CoV)[43、44]、および重症急性呼吸器症候群(SARS-CoV)[45、46]。
WHOは2019年12月、中国湖北省武漢市で原因不明のウイルス性肺炎患者が続発していると宣言した(WHO Novel coronavirus report January 19, 2020)[47]。呼吸器サンプルからのシークエンス解析により、2019年新規コロナウイルス(COVID-19)と命名された新規コロナウイルスが確認された。
SARS-CoVおよびMERS-CoVの最後の終末期には、CoVが心筋炎、重度の下痢、および多臓器不全として最も一般的な小児の肺外病理を引き起こす可能性があることが示された([48,49,50,51,52,53])。いくつかの研究では、CoVの神経刺激性および神経侵襲性が、血行性または神経細胞の逆行性ルートを介して、多発性硬化症や脳脊髄炎などの神経疾患を引き起こすことが報告されている([3, 54, 55, 56]);それにもかかわらず、CoVの中枢神経系への感染能力はよく知られていない([57, 58])。
1980年、BurksはMS患者の剖検で中枢神経系にCoVを検出した最初の研究者である([59])。2000年には、Arbourらが、さまざまな神経疾患、特にMS患者からの一連の剖検サンプルにおいて、67%の症例がCoV陽性であったことを報告した。2003年、Hungらは、神経学的症状を伴うSARS-CoV感染症の最初の症例を報告した[60]。Lauらは、SARS-CoV感染症の32歳女性の脳脊髄液サンプルからウイルス遺伝物質が検出されたことを報告している[54]。SARS-CoVで死亡した患者の剖検サンプルでは、SARS-CoVの臓器播種が報告されている。剖検では、小腸、肝臓、汗腺、副甲状腺、胃、腎臓、下垂体、大脳にウイルスRNAとSARS-CoV-Nタンパク質の存在が確認され、SARS-CoVの全身感染を誘発する能力が確認された[61]。
さらに、SARS-CoV-34またはMERS-CoV-13を経鼻的に感染させたトランスジェニックマウスでは、脳の一部の特定領域(視床および脳幹)でウイルスが検出されたことが実験的に示されている[62]。いくつかの研究では、MERS-CoVウイルスは脳のみで検出され、肺では検出されず、高い死亡率を示した[62]。興味深いことに、脳幹はSARS-CoV-34、35、またはMERS-CoVのいずれかに最も多く感染した部位であった[62]。
CoVは神経栄養学的な能力を持つ呼吸器ウイルスであり、免疫応答を回避し、感染に伴う神経学的合併症を引き起こすことを可能にする。中枢神経系に到達するメカニズムと経路は十分に解明されていないが、嗅覚経路と頭蓋神経が中枢神経系への侵入の最も妥当な説明である。
COVID-19患者におけるSARS-CoV-2感染神経系
SARS-CoVおよびMERS-CoVは、COVID-19患者のSARS-CoV-2による肺炎で報告されているような臨床徴候および症状を有する致死的な急性肺炎を引き起こす[60]。しかし、文献は、SARS-CoV-2の標的が上気道管であるのに対し、SARS-CoVは下気道管を標的としており、これがこれら2つのウイルスの主な違いであることを示唆している。武漢の地方病院で報告されたCOVID-19の一般的な症状は、発熱、乾いた咳、呼吸困難であり、そのほとんどがCOVID-19の特徴的な症状であった([60, 63, 76])。
上述したように、BCoV(SARS-CoV、MERS-CoV、CoV-229E、CoV-OC43)は神経侵襲能力を有しており、神経学的症状が文書化されている([62、64、65])。神経浸潤の経路は十分に確立されていないが、末梢神経末端、特に嗅神経および迷走神経への浸潤が、中枢神経系感染につながる合理的な経路である可能性が高い([62, 65])。
これまでのところ、いくつかの研究でSARS-CoV-2の神経刺激性の直接的な証拠が示されている[66, 67]。SARS-CoV-2とSARS-CoVはともにACE2受容体に結合してヒト細胞にアクセスする[68]。構造的な類似性と標的受容体のため、多くのSARS-CoVが媒介する病態はSARS-CoV-2にも当てはまる可能性がある。
複数の研究により、SARS-CoVの神経ウイルス性および神経栄養症に関する強力な証拠が提供されている[69]。いくつかの症例報告研究では、強直間代発作を呈したSARS患者の脳脊髄液サンプルがSARS-CoVに陽性であったことが示されており、SARS-CoVによる中枢神経系への感染の可能性が示唆されている[54]。
さらに、JunらはSARS患者の脳組織標本からSARS-CoVを分離し、脳組織の病理学的検査で神経細胞の壊死とグリア細胞の過形成を示した [70]。8例のSARS患者の剖検研究では、全例の脳組織からウイルス粒子とそのゲノム配列が検出された。そのうち6例は神経細胞の浮腫と散在性の赤色変性を呈していた[53]。
これと一致する動物モデルでは、ヒトACE2受容体(hACE2マウス)のトランスジェニックマウスでは、脳がSARS-CoVの主要標的臓器であることが示唆されている[71]。SARS-CoVにおける神経ウイルス性および神経浸潤のこれらの知見は、SARS-CoV-2の神経栄養学的特性の強力な状況証拠を提供する可能性がある。
SARS-CoVとSARS-CoV-2の類似性
SARS-CoVとSARS-CoV-2の病態の類似性がますます明らかになってきている。最近の研究では、SARS-CoVとSARS-CoV-2のゲノム配列の相同性は79.5%であり[131]、コウモリコロナウイルスとの遺伝的類似性は96%にも達している[72]。
比較を目的としたSARS-CoVとSARS-CoV-2の相同性と系統解析に基づく研究では、Zpictureを用いたSARS-CoV-2とSARS-CoVの比較ゲノム解析において、Blastを用いたタンパク質配列から、SARS-CoV-2のタンパク質のほとんどがSARS-CoVウイルスのタンパク質と高い相同性(95~100%)を示すことが示された。SARS-CoV-2とSARS-CoVのゲノム配列は、ヌクレオチドレベルで高い相同性を有しており、SARS-CoVとSARS-CoV-2の間のゲノム配列の差(RD)はわずか6領域であった[73]。
SARS-CoV-2のヌクレオカプシドタンパク質は、SARS-CoVのそれと~90%のアミノ酸同一性を共有している[74]。さらに、SARS-CoV-2のスパイク茎S2は、2つのコウモリSARS様CoV(bat-SL-CoVZXC21およびbat-SL-CoVZC45)およびヒトSARS-CoVのそれと99%同一である[127]。
SARS-CoVにおける神経侵襲能力は、コロナウイルスの共通の特徴として報告されている。このことから、理論的にはSARS-CoV-2も同様の神経原性を有する可能性が高いと結論づけられる。SARS-CoV-2の感染過程の年表には、感染後5日後の症状発現が含まれている。高齢の患者や免疫不全の患者では、8~15日後に呼吸不全を発症することがある[76]。これと一致するように、SARS-CoV-2は末梢神経末端への侵入に十分な潜伏期間を有しており、その結果、中枢神経系への侵入をもたらす。
COVID-19患者におけるSARS-CoV-2の神経学的症状
現在までにCOVID-19患者におけるSARS-CoV-2の神経学的症状を記載した報告は6例のみであり(表1)、756例中173例に神経学的症状が認められた。中国WHANでのCOVID-19患者214例の症例報告では、急性脳血管障害や意識障害などの神経学的症状が全患者の36.4%にみられ、重篤な合併症を伴う患者の約88%(78/88)にみられた([125])。
Moriguchiらは、血行動態が安定しているグラスゴー昏睡尺度6の一過性全身性発作で入院した24歳の男性を報告した。9日以前に頭痛、全身倦怠感、発熱を感じていた。鼻咽頭スワブと脳脊髄液を用いてSARS-CoV-2のRT-PCR検査を行った.ウイルス核酸は脳脊髄液から検出されたが、鼻咽頭スワブからは検出されなかった。この患者は、SARS-CoV-2感染による髄膜脳炎と診断された[125]。
表1 COVID-19患者765例の文献レビューでは、18%が脳症、脳炎および脳血管障害、急性骨髄炎、ギラン・バレー症候群を含む神経学的症状および合併症を有していた。
原文参照
北京大丹病院では、Xiangらは、臨床的にウイルス性脳炎を呈したCOVID-19患者の脳脊髄液中にSARS-CoV-2が存在することを確認している[78]。
同様に、Mingxiangらは、ウイルス性髄膜脳炎を呈したSARS-CoV-2患者の脳脊髄液中にSARS-CoV-2が検出されたという同様の観察結果を報告している。
SARS-CoV-2は脊髄を損傷し、急性骨髄炎を引き起こす可能性もある[75]。Zahraらは、65歳の男性が急性進行性対称性上行性四肢麻痺で入院した症例を報告している。入院5日前に顔面麻痺を両側に認めた。2週間後には咳嗽,発熱,時には呼吸困難を呈した.COVID-19のRT-PCRは陽性であった.この研究では、COVID-19に感染した患者のギラン・バレー症候群が報告された2020)[128]。
Huaらは、進行性の両足の脱力感と重度の疲労感を伴って入院した61歳の女性の症例を報告した。武漢から帰国する4日前に発熱、咳、胸痛、下痢を伴わなかった。この患者はSARS-CoV-2感染に伴うギラン・バレー症候群と診断された[129]。
COVID 19 例の患者における嗅覚上皮と嗅覚機能障害
SARS-CoV-2は、COVID-19の感染を促進する重要な因子と考えられている糖タンパク質のスパイクにより感染力が高いことが特徴である。このスパイクは、ウイルスが宿主の受容体に高い親和性で結合することを示している。
最近の報告では、SARS-CoV-2感染の初期マーカーは、嗅覚の無感覚または部分的な喪失(hyposmic)であることが示されている。357人の患者を対象とした研究では、85.6%がSARS-CoV-2感染に関連した嗅覚機能障害を有しており、284人(79.6%)が無感症、73人(20.4%)が低感症であった[79]。
この症状は、嗅上皮に位置する嗅覚受容体ニューロンへの直接的な損傷と考えられる。さらに、嗅覚上皮に位置する細胞(神経細胞および非神経細胞)は、ヒトにおけるSARS-CoV-2の効率的な感染に必要なACE2およびTMPRSS2タンパク質受容体の両方を発現している([80] [81])。いくつかの研究では、TMPRS2タンパク質受容体が神経細胞に発現しており、嗅神経に沿った前向性軸索輸送を介してSARS-CoV-2の脳感染を促進する可能性があることが示されている(図2)[81, 82]。
SARS-CoV-2は、まず、ウイルスが嗅上皮のACE2を発現する高発現の未確認の非神経細胞に侵入し、その後、ACE2を発現する低発現の成熟神経細胞を通過して嗅神経軸索に沿って脳に輸送されると、脳に到達する可能性がある。
動物モデルでは、マイクロアレイ解析によって決定されるように、マウスACE2およびTMPRSS2の発現が加齢とともに増加する傾向があることがいくつかの研究によって示されている[82]。これがヒトでも当てはまるとすると、高齢者では、嗅覚上皮がSARS-CoV-2の蓄積に対してより敏感になっている可能性がある。
嗅覚上皮における神経細胞の抗ウイルス防御免疫応答を理解するために、魚類を用いた最近の研究では、神経細胞がラブドウイルス表面糖タンパク質と結合した後、嗅覚上皮において超低速度の免疫応答を開始することが示されている[83]。
さらに、プロ炎症作用の活性化は、繊毛状樹状突起/相馬へのウイルスの取り込みと、それに続く嗅神経に沿った前向性軸索輸送を阻害し、脳に到達することを示している。その結果、感染した神経細胞はアポトーシスを起こし、嗅覚刺激の開始や無嗅覚を消失させる可能性がある。
以上のことから、嗅覚異常を示すSARS-CoV-2感染者は、SARS-CoV-2感染に対する免疫応答の開始が早く、より強力な患者であると考えられる。注目すべきは、SARS-CoV-2感染に対してより敏感な高齢者では、嗅上皮の神経細胞に変性機能障害が見られることである。これは、高齢者では初期の免疫応答が減衰していることが原因である可能性が高いCOVID-19の症状がより重症化しているという観察と一致している。
COVID-19感染症における解剖学的視点
トランスジェニックマウスを用いた実験研究では、SARS-CoV-34、35またはMERS-CoVが脳内で、脳幹で非常に多く検出された[62]。いくつかの呼吸器ウイルスは、気道のさまざまな器官の迷走神経の感覚線維に感染することで、逆行性ルートで脳に到達することが知られている[18, 28]。
迷走神経核は、脳幹の延髄に位置する曖昧核を含む4つの核からなる [84]。さらに、下脳幹の様々な部位、より具体的には、迷走神経核の腹側、迷走神経背側運動核、後脳領域に位置する中枢呼吸ニューロンネットワークで基本的な呼吸リズムが生成され、呼吸リズムを調節するために生成された運動活動として出力される[85]。
したがって、SARS-CoV-2が迷走神経を介して脳に到達した場合、ウイルスは迷走神経を起点として脳幹に侵入し、迷走神経核および呼吸制御中枢を含む周辺部位に侵入し、肺での一次感染による損傷をさらに悪化させる呼吸機能障害を引き起こす可能性があるという仮説はもっともである。
SARS-CoV-2感染症に関連する神経病理と後遺症
いくつかの研究では、ヒト中枢神経系におけるCoV RNAの持続性が報告されている[86]。実験的研究では、CoVによる急性脳炎を生き延びたマウスでは、野外試験での活動性の低下、海馬の興奮性の低下、それに伴うCA1とCA3の神経細胞の喪失などの長期的な後遺症が認められた[87]。インフルエンザAウイルスやRSV[88,89,90]ウエストナイルウイルス(WNV)に感染した研究でも、CA3で同様の神経細胞の喪失が認められた[91]。
COVID-19の患者は、精神状態の変化を呈した後に壊死性出血性脳炎と診断された。CT画像では両側の内側視床に対称的な低減衰を示し,MRIでは両側視床,島下領域,内側側頭葉に出血性病変が確認された[92]。
24歳の男性の症例報告では、頭痛、全身倦怠感、発熱、全身発作、精神状態の変化を呈し、それが進行して意識障害に至った。臨床検査診断はウイルス性髄膜脳炎であり,脳脊髄液のRT-PCR解析によりSARS-CoV-2感染が確認された.脳MRIでは右中側頭葉,側脳室右壁,海馬に変化がみられた.興味深いことに、RT-PCRのための鼻咽頭スワブ標本はSARS-CoV-2に対して陰性であることが判明したが、これはCOVID-19が神経病因の独立した機序を持っている可能性を意味している[125]。
Xuらは、COVID-19患者の脳組織にSARS-CoV-2による低酸素状態のために浮腫が検出されたことを剖検研究で報告している[73]。このことは、COVID-19患者は、低酸素とウイルスによる感染性中毒性脳症を発症する可能性があることを意味している。この疾患の本質的な病理学的変化は脳浮腫であり、脳脊髄液分析からは炎症の証拠はない[130]。
呼吸器感染が急性脳血管疾患の独立した危険因子であることを示すかなりの量の証拠がある[94、95]。実験マウスモデルは、インフルエンザなどのいくつかの呼吸器ウイルスが虚血性脳損傷を悪化させ、サイトカインストームを誘発して脳出血のリスクを高めることを示唆している[96]。
前述したように、SARS-CoV-2はサイトカインストーム症候群を引き起こし、これがCOVID-19患者が急性脳血管疾患を発症する要因の一つである可能性がある[63、97]。さらに、SARS-CoV-2感染症では、重症患者ではDダイマーのレベルが上昇し、重度の血小板減少を示すことが多く、急性脳血管イベントの可能性が高まる可能性がある[76]。
脳血管疾患とSARS-CoV-2感染症
中国の8つの研究における46,248人の感染患者を対象としたメタアナリシスでは、最も有病率の高い併存疾患は高血圧(17%)と糖尿病(8%)であり、次いで心血管疾患(5%)であったことが示された[77、98]。このことは、COVID-19と脳卒中が類似の危険因子を共有していることを示している。
COVID-19感染の重症度が心血管合併症の存在と直接関連しているという強い証拠がある[99]。武漢で行われたCOVID-19患者214人の症例シリーズでは、14人の患者が脳卒中を発症した。この研究では、心血管リスク因子を有する患者は急性脳血管疾患を発症する可能性が高いと結論づけられた[75]。
同様に、心血管リスクを有するCOVID-19患者4人が脳卒中を発症した。これらすべての患者における血管障害の機序は大血管疾患であった[100]。観察研究では、COVID-19患者221人のうち、5%が急性虚血性脳卒中を発症し、0.5%が脳出血、0.5%が脳静脈洞を発症した。心血管リスク因子を有する高齢の患者で発症率が高かった[101]。
COVID-19と多発性硬化症
多発性硬化症(MS)のような長期的な神経障害の病因はまだよく知られていないが、遺伝的に素因がある人ではウイルス感染が発症に役割を果たしている可能性がある [102,98,99,100,106]。過去数十年にわたり、中枢神経系におけるウイルス核酸、ウイルス、またはウイルスタンパク質の検出、または血清および/または脳脊髄液中の抗ウイルス抗体の存在に基づいて、いくつかのウイルスがMSと関連してきた。1980年、2人の患者の中枢神経系からコロナウイルスが分離されたことで、初めてMSとの関連が示唆された [59]。
それ以来、複数の研究がヒトコロナウイルス(CoV-OC-43およびCoV-229Eを含む)とMSとの関連を示してきた。いくつかの剖検研究では、MS 患者から得られた脳内物質からコロナウイルス様粒子が検出され [107]、他の研究では、マウス神経栄養コロナウイルスに分子的に関連するウイルスが MS 患者の脳組織から検出された [59]。さらに、MS患者では、中枢神経系の感染を示す抗HCoV抗体の髄腔内合成が報告されている[108]。さらに、HCoV RNA は脳内 [109,110,111] および MS やその他の神経疾患(ODD)患者の脳脊髄液から検出された [112]。コロナウイルス抗原もMS患者の脳[109,110]で検出された。
興味深いことに、90人のMS患者の剖検研究では、ウイルスRNAが多数のサンプルに存在していた;全ドナーの48%(90人中44人)が、1つまたは両方のウイルス株(CoV-OC-43およびCoV-229E)に対して陽性であった。HCoV-OC43 RNAは、正常な白質および灰白質だけでなく、MS患者の脳のプラークでも広く検出された。この研究はまた、HCoV-OC43がヒトの中枢神経系の細胞に持続的に感染する能力を持ち、そのような感染は、場合によってはこのウイルスの中枢神経系環境への特異的な分子的適応につながることを示唆している[57]。これと一致するように、動物モデル研究では、コロナウイルスの持続感染は、免疫反応を媒介するメカニズムを介して遺伝的素因を持つマウスの慢性的な脱髄を誘発した[113]。
ウイルス感染がMS様病変のような脱髄疾患を誘発するメカニズムは複数考えられる。脱髄疾患は、オリゴデンドロサイトの溶血感染など、ウイルス感染の直接的な結果として誘発される可能性がある [114]。あるいは、中枢神経系におけるMHV誘発慢性脱髄のように、グリア細胞による細胞障害性分子の発現を介して間接的に媒介される可能性もある。後者では、IL-6、腫瘍壊死因子、インターロイキン1β(IL-1β)、2型一酸化窒素合成酵素[115]、RANTES、サイトカイン応答遺伝子2、マクロファージ炎症性タンパク質1βなどの炎症性分子またはそれらのmRNAが検出された[116]。
HCoV-OC43ウイルスは、非特異的上気道感染後の神経炎症を特徴とする別の脱髄性神経疾患である急性播種性脳脊髄炎(ADEM)[55]の小児の中枢神経系で検出された。病因因子は不明のままであるが、いくつかの研究では、ヒトコロナウイルスがADEMを引き起こす可能性があることが示唆されている。亜急性全脳炎硬化症(SSPE)、進行性の致死的な神経疾患は、また、中枢神経系内の麻疹ウイルスの持続として、ウイルス感染に明確にリンクされている[117]。
オリゴデンドロサイトのウイルス感染は、その正常な機能の変化や細胞溶解を介して脱髄性疾患を引き起こす可能性があるが、これは、進行性多焦点性白質脳症の間にオリゴデンドロサイトの進行性溶解を誘導する再活性化ヒトポリオマウイルスの場合と同様である[118, 119]。ミエリン成分の放出もまた、自己免疫攻撃の引き金となりうる。アストロサイトおよびミクログリアの感染または活性化は、オリゴデンドロサイトにダメージを与える炎症性メディエーターの放出を引き起こし、病理学を悪化させる可能性がある[120,121,122,123]。
CoV-OC-43が感染に対するT細胞反応を伴う脳炎の原因であることが示されている [124]。このことは、呼吸器ウイルス感染患者におけるMS様病変などの長期的な脱髄性神経障害の引き金が免疫応答である可能性を強調している。SARS-CoV-2と系統A群のプロトタイピングコロナウイルスを含むすべてのβコロナウイルスとの系統研究と類似性を考慮すると、ウイルスの遺伝子型自体がウイルス感染に関連したMS様病変の発症に役割を果たす可能性があるとしても、CoV-OC-43やCoV-229EはMS発症の危険因子として考えられると結論づけることができる。
SARS-CoV-2とCoV-OC-43およびCoV-229Eとの類似性、およびサイトカインストームとIL-6、腫瘍壊死因子、インターロイキン1β(IL-1β)および2型一酸化窒素合成酵素の急増を含むSARS-CoV-2感染に対する免疫反応の特徴を考慮すると、SARS-CoV-2がCOVID-19の長期的な結果としてMS様脱髄性病変の原因となることはほぼ確実である。
結論
利用可能なデータに基づいて、呼吸窮迫は、肺の炎症性構造的損傷の結果だけでなく、脳の呼吸中枢でのウイルスによる損傷に起因する可能性が高く、これらの患者の管理をより困難にしている。
いくつかのヒト呼吸器ウイルスは、神経侵襲性および神経刺激性の能力を有し、脆弱な集団における神経病理学的な結果をもたらす可能性がある。神経侵襲の結果と呼吸器ウイルス(コロナウイルスを含む)および中枢神経系との相互作用の基礎となるメカニズムを理解することは、感染の潜在的な病理学的関連性をよりよく理解するために使用できるだけでなく、ウイルスの関与を伴う様々な神経疾患の症状に非常に関連性の高い分子ウイルス-宿主インターフェースの潜在的な引きずりやすさを明らかにするのに役立つ新規診断および介入戦略の設計にも役立つので、不可欠である。