Contents
Neurobiochemical Cross-talk Between COVID-19 and Alzheimer’s Disease
link.springer.com/article/10.1007%2Fs12035-020-02177-w
要旨
人類にとって世界的な脅威であるCOVID-19は、アルツハイマー病を含む複数の疾患と病因的な補因子を共有している。COVID-19とアルツハイマー病との共通点を理解することで、両者に対する治療法を戦略的に検討することが可能となる。
ここでは、COVID-19の薬剤開発の緊急性を考慮して、記憶障害や学習障害に重点を置いてCOVID-19とアルツハイマー病との関連性とその症状を検討した。
COVID-19とアルツハイマー病は、アンジオテンシン変換酵素2(ACE2)受容体とインターロイキン-1(IL-1)IL-6,細胞骨格関連タンパク質4(CKAP4)ガレクチン-9(GAL-9またはGal-9)およびAPOE4対立遺伝子などの炎症性マーカーに関連して共通のリンクを共有している。
このレビューに記載されている共通の病因因子と共通の症状は、COVID-19とアルツハイマー病の両方の治療戦略を開発するのに役立ち、したがって、現在進行中の世界的な脅威を根絶することに影響を与えるだろう。
したがって、COVID-19に苦しんでいる人、あるいはCOVID-19を発症したことがある人、そしてアルツハイマー病発症の危険性がある人、あるいはすでにアルツハイマー病に苦しんでいる人は、恩恵を受けることができるだろう。
はじめに
コロナウイルス疾患2019(COVID-19)は、ヒト呼吸器系を主に攻撃し、中枢神経系(中枢神経系)を標的とし、神経侵襲能力も有する重症急性呼吸器症候群コロナウイルス-2(SARS-CoV-2)によって引き起こされる[1,2]。SARS-CoV2の潜伏期間は5日間であり、COVID-19の主な症状としては、発熱、咳、疲労に続いて、頭痛、呼吸困難、喀血を伴う、またはそれに伴う症状が挙げられる[1, 2]。また、重症例では急性呼吸窮迫症候群、急性心疾患、肺炎、多臓器不全も観察されている[1,2]。COVID-19患者の約25%で中枢神経系の症状が報告されている[3]。また、一部の患者では、精神状態の悪化、せん妄、電解質・代謝異常などが報告されている[3]。
COVID-19の中枢神経系(中枢神経系)疾患の中では、アルツハイマー病が第一位である[4]。アルツハイマー病は、患者の記憶や学習、行動、認知能力に影響を与える神経変性疾患である。アルツハイマー病患者では、アミロイドβ(アミロイドβ)や神経原線維もつれ(NFT)の沈着により、記憶や学習を司る脳領域(特に海馬)が影響を受ける[5]。アルツハイマー病症状はほとんどが60歳以降に出現し、患者は介護者や家族にのみ依存するようになる[5]。
COVID-19の管理は隔離・隔離を必要とするため、アルツハイマー病の管理はCOVID-19の管理とは適合しない[2,3,4]。このように、COVID-19はアルツハイマー病患者、介護者、家族に余分な負担をかけ、国や世界経済にも負担をかけている。
この点で、共通の病因因子を同定することは、COVID-19とアルツハイマー病の両方に対する管理や治療アプローチを戦略的に進める上で、新たな展望を開くことになるだろう。したがって、現在のレビューは、科学者、医療提供者、政策立案者、および一般の読者は、すでに苦しんでいる患者を管理する上で有益であり、また、将来の世代を守ることができるだろうように、COVID-19とアルツハイマー病の間の共通のリンクを解明するために設計されている。
SARS-CoV-2の侵入とアルツハイマー病-COVID-19の発現
SARS-CoV-2 のヒトへの侵入経路としては、神経実質、鼻粘膜、クリブロサ層、逆行性軸索輸送、嗅球などが考えられる[6]。SARS-CoV-2に特徴的な神経刺激性は、スパイク蛋白質を神経細胞およびグリア細胞の両方および毛細血管内皮に存在するアンジオテンシン変換酵素2(ACE2)受容体と結合させることにより、神経組織への浸潤を助ける [6, 7]。肺では、上気道と下気道の上皮が主にACE2を保有している [6,7,8]。一方、中枢神経系の脳幹、毛細血管内皮、心血管系機能調節領域では、ACE2を多く保有している[6,7,8]。他のSAR-COVと比較して、SARS-CoV-2スパイクタンパク質のACE2に対する親和性は10~20倍に増加していることが明らかになっている[8,9]。SARS-CoV-2は、ACE2受容体を迂回して嗅球を利用し、シナプスを介した経路を直接利用している可能性がある[10, 11]。SARS-CoV-2は侵入すると、反応性アストログリア症、ミクログリア活性化、神経炎症性カスケードを刺激する。その結果、全身の炎症により血液脳関門(BBB)が障害され、脳の恒常性の乱れや神経細胞の死につながる [11]。その後の脳幹の感染は、化学感覚神経細胞を介した心血管系および呼吸器系の調節を妨げる可能性がある。肺の人工呼吸器機能の異常は呼吸不全を悪化させ、その結果、高濃度の低酸素が発生する [10, 11]。低酸素と神経炎症の複合的な相互作用により、大脳皮質と海馬の構造と機能が破壊され、神経障害を引き起こす。中枢神経系への直接的な侵入の提案によると、SARS-CoV-2は、BBB透過性の増加と低酸素の増加につながる炎症性メディエーターの放出を引き起こす[12]。中枢神経系は主要組織適合性抗原を欠くため、ウイルスの除去は細胞傷害性Tリンパ球にのみ依存することになる。その結果、感染性中毒性脳症、急性脳炎、および脳血管発作(CVA)が起こる [12]。頭痛や発作は急性脳炎の症状であり、せん妄や昏睡は感染性中毒性脳症の症状であるが、CVAのリスクの増加はSARS-CoV-2誘発のサイトカインストームと凝固異常の症状である[12]。ACE2の神経細胞の発現は、ニコチンによるnACh受容体刺激を介してエスカレートし、これは喫煙者が神経病理学的疾患[13]に向かってはるかに脆弱になる。
アルツハイマー病とCOVID-19との間の一致したクロストーク
インフラモ-プロテオミクス
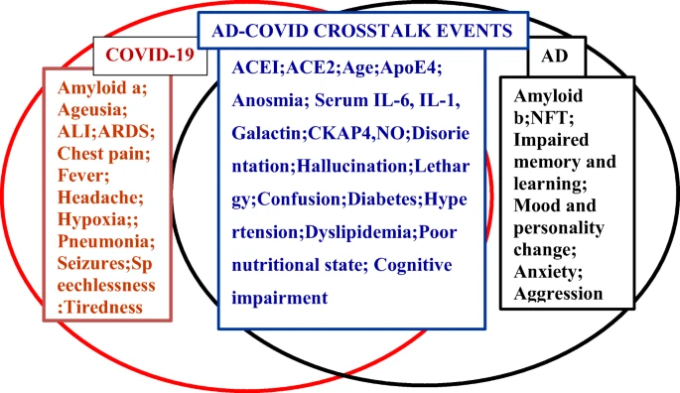
最近まで、SARS-COV-2の呼吸器症候群が最も注目されてきたが、神経症状の併発は、患者の3分の1以上が神経症状を有していたにもかかわらず、最も注目されていなかった[14]。ほとんどすべての神経学的症状は、病気の初期段階で発現していた [15]。炎症性メディエーターは中枢神経系の症状や末梢神経系(末梢神経系)異常の免疫学的プロセスに関与しており、骨格筋損傷はSARS-CoV-2の直接的な影響と考えられている[10, 16, 17]。炎症性マーカーのうち、インターロイキン6(IL-6)インターロイキン1(IL-1)細胞骨格関連タンパク質4(CKAP4)ガレクチン9(GAL-9またはGal-9)は、COVID-19とアルツハイマー病症状との共通のリンクとして最も注目されていた[18](図1)。
図1 アルツハイマー病とCOVID-19の同調と不協和音のクロストーク
IL-6
炎症性サイトカインの血漿中レベルは、アルツハイマー病 の進行状況と関連し、免疫応答とは逆に関連していることが報告されている[18]。同様に、ヒトの認知能力は、慢性的な末梢性IL-6の上昇と逆に関連していた[18]。これに関連して、年齢をマッチさせた対照群と比較して、47 人の アルツハイマー病 患者において血漿 IL-6 の有意な上昇が報告されている [19]。アルツハイマー病患者の血清中の急性期タンパク質の増加は、免疫力の低下を示している。マウスを用いた記憶と学習に関連した行動試験(モリス水迷路試験、穴板試験、高位プラス迷路試験)では、IL-6を欠損したマウスは参照記憶と空間記憶を保持し、より優れた認知能力を示すことが明らかになった[20]。正確なメカニズムはまだ解明されていないが、IL-6の減少は記憶の維持・回復に関与するシグナル伝達カスケードを媒介している可能性がある[20]。
IL-6の血清レベルの上昇はCOVID-19の致死率の上昇と関連していることが報告されている[21]。同様の傾向は、呼吸機能障害との関連も報告されている [22, 23]。血漿プロテオミクスによるプロファイリングでも、COVID-19患者ではIL-6が最も影響を受けているタンパク質の一つであり、疾患の重症度の指標となっていることが確認されている[24]。このように、血清IL-6レベルの上昇はCOVID-19患者で発生した呼吸器合併症の一般的な指標である。また、SARS-CoV-2の急速な複製は、IL-6の産生量の上昇と呼吸困難の増加を誘発する。したがって、IL-6はアルツハイマー病とCOVID-19の共通のバイオマーカーとなっている。IL-6受容体をブロックすることができる抗体(トシリズマブとサリルズマブ)は、COVID-19に対する治療薬として第2/3相臨床試験が進行中である[25]。アルツハイマー病の炎症過程ではIL-6の生成を抑制することで神経変性が起こるため、非ステロイド性抗炎症薬であるテニダップはアルツハイマー病治療薬として有望であると考えられていた[26]。このように、IL-6は中枢神経系や呼吸器系の異常を示すプリーオトロピックなバイオマーカーであり、アルツハイマー病やCOVID-19の中でも特に注目に値すると考えられる。
IL-1
COVID-19患者では、疾患発症時および疾患進行の全範囲においてIL-1が有意に高いことが明らかにされている[27, 28]。組換えIL-1受容体拮抗薬であるアナキンラは、72%の症例で臨床症状、特に呼吸困難の改善に有効であることが確認されている[27, 28]。IL-1のレベルはアルツハイマー病患者で増加することも報告されている[29]。長期的な能力増強の障害や海馬の記憶・学習過程の統合がIL-1レベルの上昇と関連していることが報告されている[30]。ラット脳にIL-1βを注入すると、アミロイドβとNFTの産生が増加することが報告されている[31]。一方、IL-1の遮断はアルツハイマー病を改善することが確認されている[32]。
GAL-9
Gal-9はβ-ガラクトシド結合タンパク質であり、免疫反応の調節に関与している。Gal-9の産生量の増加は、特に肺でのウイルス感染と関連している[33]。したがって、COVID-19パンデミックではGal-9産生を抑制することを目的とした治療戦略が適切であると考えられる[34]。中枢神経系では、Gal-9はオリゴデンドロサイトの成熟とミエリン修復機構の促進因子であることが報告されている[35]。アルツハイマー病患者では血清Gal-3の増加が報告されている[36]。ガレクチン-3は、アルツハイマー病動物モデルにおいて、アミロイドβのオリゴマー化と毒性の促進因子であることが報告されている[37]。このように、ガレクチン-3は炎症性マーカーであり、その調節はCOVID-19やアルツハイマー病治療薬として有望視されている。
CKAP4
CKAP4は、p63としても知られており、63kDaの可逆的にパルミトイル化され、リン酸化されたII型膜貫通型(TM)タンパク質である。CKAP4は神経前駆細胞(NPC)の量と生存を制御している[38]。CKAP4のアブレーションは、プロアポトーシスp53-PUMA経路を活性化することでNPCの死を増加させ、ニューロンと海馬の記憶と学習能力の低下をもたらす[38]。アルツハイマー病の発症におけるCKAP4の関与はまだ報告されていないが、NPCのプロサバイバルエージェントと認知エンハンサーとしての役割は、アルツハイマー病治療薬のターゲットとしてこのタンパク質をステッド[38]。また、哺乳類の中枢神経系の発生には、その役割が不可欠であると考えられている[38]。
肺では、CKAP4は、界面活性剤のターンオーバーを調節することで脂質の恒常性を維持することに関与していた[39]。肺がん患者の血清、肺細胞、組織では、CKAP4が健常者よりも有意に高いことが検出された。このことから、CKAP4は肺がんや呼吸器疾患の早期診断マーカーとして注目されている[40]。また、血漿プロテオミクスのプロファイリングにより、CKAP4はCOVID-19患者で最も障害されたタンパク質の一つであり、疾患の重症度の指標となっている[24]。
ApoE4 アレル
アポリポタンパク質Eは、中枢神経系(中枢神経系)のコレステロールの主なキャリアであり、また、非常に低密度リポタンパク質(VLDL)の重要な構成要素である。その3つの対立遺伝子(ε2,ε3,およびε4)のうち、ε4対立遺伝子を運ぶ個人は、アポEのɛ4/ɛ4遺伝子型は、アルツハイマー病患者の脳内の線維形成を増加させるようにアルツハイマー病を開発するリスクが高くなっている[41]。また、ApoE4は血液脳関門の漏れや脳アミロイド血管症などの脳血行動態に影響を及ぼすことも報告されている[41]。最近では、APOE4はCOVID-19の重症度を上昇させるマーカーと考えられている[42, 43]。したがって、APOE4対立遺伝子を有するアルツハイマー病患者はCOVID-19を発症するリスクが高い。
ACE2過剰発現
SARS-CoV-2 結合タンパク質である ACE2 遺伝子の発現は、アルツハイマー病 患者の脳組織では、年齢をマッチさせた非 アルツハイマー病 患者と比較して 10 倍も上昇していた[44]。このように、アルツハイマー病患者はCOVID-19併存のリスクが高い。
一酸化窒素レベル
一酸化窒素(NO)は内皮由来のリラックス因子であり神経伝達物質であり、記憶や学習過程において重要な役割を果たしており、行動や認知の正常性の維持に役立っている[45]。SARS-CoV-2は、過剰発現したACE2を介して血管収縮因子1型アンジオテンシンII受容体(AT1R)と結合し、大脳ニューロンでのNO産生を低下させる可能性がある。その結果、COVID-19患者は、アルツハイマー病の症状である行動・認知機能の低下に対して非常に脆弱になると考えられている[46]。
アセチルコリン
アセチルコリン(Ach)は中枢神経系と神経筋接合部の興奮性神経伝達物質であり、神経細胞の機能や記憶・学習能力に不可欠である。アルツハイマー病のコリン作動性仮説によると、Achの利用可能性の低下はアルツハイマー病の結果につながる[47]。アセチル-CoAとコリンからAchトランスフェラーゼによって生成されたAchは、シナプス裂け目に放出され、シナプス後のニューロンに結合すると、シグナル伝達を発揮する[47]。Achの活性は、ムスカリン性とニコチン性の2種類の受容体を介して媒介される [48]。アセチルコリンエステラーゼ(AchE)はAchを分解し、シナプス後ニューロンへのAchの長時間作用を許さないため、記憶力や学習能力に影響を与える[47]。アルツハイマー病の特徴は、コリン作動性シナプスの構造的変化、またはAch受容体の変化、またはACh産生ニューロンの変性のいずれかによって起こり、最終的にコリン作動性神経伝達の悪化につながる[47]。したがって、抗AchEI活性を有する薬剤は、アルツハイマー病に対する改善効果があるだろうということに基づいて治療戦略が開発されてきた[49]。異なるAchEI(ドネペジル、ガランタミン、リバスチグミン、タクリン)がアルツハイマー病の合併症を改善するために開発されてきた[49]。AchEIはアルツハイマー病対象者の認知と行動のパフォーマンスを改善することが報告されている[50]。
Achを介して腫瘍壊死因子α(TNF-α)IL-1β、IL-6,IL-18などの炎症性サイトカインの産生を低下させ、抗炎症性サイトカインIL-10の産生を持続させることが報告されている[51]。興味深いことに、AchEIガランタミンはTNF-α産生を低下させることが示唆されていた[52]。したがって、アルツハイマー病およびCOVID-19治療薬にAchEIを含めることは、プロ炎症性サイトカインの産生を低下させ、純結果と抗炎症性サイトカインの生成を支援することができる。“サイトカインストーム “を鎮静化することで、AchメイクアップとCOVID-19の緩和を介してアルツハイマー病の改善。サイトカインストーム」に対するもう一つの鎮静化アプローチは、ニコチン受容体媒介迷走神経刺激であり、それはコリン作動性抗炎症反応をもたらす [53, 54]。したがって、ニコチン物質とコリン作動系を応用した治療戦略は、アルツハイマー病とCOVID-19の両方に改善の影響を与えるだろう [55]。
退化したコリン作動性ニューロン
アミロイドβオリゴマーの神経毒性効果はコリン作動系を変化させ、アルツハイマー病被験者の行動変容に現れている[56]。アルツハイマー病脳の75%までのコリン作動性ニューロンの変性が報告されている[57]。アルツハイマー病患者の海馬と大脳皮質におけるChATの結果としての減少は、前脳基底部と中隔に由来するコリン作動性神経終末の変性と相関していた[57]。これに伴い、アミロイドβを持つコリン作動性神経細胞とNFTの発生との間には逆の関係があることがアルツハイマー病動物モデルで報告されている[58]。一方、ムスカリン受容体アゴニストやAchEIをベースとしたコリン作動性受容体系の刺激は、アミロイド前駆体タンパク質の処理をアミロイド生成経路から非アミロイド生成経路へとシフトさせることと関連していた[59]。抗炎症作用に加えて、α7ニコチン受容体を刺激することで、アミロイドβ、タウ、NFT誘発性神経毒性に対する神経保護作用があるとされている[60, 61]。したがって、コリン作動系を標的とした治療戦略は、アルツハイマー病およびCOVID-19の両方の改善に役立つ。
無感覚症
嗅覚や味覚を検出できない無感覚症はCOVID-19の特徴である [62]。嗅覚や味覚を検出する感度の低下である無嗅覚またはその関連マーカーである低嗅覚もまた、アルツハイマー病の特徴である [63]。嗅覚異常は、感染症や鼻の閉塞、または鼻の嗅覚受容体ニューロンの変性のいずれかに起因して生じる可能性がある [64]。重要なことに、嗅神経や嗅覚系の損傷につながる脳損傷もまた、無嗅症を引き起こす可能性がある[64]。最近では、Zn2+レベルの低下がCOVID-19の併存する無嗅覚症と関連していることが報告されている[65]。SARS-CoV-2によって誘発された鼻細胞亜鉛濃度の局所的な欠乏は、嗅覚を司る酵素であるZn2+依存性炭酸脱水酵素の活性を阻害する可能性がある。免疫学的には、枯渇したZn2+レベルはTh1/Th2バランスをTh2優勢にシフトさせ、結果としてCOVID-19被験者のIL-6生成を増加させる可能性がある[65]。これに関連して、血中Zn2+濃度の低下はアルツハイマー病と関連していた [66]。嗅覚機能障害に伴う認知機能障害は、アルツハイマー病とCOVID-19の共通マーカーとなっていた。
アルツハイマー病とCOVID-19の間の不調和なクロストーク
上述した類似性に基づくクロストークの他に、アルツハイマー病とCOVID-19の間には、いくつかの格差志向の言説が存在する[67](図1)。例えば、頭痛、咳、および発作はCOVID-19の共通の特徴であるが、アルツハイマー病の特徴ではない[67](図1)。その他の対照的な特徴は以下の通りである。
年齢
高齢者は、アルツハイマー病とCOVID-19の両方の犠牲者になるリスクが高い[68]。しかし、80歳以上の患者では、さらなる加齢はCOVID-19の危険因子ではなく、むしろ認知症とアルツハイマー病の危険因子である[68]。正確な機序はまだ明らかになっていないが、二次性肺炎の感受性の低下が原因ではないかと考えられる[68]。一方で、アルツハイマー病の発症は通常60歳以降に始まり、加齢が進むにつれてアルツハイマー病の発症も増加する [69]。活性酸素種(ROS)産生の増加、アミロイドβ産生の悪化、凝集と神経変性、プロテオスタシスの異常、心血管疾患(心血管疾患)糖尿病、高血圧、生活習慣の変化などが高齢者のアルツハイマー病発症に関与していることが示唆されている[69]。
性別
男性は女性に比べてCOVID-19の致死率が高いことが明らかになっている[70]。ACE2レベルの上昇、ACE2に対するテストステロンの影響、ACE2産物(Ang1-7,Ang1-9)の不均衡、サイトカインストームの悲惨な猛威は、女性よりも男性に影響を与える可能性のある要因の一つである[70]。したがって、性ホルモン調節薬によるACE2発現の操作は、COVID-19の治療に適していると考えられる。一方、エストロゲンやテストステロンは神経保護作用やアミロイドβクリアリング作用があることが明らかにされている[71]。80歳以上の女性のアルツハイマー病患者では、アンドロゲンとエストロゲンの脳レベルは、年齢を一致させた非アルツハイマー病の対応よりも低いことが発見されていた[72]。正常とアルツハイマー病男性被験者の場合には、アンドロゲンとテストステロンのダウントレンドレベルは、70歳以上の高齢化が進むにつれて観察されていた[72,73]。このように、性ホルモンレベルの格差は、男女のアルツハイマー病またはCOVID-19の偏った見通しに寄与している。この事実に対応して、それぞれの患者の性ホルモンレベルを回復させるための治療戦略が立案されるかもしれない。
さまざまな治療戦略
アルツハイマー病とCOVID-19は病因が異なる。アルツハイマー病は、異常に高いレベルのアミロイドβまたはNFTの沈着によって引き起こされる。したがって、アルツハイマー病に対する治療戦略は、主にアミロイドβの産生に耐えるか、またはそのクリアランスを促進することに焦点を当てている[74]。一方、COVID-19は、SARS-CoV-2の宿主細胞への侵入およびそれに続く炎症性、呼吸器系、心血管系、中枢神経系および精神的合併症によって引き起こされる。したがって、COVID-19の治療戦略は、ウイルスの侵入、ウイルスの複製、およびその後の症状の改善を阻害する傾向がある。この点で、SARS-CoV-2誘導薬(レムデシビル、ロピナビル)ACE/ACE2受容体阻害薬、アンジオテンシン受容体拮抗薬(ARB)などの宿主標的薬、IL-6およびIL-1阻害薬などの免疫調節薬、および回復期血漿療法が世界的に実践されてきた[75]。
結論
COVID-19の持続的な合併症に加えて、その長期的な影響は、世界中の医療従事者を震撼させている。アルツハイマー病は、COVID-19の最も顕著なアウトターンの一つである。このレビューに記載されている病因因子と生理学的共発現は、COVID-19とアルツハイマー病の両方に対して治療的アプローチを戦略的に行う上で役立つであろう。私たちは、これまでデータに頼ってきたことを認めざるを得ず、COVID-19やアルツハイマー病のような世界的な危機を食い止めるためにも、科学界の今後の方向性に目を向けていかなければならない。
