Contents
Natural products as a rich source of tau-targeting drugs for Alzheimer’s disease
www.ncbi.nlm.nih.gov/pmc/articles/PMC3575183/
2012年9月
要旨
アルツハイマー病(AD)は神経変性疾患であり、米国では540万人以上の人々に影響を与えている認知症の中で最も一般的な疾患である。アルツハイマー病の原因はよくわかっていないが、コリン作動性仮説、アミロイド仮説、タウ仮説が提唱されている。コリン作動説やアミロイド説に基づいたADの創薬は効果を発揮していない。本論文では、ウコンから分離された抗アミロイド剤クルクミン、セイヨウイチイから分離された微小管安定化剤パクリタキセル、ストレプトマイセス由来のHsp90阻害剤ゲルダナマイシンなど、様々な生物学的情報源から、AD治療薬としてのタウをベースとした天然物をまとめた。タウ凝集をクリアにするという見落とされていたアプローチが、ADの創薬の次の目的になる可能性が高い。
アルツハイマー病(AD)は、ドイツの精神科医であり神経病理学者であるアロイシウス ‘アロイス’ アルツハイマーによって 1906 年に最初に記述された、彼は奇妙な障害行動を示したオーギュスト・デターという 51 歳の患者からアミロイド斑(Aβ)と神経原線維のもつれ(NFTs)を識別し、記述した [1]。ADの観察される症状は、認知機能の低下、記憶喪失、混乱、読み書きや会話の問題、気分や性格の変化に関連している。病気が進行すると、アルツハイマー病患者は仕事や社会活動からますます撤退し、介護者からのトータルケアに依存するようになる[2]。アロイス・アルツハイマーがこの病気を記述して以来、アミロイド前駆体タンパク質[3]、プレセニリン-1,-2[4]、常染色体優性家族性AD、常染色体劣性ADのアポリポ蛋白E-e4(ApoE4)[5]に変異が見られる遺伝性の5%以下の症例を除いては、その原因は不明のままである。ADの発症と発達を説明するためにいくつかの仮説が提案されている。コリン性仮説では、アセチルコリン(ACh)の低産生がADを開始するとし、AβとNFTの観察から、AD発症の原因としてアミロイドとタウ仮説が導き出されている。
アセチルコリン戦略
ADのコリン作動性仮説は、神経伝達物質AChの欠損がアルツハイマー病患者で指摘された後に生じた。ACh活性はセリンプロテアーゼAChEによって制御されており、AChの加水分解を触媒してアセテートとコリンに変換することで中枢神経系でAChを分解する(図1)[6]。治療は、シナプスでAChを不活性化するAChEを阻害する薬剤が基本となる。AChEを阻害することで、ADに特徴的なAChの低濃度を補うために、AChの正常な分解を防ぐことができる。
図1 アセチルコリンエステラーゼによるアセチルコリンの分解

アミロイド仮説からタウへ
ADの特徴は大きく分けて2つある:神経細胞の間に位置するAβの不溶性沈着と、神経細胞内に見られるタウ凝集体からなるNFTの塊である。アミロイドの蓄積とADの表現型に対応する染色体21番に位置するアミロイド前駆体タンパク質に変異が同定されたので、特に最初は、Aβ理論は、タウ理論に対して勝った。しかし、最近では、タウ仮説が支持を得ている。タウタンパク質は神経細胞内の微小管を安定化させるが、タウの異常な高リン酸化は凝集体形成につながる。これらの凝集体を呈することが知られている疾患はタウオパチーと呼ばれ、そのうち最もよく知られているのはAD [7-12]である。これらの不溶性の目に見えるもつれは死後AD重症度[13]と強く相関するが、これらは単にAD病理学の出現に対する細胞の反応であるかもしれない。可溶性タウ中間体は高次凝集体よりも神経毒性が強く、ADや他のタウオパチーにおける認知機能障害の原因となっている(図2)[14-17]。タウ遺伝子のコーディング部分とノンコーディング部分の変異もまた、17番染色体(FTDP-17)に関連したパーキンソン病を伴う前頭側頭型認知症と呼ばれる状態の発症に直接関連している[18,19]。したがって、タウの凝集を防ぐことを目的としたいくつかの努力にもかかわらず[15,20]、AD治療薬に対するより有益なアプローチは、タウクリアランスを強化することであるかもしれない[21]。ADにおいて病理学的に蓄積する微小管関連タンパク質タウ(MAPT)とADのNFTを示すペアらせん状フィラメント(PHF)を標的とすることは、おそらく症候性後ADの治療に最も効果的な戦略であるかもしれない[14-16,22-26]。さらに、最近のAβ標的治療薬の第III相臨床試験での失敗は、ADに対する代替的な創薬戦略を検討することが時宜にかなった慎重さを示唆している。
図2 アルツハイマー病進行のタウ仮説
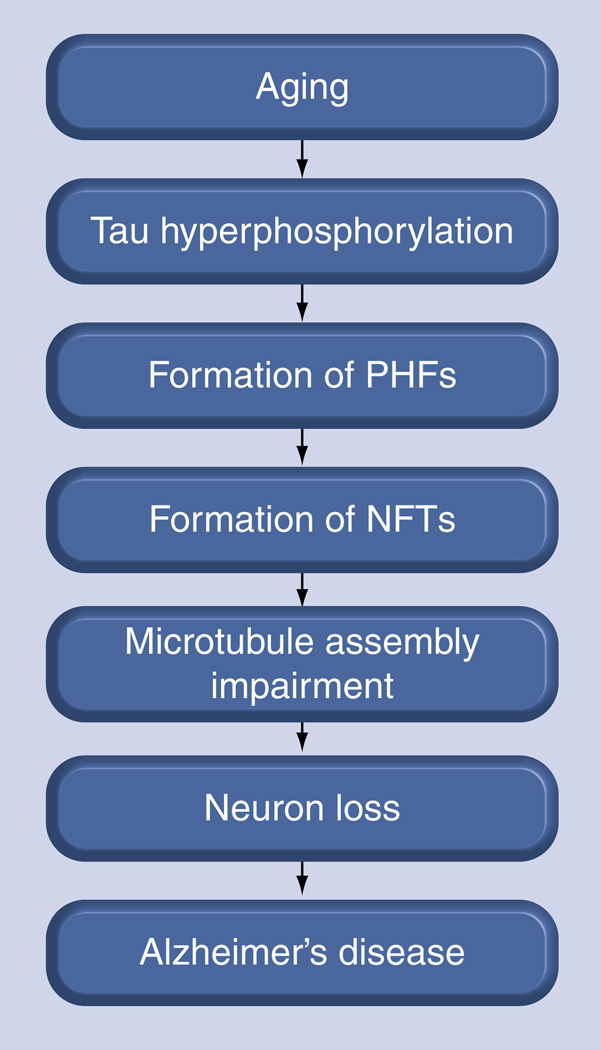
NFT(エヌエフティ)。神経原線維のもつれ; PHF: Paired helical filaments.
AD治療薬
現在のところ、ADの治療法はなく、症状を治療するために利用可能な薬は5種類のみ:4種類のAChE阻害薬、コリン作動性仮説のみに基づいて開発された薬、および1種類のN-メチル-d-アスパラギン酸(すなわち、NMDA)受容体拮抗薬(表1)[27,201]。1993年にコグネックス®(タクリン)から始まった最初のAD治療薬は、ADのコリン作動性仮説に基づいて開発された。コグネックス®、アリセプト®(ドネペジル)エクセロン®(リバスチグミン)ラザダイン®(ガランタミン)はいずれもAChE阻害薬であり、AChE活性を阻害することでアルツハイマー病患者のAChレベルが維持されることが期待されていた(表I)。最近承認された薬剤であるメマンチンは、グルタミン酸系に作用するという点でアプローチが若干異なるが、その有効性は中等度から重度のアルツハイマー病患者に限定されているようであり、効果は限定的である[28,29]。
表I 様々な臨床試験段階にあるアルツハイマー病治療薬と厳選された化合物
| 化合物 | 商標名 | ソース | 小道 | 状態 | 承認年 (米国FDA) |
|---|---|---|---|---|---|
| タクリン | コグネックス® | 合成 | AChE阻害剤 | 市場 | 1993年 |
| ドネペジル | アリセプト® | 合成 | AChE阻害剤 | 市場 | 1996年 |
| リバスチグミン | エクセロン® | 合成(天然物に触発された) | AChE阻害剤 | 市場 | 2000年 |
| ガランタミン | ラザダイン® | 天然物(植物) | AChE阻害剤 | 市場 | 2001年 |
| メマンチン | AXURA ®、ナメンダ®、Abixa ®およびMemox | 合成 | N-メチル-d-アスパラギン酸受容体拮抗薬 | 市場 | 2004年 |
| クルクミン | 天然物(植物) | Aβプラーク | フェーズII | ||
| ホモタウリン | Alzhamed™ | 天然物(藻類) | Aβプラーク | フェーズIII(失敗) | |
| R-フルルビプロフェン | フルリザン™ | 合成 | Aβプラーク | フェーズIII(失敗) | |
| ミノサイクリン | 合成(天然物に触発された) | Aβ/タウ/ミクログリア | フェーズII | ||
| メチレンブルー | Rember™ | 合成 | タウ凝集 | フェーズII | |
| チデグルシブ | Zentylor™ | 合成 | タウ凝集 | フェーズII |
データは[27,201]より引用
利用可能な薬剤のうち、1つは天然物である。ガランタミン(1;図3)は、球根性草本植物Galanthus woronowii(コーカサススノードロップ)およびアマリリス科(Amaryllis, Hippeastrum, Lycoris, Ungernia, Leucojum, Narcissus, Zephyranthes, Hymenocallis, Haemanthus属)の異なる種の球根から単離されたアルカロイドである[30]。リバスチグミン(2)は、Physostigma venosum(カラバリマメ)の毒種子に由来するコリンエステラーゼ阻害剤アルカロイドのフィソスチグミン(3)の合成類似体であることに留意することが重要である[31]。コリン作動性の薬剤は、ADの症状を緩和するだけで、病気の進行を防ぐものではないと考えられている;しかしながら、AChE阻害剤は、病気を改善する効果を持つ可能性がある[32]。
図3 AChE阻害薬であるガランタミン(1)リバスチグミン(2)フィソスチグミン(3)

将来のAD治療薬の最近の焦点はAβレベルの低下にあり、タウタンパク質の過リン酸化に起因するNFTs産生は、すでにAD症状を呈する患者においてタウベースの治療法が抗Aβ化合物よりも適切である可能性があることを臨床試験が示唆しているにもかかわらず、ほとんど注目されなかった[33]。したがって、タウ還元特性を有するADに対する効率的な薬剤が大いに必要とされている。これらの薬剤は合成することもできるし、自然から採取することもでき、後者の利点は、化学的多様性、生物学的選択性、および好ましい特性の可能性があることである。現在市場に出回っている薬剤の大部分は、天然物由来の化合物である[34]。
ADにおけるタウ機能障害の影響を軽減するための現在のアプローチ
神経細胞におけるタウのレベルを低下させる最良の方法を探すために、多くの戦略が用いられてきた。それらの戦略は、タウ凝集体の形成を阻害するものから、キナーゼを用いたタウの調節、シャペロンを介したタウ分解の制御、タウ微小管の安定化まで様々である。現在の生化学的アッセイでは、タウのフィブリル化を阻害することに焦点が当てられている[15,35]。このアプローチは新規化合物を産生する可能性があるが、最近の研究では、タウの凝集が実際には神経細胞によって採用されている保護機構であり、最も毒性のある物質はタウの中間体であることが示唆されている[15,36,37]。数多くのプロリン指向性キナーゼ(ERK2,GSK-3,CDK5)非プロリン指向性酵素(CK1,PKA)微小管親和性調節キナーゼ(MARK)がタウリン酸化の過程に関与していることが知られている[38-40]。薬物によるキナーゼの操作は、タウレベルを減少させる効果的な方法であることが示されている;例えば、GSK-3βキナーゼの低分子阻害剤は、リン酸化されたタウを減少させるのに有効であった[41,42]。あるいは、分子シャペロン蛋白質の機能に影響を与えることは、タウに対しても同様に劇症的な影響を与える可能性がある。分子シャペロンであるHsp90を阻害することで、リン酸化されたタウや誤って折り畳まれたタウを減少させる効果が示されたからである[21]。高リン酸化タウはまた、微小管を不安定化させ、微小管機能と軸索輸送の障害を引き起こすことが知られており、微小管安定化剤がこれらの損失を補うのに役立つとの考えにつながっている[43,44]。
タウを標的とした天然物
AD治療におけるその有効性についてすでに評価されているいくつかの天然物は、以前に文献[45,46]にまとめられている。最近の臨床試験では、すでにAD症状を呈している患者に対しては抗Aβ治療よりもタウベースの治療が有効である可能性が示唆されているため、タウ還元剤の相対的な不足に対処する必要がある。抗タウ食(タウの減少を助ける食生活)の例は、ADの将来の治療法として天然物を利用する可能性を示している。以下に要約すると、タウ関連の画面でアクティブに発見されている陸上および海洋植物、無脊椎動物や藻類だけでなく、微生物から、これまでに報告された天然物である。
科学者たちは、神経変性疾患の緩和のために、民族植物の抽出物や製剤を含む食事源に注目してきた [47,48];これらの物質の化学的基盤を明らかにするための最近の努力により、いくつかの生理活性代謝物が同定され、その中には薬物開発の可能性を持つものもある。植物によって作られた多くの抗タウ天然物は、最適化されたウコン(Curcuma longa)抽出物の66.8%に存在する直鎖ジアリールヘプタノイドであるクルクミン(4;図4)などのポリフェノールである[49]。この抽出物は、抗酸化剤として作用することに加えて、抗炎症性サイトカインIL-4の産生を有意に増加させ、Aβ過剰発現マウスにおいてAβおよびタウのレベルを低下させることが観察された[50]。さらに、私たちのグループは、ベイベリー根樹皮(Myrica cerifera)抽出物から、強力な大環状ジアリルヘプタノイドである(+)-aR,11S-ミリカノール(5)を同定し、タウ濃度を低下させた[51]。化合物5は、タウオパチーの細胞培養モデル(HeLa-C3細胞)において、35μMのEC50値でex vivoでタウレベルを減少させ、AD創薬に適した足場である[101]。(+)-aR,11S-ミリカノール(5)の単離は、ミリセチン(6)とそのラモシド配糖体ミリシトリン(7)を含む追加のベイベリーフラボノイドを伴っていた。ミリセチンの低マイクロモルのタウフィラメント形成阻害は、フラボノイドファミリーの他の2つのメンバーであるローゼル(Hibiscus sabdariffa)由来のゴシペチン(8) [52]と緑茶(Camellia sinensis)由来の(-)-エピカテキン-3-ガレート(9) [53]で、それぞれ1.2,2.0および1.8 µMのIC50値を示している[54]と同様に、以前に試験管内試験で報告されている[5]。試験管内試験でヒトタウの凝集を阻害するシナモン(Cinnamonium zeylanicum)抽出物は、シンナムアルデヒド(10)とカテキン/エピカテキン構造クラスのA型二重連結プロシアニジンオリゴマー(11)の両方に起因する阻害活性を示している(55)[55]。ブドウ種子(Vitis vinifera)由来のポリフェノール抽出物から同定された同様のプロシアニジンは、神経毒性を持つ凝集体へのタウのフィブリル化を防ぐことが判明した[56]。セージ(Salvia offinalis)を認知と記憶の改善のための料理源として調査したところ、有効成分はポリフェノールのロスマリン酸(12)であり、活性酸素種の形成、脂質過酸化、DNA断片化、カスパーゼ-3活性化、Aβ蓄積などのいくつかのAD経路を減衰させることに加えて、タウの高リン酸化を減少させることが示された[57]。
図4 植物由来のタウをターゲットにした天然物

レッドセージ(Salvia miltiorrhiza)
タウ修飾作用を有する他の植物由来や食事由来のものは、ポリフェノールではない化合物を生成する。タンシノンIIA(13.図5)は、レッドセージ(Salvia miltiorrhiza)由来のノルディテルペンであり、10 µMでβアミロイドによって誘導される神経毒性およびタウ高リン酸化に対する保護効果を有する[58]
リグナン
一方、リグナン14および15,ならびにイソフラバン16である。の水溶性抽出物から得られたパクリタキセル(25;図6)は、10 µMでGSK-3βを刺激し、組換えヒトタウタンパク質(rhTP)のスレオニン残基ではなくセリン残基を優先的にリン酸化する効果を示した[59]。
パクリタキセル
パシフィック・イチイ(Taxus brevifolia)由来の既知の微小管安定化剤(MSD)パクリタキセル(25;図6)は、トランスジェニックマウスモデルにおいて、タウ病理の「機能喪失」効果を打ち消すことにより、神経変性タウオパチーにおいて肯定的な結果を示した[44]。
オリーブオイル
オリーブ油(Oleaeuropaea)由来のオレカンタール(17)は、最長のタウアイソフォームT40とそれに対応する微小管結合領域K18のフィラメント形成を阻害するために試験され、IC50値はそれぞれ20と2.9 µMであった[60]。
ルバーブ
ルバーブ(Rheum palmatum)の根と根茎から単離されたアントロキノンエモジン(18)は、PHFsの阻害作用を示す [61]。
ココナッツジュース
タウ-1のレベルは、若いココナッツ(Cocos nucifera)のジュースを飲んで4週間後に卵巣摘出ラット(ADを持つ更年期の女性と同様の病理を保持している)で減少することが判明した。ヤングココナッツジュースにはエストロン様物質であるエストロン(19)17-β-エストラジオール(20)β-シトステロール(21)が含まれており、これらはタウに対する観察された効果に関与している[62]。
朝鮮人参
アジア人参(Panax ginseng)由来のステロイド配糖体ジンセノサイドRd(22)は、PP-2Aの活性を増強することにより、生体内試験および試験管内試験で神経毒性およびタウの高リン酸化を減少させることを示している[63]。
熟成人にんにく
熟成ニンニク(Allium sativum)抽出物は、硫黄含有成分であるS-アリルシステイン(23)(ニンニクの水溶性成分)とジアリルジスルフィド(24)(ニンニクの脂質可溶性成分)を有しており、抗アミロイド生成作用、抗炎症作用、抗絡みつき作用を示した[64]。
図5 植物由来のタウをターゲットにした天然物
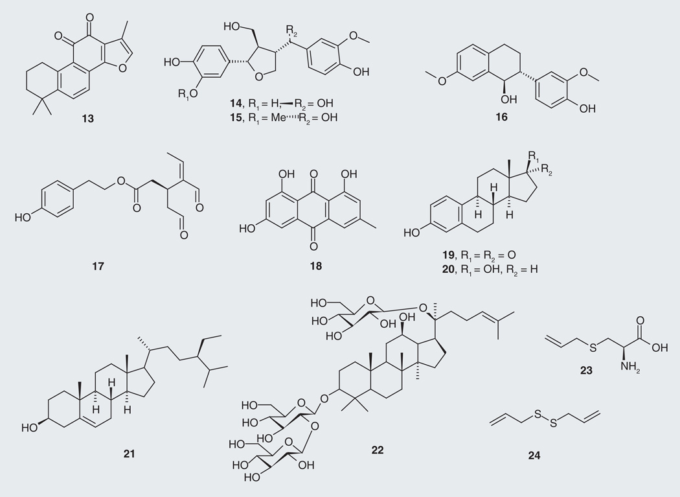
図6 パクリタキセル

タウを標的とした天然物としての植物由来微小管安定化剤製剤
タウ還元性化合物は植物由来に限定されるものではないが、上記に挙げたものに加えて、抗タウ活性を有する細菌や真菌由来の化合物が報告されている。その多くは、アントラキノン誘導体、Streptomyces peucetius細菌から単離されたダウノルビシン(26;図7)およびアドリアマイシン(27)のようなキノン誘導体であり、以前に議論された化合物であるエモジン(18)と一緒に。化合物26と27はともにタウ凝集抑制活性を示し、試験管内試験および細胞内でPHFを溶解した[61]。真菌界からは、アントラキノン系ルベリンが植物病原性真菌 Ramularia collo-cygni から単離された [65]。広範な生理活性を調べた結果、ルベリンB、DおよびE(28-30)は、IC50値がそれぞれ1.2,0.9および0.9 µMでタウ凝集体の形成を阻害し、DC50値がそれぞれ1.6,2.2および0.5 µMでタウ凝集体の分解を促進することが判明した。関連微生物Streptomyces hygroscopicus [66]から単離されたベンゾキノン系大環状ポリケチドゲルダナマイシン(31)は、Hsp90の阻害剤として同定され、高リン酸化タウのレベルを低下させることが報告されている[21]。
ミノサイクリン
Streptomyces spp.から単離された化合物であるテトラサイクリン(32)はAβ線維を阻害・分解したが[67]、その合成誘導体であるミノサイクリン(33)は、神経保護[68]、ミクログリア活性化[69]、カスパーゼ-3活性化阻害、タウ高リン酸化の抑制[70]などの付加的な能力を示した。ミノサイクリンは現在、ADを対象とした第II相臨床試験で試験されている(表1)。
図7 微生物由来のタウを標的とする天然物

ミクソバクテリア(Sorangium cellulosum)由来のMSD大環状ポリケチド・エポチロンD(34;図8)で処理した既存のタウ病理を持つトランスジェニックマウスは、軸索ジストロフィーの減少と軸索微小管密度の増加を伴う前脳タウ病理の減少を示した[71]。視神経にはまだタウのもつれが存在するが、これは予想されることである。MSDでMT機能と軸索の完全性を改善しても、タウのリン酸化と凝集は変化しないかもしれないが、タウの機能低下を補うことができるかもしれない[44]。
図8 微生物由来のタウを標的とする天然物(34および35)

シラジット
植物リターポリフェノールに対する微生物の作用は、フルボ酸およびフミン酸として知られる高次ポリフェノールの複雑な混合物を生成する。フルボ酸標準I(35)(スワンニー川I 1S101F)は、37μMのIC50値で試験管内試験でタウフィブリルの凝集を阻害し、95μMのDC50値でタウフィブリルの分解を促進することが見出された[72]。フルボ酸はまた、インドのアーユルヴェーダの伝統医学であるシラジットの主要成分であり、加齢に関連した認知障害を制御することが報告されているタール状物質である[73]。
さらなるタウ還元性化合物は、海綿やカタツムリなどの海洋生物で発見されている。Peloruside A(36;図9)は、パクリタキセルと同じ作用機序を持つ海綿体Mycale hentscheliから単離されたMSDである[74]。Ircinia属の海綿(I. variabilis, I. dendroides and I. oros)から分離された直鎖状のfuranosesterterpeneであるPalinurin(37)は、4.5 µMのIC50値を持つGSK-3βの非ATP競合阻害剤として出現した[75,102]が、結果としてタウの過リン酸化を抑制した。海洋アルカロイドもGSK-3βに対して評価されている。海綿類のHaliclona sp.から単離されたマンザミンA (38) [76] と、海綿類のAxinella verrucosaとAcanthella aurantiacaから初めて単離されたヒメナルジシン (39) [77] は、サイクリン依存性キナーゼを阻害し、GSK-3βに対するIC50値はそれぞれ10 µM [78] と35 nM [79] であった。最後に,ビスインドールアルカロイドであるインジルビンは,ムリ科やタイガエル科などの腹部軟体動物から抽出された色素の構成成分である。地中海産の軟体動物Hexaplex trunculusの6-ブロモインドゥリビン(40)とその合成誘導体6-ブロモインドゥリビン-3´-オキシム(41)は、GSK-3βに対する選択性と阻害性を示し、IC50値はそれぞれ45と5 nMであった[80]。これらの優れた結果は、臭素化ビスインドールがタウを還元する能力のために開発される良い候補であることを示している。
図9 海洋マクロ生物由来のタウをターゲットにした天然物

ADにおけるタウ修飾化合物としての天然物の開発
これらの天然物の構造活性や構造-物性関係については、現在のところほとんど知られていない。フラボノイドポリフェノールの場合、(-)-エピカテキン-3-ガレート(9)と(-)-エピカテキンの比較から、タウ還元にはオルト置換フェノール基が必要であるように思われる。同じ観察は、α-シノレインおよびプリオンタンパク質凝集に対するポリフェノールについても指摘されている[81,82]。タンパク質/低分子相互作用機構の研究により、タウフィブリル化断片K18は、リジン残基のε-アミノ基とオレカンサルアルデヒドカルボニルとの間のシッフ塩基形成を介してオレカンサルによって共有結合的に修飾されている可能性が高く、タウフィブリル化を阻害することが明らかになった[83]。しかし、タウを還元する小分子とタンパク質との相互作用を明らかにするためには、さらなる研究が必要である。さらに、タウオリゴマー形成の正確なメカニズムはまだ解明されていない。さらに、血液中の物質が中枢神経系に入るのを制限するために脳を取り囲んでいる半伝染性の防護壁である血液脳関門(BBB)は、AD治療薬の開発上の課題となる可能性がある。BBBを横断するためには、低分子量で脂質溶解度の高い薬剤が必要である[84]。上述した天然物についての伝染性試験はほとんど行われていない。しかし、クルクミン(4)はBBBを横断するのに有効であることがわかった[85]。プロアントシアニジンやフラボノイドクラスの他のタウ還元性ポリフェノールは、クルクミンと同様の化学的特性を持つ結果として、ADリードの良い候補となる可能性がある[86,87]。一方、抗がん剤MSDパクリタキセル(25)と関連するタキサン類はBBB伝染性が悪く、より小さいまたはより親油性の高い天然物の方が成功する可能性があることを示唆している[88]。実際、別のMSDであるエポシロンD(34)は脳への浸透性があり、低用量で安全である[71]。インジルビンは生体内試験での有効性を示し、BBBを横断する機能を強調し、これらの化合物は、ADおよび他の神経変性疾患における治療薬としての開発を正当化する可能性があることを示唆している[79]。
今後の展望
全体的に、我々はこのレビューをADのためのタウベースの治療薬に焦点を当ててきた。我々は、AD治療のための潜在的な薬剤として自然界からの抗タウ化合物を記述した現在の文献を要約した。植物、真菌、細菌、海綿類、軟体動物などの様々な生物学的源からの天然物は、そのタウタンパク質の調節について評価されてきた。このラインに沿った化合物の発見と開発には、病気の作用機序に関するより強力な知識が必要とされる。さらに、新たに発見された創薬リード化合物は、良好なBBB伝染性と適切な薬力学的特性を有していなければならない。
エグゼクティブサマリー
アルツハイマー病の進行を理解することは、増加する高齢化人口の治療法を見つけるために非常に重要である
- 現在市販されているアルツハイマー病治療薬はAChE阻害剤である。タクリン、ドネペジル、天然物由来のガランタミン、リバスチグミンは症状を緩和し、病状を修飾する可能性がある。
- AD発症・進行のメカニズムはよく知られていない。しかし、アミロイド仮説とタウ仮説の2つが有力である。
Aβ仮説からタウ仮説への創薬戦略の転換
- Aβをベースとした薬剤の臨床試験での成功例が限られていることから、タウをベースとした治療薬が代替の可能性が出てきた。
- タウ仮説に基づく2つの薬剤が既に第II相臨床試験に入っている。これらの臨床試験の結果により、タウ戦略の実行可能性についてより多くの情報が得られるであろう。
天然物は、AD治療薬の創薬のための多様な足場の豊富な供給源である。
- 多くの医薬品は天然物由来であり、その中にはAChEをベースにした4種類のAD治療薬のうち2種類が含まれている。
- 現在の成功例を踏まえ、天然物は、新規でより効果的なAD治療薬の発見に新たな資源を提供する可能性がある。
キーワード
アルツハイマー病
記憶、思考、行動に影響を与える神経変性疾患の最も一般的な形態。脳内のニューロンやシナプスが徐々に失われ、死に至るのが特徴。
タウ
中枢神経系の神経細胞に多く存在する微小管安定化タンパク質。タウの機能異常はアルツハイマー病などの神経変性疾患につながる。
ガランタミン
AChE 阻害剤 アルツハイマー型認知症の治療薬として、現在唯一の天然物として使用されている。
アルカロイド
塩基性窒素原子を含む有機物質。
ポリフェノール
複数のフェノール構造単位が存在することを特徴とする有機物質。
クルクミン
インドのスパイスであるウコン(Curcuma longa)の主成分。癌、自己免疫疾患、アルツハイマー病に対する幅広い治療効果がクルクルミンに起因している。
パクリタキセル
アルツハイマー病の治療薬として研究されている、がん化学療法で使用されるイチイの木由来の抗分裂病薬。
キノン
完全に共役化されたジオンで特徴づけられる芳香族有機物質。
主にニキビの治療に用いられるテトラサイクリン系抗生物質。アルツハイマー病の治療薬としても使用されている。
