Contents
www.ncbi.nlm.nih.gov/pmc/articles/PMC7658412/
2020年10月29日オンライン公開
要旨
病原性微生物とその慢性的な病原性は、生物医学研究において重要な関心事である。バイオフィルムに関連した持続的な感染症は、常駐する多剤耐性微生物のために治療が容易ではない。様々な治療法の効率が低く、また入手可能な抗生物質の生体内毒性もあるため、研究者は多くの有効な天然抗バイオフィルム剤の発見をめざしている。
天然抽出物や天然物ベースの抗バイオフィルム剤は、化学合成されたものよりも副作用が少なく、より効果的である。本総説では、様々な天然の抗バイオフィルム剤、すなわち、植物化学物質、バイオサーファクタント、抗菌ペプチド、微生物酵素に焦点を当て、それらの由来、クオラムセンシング経路の妨害による作用機構、細胞外高分子物質の破壊、接着機構、およびこれまでの文献にあるそれらの阻害濃度に言及した。
本研究により、ある特定の天然抗バイオフィルム分子が、複数の病原体種に対して異なる作用機序とバイオフィルム阻害活性を示すことをより良く理解することができた。この情報は、多様な供給源からの複数の天然抗バイオフィルム化合物の組み合わせによる治療戦略を改善するために、さらに活用することが可能である。
キーワード:微生物バイオフィルム、治療戦略、植物性化合物、多剤耐性、抗菌ペプチド、バイオサーファクタント
背景
バイオフィルムの抗菌耐性は、様々なヘルスケア分野における医学研究者の重要な課題として浮上している。合成薬、併用療法、抗生物質ハイブリッドなどは、治療中に望ましい結果を得ることができなかった。このような薬物耐性の緊急事態の中で、新しい抗菌剤を探すことは、科学界に新しい天然の抗バイオフィルム剤を探すことを強いることになる。
本総説では、バイオフィルム形成微生物を克服するための様々な天然物について再考し、様々な天然抗バイオフィルム剤を臨床利用するための有効な薬剤候補とするための改変における既存の制約と最近の開発に関する簡潔な情報を提供することに焦点を当てる。
バイオフィルム
バイオフィルムの概念は、Marshallら(1971)によって最初に開発され、Fletcher、Characklis、Costertonによってさらに説明された、「バイオフィルムは、コロニー形成中に自由生活細菌細胞に特定の特性、利点、およびより高いレベルの組織を提供する微生物の生活環における独特の成長パターン」(Characklis、1973;Fletcher and Floodgate, 1973;Geesey et al, 1978; Flemming and Wuertz、2019)であった。
バイオフィルムの説明は、Flemming and Wuertz(2019)により、バイオフィルムは、明確な無柄細胞を有する微生物の集合体であり、その後、細胞分裂により小さなクラスター、マイクロコロニー、そして大きなサムが形成されるとより明確になっている。
バイオフィルムの下の膜は、多層の不均質な微生物マットで基質と直接接触しているだけである。バイオフィルムは、例えば、バイオ燃料の生産、廃水の分解、飲料水のろ過など、様々なバイオテクノロジーの応用に広く利用されている(Flemming et al.)バイオフィルムの悪影響には、生物汚損(Flemming, 2011)、腐食(Little and Lee, 2015)、飲料水の水質悪化(Wingender and Flemming, 2011)などがある。
ヒトを含むすべての高等真核生物は、バイオフィルムを形成する微生物によって生息している(De Vos, 2015)。ヒトの歯垢、皮膚、腸は、真核生物の生息地における支配的なバイオフィルムの1つである。医療機器の広範な使用は、細菌バイオフィルム形成のためのいくつかの新しいニッチを作り出する(Qvortrup et al.、2019)。
* *
バイオフィルム内の細胞は、バイオフィルムが細胞を付着させる高分子量の細胞外高分子物質(EPS)に囲まれているため、厳しい成長条件を生き残る(Brandaら、2005; Flemming and Wingender、2010)。
EPSはタンパク質、脂質、多糖類、細胞外DNAなどから構成され、多数の微生物感染症の発症に必須の機能を果たしている(Ch’ng et al.、2019)。また、バイオフィルム内の微生物細胞は、紫外線、金属毒性、酸曝露、乾燥、pH勾配などに対して耐性があることが分かっている(Costertonら、1999;Hall-Stoodleyら、2004)。
様々な物理的および化学的耐性に降着して、EPSは、好中球を介した貪食を阻害することによって、バイオフィルム内の多くの常駐病原微生物に免疫抵抗を付与する(Gunnら、2016)。Izanoら(2009)は、EPSのeDNAと細胞間接着剤が、様々な抗菌剤の浸透のためのバリアとして機能することを報告した。
EPS内に存在するeDNAは、ヒト抗菌ペプチド(AMP)をキレートし、これらのペプチドの抗菌活性を低下させる(Jones et al.、2013)。これまで、バイオフィルム形成の方法とそれに続く予防戦略を特定し、課題、特にバイオフィルム形成による薬剤耐性を叩くために多くの研究が行われてきた(Roy et al.、2018)。
糖鎖、外膜構造、エフラックスポンプの存在、およびバイオフィルム内の細胞の増殖速度、遺伝子適応、代謝状態、代謝の不均一性が、抗菌薬に対する耐性を獲得するバイオフィルムの主要な原因である(Singh et al.、2017)。
いくつかのヒト病原体におけるバイオフィルムの成立様式、およびその薬剤耐性機構は、さまざまな研究者によってよく研究され、レビューされ、プロットされている(図1)。この図は、バイオフィルム耐性の共有メカニズムを3つのセクションに分けて説明している。
(1) 物理的耐性:EPSの過剰産生は、抗菌剤の浸透・拡散を抑制し、その結果、バイオフィルム内の細胞は耐性を獲得するまでの時間を長くすることができる。同様の観察から、EPSの産生が抗菌剤耐性を増強することが分かっており、サルモネラ・ティフィムリウムのアイソジェニックΔcsgD変異体(EPS欠損変異体)は過酸化水素(MacKenzie et al, 2017)やシプロフロキサシン(Tabak et al, 2009)に非常に感受性が高くなる。したがって、EPSを不安定化し阻害する治療戦略は、バイオフィルムを抑制し、抗菌剤耐性の重大な問題を軽減するための最良の抗バイオフィルムアプローチである。
同様の観察は、Deokar and Kadam (2020)とDieltjens et al. (2020)によって、EPSの阻害がバイオフィルムにおける薬剤耐性だけでなく細胞接着を減少させることが記録されている。
(2) 受動耐性:バイオフィルム・マトリックスに存在する酵素が抗菌分子を不活性化させる。バイオフィルム・マトリックス成分を介した抗菌剤の中和機構も報告されており(Fux et al., 2005)、バイオフィルム・マトリックスに存在するカタラーゼ酵素がStaphylococcus epidermidisバイオフィルムの各種物理化学剤に対する耐性に関与しているという報告もある(Olwal et al., 2019)。
(3) 生理的耐性:バイオフィルムの深層に存在する代謝不活性な細胞は、様々な抗菌剤に対するバイオフィルムの耐性を調節する適応的ストレス応答を示す。パーシスター細胞は、飢餓、生態学的要因、およびSOSやストリンジェント応答などの他のいくつかの適応応答によって引き起こされる表現型および可逆的変化の後、様々な抗生物質に対してより耐性になる(Harmsら、2016;Ciofu and Tolker-Nielsen、2019;Soaresら、2019)。
図1 各種抗菌薬に対するバイオフィルム耐性の一般的なメカニズム
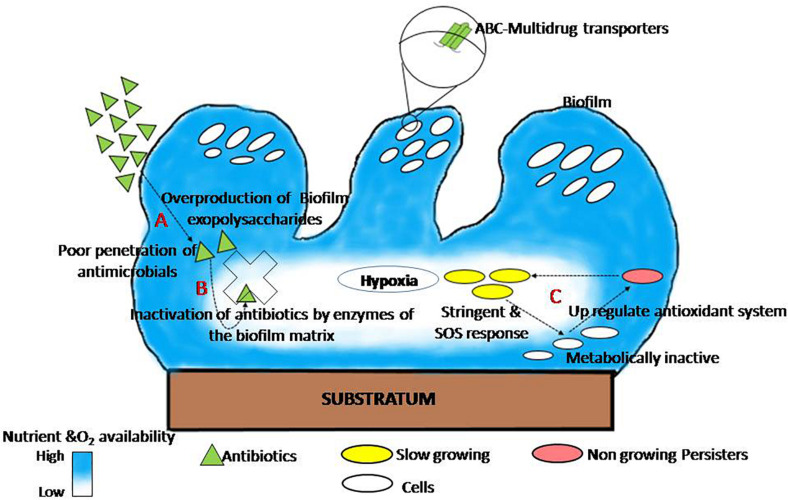
(A)物理的耐性:バイオフィルム・マトリックスが抗菌剤の拡散を制限する(Tsengら、2013)。(B)受動耐性:マトリックス酵素が浸透した抗菌剤分子を不活性化する(Fuxら、2005)。
(C)生理的耐性:バイオフィルムの深層にあるパーシスター細胞は適応的なSOS反応を誘導するため、耐性が強くなる(Ciofu and Tolker-Nielsen, 2019から引用)
パーシスター細胞は分裂が遅く、抗生物質に対する感受性が低く、バイオフィルムの再形成に不可欠な役割を担っている(Dawson et al.、2011)。パーシスター細胞は、様々な毒素・抗毒素遺伝子の発現を上昇させ、翻訳を阻害することで細胞代謝を低下させ、最終的に抗生物質の存在下で生存を保証する(Lewis, 2005)。
これらの細胞は、抗生物質の作用が終わった後、植物性の分裂細胞に復活し、再び感染を起こす(Lewis, 2010)。パーシスター細胞は、毒素-抗毒素系を発現しており、毒素モジュールによって抗生物質の標的がブロックされるため、抗生物質から隔離されている(Lewis, 2005)。
バイオフィルム内の酸素不足と代謝活動の少なさは、緑膿菌に多くの抗生物質に対する耐性を与える(Wilkinsら、2014)。バイオフィルムの層間のpHの急激な変化は、有機酸を蓄積する役割を果たし、その結果、浸透性化合物を不活性化する(Wilkinsら、2014)。
バイオフィルム全体に酸素、pH、栄養素、電子受容体の勾配が生じると、細胞が遺伝子発現を変化させることで反応する微小環境が形成される(Spormann, 2008; Stewart and Franklin, 2008)。一般に、単一種のバイオフィルムよりも、多くの種から構成される複雑な(polymicrobial)バイオフィルムの方が、抗生物質に対する耐性が高い(Van der Veen and Abee, 2011)。バイオフィルムの抗生物質耐性には、細胞の多様性と代謝条件が最も重要な役割を担っている。
* *
しかし、シーケンサー技術の進歩により、大量のゲノムデータが作成され、バイオフィルム形成と薬剤耐性の関連における未知の分子機構をさらに解明することができるようになった。RNA-seqトランスクリプトーム解析により、Enterococcus faecalisのバイオフィルム形成と薬剤耐性に関連するヒ素耐性オペロン遺伝子(arsRおよびarsD)、スポルレーション調節遺伝子(paiA)、ABCドラッグトランスポータークラス、ペニシリン結合タンパク質が特定された(Seneviratne et al.、2017)。彼らは、バイオフィルムモードでは細胞毒性を回避するためにarsDの発現量が高いことを見出し、arsD遺伝子ノックアウトがバイオフィルム形成を抑制する方法の可能性を示唆した。
同様に、彼らはまた、バイオフィルムにおけるpaiA遺伝子の発現レベルの減少を観察した。Padhiら(2016)は、非病原性Mycobacterium smegmatis株のバイオフィルム形成とその後の抗結核薬に対する耐性に、Mtb Rv0024タンパク質の発現が重要な役割を果たすと報告した。
* *
また、抗真菌剤耐性の傾向も重要な問題であり、標的作用機序を持つ新規抗真菌化合物の直接的な研究が必要である(Sharma and Bisht, 2020)。多くの研究から、Candida albicansのバイオフィルムは、浮遊性酵母細胞と比較して、多くの抗真菌薬に対して耐性があることが報告されている。
さらに、細胞外小胞(EV)によって促進されるマンナン-グルカン複合体の形成も薬剤耐性と関連しており、C. albicans、C. glabrata、C. tropicalis、C. parapsilosisで報告されている(Mitchell et al., 2015; Dominguez et al., 2018; Zarnowski et al., 2018)。
また、真菌のバイオフィルム関連耐性機構には、排出ポンプの過剰発現、薬剤の標的部位の変異、細胞の持続性、バイオフィルムと宿主免疫系の相互作用、さらにフィラメント形成過程に関連するタンパク質が関与していることが報告されている(Borghi et al.、2016)。
C. albicansのバイオフィルム成長を制御する転写ネットワークを分析すると、細胞形態制御のEfg1およびTec1、バイオフィルム形成のBcr1、Brg1およびNdt80、バイオフィルム形成の正常プロセスを制御するTec1およびRob1などの6つの主要転写制御因子が示されている(Fox and Nobile, 2012; Uppuluri et al.、2018)。
このように、バイオフィルム形成とその後の抗生物質耐性に関与する分子経路を深く理解することは、予防策を立てる上で不可欠である。このレビューでは、広範囲の微生物バイオフィルムに有効な天然の抗バイオフィルム剤と、最近のバイオフィルム治療に関連する戦略に焦点を当てることを目的とする。
天然物由来の抗バイオフィルム剤
バイオフィルムの形成と発達は、様々な段階を含む複雑な手順であり、バイオフィルムの発達を防ぐために天然の抗バイオフィルム剤のターゲットとなり得る。よく研究されているバイオフィルム形成の段階には、(1)適切な生物/生体表面への細菌細胞の付着、(2)バイオフィルム構造の形成、(3)バイオフィルムの成熟、(4)分散がある(Boles and Horswill, 2008)。
バイオフィルムの形成には、最初の2つの段階が非常に重要であり、これらの段階の一方または両方を標的とすることが、バイオフィルムの形成を阻害する理想的な戦略であると思われる。付着段階では、細胞骨格要素(主に鞭毛、ビンブリア)とリポポリサッカライドがキープレイヤーとして関与している。
バイオフィルムの形成には、クオラムセンシングと呼ばれる細菌群の表面シグナル伝達/コミュニケーションが重要な役割を果たす。図2に示すように、天然の抗バイオフィルム剤は、多様なメカニズムで単独または相乗的に作用する。
図2 天然の抗バイオフィルム剤の作用機序に基づくワークフロー
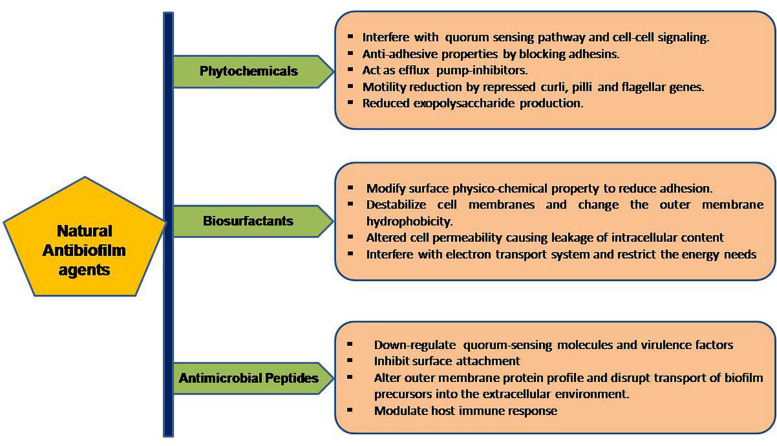
ファイトケミカル
高い抗バイオフィルム効果を持つ天然化合物は、大きく分けて5種類ある。それらは、フェノール類、精油、テルペノイド、レクチン、アルカロイド、ポリペプチド、ポリアセチレンである(Yongら、2019)。フェノール類は化合物の一群である。
フェノール酸、キノン、フラボノイド、フラボン、フラボノール、タンニン、クマリンの7つのサブクラスがあり、このうちタンニン、特に縮合タンニンは抗バイオフィルム活性を有する(Trentin et al.、2011)。
これらの化合物全体は、基質剥奪、膜破壊、アドヘシン複合体と細胞壁への結合、タンパク質への結合、真核生物DNAとの相互作用、ウイルス融合のブロックといった6つの主要なメカニズムによってバイオフィルムに作用する(Cowan, 1999; Lu et al.)
* *
抗バイオフィルム活性のための様々な供給源からの天然化合物の抽出には、いくつかの溶媒、すなわち水、メタノール、エタノール、クロロホルム、エーテル、ジクロロメタノール、およびアセトンが使用された。研究者によって行われた様々な実験により、水はアントシアニン、タンニンのような糖類、サポニン、テルペノイド、ポリペプチド、レクチンを抽出することがわかった。
エタノールでは、タンニン、ポリフェノール、ポリアセチレン、フラボノール、テルペノイド、ステロール、アルカロイド、プロポリスなどの化合物が、メタノールでは、アントシアニン、テルペノイド、サポニン、タンニン、クサントキシリン、クアシノイド、トータロール、フラボン、ラクトン、フェノン、ポリフェノールなどが抽出される(Cowan、1999年)。
クロロホルムで抽出するとテルペノイドとフラボノイドが、ジクロロメタノールで抽出するとテルペノイドのみが得られる(Cowan, 1999); エーテルを溶媒として使用すると、テルペノイド、アルカロイド、脂肪酸、クマリンが、アセトンで抽出されるとフラボノールが分離される。
Cnestis ferruginea Vahl ex DC.の水性抽出物から単離されたヒドロキノンとカフェ酸メチルエステルは、S. aureusに対して有望な結果を示した(Kouakou et al, 2019)。多くの研究者が、新規の天然抗バイオフィルム化合物の発見のために、薬用植物からの生物活性化合物に取り組んだ。
インドの薬用植物の抗バイオフィルム特性が利用され、Cinnamomum glaucescens (Nees) Hand.-Mazz, Syzygium praecox Roxb. Rathakr. & N. C. Nair, Bischofia javanica Blume, Elaeocarpus serratus L., Smilax zeylanica L., Acacia pennata (L.) Willd., Trema orientalis (L.) Blume, Acacia pennata (L.) Willd.である。
Holigarna caustica (Dennst.) Oken, Murraya paniculata (L.) Jack, and Pterygota alata (Roxb.) R. Br.抽出物は、黄色ブドウ球菌に対して有望な抗バイオフィルム活性を有する(Panda et al.、2020年)。アルジェリアの薬用植物であるSalvia officinalis L.のメタノール抽出物から同定された12-メトキシ-トランス-カルノシン酸およびカルノソールは、in vitro条件においてCandidaバイオフィルムに対する抗バイオフィルム活性を示している(Kerkoubら、2018年)。
* *
ファイトケミカルは、主にAHL、自己誘導物質、自己誘導物質2型のようなクオラムセンシング誘導物質をブロックすることによってクオラムセンシング機構を阻害する(Ciricら、2019年)。ニンニク抽出物は、シュードモナスおよびビブリオ属のバイオフィルムのクオラムセンシングシグナリング分子の阻害において重要な役割を果たす(Harjaiら、2010年;Luら、2019年)。
エモジンは、クオラムセンシングに関連する転写因子のタンパク質分解を助け、その強力な阻害剤として作用する(Dingら、2011年)。クオラムクエンチャーは、抗生物質とともに、多くの研究者によって議論されているように、最高の代替抗バイオフィルム剤である(Paluch et al.、2020)。
また、植物化学物質は、細菌の接着を阻害し、バイオフィルム形成に関連する遺伝子を抑制する上で重要な役割を果たす(Adnanら、2020年)。初期段階でのバイオフィルム形成は、様々な表面への細菌付着の支持を担う力(ファンデルワールス引力、静電引力、沈降、ブラウン運動)に干渉することで無法化できる(Roy et al.、2018年)。
植物性化合物は、付着および細菌の増殖に不可欠な栄養素へのアクセスを阻止する能力とともに、伸展を妨害する可能性を有する(Sandasi et al.)
* *
Psidium guajava L.のエタノールおよびアセトン抽出物(Razak and Rahim, 2003)および様々なEugenia属からの抽出物のC. albicansに対する抗接着特性に関する報告がある(Sardi et al., 2017)。
アルカロイド(norbgugaine)は、細胞の運動性の喪失による接着を防止することによって、P. aeruginosaバイオフィルムに有意な効果を示した(Majikら、2013年)。Adiantum philippense L.の粗抽出物に関するごく最近の研究では、バイオフィルムのエクソポリサッカライドの含有量を減少させる有望な役割を示した(Adnan et al.、2020)。
彼らは、Adiantum philippense L.粗抽出物が、アドヘシンタンパク質を標的とし、形成前のバイオフィルムを変形させ、EPS産生を妨害することによって、初期段階でバイオフィルムを抑制することを観察している。様々な研究者が、7-エピクルスアノン、タンニン酸、カスバンのようなポリフェノールを中心に、細胞表面の接着を防ぐ異なる植物性化合物群を同定している(Murata et al.2010; Carneiro et al.2011; Payne et al.2013; Adnan et al.2020 )。
* *
腸内細菌科のメンバーは、細胞表面にアミロイド繊維であるcurliを発現し、文字への付着や細胞の凝集を助け、バイオフィルム形成だけでなく細胞侵入も促進する(Tursi et al.)Cegelskiら(2009)は、ピリドン類がCsgA curliサブユニットの発現に影響を与え、curli biogenesisを妨げることを発見した。
マレーシアの植物からのフロレチン、ギンコール酸、および植物性化合物は、curliおよびpilli遺伝子の制御に役立つ(Leeら、2011、2014a、b;Johariら、2020)。Vikramら(2013)は、柑橘類のステロールβ-シトステロールグルコシドが、鞭毛オペロンflhDCを抑制することによって大腸菌O157:H7バイオフィルム形成と運動性を阻害することを報告した。
curlicideとpilicideの性質を持つ植物性化合物は、腸内細菌科細菌のバイオフィルム予防の治療戦略に利用できる(Johari et al.、2020)。副作用の少ない植物性化合物は、バイオフィルム関連感染症に対するより良い治療薬となり得るが、最近の報告では、個別的なアプローチよりも常に優れた複合的なアプローチが示唆されている。抗バイオフィルム活性が期待される植物由来の抗菌剤の一部を表1にまとめた。
表1 植物性化合物の抗バイオフィルム活性とその作用機序
| インビトロ (ブロスマイクロダイリューションアッセイ、クリスタルバイオレットアッセイ) および in vivo(単一種および二種培養モデル) |
カンジダ・アルビカンス(Candida albicans)と黄色ブドウ球菌(Staphylococcus aureus | 菌糸の形成を抑制する eDNA、多糖類、タンパク質のレベルを低下させることにより、バイオフィルムの形成を抑制する。
|
MIC(monospecies)=4μg/ml,MBIC90S(monospecies)=2μg/mlとした。
|
Qianら、2020年 | ||
| ハイパーフォリン | オトギリソウ | インビトロ (クォーラムセンシング阻害アッセイ、ヒト血漿タンパク質コーティングアッセイ、静止マイクロタイタープレートクリスタルバイオレットアッセイ)。
|
黄色ブドウ球菌AH1872 | 抗バイオフィルム活性と中程度のクーロムクエンチング活性を示すが、詳細なメカニズムは特定されていない | MIC50(開花地上部) = 0.512%v/v クォーラムセンシングの中程度の阻害を示す (QSIC50= 0.064-0.512%v/v) |
ライルズら、2017年 |
| ウォーバーガナル、ポリゴジアル、α-リノレン酸(ALA) | ユウガンジス | In vitro (テトラゾリウム還元アッセイ、チェッカーボードアッセイ)。
|
カンジダ・アルビカンス カンジダ・グラブラタ S. epidermidis S. aureus |
ポリゴジアルとワルブルガナールのα,β-不飽和1,4-ジアルデヒドは、発育中のバイオフィルムに対する強力な抗真菌活性に関与している ポリゴジアルはミトコンドリアATPaseに影響を与え、エルゴステロールレベルを低下させる。
|
BIC50(ワルブルガナル)=4.5±1μg/ml、BIC50(ポリゴジアル)10.8±5μg/ml BIC50(ワルブルガナル)=37.9±8μg/ml BIC50(ALA)=25μg/mlとした。
|
キパンガら、2020年 |
NS、指定なし
バイオサーファクタント
バイオサーファクタント(BS)は、細胞表面の疎水性の低下、膜の破壊、および電子輸送チェーンの阻害を通じて細胞接着能力を変化させることによりバイオフィルムの形成を妨げ、したがって細胞のエネルギー需要を制限する(Satputeら、2016年)。
様々なクラスのバイオサーファクタントは、抗菌、抗真菌、および抗バイオフィルム活性を示す様々な微生物によって生産される(Paraszkiewiczら、2019年)。Lactobacillus plantarumおよびPediococcus acidilactici由来のバイオサーファクタントが、黄色ブドウ球菌のクオラムセンシングシグナリング分子およびバイオフィルム関連遺伝子の発現に及ぼす影響を評価した(Yan et al.、2019年)。
彼らは、バイオサーファクタントは、バイオフィルム関連遺伝子dltB、icaA、cidAなどの発現を調節することにより、S. aureusバイオフィルムの成長を抑えることを報告した。Lactobacillus plantarum由来のBSは、12.5 mg/mlでcidA遺伝子の発現を有意に減少させた(Yanら、2019)。
Pediococcus acidilactici由来のバイオサーファクタントは、50mg/mlで自己誘導体-2(AI-2)シグナル伝達分子、アクセサリー遺伝子調節因子(agr A)、ブドウ球菌アクセサリー調節因子(sar A)の遺伝子発現をダウンレギュレートする(Yan et al.,2019年)。
以前の研究では、乳酸菌由来のBS担持リポソームの抗バイオフィルム活性が、遊離BSよりも黄色ブドウ球菌(MRSA)のバイオフィルム形成および除去を阻害する能力が高いことが報告された(Giordaniら、2019年)。いくつかのバイオサーファクタントを、バイオフィルムの成長、発達、および分散に対するそれらの結果とともに、表2にまとめた。
表2 最近報告された抗バイオフィルム活性を有するバイオサーファクタント
| クラス | ソース微生物 | 病原体株 | バイオフィルムへの影響 | 投与量 | 参考文献 |
| リポペプチドバイオサーファクタント(LPB) | アシネトバクター・ジュニイ | Staphylococcus aureus,Proteus mirabilis,Pseudomonas aeruginosaのバイオフィルム。
|
バイオフィルム破壊率 それぞれ35%、10%、32 バイオフィルム破壊率:それぞれ52, 31, 70 |
1250 μg/ml 2500 μg/ml |
オハディら、2020年 |
| リポペプチド | バウベリアバシアナ | しょうろくせいしんきん | 25.76% バイオフィルム撲滅 | 1.95 μg/ml | Abdel-Aziz et al., 2020 |
| リポペプチドサーファクチン-C15 | 枯草菌309号 | カンジダ・アルビカンス | バイオフィルム形成85%抑制 | 960 μg/ml | ジャネックら、2020年 |
| リポペプチドサーファクチン | バチルス・サフェンシスF4 | 表皮ブドウ球菌 | 80%の抗粘着力 | 6.25 mg/ml | アブデリら、2019年 |
| リポペプチド・ポンティファクチン | Pontibacter korlensis(ポンチバクター・コーレンシス)SBK-47株 | 枯草菌、黄色ブドウ球菌、サルモネラ菌、ビブリオコレラ菌 | 99%の抗粘着力 | 2mg/ml | バランら、2016 |
| リポペプチド | 枯草菌AC7 | カンジダ・アルビカンス | 付着力を最大67~69%、バイオフィルム形成を最大56~57%低減。
|
2mg/ml | セレサら、2016年 |
| グリコリポ蛋白質 | アシネトバクター・インディカスM6 | メチシリン耐性黄色ブドウ球菌 | バイオフィルム除去率82.5 | 500 μg/ml | Karlapudi et al., 2020 |
| 糖脂質 | Burkholderiasp. WYAT7 | おうしょくぶどうきゅうきん | 41% バイオフィルム形成阻害 79% バイオフィルム形成阻害 |
1 mg/ml 2 mg/ml |
Ashithaら、2020年 |
| ラムノリピッド | 緑膿菌MN1 | ミュータンスれんさきゅうきん | 事前に形成されたバイオフィルムの67%が解離 | 12.5 mg/ml | Abdollahiら、2020年 |
| ラムノリピッド | Burkholderia thailandensisE264 | Streptococcus oralis、Actinomyces naeslundii、Neisseria mucosa、Streptococcus sanguinis。
|
S. sanguinisバイオフィルムの90%抑制効果 S. oralisバイオフィルム70%抑制 N. mucosaバイオフィルム70%抑制 A. naeslundiiバイオフィルムの50%阻害 |
0.39 mg/ml 0.78 mg/ml 6.25 mg/ml 12.5 mg/ml |
Elshikhら、2017年 |
| エクソポリサッカライド | パンドレア・プノメヌサMS5 | ブルクホルデリアセパシア | Burkholderia cepaciaのバイオフィルム形成の抑制 | 0.25 mg/ml | Saccoら、2019年 |
Ohadiら(2020)は、自己凝集してβシートリッチなバイオサーファクタントベシクルを形成するAcinetobacter junii由来のアニオン性リポペプチドを同定した。このバイオサーファクタントは耐熱性があり、毒性も低いため、抗バイオフィルム剤として使用できる。
皮膚糸状菌が形成するバイオフィルムは根絶することが非常に困難である。昆虫を攻撃する菌であるBeauveria bassianaから得られたリポペプチドバイオサーファクタントは、M. canisのex vivo条件下で抗バイオフィルム剤として重要な役割を果たす(Abdel-Aziz et al, 2020)。
それは、細胞膜の完全性を破壊し、細胞膜の透過性を妨害することによって作用する。B. bassianaからのバイオサーファクタントは、急峻なコーンリカーから生産されるため、高価な生産という欠点を克服している。これは、難治性皮膚糸状菌症に対する有望なバイオサーファクタントとなり得る。
環状リポペプチドであるサーファクチンは、その金属錯体とともにC. albicansのバイオフィルムに関連した感染症に非常に有効であることが見出された。このバイオサーファクタントは、菌糸特異的な遺伝子の発現を制御し、主に細胞表面の疎水性を低下させることで作用する(Janek et al.、2020)。
* *
緑膿菌MN1から生産されるラムノリピッドは、サーファクチンよりも高い抗接着活性と抗バイオフィルム活性を有する(Abdollahiら、2020年)。Artemisia nilagirica (Clarke) PampのエンドファイトであるBurkholderia sp. WYAT7から分離された糖脂質は、S. aureusに対して抗バイオフィルム活性を有する(Ashitha et al.、2020)。
Acinetobacter indicus M6から同定されたLeu-His-Trpアミノ酸に富む広域糖脂質タンパク質は、毒性が低く、500μg/mlの濃度で82.5%のバイオフィルムを除去した(Karlapudiら、2020年)。
Pandoraea pnomenusa MS5からのEPSは、Burkholderia cepaciaに対する抗バイオフィルム剤として機能する(Saccoら、2019年)。この界面活性剤は、2つの機能性カルボニル基とヒドロキシル基を持つヘテロ多糖であり、油乳化能を有する。
* *
バイオサーファクタントは、尿道カテーテル、骨インプラントなどの医療用インプラントのコーティング剤として、合成薬剤を使用せずに病原性生物に由来するバイオフィルムを抑制するために適切なものである。ラムノリピッドおよびソルフォロリピッドは、グラム陰性およびグラム陽性微生物が形成するバイオフィルムの阻害のための潜在的な薬剤であると報告されている(Sharahiら、2019)。
ラクトバチルス・アシドフィルス由来の細胞結合型バイオサーファクタントが、ポリジメチルシロキサン(PDMS)ベースのインプラント上のProteus vulgarisおよびS. aureusのバイオフィルム形成を阻害すると報告した研究はほとんどない(Satpute et al.、2019)。
L. rhamnosus由来のバイオサーファクタントは、膜構造を破壊することによって細胞溶解を引き起こすため、シリコーンデバイス、すなわち喉頭切除の場合の人工声帯の多種のバイオフィルムの抗バイオフィルム剤として使用できる(Tan et al.、2017)。
バイオサーファクタントの抗バイオフィルム活性は、緑膿菌、大腸菌、および枯草菌のバイオフィルム形成を阻害するカプリル酸との組み合わせで広範囲に増強され得る(Diaz De Rienzo et al, 2016)、アンフォテリシンB(AmB)またはフルコナゾールは、C. albicansのバイオフィルム形成およびプレフォームドバイオフィルムに対して相乗的に作用し(Haque et al., 2016)、SDSなどの界面活性剤はP. aeruginosa PAO1バイオフィルムの破壊につながった(Nguyen et al., 2020)。
抗菌ペプチド
AMPは、真菌と細菌の両方のバイオフィルムの治療に広く使用されている広範な作用の抗菌剤である(Pletzer et al.、2016)。これらのペプチドは、黄色ブドウ球菌、肺炎桿菌、緑膿菌、腸球菌フェシウム、アシネトバクター、エンテロバクター属(ESKAPE)、および非ESKAPE病原体による院内感染で占められるカテーテル、人工弁、ステント、義歯などの医療機器に発生したバイオフィルムを破壊する(Rajput and Kumar, 2018)。
AMPは、細菌の細胞膜を攻撃することで、耐性菌が発生しにくい従来の抗生物質に代わるものである(Hirt et al.、2018)。AMPはヒト、動物、植物、微生物に自然に存在し、膜リン脂質と静電的に相互作用し、その後膜に挿入することで細菌細胞膜に作用し、細菌を死滅させる。AMPを抗菌性化合物と相乗的に作用させ、バイオフィルム形成の様々な分子経路を抑制するという報告もある(Shahrour et al.、2019)。
* *
両生類の皮膚は、様々なバイオフィルムを引き起こす微生物に対して有効な多くのAMPの供給源である。Yuanら(2019)は、膜透過性によってMRSAバイオフィルムを阻害するAMP Japonicin-2LFをFujian large-headed frog skin secretion (Limnonectes fujianensis)から単離した。
Japonicin-2LFは洗剤のように振る舞い、バイオフィルム中の浮遊性病原体と無柄病原体の両方を駆除する。この性質を利用して、このペプチドを嚢胞性線維症患者のMRSA感染症の治癒のための有望な薬剤候補として使用することができる。バイオフィルムに基づく感染症の治療にAMPを用いる場合の主な欠点は、様々な細菌プロテアーゼによって非常に分解されやすいということだ。
* *
カエル皮膚由来のAMPであるesculentin-1a、すなわちEsc (1-21)とそのd-アミノ酸含有ジアステレオマーEsc (1-21)-1cは、その膜撹乱活性によって緑膿菌のバイオフィルム形成を阻害することが示された。
以前の研究では、Esc (1-21)-1cが嚢胞性線維症患者の慢性肺緑膿菌感染症に対して潜在的な活性を示すことが報告されている(Casciaro et al.、2019)。AMP(エスクレンチン-1a)配列にLeu14およびSer17でd-アミノ酸を導入すると、AMPの安定性が高まり(Casciaro et al., 2019)、P. aeruginosaの遊泳、群泳および痙攣運動が減少し、最後にバイオフィルム形成が阻害される。このペプチドは、3つのメカニズムによって緑膿菌のバイオフィルム形成を阻害する。まず、緑膿菌の鞭毛の数を制御するfleN遺伝子をダウンレギュレートし、鞭毛を介した遊泳を阻害する。
第二に、1/8MICという非常に低い濃度でIV型ピリ生合成遺伝子のmRNAレベルを低下させ、バイオフィルム形成時のマイクロコロニー形成とコロニー形成に非常に重要な緑膿菌の痙攣運動を阻害することだ。また,Esc(1-21)MICは,バイオフィルム形成時に必須である緑膿菌の曳糸運動を抑制した。
* *
以上のことから、Esc (1-21)-1cは病原性遺伝子や細菌運動性遺伝子の発現を低下させ、最終的にバイオフィルムの形成を阻害することがわかった。これら2つの抗菌ペプチドesculentin-1a (1-21)とそのジアステレオマーEsc (1-21)-1cは、嚢胞性線維症患者の気管支上皮の修復に有望な結果を示している。
Cappielloら(2019)は、エスクレンチンが気管支細胞の移動を促進し、上皮成長因子受容体を活性化し、さらに再上皮化プロセスのためにIL-8の分泌を増加させることによって、嚢胞性線維症患者の気管支上皮を修復することを観察した。
さらに、ペプチドのエスクレンチン-1aは、細菌の界面活性剤ラムノリピッドの生合成に重要な酵素であるラムノシルトランスフェラーゼのサブユニット、すなわちRhlAおよびRhlBをコードするmRNAの発現を低下させる。Parduchoら(2020)による最近の研究では、AMPヒトβ-ディフェンシン2の特定の作用様式が、細菌表面の粗さを増加させ、外膜タンパク質プロファイルを変化させ、バイオフィルム前駆体の細胞外空間への移行を妨害することが報告されている(図2)。
* *
ハチ毒のメリチンペプチドは、抗菌活性を示し、MRSA全身感染を防ぎ、MRSA感染マウスモデルにおいて創傷治癒プロセスを開始する(Choiら、2015)。Khozaniら(2019)は、メリチンの効率を研究し、24時間の間に50μgの濃度でP. aeruginosaバイオフィルムバイオマスの約90〜95%を分解することを発見した。
ヒトカテリシジンLL-37は、非常に低い濃度でS. epidermidis ATCC 35984の細菌接着とバイオフィルム量を阻害する(Hellら、2010年)。LL-37は、抗バイオフィルム活性に加え、細胞動員などの免疫調節活性を示し(Tjabringa et al., 2006)、宿主の適応免疫応答を増強し(Diamond et al., 2009)、炎症反応を調節する(Mookherjee et al., 2006)。AMPが細菌のバイオフィルムに対抗するだけでなく、宿主免疫系を調節するという二重の特性を利用することで、薬剤耐性微生物のバイオフィルムと戦うための新しい戦略を設計することができる。
* *
Parduchoら(2020)は、ヒトβ-Defensin 2が、構造変化を誘発し、外膜タンパク質プロファイルを変化させ、細胞外空間へのバイオフィルム前駆体の移動を妨害することにより、緑膿菌バイオフィルムの抑制特性を有することを報告した。
抗バイオフィルム活性を有する少数の天然ペプチドとその欠点を表3に示す。あるペプチドDRAMP ID: サソリ(Tityus obscurus)の毒に由来するDRAMP18417は、Candida属およびCryptococcus neoformans株に対して有望な抗バイオフィルム活性を示した(Guilhelmelli et al.、2016)。これらのペプチドは、初期付着および成熟段階の真菌バイオフィルムを阻害し、赤血球およびマウス腹膜マクロファージに対して最小限の溶血活性および細胞毒性活性を示す。
表3 AMPの由来と効果
| AMPの名称 | アミノ酸配列 | 正味料金 | 3次元構造 | 出典 | バイオフィルムへの影響 | デメリット | 参考文献 |
| ジャポニシン-2LF | フィブシフィルク・カフシャルクック | 4 | ヘリックス | カエル皮膚分泌物 | メチシリン耐性黄色ブドウ球菌のバイオフィルム基質を除去するとともに、無芽胞性細菌をすべて死滅させる。
|
緑膿菌のバイオフィルムには無効。
微生物のLPS含量や細胞壁構造の変化に隠されていた抗バイオフィルム作用 |
ユアンら、2019年 |
| ダーマセプチン-PT9 | GLSKIKDAAKT AGKAALGFVNEMV | 2 | ヘリックス | カエル皮膚分泌物 | 黄色ブドウ球菌、MRSA、大腸菌のバイオフィルム形成を抑制する。
|
グラム陰性菌に対してより強力な活性を示す | 李ら、2019年 |
| フィロセプチン-PTa | を使用します。
|
2 | ヘリックス | カエル皮膚分泌物 | S. aureusバイオフィルムに対してより高い効力 | ペプチドの疎水性、電荷、αヘリシティによる抗バイオフィルム活性の変化 | リウら、2017 |
| モロネシジン様 | ffrnlwkgak aafraghaawra | 6 | 不明 | シーホース | 黄色ブドウ球菌のバイオフィルムの表面付着の抑制 | グラム陰性菌よりもグラム陽性菌に効果がある グラム陰性菌の外膜タンパク質が、外膜を介したAMPの移動を妨げている可能性がある |
モハマディら、2018 |
| マストポラン | lnlkall avakkil | 4 | ヘリックス | ヨーロッパスズメバチ毒 | 黄色ブドウ球菌および緑膿菌のバイオフィルム形成を抑制する。
|
哺乳類のマスト細胞からヒスタミンを放出し、免疫反応を引き起こす可能性 | チェンら、2018 |
| メリトイン | GIGAVLKVULTTG LPALISWIKRKRQQUE | 6 | ヘリックス | ミツバチ毒 | MDR緑膿菌の崩壊を誘導し、バイオフィルムを分解する。
|
メリチンの正常細胞に対する毒性は、臨床応用には不利である(3度の熱傷患者の場合、皮膚の3層すべてが破壊されているので、メリチンの細胞毒性はほとんど応用を制限しない)。
|
コザニら、2019年 |
| NA-CATH | krfkffkklknsv kkrakffkkpkvigvtfpf | 15 | ヘリックス | チャイニーズコブラ | Burkholderia thailandensisのバイオフィルム形成の防止 | ペプチドのサイズが小さいため、大規模な合成には限界がある | ブロアら、2015 デ・バロスら, 2019 |
| ディフェンシン ZmD32 |
RTCQSQSHRFRGPCLRRS N CANVCRTEGFPG RCRGFRRCFCTTHC | 12 | Helix 構造と Beta 構造の組み合わせ | とうもろこし(Zea mays | カンジダ・アルビカンス・バイオフィルムに対する活性 | 塩の存在下で失われる多くのディフェンシン類の抗バイオフィルム活性 | ケレンガら、2019年 |
| カプシクミシン | rscqqqiqq aqqlsscqqylkq | – | 不明 | 赤唐辛子、トウガラシ | MAA(Matrix Anti-Assembly)機構によるS. Epidermidisバイオフィルムの形成を阻止する。
|
ニューサウスウェールズ | Von Borowski et al., 2020 |
| アカゲザルのディフェンシン-1 | gfcrcrcrgvcrcictr | 5 | ベータ版 | 猿の白血球 | 定着したC. albicansのバイオフィルムに対して活性を示す。
|
宿主防御ペプチドの多くは、好ましくない炎症誘発性を示し、生物学的利用能も低い | バッソら、2019年 |
NS、指定なし。
移植された医療機器、ヒトの皮膚、腸、口腔にバイオフィルムを形成する病原体は、一般的にクオラムセンシング(QS)シグナルを通じてコミュニケーションをとる。天然由来のAMPのクオラムセンシング阻害能は、バイオフィルムに関連した感染症を克服するための抗生物質不使用の代替手段を提供する。
現在までに、3000以上のAMPが発見されているが、そのうちFDAによって承認されたものは7つしかない(Chen and Lu, 2020)。天然AMPの性能の低さ、細胞毒性および溶血活性、腎臓損傷、中枢神経系への損傷などの予期せぬ副作用のために、天然AMPの臨床研究は非常に不足している。
前臨床段階での天然型AMPの無益さは、臨床の場とその居住者の条件のばらつきによるものと思われる。そのため、様々な薬剤耐性バイオフィルムに対して、これらの天然抗バイオフィルム剤を使用するためには、臨床研究を大げさにし、最適化する必要がある。天然に存在する様々なAMPの構造を利用し、天然のものと比較して安定性と活性が改善された新規治療用ペプチドを開発することが不可欠である。
* *
広範な抗菌殺傷ペプチドドメインに連結した種特異的ペプチドからなる新規の特異的マルチドメインAMPを設計する努力がなされてきた(Sztukowska et al.、2019)。C16G2は、ターゲティングドメインとしてのストレプトコッカス・ミュータンスのコンピテンス刺激ペプチド(CSP)の16mer領域、柔軟なトリグリシンリンカーおよびG2 AMP、ノビスピリンG10の16残基断片(Steinstraesserら、2002)、オビスピリン-1の派生物(羊カテリサイジンSMAP29のN-末端18残基)を融合させて設計した最初の機能的特異標的AMPの1つである。
C16G2は、純粋培養と多種のコミュニティーの両方で、S. mutansのバイオフィルム成長を効果的に阻害する(Guoら、2015)。このペプチドは、S. mutansを殺すだけでなく、S. mutansに代謝的に依存する他の種を減らし、口腔内マイクロバイオームの再確立を媒介する。
この特異的標的AMPは、病原体を選択的に標的化し、常在菌である連鎖球菌はダメージを受けないようにすることで、天然の微生物叢の損失を回避することができる。C16G2は、女性および男性の歯科医師を対象に、さまざまなワニスおよびストリップの処方で、単盲検の第II相臨床試験(ClinicalTrials.gov Identifier: NCT03196219)を終了している。
* *
同様に、正常な微生物叢に影響を与えることなく、バイオフィルムの病原性生物のみを標的とする試みもなされている(Xuら、2020年)。彼らは、種特異的な腸球菌フェロモンcCF10と広域スペクトルAMP C6を融合させたペプチドを設計した。
彼らは、C6のN末端にcCF10を組み込むことで、E. faecalisに対する抗菌活性がC6単独に比べ劇的に向上することを証明した。また、この融合ペプチドは、ヒト赤血球に対して抗菌レベルで無視できるほどの溶血を引き起こすことを報告し、これらの融合ペプチドが臨床応用可能な抗バイオフィルム剤として利用できる可能性を示した。
天然物による治療戦略
従来の抗生物質治療の失敗は、バイオフィルム治療が補助的なアップグレードを必要としていることを示している(Zhangら、2020)。天然の抗バイオフィルム剤は、持続的なバイオフィルムを選択的に駆除し、バイオフィルムマトリックスへの抗菌剤の拡散を可能にする。
これらの天然物質は、バイオフィルム・サイクルの様々な段階をターゲットとして、バイオフィルム・マトリックスを分解し、最終的に放出された細胞を死滅させる(図3)。バイオフィルムの破壊と拡散のメカニズムをよりよく理解することは、研究者がより優れた抗バイオフィルム戦略を設計するのに役立つだろう。
図3 バイオフィルム形成の段階と抗バイオフィルム剤の潜在的標的
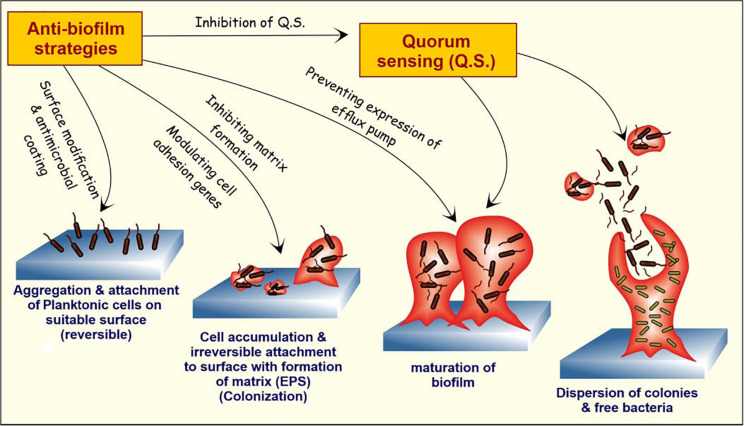
ヒトの細菌細胞は、ペプチドグリカン構造と共有結合を形成することによって、あるいは非共有結合によってマトリックス形成タンパク質に付着する。十分な数の細胞が付着・凝集すると、EPSマトリックスの形成が起こり、今度は外部からの反発力に対して抵抗力を持つようになる。
バイオフィルムの成熟に伴い、バルク構造内の細胞はさらに相互のコミュニケーションを開始し、特殊なタンパク質やDNAを分泌し始め、その一部は流出ポンプの形成に関与する。最後に、形成されたバイオフィルムから遊離した浮遊性細胞が分散することで、周辺部での新たなバイオフィルムの形成がさらに促進される。
天然の抗バイオフィルム化合物は、バイオフィルムの形成と発達の1つまたは異なる段階を攻撃し、バイオフィルムを阻害することができる
最近の研究では、エラスニン(放線菌Streptomyces mobaraensis DSM 40847由来の抗バイオフィルム化合物)が多種類のバイオフィルムのマトリックスを破壊し、抗生物質に対してより脆弱になることが報告されている(Long et al.)バイオフィルム阻害の現在の戦略を改善するために、本レビューの関心は、効果的で安全な戦略の開発のための天然薬剤を利用することだ。このレビューでは、EPSの崩壊、QSネットワークのクエンチ、接着の阻害、バイオフィルムの形成の阻害を目的として実用化されている現在のシステムをいくつか取り上げることを目的としている(図4)。
図4このレビューで取り上げた抗バイオフィルム戦略の図解
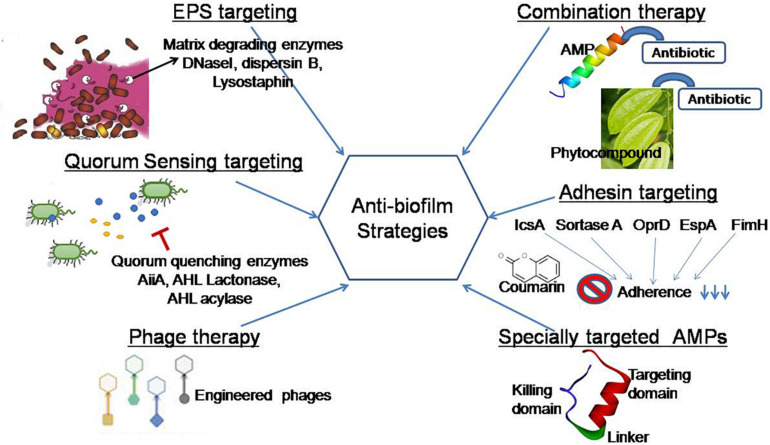
EPSのターゲティング。EPSマトリックスは、マトリックス分解酵素(DNaseI、Dispersin B、Lysostaphin)により標的とされ、表面への微生物の接着を阻害する。クオラムセンシングターゲティング。この戦略は、事前に形成されたバイオフィルムの細胞間コミュニケーションをブロックし、病原性因子の生産を制御する天然薬剤の使用に焦点を当てた(Shastry et al.、2019)。
ファージ療法。設計されたファージは、多糖類デポリメラーゼ酵素を産生することにより、マトリックスエキソポリサッカライドを分解する。特殊標的AMP:この新規戦略は、種標的ペプチドの存在により、種特異的に標的化する(Xuら、2020)。
アドヘシン標的化。フィトコンパウンドはアドヘシン蛋白質を標的とし、バイオフィルムの形成を初期にブロックする(Adnan et al.、2020)。併用療法。天然抗バイオフィルム剤は、単独使用と比較して、複合的なアプローチで効果的に機能する。
細胞外高分子物質(EPS)-標的化戦略
様々な微生物が分泌するEPSは、主に多糖類、構造タンパク質、細胞外DNAで構成されている。EPSマトリックスは、表面への微生物の接着、多層バイオフィルムでの凝集をサポートし、水和、消化能力、および抗菌化合物、抗生物質、宿主エフェクター分子に対する保護を提供する三次元足場として機能する(Flemming et al.、2016a)。
EPSマトリックスは、栄養勾配を積極的に変化させ、耐性や病原性形質に寄与する病原性環境を描写することができる。そのため、多くの治療戦略は、バイオフィルムを排除し、細菌を分解し、病原性環境を中断するために、EPSマトリックスを標的とするように設計されている。
多くの細菌酵素と二次代謝産物は、病原性細菌のクオラムセンシング機構を妨害し、バイオフィルム形成を中断させる(Khan et al.、2019)。グラム陰性歯周病菌アクチノバシラス・アクチノミセテムコミタンスが分泌するβ-N-アセチルグルコサミニダーゼやディスパーシンBなどのバイオフィルム基質分解酵素は、Staphylococcus epidermidisの成熟バイオフィルムの崩壊を行う。
2つのEPS分解酵素であるDNase Iとdispersin Bのカクテルは、in vivo豚皮膚コロニー形成モデルにおいて、ブドウ球菌の皮膚コロニー形成を阻害し、あらかじめ付着した黄色ブドウ球菌細胞を皮膚から除去し、そのポビドンヨード感受性を高めることが分かっている(Kaplanら、2018年)。
Hoganら(2017)は、リゾスタフィンが有効な抗ブドウ球菌剤であり、抗生物質との併用で治療効果が向上することを報告した。少数のバイオフィルム分解酵素とそのバイオフィルム阻害機構を表4にまとめた。
表4 様々なヒト病原体に対するバイオフィルム分解酵素
| 酵素 | 出典 | 病原性細菌 | バイオフィルム阻害の分子機構 | 参考文献 |
| セリンプロテアーゼ、Esp | 表皮ブドウ球菌 | おうしょくぶどうきゅうきん | Espは、黄色ブドウ球菌の表面タンパク質と宿主の受容体を分解する。
|
杉本ほか, 2013 |
| リゾスタフィン | シミュランスぶどうきゅうきん | メチシリン耐性黄色ブドウ球菌(MRSA) | ペプチドグリカンのペンタグリシン架橋を切断し、EPSマトリックスを破壊する。
|
アルグブリら、2017 ホーガンら、2017 |
| α-アミラーゼ | 枯草菌S8-18 | メチシリン耐性黄色ブドウ球菌(MRSA) | EPSマトリックスを破壊してプリフォーム成熟バイオフィルムを分解する | Kalpanaら, 2012 |
| セルラーゼ | ペニシリウム・フニクロスム トリコデルマ・リーゼイ |
緑膿菌 | 表面および多糖類マトリックスへの細胞の接着を減少させる | ロワゼル・アンド・アンダーソン、2003 |
| セルラーゼ | アスペルギルス・ニガー バチルス属菌 DGV19 |
ブルクホルデリアセパシア | エクソポリサッカライドを分解する。
|
ラジャセカランとラメッシュ, 2013 |
| アルギン酸リアーゼ | Bacillus circulansATCC 15518 | 緑膿菌 | エクソポリサッカライドを分解する。
|
アルカワシュら、2006 |
| ヒアルロン酸 | equi連鎖球菌 | おうしょくぶどうきゅうきん | ニューサウスウェールズ | イバーソンら、2016年 |
| システイン、ヒスチジン依存性アミドヒドロラーゼ/ペプチダーゼ チャップK |
ミオウイルス科 ブドウ球菌ファージK | おうしょくぶどうきゅうきん | Staphylococcus細胞壁ペプチドグリカンのペンタグリシンクロスブリッジのd-アラニンと最初のグリシンが関与するペプチド結合を切断する。
|
フェントンら、2013 |
| エンドライシンLysH5 | ファージvB_SauS-phiIPLA88 | 黄色ブドウ球菌、表皮ブドウ球菌 | 抗パーシスター剤 | グティエレスら、2014年 |
| DNase I | ヒト皮膚角層 | 緑膿菌、黄色ブドウ球菌 | 細胞外DNAの分解により、バイオフィルムの形成を防ぐ | Eckhartら, 2007 |
| DNase IとProteinase K | ニューサウスウェールズ | Actinomyces oris、Fusobacterium nucleatum、Streptococcus mutans、Streptococcus oralis、Candida albicans。
|
eDNAと細胞外タンパク質の除去によるバイオフィルムの構造的完全性に影響を与えた。
|
Karygianni et al., 2020 |
| トリプシン | 膵臓セリンエンドプロテアーゼ | 緑膿菌 | バイオフィルムマトリックスのタンパク質含有物を破壊する。
|
バナールら、2016 |
NS、指定なし。
触媒活性が低い既存の酵素は、モデリングとエンジニアリングのアプローチにより、バイオフィルムに対する触媒特性を向上させることができる。部位特異的変異解析は、酵素のバイオフィルム阻害特性を調節するもう一つのアプローチとして考えられている。
このように、幅広いQSシグナル分子やバイオフィルムの構造部分を標的とすることができる、幅広いスペクトルの酵素/ペプチドや二次化合物をバクテリアから分離し、バイオプロスペクションを行う必要がある。不均一なバイオフィルムを完全に除去するには、タンパク質、多糖類、eDNA、およびQS分子を分解できる加水分解酵素の合体が必要である(Yuan et al.、2020)。バイオフィルム制御におけるマトリックス分解酵素の応用は、コスト、取り扱い手順、および低い産業上のアクセス性のために、現在のところ制限されている(Naharら、2018年)。
クオラムセンシングターゲティング戦略
細胞間通信(クォーラムセンシング)の防止は、バイオフィルム形成を抑制する効率的な戦略である(Sharahi et al.、2019)。内生エンテロバクター種の無細胞抽出物由来の金属タンパク質AHL-ラクトナーゼがN- AHLの分解を引き起こし、アエロモナスハイドロフィラのバイオフィルム形成を著しく抑制することが報告されている(Shastry et al.)最近の研究の結果、新規クオラムクエンチング細菌としてのLactobacillus crustorum ZHG 2-1は、N-3-オキソドデカノイル-dl-ホモセリンラクトン(3-oxo-C12-HSL)およびN-ブチリル-dl-ホモセリンラクトン(C4-HSL)を分解して、P. aeruginosaに対する抗バイオフィルム剤として機能することを報告した(Cui et al, 2020)。
これまで、いくつかのクオラムクエンチング(QQ)酵素や化合物が報告されている。これらのQQ分子の大部分は、天然物から単離されている(LaSarre and Federle, 2013)。最近の研究の結果、緑膿菌バイオフィルムに対するナトリネマヴェルシ・フォルムの無細胞上清と細胞からの酢酸エチル抽出物のQS阻害能が明らかになった(Başaran et al.、2020)。
植物由来の天然物から多くのQS阻害剤が同定されており(Caceres et al., 2020; Zhong et al., 2020)、将来のバイオフィルム標的戦略に有効であることが提案されている。クオラムセンシング分子の阻害における天然抗バイオフィルム剤の役割については、レビューの前半で述べたとおりである。
ここでは、QS機構の破壊に対するそれらの効果について説明を試みた。これらの抗バイオフィルム剤は,主に2つの方法でクオラムセンシングシステムを破壊する:(1)シグナル分子の阻害と分解,(2)シグナル分子を模倣して対応する受容体への結合を阻害する(Kalia, 2013)。
* *
一方、クオラムクエンチャーは通常、種特異的であるため、種が混在するバイオフィルムを排除するためには、クエンチャーを組み合わせることが必要である。ニンニクから抽出した硫黄を多く含む分子であるアホエンは、グラム陰性菌(緑膿菌)とグラム陽性菌(黄色ブドウ球菌)の両方において、低分子制御RNA(sRNA)の発現を減少させる。
アホエンは、広範な範囲のクオラムセンシング阻害剤を標的とする、すなわち、S. aureusのRNAIII発現を低下させ(Scoffoneら、2019)、P. aeruginosaのRsmYおよびRsmZを低下させる(Jakobsenら、2017)ことが確認された最初の化合物である。
アホエンは、P. aeruginosaの低分子制御RNA(rsmYおよびrsmZ)の発現を低下させ、その結果、バイオフィルム基質多糖のPelおよびPslとVI型分泌系(T6SS)の翻訳が抑制されることが分かった。緑膿菌のT6SSは、様々な病原性因子の発現に必須の役割を果たし、バイオフィルム形成、ピロシアニン産生、病原性に大きく関与している(Li et al.、2020)。
これらの知見は、T6SSが緑膿菌感染症に対する有望な治療標的である可能性を示唆している。また、Jakobsenら(2017)は、アホエンがS. aureusの制御RNAおよびRNAIIIの発現を低下させ、リパーゼ、プロテアーゼ、α-ヘモリシニンなどのRNAIII依存性の病原性因子の発現を抑制することを見出した。
Rheum palmatum (Chinese rhubarb)およびPolygonum cuspidatum (Asian knotweed)から同定されたアントラキノン誘導体であるEmodin (1, 2, 8-trihydroxy-6-methyl anthraquinone)はStreptococcus suisのluxS 遺伝子 (Yang et al., 2015)とS. aureusのicaA, sarAおよびagrA 遺伝子 (Yan et al., 2017)を有効にダウンレギュレートした.
* *
抗バイオフィルムペプチドHuman Cathelicidin LL-37は、細菌細胞のシグナル伝達系に影響を与え、QS系の遺伝子をダウンレギュレートすることにより、0.5μg/mlでP. aeruginosaバイオフィルム形成を阻害する(Di Somma et al.、2020年)。
AMPは細菌の膜と相互作用し、その結果、QSを介して制御されている遺伝子を活性化する。これらのQS自己誘導物質は、膜小胞の助けを借りて、細胞膜を通過する。この過程で、QSに関連する病原性遺伝子の発現が活性化される。自己誘導物質は、種間のシグナル伝達を助ける。
興味深い自己誘導物質のひとつに、乳酸菌の小さな自己誘導ペプチド分子(AIP)があり、微生物の生存を阻害し、バクテリオトキシン産生の抑制因子として作用している。エキソトキシン産生を抑制する過程で、agr QSシステムを妨害する(Vasilchenko and Rogozhin, 2019)。
しかし、クオラムクエンチャーは、バイオフィルムの狭い領域のみに限定されたこれらの阻害剤の使用を可能にするバイオフィルム形成中に洗い流されることがある(Kooら、2017年)。したがって、これらの阻害剤と他の戦略を組み合わせたアプローチは、新しい治療アプローチにつながる。
ファージ療法
溶菌性バクテリオファージは、バイオフィルム細胞を除去する効果的な治療戦略として使用されてきた。最近発表された研究では、2つの溶菌性ファージvB_SauM_ME18とvB_SauM_ME126が、MDR S. aureusのバイオフィルムを阻害するための天然抗菌剤の可能性を証明した(Ghariebら、2020年)。
最近の研究では、(人工)ファージ由来の酵素-多糖類デポリメラーゼまたはペプチドグリカン分解酵素-が有望な治療用抗バイオフィルム候補であることが示されている(Reuter and Kruger, 2020)。ファージ療法は、2019年に最初のFDA承認を得て、カリフォルニア大学サンディエゴ校(UCSD)の医学部ファージ療法センターで患者がファージ治療を受けた(Pires et al.、2020年)。
ファージ療法の投与は一部の国でしか行われておらず、その臨床利用には、特徴あるファージを集めたファージバンクの設立、製造時のファージ製剤の安全性、安定性、品質、ファージに対する細菌の耐性進化など多くの課題がある。
併用療法
天然の抗バイオフィルム剤は、抗生物質を感作し、併用することでより効果的であることが確立されている(Zhang et al.)彼らはまた、houttuyfonateナトリウムとlevofloxacinを組み合わせて適用すると、バイオフィルム形成を阻害するのに良い方法で作用すると報告した。
植物由来の抗ニューロペプチドであるホウトゥイフォン酸ナトリウムは、緑膿菌のバイオフィルム分散を効果的に破壊する(Wangら、2019年)。シトラスやグレープフルーツから抽出されたフラバノン配糖体であるナリンジンは、市販されている抗生物質のシプロフロキサシンおよびテトラサイクリンの個別処理と比較して、P. aeruginosaバイオフィルムに対してより有効であることが判明した(Dey et al.、2020年)。ナリンジンは、バイオフィルムEPSを枯渇させ、抗菌剤の拡散を促進し、ペリクル形成を減少させ、カテーテル表面での細菌の鞭毛運動を減少させる。
* *
Zhouら(2018)は、大麦由来のポリフェノール化合物であるホルデニンのバイオフィルム形成に対する効果を、単独で、またアミノ配糖体抗生物質であるネチルミシンと併用して試験した。その結果、ホルデニンとネチルミシンの併用により、P. aeruginosa PAO1バイオフィルムが最大で88%減少し、個々の処理による効果よりも有意に優れていることが確認された。
これは、薬物とハーブの併用療法が、効果的な抗バイオフィルム製剤の機会として探索される可能性があることを示すものである。SEM研究では、バイオフィルム層の厚さが減少し、その構造が破壊されていることが示された。また、バイオフィルム形成に対するメカニズムとして、ホルデニンによるクオラムセンシング制御遺伝子、特にlasRの発現のダウンレギュレーションが明らかにされた。
異なる微生物種のアクチノバクテリア化合物も、細胞表面および細胞間の相互作用を阻害することにより、異なる病原性細菌に対する潜在的な抗バイオフィルム活性を示している(Azmanら、2019年)。異なる供給源からの、またはバイオフィルム発生の異なる段階に作用する複数の天然抗バイオフィルム化合物/sの組み合わせに焦点を当てた研究は、バイオフィルムを標的としたより効果的な薬剤の開発にさらに役立つだろう。さらに、バイオフィルム形成に対する天然化合物の効果は、細菌株によって異なるため、より効果的な化合物を選択することも必要である。
抗バイオフィルム生体材料療法
バイオフィルムに関連した病原体がインプラント表面に付着することにより、その臨床応用が制限されるため、予防策として生体材料をコーティングする試みが様々な研究者によって行われている。藻類多糖類ウルバン、デキストラン、デルマタン硫酸の抗付着性コーティング、抗菌剤放出性多糖類コーティング等の天然高分子系表面コーティングがこの10年間に普及した(Junter et al.)最近の報告では、抗接着性シアノコーティング(海洋性シアノバクテリアCyanothece sp. CCY 0110からのコーティング)が、カテーテル連動尿路感染症におけるより広範囲の微生物(特にProteus mirabilis、大腸菌、C. albicansバイオフィルム)に対する防御策として活用された(Costa et al., 2020)。
細胞接着を防ぐ分子メカニズムは、親水性多糖類が表面に水和層を形成し、物理的バリアとして働き(Damodaran and Murthy, 2016)、細胞の表面への接着を防ぐというものである。バイオフィルムの感染を回避するための骨被覆材として、リン酸カルシウム系セメントやハイドロキシアパタイトがあるが、臨床試験において様々な限界がある(Pan et al.、2018)。
インプラント関連の感染症は、膜の溶出による細菌の付着とバイオフィルムの形成を防ぐキトサンハイドロゲルコーティングによって回避できる(Pan et al.、2018)。一群の天然ポリマーは、主に歯周病バイオフィルム形成性病原菌の標的部位への抗生物質の送達を助ける繊維、ストリップ、ゲル(バダムガム、カラヤガム、キトサン)、フィルム(キトサン)、ナノ粒子、微粒子などの様々な形態の薬剤トランスポーターとして用いられた(チら、2019年)。
FDA認可のAMPであるナイシンは、メチシリン耐性黄色ブドウ球菌、肺炎球菌、腸球菌、クロストリジウム・ディフィシルに対して従来の抗生物質と相乗的に抗バイオフィルム剤として作用する(Shin et al.、2016)。最近の報告では、ナイシンと生体適合性多糖類であるジェランガムとのコンジュゲーションは、バイオマテリアル研究において有望な結果を示すと述べられている(Peng et al.、2020)。
結論と今後の方向性
バイオフィルムに基づく多くのヒト感染症の発生とその多剤耐性は、医学とヒトの健康における大きな関心事である。バイオフィルムにおける抗生物質への耐性率の上昇は、新規の天然抗バイオフィルム剤の発見と特徴づけにつながる。本総説では、有望なバイオフィルム阻害能力を示す様々な種類の植物性化合物、抗菌ペプチド、およびバイオサーファクタントについて述べる。
天然由来の抗バイオフィルム剤は、骨、歯科、眼球レンズ、乳房インプラントのような追跡不可能な感染部位の可能性がある特定の手術や疾病に対処するために効果的に使用され得る。これらの天然由来の薬剤は、従来の抗生物質と比較して、構造的・機能的に多様である。
このような天然由来の抗バイオフィルム剤の構造と機能を利用し、活性、安定性、信頼性の高い高度な治療法が多数開発されている。ここでは、天然の微生物叢を乱すことなく、薬剤耐性のある病原性バイオフィルムに対して、特別な標的を持つAMPの有効性について分析を続けている。
* *
ファイトケミカルを中心とした天然物の抗バイオフィルム剤としての研究は、in vitroおよびin vivoの条件下でより多く行われてきたが、膨大な努力にもかかわらず、FDA承認薬は一つも開発されていない。そのほとんどは、第II相および第III相臨床試験で失敗した(Lu et al.)この失敗の理由として考えられるのは、投与後のヒトでの化合物の利用可能性が、化合物の効力を低下させることであろう。
この問題の解決策として考えられるのは、より良い結果を得るために、天然の抗バイオフィルム剤とともに、抗生物質のような戦略の組み合わせである。天然物と市販の抗生物質との併用療法は、抗バイオフィルム活性を向上させるために、今後、緊急に開発される必要がある。
天然物由来のクオラムクエンチャーと抗生物質との併用は、バイオフィルムの種特異的破壊のための新規リードとなり、バイオメディカル産業での利用が期待される。この点については、新規の抗バイオフィルム植物性化合物を医薬品に転換するための研究がさらに必要である。
…clinicaltrials.gov/areで報告されている天然抗バイオフィルム化合物の臨床研究のほとんどは口腔バイオフィルムに焦点を当 et al.)今後、天然抗バイオフィルム剤の効率性を検証するために、in vivoモデルや臨床試験でのさらなる研究が必要である。
* *
また、本レビューでは、天然由来のクオラムクエンチング分子とEPS分解酵素について、様々なバイオフィルムに対する作用機序とともに解説している。バイオフィルムに対する様々な天然物薬剤の作用機序は、まだ不明である。このような作用機序の研究が進めば、新規の抗バイオフィルム剤の同定に役立つと思われる。
抗アドヘシン戦略は、細菌が細胞表面に付着するのを阻害するため、広範囲の細菌に対するバイオフィルム治療の新規戦略となり得る。この分野の研究は非常に少ないので、今後アドヘシン蛋白質の方向からバイオフィルムをターゲットにする研究が進めば、ユニークな天然の抗バイオフィルム剤の発見につながる可能性がある。
Piliやcurliの遺伝子発現を制御する植物性化合物は、バイオフィルム形成を制御することができる。これらの方向での研究が進むか、あるいは抗アドヘシン特性を持つ植物性化合物の組み合わせが、バイオフィルム関連疾患のより良い治療戦略となる可能性がある。
* *
臨床試験で天然薬が失敗することは、厳密な品質管理によって確認することができる。感度が高く安定した正確なマーカーを発見することで、この問題を解決し、天然の抗バイオフィルム剤の品質管理をより良くすることができる。天然化合物は非常に複雑な構造格子を持つため、有用なQCマーカーを発見することは、天然物研究が直面する重要な課題である(Zhang et al.、2020)。
天然化合物の薬効は、主にネットワーク薬理学の手法に基づいている。そのため、この方向での研究が進めば、最終段階での臨床試験の成功率を高めることができる。今後、品質管理、PK-PD(pharmacokinetic and pharmacodynamic co-relationships)、PK-PD相互作用と宿主のメタボロミクスを厳密に研究し、薬の安全性と有効性を評価すれば、治療における新しい天然抗バイオフィルム剤の可能性が出てくるかもしれない。
利益相反
著者らは、本研究が利益相反の可能性があると解釈される商業的または金銭的関係のない状態で実施されたことを宣言する。
謝辞
本研究を進めるにあたり、デュイスブルグ・エッセン大学化学部バイオフィルムセンターのHans-Curt Flemming教授、およびシンガポール環境生命科学工学センター(SCELSE)の客員教授から、貴重な概念的・技術的助言をいただいた。
略語
- AHL アシルホモセリンラクトン
- AMP 抗菌ペプチド
- BFC バイオフィルム形成能
- CLSM 共焦点レーザー走査型顕微鏡
- CSH 細胞表面疎水性
- eDNA 細胞外DNA
- EPS 細胞外高分子物質
- GA ギンコール酸
- HSL ホモセリンラクトン
- MBIC 最小バイオフィルム抑制濃度
- MFC 最小殺菌濃度
- MIC 最小発育阻止濃度
- PMNs 多形核白血球(polymorphonuclear leukocytes
- QS クォーラムセンシング
- SEM 走査電子顕微鏡法
- TEM 透過型電子顕微鏡
* *
