Contents
zenodo.org/record/6601991#.Yp_9U6hBzWR
2022年6月1日
荒川 央
1IFOM – FIRC Institute of Molecular Oncology Foundation, Milano, Italy
キーワード SARS-CoV-2,オミクロン、中立進化、同義置換、非同義置換
SARS-CoV-2の変異株であるオミクロンは、多くの変異を獲得している。これらの新規変異は、ワクチン接種に反応して生成される抗体の継続的な有効性に関して懸念を抱かせるものである。本研究では、SARS-CoV-2亜型のオミクロンの進化がダーウィンの軌跡をたどらないことを明らかにした。オミクロン変異株の変異は、同義置換よりも非同義置換に大きく偏っている。興味深いことに、オミクロン変異株のスパイク遺伝子に影響を与える変異は、ほとんど非同義のみである。さらに、スパイク遺伝子内の非同義置換の偏りは、本研究で評価したすべてのSARS-CoV-2変異株に共通する特徴である。この変異の特徴は、中立的進化の反証であり、これらのSARS-CoV-2変異株のスパイク遺伝子は、突然変異と選択による試行錯誤なしに進化してきたことを示している。したがって、これらのSARS-CoV-2変異株のスパイク遺伝子は、自然進化の結果ではなく、デザインされた分子であると推測される。
はじめに
SARS-CoV-2 オミクロン変異株(B.1.1.529株)は、ボツワナで初めて確認され[1] 2021年11月24日に南アフリカから世界保健機関(WHO)に報告された[2]。オミクロン変異株は、そのスパイク遺伝子に多くの新規変異を有している[3-5]。多数の変異とその独自性から、オミクロンは既存のCOVID-19ワクチンによって誘発される免疫反応を効果的に回避することができると懸念された[1]。
ウイルスタンパク質の変異は、ウイルスの進化にはつきものであり、SARS-CoV-2の場合、その流行から予想されていたことだ。しかし、オミクロン変異株は、突然多くの変異を獲得したため、ダーウィン進化というよりも、むしろ断続的な進化パターンに一致するユニークなものである。このような非常に珍しい進化の軌跡から、オミクロンの起源は科学者の間で活発に議論されている[1, 2]。オミクロン変異株の起源に関する現在の仮説は以下の通りである。1)COVID-19に慢性的に感染している免疫抑制患者で発生した[6]、2)ウイルスモニタリングのインフラがほとんどない地域で数ヶ月かけてゆっくりと進化した[1, 2]、3)オミクロン変異株はヒト以外の宿主で進化した後、新しい変異のレパートリーをもって再びヒトに流出した[7]、などである。これら3つの中心的な仮説には、いくつかの問題点がある。
もし、オミクロン変異株が免疫抑制された患者で進化したのであれば、他の変異も持っていて、事実上、感染しにくくなっていることが予想される[2]。実際、オミクロンは既知のウイルスの中で最も感染力が強いと思われる。同様に、もしオミクロンが新しい動物を宿主として進化したのであれば、すでにヒトからヒトへの感染性が高いということはありえないだろう。最後に、COVID-19のパンデミック性と世界的な注目を考えると、オミクロンが数ヶ月の間に発見されずに進化できたような、十分に大きく、モニタリングされていないコミュニティが存在するとは考えにくい [2, 8]。さらに、オミクロンがCOVID-19ワクチン接種者の間で高い感染率と感染力を持つことを考えると、その突然変異はワクチン媒介免疫を回避することを可能にしたようである。もし、オミクロンの変異型が動物や未警戒の地域社会、あるいは免疫抑制された患者の中で進化していたら、ワクチンによる免疫を回避するようなウイルスの選択的圧力はほとんどなかったであろう。最近のある論文は、オミクロン変異株がマウスで進化した可能性を示唆している[7]が、マウスに効率的に感染できるという実験的な証拠はない。
オミクロン変異株の起源を調べるには、それが自然進化の過程で確立されたものかどうかを検証する必要がある。中立進化論とは、ほとんどの変化はランダムな遺伝的ドリフトによって固定化され[9]、一般に生物の体力を変化させないという理論である。この理論は分子レベルの進化に適用され、自然淘汰による表現型の進化と両立させることができる。同義置換(サイレントミューテーションとも呼ばれる)とは、アミノ酸配列を変化させないコドン上の変異のことだ。これに対して、アミノ酸配列を変化させる変異は非同義置換と呼ばれ、置換突然変異とも呼ばれる。非同義置換と同義置換の比率は、中立変異、純化選択、有益変異のバランスを推定するのに使われる[10]。本研究では、SARS-CoV-2亜型の分子進化の軌跡を解析することにより、その起源を明らかにすることを目的としている。
材料と方法
ゲノムの収集
SARS-CoV-2変異株のゲノムをGISAID (www.gisaid.org/) から検索した。武漢SARS-CoV-2の塩基配列もGenbankから取得した。Accession numberはsupplemental Table S1にまとめた。
ゲノム解析
SARS-CoV-2のゲノム配列はCLC Genomics Workbench (QIAGEN, Aarhus, Denmark) を用いてアライメントし、さらにアライメントを手動で修正した。系統樹はneighbor-joiningアルゴリズム[11]を用いて構築した。距離測定にはJukes-Cantorを使用した。ブートストラップ再サンプリングは100回繰り返しで行った。
変異解析
各変異は、プロト・変異株配列をプロト・ウーハンに対してアラインメントすることにより同定した。Ka/Ks値はKaKs計算機[12]を用いて、Nei/Gojobori法[10]により解析した。
結果
SARS-CoV-2変異株の推定祖先配列
オミクロンを含むSARS-CoV-2の各変異株は、変異、欠失、挿入により多様性を蓄積している。各変異型の配列は、その祖先株とわずかに異なることが予想される。各変異株の祖先配列を明らかにするために、GISAIDデータベース[3]から各変異株の最も古い収集配列10件をダウンロードした。SARS-CoV-2亜型の祖先は、それらの亜型の配列の中で共有・保存されている配列によって同定され、プロト「亜型」と名付けられた。祖先配列の分子系統樹から、それらは祖先である武漢SARS-CoV-2,プロト武漢の別個の子孫であることが示された(図1)。また、プロト変異株の配列をプロト武漢と比較することにより、変異株の変異スペクトルを同定した(図S1)。
SARS-CoV-2変異株の非同義置換の偏り
SARS-CoV-1はSARSの原因となったコロナウイルスであり[13]、コウモリコロナウイルスRaTG13はSARS-CoV-2の近接起源の一つであると考えられている[14]。SARS-CoV-1,RaTG13,プロト・ウーハン間の進化では、ほとんどの遺伝子で非同義置換よりも同義置換の頻度が高かった(図2A)。スパイク遺伝子は3.8 kbであるが、ORF1abは21.3 kbに及ぶ大きなORFであり、SARS-CoV-2ゲノム30 kbの71.2%を占めている。他の遺伝子、M、ORF6,ORF7a、ORF7b、ORF8,Nの大きさは小さい。各遺伝子のサイズを考えると、ORF1abが他の遺伝子よりも頻繁に変異していることは理にかなっている。
プロト・ウーハンからの各変異株における変異の蓄積は、SARS-CoV1,RaTG13,プロト・ウーハンに比べて限定的であり(図2B)それらの進化的距離を反映していると考えられる。最も多くの変異を持つプロト・オミクロンは、プロト・ウーハンから最も分岐していた(図2B)。1つの挿入と5つの欠失に加えて(表s2)プロト・オミクロンは52の変異を持ち、そのうちの30はスパイク遺伝子に位置している(図2B)。興味深いことに、スパイク遺伝子の30個の変異のうち29個は非同義置換である(図2B)。プロトオミクロンの同義置換はORF1abに集中しており、11個の変異のうち4個が同義置換である。ORF1abをオミクロンの全変異から除外すると、全41個中36個(87.8%)の非同義置換が存在することになる。
他の変異株でも同様の傾向が見られ(図2B)プロト変異株の変異のほとんどがスパイク遺伝子とORF1abに集中していることが確認された。スパイク遺伝子、ORF1ab、N以外の遺伝子には、ほとんど変異がなかった。興味深いことに、オミクロンとラムダの変異株では、同義置換はスパイク遺伝子上に1つだけあった。各変異株の同義変異のほとんどはORF1ab上に位置していた。そこで、各変異株の総突然変異量からORF1ab上の変異を除いたものを比較した。その結果、N(非同義)/S(同義)比は、変異株間で非常に高くなった。特に、プロトデルタとプロトMuGHは、ORF1ab以外の同義の変異がなかった。
SARS-CoV-2変異株のスパイク遺伝子における中立的進化の欠如
同義および非同義遺伝子座の数は各コドンによって異なる。例えば、LeuコドンTTAの1塩基置換は、7つの非同義置換と2つの同義置換の9つの異なるコドンを生成することができる。したがって、コドンTTAの3ヌクレオチドは、7/3ヌクレオチド(=3ヌクレオチド×7/9)の非同義部位と2/3ヌクレオチド(=3ヌクレオチド×2/9)の同義部位から構成されている[10]。したがって、変異頻度は非同義部位あたりの非同義置換数(Ka)と同義部位あたりの同義置換数(Ks)の比として正規化することができる。
SARS-CoV-1,RaTG13,プロトWuhan間の進化を見ると、ほとんどの遺伝子でKsがKaより有意に高く、中立進化であることがわかる(図3A)。このような低いKa/Ks比は、SARS[15]を含め、中立進化をたどるウイルス進化が予想されることと一致する[16]。プロト武漢から子孫のプロト変異株までの変異シグネチャーを図3Bに示す。のKaとKsである。M、ORF6,ORF7a、ORF7b、ORF8,およびNのKaとKsは、その小さなサイズを反映して過剰発現している(図3B)。変異株によっては、KaがKsより高くなるとは限らない。ORF1abのKaは、プロト・デルタを除くすべての変異株においてKsより一貫して低い値であった。逆に、スパイク遺伝子のKaは、すべてのプロト変異株において、そのKsよりも顕著に高い。このようなスパイク遺伝子のKa/Ks比は、SARS-CoV-1,RaTG13,プロトWuhanの進化過程で観察されたものとは著しい対照をなしている。このことから、これらのSARS-CoV-2変異株のスパイク遺伝子は、中立的な進化の軌跡から外れているように思われる。
考察
SARS-CoV-2変異株の祖先型配列を同定し、武漢SARS-CoV-2との変異の相違を解析した。次に、変異株全体の同義置換と非同義置換の比率を詳細に解析した。Ka/Ks比に関連する変異株の解析は、タンパク質コード遺伝子に作用する自然選択の方向と大きさを解釈するために用いられた。Ka/Ks比が1より大きいとダーウィン選択、1より小さいと純化選択を示す[10]。Ka/Ks比がちょうど1であれば、選択がないことを示す。Ka/Ksの値が1よりかなり大きい場合、対応する突然変異は一般に有利である。スパイク遺伝子のKaは、私が調べた変異株全体ではKsよりずっと高かった。このことは、スパイク遺伝子のこれらの非同義置換の一つ一つが強い選択圧力の結果であることを意味する。
最近、いくつかのグループが独自にオミクロン変異株における非同義置換の偏りを指摘している[17-19]。特にXiらは、いくつかのSARS-CoV-2変異株のスパイクタンパク質とORF1abを比較し、スパイクタンパク質に同義置換がないことが不自然であることに気づき[19]、私の観察を支持するものであった。
ファイザーとモデルナのmRNAベースのワクチンは、完全長のスパイク遺伝子をコードしており、そのアミノ酸配列は、2つのプロリン置換を除いて、武漢SARS-CoV-2のスパイク遺伝子と同一である[20]。[20] 翻訳を増加させるために、これらのmRNAワクチンのスパイク遺伝子は、同義置換で大きく改変されている[21]。このことは、プロト・変異株のスパイク遺伝子は、翻訳効率を向上させるために同義置換を利用する可能性があることを示唆している。したがって、プロトタイプ変異株のスパイク遺伝子が同義置換を排除しようとする強い選択圧を、コドン使用法で説明することはできない。
それぞれの原型変異株が出現した後、ヒトの間で伝播する間にさらなる変異が蓄積される。各変異株の進化におけるKa/Ks比は3を超えていない[19]。SARS-CoV-1,RaTG13,プロトWuhanの進化の過程でスパイク遺伝子が高い同義置換率を達成したことを考えると(図3A)プロト変異株のスパイク遺伝子に同義置換がないこと(図3B)はコロナウイルスの進化における共通の特徴とはいえない。実際、細胞株での体細胞超変異を用いた機能獲得のための人工進化の際にも同義置換が達成される[22]。
コロナウイルスのスパイクタンパク質は、ウイルスの感染を媒介し、ACE2受容体に結合した後、膜融合を媒介するフゾーゲンとして機能する。スパイク遺伝子への選択的な圧力は、ヒトのACE2を介した細胞感染に依存する。一般に、スパイクタンパク質は、フソジェン(fusogen)機能を維持するために、ランダムなアミノ酸の変化を受け入れないと言われている。
突然変異と選択は通常、段階的に起こる。突然変異はその機能的選択の後に固定され、次の突然変異と選択が続く。非同義置換がタンパク質の機能を向上させることは稀であり、有害な場合もある精製選択により、酵素活性やタンパク質構造を損傷する非同義置換は除去されるため、重要な遺伝子における非同義置換の数は減少する。一方、同義置換は表現型の変化を引き起こすことがほとんどないため、翻訳効率を極端に低下させない限り、一般に純化選択の対象にはならない。同義置換は進化の過程で蓄積される傾向がある。同義置換の割合は、異なる遺伝子間では通常同程度であるため、同義置換は近縁種の進化時間を計る分子時計として利用することができる[16]。驚くべきことに、SARS-CoV-2プロト・変異株では、同義置換は非同義置換よりも著しく低い頻度である。このことは、スパイク遺伝子の進化が、古典的な試行錯誤-突然変異と淘汰のスキームの外で起こったことを示唆している。さらに、同義置換の分子時計の特徴から、スパイク遺伝子の変異は短期間に獲得されたことが示唆された。
解析したSARS-CoV-2変異株は、高い感染率を維持しながら、短期間に新しいスパイクタンパク質を進化させた。これらの変異株のスパイク遺伝子は、SARS-CoV-2ゲノムの他の部分とは対照的に、中立的な進化を遂げていないようである(図4)。これは、特定の変異を持つスパイク遺伝子がウイルスゲノムに「人為的に挿入された」と仮定すれば説明できるかもしれない。プロトデルタとプロトMuGHの変異は全体的に非同義置換に偏っているため(図2,3)変異株によってはスパイク遺伝子の外側に人工遺伝子が存在する可能性がある。技術的には、部位特異的変異導入法を用いれば、シームレスクローニングやゲノム編集で容易に特定の変異を導入することが可能である。実際、SARS-CoV-2がどのようにfurin切断部位を獲得したかという論争と同様に、SARS-CoV-2の進化は謎のままである[23]。
プロト変異株のスパイク遺伝子に多くの非同義置換が存在し、同義置換がないことは、これらの遺伝子が特に典型的な自然進化や人工進化の副産物でないことを示唆している。これらの原型変異株のスパイク遺伝子が確率的に出現した可能性は極めて低いが、機能選択の証拠がない限り、原型変異株が偶然にヒトの間でこれほど高い感染率を達成したことを説明することは困難である。したがって、SARS-CoV-2変異株は、部位特異的突然変異誘発によってスパイク遺伝子が作られた人工的なウイルスであると推測される。
図1 系統樹 各SARS-CoV-2亜型の祖先型はプロト「亜型」と名付けられた。進化的距離は目盛りで示す。
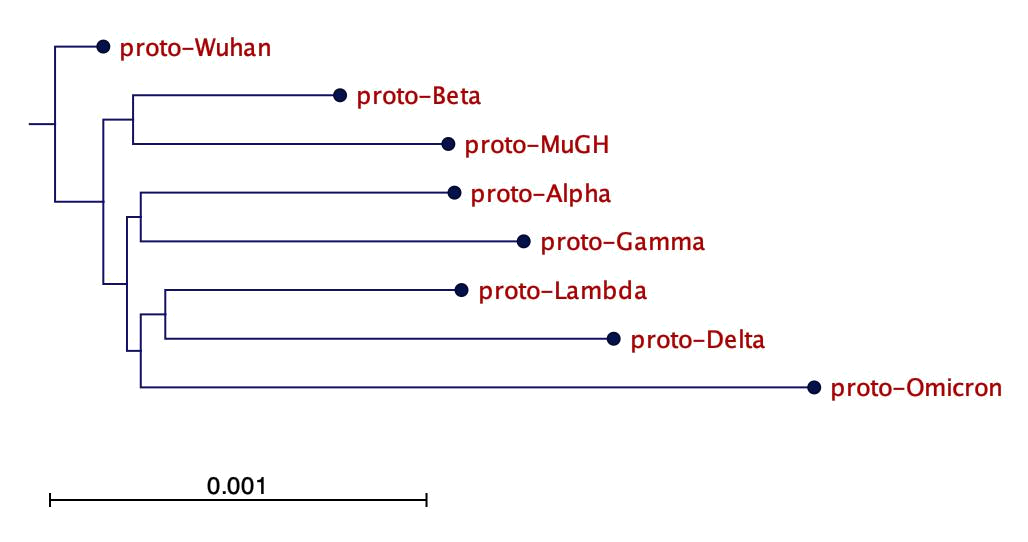
図2 同義(S)および非同義(N)置換。A. SARS-CoV-1, RaTG13, proto Wuhanの各遺伝子における同義置換と非同義置換。B. 武漢のプロトからそれぞれのプロト変異株へのもの。同義置換と非同義置換の合計がORF1abの同義置換と非同義置換の合計も示している。
図3 KaとKs A. SARS-CoV-1,RaTG13,proto-Wuhan間の各遺伝子上のKaとKs。B. Wuhanプロトから各プロト変異株へのKaとKs。Kaは非同義部位あたりの非同義置換数、Ksは同義部位あたりの同義置換数。選択圧がなく、突然変異がランダムに導入される場合、KaとKsの比は1である。
図4 SARS-CoV-2変異株のスパイク遺伝子に中立進化がないこと。SARS-CoV-2変異株のゲノム構造を示している。
図S1. SARS-CoV-2プロト変異株のマルチプルアラインメント。緑は同義置換、赤は非同義置換、ピンクは曖昧、青は非コード化変異、グレーはストップコドン起因変異、オレンジは挿入、紫は欠失を示す。
図s2. SARS-CoV-2プロト変異株のFASTA形式での配列。
