Contents
Multi-target pharmacology: possibilities and limitations of the “skeleton key approach” from a medicinal chemist perspective
www.ncbi.nlm.nih.gov/pmc/articles/PMC4585027/
アラン・タレヴィ
要旨
マルチターゲット薬は、薬剤耐性の問題に関連した複雑な疾患や健康状態の治療に有利であることから、過去10年間で大きな関心を集めていた。併存疾患を治療するための薬剤の再配置は、マルチターゲットリガンドの見落とされていた応用の一つである。薬学者は通常、新規治療薬を設計するためにある種のロックアンドキーパラダイムに依存しているが、現代の薬理学では、生体システムに対する所定の薬物の中長期的な効果は、特定のリガンド-標的認識イベントだけでなく、細胞遺伝子シグネチャに対する薬物の反復投与の影響にも依存している可能性があることを認識している。マルチターゲット薬剤の設計は、通常、候補薬剤のトポロジーや柔軟性に困難な制限を課すことになるが、これについては本稿で簡単に説明する。最後に、新規なマルチターゲット薬剤の同定にアプローチするための計算戦略を概説する。
キーワード
マルチターゲット薬剤、ロックアンドキーパラダイム、遺伝子プロファイル、薬剤耐性、薬剤リポジショニング、ドラッグデザイン、設計されたマルチリガンド
序論
マルチターゲット薬(または多機能薬またはネットワーク治療薬)は、複雑な病因の疾患(Talevi et al 2012;KoerberleおよびWerz 2014;Zheng et al 2014)および薬剤耐性の問題に関連する健康状態(TaleviおよびBruno-Branch 2013;Li et al 2014)に対する潜在的な治療ソリューションとして、過去10年間でかなり注目されてきた。「一剤一標的」のパラダイムによれば、非常に強力で特異的な(単一標的の)治療法は、標的外の副作用がないため、忍容性が高いと考えられる。しかしながら、試験管内試験での薬物効果と生体内試験での有効性との間の相関性が低いことは、しばしば標的主導型の近似法で見られる(Kell, 2013; Margineanu, 2014)。標的第一戦略は、単一遺伝子疾患へのアプローチに有用であることが証明されるかもしれないが、疾患は多くの場合、構成因子および/または環境因子の組み合わせが関与する多因子疾患である。代償メカニズムと冗長機能のおかげで、生物学的システムは単一点の摂動に対しても回復力がある(Hopkins, 2008)。このような観点から、疾患は、多くの場合、複数の遺伝的要因および/または環境的要因による頑健な生理学的システムの破壊から生じ、頑健な疾患状態の確立につながる(Yildrim et al 2007)。このように、複雑な疾患は、複数の標的を同時に調節することによって治癒または緩和される可能性が高い。
この戦略が意図的に適用されるようになったのはここ10~15年のことであるが、以前に知られていた治療薬の多くは、実際にはマルチターゲットリガンドである(Yildrim et al 2007)が、セレンディピティ、表現型スクリーニング、または伝統医学によって発見された薬には特に当てはまる。これらすべての場合において、薬理学的効果に関する知識が作用機序に関する知識に先行していることに注意してほしい。アスピリン自体は、シクロオキシゲナーゼ阻害以外にも多様な分子機構を介して作用することが示されている(Koerberle and Werz, 2014)。いくつかの治療カテゴリー、例えば気分障害の薬物は、マルチターゲット薬物の古典的な例に特に豊富である(Roth et al 2004)。したがって、実際には、マルチターゲット薬は、臨床現場では古くから知られており、効果的に使用されてきたが、主にセレンディピティヴィティ的に、あるいは表現型スクリーニングによって発見されてきた。テーラードマルチターゲット薬の可能性と限界とは?
古典的なロックアンドキーのパラダイムの再検討と絞り込み
薬用化学者は通常、リガンドとその分子標的との相互作用を説明するために伝統的な鍵と鍵のモデルに頼っている(または、リガンドと標的の柔軟性を考慮したこのパラダイムの更新版、例えばハンド・イン・グローブのアナロジー)。一般的な考え方は、リガンド(鍵)とターゲット(鍵)は、効率的に相互作用し、何らかの生物学的反応を引き起こす(鍵を開ける)ために相補的な機能を持つべきであるということである。多くの場合、異なるリガンドは、特定のターゲットで質的に類似した反応を引き起こすことができる。異なる鍵が同じ錠前を活性化するためには、共通の本質的な特徴の配置(鍵の刃)を共有しなければならないが、これはファーマコフォア(ギリシャ語で薬を運ぶもの)と呼ばれている。キーの残りの部分(弓)は確かに重要であるかもしれないが、構造的な制限の対象にはならない(図(図11))。
図1 古典的な錠前と鍵の類推をマルチターゲットエージェントに外挿したもの

マルチターゲットリガンドは、いくつかの鍵を開けることができるスケルトンやマスターキーのように考えることができるかもしれない。選択的な非選択性は有益であるかもしれないが、プロミスキュイティ(非選択的非選択性)は逆に安全性に重大な懸念をもたらす可能性があり、避けるべきである。なぜ、非選択性リガンドが異なる標的を活性化するのか?この質問に対する答えは多くの可能性がある。第一に、あるリガンドが同じタンパク質の複数のアイソフォームに作用することはよくあることである。例えば、キシロカイン(リドカイン)は、末梢神経系、心臓、中枢神経系のナトリウムチャネルを遮断することにより、麻酔作用、抗不整脈作用、および抗痙攣作用を生じさせることができる(Catterall, 2000)。あるいは、ある生化学的経路の異なるメンバーは、共進化によりリガンドの特異性をある程度共有しているかもしれない。最後に、リガンドは、同じ分子内の異なるファーマコフォアを組み合わせることで、2つ以上の無関係な標的に対して親和性を示すかもしれない(Morphy et al 2004)。しばしば、このようなファーマコフォアの組み合わせは、エンタルピー的にもエントロピー的にも好ましくない分子をもたらし、これは後に対応するセクションで議論されるように、マルチターゲット医薬品の設計を妨げることになる。これは、図1,1のキーナンバー3の不器用な設計によって比喩的に表現されている。
しかし、バイオテクノロジーの貢献により、鍵と鍵の類推は、特に中長期の薬剤曝露(複数回投与レジメン)が必要な場合には、生体システムに対する薬剤の効果を説明するには不十分であることが非常に明確になっていた。化学物質に持続的に曝露された後、細胞の遺伝子シグネチャは変化する:ある遺伝子はアップレギュレートされるが、他の遺伝子はダウンレギュレートされる(例えば、核内受容体の活性化、代償メカニズムなどのため)。これまでは、薬物とその分子標的との直接的な相互作用に注目が向けられてたが、現在では、生物系に対する薬物の作用を十分に特徴づけるためには、より全体的な視点が必要であることが知られている。例えば、バルプロ酸やカルバマゼピンの慢性投与により、細胞質ホスホリパーゼA2やシクロオキシゲナーゼがダウンレギュレーションされ(その結果、炎症性サイトカインが減少することが報告されている;Bosetti et al 2003;Gherlardoni et al 2004)これらの薬剤のてんかんや双極性障害に対する効果に関与している可能性がある。このような全体的な視点の必要性は、遺伝子プロファイルを介して疾患と低分子を結びつけることを意味する一般に利用可能なリソースであるコネクティビティマップに明確に表現されている(Qu and Rajpal, 2012)。コネクティビティマップは、多数の薬剤で培養したヒト細胞の治療に由来する遺伝子発現プロファイルを格納しており、疾患シグネチャをクエリとして使用すると、逆の発現変化(逆類似性)により疾患に関連する薬剤が治療の候補となることが期待されている。
マルチターゲットリガンドの可能性
マルチターゲット薬剤の治療への応用としては、主に3つの応用が想定される。
複合疾患
複合障害とは、生体に作用する多数の内因性因子および/または環境因子によって引き起こされる多因子性の健康状態のことである。その中には、気分障害、神経変性疾患、慢性炎症、癌などがある。これらの状態の生物学的基盤の理解が進み、医薬品部門による巨額の投資が行われているにもかかわらず、医薬品による解決策はまだつかみどころのないままである。このような疾患は、併用療法によってアプローチできる場合もあれば、併用療法によってアプローチできる場合もあるが、マルチターゲットリガンドは、薬物動態の予測性、患者のコンプライアンスの向上、薬物相互作用のリスクの低減など、明確な利点を提供する。癌(Petrelli and Giordano, 2008; Petrelli and Valabrega, 2009)アルツハイマー病(Bajda et al 2011; Dias and Viegas, 2014; Zheng et al 2014)パーキンソン病(Youdim et al 2014)炎症(Hwang et al 2013)うつ病およびその他の精神疾患(Wong et al 2008; Milan, 2014)におけるマルチターゲットアプローチの可能性を網羅したレビューがいくつか存在する。
薬剤耐性
また、異なる標的に同時に影響を与えることは、主要な疾患に関連する生物学的経路の変化や代償機序の活性化により、薬剤応答に内在的または誘導的な変動性を示す個体へのアプローチにも有利である(Zimmermann et al 2007; Xie et al 2012)。抗菌化学療法の分野での明白な応用(シングルターゲットよりもマルチターゲットの薬剤に対するシングルポイント変異に関連した耐性化の可能性が低い)とは別に、この戦略は、薬剤耐性現象の発生率が高いことを特徴とする非感染性疾患、例えばてんかん(Bianchi et al 2009; Margineanu 2014)の治療にも適していると考えられる。てんかん患者の3分の1は難治性てんかん患者である。難治性てんかん症例を説明するための有力な仮説の一つは、非反応性てんかん患者の少なくとも一部が抗てんかん薬の分子標的の変異を発現している可能性を示唆するものである(Talevi and Bruno-Blanch, 2013)。動物モデルを用いたアイソボログラフ研究や臨床経験から、異なるメカニズムの薬剤の併用が有益である傾向があることが示唆されている(Kwan and Brodie, 2006; Kaminski et al 2009; Lee and Dworetzky, 2010; Brodie et al 2011)。一方、ある特定のてんかんタイプまたは症候群の治療におけるシングルターゲット薬の有用性についてはコンセンサスが存在するが、バルプロ酸のような広範なスペクトルの抗てんかん薬は、最も使用されている抗てんかん薬の一つであり、てんかんの発症時に特定の症候群の診断がつかみにくい場合に有用である可能性がある(Bourgeois, 2007; Lagae, 2009; Löscher et al 2013; Margineanu, 2014)。
プロスペクティブドラッグの再配置
薬物のリポジショニング(すなわち、承認薬、製造中止薬、棚上げ薬、実験薬など、すでに知られている治療薬に対して、第二の、あるいはさらなる医療用途を見出すこと)は、過去10年の間に学術界や製薬界で大きな関心を集めていた(Ashburn and Thor, 2004; Novac, 2013)。薬物のリポジショニングに成功した事例のほとんどは、セレンディピティによって、あるいは薬物の本来の作用メカニズムを新たな適応症のために利用することによって発見されている(オンターゲットリポジショニング)。マルチターゲット薬は、より革新的なオフターゲット薬のリポジショニングの自然な候補となる。これまでのところ、薬物リポジショニングに対する計算科学的アプローチは、レトロスペクティブ薬物リポジショニングと呼ばれるものに焦点を当てていた。対照的に、プロスペクティブ・ドラッグ・リポジショニングは、創薬プロセスのかなり早い段階でリポジショニングの可能性を探るものである。製薬会社の中には、現在、パイプラインにある薬のリポジショニングの代替品の探索を検討しているところもあるが、このアプローチは、異なる疾患、特に、しばしば併存する疾患(例えば、糖尿病や心臓病、不安や消化性潰瘍疾患、てんかん、うつ病など)を治療するための多目的薬を設計することによって、さらに先に進められる可能性がある。アミオダロンおよび関連化合物とシャーガス病の例を例示することができる。シャーガス病は、歴史的にラテンアメリカの風土病である熱帯性寄生虫疾患である。この病気の後期には、約3分の1の患者に生命を脅かす心臓障害がみられることが特徴である。アミオダロンはクラスIIIの抗不整脈薬であり、ナトリウム・カリウムチャネルやL型カルシウムチャネルの阻害など、他の電気生理学的抗不整脈薬と多くの特徴を共有している。興味深いことに、いくつかの研究では、アミオダロンで治療されたシャーガ性心筋症の患者は、クラスIおよびクラスIVの抗不整脈薬で治療された他の患者と比較して、より迅速な回復を示すことが示された。このことから、他の作用機序が考えられることが示唆された。その後、アミオダロンは寄生虫の生存に直接作用し、トリパノソーマ・クルジ細胞外エピマスティゴートおよびT. cruzi amastigotesの増殖に影響を与えることが示された(つまり、アミオダロンは根本的な病理に作用する可能性がある)。この薬剤の作用機序が解明され、この薬剤が寄生虫の細胞内カルシウム調節を直接阻害することが示された(Benaim et al 2006)。同様の結果は、後にドロネダロンでも観察された(Benaim et al 2012)。それでも、この例は、臨床観察から新たな医療用途が出現したため、薬剤の再配置を遡及的に行ったもう一つの例である。今後の課題は、このような併存疾患の治療に向けた適応拡大が、医薬品開発プロセスの初期段階で合理的なアプローチによって予測できるかどうかを定義することであり、それによって、既存の治療法と比較して新しい治療法の利点の可能性についてのエビデンスを提供することができるかどうか、また、どの薬剤候補を臨床試験に優先的に投入すべきかを決定するための追加的な基準を提供し、比較対象の治療法の優劣を試験するために使用される臨床エンドポイントを便利に選択することができるかどうかを定義することである。計算ネットワークベースの近似は、疾患間の隠れたつながりを明らかにし、このようなタイプの取り組みを支援するために価値があることが証明される可能性がある。
マルチターゲットエージェントの設計とスクリーニングに関連するいくつかの考慮事項
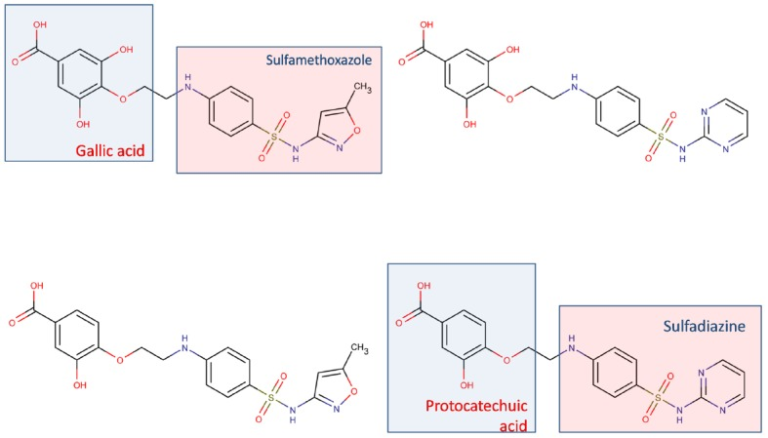
すなわち、選択的な単一標的リガンドからのファーマコフォアの方法論的な組み合わせ(フラグメントベースのアプローチ)と、複数の計算モデル(または単一のマルチタスク計算モデル)を同時に適用して、活性の適切な組み合わせを有する化合物を同定することによって、化合物コレクションをスクリーニングすることである(Morphy er al)。 最初の近似では、異なるファーマコフォアは、開裂可能なまたは安定なリンカーによって一緒に結合されるか、または代替的に、構造的な共通性を利用して重複している(Morphy et al 2004)。リンカーの使用は、しばしば、好ましくない生物薬剤学的または薬物動態学的プロファイルを有する化合物(例えば、2つ以上のリピンスキーの規則に違反する化合物)をもたらす。開裂性リンカーの使用は有利であるかもしれないが、それはまた、併用療法と比較してマルチターゲットアプローチの利点のいくつかを制限する(薬物動態の単純化、薬物相互作用の可能性の減少)。さらに、フラグメントベースのアプローチは、原子あたりの結合効率を指すリガンド効率の指標が悪くなる可能性がある(Hopkins et al 2014)。これは、分子の一部だけが提案されたターゲットのそれぞれと相互作用することができるので、他の部分が結合イベントの障害となり、エンタルピックおよび/またはエントロピックな理由で結合効率を低下させる可能性があると推測されるかもしれない(図(図1)1.1)キー番号3の厄介なトポロジーによって表される。したがって、オーバーラップまたはマージアプローチ(低分子内の部分的または高度に統合されたファーマコフォアを検索する)は、バイオ医薬品の観点からより魅力的であるように思われる。ある程度の柔軟性を分子内に含めることは、共通および非共通のファルマコフォアの特徴が、異なる意図された標的の対応する結合部位に適合するのに役立つかもしれない。しかしながら、柔軟性の程度は、柔軟性の過剰が結合親和性(結合イベントに関連する好ましくないエントロピー損失のため)または薬物のバイオアベイラビリティー(多くのドラッグライクネス規則が分子内の柔軟性結合の数を制限していることを覚えておく必要がある)を阻害しないように慎重に調整されるべきである。これらの原則のいくつかの例として、Jayaraman et al 2013)の最近の研究が挙げられる。これらの著者らは、緑膿菌DNAジラーゼサブユニットB(GyrB)/トポイソメラーゼIVサブユニットB、ジヒドロ葉酸還元酵素(DHFR)およびジヒドロプテロエート合成酵素(DHPS)の多価阻害剤として構想されたフィトケミカル-抗生物質複合体の設計にフラグメントベースのアプローチを適用した。大腸菌GyrBとDHFRの阻害剤として以前に同定されたファーマコフォアとは異なり、著者らはこれらの酵素のマルチ阻害のための共通のファーマコフォアモデルを導き出した。驚くべきことに、彼らは、スルファメトキサゾールとスルファジアジン(DHPSを阻害する;図2)に非開裂性リンカーを介して共役した単純なフェノール類(ガリン酸とプロトカテキンガレート、二価の天然物エピガロカテキンガレートのより単純な構造アナログ)を使用することを決定した2)2)。出発点として単純な植物化学物質を使用するという決定は、異なる薬物類似性規則(Lipinski規則およびVeber規則)を介して、および設計された薬物候補の溶解度および吸収率を予測することによって確認された、許容可能な計算されたバイオ医薬品特性を有する4つの薬物様化合物をもたらした。候補のうち2つは、5つのルールとVeberルールの違反を示さなかったが、残りの2つは、Lipinskiルールの違反が1つとVeberルールの限界的な違反を示しただけであった。
図2 Jayaraman et al 2013)によって設計されたマルチターゲット抗生物質植物性薬物コンジュゲート
スクリーニング近似については、スクリーニングキャンペーンでのヒット率は、シングルター ゲットの薬物候補を探索した場合(Talevi er al)。 例えば、Nair et al 2013)は、最近、DAP-キナーゼ(オートファジーにも関与するプロアポトーシスタンパク質のファミリーであり、脳虚血や神経変性疾患の治療的介入のための有望なターゲットとして提案されている)のマルチターゲット阻害剤を同定するための仮想スクリーニングキャンペーンを行った。DAP-キナーゼの中でも、DRP1はファミリーの他のメンバーの活性化にも関与していることから、全てのDAP-キナーゼの中でも上流に位置するタンパク質であることが報告されている。しかし、DAPキナーゼが活性化する細胞死経路には、他の活性化源が存在するため、DRP1の調節だけでは十分な効果が得られない。著者らは、マルチターゲットの薬剤を探索するために、DAP-キナーゼファミリーの3つのメンバーのうちの1つの既知のリガンド391個の複合データベースを探索した。DAPk1,DRP1,およびZIPk。このライブラリは、Protein Data BankとChEMBLからコンパイルされ、DAPk1,DRP1,およびZIPkの3つのファーマコフォア仮説を順に用いて順次スクリーニングした。最初の仮説(DAPk1)でスクリーニングした結果、196件のヒットが得られた。さらに、これらのヒットをDRP1ファーマコフォアでスクリーニングした結果、DAPk1およびDRP1リガンドの両方のファーマコフォアの特徴を含む56ヒットが得られた。この56個のリガンドヒットをZIPkファーマコフォアでスクリーニングしたところ、3つのDAPキナーゼすべてのファーマコフォア特徴を持つ4個のリガンドのみが得られた。マルチターゲット薬剤を選択するために逐次in silicoフィルタ/モデルを使用した場合に得られるヒット数が限られていたが、利用可能な化学物質の膨大な宇宙が拡大し続けているため、それを補うことができるかもしれない。マルチタスクQSAR近似(Zanni et al 2014; Speck-Planche and Cordeiro 2015)は、この戦略を実行するための貴重なツールとして証明される可能性がある。
ターゲットの選択
これまで、マルチターゲットアプローチがもたらす利点と課題について議論してきた。しかし、重要な疑問が残っている。それは、マルチターゲット薬剤を設計する場合、どのように分子標的を選択すればよいのかということである。薬物標的には、明らかに疾患修飾の可能性があることが必要である。第二に、感染症や規制緩和された細胞(例えば、癌の場合)と戦う場合、薬剤はある程度の選択性を示さなければならない。例えば、薬剤標的は感染症や癌細胞に排他的または優先的に発現していなければならない、病原体の標的タンパク質は宿主に相同なタンパク質を持っていてはならない、または宿主に相同なタンパク質は病原体のタンパク質と十分に異なっていなければならないなどである。さらに、メディシナルケミストリーのコミュニティは、すべてのタンパク質が等しく「ドラッガブル」ではないこと、すなわち、小分子によって調節される可能性が高いことを長い間受け入れてきた。薬効性を評価するための多くのアプローチが専門的な文献で提案されており、「関連性による罪悪感」近似法(タンパク質が、タンパク質ファミリーの少なくとも1つのメンバーが薬物によって標的とされているタンパク質ファミリーに属している場合、そのタンパク質は薬効性があると予測される)から、特に、結合部位予測に基づく方法(Keller er al)。 しかし、前記したことは、単一ターゲットとマルチターゲットの両方の近似に有効な一般的な考慮事項にすぎない。複数の標的を狙う場合、標的の選択と追求する阻害のタイプは、いくつかの要因に依存し、その中でも特に疾患の性質(感染症か、複雑な疾患か?注目に値する関連する問題は、選択された標的を直接ブロックすることが望ましいのか、あるいは(例えば、弱い部分的な阻害を通して)標的を調節することが望ましいのかということである。システム生物学の観点から構築された現代のパラダイムの下では、一般的に、我々が標的とするのは孤立したタンパク質ではなく、その代わりに経路であることが理解されている。異なるシグナル伝達経路を標的とした場合(パラレル・ターゲティング)には、逃走経路や適応的抵抗性メカニズム、代償的恒常性反応を阻害するのに有効であるかもしれないが、代わりに、垂直ターゲティング(異なるノードで同じ経路を攻撃する)は、他のタイプの抵抗性(例えば、標的変異;Shahbazian et al 2012)に対して有用であることが証明されるかもしれない。病原体や悪性細胞を殺そうとする場合には、ハブ(生化学的ネットワーク内の高度に接続されたノード)を攻撃することが選択される戦略であるかもしれない。一方で、治療の目的が障害されたネットワークを健康な状態に回復させることである場合には、低親和性のマルチターゲットリガンドを使用して、キーノードに隣接する複数の非重要ノードを変調させることが、重大な副作用を回避するために有利であるかもしれない(重要な生理機能を有するキーノードをブロックする場合には、そうでなければ期待されるかもしれない;Csernely er al)。 代謝制御解析は、特定のシステムの全体的な機能における個々の代謝ステップの重要性と相対的な貢献度を評価し、その後、最適なターゲットを特定するための有用なフレームを構成している(Hornberg et al 2007)。
おわりに
マルチターゲット薬は、複雑な多因子疾患や薬剤耐性の問題に直面した場合に有望な戦略である。さらに、これらの薬剤は、共存疾患の治療、あるいは基礎疾患とその症状の両方の治療を目的とした前向きな薬剤の再配置において価値があることを証明することができ、現時点では見落とされている応用が可能である。併用療法と比較して、薬物動態の予測性が高く、薬物相互作用の確率が低く、患者のコンプライアンスが高いなど、いくつかの利点がある。
私たちは、オーダーメイドのマルチターゲット薬の探索に関連するいくつかの困難さを強調していた(例えば、エンタルピックとエントロピーの考慮と潜在的なバイオアベイラビリティの問題、仮想ライブラリを順次スクリーニングする際のヒット数の制限など)。マルチターゲット戦略にアプローチするための古典的な鍵と鍵のパラダイムに加えて、細胞遺伝子シグネチャーに対する薬剤の効果も考慮する必要があり、特に複雑な疾患の場合によく見られる中長期的な治療法を探す場合には、これも考慮する必要がある。最後に、ネットワーク解析は、治療される疾患の性質や既知の抵抗性のメカニズムに大きく依存する標的選択を助ける手がかりを提供するかもしれない。