Contents
- 概要
- 治療アプローチ
- オリゴデンドロサイトへのαシヌクレイン到達の遮断
- セルトラリン
- パロキセチン
- プリオン増殖の抑制
- オリゴデンドロサイト内でのαシヌクレイン凝集の抑制
- αシヌクレインクリアランスの促進
- グルタミン酸誘発興奮毒性の抑制
- オートファジーの適正化
- 成長因子の補充・改善
- ミクログリア活性の調節
- 酸化ストレスの抑制
- 酸化/ニトロ化ストレス(Oxidation/Nitration stress)
- ミトコンドリア機能の回復
- ミトコンドリア関連記事
- 環境毒素の軽減・解毒
- ミエロペルオキシダーゼ(MPO)阻害剤
- 睡眠障害の改善
- 鉄代謝の改善・鉄キレート
- 腸内細菌叢不均衡・リーキーガットの改善
- ノルエピネフリン欠乏の改善
- ヒト間葉系幹細胞(MSC)
- 静脈内免疫グロブリン
- 基本治療方針(暫定案)
概要
多系統萎縮症の症状
多系統萎縮症はパーキンソン病などの一般的な疾患と似ているため診断はしばしば遅れる。初期症状は明白ではない。
自律神経系の症状を示すことが多く、運動症状の認識に先行することがある。
早期診断として起立性低血圧、男性では勃起不全が最初の症状としてあげられる。
www.ncbi.nlm.nih.gov/pmc/articles/PMC5859695/
多系統萎縮症の病理学的定義
多系統萎縮症(MSA)は以下の条件によって神経病理学的に定義される。
- パーキンソニズム
- 小脳の機能障害
- 錐体路変性
- 進行性の神経変性疾患
- グリア細胞質封入体、GCIのαシヌクレイン蓄積
パーキンソン病や、レビー小体型認知症では異常なαシヌクレインがニューロンに蓄積するのと対照的に、多系統萎縮症では異常なαシヌクレインがオリゴデンドログリアに蓄積する。
また、多系統萎縮症ではパーキンソン病やレビー小体型認知症よりもより高レベルの可溶性αシヌクレインを有しており、これはさらに高レベルの不溶性αシヌクレインへとつながる。
www.ncbi.nlm.nih.gov/pubmed/19903734/
www.ncbi.nlm.nih.gov/pubmed/16482476/
日本国内の患者数は約1万1000人
発症メカニズム
発症メカニズムは完全に解明されていないが、以下の機序を含む可能性がある。
- プリオン増殖によるαシヌクレインの細胞間伝達
- αシヌクレイン凝集
- 酸化ストレスの増加
- チューブリンタンパク質の異常発現
- 神経栄養因子発現の低下
- 興奮毒性、ミクログリア活性
- 神経炎症
上記病原性を薬理学的アプローチによって遮断する試みが、MSAモデルマウス、試験管研究で試みられており、以下の薬物投与によって神経保護効果を発揮すことが示されている。
セルトラリン、パロキセチン、リチウム、非ステロイド系炎症薬、オリゴデンドロサイトのαシヌクレイン凝集阻害剤、リルゾール、ラサギリン、フルオキセチン、間葉系幹細胞、ミノサイクリン、静脈内免疫グロブリン投与
2つのタイプ MSA-P・MSA-C
- MSA-P 表現型(パーキンソニズムが主体)
- MSA-C 表現型(小脳性運動失調が主体)
北米ではMSA-Pが60%、MAS-Cが13%
日本ではMAS-Pが16 .2%、MSA-Cが83.8 %がより多く、民族的な変動性がある。
www.ncbi.nlm.nih.gov/pubmed/16828805/
2つのタイプが存在する原因は解明されていないが、遺伝的要因または環境要因、あるいはその組み合わせが関係している可能性がある。
www.ncbi.nlm.nih.gov/pubmed/11960896/
www.ncbi.nlm.nih.gov/pubmed/18808955/
治療アプローチ
オリゴデンドロサイトへのαシヌクレイン到達の遮断
αシヌクレインの細胞伝達
αシヌクレインは、神経細胞質ゾルに存在するタンパク質であるが、特定の状況下では細胞外空間に見られることがある。
細胞外のαシヌクレインはオリゴデンドロサイトに到達する可能性があり、最近の研究では細胞外αシヌクレインと病理の関連性が報告されている。
www.ncbi.nlm.nih.gov/pubmed/24468877/
異常mRNAの活性
オリゴデンドロサイトでは通常αシヌクレインを発現せず(ニューロンでは発現する)、異常なαシヌクレインがなぜオリゴデンドロサイトに出現するのか、そのメカニズムは解明されていない。
可能性としてはオリゴデンドロサイトの異常なmRNAが活性化されることにより、αシヌクレインが過剰発現するというもの。
この仕組はマウスモデルでは確認されているが、ヒトでは確認されていない。
これは異常なαシヌクレインがオリゴデンドロサイト由来ではなく、他から来ている可能性があることを示唆する。
www.ncbi.nlm.nih.gov/pubmed/15743798/

www.ncbi.nlm.nih.gov/pmc/articles/PMC4788141/
セルトラリン
選択的セロトニン再取り込み阻害薬
試験管研究においてαシヌクレインがオリゴデンドロサイトに取り込まれるエンドサイトーシス経路を遮断する。
また用量依存的にオリゴデンドロサイトによるαシヌクレインの取り込みを防ぎ、ニューロン間伝達を阻害する。
www.ncbi.nlm.nih.gov/pubmed/16769235/
→ うつ病適用で病院で処方してもらえることもある。
パロキセチン
選択的セロトニン再取り込み阻害剤
短期プラセボ対照試験では、パロキセチン30mg2週間の投与が、統計的に有意な運動能力の改善、ある程度の構音障害の改善が示された。
www.ncbi.nlm.nih.gov/pubmed/22517540/
プリオン増殖の抑制
プリオン疾患
病理学的αシヌクレインの細胞間伝達は、野生型αシヌクレインの立体構造を変えてしまう可能性があり、プリオン疾患と類似することが浮上してきている。
www.ncbi.nlm.nih.gov/pubmed/24218576/
www.ncbi.nlm.nih.gov/pubmed/23466394/
αシヌクレインの細胞間拡散が新たな凝集体形成につながりえる。
外因性のαシヌクレインがニューロンのタンパク質凝集を引きこすことが可能。
しかし、αシヌクレインは何らかの形でニューロンからも分泌されオリゴデンドロサイトに取り囲まれてGCIを形成する。
ミスフォールディングされたαシヌクレインはMSA患者においてプリオンとなる証拠が過去20年の研究で示されている。
www.ncbi.nlm.nih.gov/pubmed/28213437
オリゴデンドロサイト内でのαシヌクレイン凝集の抑制
リファンピシン
リファンピシンは多系統萎縮症マウスモデルにおいてαシヌクレインを減少させる
www.ncbi.nlm.nih.gov/pubmed/18695506/
www.ncbi.nlm.nih.gov/pubmed/22227187/
無作為化二重盲検 多系統萎縮症患者100名 12ヶ月 300mg×2/日

リファンピシンは多系統萎縮症の進行を遅らせたり進行したりしない結果が示された。
否定的な結果にも関わらず、リファンピシンモノマーからオリゴマー、凝集体への変化、ミクログリア活性と抑制などいくつかの洞察を提供した。
これらの結果は将来の臨床試験では、軽度の多系統萎縮症患者への介入を支持する。
www.ncbi.nlm.nih.gov/pubmed/24507091/
→ 個人輸入で入手可。リポソーム化推奨
リチウム
多系統萎縮症患者10名へのリチウム投与 二重盲検 1年後の中間解析で有害事象が多く試験放棄が多かったことから中止された。
リチウムの投与量 150mg×2/日スタート → 最大で1500mg/日
www.ncbi.nlm.nih.gov/pubmed/22932748/
→ 副作用が生じない低用量オロチン酸リチウムで試みてみる。 0.5mg/日
αシヌクレインクリアランスの促進
グルタミン酸誘発興奮毒性の抑制
リルゾール
ナトリウム、カリウムチャネルの遮断により、グルタミン受容体の刺激を間接的に妨げる。
www.ncbi.nlm.nih.gov/pubmed/20377511/
www.ncbi.nlm.nih.gov/pubmed/15583958/
www.ncbi.nlm.nih.gov/pubmed/19029129/
エストロゲン
エストロゲンのNMDA受容体抑制を介した神経保護効果。
www.ncbi.nlm.nih.gov/pubmed/22492045/
エストロゲンとブスピロンの併用投与 ブスピロンのみの有効性
www.ncbi.nlm.nih.gov/pubmed/18466925/
→ エストラジオールのチェック リコード法基準で処方
GABAとグルタミン酸のバランス補正
メマンチン
オートファジーの適正化
多系統萎縮症患者のオートファジー成熟プロセスにおいて、オートファゴソームが抑制されることによって損なわれていることが示唆される。
www.ncbi.nlm.nih.gov/pubmed/22959883
オートファジーの活性とプロテアソーム系の低下
αシヌクレインは、プロテアソーム機構またはオートファジーによって分解され得る。多系統萎縮症の病理学検査ではオートファジーがアップレギュレーションされていることを示している。これはプロテアソーム活性のダウンレギュレーションによって引き起こされる可能性がある。
www.ncbi.nlm.nih.gov/pubmed/22411133
プロテアソームの阻害はオリゴデンドロサイトにαシヌクレイン蓄積するマウスの運動障害を誘発し、ミエリンの破壊、脱髄をもたらした。
www.ncbi.nlm.nih.gov/pubmed/22491959
→ 低用量メチレンブルー
成長因子の補充・改善
成長ホルモン
多系統萎縮症患者への成長ホルモン療法 ランダム化比較試験
プラセボ群との有意な違いはどの尺度においても見いだせなかったが、統一パーキンソン病評価尺度合計スコアの進行は投与群で低い傾向があった。
1年間のr-hGH投与は安全でありえるようであり、症状、徴候、そしておそらく進行に影響を与えるかもしれない。
www.ncbi.nlm.nih.gov/pubmed/17469198/
BDNF・GDNF
多系統萎縮症モデルマウスではBDNF、GDNF、IGF-1レベルの変化があったが、GDNF発現の特異的な減少が観察された。
www.ncbi.nlm.nih.gov/pubmed/20445049
フルオキセチン
フルオキセチン投与はαシヌクレイノパチーマウスのBDNF・GDNFを増加させ、ERKシグナル伝達経路の活性化伴った。フルオキセチンはMSAおよびその他の神経変性疾患に対する治療的介入となり得ることを示している。
www.ncbi.nlm.nih.gov/pubmed/22281106/
フルオキセチンは、ラットのミクログリア神経毒性に対して神経保護効果を示す。
www.ncbi.nlm.nih.gov/pubmed/22166439/
フルオキセチンは、BDNF・GDNFを増加させシヌクレインマウスモデルの海馬神経新生障害を改善する。
www.ncbi.nlm.nih.gov/pubmed/22211740/
ラサギリン
ラサギリンのBDNF・GDNF誘導
www.ncbi.nlm.nih.gov/pubmed/18077571/
→ 個人輸入で入手可。パーキンソン病での処方も可能。海外ではヌートロピクスとして用いられており安全性も高い。鉄キレート作用もある。
ミクログリア活性の調節
慢性的なミクログリア活性による神経炎症
αシヌクレインの異常凝集によって引込される中枢神経系の炎症反応は、ミクログリアの活性化によって媒介される。これはニューロンの損傷に対する通常の反応であれば、ミクログリアの食作用によって損傷を受けた細胞を除去するために必要。
www.ncbi.nlm.nih.gov/pubmed/23946308/
しかし、ミクログリアが慢性的に活性化されると神経性サイトカインや細胞傷害性分子の継続的な分泌によりニューロンの損傷を引き起こす可能性がある。
www.ncbi.nlm.nih.gov/pubmed/17504139/
ミクログリア活性化は多系統萎縮症の神経変性と並行する。
www.ncbi.nlm.nih.gov/pubmed/14748560/
ミノサイクリン
ミノサイクリンは、ミクログリアの活性化、炎症誘発性サイトカインの分泌を阻害する。
ミノサイクリン治療はモデルマウスのミクログリア活性化を抑制し、ドーパミン作動性SNcニューロンを保護した。
www.ncbi.nlm.nih.gov/pubmed/17853477/
多系統萎縮症(MSA-P)患者63名へのミノサイクリン投与 200mg/日 48週
進行速度は両方の群で同じであることが示されミノサイクリンの臨床効果を示すことはできなかった。ミクログリア活性の抑制などいくつかの生物学的効果は示唆された。
www.ncbi.nlm.nih.gov/pubmed/20014118/
酸化ストレスの抑制
酸化ストレスによるαシヌクレイン凝集
異常αシヌクレインがオリゴデンドロサイトに到達すると、GCIへの凝集によって不溶性ポリマーを形成する。この凝集は酸化、ニトロ化、リン酸化などの酸化ストレスによって引き起こされ悪化する可能性がある。
www.ncbi.nlm.nih.gov/pubmed/23454347/
www.ncbi.nlm.nih.gov/pubmed/11062131/
酸化ストレスは活性酸素種の増加、または抗酸化防御活性の有意な低下と関連しており、細胞構造に大きな損傷を与える可能性がある。
www.ncbi.nlm.nih.gov/pubmed/19405128/
ミトコンドリア機能障害・環境毒素・遺伝子変異・MPO
いくつかの研究は、ミトコンドリア機能障害、環境毒素への暴露、酸化ストレスに関する遺伝的多形性、MPO(ミエロペルオキシダーゼ酵素)の関与を示しており、多系統萎縮症の酸化ストレスに寄与する可能性がある。
酸化ストレスに関与する遺伝子
多系統萎縮症と酸化ストレスに関与する遺伝子(SLC1A4、SQSTM1、EIF4EBP1)が有意に関連性を示した。
www.ncbi.nlm.nih.gov/pubmed/18442140
酸化ストレスと環境暴露は中国人の多系統萎縮症と関連する
www.ncbi.nlm.nih.gov/pubmed/27670212
酸化/ニトロ化ストレス(Oxidation/Nitration stress)
αシヌクレインのニトロ化
病理学的αシヌクレインはニトロ化されていることが示唆さており、酸化/ニトロ化が神経変性疾患の発症または進行に関与することを示唆する。
www.ncbi.nlm.nih.gov/pubmed/11073803
www.ncbi.nlm.nih.gov/pmc/articles/PMC4960740/
膜脂質の酸化/ニトロ化ストレスは、流動性など膜の生物学的特性を変化させてしまい、膜結合受容体や酵素の不活性化を招く可能性があり非常に有害。
また脂質化酸化は酸化生成物の生成による細胞損傷を増幅させる可能性がある。
酸化/ニトロ化ストレスを保護する抗酸化システムの活性化
Keap1 / Nrf2 / AREの活性(ROS/RNSとは独立して)
www.ncbi.nlm.nih.gov/pubmed/23434765/
www.ncbi.nlm.nih.gov/pubmed/23747930/
www.ncbi.nlm.nih.gov/pmc/articles/PMC4960740/
酸化ニトロ化ストレスのバイオマーカー
8-ニトログアニン → ONOO-
8-OHdG → ・OH
F 2 -IsoP
Tempol(テンポール)
ニトロ化ストレスを軽減するための有望なニトロ化抗酸化剤Tempol
www.ncbi.nlm.nih.gov/pubmed/26891889
www.liebertpub.com/doi/abs/10.1089/neu.2004.21.1405?journalCode=neu
N-アセチル-システイン
www.ncbi.nlm.nih.gov/pubmed/12801519
www.ncbi.nlm.nih.gov/pubmed/15888969/
尿酸
www.ncbi.nlm.nih.gov/pubmed/11133262/
メラトニン
www.ncbi.nlm.nih.gov/pubmed/24180395
脂質過酸化物の種類と治療アプローチ(認知症・アルツハイマー)
ミトコンドリア機能の回復
多系統萎縮症患者では、ミトコンドリア電子伝達系の電子伝達体であるCoQ10が欠損していることが示されている。このことは多系統萎縮症でのミトコンドリア機能不全を示唆する。
多系統萎縮症の小脳白質では、ミトコンドリア複合体IおよびIV活性の増加と並行して複合体IIおよび III活性の減少を示す。
ETC伝達系の機能不全がMSAの病因に重要である可能性があるという仮説の支持。
www.ncbi.nlm.nih.gov/pubmed/31024027
www.ncbi.nlm.nih.gov/pubmed/30344007
www.sciencedirect.com/science/article/pii/S2213671118303928
ラサギリン
ラサギリンの神経保護効果
ラサギリンの神経保護効果はMAO-B阻害作用ではなく、代謝産物であるアミノインダンによるミトコンドリアへの保護効果である可能性
www.ncbi.nlm.nih.gov/pubmed/21953831/
ラサギリンの投与は、MSAマウスモデルにおいて神経保護効果を示す。
www.ncbi.nlm.nih.gov/pubmed/18222424/
無作為化二重盲検 174名の多系統萎縮症患者(MSA-P)48週間 ラサギリン1mg/日
グループ間の結果に有意差は見られなかった。期間の短さが影響を与えた可能性。
www.ncbi.nlm.nih.gov/pubmed/25498732
ミトコンドリア関連記事
環境毒素の軽減・解毒
多系統萎縮症患者の職業的危険因子
多系統萎縮症患者は対照集団よりも、金属の粉塵、プラスチック、添加剤、有機溶剤、農薬への潜在的な暴露が有意に多い。
www.ncbi.nlm.nih.gov/pubmed/1821673/
殺虫剤と多系統萎縮症
多系統萎縮症患者の一人は、高濃度のマラチオン、ジアジノン、ホルムアルデヒドにさらされていた。別の多系統萎縮症の患者は、n-ヘキサン、ベンゼン、メチルイソブチルケトンを含む農薬の暴露が確認された。
www.ncbi.nlm.nih.gov/pubmed/9923766/
www.ncbi.nlm.nih.gov/pubmed/9721261/
www.ncbi.nlm.nih.gov/pubmed/18307243/
多系統萎縮症を発症した日本人画家
www.ncbi.nlm.nih.gov/pubmed/22953138/
鉄
content.iospress.com/articles/journal-of-alzheimers-disease/jad170601
ミエロペルオキシダーゼ(MPO)阻害剤
MPO阻害剤投与は、MSAマウスの運動障害、神経変性を減少させ、ミクログリア活性を抑制し、細胞内αシヌクレインの凝集体の減少をもたらした。
MPOが多系統萎縮症に関与している可能性。
www.ncbi.nlm.nih.gov/pubmed/22161470/
www.ncbi.nlm.nih.gov/pubmed/26194617
MPOの可逆的阻害剤 可溶性クルクミン誘導体NDS27
www.ncbi.nlm.nih.gov/pubmed/30342014
ヒドロキシフェノキシアルキルアミン誘導体
www.ncbi.nlm.nih.gov/pubmed/27402298
モルヒネ MPOの弱い可逆的阻害剤
www.ncbi.nlm.nih.gov/pubmed/30005836
カフェイン酸フェネチルエステル(CAPE)
www.ncbi.nlm.nih.gov/pubmed/28528363
CAPEは、プロポリスの主要な薬効成分
www.ncbi.nlm.nih.gov/pmc/articles/PMC4058104/
グアニジン
www.ncbi.nlm.nih.gov/pubmed/28671460
カリコシン(キバナオウギ由来)
www.ncbi.nlm.nih.gov/pubmed/29890468
半枝蓮(Herba Scutellariae Barbatae)
www.ncbi.nlm.nih.gov/pubmed/29858895
モリン
www.sciencedirect.com/science/article/pii/S0304416515000288?via%3Dihub
ケンフェロール
www.ncbi.nlm.nih.gov/pubmed/24743918
Moutan Cortex Radicis(漢方)
www.ncbi.nlm.nih.gov/pubmed/22921747
アンジェリカ・シネンシス
www.ncbi.nlm.nih.gov/pubmed/26261562
PDE4阻害剤
www.ncbi.nlm.nih.gov/pubmed/28152479
![]() cAMPとcGMP PDE阻害剤(認知症・アルツハイマー病)
cAMPとcGMP PDE阻害剤(認知症・アルツハイマー病)
睡眠障害の改善
多系統萎縮症の睡眠障害
多系統萎縮症患者では睡眠障害がもっともよく見られる症状で、MSA-P、MSA-Cの両方で起こる。
睡眠障害には睡眠の減少、断片化、昼間の過度な眠気、レム睡眠行動障害(RBD)、睡眠時無呼吸症候群などがある。レム睡眠行動障害はもっとも一般的であり90~100%の患者さんが罹患している。
多系統萎縮症患者の睡眠パターン
- 閉塞性睡眠時無呼吸症候群(OSA)55%
- いびき、喘鳴(ぜんめい)90%
- 周期的な四肢の動き(PLM)60%
- レム睡眠行動障害(RBD)15%
www.e-jsm.org/journal/view.php?number=49
レム睡眠行動障害
レム睡眠行動障害は、パーキンソン病、多系統萎縮症に先行して発症している可能性がある。縦断的研究ではレム睡眠行動障害患者の17.7~65%が5~20年間の間にパーキンソン病を発症することが示されている。
www.ncbi.nlm.nih.gov/pubmed/16781987
www.ncbi.nlm.nih.gov/pubmed/19109537
レム睡眠行動障害はパーキンソン病、多系統萎縮症においてαシヌクレイノパチーを生じさせることが報告されている。
www.ncbi.nlm.nih.gov/pubmed/22136899
メラトニン・クロゼパナム
クロナゼパムは、0.25〜2の用量を就寝約30分前に投与することでレム睡眠行動障害症状の治療に奏功する。しかし、クロナゼパムは併発性の閉塞性睡眠時無呼吸症を悪化させる可能性もある。
www.ncbi.nlm.nih.gov/pubmed/16966533
この場合半減期の短いゾピクロン(3.75~7.5mg)が有害作用が深刻ではなく代替として考えられる。
閉塞性睡眠時無呼吸症候群
メラトニン・ゾピクロン
併発性閉塞性睡眠時無呼吸の場合、ゾピクロン(毎晩3.75〜7.5 mgの用量)またはメラトニン(就寝時に3〜12 mgの推奨用量)が代替の治療法になることがある。
CPAP
多系統萎縮症患者の吸気性喘鳴は、持続的気道陽圧法(CPAP)と気管切開術の両方で生存率が上昇する可能性がある。しかし気管切開術は侵襲的な外科的処置であり患者には容易に受け入れられないので、CPAP療法を最初に検討するべき。
CPAPは疾患初期では長期的に用いることのできる効果的な治療法。進行すると適応は難しくなるかもしれない。(floppy epiglottisではCPAPの重症度を悪化させた)
多系統萎縮症患者の閉塞性睡眠時無呼吸(OSA)は症例の15〜37%。
www.ncbi.nlm.nih.gov/pubmed/22886854
www.ncbi.nlm.nih.gov/pubmed/17716598
鉄代謝の改善・鉄キレート
ミクログリアは大量の鉄を保持しており、これはGCI病理、MSAの病因に寄与する可能性がある。
鉄は野生型のαシヌクレインを凝集させ酸化ストレスを直接的に増加させる。ドーパミンの暴露はこの過程をさらに促進する可能性がある。
フェリチン重鎖は主にニューロンに見られ、フェリチン軽鎖はミクログリア細胞にて観察される。
全身、脳細胞の鉄恒常性ともに鉄応答タンパク質(IRP)によって制御される。IRP2の突然変異/欠損は神経損傷をもたらすことが実証されている。
鉄は炎症条件下で変性脳領域に蓄積し、酸化/ニトロソ化ストレス応答を悪化させる。酸化ストレスから生じるニトロ化αシヌクレインはミクログリアを活性化させることが実証されている。
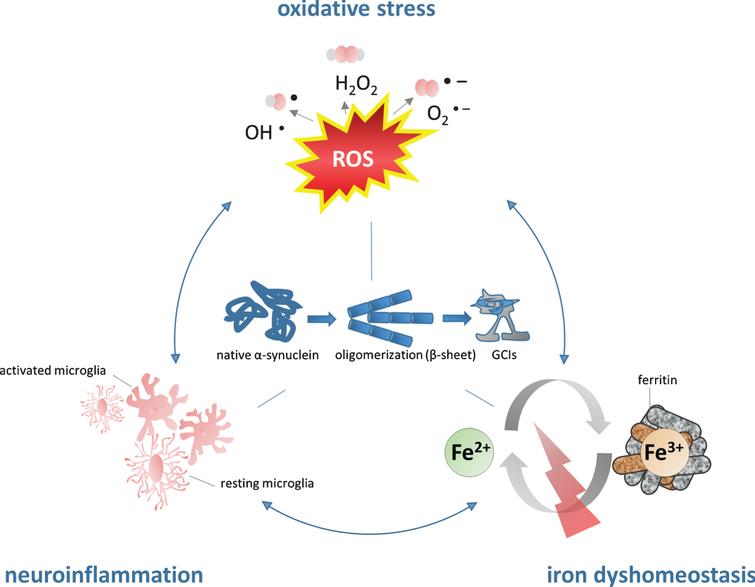
content.iospress.com/articles/journal-of-alzheimers-disease/jad170601
腸内細菌叢不均衡・リーキーガットの改善
多系統萎縮症患者では腸粘膜組織のタイトジャンクション構造が破壊されていることが示されており、腸管バリア機能障害を示唆していた。
多系統萎縮症患者の糞便および粘膜では、炎症誘発性細菌が相対的に多い量を示唆した。反対に抗炎症性と考えられている酪酸酸性細菌はそれほど豊富ではなかった。
www.ncbi.nlm.nih.gov/pubmed/28234259
多系統萎縮症患者の腸マイクロバイオームとメタボロームの変化
onlinelibrary.wiley.com/doi/abs/10.1002/mds.27203
www.mdsabstracts.org/abstract/gut-microbiota-in-multiple-system-atrophy/
www.mdpi.com/2072-6643/10/6/708/htm
ノルエピネフリン欠乏の改善
www.ncbi.nlm.nih.gov/pubmed/9915636/
ノルエピネフリン増加方法
- 強い感情を引き起こす刺激
- カフェイン
- フェニルアラニン(ノルエピネフリンの前駆体)
- チロシン(ノルエピネフリンの前駆体)
- タンパク質
- 減塩
- シネフリン(ダイダイなどのビターオレンジ成分)
ヒト間葉系幹細胞(MSC)
www.ncbi.nlm.nih.gov/pubmed/21625635
www.ncbi.nlm.nih.gov/pubmed/22829267
静脈内免疫グロブリン
基本治療方針(暫定案)
- アルサプ <標準版>
- リファンピシン 個人輸入(リポソーム化)
- トレハロース(リポソーム化)
- うつがあればセルトラリンを検討
- ラサギリン 病院で処方が可能か聞いてみる。または個人輸入 0.2~5mg/日
- 低用量リチウム(ライフエクステンション社のMEMORY PROTECT)
- エストラジオールとプロゲステロンのチェック&補充
- 低用量メマリー 5~10分の1
- 16時間断食(オートファジー活性)
- 胃腸薬テプレノンを処方(HSP70活性)
- HSP 入浴
- ミノサイクリン 個人輸入
- 尿酸を下げる薬に注意
- メラトニン増量 5~10mg(ミトコンドリア・プロテアソーム・タウ)
- メチレンブルー 3~10mg
- GPL-TOX で農薬、有機系溶剤などの化学毒素検査を受ける
- 睡眠時無呼吸症候群のチェック(必須)AHI5以上でCPAP
- L-セリン
- 腸内環境の改善(αシヌクレインの腸-脳経路の遮断)
- 有害金属のキレート(抗酸化、抗プリオン伝播)
- 緑茶またはEGCGサプリメント(抗酸化、鉄キレート)
- BDNF改善策 WCFC→有酸素運動
- GDNFを増やす
- 朝のコーヒーなどのカフェイン含有食品またはカフェインサプリメント
- 食事 タンパク質・減塩・ケトンダイエット
- シネフリン(無農薬の柑橘の皮ごとジューサーで食べる)

