Contents
pubmed.ncbi.nlm.nih.gov/35627104
mRNA Vaccines: Why Is the Biology of Retroposition Ignored?
オンライン公開 2022年4月20日
Isidoro Feliciello(アカデミックエディター)、Durđica Ugarković(アカデミックエディター
要旨
mRNAワクチンの大きな利点は、従来のアプローチと比較して、迅速な開発とパンデミック状況での大規模な展開が可能であることである。現在のCOVID-19危機では、2つのmRNA COVID-19ワクチンが条件付きで承認され、広く適用されているが、他のワクチンはまだ臨床試験中である。しかし、一般集団でmRNAワクチンを大規模に使用した前例はない。このため、mRNAワクチンの安全性については、mRNAの分子生物学と進化に関する利用可能なすべての知識を考慮した上で、慎重に評価する必要がある。
ここでは、mRNAベースのワクチンはゲノムを変化させることはできないという、広く浸透している主張について説明する。驚くべきことに、この考え方はmRNAワクチンの文献で広く述べられているが、この疑問を具体的に取り上げるような主要な科学論文を参照することで裏付けられたことはない。
この矛盾は、マウスやヒトの集団におけるレトロポジションの分子的・進化的側面に関する過去の研究を考慮すると、臨床的背景も含め、ゲノムにmRNA分子が頻繁に組み込まれることを明確に記録しており、さらに不可解なものとなっている。
私は、基本的な比較を行うことで、mRNAワクチンの配列が、ヒトゲノムに最も多く存在する自律活性型レトロトランスポゾンであるL1要素を用いた逆接続の既知の要件をすべて満たすことを示した。実際、mRNAワクチンに関連する多くの要因が、L1を介したレトロポジションの可能性を高めている。
私は、mRNAベースの治療薬がゲノムに影響を与えないと先験的に仮定することは根拠がなく、内在性のL1レトロエレメントを介してワクチンmRNAがゲノムに組み込まれるルートは容易に考えられると結論付けている。
このことは、ワクチンmRNAのレトロポジションの可能性を厳密にテストする実験的研究が早急に必要であることを意味している。現時点では、mRNAベースのワクチンの挿入型突然変異誘発の安全性は未解決と考えるべきだろう。
キーワード mRNAワクチン、レトロポジション、L1エレメント、LINE-1、レトロトランスポゾン、レトロコピー、親遺伝子、ゲノム統合、挿入型変異原性
1.はじめに
mRNAを用いた治療薬の研究開発は、COVID-19のパンデミックの発生を契機に活発化した。現在、SARS-CoV-2に対する2種類のmRNAワクチン(BioNTech/Pfizer BNT162b2およびモデルナ mRNA-1273)が、多くの国で一般市民への使用が承認されており、その他にもいくつかのワクチンが開発中である[3、4、5]。mRNAベースのワクチンの主な利点は、従来のアプローチと比較して、迅速な開発と大規模な展開が可能であることであるとしばしば示唆されている[6,7]が、これらはどちらもパンデミック状況において望ましい特性である。ワクチンのmRNAはゲノム統合のリスクをもたらさないという記述[6,8,9,10,11,12]も、特にDNAベースの治療薬の安全性と比較した場合、mRNAベースのワクチンの利点としてよく挙げられる[10, 12, 13]。この主張を受けて、私はmRNAワクチンの文献をより注意深く調べ、その根拠を探した。驚いたことに、mRNA治療薬のゲノム統合の可能性を特に取り上げた実験的、理論的な研究を探し出すことができなかった。
このような関連研究の不足は、多くのレビュー[4,5,6,9,10,14,15,16,17,18]、mRNAワクチンに関する本の章[13,19,20,21,22]、国際機関の文書[23,24,25]にも反映されていて、mRNAワクチンにはゲノム統合リスクがないと書かれていてもこの考え方に基づく文献を挙げていない場合が多いのが特徴である。時折、[15,22,26,27]などの引用文献が埋め込まれているが、残念ながら、それらは同様の裏付けのない記述[6,10,21,28,29,30]を指すため循環している。このことは、ワクチンmRNAのゲノム統合に対する抵抗性という考え方が、文献の中で自己複製するミームのように振る舞い、したがって、信頼できる科学的情報とはみなされないことを示唆している。しかし、他の研究者も、詳細は省くが、ワクチンmRNAのゲノム統合の可能性を明示的に扱った研究が少ないことに気づいている[13, 31, 32, 33, 34]。このような研究がない場合、「さらに、IVT mRNAベースの治療薬は、プラスミドDNAやウイルスベクターとは異なり、ゲノムに統合されないため、挿入型変異原性のリスクはない」というような記述がある。[10]、「まず安全性:mRNAは非感染性、非統合性のプラットフォームであるため、感染や挿入変異原性の潜在的リスクはない」[6]や「mRNAベースのワクチンは宿主細胞ゲノムとの統合のリスクを回避する…」[24,25]は、明らかに健全な科学的認識論に反している。
参考文献が少ないことに加え、ワクチンmRNA分子のゲノム統合は不可能、あるいは無視できるとする主張の論拠は、大半の論文でかなり限定的である。その多くは、ワクチンmRNAが宿主ゲノムに統合できないことを述べているだけで、なぜそれが不可能なのかを説明していない[3,10,12,19,20,21,22,26,30]。また、ワクチンのmRNAは宿主細胞の細胞質内に留まり、DNAベースのワクチンは核に入らなければ効果がないのとは対照的に、ゲノムを変化させる機会がないことを簡潔に説明しているものもある[4,9,18,27,35]。
最近、mRNAの持続時間が比較的短いため、mRNAワクチンのゲノム統合はあり得ないと主張する論文がある[4,13,27]。しかし、その中には、ワクチンmRNAが宿主細胞内で逆転写された場合、ゲノム統合の可能性を認めるものもある[4,13,31]。逆転写やゲノム統合のための酵素の供給源として、ヒト内在性レトロウイルス(HERV)やレトロウイルス感染症(HIVなど)が挙げられているが、統合リスクはまだ極めて低いというのが共通の結論だ[4,31]。一方、より慎重な意見もあり、ワクチンmRNAの統合が起こりうるかどうかを明らかにするために調査が必要であると指摘している著者もいる[13]。
2. レトロポジションの生物学
しかしながら、ワクチン学分野でのワクチンmRNAゲノム統合リスクに関するこの議論は、レトロポジションの生物学に関する蓄積された知識を考慮していないため、かなり短く、驚くほど不完全である[36,37,38,39,40].多くの真核生物では、様々な遺伝子の細胞内 mRNAが内因的に逆転写され、ゲノムに再統合され、そのレトロコピーが得られる(図 1B)[36、38、39、40]。このmRNAを介した遺伝子重複の過程は、真獣類では非常に頻度が高く[41]、霊長類とマウスで最もよく研究されている[36, 37, 38, 40]。内因性遺伝子の他に、非レトロウイルス性RNAウイルス(ボルナウイルス)に由来するmRNAのレトロポジションも報告されている[42,43]。注目すべきは、レトロポジションに関する用語がまだ完全に定まっていないため、レトロコピーという用語が、processed pseudogenes, retrotransposed pseudogenes, retropseudogenes, retroposed gene copies, retroCNVsやretrogenesなどの関連用語としばしば入れ替わることである[38,39].
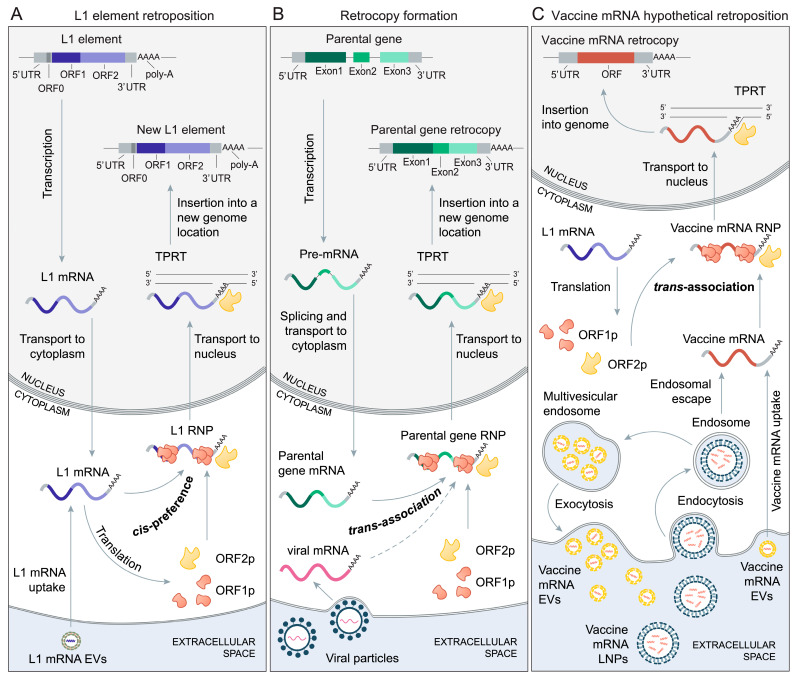
図1 L1を介した逆接続(A) L1エレメントの逆接続サイクル
A)活性化されたL1エレメントは核内で転写され、得られたL1 mRNAは細胞質へ輸送され、そこで翻訳が行われる[44,45]。L1 mRNAはORF1およびORF2タンパク質をコードし、これらのタンパク質はL1 mRNAと優先的に結合し(シスプリファレンス)、L1リボ核タンパク質粒子(L1 RNP)を形成する[44,45,46]。ORF1pはシャペロン活性を持つRNA結合タンパク質であり、ORF2pは逆転写酵素とエンドヌクレアーゼとして機能する[47,48]。まだ解明されていないメカニズムで、少なくともL1 mRNAとORF2pを含むL1 RNPは核に入る。核内では、L1 mRNAが逆転写され、ターゲット・プライム・リバース・トランスクリプション(TPRT)のプロセスを通じてゲノムに組み込まれる[45, 47, 48, 49]。レトロポジション機構は、L1 mRNAのポリAテールへのORF2pの結合に依存している[48,50,51,52]。細胞がL1 mRNAを含む細胞外小胞(EV)を取り込み、翻訳と逆接続を受けることができるという証拠もある[53]。
B)内因性コード遺伝子のL1媒介逆接続とウイルス性mRNAのL1媒介逆接続.親となるタンパク質コード化遺伝子が核内で転写される。得られたプレmRNAは処理され、成熟した親遺伝子mRNAは細胞質へ輸送される。L1タンパク質(ORF1pおよびORF2p)は、トランスアソシエーションと呼ばれるプロセスを経て親遺伝子mRNAと相互作用し、親遺伝子リボ核タンパク質粒子(親遺伝子RNP)を形成する[36、45、46、49]。L1 RNPと同様に、親遺伝子RNPは核内に入り、そこで親遺伝子mRNAはTPRTを経て逆転写され、ゲノムに組み込まれる。このプロセスでは、親遺伝子mRNAのポリAテールが重要な役割を果たす[36,50,51,52]。同様のプロセスで、非レトロウイルス性RNAウイルスに由来するmRNA分子もゲノムに統合される可能性がある。例えば、ボルナウイルス[42,43]やおそらくコロナウイルス[54,55]からのmRNAの統合がある。
(C) 仮説L1を介したワクチンmRNAの逆接着。脂質ナノ粒子(LNP)に配合されたワクチンmRNAは、エンドサイトーシスを介して細胞に入る[1,2,6,10,56]。ワクチンmRNAの一部はエンドソームエスケープを介して細胞質に入り、残りのワクチンmRNAはエンドソームで分解を受けるか[56]、多胞体エンドソームで細胞外小胞(EV)に再包装されて細胞外空間に再び分泌される[57]。隣接または遠くの細胞は、これらのEVからワクチンmRNAを取り込むことができる[57,58]。L1タンパク質(ORF1pおよびORF2p)は、トランスアソシエーションと呼ばれるプロセスを介してワクチンmRNAと相互作用し、ワクチンmRNAリボ核タンパク質粒子(ワクチンmRNA RNP)を形成する[36, 45, 46, 49]。L1や親遺伝子RNPと同様に、ワクチンmRNA RNPは核に入り、そこでワクチンmRNAはTPRTを介して逆転写され、ゲノムに組み込まれる。ワクチンmRNAのポリAテールは、このプロセスにおいて重要な役割を果たす[36,50,51,52]。
アノテーションの方法によって、ヒトゲノムのレトロコピーの推定数は異なるが、ほとんどの研究では約8000である[38,39,59,60]。これらのレトロコピーは、約2500の親遺伝子[59,61]、すなわちmRNAが逆転写されてゲノムに組み込まれた遺伝子から派生する(図1A、B)。これらの値は、スクリーニングされたすべての獣類哺乳類で同様に高く、進化の約200マイの間の内因性レトロポジション活動を反映している[41,61]。しかし、レトロポジションの継続的な活動は、現存するヒト集団においても明らかであり、新規レトロコピーの実質的な多型性が明らかにされている[37,60,62,63,64]。例えば、ヒトの参照ゲノムには存在しない新規のレトロコピーを平均6個保有しており、これらのレトロコピーは503個のユニークな親遺伝子のプールから派生したと推定されている[37]。これらの値は、現生人類集団におけるレトロポジション活動がかなり活発であることを示している。
マウスを用いた最近の研究では、現存する集団におけるレトロコピーの実際の発生率はさらに高く、ヒトとマウスの間で類似している可能性が示唆されており[40]、したがって、レトロコピーの変異が医療文脈で検出されることは驚くべきことではない[65,66]と考えられる。しかし、最適化されていない分析パイプラインの使用により、日常的な遺伝子検査で多くのレトロコピーが見落とされてきたことも示唆されている[40,65]。現在、動物の病気に関連したレトロコピーの出現がいくつか記録されており[49,65,67]、ヒトの病原性レトロコピーが1例[49,65,68,69]、さらに発見される可能性がある[40]。実際、ヒト集団におけるレトロコピーの変異は、一塩基多型よりも表現型に関連し、集団特異的である可能性があり[37,40]、新しく転座したレトロコピーのほとんどは、有害な影響を与えるようだ[40]。これらのことから、現存するヒト集団におけるレトロポジション活動から生じる変異負荷は、医学的に適切であることが示唆される。
最初の選択的パージ[40]にかかわらず、レトロコピーはヒトの生物学と健康に貢献する適応的な意義を持つ新規遺伝子の源である[36, 39]。レトロコピーは、主にレトロコピーには転写駆動要素がなく、したがって転写されないと推定されていたため、加工偽遺伝子と呼ばれる進化のターンオーバーの機能しない残骸とみなされてきた[39,40,41]。最近、ワクチン学の分野でも、ワクチンmRNAのゲノム統合の可能性とその表現型への影響が議論され、同様の議論がなされている[13]。しかし、哺乳類ゲノムのほとんどの領域が転写され[70,71,72]、レトロコピーが独自の制御要素を容易に獲得できることが分かってから[36,38,40,41]、ほとんどのレトロコピーが転写の証拠を示すことが明らかになった[38,40,41].
これらの転写されたレトロコピーは、さらに新しいタンパク質コードやRNAレトロゲンに変化する可能性があるため、進化の革新の源となる[36, 38, 41, 73]。ヒトとマウスでは、およそ数百のRNAレトロゲインと数百のタンパク質コードレトロゲインが活動していると推定されている[36,38]。そのほとんどについて、機能的意義はまだ決定されていないが、いくつかはヒトの疾患遺伝子であることが知られており[74,75,76]、あるいは識別可能な表現型を持っている[36,38]。
これまで述べてきたレトロコピーの多くは生殖細胞系列を通じて垂直的に伝達されるものだが、mRNAの逆位相も体細胞組織で起こる。体細胞レトロポジションは実質的に研究が少ないが、癌組織に多いこと[62,77,78,79,80]、発生初期に起こること[68,69]は知られている。しかし、ヒトにおいてレトロデュプリケーションを駆動する内因性レトロエレメントの活性は、mRNAのレトロポジションイベントが他の体細胞組織でも見られるはずであることを示唆している(下記参照)。このことは、集団レベルやより深い進化の時間スケールだけでなく、個体発生時の体細胞組織においても、レトロコピーが絶えずヒトゲノムを再構築していることを示している。したがって、ワクチンmRNAのゲノム統合の確率を評価する際には、ヒトにおけるレトロポジションの内因性ドライバーを考慮することが重要である。
3.レトロコピー形成のメカニズム
ヒトの系統におけるレトロコピーの形成につながるメカニズムは比較的よく研究されており、主にlong interspersed element-1 (LINE-1 or L1,Figure 1A) レトロトランスポゾンを含む[36, 38, 40, 46, 81]が、ロングターミナルリピート (LTR) レトロトランスポゾンによる回帰も可能だという証拠がいくつかある[38,81].しかし、「RNAが宿主ゲノムに統合できる唯一の既知のメカニズムは、逆転写酵素を含むレトロウイルス粒子の存在下である」というような非常に驚くべき引用がある。[23]は、ワクチン学の分野が、不明確な理由で、ヒトにおけるL1駆動型レトロポジションの存在と重要性に気づいていないことを明らかにしている。このような両分野のギャップを埋めるため、また、ワクチンmRNAの逆接続の可能性について議論するための舞台を整えるため、まず、L1依存の逆接続メカニズムの概要を説明する。
L1レトロエレメントは約6kbの長さで、ヒトゲノムの17%を占め、そのうちの約100個が自身のmRNAのレトロポジションによってゲノム内にコピーを広げる活動をする(図1A)[44, 45, 49, 82, 83, 84, 85]。転写されると、L1は2つのタンパク質をコードするバイシストロンmRNAを産生する:ORF1pはシャペロン活性を持つRNA結合タンパク質であり、ORF2pは逆転写酵素とエンドヌクレアーゼとして機能する[44,45,47,48,49,84,85]。これらのタンパク質はL1 mRNAとともに細胞質でL1リボ核タンパク質粒子(L1 RNP)に集合し、その後核に入ることができる(図1A)[44,45,47,48,49,84,85]。
核内では、L1 mRNAは最終的に逆転写され、TPRT(target-primed reverse transcription)と呼ばれるプロセスを通じて、A/Tに富んだコンセンサス標的部位でゲノムに組み込まれる(図1A)[45,47,48,49]。アンチセンス方向では、L1はORF0pもコードしており、これは核内に局在してレトロトランスポジションの効率を高める小さなペプチドである[49,86]。L1のライフサイクルにおいて、多様な宿主タンパク質は、L1 RNPのレトロトランスポジションを促進または抑制することで相互作用する[49,87]。L1タンパク質機構は、そのコードするmRNAを優先的にターゲットとするが(cis-preference)、非自律移動要素(Alu、SVA)、スプライシングソームRNA、多様なタンパク質コードmRNAなど、細胞内に存在する他の様々なRNAを動員することもできる(トランス-アソシエーション)(図1B)[45,46,49,83,88].
このようにL1エレメントのレトロポジション挙動が緩やかで、トランスアソシエーションによって様々なmRNAを動員できることが、ゲノム中に非自律移動エレメントやレトロコピーが大量に蓄積されている原因である(図1B)。L1エレメントはどのようにしてこのようなプロミスキャスな性能を実現しているのか、という疑問が生じる。このような行動の根本的な理由は、細胞質でのRNP形成時にORF2pがポリAテールに結合することを条件とするL1レトロポジション機構に関連している(図1)[50、51]。その後、核内では、ゲノム統合もポリAテールに依存しており、TPRTプロセスにおいて標的部位でのDNAプライミングに柔軟性を持たせている[48,52]。ポリAテールは非特異的な低複雑性配列であり、細胞内mRNAの3′末端にほぼ遍在していることから[89]、原理的には、すべてのmRNAがL1タンパク質機械の標的となり、TPRTプロセスを受け得ることを示唆している(図1C)。
しかし、レトロポジション特異性が完全に欠如していると、L1エレメントのフィットネスが著しく低下し、ゲノム内での寄生的な増殖が損なわれる。このシナリオを避けるために、L1エレメントはポリAテール依存性に関係なく、自分自身のmRNAを優先的にターゲットにすることに成功した[46, 90, 91]。このシスプリファレンスのメカニズムを説明しようとする一般的なモデルは、翻訳中に、出現したL1タンパク質がリボソームでコードするmRNAとすぐに結合することを想定している[44, 47, 50, 92]。明らかに、このプロセスまたは類似のプロセスによって、L1エレメントの寄生的な再生産と、ポリAトラクトを介したトランスアソシエーションによる多様なmRNAの時折の動員との間のバランスが確保される(図1)。
4.生殖細胞およびソーマにおけるL1エレメント
ワクチンmRNAの統合の可能性とその結果生じる表現型は、人体におけるL1レトロエレメントの全体的な動態に大きく依存しており、このセクションで考察するテーマである。
L1活性は、個体内および個体間の遺伝的変異の重要な要因であり、ヒトの進化と疾病に影響を与える[45,85,93]。宿主ゲノムとL1エレメントの相互作用は、宿主の体力に有益な影響と有害な影響を重層的に及ぼす[93,94,95,96,97,98]。このため、宿主細胞はその活動のバランスを保つために様々なメカニズムを進化させた[93,96,99,100,101,102,103,104]。これらの宿主保護機構にかかわらず、次世代に引き継がれるためには、L1エレメントを介した新しいレトロポジションイベントが生殖細胞系列で発生しなければならない[97]。
ヒトのゲノムには、垂直方向に遺伝する多数のL1エレメント、非自律的移動エレメント、レトロコピーが存在するだけで、それらの動員が生殖細胞系列で繰り返し行われていることを示す直接的な証拠となる[99]。また、L1の活動が生殖細胞系列での継続的な変異誘発に寄与していることもよく知られている[105,106]。しかし、生殖細胞のライフサイクルにおける逆位置の正確な動態はあまり明らかでない[96,97,107,108]。今回のデータは、L1エレメントが精巣[96,105,106,109]、精子[110,111]、卵巣[105,106]、卵子[112]、初期胚において発現とレトロポジション活動を示すことを示唆している[97,99,105,107,108,113].
当初、L1エレメントは主に生殖細胞系列で活性化すると考えられていたが、蓄積された証拠から、体細胞組織においても内因性変異原とみなされるべきであると考えられている[99,100,106,114]。L1エレメントは、肝臓、脾臓、副腎、肺、心臓、脳などの多様なヒト体細胞組織で発現している[106]。リンパ芽球系細胞株[115]; 血小板、巨核球、およびT細胞[98]。L1エレメントの発現と逆位活性は、血管内皮細胞でも検出された[109,116]。しかし、体細胞L1逆位は、脳、癌組織、消化管においてのみ広く研究されている[45,78]。
胎生期と成体期の両方の神経発生において、L1逆位活性は著しい神経細胞モザイクを発生させ[60,99,117,118,119,120,121]、神経疾患においてさらに増加する[121,122]。L1逆位は、グリア細胞、神経前駆細胞、分化する神経細胞、成熟した非分裂神経細胞など、中枢神経系の多様な細胞タイプで起こる[118,121,123,124,125,126].L1駆動型体細胞モザイクは、神経細胞の機能特性を変化させ、その多くがユニークなゲノムを含む可能性があると推測されている[118,126]。しかし、このモザイクの生物学的・医学的意義は完全には明らかにされていない[120,121,122]。
L1エレメントは、多くのヒトのがんでも高発現しており、内因性変異原として機能し、腫瘍形成における変異を促進する原因となり得る[84,85]。上皮癌は特にL1逆位を起こしやすいようである[45,78]。興味深いことに、L1挿入は腫瘍細胞だけでなく、肝臓、胃、結腸、食道の正常細胞にも見られ[127,128,129,130]、消化管におけるL1エレメントの体細胞活動が広く存在することを示唆している。一般に、体細胞L1逆位は、高度に個体差に依存し、L1転写抑制のため、高齢になると強く増加する[104,131]。内因性の制御に加え、L1エレメントの活性は外因性のシグナルに敏感であり、多くの環境因子によって誘導される可能性がある[93,99,100,114,122]。これらを総合すると、ヒトの生殖細胞や多くの体細胞は、シスプリファレンスとトランスアソシエーションを介して、L1を介した逆接続の可能性が持続していることが明らかである(図1)。
5.ワクチンmRNAとレトロポジション
明らかに、ヒトの様々なmRNAは、L1レトロエレメントを介して逆転写されゲノムに組み込まれ、フィットネスに悪影響を及ぼす可能性がある。しかし、このことは、ワクチンmRNAにも起こることを容易に示唆するものではない。決定的な答えは、実験と集団モニタリングから得られるだろうが、今のところ、その記述された特性を考慮し、L1レトロポジション機構と比較して評価することが有用である(図1)。BNT162b2ワクチンの活性物質は、4284ヌクレオチド長の合成mRNA分子で、天然に存在するウリジンを置換する修飾ヌクレオシドであるN1-methylpseudouridine(m1Ψ)を含んでいる[1,132,133]。このヌクレオシド修飾は、外来mRNA分子に対する自然免疫反応を低下させ、その翻訳を促進する(表1)[6,134,135,136].構造的に、BNT162b2 mRNAは、5′キャップアナログ、5′非翻訳領域、コドンに最適化されたSARS-CoV-2スパイクプロテインコード配列、3′非翻訳領域および110ヌクレオチドのポリA尾部からなる[1、56、132、133]。これらの構造要素は、通常の真核生物のmRNAの構造に従っており、mRNAワクチンのRNA安定性と翻訳効率を高めるのに役立つ(表1)[6,10,28,133]。BNT162b2とは対照的に、mRNA-1273ワクチンの正確なmRNA配列は公開されていないようだ[56]。しかし、その一般的な設計は、ウリジンの代わりにm1Ψの使用、5′キャップ構造、5′非翻訳領域、コドン最適化スパイクプロテインコード化配列、3′非翻訳領域およびポリAテールの存在を含むBNT162b2 mRNAに似ている[2,137].
表1 L1エレメントによるワクチンmRNAのレトロポジションの可能性を高める要因の一覧
| mRNA ワクチンの特徴 | 参考文献1 |
| ネイティブmRNAの構造 | [6,10,28,133] |
| 3′ポリAテール | [51,52,132] |
| m1Ψ modification | [20,134,135,136] |
| 安定性、半減期、翻訳効率の向上 | [6,10,27,56,133,138,139] |
| 投与量あたりのmRNA濃度 | [1,140] |
| リカレントアプリケーション | [1,2,56,141,142] |
| 脂質ナノ粒子製剤 | [1,2,10,56,143] |
| サイトゾルデリバリー | [5,6,10,56] |
| バイオディストリビューション | [1,2] |
| 細胞外ベシクルのリパッケージング | [53,57] |
| その他の要因 | 参考文献1 |
| 細胞増殖率の向上 | [37,64,84] |
| エージング | [104,131] |
| ウイルス感染症 | [54,55,144,145,146] |
1これらの要因について記述した関連文献の一部。詳しい考察は本文を参照されたい。
BNT162b2とmRNA-1273 mRNA 合成分子は、その配列の観点から、真核細胞の細胞質で生じるネイティブ mRNAの構造を構造的・機能的に模倣しているため、トランスでのL1 逆行性のターゲットとして適していると考えられる(表 1)[6,10]。この点で、おそらく最も重要な配列の特徴は、L1を介したレトロポジションに必要であることが知られているポリAテールである(図1、表1)[51]。しかし、ワクチンmRNA工学の論理に関する利用可能な情報から、ワクチンmRNAは、L1逆位相変換装置による捕捉を避けるために特別に構築されていないことが明らかになった[1,2,6,10,56]。実際、mRNAワクチンの分野では、この可能性を考慮した研究はなかったようである[4,6,10,13,31]など。例えば、BNT162b2 mRNAのポリAテールは、10ヌクレオチド長のリンカー配列を含み、30および70ヌクレオチド長のアデノシン路に挟まれている[132]。しかしながら、ポリAテールの3′末端に直接隣接するヌクレオチド変化のみがL1逆接機構に大きな影響を与えることが知られているため、翻訳効率を高めるのに役立つこのポリAテール修飾は、ワクチンmRNAの逆接傾向に影響を与えることはないと考えられる[51,52,102]。さらに、ポリAテールの3′末端の非アデノシンヌクレオチドは、翻訳効率を妨げるため、mRNA治療薬では一般に避けられる[148]。同様に、mRNA分子あたりの修飾ヌクレオチドの総数のため、m1Ψリボヌクレオシド修飾は、おそらくワクチンmRNAの最も顕著な人工的特徴である;しかしながら、これらのタイプのリボヌクレオシド修飾は、一般的に逆転写を妨げない[149]。
6.親遺伝子とBNT162b2
比較の観点から、現存する集団でレトロコピーを積極的に生成することが知られている遺伝子(親遺伝子)(図1B)は、レトロポジションに関連する一般的なmRNA配列傾向を評価するための最良の参考資料となる。しかし、親遺伝子の集団的特性については、これまで広範に分析されてこなかった。親遺伝子が翻訳、リボソーム、細胞内腔、細胞分裂関連の機能カテゴリーに富んでいること[37,62,64]、高発現の傾向が弱いこと[37]を報告した研究もあるが、より詳細な解析はまだなされていない。そこで、現存する集団でレトロコピーを活発に生成することが知られている親遺伝子から転写されたmRNAの基本的な配列特性をここで探り[37,40]、その情報を公開されているワクチンmRNA配列(すなわち、BNT162b2)と関連づけることは有益である。
現在推定されているヒトの親遺伝子数は503個[37]で、1663個が回収されているマウス[40]よりも少ない。しかし、改良されたレトロコピー検出パイプラインとより高いシーケンス深度を使用したマウスでの研究では、親遺伝子の数が飽和状態に達していないことが判明した。したがって、実際の親遺伝子の数は、特にヒトではより多いと予想されるはずである[40]。このような固有の不完全性にかかわらず、利用可能なデータセットから、マウスとヒトの両方の親遺伝子がmRNAの長さに幅広い分布を持っていることがわかった(図2A、B)。また、親遺伝子のmRNAは、すべてのタンパク質コード遺伝子の平均よりもわずかに長い配列を持つ傾向があることも明らかになった(図2A,B)。ここでは、遺伝子ごとに最も長いスプライシング変異体のみを考慮し、より短い遺伝子やイントロンレスの遺伝子はレトロコピー/親遺伝子検出パイプラインで見落とされるかもしれないという注意点のもと、この結果から、L1を介したトランスでのレトロポジションが親遺伝子のmRNA配列長によってある程度調節されていることが明らかになった。いずれにせよ、BNT162b2 mRNAの配列長は、親遺伝子の平均mRNA長に非常に近く(図2A、B)、BNT162b2 mRNAの配列長がレトロポジションの障害になることはないだろうことが示された。
図2 BNT162b2 mRNAの基本的な配列特性は、レトロコピーを生成する親遺伝子の範囲内であることがわかる
ジッタープロットは、親遺伝子(青い点)と全遺伝子(灰色の点)がx軸に沿ってランダムに分布している。赤い三角形は、BNT162b2 mRNAの値を示している。親遺伝子平均(青破線)と全遺伝子平均(灰色実線)の差の有意性は、順列検定(両側、106回の順列)を用いて検定した。初期リストには、503個のヒト[37]と1663個のマウスの親遺伝子名が含まれていた[40]。すべてのマウスと496のヒトの親遺伝子名を配列データにリンクすることに成功した。ポリAテール長は、7760(オルガノイド、レプリケート1)および9132(iPSC、レプリケート1)のヒト遺伝子について、遺伝子ごとに複数の推定値を平均化することによって得られた[89]。(A) マウスのcDNA長さの比較(p= 0; 22,770の全遺伝子、1663の親遺伝子、Ensembl GRCm38.86)。(B)ヒトのcDNA長さの比較(p = 0; 22,964個の全遺伝子、496個の親遺伝子、Ensemble GRCh38.86)。(C)マウスにおけるGC含量の比較(p = 0.00021;22,770 全遺伝子、1663 親遺伝子、Ensembl GRCm38.86)。(D) ヒトにおけるGC含量の比較(p = 0; 22,964個の全遺伝子、498個の親遺伝子、Ensemble GRCh38.86)。(E)ヒトiPSC由来大脳オルガノイドにおけるポリAテール長の比較(p = 0.69; 7760全遺伝子、330親遺伝子、Ensemble GRCh38.84).(F) ヒト人工多能性幹細胞(iPSC)におけるポリAテール長の比較(p= 0.26; 全遺伝子9132個、親遺伝子369個、Ensemble GRCh38.84).
翻訳と安定性を向上させるために、ワクチンmRNAは頻繁に配列および/またはコドンの最適化が行われ[1,6,56,150]、この最適化はGC含量に影響を与える可能性がある。そこで、BNT162b2 mRNAが親遺伝子の範囲外だろうかどうかを確認するために、マウスとヒトのGC含量を探索した。mRNAの長さ解析と同様に、親遺伝子のGC含量は広い範囲の値を示している(図2C,D)。マウスでは、親遺伝子のGC含量の平均値はゲノム平均値とほぼ等しいが(図2C)、ヒトでは、親遺伝子はやや低い値を示す傾向にある(図2D)。BNT162b2 mRNAのGC含量は親遺伝子の平均値より高いが、その範囲内である(図2C、D)。したがって、BNT162b2のGC含量の特殊性がその逆位を妨げるとは考えにくい。
これまで解析したmRNAの配列は、バイオインフォマティクスのcDNA配列(コード配列+非翻訳領域、ポリAテールを除く)に対応している。一般的に、ポリAテールは転写後に付加されるため、ゲノムベースの解析では考慮されず、その塩基配列を正確に復元することは技術的に困難であった。しかし、トランスクリプトームスケールでのポリAテール配列決定法は継続的に改善されており、最近得られたデータセットは、その長さの分布について洞察を得る機会を与えてくれる[89]。ここでは、ヒトの人工多能性幹細胞(iPS細胞)とiPS細胞由来の脳オルガノイドにおいて、FLAM-seqを用いて推定したポリAテールの長さを調べた[89]。既知の親遺伝子と全コード遺伝子の平均ポリAテール長に違いは見られなかった(図1E,F)。親遺伝子のポリAテール長の分布範囲はかなり広く(図1E,F)、L1マシンはポリAテール長の変動にほとんど影響されないことがわかる。BNT162b2のポリAテールは110ヌクレオチドであり、これらの値の範囲内にあるため、ポリAテールの長さに関するレトロポジションの困難は特に予想されない。この時点で、ポリAテールは他のmRNAワクチン候補にも存在することに言及する価値がある[5,151,152]。
この単純なアドホック比較解析は、現存する集団でレトロコピーを活発に生み出す親遺伝子の長さ、GC含量、ポリAテール長を対象としている(図2)が、他のデータセットや配列特性を考慮したり、より高度な分析アプローチを用いることで拡張できるかもしれない。しかし、その主な目的は、ワクチンmRNAを含む、ヒト細胞内のポリAテールを含むmRNAが、L1機構によってゲノムに組み込まれる可能性があることを示すことである。また、例えば[6,10,23,24,25]のように、mRNAベースの治療薬が統合の安全性があるとテストせずに仮定するのは非常に危険であることを明らかにした。
7.薬理学的側面
合成mRNAは、そのヌクレオチド配列、製剤、投与経路に依存する、かなり複雑な薬理作用を有する[10,56,143]。ヌクレオチド配列以外にも、L1エレメントを介した合成mRNAのゲノム統合の可能性は、組織や臓器におけるその分布、ひいては細胞質におけるその濃度と安定性に依存する(表1)。1回の投与における合成mRNAの量は、mRNAワクチンの薬物動態と薬力学を決定する最初の要因である[10,143]。したがって、BNT162b2およびmRNA-1273の申告値を考慮することは有益である。30μgのBNT162b2を1回投与すると[1,140]、約1.3×10^13個の合成mRNA分子が存在する。細胞質への経路におけるワクチンmRNAの損失を無視し、ヒト体内のおよそ3×10^12個の有核細胞間で均質に分布していると仮定すると[153]、すべての有核細胞は約26個のmRNAコピーを受け取ることができる。これは、細胞あたり平均25個のmRNAコピーを持つ発現ヒトタンパク質コード遺伝子と比較すると、かなりの量である[154]。これらの値は、BNT162b2の1回の投与で送達されるワクチンmRNAの量が、理論的には、原理的に逆接続を受けることができるすべての単一のヒト細胞のトランスクリプトームを再プログラムするのに十分な量であることを示している。mRNA-1273ワクチンの配列が非公開であるため、同様の計算はできないが、その配列長およびヌクレオチド組成がBNT162b2と同等であると仮定すると[2,5,56]、mRNA-1273ワクチンの単一用量は100μgの合成mRNAを含むため、有核細胞あたりのmRNA分子数はさらに多くなる可能性がある[2,56]。この計算により、ワクチンmRNAの細胞内取り込みの理論的上限が得られる。しかし、合成mRNAの複雑な薬理学[10]と文献上のデータがかなり限られているため、下限を推定するのはより困難である[1, 2, 56, 140]。
筋肉内接種後、BNT162b2とmRNA-1273 mRNA 分子は細胞質に到達し、そこで、SARS-CoV-2 スパイクプロテインに翻訳され、最終的に防御免疫応答を引き起こす[1,2,56,143,155]。侵入部位から細胞質までのこの道のりで、いくつかの裸の未修飾mRNAは、遍在する細胞外リボヌクレアーゼによってほとんど分解されるであろう[5,6,10,156]。エンドサイトーシスによって最終的に細胞内に入った残りのmRNA は、主にエンドソームに巻き込まれ、時間の経過とともに分解される[10,56,155,156]。その上、ヌクレオシドが修飾されていない裸のmRNAは、エンドソームやサイトゾルにおいてパターン認識受容体によって検出され、インターフェロンシグナルなどの経路を引き起こすことによって、RNA分解を促進し、炎症を誘発し、翻訳や複製を阻害する[5, 10,56]。したがって、一部の外部mRNAがサイトゾルに到達したとしても、その半減期は大きく損なわれているはずだ。このような外部RNAに対する複数の自然免疫機構は、真核細胞がトランスクリプトームの再プログラミングを回避するための強い選択的圧力下にあることを示している。外部mRNAの細胞質への侵入と活性化を防ぐことで、これらの保護機構は、外部mRNAと内因性L1機構との相互作用の可能性をほぼ排除し、その結果、一部の外部mRNAが逆位置に置かれる可能性を低くする。
しかし、mRNAワクチンが効果を発揮するためには、外来RNAに対するこれらの生得的防御機構を克服し、細胞質に到達し、リボソームによって効率的に翻訳されなければならない[6,10]。BNT162b2およびmRNA-1273ワクチンの場合、これは、合成mRNAを安定化させ、生得的な防御機構からほとんど見えないようにする精巧な配列最適化とヌクレオシド修飾によって達成される(表1)[1、2、6、10、56]。さらに、過酷な細胞外環境から守るために、合成mRNAは脂質ナノ粒子(LNP)に配合され、細胞への取り込みとエンドソームからの脱出による細胞質への侵入を促進する[1,2,10,56,143]。ワクチンmRNAの細胞質への送達を改善するこれらの顕著な工学的成果は、ワクチンmRNAのレトロポジションの可能性を不注意にも高めていることに注意することが重要である(表1、図1C)。この欠点は、原理的に、ワクチンmRNAの細胞質への送達を改善すると、内因性のL1機構との相互作用の確率が高まるという事実に起因している。しかしながら、ワクチンmRNAの安定性が向上し、LNPが形成されたとしても、初期投与量のかなりの部分が分解され、細胞質に到達することはない[143,155]。残念ながら、BNT162b2およびmRNA-1273に関する公開されているアクセス可能な情報では、ワクチンmRNAの初期投与量の何パーセントが細胞質で生物学的に利用可能になるかは明らかになっていない[1,2,143]。いずれにせよ、ワクチンmRNAの細胞質への送達をさらに改善することは、mRNAワクチン学の分野で大きく追求されている目標であり[6, 10, 143, 155, 157, 158]、同時にL1による逆接着の可能性を高めることになる(図1C、表1)。
細胞質内のすべてのmRNA 分子は、多くの分解経路の一つを通じて最終的に崩壊する[159,160]。一度分解されると置換されない外来ワクチンmRNAとは対照的に[6,10,157]、内因性mRNAのレベルは転写と崩壊の間の相互作用によって制御されている[159,160]。他のすべてのパラメータを無視した場合、これは、L1を介した逆接の確率が、細胞内に一過性に存在するワクチンmRNAよりも、典型的な発現レベルを持つ内因性遺伝子の方が高いことを意味することになる。しかし、いくつかの追加的な要因が、ワクチンmRNAの逆接続の可能性を高める。個体あたりの投与回数は、ワクチンmRNAがL1機械と出会う時間を長くするため、逆接の可能性を直接的に増加させる(表1)。当初、BNT162b2およびmRNA-1273は、それぞれ3週間および1カ月の間隔で2回の連続投与として筋肉内投与された[1,2,56]。しかし、その後、追加のブースター接種が導入された[141,142]。必要な接種回数が増えれば増えるほど、ワクチンmRNAのレトロポジションの可能性が高まることは明らかだ。これは、現在のインフルエンザに対する季節性ワクチン接種プログラムのように、mRNAワクチンを長期間繰り返し接種する必要がある場合に、特に顕著な問題となる可能性がある[142,161]。
ワクチンmRNAゲノムの統合の可能性に影響する追加の特性は、ワクチンmRNA分子の安定性である。真核細胞における内因性mRNA分子のターンオーバーは大きな変動性を示し、平均半減期は約7時間と推定されている[138]。細胞内のワクチンmRNAの半減期の正確な測定値は公開されていないが[1,2]、ワクチンmRNAの配列とコドンの最適化は、翻訳効率を改善する目的で、その機能的半減期を延長することが明らかである[6,10,27,56,138,139]。間違いなく、この機能的半減期の延長は、ワクチンmRNAがL1機構に遭遇し、最終的にゲノムにレトロポーズする可能性を高める(表1)。さらに、ワクチンmRNAが、mRNAの貯蔵と崩壊の制御に関与するリボ核タンパク質顆粒[28,159,162,163]や、細胞質に存在するL1リボ核タンパク質粒子とどのように相互作用するかは、まだ解明されていない[164].
8.生体内分布のプロファイル
L1エレメントの活性は細胞、組織、臓器によって異なるため、生体内分布プロファイルはワクチンmRNAゲノム統合の可能性を決定するもう一つの重要なパラメータである[99,100,114]。興味深いことに、BNT162b2ワクチンについては、直接的な生体内分布研究は実施されていない[1]。しかし、マウスとラットを用いた代理研究では、注射部位から肝臓、副腎、脾臓、生殖腺を含むほとんどの組織へ、異なる量ではあるが分布することが示されている[1]。mRNA-1273ワクチンの直接的な分布および薬物動態試験も実施されていないが、同じLNPとサイトメガロウイルス抗原をコードするmRNAのカクテルを用いたラットでの研究は、腎臓を除くこれらのmRNAが、注射部位筋肉、近位および遠位リンパ節、脾臓、目、心臓、肺、脳および精巣を含むすべての検査組織で、さまざまなレベルで検出できることを示している[2]。特に、卵巣へのmRNAの分布は、規制文書に説明されているように、この研究に雌ラットが含まれていなかったので、テストされていない[2]。明らかに、これらの代理生体分布プロファイルは、肝臓[127]、脾臓[106]、脳[60,99,117,118,119,120,121]、副腎[106]、筋肉[104,131,165] および性腺[96,105,106,109,112]など、L1要素の活動を示すことが知られている器官に大幅に重なる(表1)。
BNT162b2またはmRNA-1273の単回投与におけるワクチンmRNAの量を考慮すると、これらの厳密な局所分布でも完全な全身分布でもないパターンは、一部の組織においてワクチンmRNAがかなり高い濃度で蓄積され、受容細胞の外来mRNA取り込み能力を飽和する可能性があることを示唆している[10,166]。L1を介したレトロポジションの可能性をより正確に評価するためには、どのような細胞タイプがワクチンmRNAを取り込むことができるかを理解することが重要である。規制当局によれば、接種部位と排泄節に存在する樹状細胞とマクロファージは、BNT162b2ワクチンとmRNA-1273ワクチンの標的となる2つの主要な細胞タイプである[167]。しかし、BNT162b2ワクチンの評価報告書では、専門の抗原提示細胞(APC)以外の細胞がワクチン由来のスパイクプロテインを一過性に発現するかどうかは不明であるとしている[1]。同様に、mRNA-1273ワクチン評価報告書では、送達されたワクチンmRNAは主にマクロファージと樹状細胞によって発現されると宣言されている[2]。これは、mRNA-1273が他の細胞種でも発現していることを明らかにするものである。また、BNT162b2およびmRNA-1273を樹状細胞およびマクロファージに排他的/優先的に駆動する作用メカニズムが存在するとしても、これらの文書では説明されていないことを示している[1,2,167]。
マクロファージや樹状細胞は、専門的な抗原提示細胞(APC)として、その環境をサンプリングすることに特化しているが、基本的にすべての有核細胞はエンドサイトーシス能力を有している。いくつかの研究から、mRNA LNPの細胞への取り込みは、アポリポタンパク質E(ApoE)のLNPへの結合と、低密度リポタンパク質(LDL)受容体によって促進されるその後のエンドサイトーシスに依存することが示されている[56, 166, 168, 169].ApoE、LDLおよびLDL様受容体は、体中の多くの細胞タイプで発現しているため[170,171]、mRNA LNPを内在化する細胞タイプはAPCだけではないと予想される[56,169]。例えば、筋細胞、上皮細胞、線維芽細胞がワクチンmRNAを取り込み、その発現に寄与することを示す研究もある[56,172,173,174]。これらの考察から、樹状細胞やマクロファージ以外の細胞種がBNT162b2やmRNA-1273のワクチンmRNAを内在化する可能性が最も高く、L1機械とワクチンmRNAの潜在的な出会いは、幅広い組織内の多様な細胞種で起こる可能性があると考えられる(表1)。
エンドサイトーシス後、mRNAを含むLNPは後期エンドソームで再包装され、細胞外小胞(EV)として細胞外空間に分泌されるという最近の発見により、LNP製外来mRNAの輸送と摂取における別のレベルの複雑さが生じる(図1C)[57].これらのワクチンmRNA EV(エンドEV)は、他の臓器への生体内試験輸送中に細胞外液中の外来mRNAを保護し、無傷の外来mRNAを遠くのレシピエント細胞の細胞質に送達する[57,58,175,176,177]。ワクチンmRNA EVはサイズが小さいため、自然免疫機構に対してはLNPよりも見えにくく、血管内皮や細胞外マトリックスを通過することができる[57,178]。樹状細胞[179]やマクロファージ[180]など多くの細胞種がEVを分泌することを考えると、外来mRNAが到達し得る細胞や組織の範囲は、LNPsルートのみと比較して大幅に拡大する(図1C)。最近の研究では、培養細胞中のL1 mRNAもEVにパッケージされ、EVを介してレシピエント細胞に送達され、そのゲノムにレトロポーズされることが示された(図1A)[53]。これらのことから、EVのダイナミクスは、活性型L1エレメントとワクチンmRNAの相互作用の確率を大幅に引き上げることが示唆される(図1C、表1)。
体細胞や生殖細胞におけるワクチンmRNAのゲノム統合の可能性(図1)は、考慮すべき唯一の副作用ではない。理論的には、ワクチンmRNAは精子RNAカーゴを介してエピジェネティックに継承される可能性もある[181,182,183,184]。これは、男性の生殖細胞系列の精巣細胞がワクチンmRNAを含むLNPまたはEVを取り込み、これらのmRNAがその後精子に到達した場合に起こり得る[182,183,185]。あるいは、精巣上体で機能的に成熟する間に、精子は精巣上体EVによって送達されたワクチンmRNAを積極的に内在化する可能性もある[184,185]。ヒト精子におけるワクチンmRNAの存在と統合は、他の統合関連組織と比較して、ワクチン接種を受けた男性の精液が比較的アクセスしやすい体液であるため、比較的容易に試験することができる。
9.最後に
さらに言及すべき点がいくつかある。SARS-CoV-2を含むウイルスによるヒト細胞の感染が、その内在性L1レトロエレメントの活性を高めることを報告した論文がいくつかあり[54、55、144、145、146]、これはL1活性の推定環境調節と一致している[114]。これらの知見は、逆説的ではあるが、ウイルス感染活動中または治癒後のmRNAワクチン接種は、ワクチンmRNAゲノムの統合の可能性を高める可能性があることを示唆している。COVID-19ワクチンmRNAはSARS-CoV-2スパイクプロテインをコードしている[56]。実際、最近の研究では、感染すると、SARS-CoV-2のサブゲノムmRNAはL1エレメントによって逆転写され、感染細胞のゲノムに統合されることが示されている[54]が、別の研究ではこれらの結果に一部異議を唱えている[55]。興味深いことに、スパイクmRNAを含むSARS-CoV-2ゲノムの3′末端に近いmRNAの断片は、5′末端に近い配列よりも頻繁に細胞DNAに統合される[54]。この統合の偏りは、著者らによって示唆されたように、SARS-CoV-2サブゲノムmRNAの存在量の違い[186]に関連している可能性がある[54]。しかし、これは、サブゲノムmRNAの入れ子構造[186]と、ポリAテールに依存し[51]、3′末端からの距離が長くなると転写物を切断しやすいL1レトロポジションの機構を反映しているとも考えられる。
L1レトロトランスポゾンの活動は複製と密接に関連しており[47,86,187,188]、細胞mRNAのレトロポジションは細胞分裂と連動していることが示唆された[37,64]。このことは、ヒトの増殖細胞集団において、ワクチンmRNAのゲノム統合のリスクが高まる可能性があることを示唆している。腫瘍については、ワクチンmRNAの生物学的分布プロファイルを入手することができない。しかし、腫瘍細胞におけるL1再転写の上昇と相まって、複製活性が上昇していることから[84]、腫瘍はワクチンmRNAのゲノム統合の可能性にとって好ましい環境と言える(表1)。この点で、マウス腫瘍モデルにおけるmRNAワクチンの生物学的分布プロファイルをテストし、最終的な体細胞逆位事象を探すことは非常に有益であろう。実際、本論文のプレプリントバージョンが公開されてから約半年後に、ヒト肝腫瘍細胞株におけるBNT162b2の高レベルの取り込みとその逆転写を報告する実験的研究が発表された[189]。
一見すると、mRNAワクチンを接種しても、個体および集団レベルでの一次逆位率を変化させることはできないように見える。その理由は、ワクチンのmRNAは直接変異原性がなく、ゲノム統合の可能性があるルートは内因性の細胞メカニズム、すなわち利用可能なmRNAプールを継続的に操作するL1エレメントの活性に依存するためだ。とはいえ、一次レトロポジション率の変化の可能性は、LNP製mRNAのワクチン接種がL1活性を変調させないことを試験せずに除外することはできないので、直ちに否定すべきではない。すでに説明したように、ウイルス感染[54,55,144,145,146]など、多くの外来因子がL1活性を修飾することはよく知られている[114]。
一方、ワクチンmRNAゲノムを統合することで、レトロコピーされる可能性のある配列のスペクトルが広がることは明らかである(図1)。私たちの細胞は、固有遺伝子のレトロコピーを生成するL1エレメントの活動から生じる突然変異の圧力下で進化していた[37,40]。しかし、ゲノムにレトロコピーされる可能性のある外来性・人工改変mRNAをヒト細胞にトランスフェクションすると(図1C)、標準的な変異配列空間がトランスジェニック改変の領域にまで拡大される。ヒトにおけるトランスジェニックの可能性が、倫理的に適切な対処を必要とするものであることは、むしろ明らかだ。このことは、2つの疑問を提起している:ワクチンmRNAのレトロポジションの可能性を調査する責任は誰にあるのか、そして緊急用mRNAワクチンの適用によって生じる最終的なゲノム改変に責任を持つのは誰なのか。これらの疑問に対する答えは、間違いなく、社会全体にとって極めて重要である。
ワクチンmRNA分子の逆位置は、原則として、L1エレメントの活性を示すトランスフェクション細胞であれば、どの細胞でも起こり得るランダムな事象である(図1C)。新しいレトロコピーのクローン拡大は、その表現型効果と変異細胞の既存の増殖能に大きく依存する。極端な話、必須遺伝子を直接不活性化するワクチンmRNAレトロコピー[113,190]は、細胞死を引き起こし、そのレトロコピーのさらなる拡散を妨げることになる。しかし、中程度の毒性または中立のレトロコピー[76,191]で、増殖能の高い細胞で出現したものは、多数の子孫細胞に伝播する可能性が高い。成人では、ソーマの多くの細胞の増殖能力はかなり制限されており[191,192]、加齢とともにさらに低下する[193]。このことから、成体におけるワクチンmRNAのレトロコピーモザイクは、より小さな細胞集団や個々の細胞に大きく限定されるはずだ。しかし、前駆細胞、成人幹細胞[194]、前がん細胞[193]でレトロポジションが起こると、体組織のより大きな塊でレトロコピーのクローン拡大が起こると考えられる。
体細胞レトロポジションの比較的限定された影響とは対照的に、遺伝性のワクチンmRNAレトロポジションの可能性は、完全なトランスジェニック個体を作り出すことによって、より広範囲に影響を及ぼすと考えられる。遺伝する可能性のある仮想的なワクチンmRNA逆接合は、生殖細胞または初期胚の多能性細胞で起こりうる[113]。すでに述べたように、規制当局の文書には、代理生物学的分布研究により、L1エレメントの活性を示すことが知られている生殖腺へのLNP製mRNAの分布が報告されている[1,2]と記載されている[96, 99,105,106,109,110,111,112].一方、精子RNAカーゴに格納されたワクチンmRNAは、L1活性のホットスポットである初期胚の多能性細胞に到達し[93,94,95,97,107,108]、そこでレトロポジションを受ける可能性があると仮定できる。その結果、体細胞モザイクが生じ、個体内の細胞のかなりの部分がトランスジェニックとなり、生殖腺も影響を受けると、レトロコピーが遺伝する可能性がある[97,113]。
ワクチンmRNAレトロコピーの表現型は、他の要因の中でも、トランスジェニックとなる細胞の数とアイデンティティ、挿入遺伝子座、挿入配列の完全性、挿入方向、レシピエントゲノムの特殊性、レトロコピーの発現能に依存する。ネイティブmRNAは転写駆動要素を持たないが、そのレトロコピーのほとんどが転写の証拠を示すことがよく知られている[38,40,41]。したがって、仮説のワクチンmRNAレトロコピーも発現の可能性が高いと予想される。ネイティブ遺伝子の多くの発現したレトロコピーは、フィットネスに強い負の影響を与える傾向があり、したがって、比較的早く集団から粛清される[40]。発現したレトロコピーのこれらの有害な影響は、しばしば親遺伝子との干渉に関係していることが示唆された[40]。仮想的なワクチンmRNAレトロコピーは宿主ゲノムに親遺伝子を持たないため(図1C)、レトロコピーとその親遺伝子の間の発現干渉に関連した影響はありえない。しかし、発現したワクチンmRNAのレトロコピーは、宿主の免疫系、後のウイルス感染、その後の投与ラウンドで受け取ったワクチンmRNA、およびネイティブmRNAと予測不可能な方法で相互作用する可能性がある。例えば、ワクチンmRNAのレトロコピーのアンチセンス転写UTR領域は、ヒトグロビン遺伝子の相補的転写物を潜在的に沈黙させる可能性がある[43,195,196,197]。
10.結論
mRNAワクチンの改良のための現在のエンジニアリング戦略[150]と宣言された将来の方向性[150,198]は、ヒト細胞に内在するL1レトロエレメントを介したワクチンmRNAゲノム統合の可能性を考慮していない。これは、L1を介したレトロポジションの生物学と、ヒトの遺伝学、発生、進化におけるその役割に関する知識ベースと矛盾している。mRNAの逆位は、ワクチン学以外でも生物医学的に認められている現象であることを考えると、なぜこのようなリスクが見過ごされているのか、さらに不明である[44,49,62,65,66,68,69,77,79,80,83].このような両分野の相違を解消するためには、ワクチンmRNA逆接の存在を検出し、逆接の頻度を推定することを目的とした動物モデルの実験的研究を計画し実施することが重要であろう。この試みでは、様々な組織のシングルセルシークエンスが重要な役割を果たすと思われる[191]。L1レトロエレメントを介した逆接着傾向は配列に依存するため、すべてのmRNA治療薬候補を独立してテストすることが望ましい。この情報は、ワクチンmRNAをさらに改良し、活発なL1細胞環境を回避する方向へ導くか[199]、あるいはL1機構の捕捉に対する耐性を向上させることで導くことができる[102]。
あらゆる技術は諸刃の剣であり、mRNA治療薬も例外ではない。この複雑なCOVID-19の危機において、制御手段、手順、治療法、予防法、ワクチン技術のすべての長所と短所を継続的にオープンに議論し、多くの角度から慎重に評価することが不可欠である[200].この方向で強力な例は、最近発表された論文で、バランスのとれた方法で、COVID-19パンデミック対策と実践が、ヒト全体のマイクロバイオーム[201]、新生児マイクロバイオーム[202]、および免疫[203]に対して、ほとんど無視されている負の側面を論じたものである。ここで紹介したmRNAワクチンとL1要素の相互作用の可能性についても、例えば[204]のように、幅広い分野の研究者の議論を喚起し、注目を集めることを期待する。
現在のワクチンmRNAがゲノムに組み込まれるかどうか、またその頻度はどうなのかは、最終的には実験によって証明されなければならない。しかし、L1レトロエレメントの逆接生物学とワクチンmRNAの逆接の可能性との理論的関連性を、mRNAワクチン学分野がなぜ、どのように無視したのか、特にL1[44,45,60,83,84,85,117,131]と逆接研究[36,37,38,39,40,41,45,46,49,60,66,68,77,80]の量と知名度と重要性を考慮すると、不可解さが残る。mRNAワクチン学分野は30年以上前に発展を始め[11,31]、ヒトのL1レトロエレメントは40年以上研究されているが[205,206]、明らかにこの二つの分野間のクロストークはない。このような厄介なサイロ効果は、時として、アマチュア化、グローバル化、前例のない普及にもかかわらず、現代科学の構造的な欠点が、私たちが認めようとする以上に深いという事実を指摘するものである。残念ながら、これらのことは、L1-driven retropositionがmRNAワクチン学において一種のタブーだろうかのような印象を与えている。
私は、mRNAベースの治療薬はゲノムに影響を与えないという広く繰り返される声明は、起源が不明確な根拠のない仮定であると結論付けている。このことは、ゲノム統合に特化した研究を欠く現在のmRNAワクチンの評価では、ゲノム統合の安全性を宣言するには不十分であることを意味している。mRNAは、原理的にあらゆる情報をコード化できる情報伝達分子であることを忘れてはならない[207]。この観点から、mRNAワクチン接種は、一種の「分子タトゥー」と見なすことができる。したがって、すでにワクチン接種を受けた人やその子孫の体細胞ゲノムや生殖細胞ゲノムに、ワクチンmRNAが組み込まれる可能性があることを、明確かつ独立して追跡できるように、製品情報文書[208,209]を含め、mRNAワクチンの正確な塩基配列を開示し、容易に一般公開することが重要である。
ファンディング
本研究は、プロジェクトIP-2016-06-5924の下、クロアチア科学財団、アドリス財団、欧州地域開発基金(KK.01.1.01.0009 DATACROSS)から一部支援を受けている。
利益相反行為について
著者は利益相反がないことを宣言している。
フットノーツ
出版社からのコメント:MDPIは、出版された地図や機関名における管轄権の主張に関して中立を保つ。