Molecular Mechanisms Lead to Sex-Specific COVID-19 Prognosis and Targeted Therapies
オンラインで公開2020年12月8日
www.ncbi.nlm.nih.gov/pmc/articles/PMC7753152/
要旨
臨床研究や疫学研究では、男性性がCOVID-19の臨床転帰や死亡率の重要な危険因子であることが明らかになっている。このことは、コロナウイルス疾患2019(COVID-19)患者の予後、臨床管理、治療において、この危険因子にどのように対処できるかという問題を提起している。現在のところ、特に重症の疾患呈示において、性特異的なCOVID-19の予後の経過を変化させるのに役立つガイドラインやプロトコルは存在しない。これは、重症急性呼吸器症候群コロナウイルス-2(SARS-CoV-2)感染に対する男性 vs. 女性宿主応答の違いを特徴づける研究の欠如、および関与する分子機構の十分な理解の欠如が原因の一つである。
ここでは、COVID-19の予後に重要な役割を果たしている可能性の高い、男性と女性の3つの異なるが相互に関連した分子レベルの違いについて議論する。我々は、SARS-CoV-2と宿主細胞アンジオテンシン変換酵素2(ACE2)との相互作用を、男性と女性の間のウイルス侵入における相互作用を検討し、両性間のレニン-アンジオテンシン系(RAS)の差異制御について議論する。
次に、免疫応答の格差、および免疫機能と内分泌調節がどのように男性を重症COVID-19に対してますます脆弱にしているかを提示する。我々は、SARS-CoV-2感染に対する男性と女性におけるこれら3つの調節系の相互に関連した役割を説明する。
最後に、これらのメカニズムがCOVID-19患者に及ぼす臨床的影響を明らかにし、重症化した患者のCOVID-19重症化を軽減するための標的治療法を提案する。
キーワード
SARS-CoV-2,コロナウイルス、男性、性別、ACE2,免疫、内分泌、アンドロゲン
序論
重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)感染症は、患者の間で様々な臨床転帰を引き出す。コロナウイルス疾患2019(COVID-19)のパンデミックが展開されるにつれて、疾患関連の危険因子の理解が深まってきている。例えば、重症COVID-19の主要な危険因子は、高齢、慢性呼吸器疾患、心血管疾患、糖尿病、高血圧を含む併存疾患である(1-4)。さらに、COVID-19の症例および死亡率を性別に層別化した複数の研究では、重症および致死的な症例では男性と女性の間に性差があることが実証されている(2,5-9)。最近では、COVID-19の臨床研究のシステマティックレビューにより、男性性がCOVID-19の予後不良と死亡率の上昇の実質的な危険因子であることが明らかになってきた(10-12)。
また、喫煙やたばこの使用などの社会的危険因子が男性のCOVID-19の重症化を促進する可能性があることも指摘されている(13-16)。我々は性別COVID-19の臨床転帰を調査したところ、地域や国に関係なく、世界中で男性の性が明確な危険因子であることが観察された(10)。コロナウイルス疾患の重症度には社会的要因が関与している可能性があるが、男性が重症のCOVID-19にかかりやすくなる性特異的な分子機序の違いがある可能性は否定できないという証拠が出てきた。男性と女性の間には、固有の性特異的な違いがある。これらの違いは、観察された性特異的なCOVID-19の臨床転帰をより包括的に説明してくれるかもしれない。例えば、分子レベルでは、男性と女性では、免疫応答および内分泌機能の調節の点で、様々な感染症に対して異なる反応を示す(17-21)。しかし、分子レベルでのSARS-CoV-2に対する性差はまだ明確に定義されていない。
我々のレビューでは、男性の重篤なCOVID-19病を引き起こす可能性の高い、男性と女性の分子レベルの違いを3つのカテゴリーに分けて検討している。これらには、(1)アンジオテンシン変換酵素2(ACE2)とSARS-CoV-2の分子的相互作用とレニン-アンジオテンシン系(RAS)内でのその調節、(2)病原体に対する免疫応答における性関連内分泌系の違い、(3)ACE2とRASの調節に対するエストロゲンとアンドロゲンの影響が含まれる(図1)。重要なことは、COVID-19の重症度におけるこれらの特に特異的な性差をよりよく理解することで、生命を脅かす疾患を回避するための臨床医による標的治療の使用につながる可能性があるということである。
図1 男性と女性でのCOVID-19 重症度の違い
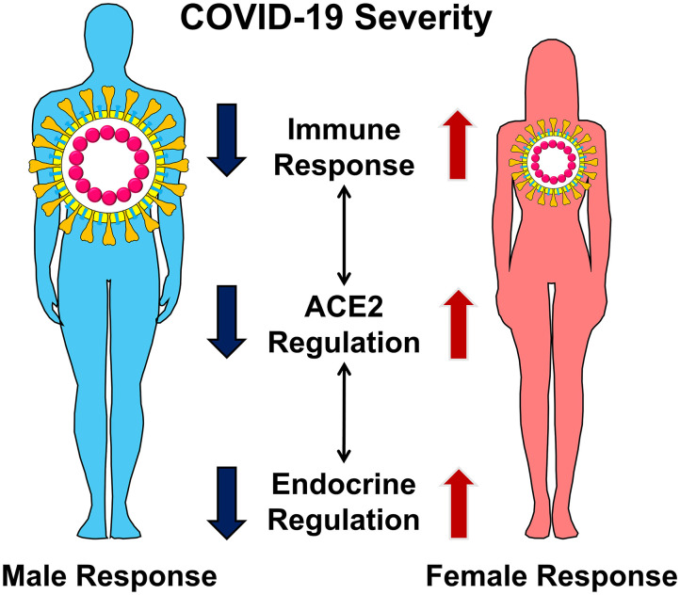
疾患の重症度の違いは、ACE2の調節、免疫応答、内分泌調節における性差によって説明できる。これらの異なるが相互に関連した分子メカニズムが、男性の重症COVID-19につながる。
ACE2はウイルス細胞侵入のための機能的受容体として作用する
ACE2はアンジオテンシン変換酵素(ACE)のホモログであり、アンジオテンシンI(Ang-I)とアンジオテンシンII(Ang-II)の両方を切断することでRASを調節するように作用する(22,23)。COVID-19パンデミックにより、SARS-CoV-2の発症におけるACE2の役割は、特にRASとの関連性とその臨床的意味合いのために、広く関心を集めている(24)。SARS-CoV-2は 2002-2003年に発生したSARS-CoV-1と高いアミノ酸配列の相同性を有している。SARS-CoV-1は、ウイルススパイク(S)タンパク質を宿主ACE2受容体へのリガンドとして用いて宿主細胞に侵入する(25-27)。
同様に、ACE2はSARS-CoV-2の機能的な宿主受容体であり、呼吸器管の上皮への侵入ポイントとして作用する(28)。SARS-CoV-2のSタンパク質はACE2と結合し、宿主セリンプロテアーゼTMPRSS2を用いてSプライミング、融合、および侵入を行う。SARS-CoV-2のACE2受容体への結合は、SARS-CoV-1よりも10~20倍高い結合親和性で起こると報告されており、より病原性が高く、感染性が高い(28-30)。このように、ACE2発現の増加は、ウイルス細胞の侵入プロセスを促進する可能性がある。
SARS-CoV-2でのACE2の内部化は、細胞表面のACE2受容体量の減少をもたらし、これがデリケートなRASのバランスに影響を与える(31)。ACE2とRASは血圧調節や電解質の恒常性維持に不可欠である(32)。このような関係から、臨床医は患者を管理する際にアンジオテンシン受容体拮抗薬(ARB)やACE阻害薬のようなRAS系調節薬の使用を懸念するようになった(33, 34)。COVID-19パンデミックの中でのこれらの高血圧メディエーターの安全な使用は、現在活発な研究が行われている分野である(35)。
男性と女性では異なるCOVID-19のアウトカムにつながるACE2の発現量が異なる
アンドロゲンはアンジオテンシノーゲンの発現を促進し、レニンの血漿活性を増加させることでRASに役割を果たしている(36)。一方、エストロゲンはAT1R、ACEの発現を低下させ、レニンの血漿活性を低下させる(37)。ACE活性の調節に加えて、エストロゲンはACE2,AT2R、ミトコンドリア集合体受容体(Mas R)の発現をアップレギュレートする(19)。これは、アンドロゲンとエストロゲンによるRASの調節における決定的な違いである。アンドロゲンによるACE2およびAT1R軸の活性化は、炎症、高血圧、血管収縮、線維化および細胞増殖をもたらす(38,39)。一方、エストロゲンによる代替アンジオテンシン(1-7)[Ang-(1-7)]、AT2R、およびMas R軸の活性化は、抗炎症、低血圧、血管拡張、およびアポトーシスを含む保護効果をもたらす(40,41)。COVID-19患者のAng-IIレベルは、ウイルス負荷および肺損傷と強く関連している。COVID-19患者の血漿中のAng-IIのサンプルは、かなりの上昇を示し、ウイルス負荷および肺損傷と関連していた(42)。臨床的に上昇したAng-IIは、副腎を刺激し、その後血圧を上昇させ、有害な生理学的効果をもたらす可能性がある。SARS-CoV-2は、ウイルス細胞の侵入にACE2受容体を使用し、それによって細胞表面のACE2をダウンレギュレートする(28)。ACE2のダウンレギュレーションは、Ang-IIのAng-(1-7)への変換を減少させ、これは、AT1Rの活性の増加につながる可能性があり、その下流の効果をもたらす。
RASの制御は、動物モデルにおいて、雄と雌で異なることが実証されている。例えば、ある研究では、雄ラットは、より高いアンジオテンシンII受容体タイプ2(AT2R)およびAng-(1-7)を有する雌ラットとは対照的に、より高いAng-IIおよびアンジオテンシンII受容体タイプ1(AT1R)を発現していた(43)。さらに、卵巣摘出は雄マウスでは酵素機能を低下させ、卵巣摘出は雌マウスでは肥大とACE2を増加させた。若い成体ラット(生後3ヶ月)では、高齢ラット(生後24ヶ月)と比較して、それぞれACE2の発現が高かった(44)。これらの観察は、SARS-CoV-2に感染した患者の肺組織で観察されたACE2受容体のレベルの逆説的な減少を説明するのに役立つかもしれない。興味深いことに、SARS-CoV-1に感染した患者ではACE2の発現が低下しているという観察結果は、SARSにつながるメカニズムを示唆している可能性がある(45-47)。これらの結果は、エストロゲンおよびアンドロゲンがRASの調節に不可欠な役割を果たしていることをさらに支持するものである。
男性はACEとACE2をより多く発現しているため、SARS-CoV-2がACE2に結合し、それに続く内在化により、この重要な血圧低下メカニズムが除去されている(48)。ACE/ACE2 のバランスは女性では ACE2 に向かっており、この相対的な発現の違いが血圧を下げることによる保護を伝えている可能性がある(49)。ACE2のこれらの性差は、COVID-19関連の感染症、罹患率、死亡率で観察される性差に寄与している可能性が高い(48, 49)。女性特有の免疫応答とACE2調節もまた、免疫機能と血圧の恒常性の両方を維持するために協働している(50)。
免疫応答の性差が疾患予後の違いにつながる
男性はウイルス、細菌、真菌、寄生虫感染症にかかりやすく、女性は自己免疫疾患にかかりやすい(18, 51-54)。また、女性はワクチン接種に反応して優れた免疫を獲得している(52,55,56)。SARS-Cov-2感染に対する性差に基づく脆弱性とCOVID-19疾患の重症度は、女性の方が自然免疫と適応免疫が強く、サイトカイン放出と炎症反応の性差に関連している可能性が高い(48)。細胞性免疫応答と炎症における性差は、X染色体にコードされた遺伝子と関連しており、後にはエストロゲンとアンドロゲンの免疫機能への影響の違いと関連している(18, 54, 56)。X染色体とY染色体の両方に見られるいくつかの遺伝子と性ホルモンは、造血器の骨髄系とリンパ系の血統プロファイル、その後の細胞発生と表面タンパク質発現、サイトカイン産生を指示する(18, 54, 56)。女性では、CD4+細胞数が多く、CD4+/CD8+比が高く、細胞障害性TおよびTサプレッサー細胞の活性が高く、数も多い(18)。SARS-CoV-2では、T細胞が多い女性の適応免疫応答がより抑制されていることが、男性に比べて女性の死亡率が低いことに表れている(6, 8, 9)。
免疫細胞の機能や免疫細胞のタンパク質発現に影響を与えるいくつかの遺伝子は、X染色体上に位置している(51, 54)。これらのXリンク遺伝子は、自然免疫細胞と適応免疫細胞の両方において、TLR-7やTLR-8のようなパターン認識受容体、CD132,CD40の発現を制御し、NF-κB転写因子の調節因子を制御している(51, 54)。X染色体はまた、免疫機能の調節に関与する多数のマイクロRNA(miRNA)とアンドロゲン受容体(AR)の遺伝子(Xq12の位置)を含んでいる(54)。ARの男性特有の機能に加えて、抗体産生の調節やセリンプロテアーゼTMPRSS2の転写にも重要である(57)。したがって、ARはSARS-CoV-2ウイルスの細胞侵入において重要な役割を果たしており、TMPRSS2は細胞侵入前のSタンパク質のプライミングに必要とされる(28)。ARのレベルが女性よりも高い男性は、COVID-19感受性のレベルが高くなる可能性がある。
男性および女性における免疫応答の内分泌制御
一般に、エストロゲンは免疫系を活性化するように作用し、アンドロゲンは免疫機能を抑制するように作用する(54)。エストロゲン受容体(ERαおよびERβ)は造血前駆細胞上に存在し、分化リンパ球(T細胞およびB細胞)およびミエロイド細胞(マスト細胞、マクロファージ、樹状細胞、ナチュラルキラー細胞)において特異的な発現を示す(56,58)。エストロゲンが免疫系によって侵入された組織の受容体に結合することで、血小板凝集および凝固カスケードを開始する引き金となりうる酸化的およびアポトーシス的な損傷を減少させることも可能である(53)。女性はより高い骨髄貪食活性を示し、骨髄細胞抗原提示は男性よりも優れている(18)。エストロゲンは、CD4+およびCD8+ T細胞と骨髄系細胞株の両方の機能を調節する。エストロゲンは、TH1プロ炎症性サイトカイン(IL-12,TNF-α、IFN-γ)の発現および放出を増加させ、TH2抗炎症性サイトカインIL-10,IL-4およびTGF-βの放出を濃度依存的に減少させる(54,58)。エストロゲンとアンドロゲンは自然免疫細胞に結合し、それぞれ活性化効果と抑制効果をもたらす(53, 54)。自然免疫の分析では、女性の樹状細胞はウイルス感染に対してより反応性が高く、INF-αの産生の増加を示すことが示されている(51,54)。樹状細胞機能におけるこの女性に関連した差異は、エストロゲンによる抗原認識Toll様受容体7(TLR7)の調節の影響を受けている。これらの性差の多くは閉経後も維持され、思春期前に見られることから、ホルモン受容体の活性化とは無関係にX染色体遺伝子発現が果たす重要な役割を示唆している[54]。この調節は、免疫応答と性特有の疾患転帰につながる内分泌調節の相互に関連した役割を浮き彫りにしている(43,52,59)。
COVID-19の重症度を調節する性特異的分子機構
RAS機能、免疫応答、および内分泌調節は、SARS-CoV-2への応答において相互に関連している(図2)。ACE2は、COVID-19の重症度における観察された性差において中心的な役割を果たしている。ACE2は、ウイルス細胞の侵入のための受容体であり、TMPRSS2は、ウイルス細胞の侵入が起こる前に、ウイルスSタンパク質のプライミングに不可欠である。TMPRSS2の転写は、X染色体(Xq12)上に位置するARの制御下にある。SARS-CoV-2の侵入により、ACE2はダウンレギュレートされ、Ang-IIの作用が増加する。これにより、炎症、線維化、急性肺障害が大きくなり、重度のCOVID-19を引き起こす(図2)。ACE2遺伝子はX染色体(Xp22.2)にも存在し、エストロゲンによって制御されている。エストロゲンはACE2のレベルを上昇させ、これはAng-IIを切断してAng-(1-7)にする。ACE2はAng-(1-7)/Mas R/AT2R軸の活性化とACE/Ang-II/AT1R軸の阻害を引き起こす。したがって、ACE2のレベルの増加は、抗炎症反応を引き起こし、線維化を減少させ、急性傷害から肺を保護する。これは、COVID-19の重症度の低い形態につながる(図2)。SARS-CoV-2感染に関与するこれらの性特異的な分子機構は、疾患の重症度を軽減するのに役立つ治療の潜在的なターゲットを提供する。
図2 COVID-19重症度の調節におけるACE2受容体の役割
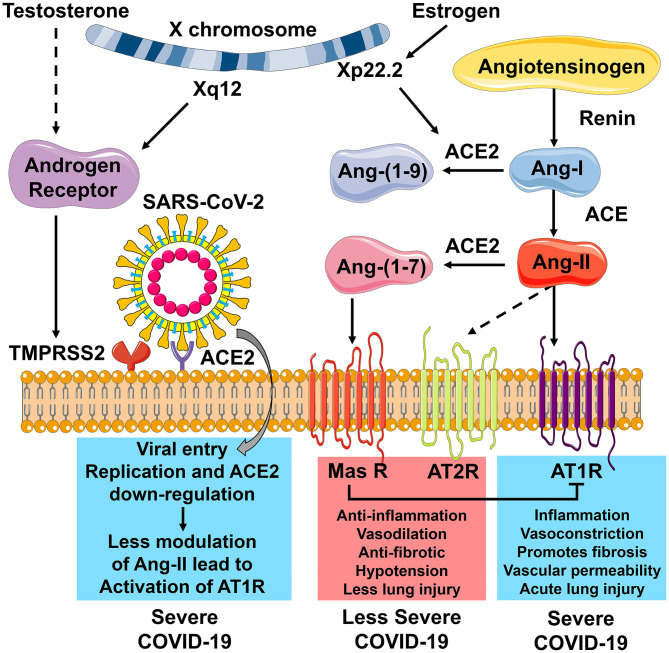
アンジオテンシン変換酵素2(ACE2)は、COVID-19重症度における観察された性特異的格差において中心的な役割を果たしている。ACE2は、ウイルス細胞侵入のための受容体である。膜貫通型プロテアーゼであるセリン2(TMPRSS2)は、ウイルス細胞の侵入を可能にするためのウイルスSタンパク質のプライミングに必要である。
TMPRSS2の転写は、X染色体(Xq12)上に位置するアンドロゲン受容体(AR)の制御下にある。SARS-CoV-2が宿主細胞に侵入すると、ACE2はダウンレギュレートされる。ACE2が存在しない場合、アンジオテンシン-II(Ang-II)が切断されてアンジオテンシン-(1-7) [Ang-(1-7)]を生成することができず、Ang-IIの作用が亢進する。Ang-IIによるアンジオテンシン1型受容体(AT1R)の活性化は、より多くの炎症、血管収縮、線維化、血管透過性、および急性肺障害をもたらし、重度のCOVID-19をもたらす。ACE2遺伝子はX染色体(Xp22.2)上に位置し、エストロゲンによって制御されている。エストロゲンはACE2のレベルを上昇させ、これはAng-IIを切断してAng-(1-7)にする。Ang-(1-7)はミトコンドリア集合体受容体(Mas R)を活性化する。これにより、抗炎症、血管拡張、線維化の減少、低血圧、および肺損傷の減少を引き起こし、COVID-19の重症度の低い形態へと導く。
青色で強調表示された結果は男性との関連性が高く、赤色で強調表示された結果は女性との関連性が高い。この図は、Servier Medical Artで利用可能な画像を使用して作成したもので、Creative Commons Attribution 3.0 Unported Licenseの下でライセンスされている。
COVID-19の予後と現在の治療についての臨床的視点
COVID-19は誰でも発症する可能性があるが、男性の方が女性よりも発症率が高い傾向があり、これは臨床的に重症度がどの程度であるかに関係なく当てはまる(6, 8, 10)。COVID-19の主な症状としては、通常、発熱、咳、および息切れの組み合わせが挙げられる。しかし、頭痛、悪寒、疲労、無気力症、喉の痛み、鼻づまり、鼻漏、吐き気、下痢、および筋肉痛などの他の症状も記載されている(60)。大多数の患者では、COVID-19の症状は、自宅での回復を可能にするほど軽度である。しかし、かなりの少数の患者は、入院を必要とするほど症状が進行する。重症化した患者では、ウイルス感染に対する炎症反応が亢進し、「サイトカインストーム」とも呼ばれ、急性呼吸窮迫症候群ARDS(61)を含む、より悲惨な臨床所見を引き起こすことがある。
ウイルス自体と免疫反応の両方を標的とした様々な薬物療法が試みられてきた。最も有望なものには、レムデシビルとデキサメタゾンがある。レムデシビルは、エボラの治療のために2015年に最初に開発された抗ウイルス剤である。レムデシビルは、活性代謝物がウイルスRNA依存性RNAポリメラーゼの作用を阻害し、最終的にウイルスRNA産生の低下を引き起こすプロドラッグである。国立アレルギー・感染症研究所がスポンサーとなった適応型COVID-19臨床試験の予備的な結果では、レムデシビルを服用している患者の回復までの時間がプラセボと比較して有意に短縮され、死亡率が改善される傾向が示されている(62, 63)。炎症の抑制に有用性が期待できる合成コルチコステロイドであるデキサメタゾンは、RECOVERY試験では、人工呼吸をしている患者では3分の1,その他の酸素のみを投与している患者では5分の1の死亡を減少させたことが明らかになった(64)。上述のように、うまくいかない患者は男性で、基礎疾患を持っている傾向がある。これらの重症患者では、機械的人工呼吸の日数が平均よりも長いことが報告されている。死因は進行性の難治性肺不全であることが多いが、腎不全、心筋梗塞、血栓塞栓症などの他の臓器系にも影響を及ぼすことが明らかになっている。COVID-19を呈する男性患者は、女性患者に比べて急速に臨床症状が悪化する可能性が高いことを知っておくことは、臨床医にとって有益なことであろう。
COVID-19の潜在的標的療法としての抗アンドロゲン
COVID-19の性特異的予後の証拠が増加していることから、標的となる臨床療法の使用を検討することに新たな関心が寄せられている。男性患者における5αリダクターゼ阻害薬の使用を含む抗アンドロゲン療法が現在研究されている(65,66)。前立腺がん患者のCOVID-19感染リスクを調べた研究では、アンドロゲン遮断療法(ADT)を受けている患者では、部分的な防御効果が示された(67)。ARはTMPRSS2の転写を制御するので、これは男性患者におけるCOVID-19の重症度を低下させる標的治療の可能性がある。これは最終的に、抗アンドロゲン療法がCOVID-19の男性患者に投与されるべきかどうかという疑問を投げかけている。
いくつかの食事性化合物は、5α還元酵素阻害剤および抗アンドロゲン治療薬として働くことが証明されている。
- ウコンの有効成分であるクルクミン
- トマトに見られる赤い色素であるリコピン
- 唐辛子に見られる化学物質であるカプサイシン
これらは、ジヒドロキシテストステロンの代謝における阻害特性を介して知られているアンドロゲン阻害剤である(68-72)。これらは、前立腺疾患を予防するための予防能力のためにもよく知られている。したがって、SARS-CoV-2の発症におけるARの関与を考えると、これらの化合物は、COVID-19に対して何らかの予防的な可能性を有している可能性がある。
我々のレビューは、COVID-19患者の臨床管理における性差の重要性を強調するのに役立つように、現在の研究文献を視野に入れている。このような治療の有効性を決定するには時期尚早かもしれないが、感染症の治療および予防における医療行為が、病原体の性差を含むように進化してきたことを浮き彫りにしている。
