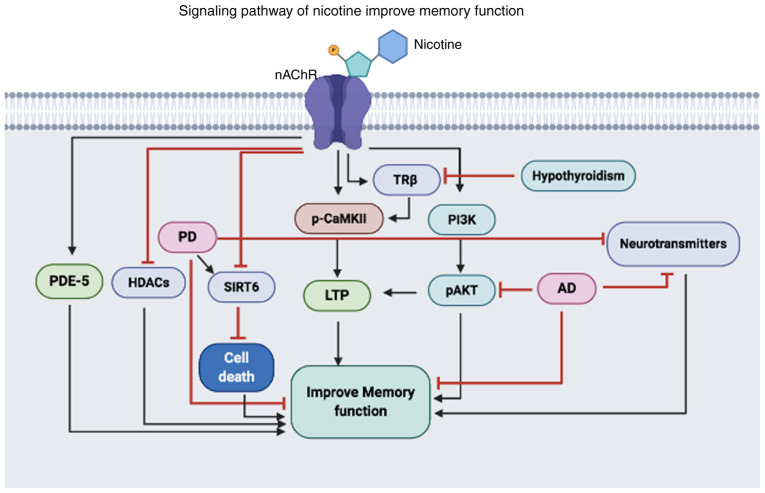
ニコチンはnAChRを活性化し、様々なタンパク質の発現や機能を活性化または抑制することができる。ニコチンはPDE-5、TRβ、CaMKIIを活性化し、これらのタンパク質の活性化により、神経細胞間のコミュニケーションが活発になり、最終的に記憶機能を改善することができる。
さらに、ニコチンは、生存を促進するPI3K/AKT経路を活性化し、LTPを増加させ、ADによる記憶機能障害を改善させる。また、ニコチンはPDで増加するHDACやSIRT6を阻害することができるため、これらのタンパク質の活性を低下させることで神経のアポトーシスを抑制し、記憶機能障害を改善することが期待される。
PDE-5, phosphodiesterase-5; HDAC, histone deacetylases; PD, Parkinson’s disease; SIRT6, Sirtuin 6; LTP, long-term potentiation; p-, phosphorylated; CAMKII, calmodulin-dependent protein kinase II; TRβ, thyroid receptor subunit β; PI3K, phosphoinositide 3-kinase; AD, Alzheimer’s disease; nAChR, nicotinic cholinergic receptors.「ニコチン受容体」とは、ニコチンが神経細胞のアポトーシスを抑制し、記憶機能障害を改善することを意味する。
2.アルツハイマー型認知症(AD)におけるニコチンの有用性
ADは、主に高齢者が罹患し、認知症を引き起こす神経変性疾患である(27)。ADは、脳内に毒性のあるアミロイドβ(Aβ)およびタウタンパク質が沈着することが特徴である,29)。
特に、Aβの蓄積はミトコンドリア機能を阻害し、活性酸素の生成の増加や炎症プロセスの刺激につながることが実証されている(30)。実際、いくつかの研究により、Aβの沈着が脳の生理機能を変化させ、神経細胞の機能障害を引き起こすことが明らかにされている,32)。
残念ながら、ADの治療法はまだなく、現在は抗酸化剤やコリンエステラーゼ阻害剤などの薬剤の投与により進行を遅らせることで病気を管理している(33)。
*
コリン作動性仮説によれば、ADにおける認知機能の低下は、アセチルコリンの喪失による中枢性コリン作動性神経伝達の欠損から生じるとされている(34)。
したがって、アセチルコリンの分解を阻害するコリンエステラーゼ阻害剤(ドネペジルやガランタミンなど)は、ADにおける中枢性コリン作動性機能の回復のための第一選択薬であり続けている。さらに、ADでは海馬におけるα7 nAChRの発現と密度の変化が観察されており、認知機能に最も影響を及ぼすと考えられている(35)。
また、このようなα7 nAChRは、ADのプラークと共局在していることが分かっている(36)。したがって、ニコチンを含むα7 nAChRのアゴニストは、ADの治療に有用である可能性がある。
*
また、ニコチンによるnAChRの刺激は、シナプス可塑性や記憶の重要な制御因子であるプロテインキナーゼなどの下流シグナル伝達分子にも影響を与えると考えられる(37)。
特に、プロテインキナーゼB(Aktとも呼ばれる)は、phosphoinositide 3-kinase (PI3K) /Aktシグナル伝達経路の中心分子であり、神経細胞の生存,44)など中枢神経系の調節機能において重要な役割を担っている。
したがって、ニコチンまたはそのアナログによるnAChRの刺激は、PI3K/Aktシグナル伝達経路を活性化し、その結果、学習および記憶過程を調節していると仮定される(45)。実際、ニコチンの急性および慢性投与は、AD患者の認知機能障害を改善することが報告されている(46-48)。
さらに、コリンエステラーゼ阻害剤を投与されたアルツハイマー病患者において、脳波測定中に急性ニコチン投与を行うと、脳波測定値が正常値に移行することが判明した(49)。このように、ニコチン投与はADで観察される認知機能低下に対して有益な効果をもたらす可能性がある。
3.パーキンソン病(PD)におけるニコチンの有用性
PDは、高齢者が罹患する神経変性疾患の中で、ADに次いで多い疾患である(50)。PDの正確な原因はまだ十分に解明されていないが、その病態には、中脳の黒質にあるドーパミン作動性ニューロン(ドーパミン産生ニューロン)の損失または変性が関与している(51)。
このドーパミン神経細胞の消失により、運動制御障害、振戦、硬直・徐脈、認知機能障害などが引き起こされる,53)。PDの動物モデルにおける研究により、ニコチンが脳細胞を損傷から保護することが明らかにされている,55)。
また、タバコを吸うとPDの発症リスクが低下することが報告されており(53)、ニコチンはジスキネジアや記憶障害などPDのいくつかの症状の改善に役立つと考えられている生体内試験で検討されており、主にドーパミン作動性ニューロンに対する生存促進効果によるものと仮定されている(56)。
*
ニコチンは、前述のPI3K/Akt経路などの脳内の生存促進シグナル伝達経路を活性化することに加え、NAD+依存性クラスIII脱アセチル化酵素であるサーチュイン6(SIRT6)を阻害することによってもPDの進行を遅らせることができると考えられる(57)。
このSIRT6の抑制は、アポトーシスを減少させ、ニューロンの生存を増加させることが判明した(57)。また、SIRT6を過剰発現させると、文脈的恐怖記憶の形成が阻害されることも報告されている,59)。
にもかかわらず、別の研究では、脳内のSIRT6の喪失も記憶障害を引き起こすことがわかった(60)。したがって、PDにおけるニコチンのSIRT6に対する下流効果については、さらなる調査が必要である。
4.甲状腺疾患患者におけるニコチンの記憶プロセスへの効果
サイロキシン(T4)やトリヨードサイロニン(T3)などの甲状腺ホルモン(61)が、脳の発達、神経発生、シナプス形成、髄鞘形成を制御していることが研究により明らかにされている,65)、血液中に放出され、最終的にはαとβの2つの異なるアイソフォームで存在する甲状腺ホルモン受容体(TR)と呼ばれる核内受容体に結合してその作用を発揮する(66)。これらのアイソフォームの発現量は組織によって異なる。α1受容体は主に心臓と骨格筋に発現し(68)。
*
また、TRは記憶形成を担う脳の海馬に多く発現している(63)。したがって、甲状腺機能亢進症、甲状腺機能低下症、クレチン病など、甲状腺ホルモン値に異常がある病気では,70)、海馬の機能が影響を受け、その結果認知障害が起こる可能性がある(71)。
実際、神経画像研究により、甲状腺機能低下症の患者では海馬の構造と機能が変化していることが証明されている(72-74)。
*
特に、ニコチンの急性投与は、TR(甲状腺ホルモン受容体)(特に脳内のTRβ)を活性化することが報告されており、その結果、特定の個体において学習および記憶のプロセスを促進する可能性がある(66)。
さらに、マウスのTRβノックアウトは、ニコチン投与後の記憶機能に影響を与えず、記憶プロセスにおけるTRβの役割を確認した(75)。
さらに、甲状腺機能低下症による記憶障害は、ニコチンによって、カルモジュリン依存性プロテインキナーゼII(CaMKII)の機能を調節し、シナプス可塑性を改善するカルシニューリンの調節を介して改善することが明らかにされた(76)。しかし、甲状腺疾患患者の認知機能障害を改善するニコチン投与の正確な基礎メカニズムは、さらなる調査が必要である。
5.健常者の認知機能に対するニコチンの影響
ニコチン投与が、健常者における記憶を改善する可能性があることを示す証拠が次々と得られている。例えば、睡眠不足は、細胞増殖とシナプス可塑性の必須調節因子であるCaMKIIのリン酸化をダウンレギュレートすることにより、記憶障害を引き起こすことが研究により明らかにされた(77-79)。
CaMKIIは、正常な脳機能と記憶形成に必要なグルタミン酸受容体サブユニット-1の発現とそのシナプス表面への輸送を制御することが以前に明らかにされている(80)。
また、ニコチンの急性投与は、CaMKIIのリン酸化を促進することにより、睡眠不足による記憶障害を改善することが見出された(81)。したがって、ニコチンは健康な人の睡眠不足によって引き起こされる記憶障害を改善する可能性がある。
6.ニコチンによるクロマチン修飾は記憶と学習を改善する可能性がある
ニコチンが細胞核のクロマチンに影響を与えるという研究もある(82-84)。クロマチンはヒストンと呼ばれる4つのサブユニットで構成されており、アセチル化、メチル化、リン酸化などの修飾を受ける(87)。
特に、ヒストンアセチルトランスフェラーゼとヒストンデアセチラーゼ(HDAC)は、記憶やシナプス可塑性など様々な細胞機能に関わるクロマチン修飾に必須の役割を担っている(89)。
例えば、HDACを阻害すると、cAMP応答要素結合タンパク質(CREB)-CREB結合タンパク質転写複合体によって制御されている記憶プロセスに関わる主要遺伝子の発現を増加させることができる(89)。
特に、HDAC4は学習および記憶のプロセスに重要であることが実証されている,90)。タバコは、肺においてHDAC6などのHDACの機能を変化させることでクロマチンの制御を調節することが報告されているように(83)、中枢神経系においても同様の影響を及ぼすと考えられる。
実際、ニコチンが脳内のHDACを阻害することで、記憶機能を改善することが明らかにされている(84)。しかし、クロマチン調節を介したニコチンの認知機能への影響については、さらなる研究が必要である。
7.ニコチンの電気生理学的効果シナプスの強化
脳内の神経細胞は相互に結合してネットワークを形成し、機能別に組織化されている(91)。したがって、これらの結合を理解することで、特定の領域を刺激して記録し、脳の特定の領域における神経伝達物質の放出や受容体の反応をモニターすることができる。長期増強(LTP)は、シナプス可塑性の測定に用いられ、学習や記憶の符号化の細胞モデルを提供することができる。
例えば、シナプス前細胞からシナプス後細胞に放出されるグルタミン酸のレベルが増加すると、空間学習課題中に海馬の興奮性シナプス後電位が増強されることが見出された(92)。
これまでに、急性ニコチン曝露が睡眠不足の人のLTPを回復させることが研究により報告されている(81)。さらに、ニコチンの慢性投与は、AD、慢性ストレスモデル、甲状腺機能低下症モデルにおいてLTPを改善することが明らかにされている,94)。
また、ニコチン曝露によるLTPの回復は、CREBやCaMKIVなどの必須キナーゼのリン酸化の正常化に関係していることを示す証拠も増えている(95)。したがって、ニコチン投与は、2つのニューロン間のシナプスを強化し、健常者、ADや甲状腺機能低下症などの疾患のいずれにおいても、記憶の改善につながると考えられる。
8.結論
今回の総説に含まれる研究で報告された知見は、ニコチンが記憶機能を刺激することを示している。したがって、ニコチンは依存や乱用を誘発する点では他の精神活性物質と同様であるが、健康な人の認知機能を高め、AD、PD、甲状腺機能低下症などの疾患を持つ患者の記憶機能を回復させるなど、一定の有益な効果も有していることが示された。