Contents
Modulating Effect of Diet on Alzheimer’s Disease
要旨
平均寿命の延伸に伴い、アルツハイマー病などの神経変性疾患が増加している。この疾患の特徴は、高リン酸化タウタンパク質による細胞内神経原線維のもつれの蓄積、βアミロイドペプチド(アミロイドβ)の細胞外沈着物からなる老人斑、神経細胞の喪失である。
これには、ミトコンドリア機能の低下、酸化ストレスの増加、炎症反応の変化、オートファジープロセスの障害が伴う。本研究では、特定の栄養素がアミロイドβ産生とタウ処理の両方に直接的な影響を与え、オートファジー活性化によるそれらの排泄に影響を与えることを示す科学的証拠を収集した。
同様に、特定の栄養素は、炎症反応および疾患に関連する酸化ストレスを調節することができる。しかし、これらの効果がどの程度まで臨床的に有益な結果をもたらすのかは明らかになっていない。それでも、いくつかの研究では、これらの化合物の多くが豊富に含まれていることから、アルツハイマー病に対する地中海式食事の利点が示されており、これらの化合物が前述のプロセスに示すプリーオトロピック効果による神経保護特性に起因することができる。
以上のことから、アルツハイマー病患者や発症リスクのある患者の臨床管理のために、適切な食生活を推奨することが重要であることが改めて強調された。
キーワード
アルツハイマー病、栄養素、地中海料理、酸化ストレス、炎症、オートファジー、βアミロイド、タウ
1. はじめに
アルツハイマー病などの神経変性疾患における食事の可能性のある効果についての科学的証拠の蓄積は、このレビューは、どの栄養素が病理学に有益または有害な役割を持っている可能性があるを決定するために動機づけられている。
食事の推奨は、アルツハイマー病の治療にはほど遠いが、それは患者が表示される症状のいくつかを軽減したり、彼らが苦しむ認知と身体的な衰えを遅らせることができる可能性がある。地中海式の食事は、好ましいことが証明されている複数の栄養素が含まれており、これらの食事の要件に高いアドヒアランスは、アルツハイマー病または軽度の認知機能障害を開発するリスクを減少させる[1,2]。すなわち、保護効果は、オリーブオイル、ワイン、野菜、果物、ビタミン、ポリフェノールなどの抗酸化機能を持ついくつかの物質にリンクされており、酸化ストレスや炎症を減少させることができる[2,3]。
我々は、食事はアミロイドβ産生、タウの蓄積と排泄に影響を与え、酸化ストレスと炎症を調節するため、アルツハイマー病において食事が重要な役割を果たしていることを提案している。したがって、アルツハイマー病患者とアルツハイマー病発症のリスクのある集団の両方に食事療法の介入が必要である。
この側面をレビューするために、我々は、食事がアルツハイマー病にどのように影響を与えるか、および病理に関与するプロセスのモジュレーターとしての特定の栄養素の可能性のある効果に関する利用可能な証拠を収集することを目的としている。我々は、これらの患者のための適切な食事の一例として地中海式食事の利点を評価し、それらの患者における栄養介入の関連性を評価した。さらに、食事療法によって変化する可能性のある疾患の側面と、それらの側面に調節効果を有する可能性のある栄養素の見直しを行った。
2. アルツハイマー病
2.1. 疾患の説明
アルツハイマー病は、認知症の大部分を占める神経変性疾患であり、世界中で3,500万人以上の人々に影響を与えている[3]。一般的には65歳以上の患者さんに発症することが多く、高齢者に多く見られることを説明している[4]。加齢に関連した病態の発現がますます頻繁になる高齢化が進む中では [5]、アルツハイマー病の有病率と発生率の上昇が予想され、2050年までにこれらのデータを最大で3倍に拡大することを示唆する研究もある [3]。
より通常の臨床的特徴のいくつかは、認知障害、記憶喪失、言語障害、気分や行動の突然の変化、および時間と空間の見当識障害を含み、患者が通常の日常活動を行う能力を妨げている[6,7]。典型的には約10~12年持続するが、個人差が顕著である [8]。
アルツハイマー病はその発症に応じて2つのタイプに分類される。家族性アルツハイマー病(家族性アルツハイマー病)と散発性アルツハイマー病(Sアルツハイマー病)である。家族性アルツハイマー病は40~60歳の間に発症し(早期発症型)常染色体優性遺伝のパターンをたどる。有病率は低く、症例の5%程度である。プレセニリン1およびプレセニリン2をコードする遺伝子(PS1およびPS2)の突然変異が、アミロイド生成経路を担うβ-およびγ-セクレターゼによるアミロイド前駆体タンパク質(APP)の処理亢進をもたらすことに関連している[9,10]、またはAPPをコードする遺伝子自体に関連している[11]。
この疾患の散発型は後期発症型アルツハイマー病としても知られており、65歳以降に発症する。遺伝的形質と環境因子が関与しており、多因子性の起源がある。後者はライフスタイル、食生活、社会経済的地位、教育レベル、または肥満や糖尿病などの併存疾患の存在を含むかもしれないが [7,12]、前者は、疾患の特定のメカニズムからの保護を与えるか、または疾患を発症するリスクを増加させる可能性があるいくつかの遺伝的因子を指す。非常によく知られており、広範囲に研究されている例としては、晩発型アルツハイマー病の最も一般的な遺伝的危険因子[14]を構成するアポリポ蛋白Eε4(APOEε4)対立遺伝子[13]が挙げられる。この対立遺伝子の存在が脳内のより高いアミロイドβ濃度に関連しているという事実によって指摘されているように、この対立遺伝子はアミロイドβの消去に寄与している[15]。また、この対立遺伝子を持つ患者は、非ApoEε4キャリアであった患者からのものよりも酸化された血漿を示すと、酸化ストレスにリンクされている。これは、それがシステイン残基を含まないので、この対立遺伝子によってコードされたタンパク質の構造の結果であろう、したがって、通常、抗酸化物質として作用する遊離チオール基を欠いている[14]。
アルツハイマー病で観察される神経変性過程は、主に神経原線維のもつれ、老人性プラーク、および神経細胞の損傷と喪失から構成され、通常、患者の脳には最初の症状が現れる前に存在し、敏感なニューロンにおけるミトコンドリア機能不全がアルツハイマー病の最も早く、より広範な特徴の1つであることを指摘するいくつかの証拠がある[16]。
2.2. 神経病理学的マーカー
アルツハイマー病の主な特徴は、前述したように、神経原線維性タングルや老人性プラークの存在と神経細胞の喪失により、脳の萎縮が生じることである。
神経原線維性麻痺は、異常なタウタンパク質の凝集体で構成されている[17]。正常な状態では、タウタンパク質は微小管ネットワークを安定化させるためにチューブリンと相互作用することで細胞骨格構造に寄与している[18]。しかし、タウタンパク質は転写後にトランケーションや高リン酸化などの異なる修飾を受けることがある。これらの修飾を引き起こす理由はまだ不明であるが、この高リン酸化形態は凝集しやすく、主に海馬に位置する有毒な細胞内蓄積を構成する神経原線維のもつれの形成につながるという説得力のある証拠がある[10]。さらに、タウの機能不全は微小管の崩壊による細胞骨格の不安定化を引き起こし、シナプス障害を引き起こしてコミュニケーションの喪失を引き起こし、その結果、アルツハイマー病を介した神経変性に寄与している[7]。
ミトコンドリアの輸送は微小管との相互作用に依存しているため、このプロセスはタウの高リン酸化によって妨げられ、ニューロン間の情報交換を達成するために必要とされる大量のエネルギーを考えると、シナプス前領域でのエネルギー欠損を引き起こし、シナプス障害につながる可能性がある。
老人斑は、アミロイド前駆体タンパク質(APP)の分解に由来するβ-アミロイドペプチド(アミロイドβ)の細胞外沈着物からなる。このような沈着物は炎症や神経細胞死の原因となる[17]。APPは神経細胞に存在する膜貫通型タンパク質であり、2つの異なる経路で処理される。アミロイド生成経路と非アミロイド生成経路[10]であり、どちらもセクレターゼによって媒介される。前者ではβ-およびγ-セクレターゼが、後者ではα-およびγ-セクレターゼが介在する(図1)。
図1 アミロイド前駆体タンパク質(APP)の処理経路とその異なる栄養素による変調
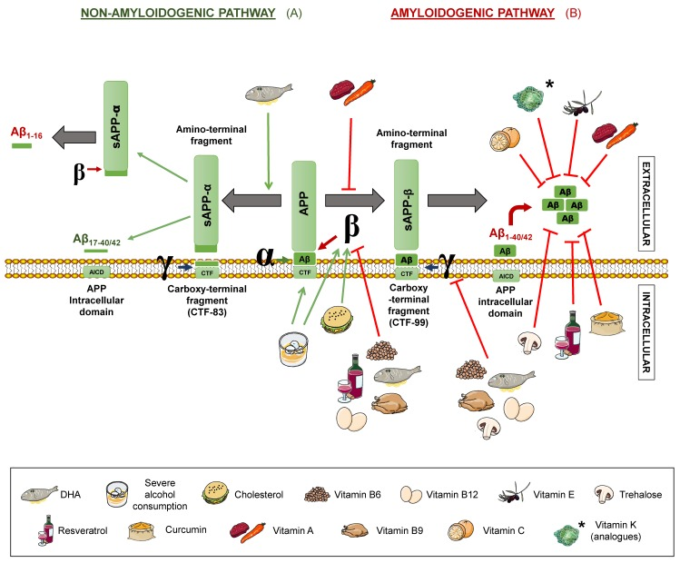
非アミロイド生成経路(A)は、α-およびγ-セクレターゼによる順次開裂(非病理的状況)またはα-およびβ-セクレターゼによる順次開裂(病理的状況)で起こり、アミロイド生成経路(B)はβ-およびγ-セクレターゼによる順次開裂(病理的状況)で起こる。アルファベットα、β、γは各セクレターゼを表す。APP:アミロイド前駆体タンパク質。 sAPPα:可溶性α-APP。APPの処理を阻害することが提案されている栄養素を凡例に示す。緑の矢印は活性化を示す。赤く切り捨てられた矢印は阻害を示す。
非アミロイド生成経路では、APPは、α-セクレターゼおよびγ-セクレターゼによって順次切断され、切り捨てられたペプチドであるアミロイドβ17-40/42を生じる。しかし、β-セクレターゼによる切断は、α-セクレターゼがα-セクレターゼの後に続くことから、代替的な短い非会合性Aβフラグメントを生成することが報告されていることは注目に値する[14,19]。その中で、切り詰められたペプチドアミロイドβ1-16は、家族性および散発性アルツハイマー病患者の脳脊髄液(脳脊髄液)中でアミロイドβ1-42の減少とともに増加していることが発見されており、疾患への寄与の可能性を示唆している[20,21](図1)。一方、アミロイド原性ルートでは、β-セクレターゼとγ-セクレターゼによる逐次切断が行われ、前述のプラークの形成に関与する全長アミロイドβペプチドが得られる。いずれのルートも、アミノ末端断片(非アミロイド原性ルートの場合はsAPPα、アミロイド原性ルートの場合はsAPPβ)およびカルボキシ末端断片(それぞれCTF83およびCTF99)をもたらす。γ-セクレターゼの作用により、APP細胞内ドメイン(AICD)が生成され、細胞内シグナル伝達に関与する。γ-セクレターゼがアミロイド生成経路で切断を行う点に応じて、全長アミロイドβペプチドの長さは異なり、脳内ではアミロイドβ1-40とアミロイドβ1-42が支配的な断片となっている[14](図1)。
さらに、最近、新規なAPP処理機構が記述されている。このようなメカニズムは、アミノ酸504と505の間のAPPがn-セクレターゼによって切断され、結果的にαまたはβセクレターゼ切断後に大きなカルボキシ末端断片が生成されることで構成されている。Aη-αおよびAη-β、それぞれである。特に、Aη-αはアミロイドβ1-16を含む配列であり、神経毒性があることが証明されている[22]。
2.3. 酸化ストレス
アミロイドβおよびタウの両方の蓄積は、ミトコンドリア機能を妨害することができる。例えば、両タンパク質と電圧依存性アニオンチャネル1(VDAC1)との相互作用は、ミトコンドリアの機能不全および酸化ストレスの増加をもたらす。また、それらは、以前に述べたように、呼吸鎖上の複合体を変化させることができる[16]。いずれにしても、この増強された酸化ストレスは、ミトコンドリアレベルでのAβ分解に関与するプレシークエンスプロテアーゼの不活性化につながり、Aβの蓄積をさらに促進し、その結果、ミトコンドリア機能不全および酸化ストレスを悪化させ、細胞内でアポトーシスを誘導することになる[16]。
酸化ストレスは神経変性疾患を発症する主要な危険因子の一つであり、フリーラジカルの形成を誘発し、細胞レベルだけでなく分子レベルでもダメージを与え、タンパク質、脂質、核酸に影響を与えるからである。この酸化ストレスは、活性酸素またはフリーラジカルと抗酸化物質との間の不均衡に起因しており、前者の濃度上昇または後者の濃度低下のいずれかによって引き起こされる[10]。
脂質の酸化的損傷は、その過酸化を引き起こす(図2)。このプロセスは、細胞膜のような大量の脂質を含む構造物にとって重要であり、脂質の過酸化によって透過性が大きく変化し、最終的には細胞死に至る。このプロセスは3つの段階で構成されている。開始、伝播、終了の3つのフェーズで構成されている。
図2 酸化ストレスの発生に及ぼす様々な栄養素の影響
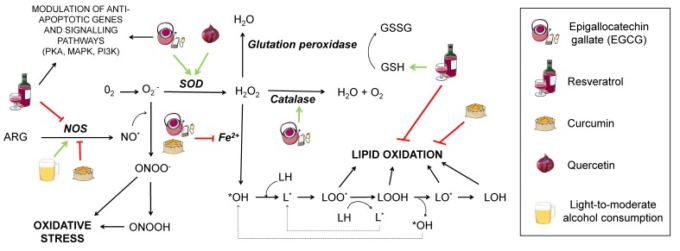
酸化ストレスに寄与するいくつかの経路が相互に関連して示されている。ARG:アルギニン。NOS:一酸化窒素合成酵素。SOD:スーパーオキシドジスムターゼ。NO*:一酸化窒素。ONOO-:ペルオキシナイトライトアニオン。ONOOH:硝酸。O2-:スーパーオキシド。H2O2:過酸化水素。GSH:還元型グルテーション。GSSG:酸化されたグルutation。*OH:ヒドロキシルラジカル。LH:脂質。LOH:脂質アルコール。L*:脂質ラジカル。LOO*:過酸化脂質ラジカル。LOOH:過酸化脂質。LO*:アルコキシル。前述の酸化ストレス経路を妨害することが提案されている栄養素は、凡例に示されている。緑の矢印は活性化を示す。赤く切り捨てられた矢印は阻害を示す。
活性化は、酸素分子、一重項酸素、またはヒドロキシルラジカルが脂肪酸を攻撃し、水素原子を引き抜き、脂質ラジカル(L*)を生じさせるときに始まる。これは、脂質ラジカルが酸素と相互作用し、別の脂肪酸と相互作用する可能性がある脂質ペルオキシラジカルを生成し、脂質過酸化物およびサイクルを繰り返すことができる別の脂質ラジカルをもたらす伝播ステップに続いている。終了は、脂質ペルオキシラジカルが他のラジカルと相互作用し、安定した種を生成するときに行われる。アルツハイマー病患者における脂質過酸化マーカーの増加がいくつかの研究でしか発見されていないので、これがアルツハイマー病にどの程度影響を与えるかについては議論がある[23]。
タンパク質に関しては、酸化的損傷は構造的および機能的変化を引き起こし、それがさらに酸化的損傷を増加させ、周期的なプロセスを確立する可能性のある異常なタンパク質につながる。アルツハイマー病では、活性酸素はタウとアミロイドβを酸化する。これらの酸化された機能的に異常なタンパク質は、ニューロンの細胞質に蓄積し、神経原線維のもつれとアミロイドβプラークを形成し、後者はROSレベルを上昇させ、酸化的損傷のサイクルに拍車をかける [24]。さらに、これらの異常なタンパク質の中には、タンパク質分解に抵抗性があり、酸化されたタンパク質を分解するプロテアーゼを阻害することができるものもある[25]。
タンパク質は生理的条件下で酸化される。その状態を適切な範囲内に保つためには、タンパク質とその修復機構の間にバランスが存在しなければならない。しかし、これらの修復機構は加齢とともにその効力を失い、その結果、損傷を受けたタンパク質がより多く蓄積されることになる [25]。
酸化ストレスによる神経細胞の死とシナプス喪失を防ぐために、神経細胞は内因性および外因性の抗酸化系の修復機構に依存している。前者にはスーパーオキシドジスムターゼ(SOD)カタラーゼ、グルタチオンペルオキシダーゼ(GSHペルオキシダーゼ)などの酵素が含まれ、一方、外因性システムは、いくつかのビタミン(A、C、およびE)ポリフェノール、および銅、亜鉛、およびセレンなどの特定の金属から構成されているが、亜鉛およびセレンは実際の抗酸化物質ではなく、いくつかの酵素がその機能を果たすために必要な補因子であることに注目すべきである[26]。SODはその活性部位にいくつかの金属原子を持っており、スーパーオキシドアニオンを過酸化水素(H2O2)に変換するのに不可欠である。GSHペルオキシダーゼは、H2O2などの酸化化合物の還元とグルタチオン酸化からグルタチオンジスルフィド(GSSG)へのグルタチオン酸化を調整するためにセレンに依存する。このように、GSHペルオキシダーゼは、そうでなければ活性酸素を形成するために代謝されるであろう脂質過酸化物またはH2O2の酸化を防ぐ。この酵素は、この抗酸化代謝物の適切なレベルを確保するために、NADPH(還元型ニコチンアミド・アデニン・ジヌクレオチドリン酸)の存在下でGSSGをGSHに戻し、GSH還元酵素と協働して作用する[27]。カタラーゼについては、コアに鉄を含み、細胞の代謝によるH2O2の水と酸素への変換を媒介している[26]。
SODとGSHペルオキシダーゼ活性はアルツハイマー病患者では低下し、その結果、脳内の酸化ストレスと酸化タンパク質の濃度が上昇し、主に後頭皮質と比較して前頭皮質で、また高齢の患者ではより大きな範囲で上昇する。最近の研究では、酸化タンパク質の濃度が最も高いのは海馬と頭頂皮質であることが示されている[28]。
酸化ストレスはミトコンドリアにも影響を与え、アミロイドβ形成に関与するβ-セクレターゼ(BACE 1)の発現を促進し、アミロイドβ42/40比を増加させるPS1の構造変化を誘導する。これらの変化は通常、アミロイドβプラークの近くに位置するニューロンで観察される[29]。ミトコンドリアの機能不全は、前述したように、アミロイドβおよびタウがVDAC1と相互作用することによって増強され得る。さらに、PS1の突然変異は、オートファジーによるミトコンドリア処理とマイトファジーによるミトコンドリアのリサイクルに影響を与える;プレセニリンはこの過程でのリソソソーム成熟に必要であるため[16]。
最近の証拠は、タンパク質や脂質の酸化を受けている脳領域にはアミロイドβペプチドが豊富に含まれていることを示している[14]。いくつかの研究では、抗酸化剤の異所性投与がアルツハイマー病患者の脳におけるアミロイドβ誘発毒性を緩和し、ニューロンの酸化ストレスを防ぐことができるかもしれないことを示唆している[30]が、これらの知見を支持するためにはさらなる研究が必要である[26]。
2.4. オートファジー
オートファジーは、異常に折り畳まれたタンパク質や損傷した小器官を除去する異化機構を構成している。アルツハイマー病ではこのプロセスが阻害され、Tauとアミロイドβの凝集を引き起こし、神経原線維のもつれや老人性プラークの形成につながる[31]。
オートファジーには、マクロオートファジー、ミクロオートファジー、シャペロン媒介オートファジーの3つのタイプがあり、認識機構や基質分解経路が異なる。マクロオートファジーは、凝集したタンパク質の主な分解経路であり、それは主要なアルツハイマー病マーカーの一つとしてその使用を説明している。単純化するために、マクロオートファジーは、それ故に ‘オートファジー’と呼ばれる。
オートファジーは、5つの段階で構成されている。核形成、ファゴフォアの伸長、オートファゴソームの形成、オートファゴソームとリソソームの融合、および隔離された生物学的残基のリサイクルまたは分解[29](図3)。
図3 オートファジープロセスの段階と栄養素による調節
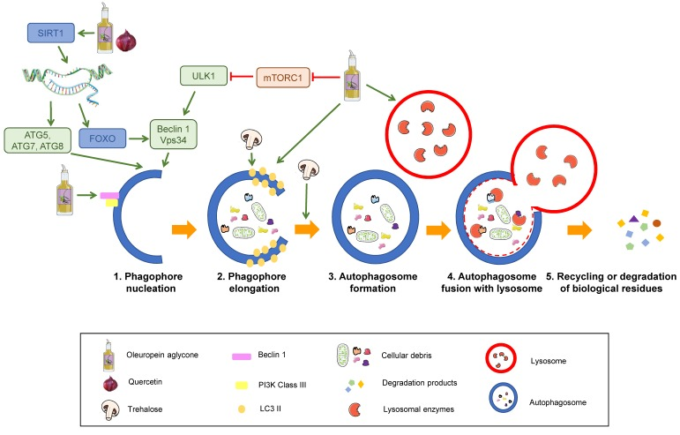
オートファジーによる分解の段階。SIRT1:サーチュイン1。 ATG:オートファジー関連タンパク質。ULK1:オートファジー活性化キナーゼ1のunc-51様。FOXO。フォークヘッドボックスクラスの “O “タンパク質。VPS34: 液胞タンパク質ソーティング34 mTORC1: ラパマイシン複合体1の哺乳類標的。オートファジーを調節することが提案されている栄養素は、凡例に表示されている。緑の矢印は活性化を表す。赤く切り捨てられた矢印は抑制を示す。
プロセスは、キナーゼ複合体ULK(オートファジー活性化キナーゼのようなunc-51)の活性化から始まる。この複合体はベクリン-1をリン酸化して活性化する。ベクリン-1は、処理が必要な基質の周りに形成された最初の隔離小器官であるファゴフォアの核形成を開始する複合体の一部である。mTORC1の活性化は、ULK複合体をリン酸化し、それを阻害し、結果としてオートファジーの活性化を阻害する。このように、mTORC1の阻害はオートファジーを誘導する[30,31](図3の1)。
オートファジーが開始されると、LC3-IIというタンパク質がファゴフォアに結合し、脂質を獲得することでファゴフォアを伸長させることができる(図3の2)。LC3はプロLC3として合成され、ATG4によって切断され、活性型のLC3-Iが得られる。ATG7とATG3は、ファゴフォア膜からホスファチジルエタノールアミンへのLC3-Iの結合を触媒し、LC3-IIになる。このことは、LC3-IIがオートファゴソーム膜の数の相関関係として使用できることを説明している[32,33]。
膨張したファゴフォアは最終的に封鎖され、分解される細胞質物質を含むオートファゴソームを生成する(図3の3)。
この成熟したオートファゴソームはリソソームと合体し、オートリソソームまたはオートファゴリソームを生じさせ、その相互作用はリソソームの酸性pHに依存する(図3の4)。これらのオートリソソームに含まれる加水分解酵素は、封じ込められた物質を分解し、その結果生じる生成物(脂質、アミノ酸、単糖、ヌクレオチド)は、ペルメラーゼによって細胞質に戻され、新しい生体分子を合成するためにリサイクルすることができる。
オートファジーは、加齢によって細胞内に蓄積された有毒な残基や損傷した小器官が恒常性を損なうため、ニューロンでは必須の経路である。さらに、Beclin-1,ATG5,ATG7のようないくつかのタンパク質は加齢とともに減少し、オートファジーを阻害し、アミロイドβの蓄積を促進する。これは、アルツハイマー病患者の神経機能障害と関連している[34]。
ベクリン-1は、Vps34の活性を調節し、オートファゴソームを生成するための膜リクルートに関与することによってオートファジーを誘導する[32]。これら2つのタンパク質は、ATG14とVps15とともに、オートファジー小胞の核形成を担うホスホイノシチド3-キナーゼ複合体(PI3K)を構成している。加齢とともに記載されているように、この経路の障害は、したがって、アミロイドβの蓄積とアルツハイマー病症状の表示につながる可能性がある[31]。マウスを用いた研究では、オートファジー誘導時に減少させることができる脳内の高リン酸化タウ沈着物の形成についても記載されている[35]。さらに、APPトランスジェニックマウスでベクリン-1を欠損させると、神経細胞のオートファジーが低下し、細胞内および細胞外にアミロイドβが沈着して神経変性を引き起こすことが報告されている[32]。このように、オートファジーとBeclin-1の誘導が神経変性とアミロイドβ蓄積を調節することが提案されている。
他の研究者は、PARK2過剰発現によるマイトファジー活性化が、アルツハイマー病患者由来の線維芽細胞に見られるミトコンドリア欠損を救済し、本疾患のトリプルトランスジェニックマウス(3xTg)モデルにおいてシナプス機能を回復させることを実証している[36,37]。
2.5. 炎症
炎症は、サイトカイン(インターロイキン1,腫瘍壊死因子)プロスタグランジン、成長因子、トロンボキサン、または活性酸素などの炎症性メディエーターによって行われる、脅威に対する生物の応答である。アルツハイマー病患者では、アミロイドβプラークと神経原線維のもつれは、これらのメディエーターの作用を刺激し、慢性的な炎症状態を引き起こす。これらは、順番に、APP処理のアミロイド原性ルートを強化し、アミロイドβ42レベルを増加させる。アミロイドβはまた、グリア細胞における腫瘍壊死因子(TNF)[38,39]などの炎症性サイトカイン、およびシクロオキシゲナーゼ-2(COX-2)や誘導性一酸化窒素合成酵素(iNOS)核内因子κB(NF-κB)などの炎症に関連するいくつかの酵素を活性化させる。アミロイドβの蓄積の結果としてのこの炎症反応は、アルツハイマー病で観察される神経細胞の損傷につながると推測されている[39]。
3. 食事パターンの関連性
この研究の主な焦点は、酸化ストレス、オートファジー、炎症、APP処理などのアルツハイマー病の病態に関与するメカニズムと、栄養素がそれらにどのように影響するかについて、利用可能なエビデンスを収集することであり、この病気の有効な治療法がないことを考えると、潜在的に役立つ可能性がある。
ここ数年の間に、増加している証拠は、ライフスタイル、食事、肥満、および社会経済的地位がアルツハイマー病の発達に役割を果たす外因性因子のいくつかであることを示唆している。したがって、食事の推奨事項は、最も楽観的なシナリオでその進行を遅くしたり、リスクのある集団でそれを防ぐために助け、病理学上の栄養素の影響を調整する良い機会を提供する可能性がある。
食事療法は、特定の手段が異なる経路上に与えることができる多元的な効果の完璧な例であり、アルツハイマー病上の食事療法の介入の妥当性を支持する。しかし、食事療法の介入は、予防、保護、またはアルツハイマー病または認知機能の低下[40]を治療することが明確に証明されていない。それはともかくとして、本研究で議論されるように、アルツハイマー病の発症や他の神経変性疾患のさまざまなプロセスにおける特定の栄養素の効果に関する証拠が蓄積されている。栄養素がアルツハイマー病を修飾する可能性があるメカニズムを扱うこの種の研究の必要性にもかかわらず、それらの潜在的な有用性は、せいぜい限定的であることは疑いの余地がない。栄養素は単独で消費されるものではなく、特定の栄養素の補充がアルツハイマー病に及ぼす効果は不明であり、特定の食品に含まれる異なる栄養素間の相乗作用または拮抗作用を見落としている可能性がある[40,41,42]。実際、最近のネットワークメタアナリシスでは、栄養素に基づく介入は影響が限定的であり、有意な効果を達成していないことが指摘されている[41]。単一の食物であっても、認知機能の改善または記憶力の低下と相関することはできないようである[40]。したがって、食事パターンの効果を調べることが、より適切で有益なアプローチである可能性がある。栄養素の効果が報告されていないのとは対照的に、いくつかの食事は認知機能の改善と軽度認知障害やアルツハイマー病の発症率の低下に関連している。しかし、臨床研究で食事療法の介入を検討する際には、科学的知見に顕著なギャップがあることを強調しておくことが重要である。地中海食(地中海食)は、これらのプロセスを調節するための最良の選択肢の一つとして提案されており、地中海食へのより高いアドヒアランスは、アルツハイマー病および認知機能障害のリスクの減少と関連している[43,44,45,46]。
地中海食は後述する栄養素のいくつかを含んでいる。例えば、大量の野菜、豆類、果物で構成されており、酸化ストレスを軽減する抗酸化ビタミンが豊富に含まれている。また、オートファジーを促進するオレウロペインアグリコンのアウトラインであるアミロイドβ凝集体とミトコンドリアからの活性酸素を減らすのに役立つポリフェノールを含むオリーブオイルの不飽和脂肪の摂取量が多いことも特徴である。地中海食のさらなる特徴は、赤肉の量が少なく、鶏肉の適度な摂取量が含まれており、大量に摂取すると神経細胞膜の硬直と流動性の喪失を誘発する飽和脂肪とコレステロールの量が少ないことを意味する。さらに、コレステロール値が低いということは、β-セクレターゼの活性化が少ないことを意味し、アミロイドβの沈着を防ぐことになる。さらに、地中海食はω3が豊富な魚を適度に摂取することを提案しており、これは炎症性および血栓性サイトカインの合成を減少させるのに役立つ。ω3シリーズに属し、DHAはまた、アミロイド原性ルートのセクレターゼの活性を減少させ、間接的に非アミロイド原性のものを強化する。これらの観察の上に、地中海食は、そのポリフェノール[8,14,34]のために肯定的な効果を持つ赤ワインの適度な消費、通常の食事中に関連している一方で、脳血管機能を維持するのに役立つかもしれないエタノールを含んでいる[47]。
これらの効果は、単一の栄養素を使用した研究の反映であるが、それらの潜在的な利点への傾向は、地中海食へのより高いアドヒアランスにリンクされた認知機能の改善の証拠と一緒に認知機能の低下とアルツハイマー病に苦しんでいる患者で特定の食事介入の必要性に対処するための説得力のある引数を構成している[41,45]。この点で、それはBertiと共同研究者が3年間の追跡調査[48]でアルツハイマー病バイオマーカーの変化に地中海食の効果を評価する非常に最近の研究からの結果を強調することが重要である。その中で著者らは、地中海食へのアドヒアランスが低い患者ではアミロイドβ沈着と神経変性が増加しただけでなく、これらの病理学的特徴の進行がより高い割合で起こったことを報告した。このような異常の発症は、試験開始の少なくとも1.5年前に起こると推定された。さらに、地中海食の有益な効果は、この食事へのより高いアドヒアランスは、最大3.5年のアルツハイマー病に対する保護につながる可能性があると推定されることによって強調された。Bertiらが指摘したように、地中海食の予防や治療の手段としての臨床応用はまだ正当化されていない。注目すべきことは、地中海食 に関連する栄養素-薬物相互作用に対処する研究が不足している、特に重要な可能性がある アルツハイマー病 患者では、他の年齢に関連した健康上の懸念のために通常多剤併用されている、この人口層の間でかなり一般的である。
ちなみに、それは最後の年の間に、いくつかの研究が行われていることを強調する価値がある アルツハイマー病 上のケト原性食事療法の効果について。ケトジェニック ダイエットは、飽和脂肪が豊富で炭水化物が少ない。科学的根拠は、飽和脂肪が豊富な食事は、アルツハイマー病を開発するリスクを増加させることを指摘したが、その低炭水化物の量の低量との組み合わせは、潜在的に有益であることが判明している。実際、この食事を43日間摂取させたアルツハイマー病のトランスジェニックマウスのモデルでは、APPアミロイド生成処理の減少により、脳内のアミロイドβレベルが有意に低下したことが示された[49]。しかし、アミロイドβの減少が認知機能の改善と相関するかどうかを調べるためには、ヒトでのさらなる研究が必要である。
さらに、いくつかの食事パターンは、いくつかのアルツハイマー病リスク因子の変調を介して、間接的にアルツハイマー病リスクと発達に影響を与える可能性がある。例えば、肥満、2型糖尿病、または心血管疾患は、アルツハイマー病を開発するリスクを増加させるために確立されている[8,15,39,50]と特定の食事とライフスタイルの介入は、健康におけるこれらの条件の影響を予防または軽減することが証明されている。したがって、この改善はアルツハイマー病や別のタイプの認知症を発症するリスクの減少として翻訳される可能性がある[51]。
地中海食や他の食事パターンがアルツハイマー病や他の病理学の利益につながる可能性がある特定のメカニズムはまだ解明されていない[48]。これにより、我々は常に食品や食事の中で相乗的な活動が期待されることを念頭に置いて、アルツハイマー病の発症を調節するのに役立つかもしれないさまざまな栄養素のために記述された最も重要なメカニズムのいくつかをレビューし、観察された効果のための最終的な責任である可能性が最も高い。さらに、我々は、議論されている栄養素についてのヒトで行われた研究についての情報を含むが、全体的に、臨床研究では、アルツハイマー病のための食事介入の明確な予防的または治療的効果を証明することができなかったことを強調する必要がある。これは、トランスレーショナルリサーチに内在する問題によるものであり、また、食事療法を評価する際に存在する可能性のある交絡因子の数の多さによるものでもある。しかし、前述の研究[43,44,45,51]から引き出された食事介入の潜在的な有用性は、食事のパターンと組み合わせた栄養素がアルツハイマー病などの慢性疾患を調節する可能性があるメカニズムに焦点を当てた研究の支持のための説得力のある引数を構成している。
4. アルツハイマー病を修飾する栄養素
4.1. 不飽和脂肪(一価不飽和および多価不飽和
一価不飽和脂肪酸(MUFAs)は、多価不飽和脂肪酸(PUFAs)は、その炭素間に1つ以上の二重結合を持っている間、その構造に1つの不飽和炭素結合または二重結合を含む脂質性生体分子である。PUFAsは2つのグループによって構成されている。オメガ3シリーズ(ω3)に属するものとオメガ6シリーズ(ω6)に含まれるもの。これらの系列の中で、α-リノレン酸(ω3)およびリノール酸(ω6)は、人間が食物摂取から獲得する必要がある必須脂肪酸であり、伸長および脱飽和により長鎖必須脂肪酸を生成する[38]。アラキドン酸(AA)はリノール酸から合成され、ドコサヘキサエン酸(DHA)およびエイコサペンタエン酸(EPA)はα-リノレン酸(ALA)から得られるのに対し、アラキドン酸(AA)はリノール酸から合成される[52]。ω3/ω6の比率は、アルツハイマー病に意味を持つ(図4に要約)。脂肪酸の両方のタイプは、細胞膜に組み込まれるために同じデサチュラーゼを競います。したがって、ω6酸の量が多いと、EPAとDHAへのα-リノレン変換を妨げ、結果として、これらの脂肪酸のレベルが低下する。したがって、それはプロスタグランジン、トロンボキサン、およびロイコトリエンなどのω6酸からのプロ炎症性エイコサノイドの合成を高める。これらの物質は炎症性および血管収縮機能を発揮し、心血管リスクを高め、したがって神経変性疾患に罹患する確率を高める可能性がある[53]。
図4 不飽和脂肪のアルツハイマー病への影響
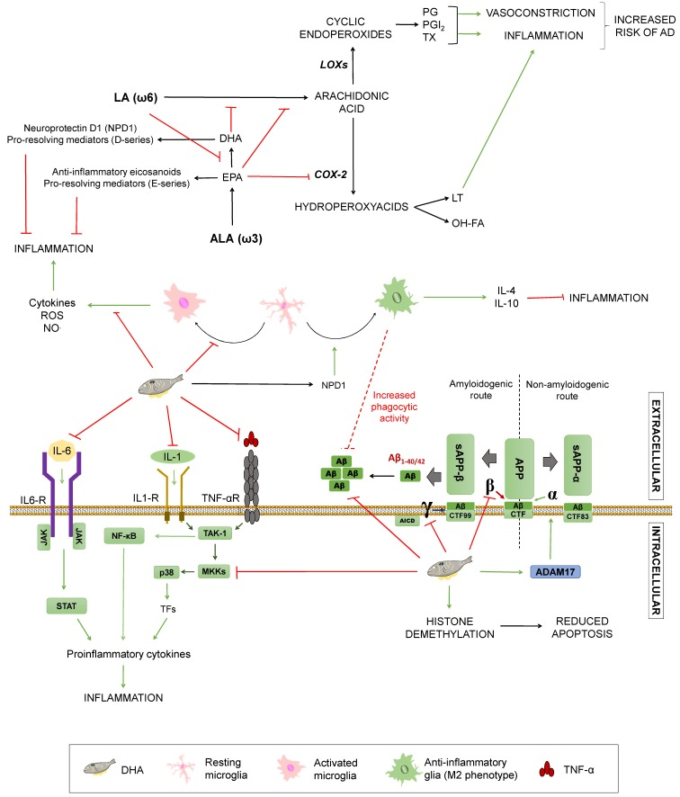
不飽和脂肪がアルツハイマー病を修飾する可能性のあるプロセスのまとめ。COX-2:シクロオキシゲナーゼ-2。LOXs(ロックス)。リポキシゲナーゼ。LT:ロイコトリエン。OH-FA:ヒドロキシ脂肪酸。PG:プロスタグランジン類。PGI2:プロスタサイクリン。TX:トロンボキサン類。NO:一酸化窒素。TNF-α。TNF-αR:TNF-α受容体。IL-1:インターロイキン-1。IL-1R:IL-1受容体。IL-6:インターロイキン-6。TAK1:形質転換成長因子β活性化キナーゼ1。NF-κB:活性化B細胞の核内因子κ-光鎖エンハンサー。P38:P38マイトジェン活性化プロテインキナーゼ。MKKs:MKKs。ミトゲン活性化プロテインキナーゼキナーゼ。STAT:転写のシグナル変換器および活性化因子。APP:アミロイドβ前駆体タンパク質。 sAPPα:可溶性α-APP。ADAM17:ADAMメタロペプチダーゼドメイン17。CTF:カルボキシ末端断片。AICD:APP細胞内ドメイン。緑の矢印は活性化を表す。赤く切り捨てられた矢印は阻害を示す。
逆に、ω3脂肪酸は様々なメカニズムで炎症を抑えることができる。それらは、ω6脂肪酸と競合することでAA合成を阻害し、EPA媒介のCOX-2阻害を介してプロ炎症性因子へのAA変換をブロックすることができる。さらに、炎症性メディエーターの産生を阻害するために、EPAは抗炎症性エイコサノイド、および炎症の終結を促進するレゾルビン(Eシリーズ)を産生する[53]。マウス由来のミクログリアでは、DHAはリポ多糖やインターフェロンγによって誘導されるNOや活性酸素の放出を減少させることができるため、グリアの調節を介して炎症を防ぐことができる[54,55]。この現象は、DHAが細胞膜に取り込まれて抗原提示を阻害することで部分的に説明できるが、MKKsによるp-38マイトジェン活性化プロテインキナーゼのリン酸化阻害やPPARγ活性化の促進により炎症性分子の発現を抑制し、グルコースや脂質代謝を調節するようである[38,56,57]。さらに、DHAおよびその活性誘導体であるニューロプロテクトインD1(NPD1)は、IL-10およびIL-4などの抗炎症性メディエーターの分泌を介して炎症の終結に関連するミクログリア表現型M2にリンクされている。DHAはまた、試験管内試験と生体内試験の両方で、グリアの貪食活性の増加を媒介することが提案されている。これにかかわらず、DHAが直接または間接的に減少した炎症性メディエーター[38,53,55]を介してグリア表現型に影響を与えることができるかどうかは不明のままである。炎症過程は認知症の本質的なメカニズムの一つを構成しているので、ω3脂肪酸はこれらの抗炎症性のために保護効果を有する可能性がある[58]。2015年の研究では、J.トーマスらは、このような長鎖オメガ3脂肪酸の枯渇など、いくつかの生理的変化が老化脳で発生し、このプロセスは、アルツハイマー病 [59]で急な方法で進行することを断言した。これは、アルツハイマー病患者[15,59]で見つかったDHAの低レベルと一致している。
DHAは、神経系の正常な成長、発達、機能だけでなく、その維持と神経細胞構造の保全[37]で基本的な役割を果たしている。DHAはニューロンの細胞膜に取り込まれることができ、ここではAPPの処理に直接的な影響を与えるだけでなく、タンパク質の横方向への移動を妨げ、基質/酵素の相互作用を妨げることができる膜の流動性の変化に起因する間接的な影響を与える可能性がある[57]。いくつかのもっともらしいメカニズムが記述されているが、アルツハイマー病の病理における脂肪酸の役割はあまり明らかではない。CHME3細胞(ヒトミクログリア細胞株)での研究は、DHA投与後の抗炎症プロファイルと一緒に増加したアミロイドβファゴサイトーシスを示した[58]。APPsw(Tg2578)トランスジェニックマウスモデルでは、この酸は脂質の過酸化を防ぎ、β-およびγ-セクレターゼの活性を低下させることにより、海馬および皮質領域でのアミロイドβ蓄積を減少させ、アミロイドβペプチドの生成を回避している[59,60,61]。このことは、12匹の雄のC57B1/6JマウスにDHAを豊富に含む食事を4週間与えたところ、γ-セクレターゼとβ-セクレターゼの両方が減少し、γ-セクレターゼに対してより大きな効果を示したという証拠と一致している[62]。DHAはPS1やBACE1などの他の遺伝子やタンパク質の発現を変化させず、アミロイド生成経路のセクレターゼへの直接的な効果を確認した。また、α-セクレターゼとともにAPPのタンパク質分解切断に関与する遺伝子であるADAM-17の転写を増加させ、アミロイドβの産生を抑制し、非アミロイド原性経路のアミノ末端フラグメントであるsAPP-αおよびC末端フラグメント(CTF83)のレベルを増加させることにより、非アミロイド原性経路に間接的な影響を与えた(図4)。最後に、DHAの代謝は、神経保護[63]であると提案されているニューロプロスタンやNPD1などの活性誘導体、炎症の終結[50]を誘導するのに役立つDシリーズレゾルビンなどを生じさせることは注目に値する;炎症やAPP処理を含む前述のプロセスへのそれらの影響はまだ解明されていないが。
これらのメカニズムの大部分は、最近、GrimmらとCardosoらによる2つのレビューで要約されている[60,61]。このすべてから、それはDHAは主に、しかし唯一ではなく、炎症を減少させ、脳内のアミロイドβ沈着を減少させることによって、アルツハイマー病の発症に有益である可能性があると結論づけることができる。これに沿って、疫学研究は、DHAの不十分な消費量は、アルツハイマー病 [62]を開発するより大きなリスクにリンクされているという考えをサポートしている。
しかし 2006年に、フロイント-レヴィらは、彼らが1.72グラムのDHA + 6ヶ月間1日あたり0.6グラムのEPAを補充した軽度から中等度までのアルツハイマー病の異なる段階の患者との二重盲検試験を実施した。彼らは、アルツハイマー病の軽度のフォームを持つ患者のサブグループの認知機能の低下でわずかな改善を発見し、患者の残りの部分では改善はない[63]。これは、ω-3サプリメントは軽度の認知障害を持つ患者の認知状態を安定させたが、アルツハイマー病患者では安定させたり、それを改善することはできなかった[64] Fialaらの研究によって示唆されたように、ω-3は、アルツハイマー病の予防に役割を果たすことができるが、神経病理学的な状態が進行した後ではないことを示しているかもしれない。疫学的研究と臨床研究の両方とも、ω-3脂肪酸は発症前または患者が軽度の症状を示すときにのみ有効であるかもしれないという考えに賛成している[65,66,67]。
これとは別に、他の相互作用因子も考慮されるべきである。例えば、DHAの代謝は、その後、この酸[38]との治療に不応なサブグループを構成するであろうAPOE ε4対立遺伝子を持つアルツハイマー病で特に破壊されていることを示唆する証拠がある。これは、この研究を含むより最近のメタアナリシスでは魚の保護効果のための決定的な結果を示したが、APOE ε4対立遺伝子の非キャリアにおける認知症リスクの低下と脂肪の多い魚の摂取に関連したHuangらの研究[68]によってサポートされている[69]。対照的に、APOE ε4キャリアは、認知症前の段階では高用量のω3補充から恩恵を受ける可能性があるが、この介入は、脳イメージング技術の進歩を利用して最適化される必要がある[70]。APOE ε4キャリアと非キャリアの違いは、異なるAPOE対立遺伝子の分布が地理的に異なることを考慮すると、集団的な結果をもたらす可能性がある [71]。言及に値するもう一つの要因は、これらの栄養素を補充する研究のほとんどがω3(特にDHA)のみを特定の栄養素として使用しているという事実であり、これらの栄養素を含む全食品[60]とそれらの食品を含む食事パターンの相乗効果を無視している可能性がある。実際、いくつかの証拠は、単離された化合物ではなく、AA:EPAおよびAA:DHAの比率が、観察された効果に責任があるであろうと指摘している。例えば、抗炎症性サイトカインであるIL-10およびTNF-αの放出の増加、およびIL-6およびIL-8の減少は1-2:1の比率で見られ、一方でこれらの炎症性プロメディエーターのレベルは4-7:1の比率で増加している[72]。このことは、60歳以上の人にDHAを濃縮した魚油を1年以上摂取させた二重盲検プラセボ対照試験の結果を説明するのに役立つであろう。
すべての上に、他の可能性のあるメカニズムは、アルツハイマー病上のω3脂肪酸の効果に役割を果たしている可能性がある。この点では、エピジェネティクスの分野は、異なる栄養素がどのように病気に影響を与える可能性があるかの理解を向上させる良い機会かもしれない。特に、DHAは、遺伝子発現の変化につながると減少したアポトーシス[74]を示唆し、ヒストンの脱メチル化に関与しているように見えるが、さらなる研究は、これがアルツハイマー病の開発[75]に影響を与えるであろう特定のメカニズムを解明するために実施されなければならない。これらのメカニズムの中で最も関連性の高いものの要約を図4に示す。
4.2. ビタミン
上記のように、脳内の活性酸素の蓄積は、抗酸化能力の低下に起因する可能性がある。このため、ビタミンA、C、D、E、ビタミンB群などのビタミンを多く含む果物や野菜の摂取は、それらの潜在的な抗酸化作用の一部のおかげで、アルツハイマー病発症に対する予防的な役割を果たす可能性がある。果物や野菜は、フラボノイドなどの他の有益な栄養素で構成されており、その神経変性プロセスに対する保護効果については本論文で後述する[2]。実際、脂溶性ビタミンA、D、K、E、および水溶性ビタミンCの低レベルは、高齢者やアルツハイマー病患者の認知機能の低下と関連している[69,76,77,78,79]。他の水溶性ビタミンについては、ビタミンB6,B9,B12の機能状態を反映するバイオマーカーである総血漿ホモシステイン値の上昇が、最近のコンセンサス論文で認知症、認知機能低下、アルツハイマー病の危険因子として指摘されている[80]。しかし、ビタミン補給の効果は、特に遺伝的背景が異なる患者では効果が同じではない可能性があることを考慮すると、まだはっきりしないままである[81]。さらに、ビタミンのレベルが低い人は、他のリスク因子を示唆する可能性のある健康的でないライフスタイルを送っている可能性が高いという事実など、結果は他の交絡因子の影響を受けている可能性がある。アルツハイマー病に対するこれらのビタミンの効果は、図5にまとめられており、以下で議論されている。
図5 アルツハイマー病に対するビタミンの効果
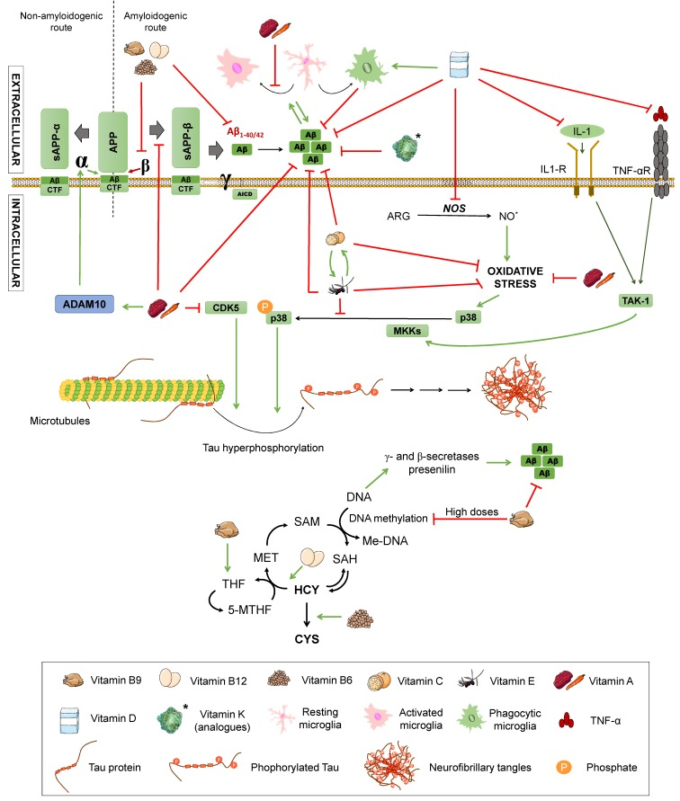
アミロイドβおよびタウの病理、炎症、酸化ストレスに対する各種ビタミンの効果。ARG:アルギニン。NO:一酸化窒素。TNF-α。TNF-αR:TNF-α受容体。IL-1:インターロイキン-1。IL-1R:IL-1受容体。TAK1:トランスフォーミング成長因子β活性化キナーゼ1。P38:P38マイトジェン活性化プロテインキナーゼ。MKK4:マイトジェン活性化プロテインキナーゼキナーゼ4。CDK5:サイクリン依存性キナーゼ5。APP:アミロイドβ前駆体タンパク質。 sAPPα:可溶性α-APP。ADAM10:ADAMメタロペプチダーゼドメイン10。CTF:カルボキシ末端断片。AICD:APP細胞内ドメイン。ホモシステイン代謝経路。MET:メチオニン。SAM:S-アデノシルメチオニン。SAH:S-アデノシルホモシステイン。HCY:ホモシステイン。CYS:システイン。THF:テトラヒドロフォレート。5-MTHF:5-メチルテトラヒドロ葉酸。Met-DNA:メチル化されたDNA。緑の矢印は活性化を表す。赤く切り捨てられた矢印は抑制を表す。
ビタミンAは、胚性ニューロンへの酸化的損傷から保護するため、成人期および小児期の神経系の発達に不可欠である[82]。これらの抗酸化特性は、抗オリゴマーおよびニューロン保護効果[77,79]とともに、試験管内試験および生体内試験のADモデルの両方で確認されている。アミロイドβ形成および炎症に関連する機能も記載されている[83]。例えば、APPのアミロイド生成処理は、全トランスレチノイン酸(ATRA)による細胞内でのスクレプターゼの選別に関わる修飾のために妨げられているようである[76]。ビタミンA代謝物であるトランスレチノイン酸を、5%のジメチルスルホキシドを含む通常の生理食塩水に溶解したものを週3回腹腔内注射(20mg/kg)で投与したAPP/PS1二重トランスジェニックTgB6C3(APPswe、PSEN1dE9)マウスを用いたブラインド研究では、この酸が、タウの異常なリン酸化に関与するCDK5キナーゼの活性を低下させることにより、タウの高リン酸化を減少させることができたと報告されている[76]。同様の知見は、非アミロイド性APPの処理に関与する酵素であるADAM10をアップレギュレートする合成レチノイン酸アナログであるタミバロテンを用いた研究でも報告されている[84]。また、APPのアミロイド原性処理からのC末端断片の産生を阻害することで、アミロイドβの沈着を制限している。これらの変化は、これらのマウスの認知機能の改善を伴うものであった。炎症に関しては、同じ研究でミクログリアとアストロサイトの活性化が減少したことが報告されている[85]。さらに、ビタミンAおよびその誘導体は、ADAM9やADAM10,APP、BACEなどのアルツハイマー病に関連するいくつかの遺伝子に対して、試験管内試験および生体内試験で転写調節作用を示すことが示されている[76,86,87,88];また、抗酸化作用を介してヒストンアセチル化を抑制する役割を果たす可能性があることが示されているが、これはビタミンCやビタミンEにも起因する可能性がある[74]。
それにもかかわらず、これらの効果がどんなに有望に見えても、レチノイドの投与の安全性プロファイルを考慮することが重要である。例えば、ATRAは化学療法用量(45mg/m2/日)で毒性があり、レチノイドの長期使用は消化管出血を引き起こす可能性があり[79]、毒性試験および臨床試験が実施されるまでは、少なくともその治療上の有用性が制限される可能性がある。
ビタミンEとその活性型、α-トコフェロールは、脂質に可溶であり、後者はヒトに吸収され、蓄積されていると、かなりの抗酸化力を持っているが、ビタミンCまたはアスコルビン酸は、水に可溶であり、低密度リポタンパク質の酸化を防止する。アルツハイマー病に対するそれらの効果に関する文献はまた、決定的ではない。ビタミンCは抗酸化作用を発揮し、アルツハイマー病に役立つかもしれないが、APPトランスジェニックマウスでは抗オリゴマー特性もそれに起因している[89]。さらに、5X家族性ADマウスを背景としたGulo KOマウス(ADマウスモデルとビタミンCを産生できないマウスとの交雑種)に高用量ビタミンCを投与すると、海馬および皮質領域のアミロイドプラークが減少し、APP/PSEN1マウスおよび野生型マウスでは、短期高用量輸液により空間学習および記憶が増強された[90]。これに関連して、いくつかの臨床研究では、アスコルビン酸の補給がアルツハイマー病のリスクを減少させる可能性があることを示唆しており、アルツハイマー病患者の間でビタミンCの血漿中濃度が低下することを支持する疫学研究もある[79]。しかし、かなりの研究では、ビタミン C の摂取量と アルツハイマー病 のリスクの低下との間の関連性を発見せず、それらのいくつかは、血漿 アミロイドβ レベルに効果の欠如を指摘している [79,91]。
ビタミンEに関しては、実際には4つのトコフェロールと4つのトコトリエノールのファミリーであり、そのうちのいくつかは抗酸化作用と抗炎症作用を示している[92]。これらの特性とは別に、ビタミンEは、試験管内試験およびAPP/PS1マウスにおいて、p38MAPKリン酸化を阻害することにより、アミロイドβ誘導タウリン酸化を抑制することが報告されている[93,94]。さらに、抗アミロイド生成活性とセクレターゼmRNAの調節はビタミンEに起因していると考えられている[79]。臨床研究は、ビタミンEレベルとアルツハイマー病の進行率との間に逆相関があり、Visioliら[79]がレビューしたように、ビタミンEの摂取は認知機能の低下の減少を示し、これらの患者の依存性と生存率を改善することを示しており、アスコルビン酸に関する研究よりもより決定的であるように思われる[95]。興味深いことに、いくつかの研究では、アスコルビン酸が酸化したα-トコフェロールを還元し、それを再生するので、ビタミンCとビタミンEの間のむしろ相乗的な活性を示唆している[96]とビタミンEは、今度は膜-細胞質界面で酸化したビタミンCを復元することができる[66]が、Caoと共同研究者ら[69]によって行われたメタ分析は、総抗酸化物質の摂取量と低いアルツハイマー病リスクの間の関連は、ビタミンEの摂取に起因する可能性があるが、ビタミンCやフラボノイドではなく、ビタミンEの摂取に起因する可能性があることを指摘している。これらの結果は説得力があるかもしれないが、ヒトにおけるビタミンCとEの全身的な抗酸化作用は明確に証明されておらず、ビタミンEの効果を報告している試験の大部分はα-トコフェロールの補充[79]を使用しており、他のビタミンEの形態の前述のメカニズムを無視している可能性がある[92]ことは注目に値する。実際、いくつかの研究では、これらの他の形態が最も神経保護効果を発揮する可能性があり、脳内のα-トコフェロールの高濃度がアルツハイマー病の病理を増加させる可能性があることを示唆している[74]。
アルツハイマー病に対するビタミンKとDの効果に関する研究は、はるかに少ない。他のAPOE対立遺伝子を持つ健康な被験者と比較して、APOE ε4キャリアの血漿サンプルでビタミンKのレベルが低いことが発見されている[97];しかしながら、アルツハイマー病患者に関する研究は不足しており、Presseら[78]によって報告されたように、アルツハイマー病患者の食事中のビタミンKの摂取量が少ないことなど、多くの交絡因子がこれらの結果に関与している可能性がある。それにもかかわらず、ビタミンKの欠乏は血管運動の損失と出血のリスクの増加にリンクされていることに言及する必要がある[79]、心血管疾患による認知症のリスクを増加させる可能性がある。また、ビタミンK類似体は、シリコおよび試験管内試験でアミロイドβ凝集を抑制し、その細胞毒性から保護することが報告されている[98]が、ビタミンKのこれらの結果を検証するために、またはアルツハイマー病動物モデルおよび患者におけるその有用性を検証するために、より深い研究が行われるべきである。ビタミンDに関するより多くの研究が行われており、そのほとんどは、ビタミンDの低レベルと認知症リスクの増加との間の相関関係を示し、アミロイドβクリアランスとファゴサイトーシスの増加を介して蓄積量の減少につながったアミロイドβクリアランスとファゴサイトーシスを介して、試験管内試験および生体内試験でのアルツハイマー病病理学との関連を示している[79,99]。また、ビタミンDには抗炎症作用と抗酸化作用があり、前者はマウスモデルではおそらく炎症性サイトカインの抑制を介して、後者は試験管内試験でフリーラジカルに対する神経保護効果を発揮したり、iNOSを阻害したりするなどの作用が報告されている[99]。それでも、臨床試験ではアルツハイマー病に対するビタミンDの効果について結論を出すことができず、研究間の不均一性が高い[79]。
最後に、ビタミンB群に関しては、ビタミンB12,B6,B9または葉酸を挙げるべきである。これらは、メチオニン代謝に由来する硫黄アミノ酸であるホモシステインの代謝サイクルに影響を与えるため、アルツハイマー病に有益な効果があると提案されている(図5)。この代謝経路では、ホモシステインは、DNAメチル化を含む他の代謝反応でメチル基のドナーであるS-アデノシルメチオニン(SAM)になる。このプロセスには、葉酸(ビタミンB9)ビタミンB12,ビタミンB6という一連の補酵素が関与している。葉酸とビタミンB12は協調して作用してホモシステインをメチオニンに変換し、ビタミンB6はホモシステインをシステインに変換する。食事療法からの葉酸は 5,10-methyltetrahydrofolate (5-10MTHF) に順番に変えられるテトラヒドロ葉酸 (THF) に変形する。この化合物は、葉酸の活性形態を生成する:5-メチルテトラヒドロ葉酸は、メチオニンの生産と、その結果、DNAのメチル化を可能にするメチル基ドナー化合物である[100]。
したがって、ホモシステイン経路に関与するこれらの補酵素の欠損は、サイクルをブロックし、ホモシステインレベルを増加させ、DNAのメチル化を妨げる。DNAの低メチル化は、アミロイド生成経路のγ-およびβ-セクレターゼを活性化し、アミロイドβ産生を促進する[100]。他のエピジェネティックなメカニズムも提案されており、例えば、B12欠乏がプレセニリンを誘導することもDNAの低メチル化に起因すると考えられている。また、葉酸は直線的な相関関係ではなく、逆U塩基上でのDNAメチル化と関連しているようであるが、これは葉酸が過剰になるとB9の代謝異常につながる蓄積が起こり、DNAメチル化が起こるためであり、B9レベルの低下と同様である[74]。これに関連して、特定の多型がこれらの代謝経路の変化に対する感受性を高める原因となっていることを考慮することが重要であり、DNAの修復やメチル化が不十分であることやホモシステインのレベルが高くなることなど、他の結果[101]の中でも特に重要である。一方、ホモシステインの蓄積が15μmol/L以上になると、高ホモシステイン血症と考えられる。このような状況は、アテローム性および血栓性の特性のために、認知症に伴う認知機能障害の増加と血管機能障害の増加の両方をもたらし、したがって、心血管疾患の危険因子を構成し、アルツハイマー病に関連する可能性がある[8,15]。この仮説を評価するために、葉酸とビタミンB12のレベルが低いが、ホモシステインが上昇しているアルツハイマー病患者を対象に研究が行われた。ホモシステインのレベルは、蛍光検出を伴う高速液体クロマトグラフィーによって決定された[102]。ホモシステインの上昇は一部の症例で微小梗塞を生じ、それはアミロイドβ沈着と神経原線維のもつれに関連しており、認知症の病態と結びついていた。
ホモシステインの代謝に果たす役割に基づいて、ビタミンB12,B9,またはB6の補給をホモシステインレベルを低下させる手段として提案する著者もいる[8,103]。これは、スウェーデン突然変異を持つヒトAPP(K670N/M671L)を過剰発現させたアルツハイマー病 Tg2576雌性トランスジェニックマウスを、葉酸(<0.2 mg/kg)ビタミンB12(<0.001 mg/kg)およびビタミンB6(<0.1 mg/kg)の低い食事を与えた場合に、高ホモシステイン血症を示した以前の結果と一致している[104]。
ヒトにおけるホモシステインの役割については相反する論文があるにもかかわらず、認知症におけるホモシステインの関連性について臨床的証拠を集めたSmithらによる最近のコンセンサス論文があることは注目に値する[80]。この論文で著者らは、認知機能障害や認知症における血漿中総ホモシステイン(tHcy)の上昇に因果関係があるとするには、実験的証拠が十分以上にあると結論づけている。逆に、ビタミンB6,B9,B12の投与はtHcyの低下をもたらし、これが脳の萎縮や認知機能の低下を遅らせるという。このように、リスクのある人たちにはtHcyのスクリーニングを行い、tHcyが高い人にはビタミンB群の補給を行うなど、公衆衛生上の対策を講じるべきであるが、補給の適切な閾値はまだ決定されていないとしている。
4.3. ポリフェノール
ポリフェノールは、アミロイドβレベルを低下させるようであるため、アルツハイマー病に対する潜在的な神経保護機能を持つ抗酸化物質である[3]。ポリフェノールは植物の二次代謝から得られ、ブドウのようないくつかの食品の皮、果肉、または種子に含まれている。これらの化合物は、その構造中に芳香環と1つ以上のヒドロキシル基(OH)が存在することを特徴としている。これらの化合物は、その抗酸化性および抗炎症性の特性により神経変性疾患の予防および治療に役割を果たす可能性がある[105]だけでなく、細胞内シグナル経路および遺伝子発現[66]やミトコンドリア増強作用[79]を調節する能力など、他のあまり知られていないメカニズムによっても役割を果たす可能性がある。異なるポリフェノールがアルツハイマー病を調節する可能性があるメカニズムは、図2と図6に要約されている。
図6 炎症シグナル伝達経路およびアミロイドβ産生への影響
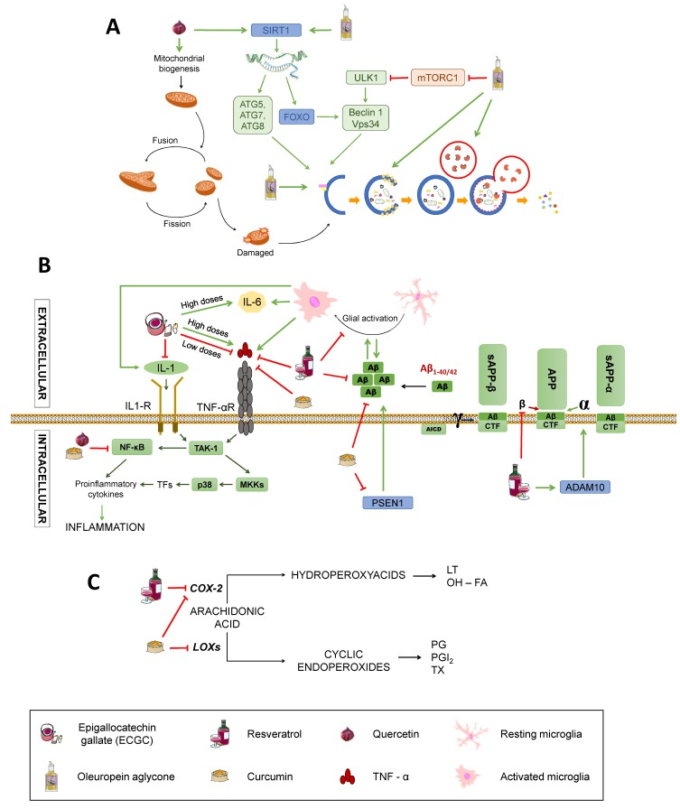
(C)プロ炎症性メディエーターの合成への影響。SIRT1:サーチュイン1。ATG:オートファジー関連タンパク質。ULK1:オートファジー活性化キナーゼ1のunc-51様。FOXO。フォークヘッドボックスクラスの “O “タンパク質。VPS34: 液胞タンパク質ソーティング34 mTORC1: ラパマイシン複合体1の哺乳類標的、TNF-α。腫瘍壊死因子α:Tumour Necrosis Factor α;TNF-αR:TNF-α受容体。IL-1:インターロイキン-1。IL-1R:IL-1受容体。IL-6:インターロイキン-6。TAK1:トランスフォーミング成長因子β活性化キナーゼ1。NF-κB:活性化B細胞の核内因子κ-光鎖エンハンサー。P38:P38マイトジェン活性化プロテインキナーゼ。MKK4:マイトジェン活性化プロテインキナーゼキナーゼ4。CDK5:サイクリン依存性キナーゼ5。APP:アミロイドβ前駆体タンパク質。 sAPPα:可溶性α-APP。ADAM10:ADAMメタロペプチダーゼドメイン10。PSEN1:プレセニリン-1。CTF:カルボキシ末端断片。AICD:APP細胞内ドメイン。C)炎症に対する効果。COX-2:シクロオキシゲナーゼ-2。LOXs(ロックス)。リポキシゲナーゼ。LT:ロイコトリエン。OH-FA:ヒドロキシ脂肪酸。PG:プロスタグランジン類。PGI2:プロスタサイクリン。TX:トロンボキサン。緑の矢印は活性化を示す。赤く切り捨てられた矢印は抑制を表す。
ポリフェノールが豊富な食品は、地中海の食生活で一価不飽和脂肪の主な供給源として使用されているエキストラバージンオリーブオイルである。エキストラバージンオリーブオイルに含まれる最も特徴的なポリフェノールの一つは、オレウロペイン・アグリコン(OLE)であり、様々な経路に介入することでオートファジーを誘導する[34](図6A)。OLEが介在するオートファジーの活性化は、生体内試験と試験管内試験の両方で、ベクリン-1,カテプシンB、p62,LC3などの特定のオートファジーマーカーの発現の増加に関係している。さらに、OLEは細胞内Ca2+の増加を媒介としたCa2+カルモジュリンキナーゼ/AMPKの活性化を介してmTORCを阻害する。前述のように、mTORCはオートファジーの阻害剤であり、その不活性化はオートファジーを誘導する。さらに、OLEはまた、SIRT1やヒストン脱アセチル化などのサーチュインを活性化することにより、オートファジー遺伝子の活性化を媒介する。SIRT1は、オートファジーを促進するNF-κB、p53,FOXOなど、脱アセチル化を介して多くの転写因子を活性化する。これらの転写因子は、オートファジー遺伝子を活性化する可能性がある。SIRT1 はまた、Atg5,Atg7,Atg8 などのオートファジータンパク質を脱アセチル化し、直接活性化する [106,107]。
しかしながら、ポリフェノールは、カテキン、エピカテキン、ケルセチン、レスベラトロール、クルクミンなどの様々な化合物を含む非常に広いグループであることを強調することが重要である。
カテキンとエピカテキンは緑茶に含まれ、その神経保護能力は、その抗酸化活性に関連付けられているフラバノールのグループに属している[108]。緑茶の主な有効成分であるエピガロカテキンガレート(EGCG)は、カタラーゼとSODの活性を高めることができるため、神経細胞の酸化ストレスを減少させ、アミロイドβの細胞毒性効果から神経細胞を保護する[10](図2参照)。また、アミロイドβはTNF、IL-1,TGBなどの炎症性分子の発現を抑制することで抗炎症作用を発揮するが、高用量ではTNFやIL-6の発現を刺激して炎症を悪化させる[109](図6B)そのメカニズムを解明するための更なる研究が求められている。さらに、金属キレートおよびフリーラジカルの封鎖活性が報告されており、抗アポトーシス作用を持つ遺伝子や MAPK、PKA、および PI3K を含むいくつかのシグナル伝達経路の調節が報告されている(Singh er al)。
ケルセチンはフラボノールのグループに属し、SODなどの抗酸化酵素をコードする遺伝子の転写を促進するため、酸化ストレスに対する重要な因子であるNrf2経路への参加に起因する神経保護特性を持っている(図2)。また、NF-κBなどの神経炎症性因子をブロックすることができ、以前に述べたように[33,109,111](図6B,C)SIRT1を活性化してオートファゴソームの内部から損傷物質を排除するオートファジーを誘導することができる。さらに、ケルセチンは、ミトコンドリアのバイオジェネシスを強化することができるように見えるので、神経細胞の変性を防ぐのに役立つ(図6A)[109]。
レスベラトロールは、スチルベン類に属するフェノール化合物である。この化合物は、酸化ストレス、炎症、または APP 処理(図 2 および図 6)などの アルツハイマー病 の病理学に関連するさまざまなメカニズムに影響を与える。それは一酸化窒素の合成を減少させ、グルタチオンのレベルを増加させることによって酸化ストレスを減少させる (図 2)。また、TNFや酵素シクロオキシゲナーゼ-2(COX-2)などのサイトカインの転写を阻害し、グリア細胞の活性化を抑制することにより、炎症を軽減する(図6B,C)[108,109]。また、β-セクレターゼ活性を阻害し[110]、既に形成されたプラークを不安定化させることで、アミロイドβ凝集体の形成を防ぐことができる(図6B)[108]。指摘されているように、レスベラトロールはまた、広く知られている抗酸化作用を発揮する。これは、レスベラトロールでの治療は、500から550グラムの重量を量るアルツハイマー病の成人雄スプラague-Dawleyラットモデルでマロンジアルデヒド(MDA)の過酸化を減少させることを示す研究と一致している[111]、MDAは、これらの動物の海馬で脂質過酸化を決定するための方法として使用されている脂質代謝に由来する生成物である(図2)。アミロイドβ誘発神経毒性に対するレスベラトロールの効果を調べるために、アミロイドβ25-35投与の30分後にレスベラトロール(100μM)を毎日注射した。その結果、レスベラトロールは、アミロイドβが媒介するMDAの過剰産生とiNOSの活性化を逆転させ、酸化ストレスを軽減する能力を示した。さらに、レスベラトロールは、SIRT1の活性化を媒介とした神経保護活性を有することが報告されており、その結果、アセチル化された形態がアポトーシスや老化を誘導するp53などのいくつかの基質が脱アセチル化されることになる[108]。SIRT1 の活性化の程度に応じて SIRT1 のバイモーダルな役割を提案する著者もおり、SIRT1 から得られる利益は議論の余地があるが(例えば、p53 を過度に阻害すると、p53 の腫瘍抑制活性が阻害され、発がんを促進する可能性がある) [107,112,113]。合理的には、他の栄養素について議論したオートファジー経路に対するSIRT1活性化の効果は、レスベラトロールにも適用可能であろう[114]。PPAR活性化およびPI3K/Nrf/KEAP経路に関与する他の細胞メカニズムは、記載されており[115]、Velmuraganらによる非常に最近のレビュー[108]に要約されている。しかしながら、LangeおよびLi [116]によって発表されたように、レスベラトロールを神経変性疾患の潜在的な治療薬として試験する臨床試験では、ブドウのようなレスベラトロールを豊富に含む食品の投与は、レスベラトロール自体の投与と比較して改善された効果があるように思われるにもかかわらず、結論は出ていない。これは、ブドウに含まれるさまざまなフィトケミカルの相乗効果によるものかもしれないが、マウスとヒトの代謝の違いや、併用薬(高齢者に非常に多い)や抗酸化物質の信頼できるバイオマーカーの欠如などの他の交絡変数のために、ヒトでの有効性の欠如が生じる可能性があることを考慮することが重要である[117]。
最後に、またクルクミン、多数の有益な効果を持っているウコンからフェノール系抗酸化物質を言及する価値がある。その抗酸化力は、その生理活性化合物(クルクミノイド)によるもので、フリーラジカルを隔離し、脂質過酸化から脳を保護する[118,119](図2)。炎症性と酸化性の両方の損傷を抑制するためにクルクミンの能力を確認するために、アルツハイマー病(Tg2576)のトランスジェニックAPPswマウスモデルを用いた研究が実施された[118]。マウスは、安楽死される前に、6ヶ月間クルクミンの高用量(5000部/百万)と低用量(160 ppm)で処理され、未処理のものは、薬剤を含まない飼料を与えられた。処理したマウスは未処理のマウスに比べて酸化タンパク質のレベルが低く、アミロイド負荷が低く、老人斑が小さかった。したがって、この物質は、炎症とペプチドアミロイドβの存在によって引き起こされる酸化的損傷の両方を減少させる。クルクミンはまた、核内因子NF-κBの転写を阻害することができるため、直接的な抗炎症活性を有する(図6B)。また、一酸化窒素の合成に関与する一酸化窒素合成酵素(図 2)を阻害することによって酸化ストレスを軽減することができるだけでなく、リポキシゲナーゼと COX-2 を阻害することによって、その合成は、プロスタグランジンとプロ炎症性ロイコトリエンを生成する(図 6C)。また、低用量のクルクミンを投与したマウスの脳内では、不溶性アミロイド断片が39%減少し、プラーク負担が43%減少した(図6B)[118,119]。さらに、クルクミンは、フリーラジカルの形成に関与し、アミロイドβ凝集を増加させるFe2+やCu2+などのいくつかの金属のキレート剤として作用することが報告されている[120,121](図2)。これにもかかわらず、著者らは、クルクミンの主な問題の一つは、経口投与後または非経口経路を介して、その低いバイオアベイラビリティを説明する可能性があり、アルツハイマー病 [121]のための無作為化比較試験での失敗の原因の一つを構成するであろう、その貧しい水溶性であることを確認した。TNF-αとカスパーゼの減少、BDNFの上昇、および異なるシグナル伝達経路との相互作用を含む、アルツハイマー病で重要であるかもしれないクルクミンの他の役割が記述されており、またVelmuruganらによって要約されている[108]。
重要なことは、これらの栄養素は単一の食品から分離されて現れることはめったになく、相対的な濃度が異なる組み合わせで見られることである。このため、いくつかの研究では、それらの効果を引き起こす可能性のある特定の栄養素ではなく、ポリフェノールが豊富な食品[79]またはポリフェノールとビタミン[69]を含むグループとしての抗酸化物質のアルツハイマー病に対する効果が報告されている。このように、緑茶や紅茶、ココア、コーヒー、ウコン、またはワインは、VisioliとBurgos-Ramosによってレビューされている[79]。一例として、緑茶にはフラボノイド、カテキン、カフェインなどの抗酸化性、抗炎症性、神経保護性の化合物が含まれており、それらの効果は相互作用の結果である可能性が高い。さらに、彼らはまた、人口の異なるサブセットで緑茶の摂取量とアルツハイマー病との関連を評価するときに得られた異なる結果を説明する可能性がある遺伝的および環境要因と相互作用する。すなわち、アジアのコホート研究では、より高い緑茶の摂取量で認知機能の低下が減少した[122]を示したが、ドイツで実施された最近の前向き研究では、緑茶内のこれらの化合物の代謝や純度の違いに起因する可能性があるが、この効果の欠如[40]を報告した。
前述の証拠の上に、エピジェネティクスのメカニズムは、いくつかのポリフェノールのために記述されている。例えば、レスベラトロールは、SIRT1とADAM10(図6B)を活性化し、おそらくSIRT3を阻害することによって、カロリー制限に似た効果を表示し、クルクミンは、減少したアミロイドβ産生[74](図6B)の結果、PSEN1の活性化を阻害する。
いずれにしても、ポリフェノールのバイオアベイラビリティおよび内部代謝の悪さは、その臨床応用に関しては大きな懸念事項であることに留意することが重要である[123]。したがって、ヒトにおけるそれらの効果を比較し、それらがアルツハイマー病の発症にどの程度の違いをもたらすかもしれないだけでなく、治療効率を保証するために製剤化を通じてこれらの問題を改善するために、より深い研究が必要である[123]。
4.4. 適度なアルコール摂取
エタノールの有害性は広く証明されている。神経障害への影響については、多量のアルコールが認知障害を促進し、海馬でアセチルコリンの放出が増加し、記憶力や注意力が低下することが確認されている[2]。さらに、エタノールの神経炎症作用は中枢性と末梢性の両方で報告されている[124]。一方で、TLR4 のノックアウトマウスはコントロールマウスと比較して炎症の増加を示さなかったという長期アルコール依存性の齧歯類モデルで得られたデータから、TLR の活性化を介した直接的なメカニズムが提案されている[125](図 7A)。一方、間接的なミクログリアの活性化は、アルコール依存症患者の死後サンプルの臨床研究で確認されている[126]が、おそらくミクログリアの表現型に影響を与えることが知られているプロ炎症性サイトカインの増加によるものである[127]。これらのメカニズムは相加的に作用し、アルツハイマー病患者のアミロイドβ病理学を増強するであろう[124]。アルコール乱用の結果としてチアミン欠乏を示すADマウスモデルを用いた前臨床研究はまた、この仮説を支持するであろうAPPとBACE1レベルの増加とともに、アミロイド斑を悪化させた証拠である[128,129]。さらに、最近の知見は、アルコール摂取がS-アデノシルメチオニン代謝に影響を与えることでエピジェネティックな効果を持つ可能性があることを示唆しており、これは慢性的な摂取時にDNAのハイメチル化またはヒストンの脱メチル化につながる可能性がある[74]。
図7 アルツハイマー病に対するアルコールの影響
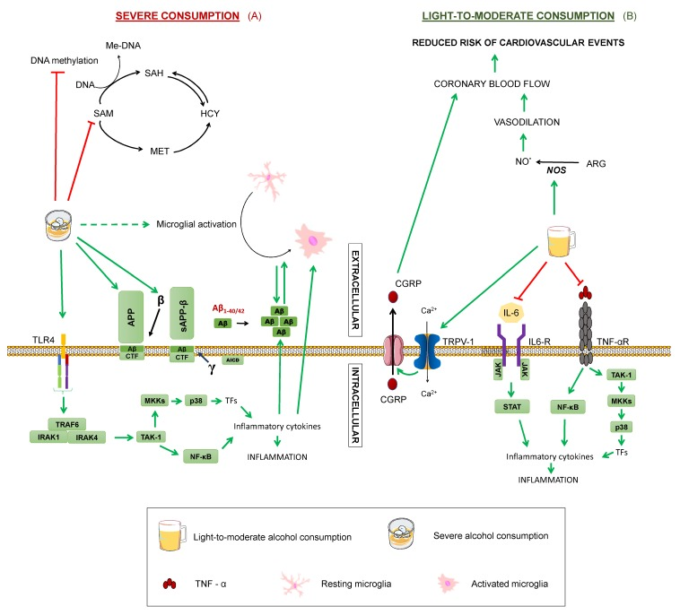
アルコールが(A)重度の消費と(B)軽度から中等度のアルツハイマー病を修飾する可能性があるプロセスのまとめ。腫瘍壊死因子α:TNF-αR:TNF-α受容体。IL-6:インターロイキン-6。TAK1:トランスフォーミング成長因子β活性化キナーゼ1。NF-κB:活性化B細胞の核内因子κ-光鎖エンハンサー。P38:P38マイトジェン活性化プロテインキナーゼ。MKK4:マイトジェン活性化プロテインキナーゼキナーゼ4。TRAF6:TNF受容体関連因子6。IRAK1:インターロイキン-1受容体関連キナーゼ1。IRAK4:インターロイキン-1受容体関連キナーゼ4。APP:アミロイドβ前駆体蛋白質。 sAPPα:可溶性α-APP。CTF:カルボキシ末端断片。AICD:APP細胞内ドメイン。MET:メチオニン。SAM:S-アデノシルメチオニン。SAH:S-アデノシルホモシステイン。HCY:ホモシステイン。THF:テトラヒドロ葉酸塩。5-MTHF:5-メチルテトラヒドロ葉酸。Me-DNA:メチル化DNA。ARG:アルギニン。NO:一酸化窒素。TRPV-1:一過性受容体電位カチオンチャネルファミリーV(バニロイド)メンバー1。CGRP:カルシトニン遺伝子関連ペプチド。TNF-α 緑の矢印は活性化を示す。緑の破線矢印は間接的な活性化を示す。赤く切り捨てられた矢印は阻害を示す。
しかし、これらの研究は重度のアルコール摂取を評価したものであることを考慮することが重要である。対照的に、いくつかの疫学研究では、認知症リスクを軽減することで、適度なアルコール摂取が有益な役割を果たす可能性があることが指摘されているが[74]、大きなばらつきが報告されているが、これはおそらく人口や個人差、飲酒パターン、性別、薬物や他の生活習慣との相互作用などの交絡因子の組み合わせによるものである[64,125]。例えば、赤ワインの適度な消費は男性の間ではアルツハイマー病の発生率が低いが、女性ではアルツハイマー病のリスクが高くなることと関連している[37]。この有益な効果は、ポリフェノールのような抗酸化物質、すなわちアントシアニンやフラバノールなどのフラボノイドとレスベラトロールやガロン酸などの非フラボノイドの複雑な混合物など、赤ワインに含まれる他の成分によって部分的に説明される可能性がある。エタノール自体が大きな役割を果たしている可能性もあるが、複数の専門家が発表したコンセンサス文書[125]に記載されているように、リスクの低減が異なるアルコール飲料全体で述べられていることから、エタノール自体が大きな役割を果たしている可能性が高いと考えられる。さらに、赤ワイン摂取による冠血流量の増加は、同量のエタノールを摂取した場合と実質的に同じであると報告されている[44]。赤ワインの女性への影響については、同じ研究で白ワインを摂取すると男性よりも女性の方が記憶力が急速に低下することが報告されている[37]ように、女性はアルコールの有害な影響を受けやすいのかもしれない。
適度なアルコール摂取が認知機能障害を予防するメカニズムについては、まだ知見にはいくつかのギャップがある。エタノールは心筋血流を増加させることで心血管イベントのリスクを軽減する心保護効果を発揮することが実証されている[47,130](図7B)。エタノールの血管拡張作用は、一酸化窒素合成酵素の活性化と、神経末端に存在するカルシトニン遺伝子関連ペプチド(CGRP)を活性化する一過性受容体電位バニロイドタイプ1を刺激する能力に起因している。まさにこの血管拡張ペプチドであるCGRPこそが、冠血流量の増加につながるのである。脳循環障害は認知機能障害の素因となるため、脳血管リスクに対するエタノールの予防効果は、アルツハイマー病のような認知症から保護する可能性がある[47]。さらに、エタノールの適度な摂取は、インターロイキン6,フリブリノーゲン、腫瘍壊死因子などの炎症性メディエーターを減少させ、抗炎症作用を発揮することがコホート研究で示されている[47,130]。最後に,0.02-0.08%濃度のエタノールで処理した培養海馬および皮質ニューロンの研究では、アミロイドβおよびシヌクレインによって誘発されるシナプス損傷が減少したことが証明されている[131]。
それにもかかわらず、適度なアルコール摂取の保護効果を分析するためには、使用するアルコールの種類を特定する必要があるため、より多くの研究が必要であり、質的および量的な組成はアルコール飲料によって異なり、相乗作用または拮抗作用を否定することはできない[2]。例えば、赤ワインに含まれるレスベラトロールとエタノールは、一酸化窒素合成酵素である一酸化窒素合成酵素に対して、前者は酵素を阻害し、後者は酵素を活性化するという相反する作用を示している[47,111](図2,図7)。このように、特にアルコールの潜在的な有害作用と被験者や研究間で見られる広い変動性を考慮すると、認知障害を予防する方法として禁欲的な人にアルコールの適度な消費を推奨するには十分な科学的証拠がないことを示すことが重要である[130]。
4.5. トレハロース
トレハロース(TRH)は、酵母、昆虫、植物、細菌に存在する二糖類である。それがアルツハイマー病の病理学に役立つかもしれないメカニズムはとらえどころのないままであるが、いくつかの関連する結果が記載されている(図8)。例えば、TRHはアミロイドβ凝集を抑制し、C57BL/6J 8ヶ月齢のトランスジェニックAPP/PS1マウスと野生型の継代マウスの表現型をレスキューすることが証明されている[132,133]。また、TRHは、細胞内標的に作用してオートファゴソームの生成を促進し、LC3-IIの増加に反映されるようにオートファゴソームの生成を促進することから、mTOR阻害とは無関係にオートファジーの強力な誘導因子であると考えられている。これに関連して、TRHはリソソソームの恒常性を調節する分泌成長因子であるプログラヌリン(PGRN)を増加させることが報告されており、主にその遺伝子であるGRNの発現をアップレギュレーションすることで、オートファジーのフラックスを増加させることが報告されている[134]。これらの研究は、患者由来のニューロンと、GRNハプロ不全マウスの生体内試験モデルで行われた。重要なことに、PGRNの欠損は、アルツハイマー病を含むさまざまな神経変性疾患と関連しており、PGRNの過剰発現はADマウスモデルにおいてアミロイドβの毒性と蓄積を減少させることが実証されている[134,135]。
図8 トレハロースのアルツハイマー病への影響
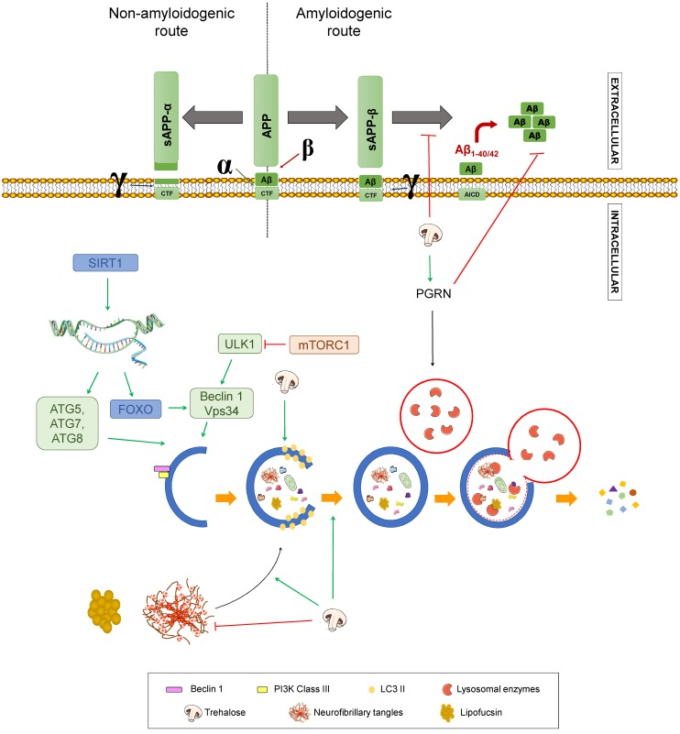
トレハロースがアルツハイマー病を修飾する可能性があるプロセスのまとめ。APP:アミロイドβ前駆体タンパク質。 sAPPα:可溶性α-APP。CTF:カルボキシ末端断片。AICD:APP細胞内ドメイン。SIRT1:サーチュイン1。 ATG:オートファジー関連遺伝子。ULK1:オートファジー活性化キナーゼ1のnon-51様。FOXO。フォークヘッドボックスクラスの “O “タンパク質。VPS34: 液胞タンパク質ソーティング34 mTORC1: ラパマイシン複合体1の哺乳類標的。緑の矢印は活性化を表す。赤く切り捨てられた矢印は阻害を示す。
さらに、このトレハロース媒介オートファジー活性化は、リポフスチン、アルツハイマー病患者に見られるリソソーム貯蔵物質をクリアする。アミロイドβ病理学のもう一つのポイントは、TRHがAPPの輸送と代謝を変化させるように思われることである[136]。具体的には、トレハロース投与時には、酵素を阻害することなく、γ-セクレターゼの切断が阻止される。このように、CTFは再分配され、γ-セクレターゼが主に存在するエンドリソソームコンパートメントに到達する量が減少すると結論づけられている[136,137]。アルツハイマー病の病理学の他の側面については、この二糖は媒体からのタウタンパク質の取り込みを増加させ、リソソソームによるその分解を促進し、その結果、アルツハイマー病のマウスモデルではタウ凝集体を減少させる[133,138]。さらに、抗酸化性および抗炎症性の特性が試験管内試験および生体内試験でTRHについて記述されており、これらのプロセスに起因するアルツハイマー病の病因を緩和することに貢献する可能性がある[139,140]。最後に、TRHは化学的シャペロンとして作用し、タンパク質の凝集体の形成を回避し、その分解を促進することができ、それゆえに、ユビキチン-プロテアソームシステムのアップレギュレーションを介して凝集体が減少したとはいえ、アルツハイマー病のようなタウオパチーにおけるその神経保護効果[134,141]、[136]。これらのメカニズムは図8に示されている。
4.6. コレステロール、飽和脂肪、トランス脂肪、または水添脂肪
コレステロールは、細胞膜、リポタンパク質、ステロイドホルモンの必須成分を構成する脂質である。いくつかの著者は、飽和脂肪(SFA)が豊富で、不飽和脂肪の低い食事は、肝臓のLDL受容体の発現を減少させることにより、高密度リポタンパク質レベル(HDL)の減少と低密度リポタンパク質(LDL)の増加を生成することを確認している。これは、アルツハイマー病の病態に何らかの影響を与え、直接的にも間接的にも心血管疾患のリスク増加を介している[2,53,66,142]。
ヘミ接合型二重変異体PS1/APPマウスを用いて、コレステロール生合成の最終段階である7-デヒドロコレステロール-D7-リダクターゼという酵素を阻害してコレステロール値を低下させる薬剤であるBM15.766[(4-[2-[1-(4-クロロシンナミル)ピペラジン-4-イル]エチル]安息香酸]]を1日250mg/kg経口投与したADモデルの研究が行われた。マウスモデルは、家族性アルツハイマー病変異体、ヒトAPP K670N、M671L(ラインTg2576)を発現するヘミ接合体トランスジェニックマウスと、ヒト家族性、変異体PS1M146Vを発現するマウスのホモ接合体ライン(ライン8.9)とを交配することにより得られた[143]。彼らは、マウスの脳内でアミロイドβ1-40とアミロイドβ1-42の両方の平均値の低下を観察した。また、この誘発された低コレステロール血症は、α-およびγ-セクレターゼの開裂生成物を増加させ、非アミロイド化経路を強化したことから、マウス脳内のアミロイドβペプチドの減少は、これらのAPP処理の変化によるものであることが示唆された。これらの結果は、60歳以上の3つのタイプのアルツハイマー病患者の有病率をいつもの薬で細分化して比較した他の横断的解析と一致している。(1)全人口、(2)スタチン系薬剤(コレステロール合成に関与する酵素であるHMG-CoA還元酵素の阻害剤)を投与されている患者、(3)高血圧や心血管系の問題を軽減するために他の薬剤を投与されている患者の3つのタイプのアルツハイマー病の有病率を比較する他の横断的分析と一致している。この研究では、Wolozinらは、スタチン系薬剤(ロバスタチンまたはプラバスタチン)を投与されている患者は、アルツハイマー病有病率が69.6%減少したことを観察した。興味深いことに、スタチン投与を受けた患者のみが、高血圧や心血管疾患の治療に他の薬物を使用した患者と比較して、このタイプの認知症の有病率が低いことが示された;しかし、この分析の限界は、これらの患者に投与された薬物の正確な投与量が報告されていないことである[144]。
認知症におけるコレステロールの役割に関する臨床研究はいくつかある。Ansteyらは最近のメタアナリシスで、中年期の総血漿コレステロール値が高い(>6.5mmol/L)ことが後年のアルツハイマー病の危険因子となる可能性があると結論づけている[145]。この考えを支持するWangらは、軽度の認知障害を有する患者におけるコレステロール値の上昇を報告している[146]。それにもかかわらず、コレステロールに関連するリポタンパク質の異なるサブセットや異なる集団グループを考慮した研究が、これらの知見を検証するために必要である[145]。この点では、HDLレベルと認知症との関連性の可能性を扱った研究は不明確であるが、KochとJensenによる最近のレビュー[147]では、中程度から大規模なサンプルサイズの研究でHDLレベルと認知症のリスクとの間に逆相関があることが示唆されていると指摘されている。
コレステロール低下戦略としてのスタチンの使用と、それが認知症の発症に及ぼす影響に関する今後の長期的なデータは、アルツハイマー病発症におけるコレステロールの重要性についていくつかの光を当てるかもしれない[145]。しかし、最初のスタチンは1980年代後半に商業化され[148]、これらのデータを収集するには、コレステロール血漿中濃度を考慮して2~3十年の追跡調査が必要である[145]ため、短期でこれらのデータを得ることは意外なことである。また、循環から脳へのコレステロールの取り込みは血液脳関門によって阻止されるため、24-ヒドロキシコレステロールや27-ヒドロキシコレステロールなどのコレステロール代謝物が脳内のコレステロールレベルのより適切な代用品である可能性があることを強調する価値がある[146]。
注目すべきことに、アポリポ蛋白Eはコレステロール代謝において基本的な役割を果たしており、心血管疾患および認知症と広く関連しており、APOE ε4対立遺伝子はアルツハイマー病発症の主要な危険因子であることが提案されている[149,150,151]。実際、APOE ε4キャリアは脳内でアミロイドプラークおよびリン酸化タウを増加させ、ミトコンドリア機能不全またはミトコンドリア運動性の障害などの他のプロセスに関与している可能性がある;特定のメカニズムはまだ議論中であるが[150]、心血管疾患とは無関係にコレステロールレベルとアルツハイマー病の間のリンクを構成している可能性がある。これに伴い、コレステロール代謝異常はアルツハイマー病の重要な特徴として述べられている。実際、脳脊髄液中の前述のコレステロール代謝物のレベルは、アミロイドβ42,総タウ、またはリン酸化タウと組み合わせて、潜在的なアルツハイマー病バイオマーカーとして提案されている[146]、24-ヒドロキシコレステロールは、アストロサイトにおけるAPOEの増加、およびアルツハイマー病被験者におけるアミロイドβおよびタウレベルと関連しており、一方、27-ヒドロキシコレステロールは、高コレステロール血症およびアルツハイマー病にリンクされている[152]。
最後に、コレステロールの脂質性のため、以前に議論されたように、酸化を含む他の脂質と同じような修飾を受ける可能性があると予想され、アルツハイマー病の病理に関連する潜在的なメカニズムである[23,24]。酸化されたコレステロールは、マクロファージのリクルートと補体の活性化を介して老人性プラークの蓄積と炎症に役割を果たしている可能性がある[153]。
飽和脂肪とトランス脂肪に関しては、利用可能な証拠は飽和脂肪の食事摂取量の増加に伴うアルツハイマー病発症リスクの増加を示唆しているが、トランス脂肪の摂取量とアルツハイマー病リスクに関する研究は決定的ではない[66]。Barnardと共同研究者によるレビューでは、飽和脂肪の摂取は大多数の研究でアルツハイマー病および認知機能の低下と正の相関があった[154]。トランス脂肪酸を用いた研究は頻度が低く、このレビューでは混合した結果が報告されている。
4.7. アルツハイマー病を調節する栄養素を含む食品
最後に、食生活に取り入れることを目的とする場合には、これまでに議論されてきた栄養素を含む食品を検討することが重要である。表1は、提案されている栄養素のそれぞれについて、栄養価の高い食品の概要を示している[155,156]。最後に、食事介入の潜在的な有益な結果は、単一栄養素や単一食品の補給よりも、食事パターンの変化が原因である可能性があることを強調しすぎてはならない。
表1 アルツハイマー病に介入する可能性のある栄養素を含んだ食品
| 栄養素 | 食品 | |||
|---|---|---|---|---|
| DHA | オイリーフィッシュ サーモン |
ナッツ クルミ、アーモンド |
卵黄 | |
| ビタミンA | ミート チキン、ターキー、ビーフ |
野菜 にんじん、ブロッコリー、さつまいも、かぼちゃ、ほうれん草 |
酪農 牛乳、チーズ |
フルーツ メロン、アプリコット、パパイヤ |
| ビタミンCとE | スイスチャード | クランベリーとスグリ | ブラックオリーブ | |
| ビタミンB12 | 肉 豚、牛レバー |
魚 サーモン、イワシ、サバ、アサリ |
卵 | |
| ビタミンB9 | ミート チキン、ビーフ |
野菜と豆類 ほうれん草、レンズ豆、大豆 |
卵黄 | |
| Vitamin B6 | ミート チキン、ターキー、ビーフ、ポーク |
野菜と果物 ほうれん草、グリーンピース、ブロッコリー、アスパラガス、バナナ |
魚 サーモン |
ナッツ ヒマワリの種、ヘーゼルナッツ、カシューナッツ |
| EGCG | 緑茶 | ブラックベリー | 林檎 | |
| ケルセチン | ケーパー | ダークチョコレート | 赤タマネギ | クローブ |
| レスベラトロール | 赤ワイン | ベリー ブラックベリー、ラズベリー、カラント |
ダークチョコレート | ナッツ クルミ、ピーナッツ |
| オレウロペインアグリコン | エクストラバージンオリーブオイル | |||
| トレハロース | きのこ | |||
5. 結論
今回のレビューでは、アミロイドβ蓄積、タウの高リン酸化、酸化ストレス、炎症、オートファジーなどの様々なプロセスに対する栄養素の作用により、アルツハイマー病に対する食事療法の潜在的な調節効果を示す最新の科学的証拠を収集した。全体として、この証拠は、これらの患者やアルツハイマー病発症のリスクのある集団において栄養介入が果たすかもしれない関連する役割を明らかにし、健康維持における食事パターンの重要性を改めて明らかにした。
これらの栄養素を含む食品を早期に摂取するか、あるいはそのような食品を含む特定の食事パターンを守ることが、アルツハイマー病の予防法として有用であるかどうかを明らかにするためには、さらなる研究が必要である。栄養素がアルツハイマー病の神経変性につながる過程に直接的または間接的な影響を与えることは明らかであるが、これらの影響が実際に疾患の変調にどの程度影響を与えるのかは不明である。
したがって、これらの集団における長期的な食事介入の効果を分析することが極めて重要であり、特にアルツハイマー病は最初の症状が現れる何年も前に発症することを考慮して、疫学的な縦断的研究を実施すべきである。
さらに、それは有益な作用を発揮するために必要な各栄養素の量を推定することに今後の研究に焦点を当てることが不可欠であり、特にこれらは、毒性用量、食品-薬物相互作用、およびアルツハイマー病のために特別に最適化された食事になる可能性がある定義された組み合わせから生じる理想的な相乗効果に関する情報とともに、食事の基準摂取量にこれらを参照してほしい。
