Modeling of SARS-CoV-2 Treatment Effects for Informed Drug Repurposing
www.ncbi.nlm.nih.gov/pmc/articles/PMC7988345/
Charlotte Kern, 1 , 2 , † Verena Schöning, 1 , † Carlos Chaccour, 3 , 4 , 5 and Felix Hammann 1 ,*.
概要
コロナウイルス感染症2019(COVID-19)の対策として,いくつかの再利用医薬品が現在検討されている。しかし、COVID-19ではその期待に応えることができなかった。In vitroの実験で使用される細胞株は、必ずしも肺組織を代表するものではない。また、仮に提案された作用機序が本当に正しいとしても、生体内でのウイルスの動態、宿主の反応、濃度時間プロファイルなども考慮しなければならない。
ここでは後者の問題を取り上げ,ヒトSARS-CoV-2ウイルスの動態と後天性免疫応答のモデルを用いて,ヒドロキシクロロキン,ロピナビル/リトナビル,イベルメクチン,アルテミシニン,ニタゾキサニドの投与時期と投与レジメンが与える動的な影響を調べた。診断時に直ちに治療を行うことで、最大の効果が得られた。
抗ウイルス効果の低い介入であっても、タイミングが合えば宿主の曝露を減らすことができる。イベルメクチンは少なくとも部分的には効果があるようで、陽性時に投与することで、ピーク時のウイルス量は0.3~0.6 log unit減少し、曝露量は8.8~22.3%減少した。
他の薬剤はほとんど効果がなかった。ヒドロキシクロロキンとロピナビル/リトナビルの過去の臨床試験結果が、今回提示したモデルで十分に説明できることから、今後の薬剤候補の優先順位付けにおいても同様の戦略を検討すべきである。
キーワード
COVID-19,疾患モデル、リパーパス、ウイルス動態、ファーマコメトリクス
はじめに
重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)の世界的なパンデミックが始まって以来、様々な薬物療法が提案されてきた。あるものは専門家の意見に基づき,あるものは有望な試験管内試験の結果に基づき,あるものは慈悲深い,あるいは適応外の治療によるケースシリーズの知見に基づいている。残念ながら、無作為化臨床試験という厳格なプロセスを経るたびに、実際の世界での明確な効果を示す証拠はほとんど残っていない。
新型新型コロナウイルス019(COVID-19)は、宿主から宿主へだけでなく、それぞれの宿主の中でも急速に拡散する。個々の患者では驚異的なスピードで感染が進行し、2~3日後に感染力を持ち、逆転写酵素ポリメラーゼ連鎖反応(RT-PCR)検査が陽性になってからわずか数日でウイルス量がピークに達することもある(To er al 2020)。感染症の治療を成功させるためには、薬物療法を早期に開始することが重要であると認識されており、COVID-19も例外ではなさそうである(Gonçalves er al 2020)。
確立されたサプライチェーンと低い製造コストを持つ薬剤を再利用することは、タイムリーな薬理学的介入に向けた最も直線的な道であると思われる。COVID-19の病態生理についての理解はまだ進んでいないため、実行可能な候補の選択は、ほとんどが試験管内試験およびin silicoの証拠からの推定によって決定される。ウイルスの構造的スパイク(S)タンパク質、宿主の2型膜貫通セリンプロテアーゼ(TMPRSS2)タンパク質分解を媒介する3-chymotrypsin-like(3CL)プロテアーゼ、RNA依存性RNAポリメラーゼ、インターロイキン6受容体などが薬剤の標的として特定されている(Arshad et al 2020,Sanders et al 2020)。
臨床薬理学の基本的な考え方では、結合していない薬物は、十分な濃度(例えば、半最大有効標的濃度(EC50))で標的に到達し、それを維持しなければ効果を発揮しないとされている。これは薬の候補を選ぶ際の一般的な基準であり、COVID-19にもよく行われた包括的な調査で早くから適用されていた(Arshad er al 2020)。残念ながら、成功確率の高い候補は実際にはほとんど失敗しており、EC50に到達するかどうかだけでなく、(EC50以上の)濃度を特に標的部位でどれだけ長く維持できるかが重要なこの疾患では、EC50のアプローチは単純すぎるのではないかと考えられている。
その理由の一つは、宿主の要因を考慮していないことである。例えば、治療反応の重要な要素として、宿主の免疫がある。免疫反応とセロコンバージョンの時間的なダイナミクスに関する生体内試験の研究がある(Long er al)。 短期間であってもウイルス量を早期に抑制することは、宿主が防御を行う時間を増やし、圧倒的な感染を解消するのに役立つと考えられる。
インフルエンザ、C型肝炎、エボラ出血熱など、いくつかの疾患のウイルス動態は、過去に数学的に記述することに成功している(Beauchemin and Handel, 2011; Canini and Perelson, 2014; Oakes er al)。 COVID-19について、Kimらは標的細胞限定モデルを用いて、治療の早期開始と薬剤の作用様式の重要性を示している(Kim et al 2020b)。他の著者は、日食モデルで同様の結果に到達している(Czuppon et al 2020,Gonçalves et al 2020,Hernandez-Vargas and Velasco-Hernandez 2020)。しかし、これらの研究のいずれも、モデルに薬物動態プロファイルを直接使用していなかった。
今回のモデリングおよびシミュレーション研究では、COVID-19の急性期において、異なる作用機序、濃度プロファイル、投与スケジュール、介入のタイミングが、ウイルス量の主要パラメータ(ピークロード、陽性期間、曲線下面積(AUC)で測定される総曝露量)に与える影響を理解することを目的とした。公開されている患者データからSARS-CoV-2の宿主内ウイルス動態モデルを構築し,異なる用量レジメンの薬剤の薬物動態(PK)プロファイルをシミュレーションすることで,抗ウイルス効果を導き出した。これらの薬剤には、ヒドロキシクロロキン( ヒドロキシクロロキン、ウイルスの侵入を阻止すると考えられている)リトナビルでブーストしたロピナビル(LPV/r、3CL阻害剤)イベルメクチン(IVM、抗ウイルス活性を持つ広域駆虫薬)が含まれている。ニタゾキサニド(NZT:抗ウイルス活性を有する抗寄生虫剤)アルテミシニン(ART:サツマイモの主成分で、SARS-CoV-2のウイルス侵入と細胞内での繁殖を阻害すると考えられている)(Caly er al)。 , 2020; Choy et al 2020; Gordon et al 2020; Li et al 2005; Liu et al 2020; Wang et al 2020a; Wu et al 2020)。) 我々の選択は、認識されている研究上の関心( ヒドロキシクロロキン、LPV/r、NZT)と、セルフメディケーションとして一般に使用されている薬剤( ヒドロキシクロロキン、IVM、ART)に影響された(Martins-Filho er al 2020; Molento 2020; Nordling 2020; Owens 2020; WHO 2020)。レムデシビルはこれまでのところ最も期待されているが、今回提案したモデルでの薬理シミュレーションを可能にするだけの公表データは現在のところないので、この薬剤は含まれなかった(Beigel et al 2020)。
方法
データソース
COVID-19患者のウイルス動態プロファイルは、シンガポールの4つの病院で最初の患者(n = 18)を追跡した研究であるYoung et al 2020)から感染した(中国国民:n = 16,シンガポール居住者:n = 2)。デジタル化ソフトを用いて値を読み上げた。ほとんどの患者(n=13)は特定の治療を受けておらず、解析に含まれた。ウイルス量は、鼻咽頭ぬぐい液からRT-PCR法で測定し、サイクル閾値(Ct)値で示した(Young et al 2020)。Ct値とウイルス量の相関関係は実験室や分析条件によって異なるため,モデルの出力と観測されたCt値を,公表されている回帰フィットを用いて関連付けることにした(Chu er al 2020).感染した時間が記録されていないため、この値は推定する必要があった。潜伏期間は患者ごとに異なるが、すべての患者について平均潜伏期間を5日とするとよく適合した(Lauer er al)。 陽性の閾値は、101.58コピー/mlに対応する35サイクルに固定した(Wang et al 2020b)。
ウイルスのキネティクスモデル
標準的な標的細胞限定モデルでは、ウイルス粒子Vは、細胞感染率βで感受性(標的)細胞Tのプールに感染する。 感染した細胞Iは、生産率pでウイルス粒子を排出し始める(Canini and Perelson, 2014)。パラメータcとδは、それぞれウイルスのクリアランスと感染細胞の細胞死の速度を決定する。時間に依存した感受性細胞数(式(1))感染細胞数(式(2))ウイルス量(式(3))は、次のような常微分方程式系で記述される。
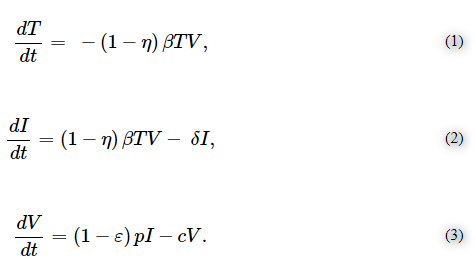
異なる作用機序による薬理学的治療の効果は、次の変数によって記述される:ウイルスの感受性細胞への侵入の抑制、効果ηによる細胞感染率の低下、および/または効果εによる感染細胞内のウイルス産生率の阻止。 我々は、ある時間における薬物の濃度をC(t)とし、シグモイドEmaxモデル(式(4))を用いて、それぞれの標的に対する薬物のIC50またはEC50値に基づいて治療効果をモデル化した。
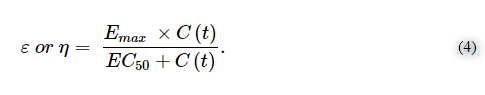
また、日食モデルも検討した。日食モデルとは、感染した細胞がウイルスを排出し始めるまでの平均期間k-1の間、日食期(E)に入るという拡張モデルである。初期条件は次のように設定した。
また、日食モデルでは

ここで、T0は感受性細胞の数を1×105に固定し(事前のモデル化に基づき、SARS-CoV-2の主な侵入口であるACE2を発現している肺胞細胞の約1%を占める)(Baccam et al 2006;Li et al 2020b)V0は接種時の初期ウイルス量(1×100コピー/mlに固定)E0は日食状態の細胞数とした。宿主内再生産数R0は3.79とした(Li er al 2020a)。この値も、他の宿主内ウイルス動態モデルとほぼ同じ範囲である(Kim et al 2020b;Hernandez-Vargas and Velasco-Hernandez 2020)。他のパラメータは、数値最適化によって推定する必要がある。すなわち、ウイルスのクリアランスc、生産率p、および感染細胞の死亡率δである。ウイルスの細胞感染率βは、動的に計算される。

補足表S2にモデルの全パラメータと出典を示する。
免疫応答
SARS-CoV-2の免疫についての理解はまだ進んでいない。免疫には、細胞が不応性の状態になることや、抗体を介してウイルスのクリアランスが増加することなどが考えられる。しかし、このような状態を追加すると、モデルの複雑性が増し、データの裏付けが得られなくなる。そこで、後天的な免疫反応を、ウイルスクリアランスに対する時間依存性の共変量として設定することにした。時間的なダイナミクスは、Long et al 2020)が重慶(湖北省の隣)の3つの病院で285人の患者を対象にIgMとIgGのセロコンバージョンを評価した結果に基づいている。データはデジタル化ソフトウェアを用いて抽出し、シグモイドEmaxモデルに適合させた。SARS-CoV-2感染症における免疫反応の効果の大きさ(Emax, immunity)は不明であるため、ウイルスの動態モデルと合わせてこの値を推定した。
薬物動態モデル
公表されている集団薬物動態モデルを用いて, ヒドロキシクロロキン,IVM,LPV/r,ARTの薬物動態(PK)をシミュレーションした。 ヒドロキシクロロキンのプロファイルは、Lim et al 2009)が報告した健康なボランティアからシミュレーションした。IVMモデルは、Duthalerらから引用し、fed state dosingを用いてシミュレーションした(Duthaler et al 2019)。Dickinson et al 2011)によるLPV/rモデルは、WHO Solidarityで検討されていた用量である400/100mgを投与した健康なボランティアのデータから構築した。ARTについては、Birgerssonらが開発したモデルを健康な男性ボランティアに1日500mgを5日間投与するという投与法で直接実施した(マラリアにおける過去の投与推奨量と同様)(Birgersson et al 2016)。NTZについては、公表されている薬理学的モデルはない。本剤は迅速かつ完全に加水分解され、活性代謝物であるチゾキサニド(TZ)になる。そこで、メキシコの健康なボランティアを対象とした研究からTZの平均的な薬物動態プロファイルをデジタル化ソフトウェアで抽出し、ラグタイムを考慮した1コンパートメント経口吸収モデルを当てはめ、これをシミュレーションに用いた(Balderas-Akata er al)。
薬物のタンパク質結合画分は標的と相互作用しないと考えられるため,薬物の非結合画分のみを利用可能とした(Supplementary Table S2)。すなわち, ヒドロキシクロロキンの50%(Furst, 1996),IVMの7%(Klotz et al 1990),NTZの1%(FDA, 2005),LPVの1%(Boffito er al)。 本研究のいずれの薬剤においても、肺濃度に関するヒト生体内試験データは存在しない。血漿と肺の濃度プロファイルの違いを調整するために、文献に基づいた近似値を用いた。肺組織濃度の問題は ヒドロキシクロロキンでは特に議論の的となっており、マカクでは肺:血漿の比が27から 177に及ぶという報告もある(Maisonnasse et al 2020)。最近の証拠では、COVID-19では ヒドロキシクロロキンの血漿濃度がより代表的であることが示唆されている(Fan et al 2020)。IVMの肺への蓄積については、Lifschitzらが発表した牛のデータを使用した。このアプローチは、COVID-19におけるIVMの潜在的な役割について議論している別の出版物でも使用されている(Lifschitz et al 2000; Schmith et al 2020)。肺組織中のLPV濃度は血漿中の1.78倍と仮定し、タンパク質結合率は99%とした(Atzori er al)。 NTZについては、最近発表された生理学に基づく薬物動態(PBPK)モデルによる肺分配の推定値を用いた(Rajoli er al)。
薬力学的効果
ヒドロキシクロロキンの有効性は、Liu et al 2020)によりVero E6細胞で試験管内試験で示された。48時間後のEC50値は、接種量に応じて4.06~12.96μMの範囲であった。これらの値の平均値(8.51µM)を細胞感染率低下効果βとして入力した。投与量は,Gautretらが提案した200mg q8hを10日間,WHO Solidarity試験で以前に採用されたスキームである,初日に800mg q12h(ローディングドーズ),2~10日目に400mg q12hをシミュレーションした(Gautretら,2020;WHO,2020)。
IVMについては、RNAヘリカーゼの阻害とニコチン性アセチルコリン受容体(nAChR)の阻害という2つの薬力学的効果を想定した。IVMのヘリカーゼ阻害作用は,黄熱病ウイルス(YFV,IC50 0.12 µM),デング熱ウイルス(デングウイルス,IC50 0.5 µM),ウエストナイルウイルス(WNV,IC50 0.35 µM)などのflaviviridaeで報告されている(Mastrangelo er al)。 SARS-CoV-2の試験管内試験データはまだないが、Caly et al 2020)は、Vero E6細胞株において、IC50が約2 µMとなり、ウイルスの複製を強く最大抑制したと報告している。デングウイルスの複製を同様に阻害するためには、より高い濃度(10~25µM)を達成する必要がある(Wagstaff et al 2012)。マイクロモル濃度の達成が難しいことから、COVID-19の文脈ではIVMは薬効がないと推測する著者もいる(Bray et al 2020)。印象的なのは、デングウイルスに感染したVero E6細胞でのIC50が高いにもかかわらず、デングウイルス患者にIVM 3×400μg/kgを投与した小規模な試験では、生体内試験での抗ウイルス効果が実証されたことである(Yamasmith et al 2018)。Vero E6細胞におけるSARS-CoV-2のIVMに対する感受性がデングウイルスよりも高いことから、シミュレーションでは、ウイルス産生pに対する抑制的な影響として、保守的に低減したIC50 0.1 µMを使用した。
また、IVMはnAChR(IC50 156 nM)と相互作用する(Degani-Katzav er al 2017)。nAChRを阻害することで、アンジオテンシン変換酵素2(ACE2)の発現をダウンレギュレートし、その結果、SARS-CoV-2の侵入ポイントを減少させるという仮説が立てられている(Oakes et al 2018)。我々は、これを細胞感染率βに対する正味の阻害効果として入力する。 ウイルスの侵入を直接阻害するのとは対照的に、これは宿主によって媒介される抗ウイルス活性であるため、試験管内試験アッセイでは容易に捉えることができない。IVMでは、300µg/kgおよび600µg/kgを24時間×3日間で評価した。これらの用量は承認されていないが、120mgの単回固定用量の安全性と忍容性が健康なボランティアで示されている(Guzzo et al 2002)。
LPVとRTVはともにプロテアーゼ阻害剤である。COVID-19での使用は、WHOの連帯試験(LPV 400mgとRTV 100mgを14日間、12時間ごとに投与)のうち、現在は中止されているものとして検討された(WHO 2020)。LPVはSARS-CoV-2のウイルスRNAコピーを試験管内試験でEC50が26.1μMで減少させたが、RTVはEC50>100μMであった(Choy er al 2020)。このコフォーミュレーション(LPV/r)におけるRTVは、LPVのバイオアベイラビリティを高めることのみを目的としているため、ウイルス産生率pに対するLPVの抗ウイルス効果のみを考慮する(Chandwani and Shuter, 2008)。
A. annua(sweet wormwood)抽出物の主成分であるARTは、SARS-CoV-2では研究されていない。Nairらは、Vero E6細胞において、SARS-CoV-2に対するアルテシミニンの抗ウイルス効果を報告しており、そのEC50は19.8μg/ml(=70μM)であった(Nair et al 2021)。研究によると、アルテシミニンはスパイクタンパク質との相互作用によってウイルスのエントリーを妨げるが(Sehailia and Chemat, 2020)感染のポストエントリーステップにも影響を与える(Cao et al 2020b; Nair er al)。 これを、ウイルス生産率pと細胞感染率βへの影響として入力した。
NTZは、Vero E6細胞のSARS-CoV-2に対して試験管内試験でEC50 2.12 µMの活性を示している(Wang et al 2020a)。作用機序は明らかではないが、NTZは複製だけでなくウイルスの侵入も阻害するという仮説が立てられている。シミュレーションでは両方の効果を利用した(Arshad er al 2020)。
ソフトウェア
Pkanalixと、Monolix(バージョン2019R2,…www.lixoft.com、Antony、France)と連携するためのRパッケージであるmlxR(バージョン4.1.3)を用いて、薬物動態プロファイル� R(version 3.6.3, R Foundation for Statistical Computing, www.R-project.org, Vienna, Austria)を用いて行った。常微分方程式(ODE)系とパラメータの推定は,RパッケージのdeSolve(バージョン1.28)とdfoptim(バージョン2018.2-1)を用いて実装した。
結果一覧
ウイルスキネティクスモデル
Youngら(n = 13,Supplemental Material)が発表した未治療患者のウイルス負荷プロファイルを使用した(Young et al 2020)。我々は、報告されたセロコンバージョンデータに適合したシグモイドEmaxモデルに続いて、ウイルスクリアランスcに時間的に変化する効果を持つ、標的細胞限定モデルおよびエクリプスモデルを評価した(Long er al 2020)。Nelder-Mead法による個々のプロファイルからの平均化されたパラメータ推定値は以下の通りであった(補足表S1および補足図S1も参照)。
- ウイルスクリアランスc:5.07
- 産生率p:10.2,
- 感染した細胞の死亡率δ 0.54,および
- クリアランスに対する免疫効果の最大値 Emax,immunity: 57.0.
これらのモデルを非線形混合効果で実装した場合、初期推定値の変化に対するロバスト性が低く、また数値的な同定可能性の問題に悩まされた。
プロファイルは、標準的な標的細胞限定モデルで最もよく説明された。日食期を追加しても適合性は改善されず、別の研究ですでに指摘されているように、識別性の問題も生じた(Hernandez-Vargas and Velasco-Hernandez, 2020)。未処置のままでは、ウイルス負荷は、5.4dpiでRT-PCRの陽性限界である35サイクルを超え、10.2dpiでCt値28.4サイクルでピークに達し、18.9dpiで陽性限界を下回ったが、これは臨床研究からの報告と同様である(Kim et al 2020a;Lauer et al 2020;To et al 2020)。ウイルスの総曝露量(AUCとして測定)は12’003日*log(copies/ml)であった。
治療の投与量と効果
治療の時間的な影響は、図1の個々の曲線として示されている。曲線下面積(AUC)の差、持続時間の相対的変化、およびピークサイクル(Ct)の変化としてのウイルス暴露に対する効果を図2に示した。ピークウイルス量および罹患期間の変化を含む全結果は,補足表S3および補足図S2に掲載されている.治療法のPK曲線と、SARS-CoV-2ウイルスの動態に対する対応する効果は、補足図S2〜S5に示されている。
図1 異なる治療レジメンと治療開始後のSARS-CoV-2のウイルス負荷プロファイル
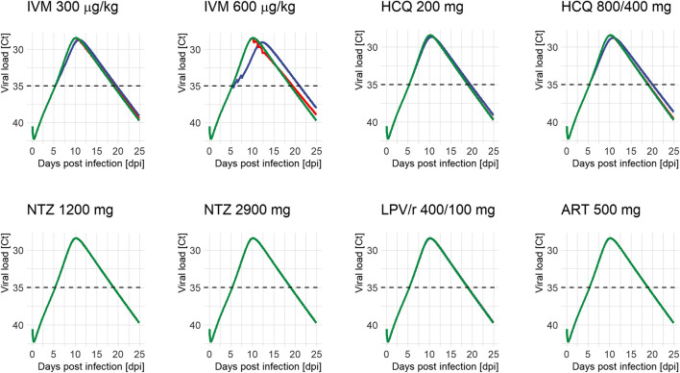
(緑:未治療、青:陽性時(感染後5.4日目)赤:ピーク時(感染後10.2日目))。線が重なって1色しか見えない場合もあるが,シミュレーションは常にすべての時点で行った。Ct:シリアルサイクル閾値,ART:アルテミシニン, ヒドロキシクロロキン:ヒドロキシクロロキン,IVM:イベルメクチン,LPV/r:ロピナビル/リトナビル,NTZ:ニタゾキサニド.異なるモデルの治療レジメンの投与量。IVM 300:300μg/kgを24時間毎に3日間、IVM 600:600μg/kgを1日毎に3日間、 ヒドロキシクロロキン 200:200mgを8時間毎に10日間、 ヒドロキシクロロキン 800/400:800mgを12時間毎に1日間、その後400mgを12時間毎に9日間、NTZ 1200: NTZ 1200:NTZ 1200mgを6時間ごとに5日間;NTZ 2900。NTZ 2900:NTZ 2900 mg を 12 時間ごとに 5 日間;LPV/r 400/100:LPV/r 400/100 mg を 12 時間ごとに 14 日間;ART 500: ART 500:ART 500mgを1日1回、5日間投与する。
図2 治療開始時期の違い
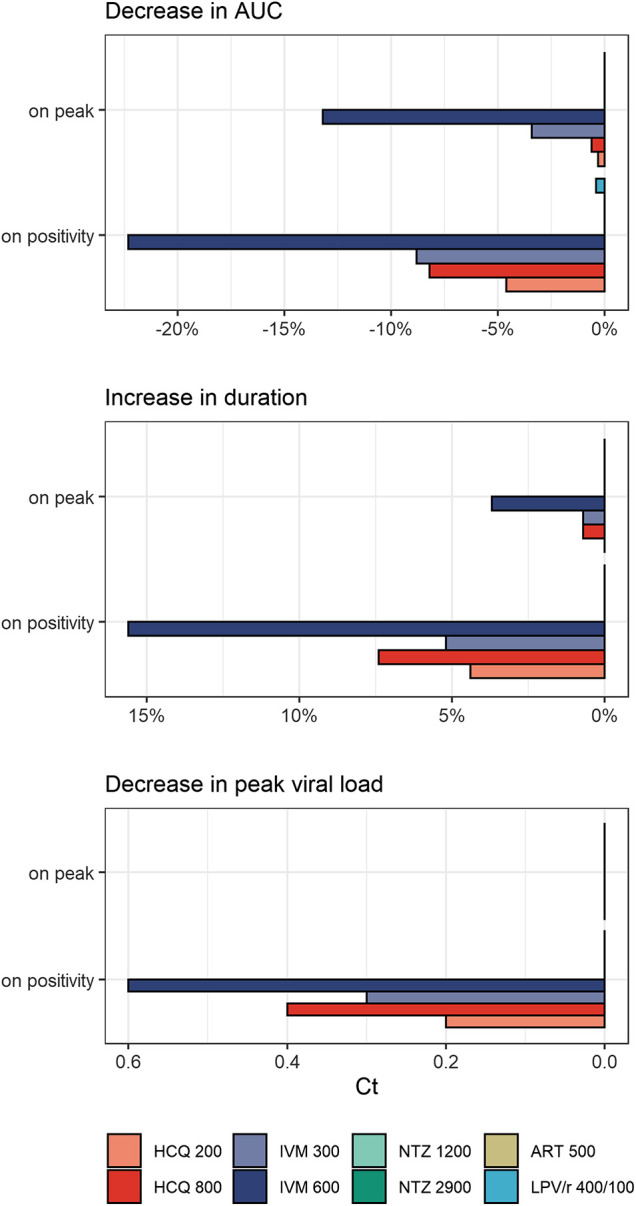
(陽性時:感染後5.4日、ピーク時:感染後10.2日)に伴う曲線下面積(AUC)の差、持続時間の相対的変化、ピークサイクル(Ct)の変化として、ウイルス暴露に対する治療効果を示した。 ヒドロキシクロロキン:ヒドロキシクロロキン、IVM:イベルメクチン、NTZ:ニタゾキサニド、ART:アルテミシニン、LPV/r:ロピナビル/リトナビル。異なるモデルの治療レジメンの投与量: ヒドロキシクロロキン 200:200mgを8時間ごとに10日間、 ヒドロキシクロロキン 800:800mgを12時間ごとに1日間、その後400mgを12時間ごとに9日間、IVM 300:300μg/kgを24時間ごとに3日間、IVM 600:IVM 600μg/kgを1日ごとに3日間、NTZ 1200: NTZ 1200:NTZ 1200mgを6時間ごとに5日間投与;NTZ 2900。NTZ 2900:NTZ 2900 mgを12時間ごとに5日間投与;ART 500: ART 500:ART 500mgを1日1回、5日間;LPV/r 400/100:LPV/r 400/100mgを12時間ごと、14日間。
ヒドロキシクロロキンは、陽性時に投与することで、ピーク時のウイルス量を0.2~0.3 log unit、曝露量を4.6~8.2%減少させた。ウイルス量のピーク時(10.2dpi)に投与を開始しても,総ウイルス量や罹患期間には有意な影響はなかった。両投与法の間では、WHO Solidarity試験群の方がより顕著に総ウイルス量を減少させた。IVMの効果はさらに顕著で、陽性の場合、ピーク時のウイルス量は0.3~0.6log単位、曝露量は8.8~22.3%減少した。曝露量の減少は、排出期間が13.5日(未治療)からIVMでは14.2〜15.6日、 ヒドロキシクロロキンでは14.1〜14.5日とわずかに延長し、Tmaxがそれぞれ10.2日(未治療)から 10.9〜12.3日、10.5〜10.9日にシフトしたことと関連している。興味深いことに、 ヒドロキシクロロキンとは対照的に、ウイルス量のピーク時に治療を開始した場合でも、いくつかの効果が残ってた(暴露量の差は3.4~13.2%)。LPV/r、ART、NTZは、投与開始時期によらず、ウイルスの動態に影響を及ぼさなかった。
考察
今回のモデル化・シミュレーション研究は、患者のウイルス量をよく表しており、SARS-CoV-2のウイルス動態の重要なマイルストーン(ウイルス排出期間やウイルス量のピークなど)を捉えていた。また、COVID-19を治療する機会は限られていることもわかった。感染が宿主に急速に広がると、感染しやすい細胞のプールはすぐに枯渇してしまう。したがって、 ヒドロキシクロロキンのようにウイルスの侵入を阻害する薬剤は、役割があるとすれば、接種後の最初の数日間(曝露後の予防)か、リスクのある人に配布される第一次予防薬としてのみであると考えられる。
これらの知見は、 ヒドロキシクロロキンを用いた臨床試験の残念な結果を説明するのに役立つかもしれない。患者が入院したり、さらには重症患者に移されたりする頃には、感受性の高い細胞はほとんど残っていないため、この時点ではほとんど影響を与えることができない(Annie et al 2020,Cavalcanti et al 2020,Molina et al 2020,Tang et al 2020a)。WHO Solidarity試験の投与法は、Gautret et al 2020)が提案したものよりも明らかに効果的であった。しかし、WHO Solidarity試験で使用されたより高い投与スキームであっても、 ヒドロキシクロロキンの評価できる効果は観察されず 2020年6月18日に治療群は早期に終了した(Pan er al 2020)。注目すべきは、最近の試験では、曝露前後の予防的な適応においても ヒドロキシクロロキンの有益性が認められなかったことである(Boulware et al 2020,Rajasingham et al 2020)。ウイルス量は病気の状態を決定する唯一の要素ではないため、これらのシミュレーションからどのレジメンの臨床効果も直接推測することはできない。 ヒドロキシクロロキンを用いた過去の臨床試験で否定的な結果が出ていることを考えると、 ヒドロキシクロロキンの結果は他の薬剤をランク付けするための低い閾値として用いるべきであると考えられる。
IVMでは最大の効果が得られた。繰り返しになるが、IVMのような化合物は、より早い段階で、より長く暴露されればされるほど良いのであるが、遅い段階で開始された場合でも、ある程度の利益をもたらす。 ヒドロキシクロロキンを基準とした場合、IVM 600μg/kgを1日3日投与した場合、特に陽性になった頃に投与した場合、意味のある効果が得られる可能性があるが、IVM 300μg/kgを1日3日投与した場合は、 ヒドロキシクロロキンレジメンと同等の効果が得られた。この結果は、COVID-19においてIVMの薬剤耐性が低いことを示唆する他の分析結果とは対照的である(Schmith et al 2020)。これらのIVM投与量は、健康なボランティアでは明らかに安全であるが、他の適応症で承認されているどの投与量(1×200μg/kg~1×400μg/kg)よりもはるかに高いことを強調することが重要である。70kgの患者に3×600µg/kgを投与すると、Guzzo et al 2002)が記載した最大投与量(120mgを単回投与)と同程度の投与量となる。IVMの代謝または排泄の阻害剤(CYP3A4およびP-glycoprotein(P-gp)阻害剤であるリトナビルなど)を共同投与することでIVMへの曝露を高めることは、理論的な選択肢である(Chaccour et al 2017)。しかし、機能的な血液脳関門の不可欠な部分であるP-gpを阻害することで、より中枢神経系の有害事象が発生する可能性が懸念されている(Chandler, 2018)。この相互作用が体系的に研究されるまでは、この戦略を検討するのは賢明ではないと思われる。IVMについては、COVID-19での有効性に関する臨床試験の結果はまだ発表されていない。
ART、NTZ、LPV/rは顕著な効果がなく、現時点では追跡調査の対象にはならない。これは、ART、NTZ、LPV/rがタンパク質との結合力が強く(88-99%)標的と結合する遊離薬物が少ないことが一因と考えられる。さらに、ARTのEC50は70μMとかなり高く、部分的にも達成できそうにない。LPV/rについては、臨床試験結果(Cao et al 2020a, 24)特にRECOVERY試験(University of Oxford, 2020)とWHO Solidarity試験(2020年7月4日にLPV/r治療群を中止)によって、我々の発見が確認されている(Pan et al 2020)。現在のところ、NTZとARTに関する試験は結果が報告されていない。
本研究にはいくつかの制限がある。我々のモデルのパラメータ推定値は、インキュベーション時間と肺の中の標的細胞の数の仮定に基づいており、どちらもバイアスを導入する。COVID-19は当初、肺炎の症例群から記載され、上気道と下気道の症状が最も認識されているが、血管、血栓塞栓、胃腸、神経系の症状も広く記載されている(Klok et al 2020,Mao et al 2020,Struyf et al 2020,Zhang et al 2020)。ACE2の発現レベルは、他の組織、例えば、小腸、腎臓、および心臓においてもはるかに高い(Li et al 2020b)。したがって、全身のウイルス負荷が肺胞上皮細胞の産物だけであるとは考えにくい。ウイルス負荷の程度は、疾患の重症度やサンプリング部位(口腔咽頭、鼻咽頭、血漿など)に依存する(Fajnzylber er al)。 民族性は臨床転帰に影響を与えると考えられているが(Sze et al 2020)民族性がウイルス負荷に与える影響については結論の出ていない証拠がある(Magleby et al 2020)。結論として、異なる集団において標的細胞のプールの大きさを再推定することを提案する。
ウイルス動態パラメータの点推定値は、点推定値周辺の合理的な不確実性(%CV: 30-43)で、ウイルス負荷プロファイルの現実的な推定値をもたらした。データの非同期性を正規化していない(例:異なるdpiでのウイルスのピーク)ため、適合性が向上した可能性がある。しかし、現在、受け入れられている手順は存在しない(Hernandez-Vargas, 2019)。他の著者は、同じソースデータに非線形混合効果(nlme)モデリングなどのより洗練された手法を用いて、日食モデルなどの他の構造モデルを実装している(Czuppon et al 2020; Gonçalves et al 2020)。私たちが実装したモデルのnlmeは、他の著者が見たのと同じ数値的な識別性の問題に悩まされた(Hernandez-Vargas and Velasco-Hernandez, 2020)。ここで紹介したモデルは、他の標的細胞限定モデルや偏食モデルとは構造的に異なるため、いくつかのポイント推定値は他の実装と異なる可能性がある(再生産数R0や感受性細胞数T0など(Gonçalves er al 2020))。
ウイルスの絶滅は、今回提案したようなモデルでは捉えられない。そのため、予防的投与(曝露前または曝露時)のモデル化は行わず、発病期間の代替指標としてRT-PCRの陰性化に頼ることにした。これは、後期の排出は非感染性のウイルス粒子のみであることを示唆するデータによって裏付けられている(Walsh er al)。
薬剤の作用機序とその有効性について、いくつかの仮定を置いた。我々は、SARS-CoV-2に対する ヒドロキシクロロキンの作用様式として公表されているものを使用したが、これはアフリカミドリザルの腎臓由来の細胞株Veroで行われたものであり(Wang et al 2020a)この細胞株が肺組織を表すのに適していないかもしれないという証拠があるにもかかわらず(Hoffmann et al 2020)。このモデルでは、 ヒドロキシクロロキンの効果をウイルスの侵入のみに置いているが、感染細胞内でのウイルスの産生に影響を与える他の作用様式もあるかもしれない(Quiros Roldan et al 2020,Tripathy et al 2020)。さらに、 ヒドロキシクロロキンには免疫調節作用があり、B細胞やT細胞の活性化を妨げ、その結果、宿主-宿主間の免疫反応を阻害する可能性がある(Goldman et al 2000,Quiros Roldan et al 2020)。SARS-CoV-2については、モデル化に必要なデータがなかった。もし関連性があれば、我々のモデルは ヒドロキシクロロキンの有効性を過大評価していることになる。
SARS-CoV-2に対するIVMの有効性を示す試験管内試験の証拠は、効果をより正確にモデル化できるほど詳細ではない。他のフラビウイルス科、特にデングウイルスのデータに基づけば、提案されている複製の阻害は妥当であると思われる(Mastrangelo er al 2012)。ウイルスの侵入に対する影響を含めることは、病態生理学的な理由に従ったものであり、研究ではまだ確認されていない。IVMはnAChRと結合することでACE2を減少させ、SARS-CoV-2の侵入口を減少させ、細胞感染率に影響を与える。IVMのnAChRに対するIC50は実験的に決定されているが、これがACE2の発現低下とどのように関係しているのかは不明である。そのため、血漿中の濃度と利用可能なIC50のみに基づいてモデル化することにした。
ヒドロキシクロロキンおよびIVMでは、総ウイルス量が減少しても、ウイルス排出期間が長くなる可能性があり、これは集団規模で観察されるのと同様の「曲線の平坦化」の結果である。しかし、これにより、免疫反応が発現するまでの時間が長くなる。このため、シミュレーションされたモデルでは、全体の総ウイルス量が減少した。ピーク時のウイルス量の変化は、せいぜい中程度(1 log unit未満)であった。臨床現場で測定するには便利なエンドポイントであるが、ウイルス量のAUCは創薬に適しているようである。
COVID-19の治療においてARTとNZTが注目されたのはごく最近のことである。我々の研究ではほとんど効果がなかったにもかかわらず、経済的およびロジスティックな観点から、これらは優れた候補となるだろう。ARTを選んだのは、甘いヨモギに含まれる主な有効成分だからである。ヨモギのハーブ調合液は、COVID-19では安価で簡単に手に入るセルフメディケーションの一形態として推進されている(Welle, 2020)。ヨモギとその誘導体(アルテスネート、ジヒドロアルテスネート)は、抗マラリア薬として広く使用されている。ARTとその誘導体の有効濃度はまだ決定されていないが、タンパク質の結合度が大きいことから、有効な目標濃度は低マイクロモルの範囲である必要がある。また、アルテミシニンには抗炎症作用や免疫調整作用があることが研究で示唆されており、COVID-19の治療に有益であると考えられている(Tang er al)。 しかし、これらの効果はウイルスの動態とは関係がないため、今回のシミュレーションではこれらを含めることができなかった。WHOは、経口アルテミシニン単剤療法(AMT)が寄生虫抵抗性の発達の大きな要因になると考え、マラリアへの使用を控えている(WHO, 2014)。現在進行中のCOVID-19パンデミックの際に、マラリアパンデミック地域でAMTの経口投与が再開された場合、利益よりも害が大きくなる可能性がある。
NTZについては、NTZ 500mgを単回投与したときの平均曲線に基づいて薬物動態シミュレーションを行った。EC50値は、組織に到達すると予想される活性化合物である即時形成される活性代謝物のtiaxozanideではなく、NTZに対して決定された(Wang er al 2020a)。Tiaxozanideに関するより詳細な結果が得られれば、シミュレーションされた有効性が変わる可能性がある。
結論として、試験管内試験はCOVID-19の潜在的な治療法の作用機序を特定するのに非常に適しているが、薬剤の臨床効果を予測することはできない。我々が行った治療法のシミュレーションは、いくつかの推定を行い、限界を受け入れる必要があったものの、臨床試験から得られた結果とよく一致した。早期開始は治療効果の強い決定因子であるが、研究した治療法の中でウイルスの動態に大きな影響を与えたものはなかった。今後は、より効果的な薬剤候補の同定やワクチンの開発に力を入れるべきである。それまでは、一般的な社会的・衛生的措置が、COVID-19に対抗するための最良の介入策であることに変わりはない。
