Contents
Microglia in Alzheimer Disease: Well-Known Targets and New Opportunities
www.ncbi.nlm.nih.gov/pmc/articles/PMC6730262/
要旨
ミクログリアは、中枢神経系に常駐するマクロファージである。ミクログリアは、脳の発達に重要な役割を果たしており、生活や加齢に伴う生理学的な役割を担っている。様々な分子センサーを備え、それらが果たすことができる様々な機能を通じて、脳の恒常性の維持に決定的に関与している。
アルツハイマー病では、当初、ミクログリアの反応は偶発的なものであり、アミロイド沈着やジストロフィー化した神経突起によって引き起こされると考えられてた。しかし、最近のゲノムワイドな関連研究により、アルツハイマー病リスク遺伝子座の大部分は、ミクログリアで高度に、時には一義的に発現している遺伝子の中に、あるいはその近傍に見出されていることが確立された。
このことは、ミクログリアが疾患の初期段階で決定的に関与しているという概念につながり、重要な潜在的治療標的として同定された。ミクログリアの反応がアルツハイマー病の進行に有益なのか、有害なのか、あるいはその両方なのかはまだ不明であり、激しい議論の対象となっている。
このレビューでは、アルツハイマー病の進行に決定的に関与していることが示されている様々なミクログリアの機能と経路を強調することを目的とした最新の知見を報告している。
我々は最初に新しい機能の獲得と反応性ミクログリアによる恒常的な役割の変化の両方に対処する。
第二に、我々は現在、関連するミクログリアのターゲットを特定するために考慮する必要がある分野で浮上している新しい重要なパラメータの要約を提案する。
最後に、我々は、アルツハイマー病の効率的な治療戦略を設計する上で多くの障害について議論し、病理学におけるミクログリアの役割の我々の理解を促進する可能性がある革新的な技術を提示する。
最終的には、様々なミクログリアの機能を飛び越えて、アルツハイマー病におけるミクログリアの関与に関する現在の知見と、この分野における新たな研究の可能性について、一般的かつ信頼性の高い報告を行うことを目的としている。
キーワード
アルツハイマー病、ミクログリア、神経炎症、ミクログリアの多様性、ピュリネリックシグナル伝達、性的二型、早期、hiPSCs
序論
ミクログリア細胞は、脳内の主要な免疫細胞である。彼らは、出生前の初期に脳を植民地化する(Ginhoux et al 2010)が、他の組織常駐マクロファージとは異なり、彼らは生涯にわたって中枢神経系内に隔離されたままであり、ゆっくりとしたペースで自己再生(Ajami et al 2007)。重要なことに、中枢神経系の微小環境は、ミクログリアの表現型を大幅に形成し、特定の重要なホメオスタシスと支持的な脳機能をそれらに与えている(KierdorfとPrinz 2017)。脳の恒常性が損なわれるときに、ミクログリアは表現型を変更し、防衛プログラムを開始する。したがって、病理学的条件下では、これらは、貪食の増加および受容体、サイトカイン、ケモカインおよび追加の炎症関連分子の発現の増加を含むがこれらに限定されない、複数の形態学的および機能的変化によって特徴付けられる反応性状態を採用する(Wolf et al 2017)。
アルツハイマー病の古典的な特徴は、脳の萎縮、細胞外アミロイドベータ(アミロイドβ)沈着、細胞内凝集リン酸化タウ、ジストロフィー性ニューライト、シナプスおよびニューロンの喪失を含む(Bedner et al 2015)。神経斑内の反応性グリア細胞の存在は、アロイス・アルツハイマー自身によって記述され(Alzheimer, 1907; Graeber et al 1997)さらなる研究により、アミロイドβ)堆積物の近傍に反応性アストロサイトおよびミクログリアの両方が同定された(Verkhratsky et al 2016)。長い間、病態の結果として考えられてきたが、反応性グリアとそれに伴う神経炎症は、現在では疾患の開始と進行の両方において重要な役割を果たしていると考えられている。実際、ヒトの遺伝学的研究では、アルツハイマー病リスクとロバストに関連する25以上の遺伝的遺伝子座位が同定されている(Hansen er al)。 その中で、共通の(ApoE、Sp1l)またはまれな(Trem2,Cd33)遺伝的変異のほとんどは、ミクログリアで優先的または排他的に発現するタンパク質をコードしていた。これらの知見は、アルツハイマー病の発症にミクログリア細胞が関与していることを強く支持し、アルツハイマー病におけるミクログリア細胞の研究への強い関心を生み出した。しかし、アルツハイマー病の発症と進行におけるミクログリアの役割は明らかにされておらず、また、アルツハイマー病への有害または保護的な寄与については相反する報告があり、激しい議論がなされている。
本研究では、アルツハイマー病におけるミクログリアの役割に関する主な知見をまとめた。ミクログリア反応は、危険や病原体関連分子パターン(DAMPs/PAMPs)を認識するために設計された受容体の活性化によって引き起こされる多くの免疫機能の獲得に関連していることが知られている。その役割は恒常性の回復であり、脳の生理機能に重要な恒常性機能の喪失や変化にも関連している。2 つの最初の部分では、我々 はこのように アルツハイマー病 の間に変更されることが知られているミクログリア機能と経路の概要を提供する。我々はその後、そのようなマウスモデル、性別、年齢などの要因を強調し、その影響が病気の進行にミクログリア細胞の貢献を評価する上で十分に検討されていない可能性がある。最後に、我々は、アルツハイマー病の開始と進行に対するミクログリアの役割の我々の理解を促進し、よりターゲットを絞った治療戦略の設計に役立つ可能性がある新しい研究トピックを特定した。
アルツハイマー病における反応性ミクログリアの新機能
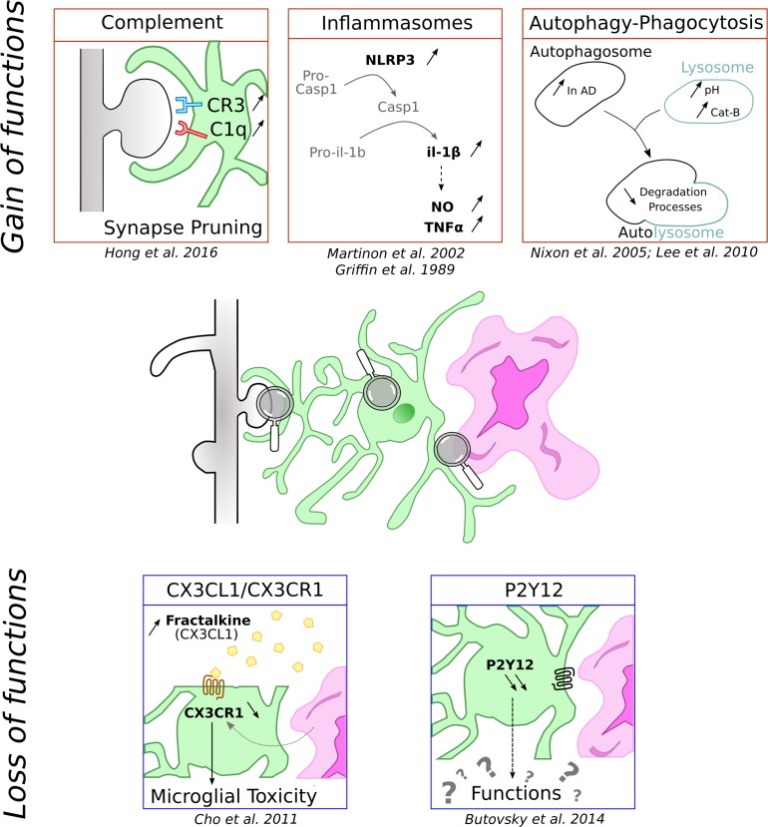
神経炎症は神経変性疾患の共通の特徴であり、炎症過程はアルツハイマー病におけるミクログリアの機能について最も研究されている。脳の主要な免疫細胞であるミクログリアは、この脳内炎症の制御に重要な役割を果たしていることが示されている。以下では、神経炎症に関与する主なミクログリアのプロセスを報告する(図1,上段)。しかし、これらのプロセスのより詳細な記述は、これらの特定の点に焦点を当てた最近のレビューに見出すことができる(Labzin et al 2017; Nizami et al 2019)。
図1 ミクログリア細胞がアルツハイマー病の文脈で緩んだり得たりする機能の模式図
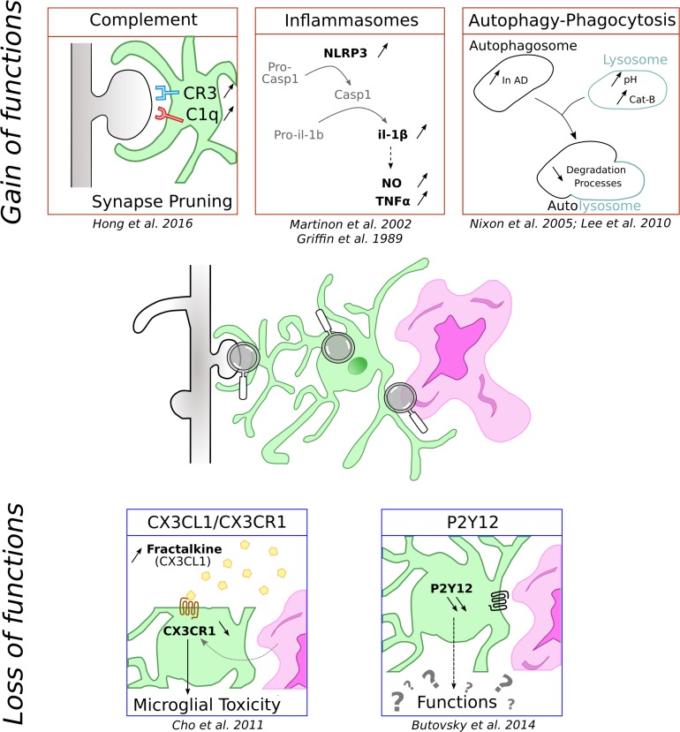
ミクログリアは緑で、紫ではアミロイドβ沈着物、灰色では樹状突起に関連して表現されている。
インフラマソームは、サイトカイン生産のための中心的なハブである
炎症の特徴の一つは、サイトカインの放出である。この分泌は、インフラマソームと呼ばれる誘導性多保護複合体の活性化を必要とする。いくつかのインフルナソームが特徴づけられているが、病理学的に最も重要なミクログリアの寄与者は確かにNLRP3である。これは、センサータンパク質NLRP3と、カスパーゼリクルートドメインを含むアダプタータンパク質apoptosis associated Speck-like protein (ASC)から構成されている。ASCは、プロカスパーゼ-1をリクルートして活性化することができる。刺激を受けると、この複合体はプロカスパーゼ-1の切断を活性なカスパーゼ-1に誘導し、その結果、プロIL-1βとIL-18が切断され、細胞外空間での放出を誘発する(Martinon et al 2002)。NLRP3活性化経路は完全に特徴づけられていないが、現在の見解では、NLRP3活性化は、2つの独立しているが共存するプライミングおよび活性化シグナルの発生を必要としている(Próchnicki et al 2016)。
アルツハイマー病の文脈では、IL-1βは、NOおよびTNF-αの分泌を誘発し、劇症的なアミロイド斑の形成および神経細胞の変性を促進することが知られている(Griffin er al)。 これらのデータに従って、アルツハイマー病患者の前頭皮質は、アミロイドβペプチド貪食の減少と相関するカスパーゼ-1の増加を示す(Burguillos et al 2011; Heneka et al 2013)。同様に、身近なアルツハイマー病関連変異を有するマウスにおけるNLRP3の遺伝子欠失は、IL-1βおよびアミロイドβ沈着物のレベルを減少させ、シナプス機能障害および認知パフォーマンスへの正の影響と相関している(Heneka et al 2013)。
カスパーゼファミリーの他のメンバーもまた、アルツハイマー病の病理に関与している。興味深いことに、ADマウスモデルの海馬ニューロンでは、カスパーゼ-3の活性が早期に増加する(D’Amelio et al 2011)。同様に、アルツハイマー病患者のサンプルでは、皮質ミクログリアでカスパーゼ-8と-3がアップレギュレートされている(Burguillos et al 2011)。アミロイドプラーク周辺のミクログリアのカスパーゼ-3も細胞質的な位置を示し、アルツハイマー病におけるカスパーゼの非アポトーシス的役割を示唆している(Burguillos et al 2011)。このような証拠は、反応性アストロサイトおよびミクログリアが細胞質非アポトーシスのカスパーゼ-3を発現する脳虚血などの他の変性モデルにおいても記述されている(Wagner et al 2011)。この非核局在化は、細胞質の再配列や病変周囲の細胞集団の改変に関与している可能性がある。カスパーゼシグナル伝達がアルツハイマー病の発症に重要であることは否定できないが、それぞれの活性化の遅れやその下流の経路を明らかにする必要がある。
補体系、ミクログリアがシナプスを食べる?
補体経路は自然免疫系の一部であり、病原体や細胞ゴミの認識と排除を媒介している。それは、発生時の活性依存性シナプス消去を含む、生涯を通じて多くの生理学的および病理学的機能に関与している(Schafer et al 2012)。アルツハイマー病では、アミロイドβ沈着によるこの経路の再活性化がシナプスの消失と関連している。
補体カスケードは、3つの異なる経路によって活性化されることができるC1qおよびC3複合体タンパク質を含むメディエーターの大規模なパネルで構成されており、それらのすべてが貪食を誘発することができる(Stephan et al 2012)。中枢神経系では、補体タンパク質はニューロンとグリア細胞で発現しているが、ミクログリアとアストロサイトが補体の主な供給源である。特にミクログリアはC1qとCR3を高レベルで発現しており(Veerhuis et al 2011年)ミクログリアのCR3はシナプス形成に重要な役割を果たしていることが示されている(Schafer et al 2012)。
アルツハイマー病の文脈では、患者はC3とCR1の脳脊髄液濃度の上昇を示し、病理学的に補体系の変化を指摘している(Daborg et al 2012)。補体はアミロイドβと関連しているが、それが保護または有害であるかどうかは明らかではない。実際、いくつかの研究では、補体の阻害または欠乏がアミロイド病理学の加速をもたらすことが報告されており(Wyss-Coray et al 2002;Maier et al 2008)CR3とともにC3がアミロイドβ貪食に寄与していることが報告されている(Fu et al 2012)。一方、他の研究では、ミクログリアCR3の消去および変調がアミロイドβレベルを低下させ(Czirr et al 2017)C3アンタゴニストがプラーク負荷を改善することが指摘されている(Lian et al 2016)。したがって、アミロイドβ病理における補体の役割をよりよく理解するために、さらなる研究が必要である。
アルツハイマー病は重要なシナプスの消失によって特徴づけられるので、補体がそのようなシナプスの消去を媒介しうるかどうかについて疑問が提起されてきた。Fonseca et al 2004)は、ADマウスモデルにおいてC1q欠損が部分的にシナプスの完全性を回復することを実証し、アルツハイマー病における補体システムの役割を指摘した。より最近、Hongらの研究は、オリゴメリックアミロイドβで挑戦したときにミクログリアC3/CR3がシナプスの消去を媒介することを実証した(Hong et al 2016)。より具体的には、彼らは、J20マウスにおいてC1qが早期にシナプスにアップレギュレートされ、アミロイドβオリゴマーがC1qとミクログリアの貪食活性を増加させることを発見した。この結果、CR3 KOマウスではシナプスの消去が失われているミクログリアによるシナプス消去のプロセスが得られた。この研究では、C1qとオリゴマーアミロイドβが補体カスケードを活性化し、ミクログリアCR3によるシナプス消去を促進するモデルを提案している。
私を食べて私自身も食べる
オートファジーとファゴサイトーシスは、リソソーム内の追加または損傷した粒子を分解するために必要な細胞分解プロセスである。大規模な酵素分解系によって確保されたこれらのプロセスは、加齢の間に調節障害され、アルツハイマー病患者におけるオートファジーの失敗およびオートファゴソームの増加で示されるように、アルツハイマー病の間に特に重要である(Nixon et al 2005)。さらに、リソソソームの酸性化とオートファジーは、アルツハイマー病に関連したPS1変異によって障害される(Lee et al 2010)。
数多くの研究で、ミクログリアのアミロイドβファゴサイトーシスがNLRP3とリソソソームカテプシンBを誘発し、IL-1βの成熟と放出をもたらすことが示されている(Halle et al 2008)。
このように、細胞の分解プロセスは、インフラマソームを異なる方法で調節することで、逆の効果をもたらす可能性がある。これは、正常な生理学的状態や病理学的状態の早期段階では保護的であり、疾患の慢性期や後期段階では有害である可能性がある。
反応性ミクログリアにおける恒常性機能の喪失
研究の大部分はミクログリア反応性獲得機能に焦点を当て、神経変性への寄与を評価しているが、主要な恒常性機能の喪失は神経細胞機能にも有害であり、ミクログリア反応の有害な影響に寄与している可能性がある。以下では、アルツハイマー病で障害されるいくつかの主要なミクログリア機能をレビューする(図1,下段)。
アルツハイマー病におけるCX3CL1/CX3CR1シグナル欠損の影響
脳では、CX3CR1受容体は主にミクログリアで発現している。そのリガンドはフラクタルキンの可溶性分泌型であり、CX3CL1とも呼ばれ、ニューロンによって構成的に発現している。CX3CL1は抑制シグナルを発し、ミクログリアを安静状態に維持している。CX3CL1-CX3CR1は、CX3CR1-/-マウスにおけるグルタミン酸シナプス成熟の遅延(Paolicelli et al 2011;Hoshiko et al 2012)および成体シナプスにおける機能的帰結(Basilico et al 2019)によって示されるように、発達中の重要なシグナル伝達経路である。LPSチャレンジは、若いラットに比べて高齢のラットではCX3CR1発現のより顕著な障害を引き起こすため、年齢もCX3CR1発現の調節において決定的な因子である(Lyons et al 2009)。
神経炎症時のCX3CL1/CX3CR1コミュニケーションの役割は、CX3CR1欠失の効果が課題に応じて異なるため、まだ議論の対象となっている。CX3CR1//-マウス、およびパーキンソン病とALSの両方のモデルにおいて、Cardona et al 2006)は、サイトカイン産生の変化に起因する広範な神経細胞の損失を実証した。CX3CR1の減少は、ADモデルでも観察されている。神経変性状態では、この障害は強いミクログリア毒性と病理の悪化と関連している(Keren-Shhaul et al 2017)。アルツハイマー病におけるCX3CL1/CX3CR1シグナル伝達経路の関与は、健常対照者と比較したアルツハイマー病およびMCI患者におけるCX3CL1の形質濃度の増加によって確認されている(Kim et al 2008)。しかし、CX3CR1を欠失させると、3×TgのADマウスでは神経細胞の損失を防ぐことが示されている(Fuhrmann et al 2010)が、hAPP-J20マウスでは細胞障害や行動障害を悪化させることが示されている(Cho et al 2011)ので、この経路の役割はより複雑であるかもしれない。
これらのデータはいずれも、アルツハイマー病を含む神経変性疾患におけるCX3CL1-CX3CR1シグナル伝達に重要な役割があることを示しているが、その複雑な応答スペクトルは疾患の遺伝モデルに依存する可能性があることも示している。
アルツハイマー病におけるP2Y12ダウンレギュレーションの未だ解決されていない役割
生理的条件下では、P2Y12受容体は走化性に関与しており、この受容体を欠失したマウスは、ミクログリアの移動および分極の変化を示した(Haynes et al 2006)。P2ry12は、中枢神経系における特異的なミクログリア遺伝子として同定された(Butovsky et al 2014)。この遺伝子は、ミクログリアで最も発現量の高い遺伝子の一つであり、反応性ミクログリアでは発現量が低下する(Haynes et al 2006)。したがって、P2ry12遺伝子の発現レベルは、恒常性微小グリアのシグネチャーのマーカーであることが提案されている(Butovsky et al 2014)。これと一致して、アルツハイマー病トランスジェニックマウスモデルでは、アミロイドプラークに近い位置にあるミクログリアはP2Y12Rを発現しないのに対し、プラークから遠い位置にあるミクログリアではP2Y12Rの受容体が観察されている(Butovsky et al 2014; Jay et al 2015)。同様の知見は、ヒトAD患者においても報告されている(Sanchez-Mejias et al 2016;Mildner et al 2017)。しかし、今のところ、このダウンレギュレーションがミクログリア機能に及ぼす影響は不明であり、さらなる注目に値する。
アルツハイマー病における最も研究されているミクログリア分子標的
これらの遺伝子の多くは神経炎症に関連しており、ミクログリア細胞で優先的または排他的に発現していることから、ミクログリア反応はアルツハイマー病の結果だけでなく、その原因でもあると考えられている。このセクションでは、最も研究されている遺伝子の役割について、現在の知見をレビューする。
APOE:アミロイドβ調節を超えたミクログリア機能修飾因子
アポリポ蛋白E(APOE)のε4アイソフォームは、アルツハイマー病に関連する一般的な遺伝的変異を表し、最も重要な既知の危険因子である。APOEは、細胞間のコレステロールと脂質の移動に関与するアポリポ蛋白である。脳では、それは主にアストロサイトによって生成されるが、ミクログリアによっても、より少ない範囲でニューロンによっても生成される。ヒトでは、APOEは、ε2,ε3,およびε4の3つの主要なアイソフォームで見出される。APOE-ε4アイソフォームは高齢発症型アルツハイマー病の最も重要な危険因子であり、APOE-ε4のコピーが1つあると高齢発症型アルツハイマー病発症のリスクが3倍に増加するのに対し、APOE-ε4のコピーが2つあると9倍に増加する(Corder et al 1993)。反対に、まれなε2変異体を有する個体はアルツハイマー病を発症する可能性が低く、最も一般的なAPOE-ε3アイソフォームは中性であると考えられている(Serrano-Pozo et al 2015)。APOEアイソフォームがアルツハイマー病の発症および発症にどのように影響するかは不明のままである。初期に記載されたAPOEとアミロイドβの間の相互作用に基づいて、研究は主にアミロイド負荷およびオリゴマー化に対するAPOEの効果に焦点を当てており、これはアイソフォーム依存性であることが示されていた(Strittmatter et al 1993;Naslund et al 1995;Hashimoto et al 2012)。したがって、APOE-ε4患者は、ε3キャリアよりも多くのアミロイドβプラークおよびオリゴマーを有する(Schmechel et al 1993;Tiraboschi et al 2004;Hashimoto et al 2012;Koffie et al 2012)ヒトAPOEアイソフォームを発現するマウスモデルは、アミロイドβ沈着物上のアイソフォーム依存性修飾を模倣する(Fagan et al 2002;Hudry et al 2013;Zhao et al 2014)。また、APOEはアミロイドβクリアランスにも影響を与え得ることが報告されている(DeMattos et al 2004;Castellano et al 2011)が、APOEノックダウンマウスは、より少ないアミロイドβ沈着物を発現する(Holtzman et al 1999;Fagan et al 2002)。
APOEのミクログリアの役割についてはほとんど知られていない。ヒトにおける初期の死後研究では、APOE-ε3と比較してAPOE-ε4キャリアの反応性ミクログリアの数が多いことが発見され(Egensperger et al 1998)最近ではMinett et al 2016)がAPOE-ε4対立遺伝子が反応性ミクログリアと強く関連していることを発見した。ヒトアイソフォームを発現するマウスモデルを用いた研究もまた、APOE-ε4を発現するマウスにおいて、APOE-ε3と比較してミクログリア症の増加を示した(BelinsonおよびMichaelson, 2009; Rodriguez et al 2014)。全体的に、これらの研究は、APOEアイソフォームと反応性ミクログリアとの関係を強調している。証拠はまた、炎症プロセスにおけるAPOEの役割を指摘してきた(Lynch et al 2001; Thangavel et al 2017)。したがって、APOEは、疾患関連ミクログリア(DAM)においてアップレギュレートされ、恒常性因子および炎症性因子の転写を調節する(Krasemann et al 2017)。さらに、APOEは、炎症応答をアイソフォーム的に修飾する;APOE-ε4発現マウスは、APOE-ε3よりも多くのプロ炎症性サイトカインを放出する(Guo et al 2004;Vitek et al 2009;Zhu et al 2012)。しかしながら、APOEがアミロイドβの存在下でのAPOEは炎症性サイトカイン放出の減少を誘導することから、APOEがより多くの炎症性反応を誘発するという概念は疑問視されてきた(Guo er al)。 全体として、APOEはアミロイドβの凝集とクリアランスを介して、ミクログリアの活性化とサイトカイン放出を調節することによっても高齢発症型アルツハイマー病に関与していることは間違いない。しかし、これらのプロセスを探求するためには、さらなる研究が必要である。
TREM2,役割が不明確なよく知られた危険因子
APOEとは別に、高齢発症型アルツハイマー病と関連する他の主要なよく研究されている遺伝子は、骨髄細胞上に発現するトリガー受容体2(TREM2)である。実際、GWAS研究により、高齢発症型アルツハイマー病と関連するいくつかのまれなTrem2遺伝子変異が同定された(Guerreiro et al 2013;Jin et al 2014)。その中でも、機能喪失R47H変異を引き起こすrs75932628変異は、アルツハイマー病との有意な関連を示し、アルツハイマー病におけるTREM2活性化経路の保護的役割を示唆している(Guerreiro et al 2013; Jonsson et al 2013)。
TREM2は、ミクログリアを含むミエロイド細胞に発現する細胞表面受容体であり(Schmid et al 2002;Kiialainen et al 2005年)炎症(Piccio et al 2007年)貪食(Takahashi et al 2005年)ケモカイン分泌(Bouchon et al 2002;Sieber et al 2013)を調節することが示された。TREM2がアルツハイマー病にどのように影響するかは現在のところよくわかっていないが、TREM2はAPP/PS1海馬や皮質で増加し(Jiang et al 2014年)その発現は加齢とともに増加する(Jay et al 2015)。
さらに、TREM2発現はプラーク関連ミクログリアで増加し(Frank et al 2008;Guerreiro et al 2013)TREM2発現を調節するとミクログリア応答を再プログラムすることができる(Krasemann et al 2017;Lee C.Y.D. et al 2018)。特に、Keren-Shhaulらは、TREM2がDAMsの完全な活性化に必要であることを実証し(Keren-Shhaul et al 2017)これらの細胞におけるTREM2の主要な役割を指摘している。
アルツハイマー病におけるTREM2に関する研究のほとんどは、ミクログリア媒介のアミロイドβ貪食に関連しているが、有益な効果があるか有害な効果があるかについては、すべての研究が一致しているわけではない。実際、Ulrich et al 2014)は、3ヶ月齢のTREM2ヘテロ接合APP-21マウスではアミロイド負担に変化がないことを発見したのに対し、(Jay et al 2015)は、4ヶ月齢のTREM2欠損APP/PS1マウスで6E10染色の減少を示した。反対に、Wang et al 2015)は、8ヶ月齢5x家族性ADマウスを用いて、TREM2欠損は海馬のアミロイドβペプチドを増加させるので有害であることを示唆した。同様に、Jiang et al 2014)は、TREM2がアミロイドβ1-42貪食を促進することを試験管内試験で示し、生体内試験では、TREM2過剰発現がAPP/PS1マウスの大脳皮質および海馬におけるプラーク密度を減少させることを示した。以上のように、これらの異なる研究は、アミロイドβにおけるTREM2の複雑な役割を示唆しており、年齢やステージに依存した効果を示唆している。
また、TREM2依存性の炎症性応答についても対照的な結果が得られている。(Jay et al 2015)は、APP/PS1マウスにおけるTREM2欠損がプロ炎症反応を低下させることを示した。反対に、試験管内試験研究では、TREM2過剰発現は、TREM2欠乏は-プロ炎症性サイトカイン産生を増加させる一方で-減少させることが示された(Takahashi et al 2005;Jiang et al 2014)。したがって、TREM2が炎症反応にどのように影響するかを明らかにするためには、さらなる研究が必要である。
炎症性応答およびアミロイドβ沈着におけるTREM2の含意について見出された不一致にもかかわらず、TREM2欠損がアミロイドβ関連ミクログリアの減少を引き起こすことは一致している(Jay et al 2015;Wang et al 2015;Zhaoo et al 2018)。全体として、これらの研究は、炎症過程とアミロイドβ沈着を調節することによって、TREM2がアルツハイマー病に関与していることを示している。さらに、いくつかの研究は、アミロイドβがTREM2に結合し、この相互作用が、増殖、アミロイドβ分解、炎症反応などのミクログリアの機能を調節することができることを発見した(Zhong et al 2018)。興味深いことに、TREM2とAPOEとの間のリンクは、TREM2がAPOEの発現およびシグナル伝達を調節することを示唆することが最近強調されている(Krasemann et al 2017; Parhizkar et al 2019)。
多くの研究は、アルツハイマー病におけるTREM2の役割を解読することを目的としている。しかし、TREM2バリアントの研究も関連しているかもしれないが、現在の研究では主にTREM2の過剰発現またはノックアウトを用いている。
その他のアルツハイマー病の危険因子
アルツハイマー病関連のGWASでは、アルツハイマー病の潜在的な危険因子として他の多くのミクログリア遺伝子が同定されている。これには、ファゴサイトーシスに関与しているCd33,Cr1,またはabca7などの遺伝子が含まれる(Villegas-Llerena et al 2016)。さらに、CD33は、Cr1がアミロイドβプラークの除去を助ける補体経路の一部であるのに対し、アミロイドβクリアランスを阻害することが示された。CD33の様々なSNPが発見されている:rs3826656およびrs3865444バリアントは高齢発症型アルツハイマー病と関連しているのに対し、rs3865444バリアントは保護を与える(McQuadeおよびBlurton-Jones 2019)。全体的に、25以上のミクログリア遺伝子がGWAS研究によってハイライトされている(VerheijenおよびSleegers 2018)。アルツハイマー病の発症への彼らの貢献はまだ知られておらず、彼らはより一般的な遺伝的変異体である傾向があるので、科学者の注目を集めるメリットがある。
アルツハイマー病における新たなミクログリア標的
新興のミクログリア標的は図2で強調表示されている。
図2 このレビューで研究されたアルツハイマー病の生理学における現在のホットなトピックと新興のミクログリア標的の模式図
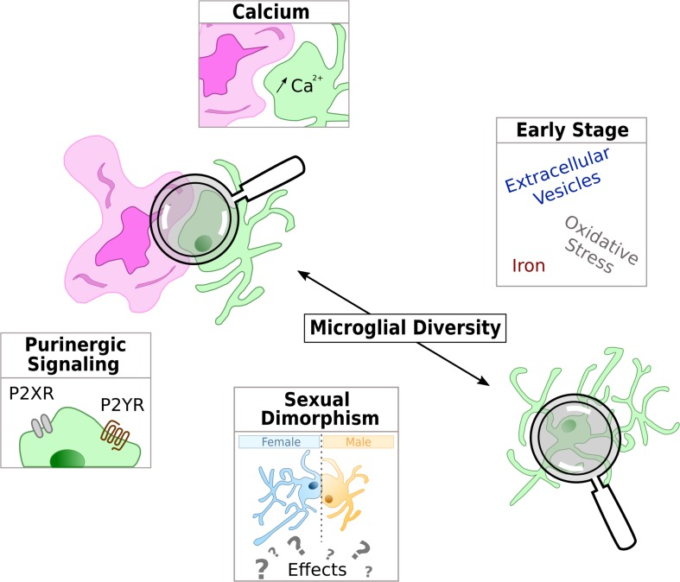
ミクログリアは緑色で表され、紫色のアミロイドβ沈着に関連した反応性の形状を持つか、またはアミロイドβから離れたホメオスタティックな形状を持つ実質細胞のいずれかである。
プリン作動性シグナル伝達
ミクログリアの機能に関与する多くのメカニズムの中で、プリン作動性シグナル伝達は特筆に値するものの一つである。実際、ミクログリアのプリン作動性受容体は、貪食、走化性およびサイトカイン放出を含むいくつかのプロセスを調節することが知られている(アミロイドβbracchioおよびCeruti 2007; Calovi et al 2019)。プリン作動性受容体は、2つのスーパーファミリーに分けられる。P1受容体はアデノシンに応答するのに対し、P2受容体はADPおよびATPに応答する。プリン作動性受容体は、ミクログリアを含むいくつかの中枢神経系細胞型で広く発現しており(Butovsky et al 2014)イオントロピックP2XおよびメタボトロピックP2Y受容体の両方が、アルツハイマー病を含む神経疾患に暗示されている(Burnstock 2016)。
Gタンパク質共役型P2Y受容体のうち、P2Y6R、12,および13は、ミクログリアで発現している3つの最も研究されたサブタイプである(Calovi et al 2019)。アルツハイマー病では、最も研究されているのは、ホメオスタティックなミクログリアにおいて重要な役割を果たし、その役割は上述したP2Y12受容体である(「反応性ミクログリアにおけるホメオスタティック機能の喪失」の項を参照)。他のP2YRに関しては、(Wendt et al 2017)が9ヶ月齢5x家族性ADマウスにおけるP2Y6R依存性ファゴサイトーシス機構の障害を実証しているように、P2Y6Rはアミロイドファゴサイトーシスに関与している可能性がある。ミクログリアにおけるP2Y2Rの発現は非常に低いと思われるが(Calovi et al 2019)研究はまた、アルツハイマー病におけるその含意を調査している。試験管内試験では、一次ミクログリアのアミロイドβ処理はP2Y2R発現の増加を誘導し、アミロイドβ処理されたP2Y2R-/-ミクログリアは運動性の喪失とATP/UDPをトリガーとしたアミロイドβ取り込みの変化を示した(Kim er al)。 興味深いことに、10週齢のTgCRND8 ADマウスモデルではP2Y2R発現がアップレギュレーションされており、P2Y2Rヘテロ接合マウスは野生型マウスと比較して病理学的に加速されたことが示された(Ajit et al 2014)。TgCRND8マウスからのデータと矛盾するが、P2Y2Rが保護効果を表示するという考えを支持しているが、データは、アルツハイマー病患者の頭頂皮質におけるP2Y2Rのダウンレギュレーションを示している(Lai et al 2008)。マウスとヒトのP2Y2R発現調節の不一致は、研究が行われた段階によって説明できるかもしれない。全体として、これらの結果は、アルツハイマー病の文脈でのP2Y2Rシグナル伝達の保護的役割を示唆している。
他の主要なP2受容体は、ATP作動性イオンチャネルP2X受容体である。7つのP2XRサブユニットがあり、その三量体での集合体は、中枢神経系で広く発現している陽イオン透過性チャネルを形成している。現在までのところ、ミクログリアではP2X4RとP2X7RだけがP2XRの特徴を正確に示している。P2X7は、IL-1β放出を導くNLRP3インフラマソーム活性化の鍵となるステップである、その確立されたプロ炎症性役割のために、アルツハイマー病のコンテキストで最も研究されている(BhattacharyaとBiber 2016; Adinolfi et al 2018)。P2X7Rは、アルツハイマー病患者の脳においてアップレギュレーションされており(McLarnon et al 2006;Martin et al 2018)ラット海馬におけるアミロイドβペプチドの投与は、P2X7R発現を増加させる(McLarnon et al 2006)。さらに、P2X7Rのダウンレギュレーションまたはブロックは、ATPおよびアミロイドβによって刺激されたミクログリア細胞培養物中のプロ炎症性サイトカイン放出を減少させる(Ni et al 2013)。一方、Martin et al 2018)は、P2X7R欠損がIL-1βレベルを変化させることなく認知機能を改善し、アミロイド負荷を減少させることを実証している。この一連のデータは、アルツハイマー病におけるP2X7Rのプロ炎症性役割を示唆している。最後に、機能喪失を引き起こすP2X7RのC489T多型は、アルツハイマー病患者では頻度が低いことが判明し、アルツハイマー病の病因におけるP2X7Rの潜在的な貢献を支持した(Sanz et al 2014)。
反応性ミクログリアにおけるもう一つの高発現P2X受容体は、P2X4Rである。P2X4Rは、ミクログリアの活性化に伴って高度にアップレギュレーションされ、神経障害や炎症過程に関与している(Suurväli et al 2017)。P2X4Rはアルツハイマー病脳患者では減少し、神経細胞P2X4Rはアミロイドβ誘発性神経細胞死を調節しているようであるが(Varma et al 2009)アルツハイマー病におけるミクログリアP2X4Rに関する研究はまだ行われていない。
第三の主要なプリン作動性受容体ファミリーは、A1,A2a、A2B、およびA3受容体からなるアデノシンP1Rである。P1Rは中枢神経系に豊富に発現するGタンパク質共役型受容体であり、すべてのP1サブタイプはミクログリアで発現している。A1およびA2a受容体の発現は、アルツハイマー病患者からの死後の組織において調節障害が認められており(Erb et al 2018)したがって、P1受容体がアルツハイマー病に関与している可能性が示唆されている。しかしながら、これまでのところ、アルツハイマー病の文脈におけるミクログリアP1シグナル伝達の寄与については、あまり知られていない。
全体として、これらの少数の研究は、炎症や貪食などの異なるプロセスを介して、ミクログリアのプリン反応性受容体がアルツハイマー病に関与していることを示唆している。しかし、プリリン作動性受容体は、アルツハイマー病の原因となっているすべての神経細胞型に発現しているため、ミクログリアのプリリン作動性シグナル伝達の役割を解明するためには、細胞特異的KOモデルのようなより特異的なツールが必要とされる。
アルツハイマー病におけるミクログリアカルシウムシグナル伝達、十分に研究されていないメッセンジャー
カルシウムシグナル伝達は、ほとんどすべての細胞タイプにおいて重要なセカンドメッセンジャーであり、正常な中枢神経系の機能に不可欠である。多くのミクログリアの機能はCa2+によって媒介されている(McLarnon, 2005; Färber and Kettenmann, 2006)。特に、ミクログリアの反応は細胞内カルシウムの増加を伴っており、これはサイトカインやケモカインの放出を誘導するために必要なプロセスである(Hoffmann et al 2003)。
アルツハイマー病におけるカルシウムシグナル伝達障害は、神経細胞において広く研究されてきたが(Tong et al 2018)アルツハイマー病の文脈におけるミクログリアにおけるカルシウムシグナル伝達については、ほとんど知られていない。初期の研究では、Combsら(1999)は、培養ミクログリアをアミロイドβ25-35ペプチドで刺激すると、細胞内[Ca2+]の一過性の増加をもたらすことを実証した。このカルシウムは細胞内貯蔵庫から放出され、ミクログリアの活性化と神経毒因子の産生につながる。より最近では、McLarnonらは、アルツハイマー病患者からの培養ミクログリアは、非障害者からのミクログリアで測定されたものと比較して、より高い基底Ca2+レベルを持っているが、より低い振幅と長続きするATP誘発カルシウム応答を持っていることを示した、したがって、カルシウムシグナル伝達は、アルツハイマー病患者からのミクログリアで障害されていることを示唆している(McLarnon et al 2005)。
変異したP2YR依存性カルシウムシグナル伝達は、プラークに関連するミクログリアではADマウスモデルで観察されているが、プラークから離れたミクログリアでは、マッチした対照と比較して同様のCa2+活性を示した(Brawek et al 2014)。カルシウムは多くのミクログリア機能を媒介するので、アルツハイマー病の文脈でミクログリアのカルシウムシグナル伝達をさらに調査することは興味深いことかもしれない。特に、いくつかのプリン反応性受容体がアルツハイマー病に関与している可能性が高いので、カルシウムシグナル伝達障害がプリン反応性シグナル伝達障害を伴うかどうかを研究する価値があるかもしれない。
アルツハイマー病におけるミクログリア 最新のホットトピックス
アルツハイマー病におけるミクログリアの関与は比較的新しい研究分野であるが、急速に発展している。上述の経路に加えて、ミクログリア機能に関する現在の知見に基づいて、新たな研究領域が出現したり、再検討されたりしている。以下のパートでは、いくつかの現在のホットなトピックをハイライトする(図2)。これらの新しい研究分野は、アルツハイマー病の病態の理解を深めるのに役立ち、長期的には、患者の層別化や治療戦略の設計に役立つかもしれない。
効率的な治療戦略を設計するための重要な要素である性の二型性
生物学における性的二型の影響はホットな話題であり、アルツハイマー病研究も例外ではない。実際、アルツハイマー病有病率は女性の方が2倍高く(Hebert et al 2013年)アルツハイマー病に苦しむ女性は特定の認知的変化、バイオマーカーパターン、または危険因子の感受性を示す(Ferretti et al 2018)。この性の効果は、最初は、より高い長寿に起因すると考えられていたが、最近の報告では、明らかにそれが唯一の説明ではないことが示されている(Viña and Lloret, 2010)。性の関与はいまだに激しい議論の対象となっており、ヒトの病理に関与する生物学的メカニズムはいまだに論争の的となっている。ほとんどのアルツハイマー病の前臨床研究では、男性か女性のどちらかを使用しているが、両方を使用することは稀であるため、アルツハイマー病の性的二型に関与する細胞および分子機構はまだ十分に理解されていない。しかし、ADマウスモデルにおける性二型の影響を比較した数少ない研究では、すべての研究で雌の方が早熟でより強いアルツハイマー病表現型であることに同意している(表1)。性に基づく影響は、行動レベルと組織学的レベルの両方で、異なるADマウスモデルで観察されている。世界的に見て、雌の認知的変化は若い年齢で現れ、雄よりも強いままである(Clinton et al 2007;Carroll et al 2010;Gallagher et al 2013;Yang et al 2018)。脳の部位、モデル、年齢を問わず、女性はより多くのアミロイド斑を示し、より多くの可溶性アミロイドβの量を示す(Wang et al 2003;Carroll et al 2010;Gallagher et al 2013;Ben Haim et al 2015;Janus et al 2015;Jiao et al 2016;Yang et al 2018)。さらに、後期になると、タウリン酸化レベルおよびPhospho-Tau陽性細胞の数は、雌の方が高い(Clinton et al 2007)。シナプスおよび神経細胞の変性過程もまた、高齢の女性ではより強くなるようである(Jiao er al)。 神経炎症に関連して、高齢のメスADマウスからのグリア細胞は、オスに比べてより強い反応性状態を示し、より高いレベルのプロ炎症性因子と関連している(Jiao et al 2016; Yang et al 2018)。性の影響はADマウスと患者の両方で明らかに確立されているが、これらの修飾が全身的/ホルモン的影響によるものか、それとも細胞レベルでも存在するのかは不明のままである。
表1 各種マウスモデルにおける性二型のアルツハイマー病病態への影響
この表は、アルツハイマー病の性的二型に関する文献を網羅的にまとめたものではない。NCは大脳新皮質、PFCxは前頭前皮質、HCは海馬、SBは小胞体、OBは嗅球、MWMはモリス水迷路、IDEはインスリン分解酵素、?
性的二型がミクログリアの形状および機能に及ぼす影響を強調する研究が増えてきている(表2)。ミクログリアに対する多くの性介在性の影響が実証されている。それらは年齢や脳の部位に大きく依存しているようである。(1)マウスおよびラットの両方において、成体のオスはより高いミクログリア密度を示す(Guneykaya et al 2018; Perkins et al 2018);(2)成体のメスのミクログリアはまた、オスのミクログリアがより大きなソーマを有するのに対し、長くて太いプロセスを有する細胞のより高い割合を示す(Schwarz et al 2012; Guneykaya et al 2018; Weinhard et al 2018)。これらの違いは、男性がより反応性の高い状態を示すのに対し、成体のメスのミクログリアはより恒常性の高い状態にあることを示している可能性がある。機能的な違いも観察され、男性の脳からのミクログリアはより高い遊走率を表示しているのに対し、女性のは貪食関連遺伝子の発現の増加に関連したより強い貪食活性を提示している(Nelson et al 2017; Yanguas-Casas et al 2018)。RNAシーケンシングはまた、男性ミクログリアがより炎症性の表現型を表示している間、女性ミクログリアのためのより保護的なトランスクリプトームプロファイルを明らかにした(Villa et al 2018)。最近の研究では、ミクログリアの電気的特性に対する性の影響も報告されており、性が炎症反応能力に直接影響を与えうる特性であるミクログリア分泌プロファイルに影響を与える可能性が示唆されている(Guneykaya et al 2018)。当初、ミクログリアの性差は循環性ホルモンに依存すると考えられてたが(Nissen, 2017)女性のミクログリアが男性の脳に移植された場合、その保護特性を保持することが示されたため、この見解は最近挑戦された(Villa et al 2018)。
表2 性的二型がミクログリアの形状と機能に与える影響
この表は、ミクログリア性二型に関する文献を網羅的にまとめたものではない。Cxは皮質、HCは海馬、N/Aは欠損データ。
したがって、このミクログリアの性化に関与する分子経路はほとんど不明のままであるが、現在のデータは、少なくとも成人期には、女性のミクログリアは、より恒常性と保護状態にあることを示唆している。アルツハイマー病の文脈では、それは恒常性機能にコミットした女性のミクログリアが有害な刺激に正しく答えるために彼らの形状と機能を分極するために、より長い時間の暴露やより強い刺激を必要とするだろうと推測することができる。さらに、彼らが最終的にアミロイドβに反応するとき、彼らは彼らの局所環境を低炎症性環境から高炎症性環境に変更する。この劇的な変化は、ミクログリア自身だけでなく、他のすべての周囲の細胞にもより有害な影響を及ぼす可能性があり、なぜ女性がこの病理を発症しやすいのかを説明することができるかもしれない。
ミクログリア機能に対する性の影響は、様々な中枢神経系の病態に暗示されているが(Sorge et al 2015;Charriaut-Marlangue et al 2018;Jullienne et al 2018;Mapplebeck et al 2018;Thion et al 2018年)アルツハイマー病の開始と進行におけるミクログリアの性的二型性の影響を理解し、それがアルツハイマー病における性の不均衡にどこまで依存しているかを理解するために、さらなる研究が必要である。また、性的二型性のメカニズムがヒトモデルと動物モデルで類似しているかどうかも明らかにする必要がある。
ミクログリアの多様性は挑戦と機会の両方である
ミクログリア細胞の多様性は、1919年にピオ・デル・リオ=ホルテガ(Pio del Rio-Hortega)によって初めて記述されて以来、認識されてきた(Sierra er al)。 彼はまた、ミクログリアの形態が疾患状態でかなり変化することを確立し、ミクログリアがその局所環境に緊密に適応するという概念を導入した。病理状態におけるミクログリアのより最近の機能的、形態学的、免疫組織化学的、中程度のスループット解析では、反応性表現型の多様性の存在も指摘されている(Hanisch and Ketternmann, 2007; Ransohoff and Perry, 2009; Kierdorf and Prinz, 2017)。この点に関して、現在、いくつかの半自動化ツールが、表現型的に異なるミクログリア細胞サブ集団の同定を可能にするために利用可能である(Wagner et al 2013;Verdonk et al 2016;Salamanca et al 2019)。
過去10年間で、改善された細胞精製技術と組み合わせたハイスループットトランスクリプトームアプローチの開発は、生理学的(Grabert et al 2016)および病態生理学的条件の両方において、ミクログリアの分子多様性の理解を洗練させるのに役立った(Hirbec et al 2017;Holtman et al 2017;Sousa et al 2017;Dubbelaar et al 2018)。彼らは、ミクログリアは、生理学的および病理学的状態の離散的な数に分類することができないことを確立した。しかし、ミクログリアの多様性の評価におけるブレークスルーは、単細胞ハイスループットアプローチの出現から生じた。特に単細胞RNAseq(scRNA-seq)は、細胞分解能での多様性の調査を可能にし、細胞状態の多様性と生体内のそれを反映した変化の詳細な検討を可能にする(Macosko et al 2015)。
2つの非常に最近のscRNA-seq研究は、マウスの発生中、および神経変性状態または炎症状態のいずれかにおいて、ミクログリアの空間的および時間的多様性を確立した(Hammond et al 2019; Masuda et al 2019)。これらの研究は、より焦点を絞った以前のもの(Keren-Shaul et al 2017;Friedman et al 2018)とともに、異なるミクログリア亜集団が、与えられた生理学的または病理学的状態で共存することを確立した。ミクログリア細胞集団内のこのような不均一性は、課題と機会の両方を表している:明確なサブポピュレーションの存在は、有益なサブポピュレーションを促進し、および/または有害なものを妨げることのいずれかを目的として、特定のサブポピュレーションをターゲットとした特定の治療法の設計をサポートしている。
アルツハイマー病のミクログリアの多様性についてはどうか?それは、アルツハイマー病の脳は少なくとも2つの非常に異なる形態学的ミクログリアの表現型を示すことが長年にわたって知られている:アミロイド斑に関連付けられている細胞が “反応性”/アメーバのような表現型を表示する一方で、それらの実質の残りの部分に存在するものは、恒常性のような形態を持っている(Krabbe et al 2013)。この多様性の重要性の印として、それは、ADマウスから分離されたミクログリアでアップレギュレートされた転写物は、アミロイド斑から遠いものと比較して、アミロイド斑の近傍で分離された組織でより高度に発現していることが示された(Orre et al 2014)。このことから、プラークに関連するミクログリアが特定のシグナル伝達経路や機能を活性化していることが示唆された。ソートされた5x家族性ADマウス脳免疫細胞のscRNA-seqを用いて、Keren-Shhaul et al 2017)は、疾患の進行に伴って相対的な豊富さが増加し、アミロイドプラーク周辺に優先的に位置するDAMを含む、3つの異なるサブタイプのミクログリアを同定した。このDAMのトランスレーショナル関連性は、特定のDAMマーカーがアルツハイマー病患者のミクログリアのサブセットで発現しているが、対照被験者では発現していないヒトの死後脳で確認された。より最近、ノックインAPPNLFG ADマウスモデル(Saito et al 2014; Sala Frigerio et al 2019)において、活性化およびインターフェロン応答ミクログリア(それぞれARMおよびIRM)が同定された。ARMはDAMと部分的に重複しているが、細胞軌跡推論法を適用することで、これらの最後の著者は、ARMが疾患状態のみに存在するのではなく、正常な脳の老化過程の一部であることを実証した。しかし、この多様性の機能的意義については、多くの未解決の疑問が残されている。特に、アルツハイマー病の進行中にいつ発生するのか、病気の前段階ですでに存在しているのか、という点である。技術と分析方法の両方の進歩により、それは現在、アルツハイマー病の進行全体でミクログリアの多様性のより深い理解を得ることが可能である。特定の、潜在的にサイズが小さい、ミクログリア亜集団の同定は、トランスレーショナルアプリケーションのための重要な意味を持つ可能性がある。これらの小集団によって放出され、脳脊髄液に拡散する因子の同定は、新しいバイオマーカーの同定につながる可能性がある。さらに、特定のサブ集団を同定することは、疾患の進行に寄与する新たな経路や機能の発見に役立ち、より特異的で機能的なポジトロン断層撮影(PET)トレーサーの開発につながる可能性がある。これらのサブ集団が神経細胞を含む脳細胞に有益な影響を与えるのか、中立的な影響を与えるのか、あるいは有害な影響を与えるのかを解明することは、疾患を修飾する革新的な治療戦略を設計するための道を開くことになるであろう。
早期のバイオマーカーを特定するためにアルツハイマー病を早期に研究する
長年の臨床試験が失敗した後、科学者たちは今、アルツハイマー病は我々が治療するのではなく、予防(または停止)したいと思うかもしれない病理学であることを認識している。このことは、前兆診断や革新的な疾患修飾治療戦略を設計するために非常に不足している早期診断バイオマーカーの同定を求めている。アルツハイマー病の初期段階はまだあまり研究されていないが、現在では、初期の制御異常を解明するために前駆期に焦点を当てた研究が増えている。
ミクログリアの主な役割の一つは、環境を感知して危険に反応することであるため、ミクログリアは、アルツハイマー病に駆動された変化に対する脳の初期反応において重要な役割を果たしている可能性が高い。これと一致して、最近のPETおよび磁気共鳴画像法(MRI)に基づく研究では、アルツハイマー病患者は病理の他の特徴を示す前に最初のミクログリア活性化ピークを有することが示されており、ミクログリアの機能不全がアルツハイマー病の開始に決定的に関与していることが示唆されている(Fan et al 2017)。アルツハイマー病の開始段階におけるミクログリアの関与は、疾患の進行を遅らせるために、どのミクログリア標的を早期に調節することができるかという疑問を提起している。
細胞外小胞(EV)は、エクソソームやマイクロベシクル(MV)を含む小膜小胞の一族であり、様々な種類の分子を輸送している。近年、細胞間の新たなコミュニケーション手段としてEVが登場している。ミクログリアのEVやMVを分泌する能力は、その本質的な炎症機能の一部である。アミロイドβ貪食プロセスにおいて、過負荷のミクログリアは、アミロイドβを含む小分泌小胞を放出することができ(Joshi et al 2014)またエクソソソームを介してTauまたはP-Tauを放出することができる(Saman et al 2012; Asai et al 2015)。したがって、MCIまたは早期アルツハイマー病患者の脳脊髄液で検出されたミエロイドMVのレベルは、それらの白質損傷の程度と相関している(Agosta et al 2014)。ミクログリアEVは、したがって、初期の段階で病理学を広げるための可能な手段とみなされる可能性がある。興味深いことに、それらは分泌され、最初に脳脊髄液コンパートメントにアクセスし、次に血液にアクセスすることができるので、ミクログリアEVは貴重な診断ツールを表す可能性がある(Trotta et al 2018)。
酸化ストレスは、必要ではあるが潜在的に有害なプロセスとして知られている。線維性アミロイドβに応答して、反応性ミクログリアは、NADPHオキシダーゼ(NOX)を介してフリーラジカル、特にスーパーオキシドを産生する(Harrigan et al 2008)。さらに、MCI患者では対照群と比較してNOX活性が増加している(Bruce-Keller et al 2010)。これらの知見は、アルツハイマー病の初期ミクログリア反応のマーカーとしてNOX活性を用いることに道を開くものである。特定の化合物を介してNOX活性を妨害することはまた、病理学を遅らせるための手段を提供する可能性がある(DumontとBeal 2011)。
鉄は重要な生物学的プロセスに関与する重要な金属である。しかしながら、細胞内鉄過負荷は、神経細胞の変性につながる可能性がある(Zhang er al)。 ミクログリアは、鉄と相互作用し、鉄を輸送し、代謝することができる。彼らがプロ炎症性因子を分泌すると、ミクログリアは神経細胞の鉄の取り込みを刺激して神経変性の増加につながることができる(Zhang et al 2014)。興味深いことに、特定の鉄過負荷障害を持つ患者は、鉄が病理学の開始ステップに関与している可能性があることを示唆している、より早いアルツハイマー病の発症を受ける。さらに、鉄キレーションはアルツハイマー病患者にとって有益であると思われる。アルツハイマー病におけるミクログリアの鉄調節の早期の含意を理解するためには、さらなる研究が必要である(Nnah and Wessling-Resnick, 2018)。
発見への障壁
基礎的な知識は重要であるが、生理学的・病理学的条件における細胞の機能と機能不全を特徴づける究極の目標は、臨床的に有益な効率的な治療戦略を設計することである。アルツハイマー病の複雑性を理解することは、21世紀の課題の一つである。そのためには、主に病態(アミロイド沈着、高リン酸化タウ、認知機能の変化など)を模倣した動物モデルに頼っている。しかし、これまでのところ、これらのモデルから得られた結果は、一般的に臨床への翻訳に失敗しており、症状のある、効率の悪い治療法しか存在していない(Ransohoff, 2018)。以下の2つの段落では、アルツハイマー病の前臨床研究において過小評価されている可能性のある2つの重要な要因、すなわち、現在のADマウスモデルの関連性と、マウスとヒトの間の免疫学的な違いを探る。これらの注意事項は、アルツハイマー病におけるミクログリアの役割の研究にのみ適用されるものではなく、あらゆる前臨床研究のデザインのために考慮すべき重要な問題である。
現在のマウスモデルはアルツハイマー病を理解し、薬物標的を特定するために調整されているか?
ほとんどの動物モデルは、ヒトのタンパク質変異を過剰発現させるように遺伝子操作されており、それぞれの副産物の過剰発現にもつながり、その結果、潜在的な交絡因子が発生する(Sasaguri et al 2017)。さらに、ほとんどのADモデルは家族性突然変異に基づいているが、早期発症の家族性アルツハイマー病はアルツハイマー病症例全体の3.5%しか占めていないと推定されている(Harvey et al 2003)。さらに、これらのモデルの中には、患者では発見されなかった突然変異の組み合わせに基づいているものもある。アルツハイマー病の最初の特徴であるため、ほとんどのモデルはアミロイド生成経路に焦点を当てていた(Sasaguri et al 2017)。しかし、ヒトでは、アミロイドβとP-Tauの併用効果があることが明らかになっている。この問題を解決するために、3x-TgモデルはアミロイドβとTauの関連する特徴を組み合わせている。しかし、このモデルでは、アミロイドの蓄積やタウの調節障害が起こる前に認知障害が現れるため、症状の出現の速度論的な観点からは病態を十分に表現できていない(AlzForum1)。これらの問題を解決するために、マウスベースまたはヒトベースの新しいモデルが作成される(セクション “アルツハイマー病研究の新しい機会 “を参照してほしい)。
ミクログリアがアルツハイマー病に与える影響を研究するために、ミクログリア専用ツールとADモデルを組み合わせた新しいモデルが作成されている(Zhou er al)。 最も一般的に使用されているモデルの1つは、フラクタルカイン受容体CX3CR1の対立遺伝子をGFPに置き換えたCX3CR1+/eGFP x APP/PS1株で、ミクログリア細胞を追跡できるようになっている。しかし、私たちの知識に、アルツハイマー病の発達にCX3CR1ハプロ欠損の影響はまだ徹底的に調査されていない。最後に、アルツハイマー病研究は一般的に病理症状や特徴が確立されている高齢のマウスで行われる。病態のこの段階では、おそらく効率的な疾患修飾薬の同定のためにあまりにも進行している。
ヒトとマウスは免疫学的に似ていない
炎症の分野では、Seok et al 2013)の包括的な研究により、ヒトの重度の炎症状態(内毒素血症、火傷、外傷)のマウスモデルにおける遺伝子異常は、ヒトのゲノム変化とは相関しないことが明らかになった。このことは、脳疾患を含む疾患における免疫細胞の役割を研究するためのマウスモデルの妥当性に疑問を投げかけている。免疫機能に重要であることが知られているいくつかの因子は、げっ歯類とヒトの研究では異なっている。最も多くの場合、げっ歯類モデルや研究では、ヒトの遺伝的背景がはるかに多様であるのに対し、近交系の系統が使用されている。さらに、研究用マウスモデルが厳密に管理された環境で飼育されているのに対し、ヒトは複数の疾患にさらされている(Davis, 2012)。
機能研究では、内因性(すなわち、M-脳脊髄液)または外因性(すなわち、LPS)刺激に対するヒトミクログリアの応答を調査した(Melief et al 2012; Smith et al 2013)。ほとんどの場合、それらはマウスの解析と同等の結果を示し、したがって、ヒトおよびマウスミクログリアにおける遺伝子発現プロファイルを比較し、全体的に、遺伝子発現は両種において非常に類似していると結論づけた2つの包括的なトランスクリプトーム研究と一致する(Galatro et al 2017; Gosselin et al 2017)。脳疾患に関心のあることとして、神経変性への応答におけるヒトおよびマウスミクログリアの間の良好な相関関係は、他の著者によっても観察された(Holtman et al 2015;Keren-Shhaul et al 2017;Krasemann et al 2017)。
しかし、それらのグローバルな類似性にもかかわらず、かなりの数の遺伝子がマウスとヒトのミクログリアでは異なる発現をしている。特に、特定の免疫遺伝子は、ヒトサンプルにおいてのみ発現している(Gosselin et al 2017)。さらに、マウスとヒトとの間で、系統依存性およびシグナル依存性転写因子の相対的な発現の違いが観察された(Holtman et al 2017)。一致して、先行研究は、マウスとヒトのミクログリアの間で有意に異なるいくつかの分子経路およびシグナル伝達機能を同定した。これには、増殖、TGFβ1への応答、Siglecsシグナル伝達、一酸化窒素(NO)産生、およびバルプロ酸(VPA)などの特定の薬剤への応答が含まれる(Smith and Dragunow, 2014)。
アルツハイマー病に関連して、アルツハイマー病の危険因子として同定されているSiglec-3(CD33)は(Bertram et al 2008)発現パターンおよびリガンド認識において実質的な種差を示す(Lajaunias et al 2005)。さらに、平均寿命がヒトに比べてはるかに短いげっ歯類では、免疫機能や認知機能の加齢に伴う変化が正しくモデル化されていない可能性がある。したがって、加齢に伴うヒト脳の遺伝子発現変化は、マウス脳の遺伝子発現変化とは大きく異なる(Loerch et al 2008; Bishop et al 2010)。これと一致して、Galatro et al 2017)は、ヒトとマウスのミクログリアの加齢に伴う変化には限定的な重複があることを明らかにしており、高齢化マウスで得られたデータは注意してヒトの状況に外挿すべきであることを強調している。また、マウスからヒトへの結果の翻訳は、患者のミクログリア反応性を正確に特徴づけるツールがないために妨げられている。TSPOの結合は、これまでのところ、臨床的な文脈でミクログリア反応を研究する唯一の方法である。
ヒトのミクログリアを精製、培養、実験する方法が確立されているが、高品質の研究の要件を満たすヒトサンプルへのアクセスは限られている。したがって、ADマウスモデルは、特定のミクログリア機能とシグナル伝達経路の役割を解読するために有用であることは間違いない。しかし、上記で強調された種の違いは、マウスモデルで得られた結果をヒトのサンプルで確認することを促すはずである。
アルツハイマー病研究の新たな機会
アルツハイマー病を研究するための現在のモデルには複数の限界がある一方で、科学者たちは限られた落とし穴の中で新しいモデルを生み出そうとしている。この最後の部分では、現在開発されている新しいアプローチをレビューしている。これらのアプローチは、ミクログリア機能に関する知識を向上させ、試験管内試験研究、げっ歯類モデル、ヒト疾患とのギャップを埋めるのに役立つと期待されている。
識別された落とし穴を克服する有望な動物モデル
マウスモデルには大きな落とし穴があるが、前臨床研究においては魅力的なモデルである。実際、マウスは小型で飼育が容易な哺乳類であり、適度な寿命を持っている。マウスは飼育下でもよく繁殖し、比較的簡単に遺伝子操作やヒト化が可能である。さらに、幅広いマウス系統のレパートリーが指数関数的に開発されており(Model Organism Development and Evaluation for Late-Onset Alzheimer’s Disease2)科学者は異なるマウス系統を組み合わせることで新たな仮説を探求することが可能である。この文脈で、そしてAPPの過剰発現に関連する問題を克服するために、齋藤博士と西堂博士は、新しいノックインADマウスモデル、すなわちAPPNLFマウスとAPPNLFGマウスを開発した(Saito et al 2014)。 これらのモデルはまだ徹底的に特徴づけられておらず、タウ関連の機能障害はまだ除外されている。しかしながら、APPNLFモデルでは、アミロイドβ沈着が出現する前の遅延は、疾患の前駆期を研究するための興味深いモデルを代表する可能性があることを支持する。
遺伝子改変に基づかない他のモデルもここ数十年の間に出現している。人間と比較して、犬はAPPを処理するための酵素機構をほぼ同じものを共有している。さらに、彼らは、アルツハイマー病のいくつかの側面を再現する加齢に伴う認知機能障害を自然に発症する可能性がある(Schmidt et al 2015)。その高い寿命により、イヌモデルは、疾患の初期段階におけるアミロイドβの沈着とクリアランスに関与する経路を研究するために特別に有用である可能性がある(Sarasa and Pesini, 2009)。ヒトの病理学に近づくために、いくつかの霊長類モデルは現在、アルツハイマー病を研究するために使用されている。ヒトへの彼らの系統的な距離に応じて、彼らはどちらも神経学的変化の同じ運動学的または種類を表示しない(ホイヤー et al 2012)。霊長類の中で、また、灰色マウスキツネザルとして知られているMicrocebus Murinusは、特に興味深いものである(Bons et al 2006)。実際、彼らはマウスの大きさ以上の小さな動物である。彼らは数匹の個体のコホートで飼育することができ、飼育下で繁殖することができる。加齢に伴い、一部の個体は自然にアミロイドβプラーク(Mestre-Francés et al 2000)を伴うアルツハイマー病のような病理を発症し、特定のトランスクリプトームリモデリング(アミロイドβdel Rassoul et al 2010)と関連している。組織学的特徴もまた、認知的変化と関連しているようである(Trouche et al 2010)。少なくとも脊髄においては、灰色マウスキツネザルのミクログリアの形状と分布がマウスに比べてヒトに近いことがわかっているが(Le Corre et al 2018)ミクログリアはこのモデルではまだ十分に研究されていない。この加齢性アルツハイマー病のような病態におけるミクログリアの関与を調べるためには、さらなる研究が必要である。
犬モデルと霊長類モデルの両方が興味深いモデルを表しているが、それらはそれほど簡単に使用できるものではない。例えば、Microcebus Murinusのための繁殖センターは世界的にわずかしかない。また、これらの動物はより多くの収容スペースを必要とし、その利用には抜本的な倫理的ルールが課せられている。さらに、研究ツールの多くはマウスのゲノムやタンパク質を使って設計されているため、これらの特殊なモデルの使用は制限されている。
hiPSCs由来ミクログリア。アルツハイマー病におけるミクログリアの役割を解明するための新たなツール
種の問題を克服するためには、ヒト由来のミクログリア細胞株が有用である。これらの細胞株は、特定の生物学的機能や機能的な経路を研究することができるが、細胞の複雑さを再現することはできない。このことは、ミクログリアと同様に、環境に高度に適応している細胞に特に当てはまる。骨髄由来または血液単球由来のマクロファージは、ヒトのミクログリア様細胞のもう一つの供給源である。しかし、これらの細胞は根本的に異なる胚由来であるため(HoeffelおよびGinhoux 2015)それらはおそらく成体ミクログリアの貧弱なモデルである。成体一次ミクログリアは、解離した脳領域から収穫することができるが、このプロセスは一般的に低収率につながり、ヒトサンプルのためにまばらにしか得ることができない。さらに、単離プロセスや培養方法は遺伝子発現パターンに影響を与えるため、これらのアプローチに基づく結果の解釈には注意が必要である(Gosselin et al 2017)。
これらの問題に代わる方法として、細胞の再プログラミング法の開発があり、これは、健康な個体からだけでなく、特定の疾患を持つ患者からもヒト多能性細胞株(hiPSCs)を生成する可能性を提供する(Sullivan and Young-Pearse, 2017)。ヒトiPSCs由来の神経細胞は、一貫した収率で生産することができる。アルツハイマー病の文脈では、アルツハイマー病に見られる変異を有する家族性アルツハイマー病(家族性アルツハイマー病)患者または散発性アルツハイマー病(Sアルツハイマー病)患者のいずれかから発行されたiPSC由来のニューロンは、疾患の主要な特徴のいくつかを再現している(Poon et al 2017)。同様に、アルツハイマー病患者のiPSCに由来するアストロサイトは、炎症性サイトカインのアップレギュレーションを含む、有意な形態学的および機能的変化を示す(Chandrasekaran et al 2016; Auboyer et al 2019)。
ヒト多能性細胞株は最近、ミクログリアへの分化に成功している(Muffat et al 2016;アミロイドβud et al 2017;Douvaras et al 2017;Haenseler et al 2017;Takata et al 2017;PocockおよびPiers 2018)。hiPSCs由来のミクログリアを得るためのコンセンサスプロトコルはまだ存在しないが、すべてのプロトコルは、この細胞型のオントジェニーに基づいて同様の手順に従う。このようなプロトコルに基づいて、Garcia-Reitboeck et al 2018)は最近、TREM2 T66MおよびW50CキャリアからのhiPSCs由来ミクログリアにおけるミクログリアの機能障害を記載し、したがって、アルツハイマー病におけるミクログリアの機能および機能障害の役割を解読するために、このようなiPSCsアプローチの関心を概説している。異なる患者(すなわち、異なるSアルツハイマー病および/または異なる家族性アルツハイマー病変異)に由来するミクログリアが同じ分子および/または機能的特性を共有するhiPSCsをどこまで拡張するかを解読することは、アルツハイマー病の不均一性をよりよく理解するのに役立ち、アルツハイマー病における個別化された治療を実施するためにhiPSCsの使用に向けた道を開く可能性がある。
重要な新しい概念は、ミクログリアは中枢神経系環境に高度に適応した中枢神経系常駐マクロファージであるため、真のミクログリア機能を持つhiPSCs由来のミクログリアを得るためには、2つのステップのプロトコルが必要であるということである。このスキームでは、第一のステップは、iPSCs由来のマクロファージ前駆体を得ることであり、第二のステップは、条件付き環境、すなわち他の神経細胞の存在下でそれらを成長させることである(Lee C.Z.W. et al 2018)。このような実験的設定の下で、hiPSCs由来のミクログリアは、脳孤立ミクログリアに近い表現型、遺伝子発現プロファイル、および機能的特性を示す(Pandya et al 2017; Takata et al 2017)。
組織アーキテクチャの維持は、生体内試験研究の重要な側面である。興味深いことに、HiPSCs由来の細胞は、試験管内試験の操作および実験を可能にしながら、脳のサイトアーキテクチャーおよび結合性をモデル化するために、3D培養で増殖させることができる。このような3Dまたはオルガノイドモデルは、生理学的および生理学的病理学的文脈に近い条件でヒトのミクログリアを研究するための道を開いている。患者とコントロールの間の遺伝的背景の違いによる共創因子のリスクを軽減するために等原性コントロールを開発する必要性など、このようなアプローチには特定の落とし穴が存在するが、これらのアプローチがアルツハイマー病の進行におけるミクログリアの役割を解読する上で有用であることはほとんど疑いの余地がない。
おわりに
ミクログリアを含むグリア細胞はアルツハイマー病に関与していると疑われてきたが、その理由は神経細胞の機能障害(アミロイドやタウの集合体など)に反応する能力にあると考えられてきたからである。グリア細胞を二次的なものと考えていたこの神経中心的な見解は、グリア細胞で優先的にまたは排他的に発現している遺伝子に関連するアルツハイマー病のリスクに関連する遺伝子座を同定する遺伝学的関連研究の結果によって、最近挑戦されている(Verheijen and Sleegers, 2018)。これにより、アルツハイマー病がどのようにして発症し、進行するかについての見解が洗練され、分子レベルと細胞レベルの両方で、アルツハイマー病の病態生理学的メカニズムについての新しい概念とアイデアが導入された。
反応性ミクログリアは、環境を感知して反応する能力を持っているため、病気の進行において初期段階で重要な役割を果たしている可能性が高く、初期のバイオマーカーの同定につながる可能性がある。彼らは、アストロサイトの機能的変化を駆動することができるので(LiddelowおよびBarres 2017)および非神経性免疫細胞とのクロストーク(Dionisio-Santos et al 2019)彼らはまた、疾患の進行を停止または制限するための魅力的な薬物標的を表している。
ここで報告されているように、アルツハイマー病に対する異なる反応性ミクログリアサブタイプの正確な寄与は、現在のところ不明であり、激しい研究の対象となっている。ここ数年の間に、いくつかの技術的なブレークスルーが達成され、科学者は新たな挑戦的な問題に取り組むことができるようになった。これらの技術開発により、中・高スループットのフローでミクログリアの役割を研究し、保存された環境でミクログリアの機能の詳細な解析を行うことが可能になった。アルツハイマー病の開始と進行に対するミクログリア細胞の貢献をよりよく理解することは、この分野への再投資に対する製薬会社の関心を新たにし、より良いデザインの戦略への道を開くことが期待されている。
アルツハイマー病におけるミクログリアの役割を完全に解読するためには、性別、年齢、種、分子の多様性、健康状態、周辺部とのコミュニケーションなど、多くの要因を考慮する必要がある。これらは、革新的な治療戦略を定義し、この壊滅的な疾患の社会経済的負担を軽減することが期待される、挑戦的であると同時に非常にエキサイティングな研究分野であることは間違いない。