Contents
Microglia Fighting for Neurological and Mental Health: On the Central Nervous System Frontline of COVID-19 Pandemic
www.ncbi.nlm.nih.gov/pmc/articles/PMC7961561/
オンラインで2021年2月18日に公開
概要
新型コロナウイルス感染症(COVID-19)は、心肺機能の変化が特徴的であるが、最近では感染者に神経症や精神症状が見られるとの報告も増えている。COVID-19では,重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)の侵入,全身性の炎症反応の亢進,低酸素症などが中枢神経系に影響を与えている可能性がある。
パンデミックによる心理社会的ストレスは、COVID-19患者だけでなく、非感染者の中枢神経系にも影響を与え、さまざまな神経疾患や精神疾患の発生や悪化の原因となる可能性がある。ミクログリアは、中枢神経系の恒常性維持や炎症反応の中心的な役割を果たしており、他の中枢神経系細胞と協調して重要な機能を発揮している。脳実質の恒常性が損なわれると、ミクログリアはその密度、形態、分子シグネチャーを変化させ、その結果、機能を調整する。
この総説では、COVID-19に起因する中枢神経系障害に対する神経保護および神経毒性反応に、ミクログリアがどのように関与しているかを論じている。これらの反応が、COVID-19患者や一般の人々に報告されている神経学的および精神医学的症状を、少なくとも部分的にはどのように説明するのかを検討する。さらに、高齢者や既往症のある人など、特定の集団における中枢神経系の脆弱性の増大に、ミクログリアがどのように寄与しているかを考察する。
キーワード
ミクログリア、COVID-19,SARS-CoV-2,中枢神経系、サイトカイン、低酸素、神経学的症状、心理社会的ストレス
はじめに
パンデミック当初、重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)感染によるコロナウイルス感染症2019(COVID-19)は、呼吸器系のみに影響を及ぼすと考えられてた(Wang er al 2020b)。しかし、感染した患者に嗅覚や味覚の症状が現れたという報告が増えたことから、中枢神経系(CNS)に被害が及ぶ可能性が示唆された(Agyeman et al 2020)。シナリオが進展するにつれ、COVID-19の神経学的症状のさらなる報告が現れ、脳症、脳血管障害、さらにはうつ病や不安の精神症状などが報告された(Gautier and Ravussin, 2020; Giacomelli et al 2020; Mao et al 2020; Poyiadji et al 2020; Taquet er al)。 同時に、パンデミックは、一般の人々に、メンタルヘルス障害の強い予測因子である高度な心理社会的ストレス(Brooks et al 2020,McGinty et al 2020,Pierce et al 2020)を広く課している(Maes et al 1998年、Schneiderman et al 2005)。また、重症急性呼吸器症候群コロナウイルス1(SARS-CoV-1)や中東呼吸器症候群コロナウイルス(MERS-CoV)などの類似のコロナウイルス(CoV)も最近、精神疾患や神経疾患と関連しており、有病率はSARS-CoV-1で0.09%、MERS-CoVで0.36%とされている(Ellul er al)。 一見、割合が低いように見えるが、COVID-19の報告数の多さ[78,383,527,2020年12月26日現在 WHO Coronavirus Disease (COVID-19) Dashboard (2020)]を考えると、SARS-CoV-2でも同様の割合であれば、約70,545人が影響を受けたことになる(Ellul et al 2020)。
このような多様な症状の原因は、まだ解明されていない。この総説では、COVID-19が神経学的および精神的な健康に及ぼす影響について、さらなる研究を促し、方向付けるために、いくつかの推定される原因について論じている。中枢神経系におけるSARS-CoV-2感染、脳における低酸素由来の損傷、COVID-19感染者における炎症性因子の過剰な循環などである。これらの要因が相乗的に作用して、中枢神経系の自然免疫細胞であるミクログリアによる防御反応や神経毒性反応を引き起こすこと、さらにSARS-CoV-2感染時に生じる神経学的・精神医学的症状との関連性を示唆している。最後に、COVID-19に感染した人と一般の人々の両方において、パンデミックによって課せられた心理社会的ストレスの負担を考察する。感染していなくても、ミクログリアがストレスに反応し、弱い立場にある人々の精神的健康に深刻な影響を与える可能性があることを取り上げる。
ミクログリアはSARS-CoV-2感染による中枢神経系への影響を媒介する
SARS-CoV-2の直接感染による中枢神経系への影響
COVID-19の中枢神経系関連症状は、SARS-CoV-2の脳への感染に起因すると考えられる。中枢神経系への侵入経路としては、(i)神経細胞による輸送、(ii)血行性輸送、の2つが提案されている(図1)。
図1 COVID-19パンデミックの際、ミクログリアは、ウイルス感染、低酸素傷害、過剰な循環サイトカイン、心理社会的ストレスなど、さまざまな中枢神経系(CNS)のインシュルトに反応する
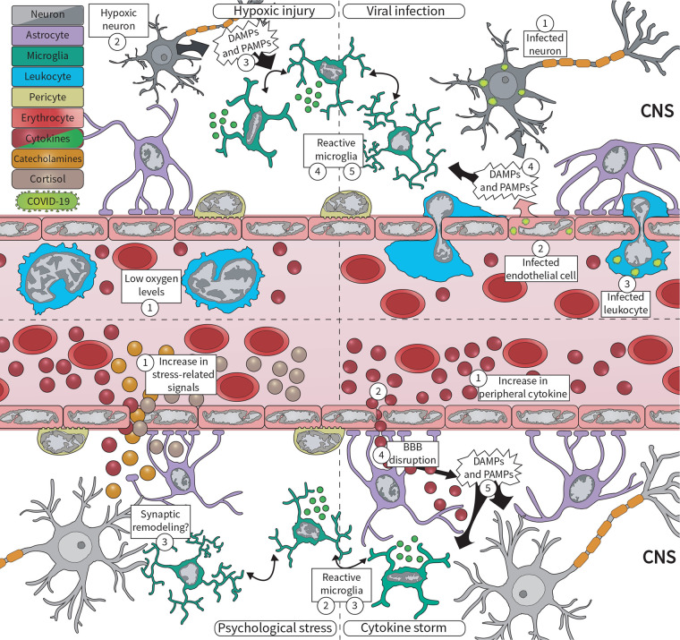
上段)重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)は、(1)末梢に感染した神経細胞、(2)感染した微小血管の脳内皮細胞、(3)感染した浸潤白血球を経由して脳内に侵入する。感染した細胞は、(4)ダメージ関連分子パターン(DAMPs)や病原体関連分子パターン(PAMPs)を放出し、それをミクログリアが感知して(5)反応する。同時に、COVID-19の病態は、(1)低酸素状態を助長し、脳内の低酸素傷害を引き起こすと考えられる。神経細胞は酸素不足に非常に敏感で、(2)すぐに損傷を受け、(3)DAMPsやPAMPsを放出する。これを(4)ミクログリアが感知し、ミクログリアは形態、分子シグネチャー、サイトカインの放出を変化させて反応する。下段)COVID-19は、炎症反応の悪化とも関連しており、(1)循環サイトカインの増加、すなわちサイトカイン・ストームが特徴的である。これらのサイトカインは、例えば、(2)血液脳関門(BBB)を介してシグナルを送り、(3)ミクログリアによって素早く感知されるなど、さまざまな経路を介して脳にシグナルを送る。さらに、過剰なサイトカインは(4)BBBの破壊を促進し、脳内のサイトカインレベルだけでなく、(5)全身性ウイルス感染に伴うDAMPsやPAMPsも増加させる可能性がある。最後に、心理社会的ストレスは、コルチゾール、カテコールアミン、サイトカインの産生を促し、(1)循環系に放出される。ミクログリアは、これらの要因に反応して、(2)反応性を高め、(3)シナプスのリモデリングを機能不全に追い込む可能性がある。
神経細胞ルート
神経細胞ルートは、嗅覚神経や迷走神経などの感染した末梢神経からの逆行性軸索輸送に依存している(Desforges et al 2019,DosSantos et al 2020)。他のCoVを含むSARS-CoV-2関連ウイルスの多くは、嗅覚神経線維を利用して中枢神経系に侵入する(Koyuncu er al 2013)。SARS-CoVの高親和性受容体であるヒトアンジオテンシンI変換酵素2(ACE2)タンパク質を発現させたトランスジェニックマウスでは、SARS-CoV-1を鼻腔内投与したところ、嗅神経に感染し、嗅球、大脳皮質、基底核、中脳へと徐々に広がっていった(Netland et al 2008)。同様に、COVID-19に伴う重度の呼吸不全で死亡した患者では、嗅神経、直回、脳幹にSARS-CoV-2ウイルス粒子が検出された(Bulfamante et al 2020)。同様に、免疫組織化学的分析により、COVID-19患者の剖検された嗅球では、延髄下部に由来する脳神経にSARS-CoV-2タンパク質が検出され、高度な反応性グリア細胞、すなわちグリオシスが見られた(Matschke er al)。 嗅覚系への感染は、患者の嗅覚皮質で測定された頻繁な嗅覚喪失および磁気共鳴画像(MRI)信号の増加とも一致する(Lu er al 2020; Politi er al 2020)。しかしながら、ACE2およびもう一つのSARS-CoV-2受容体である膜貫通型セリンプロテアーゼ2(TMPRSS2)が、嗅覚系の神経細胞に特異的に発現しているかどうかは依然として不明であることに留意する必要がある(Brann et al 2020;DosSantos et al 2020)。
小腸内皮細胞(EC)における豊富なACE2の発現(Haming et al 2004)や、COVID-19患者における胃腸症状の発生率(Chen et al 2020a;Wang et al 2020b)からも、腸管神経系が関与する仮説的な神経細胞ルートが促された。実際、この戦略は、CoVを含むいくつかの神経刺激性ウイルスについて提案されている(DosSantos et al 2020)。例えば、MERS-CoVの受容体であるヒトジペプチジルペプチダーゼ4(DPP4)タンパク質を発現させたトランスジェニックマウスにMERS-CoVを胃内接種したところ、腸細胞、肺、脳への感染が生じた(Zhou er al)。 これらのウイルスが中枢神経系に到達する際に使用する経路は不明だが、腸管神経叢や迷走神経をたどり、軸索輸送によって脳幹に到達する可能性がある(DosSantos et al 2020)。これらの神経におけるSARS-CoV-2の存在は依然として不明であるが、ヒト小腸オルガノイドは、この新規コロナウイルスに生産的に感染することが示されている(Lamers er al 2020)。注目すべきは、腸管グリア細胞がウイルスを認識して戦い、生得的および適応的な抗ウイルス反応を調整することで、例えば炎症性サイトカインであるインターロイキン(IL)6の放出を介して神経学的障害に結びついていることである(Esposito er al 2020)。
血行性ルート
とはいえ、SARS-CoV-2は血行性ルート、すなわち血流を経由して、脳微小血管のECや血液脳関門(BBB)を通過する白血球に感染して中枢神経系に到達することも考えられる(図1;Desforges er al 2019)。BBBはタイトジャンクションで結合したECの単層で構成されており、周皮細胞のほか、アストロサイト(Abbott et al 2006年)ミクログリアのエンドフィート(Joost et al 2019)で覆われている。この構造は、血液から脳実質へのほぼすべてのトランスセルラーおよびパラセルラー輸送を制限し、中枢神経系を病原体および毒素から保護する(Abbott et al 2006)。ヒトやげっ歯類を対象とした試験では、BBBのすべての構成要素がウイルスに感染する可能性が示唆されている(Chen and Li, 2020)。これに対応して、ACE2タンパク質は、死後のヒト脳のECに広く存在している(Haming et al 2004,Buzhdygan et al 2020)。さらに、死亡したCOVID-19患者の脳ECでは、SARS-CoV-2ウイルス粒子の出芽が観察されている(Paniz-Mondrfi et al 2020)。これと並行して、脳血管系を介したSARS-CoV-2の浸潤は、BBBの破壊によって促進される可能性がある(Alquisiras-Burgos er al 2020)。BBBの伝染性を高める内皮感染は、タイトジャンクションタンパク質1(TJP1)カドヘリン5,オクルディンなどの脳EC間のタイトジャンクションを形成するタンパク質のダウンレギュレーションを通じて、マウスCoV、すなわち神経栄養性マウス肝炎ウイルス(MHV)と関連していた(Bleau er al)。 また、SARS-CoV-2スパイクタンパク質(サブユニット1および2)は、デキストラン灌流の促進およびTJP1免疫染色の減少によって評価されるように、ヒト初代脳ECで構成された試験管内試験の3D BBBモデルの伝染性を増加させた(Buzhdygan er al)。 この効果は、脳ECにおいて、(i)サイトカインIL-6およびIL1B、(ii)細胞外マトリックスのリモデリングに関与するマトリックスメタロペプチダーゼ(MMP)2,3,9,および12のメッセンジャーRNA(mRNA)発現の上昇を伴っていた。C-Cモチーフケモカインリガンド5(CCL5)やC-X-Cモチーフケモカインリガンド10(CXCL10)などの白血球走化性因子、細胞内接着分子1や血管細胞接着タンパク質1などの細胞接着分子のタンパク質発現(Buzhdygan er al)。 , 2020).
中枢神経系に到達するために、SARS-CoV-2は同様に、脈絡叢のECの単層で形成されたBBBに比べて伝染性の高い血液-脳脊髄液(脳脊髄液)バリアを利用することができる(Pellegrini er al)。 ACE2およびTMPRSS2を含むSARS-CoV-2受容体は、トランスクリプトミック分析およびイムノブロッティング分析により、ヒト脈絡叢オルガノイドにおいて検出された(Pellegrini er al)。 Pellegrini et al 2020)はまた、SARS-CoV-2臨床分離株が神経細胞オルガノイドではなく脈絡叢に感染し、この感染によりクローディン5(CLDN5)で標識されたタイトジャンクションが破壊され、全体的なバリアーの完全性が破壊されることを観察した。同様の報告はまれであるが、神経症状のあるCOVID-19患者30人を調べたケースシリーズでは、5人が高い脳脊髄液-血液アルブミン比を示し、BBBまたは血液-脳脊髄液バリアーの崩壊を示唆している(Neumann et al 2020)。最後に、内皮を利用するのではなく、SARS-CoV-2の中枢神経系侵入は、脳に浸潤する感染した免疫細胞を介して起こる可能性がある。しかし、COVID-19患者の気管支肺胞洗浄液サンプルのシングルセルRNAシーケンス(RNA-seq)によると、マクロファージのみがウイルスに対して陽性であった(Bost er al)。 注目すべきは、この知見は、ウイルス成分または感染細胞の貪食によるものであり、必ずしもウイルスの伝播によるものではないことである。さらに、これまでのところ、死亡したCOVID-19患者の一連の剖検では、脳への顕著な末梢免疫細胞の浸潤は見られず(Iadecola et al 2020)SARS-CoV-2の血中への拡散は、1(Wang et al 2020b)から41%(Zheng et al 2020)まで、一貫性のない割合で記述されている。
SARS-CoV-2の脳内感染の証拠
SARS-CoV-2が中枢神経系に侵入する経路は、脳に到達した後のウイルスの運命とともに、依然として不可解である。一方で、ヒトの神経オルガノイドは、SARS-CoV-2の複製をサポートする能力に限界があるようだ(Pellegrini et al 2020,Ramani et al 2020)。一方、ヒト多能性細胞由来のドーパミン神経細胞はSARS-CoV-2に感受性があるが、皮質神経細胞、脳EC、マクロファージ、ミクログリアには感受性がないことがわかった(Yang er al 2020a);いくつかの中枢神経系細胞タイプでSARS-CoV-2受容体がRNAで発現しているにもかかわらず。ヒト脳のシングルセルRNA-seqによると、ACE2は多くの神経細胞サブタイプ、アストロサイト、およびオリゴデンドロサイトで発現している(Matschke er al 2020)。TMPRSS2とTMPRSS4の発現は神経細胞で最も高く、一方、ウイルスの侵入と複製に必要なカテプシンL(CTSL)はミクログリアで最も高かった(Matschke er al)。 しかし、中枢神経系におけるこれらの受容体のタンパク質発現については、SARS-CoV-2が生体内の異なる脳細胞タイプで複製する能力と合わせて、まだ調査する必要がある。
注目すべきは、SARS-CoV-2の中枢神経系への侵入は、COVID-19患者の脳脊髄液と脳の両方におけるウイルス検出によっても支持されていることである(Bulfamante et al 2020,Domingues et al 2020,Huang et al 2020,Kremer et al 2020,Matschke et al 2020,Moriguchi et al 2020,Paniz-Mondrfi et al 2020,Puelles et al 2020,Solomon et al 2020,Virhammar et al 2020)。しかし、脳脊髄液におけるSARS-CoV-2の存在は稀であることは明らかである(Domingues et al 2020,Huang et al 2020,Kremer et al 2020,Moriguchi et al 2020,Virhammar et al 2020)。例えば、31個の脳脊髄液ヒトサンプルを用いた研究では、そのすべてにおいて高タンパク数や免疫グロブリンGの上昇などの脳脊髄液の炎症マーカーが増加していたにもかかわらず、定量的逆転写ポリメラーゼ連鎖反応(RT-qPCR)(RNA依存性RNAポリメラーゼ配列を標的とする)によってSARS-CoV-2が陽性となったのは1つだけであった(Kremer et al 2020)。同様に、神経学的症状を有する合計30人のCOVID-19患者を評価した他のいくつかの研究では、RT-qPCR(E遺伝子およびヌクレオカプシド遺伝子を標的とする)によって脳脊髄液中にSARS-CoV-2が検出されなかった(Al Saiegh et al 2020,Al-Dalahmah et al 2020,Alexopoulos et al 2020,Filatov et al 2020,Helms et al 2020,Paniz-Mondrfi et al 2020,Schaller et al 2020)。同時に、限定的ではあるが、重度のCOVID-19を示し、過去に慢性疾患の病歴がある患者において、剖検組織を介したSARS-CoV-2の脳への侵入の明確な証拠が報告された(Matschke et al 2020)。電子顕微鏡を用いて、パーキンソン病(PD)の既往歴のある74歳の患者の脳内ECと前頭葉ニューロンにウイルス粒子を検出した最初の報告がある(Paniz-Mondrfi er al 2020)。SARS-CoV-2ウイルス粒子は、別のCOVID-19死亡患者の脳幹でも発見された(「Neuronal Route」の項を参照)(Bulfamante er al 2020)。その後、18人中5人(Solomon et al 2020)と22人中8人(Puelles et al 2020)の死後の人間の脳は、SARS-CoV-2のRNA(Eおよびヌクレオカプシド遺伝子)は陽性であるが、ヌクレオカプシド(Solomon et al 2020)とスパイク(Puelles et al 2020)のタンパク質の免疫組織化学的分析は陰性であることが示された。しかし、これまでに発表された最大の研究では、40人の罹患者のうち21人が、RT-qPCR(E遺伝子)と免疫組織化学(ヌクレオカプシドおよびスパイクタンパク質)に基づいて、脳内にSARS-CoV-2のRNAとタンパク質の両方を示した(Matschke er al)。
中枢神経系と脳脊髄液におけるSARS-CoV-2の検出に一貫性がないことは、この新型コロナウイルスの神経栄養学的レベルをめぐる大きな不確実性の原因となっている。例えば、ある研究では、患者の脳内にウイルスが存在していたにもかかわらず、脳脊髄液ではウイルスが検出されなかった(Paniz-Mondrfi et al 2020)。同様に、別の研究では、8人の患者の脳サンプルはウイルスRNAが陰性であるにもかかわらず、スパイクやヌクレオカプシドタンパク質の免疫陽性であった(Matschke er al)。 さらに興味深いことに、呼吸器症状のない1人の患者の脳脊髄液からSARS-CoV-2が報告されている(Huang er al 2020)。脳脊髄液でのRT-qPCRによるSARS-CoV-2検出、および脳でのRT-qPCRと免疫組織化学の間で矛盾した結果が出ており、脳内感染の有病率を適切に推定するためには、検査にもっとまとまりが必要であることが明らかになった(Murta er al 2020)。同様に、中枢神経系への侵入経路とその結果は、ほとんどが相関的なデータから導き出されたものであるため、SARS-CoV-2がどのような経路を利用しているのか、また、脳内で生産的な感染が発生するのかを直接調査することが必要である。SARS-CoV-2が脳に感染した場合、中枢神経系機能の命運は抗ウイルス防御にかかっているが、脳の常駐自然免疫細胞であるミクログリアは、以下に述べるようにウイルスの拡散を妨げる可能性がある。
SARS-CoV-2中枢神経系感染に対するミクログリアの仮説的反応
ミクログリアは、他のすべての中枢神経系細胞とは異なり、胎児の卵黄嚢内の赤血球・骨髄系前駆細胞から生じ、胚発生期には脳内に存在し、生涯にわたって自己複製する(Ajami et al 2007,Ginhoux et al 2010,Tay et al 2017b)。これらの細胞は、中枢神経系に対するすべての物理的、感染的、精神的、または神経変性関連の傷害において、ほとんどの場合、脳の炎症反応、すなわち神経炎症の中心的なプレーヤーである。ミクログリアはまた、脳の発達、可塑性、および恒常性に不可欠であり、
- 神経前駆体および神経細胞のターンオーバー(排除と生存の両方)
- オリゴデンドロサイト前駆細胞の成熟
- 神経細胞の配線
- シナプスの成熟、活性、および可塑性
- 髄鞘形成
- BBBの完全性
- 血流調節
自然免疫は、中枢神経系におけるウイルスクリアランスの基本となる。この反応は、パターン認識受容体(PRR)を介して病原体関連分子パターン(PAMP)や損傷関連分子パターン(DAMP)を感知することで開始される。SARS-CoV-2は、一本鎖RNA(ssRNA)ウイルスで、SARS-CoV-1やMERS-CoVと同様に、複製時に二本鎖RNA(dsRNA)分子を生成すると考えられている。これらのPAMPを認識するのが、Toll様受容体(TLR)や細胞質レチノイン酸誘導遺伝子I様受容体(RLR)などのPRRであり、TLR3やDEAD/Hボックスヘリカーゼ58やインターフェロン誘導ヘリカーゼCドメイン1などのRLRはdsRNAを認識するのに対し、TLR7やTLR8はssRNAを認識する(de Wit et al 2016;Carty et al 2021)。これらのPRRは、主にミクログリア(Kumar, 2019; Carty et al 2021)に発現しているが、神経細胞、アストロサイト、周皮細胞、脳ECにも発現している(Klein et al 2019; Chen and Li, 2020)。TLRやRLRの活性化は、インターフェロン制御因子3/7を介したI型インターフェロン(IFN)の発現や、核内因子カッパB(NFKB)を介した炎症性サイトカインの発現をもたらし、それによって抗ウイルスカスケードが開始される(Carty er al 2021)。
サイトカイン、DAMP、およびPAMPがそれらの適切な受容体に結合すると、ミクログリアは炎症反応を開始し(Klein et al 2019年)「反応性」または「ミクログリオシス」(以前は「活性化」と呼ばれていたが)として知られるプロセスにおいて、その遺伝子発現、形態、および機能を変化させる(Hoogland et al 2015,Savage et al 2019)。その調整の中でも、げっ歯類では、ミクログリア(脳内の末梢マクロファージに類似)は、イオン化カルシウム結合アダプター分子1(IBA1)主要組織適合性複合体クラスII(MHCII)およびファゴリソームマーカーである分化クラスター(CD)68のタンパク質発現をアップレギュレートすることができる(Jurga er al 2020)。反応性ミクログリアは増殖し、炎症性サイトカイン[腫瘍壊死因子(TNF)、IL1B、IL-6,IFNG]や活性酸素種(ROS)、一酸化窒素(NO)の放出を増加させ、ミクログリアによる抗炎症性サイトカインの同時放出とのバランスをとることで、ホメオスタシスの回復を助ける(Lund et al 2006,Block et al 2007,Cunningham 2013年)。その上、反応性ミクログリアは一般的に異なる形態をとり、例えば、定常状態の高度に分岐した「モニタリングする」表現型とは対照的に、より大きなソーマとより少ない隆起した突起を有するアメーバ状の形状に移行する(図1;Savage et al 2019;Tremblay et al 2020)。それに伴い、MHV感染マウスの嗅球では、IBA1免疫染色の増加と、CX3Cケモカイン受容体(CX3CR1)-緑色蛍光タンパク質(GFP)陽性ミクログリア細胞の隆起が少ないことが観察された(Wheeler er al 2018)。また、ヒトACE2タンパク質を発現させたマウスでは、SARS-CoV-1の鼻腔内感染から6日後に、IBA1陽性ミクログリア細胞の増加が記載されている(Netland er al 2008)。
反応性ミクログリア表現型は、IFNやIL-6などの抗ウイルス因子を分泌することができる(Klein et al 2019)。しかし、正常なレベルのミクログリアが存在しない場合には、他の細胞がこの放出を補うことができる(Wheeler et al 2018)。このことは、ミクログリアの発生、維持、および増殖に必要な受容体チロシンキナーゼであるコロニー刺激因子1受容体(脳脊髄液1R)を介したシグナル伝達を操作することで示されている(Ginhoux et al 2010,Erblich et al 2011,Elmore et al 2014)。Wheeler et al 2018)は、そのアンタゴニストであるPLX5622を用いて、ミクログリアを含むCFSR1陽性細胞(ただし、循環から中枢神経系に浸潤することができる常駐するCD45高濃度マクロファージ集団ではない)を有意に枯渇させ、マウス肝炎ウイルス(JMHV)の神経減衰rJ2.2株に感染させたマウス脳において、Ifnb、Ifna、Il6のmRNAレベルが変化しないことを示した。同様に、MHVの神経強毒株の場合、脳から分離したex vivo CD45-high細胞のシングルセルRNA-seqからの遺伝子セットエンリッチメント解析により、PLX5622を投与した感染マウスと非感染マウスの末梢のマクロファージと樹状細胞でIFN応答遺伝子が濃縮されていることが明らかになった(Mangale et al 2020)。この代償メカニズムは、マウスのアストロサイト細胞がMHV株A59の感染後のIFNA/Bの重要な供給源であることを示す試験管内試験の研究によっても支持されている(Savarin and Bergmann, 2018; Lavi and Cong, 2020)。
他のCoVと同様に、SARS-CoV-2は、試験管内試験のヒトBBBモデルに感染し、伝染性を促進することができる(Bleau et al 2015;Buzhdygan et al 2020)。BBBの破壊は、ひいては、感染と戦うための末梢免疫細胞や炎症性因子の脳内への侵入を促進することになる。ミクログリアは、全体的な免疫細胞の浸潤には重要ではないようであるが(図1)末梢細胞の抗ウイルス反応を開始するためには極めて重要だ。例えば、頭蓋内JMHV感染後の早期(0日および6日)にミクログリア集団(PLX5622によって媒介される)を大幅に減少させると、ウイルスの制限に重大な影響を与え、その結果、ウイルス負荷が増加し、マウスの死亡率が高くなった(Wheeler er al)。 ミクログリアの枯渇は、(i)抗原提示を阻害し、その結果、CD4陽性T細胞および制御性T細胞(Treg)の抗ウイルス応答を阻害し、(ii)未熟なマクロファージの浸潤をもたらした(Wheeler et al 2018,Mangale et al 2020)。逆に、ミクログリアの制御には末梢細胞が重要であるようだ。MHV感染の24時間前に、ウイルスのMHV M133エピトープを認識するFoxp3陽性のCD4制御性T細胞を静脈内投与すると、ミクログリアのMHCIIタンパク質の発現が減少し、Tヘルパー1型(Th1)細胞の反応が制限され、マウスの生存率が向上した(Zhao et al 2014)。脳内常駐免疫細胞とウイルス特異的T細胞の密接な相互作用は、MHV感染マウスのミクログリアにおける(i)抗原提示、(ii)自然免疫系と適応免疫系のクロストーク、(iii)IFNシグナル、(iv)IFN調節因子、(v)PRR、(vi)ケモカインに関連する経路の有意な遺伝子発現変化が、コントロールと比較しても裏付けられている(Wheeler et al 2018)。
抗ウイルス反応を調整する一方で、ミクログリア自身が感染することもある。このことは、ヒトコロナウイルスOC43を含むCoVや、マウス株のMHVおよびJHMVについて示されている(Bonavia et al 1997年、Arbour et al 1999年、Nakagaki et al 2005,Das Sarma 2014,Lavi and Cong 2020)。しかし、MHVを除いて、このミクログリアへの感染は低レベルでしか観察されず、ほとんどがヒトやマウスの不死化細胞株であり、必ずしも生体内の条件とは相関していない(Bonavia et al 1997;Arbour et al 1999;Nakagaki et al 2005;Das Sarma 2014;Lavi and Cong 2020)。異なるウイルスファミリーからの証拠は、直接感染時に、ミクログリアが反応性の兆候を示すことを示唆している。例えば、ラットの初代ミクログリア培養では、日本脳炎ウイルス(JEV)は、プロセスを持つ形態から、食細胞表現型に特徴的なアメーバ状でCD68陽性の細胞への変化を促す(Chen er al)。 驚くべきことに、この形態変化は、活発なウイルス複製ではなく、感染細胞から放出された可溶性成分によって誘発されるようであった(Chen er al 2010)。多能性細胞から得られたヒトのミクログリア細胞を用いた初期の結果では、ACE2タンパク質とCTSL mRNAが発現しているにもかかわらず、これらの細胞はSARS-CoV-2に感受性がないことが示唆されている(Matschke et al 2020,Yang et al 2020a)[ただし、この知見を確認するためには、ヒトでのさらなる研究が必要である]。
COVID-19症例の死後脳組織におけるミクログリアマーカーを評価した報告のうち、40人中21人にSARS-CoV-2脳浸潤を検出したものがある(「SARS-CoV-2脳浸潤の証拠」の項も参照)(Matschke et al 2020)は、検査したCOVID-19患者32人のうち29人の脳幹および小脳の間で、IBA1およびミクログリアの濃縮マーカーである膜貫通タンパク質119(TMEM119)の拡散した染色が観察され、時折ミクログリアの結節、すなわちミクログリアクラスターが観察された。皮下および小脳下領域では、IBA1陽性ミクログリアがCD8陽性T細胞に囲まれているのが頻繁に見られ、CD68を強く発現しており、ヒト白血球抗原DRアイソタイプ(HLA-DR、MHCII受容体)も発現していた(Matschke et al 2020)。しかし、SARS-CoV-2の脳内レベルが検出可能であった同じ患者が、これらのミクログリアマーカーの増加を示した患者であったかどうかは明らかではない(Matschke er al 2020)。IBA1,CD68,TMEM119,ならびにHLA-DRのミクログリアタンパク質発現のアップレギュレーション、およびT細胞への近接性は、他のCoVで以前に観察されたように、ウイルス感染後のT細胞活性化および中枢神経系浸潤を促進するための抗原の活発な貪食を示している可能性がある(Wheeler et al 2018;Mangale et al 2020)。同時に、本研究で検出されたミクログリアの変化は、次で述べるように、それ自体が例えば低酸素性脳障害と関連する全身性COVID-19に対する反応に由来するか、それによって増強される可能性がある。
ミクログリアがCOVID-19感染症理による中枢神経系の影響を決定する可能性
ミクログリアはCOVID-19による低酸素症に反応する
SARS-CoV-2感染者の81%は軽度の肺炎を呈するが、重症化に伴う低酸素症は約14%、重症化は5%、死亡は2.3%に認められる(Wu and McGoogan, 2020)。重症例では、COVID-19の最も表現力のある病理学的結果として、大量の肺胞損傷、心不全、凝固障害、および虚血イベントを含む脳血管障害が挙げられる(Agarwal et al 2020,Carsana et al 2020,Chen et al 2020b、Helms et al 2020,Klok et al 2020,Mao et al 2020,Oxley et al 2020)。これらの全身的な変化は、低酸素性脳損傷を引き起こす可能性が高い(図1;Iadecola er al)。 一貫して、COVID-19患者は、頭痛、眠気、昏睡などの中枢神経系低酸素症に関連する症状や、脳の病変を示すことが多い(Chen et al 2020a;Giacomelli et al 2020;Mao et al 2020;Pezzini and Padovani 2020;Wu et al 2020a)。COVID-19患者の脳の剖検では、大脳皮質、海馬、小脳、すなわち低酸素に非常に脆弱な脳領域における神経細胞の損傷とともに、広範囲の微小血栓および梗塞斑も検出されている(Kantonen et al 2020,Kashani et al 2020,Solomon et al 2020)[ただし、これらの損傷はCOVID-19以前にも存在する可能性がある]。
虚血性-低酸素性脳傷害は、脳細胞の嫌気性代謝への切り替えによって部分的に生じ、(i)実質内の乳酸の蓄積、(ii)酸化ストレス、(iii)BBB機能不全、(iv)脳血管拡張、(v)神経細胞の腫脹、(vi)血流障害、(vii)炎症、および(viii)細胞死をもたらす(Fumagalli et al 2015;Wu et al 2020b)。ミクログリアは、細胞骨格を再編成し、脳実質をモニタリングするためにATPに依存しており(Atkinson et al 2004,Davalos et al 2005,Masuda et al 2011,Gimeno-Bayón et al 2014年)エネルギー不足に非常に敏感である(Fumagalli et al 2015)。したがって、COVID-19関連の低酸素症時には、ATP微小勾配の変化がミクログリアのプリン作動性P2XおよびP2Y受容体によって感知され、げっ歯類およびヒトの低酸素性傷害で観察されたように、傷害部位への移動、貪食、増殖が促進されると考えられる(Davalos et al 2005,Melani et al 2006,Wixey et al 2009,Webster et al 2013,Fukumoto et al 2019)。
また、低酸素は、げっ歯類ミクログリアの転写因子(例:低酸素誘導因子1,αサブユニット、NFKB)マイクロRNA(miR-s)(例:。miR-146a、およびmiR181a/c)が、試験管内試験および生体内試験の両方で放出される;その結果、TNFA、ROS、IL1B、およびIL18が放出され、これらは、細胞の残骸を除去し、損傷を解決するのに役立つことができる(Zhang et al 2012;Kong et al 2014;Kiernan et al 2016;Mukandala et al 2016;Jiang et al 2020;Yang et al 2020b)。虚血-低酸素症に対応して、ネズミのミクログリアも同様に形態的に変化する(図1参照;Masuda er al 2011)。急性期の大脳皮質では、マウスのミクログリアはプロセスを拡大して低酸素領域に到達するが(Davalos et al 2005,Hines et al 2009年)より大きな損傷や持続的な損傷では、ネズミの海馬や新皮質でミクログリアがアメーバ状の形態をとることもある(Raivich et al 1999年、Stence et al 2001,Kurpius et al 2007,Masuda et al 2011)。COVID-19の病態においてミクログリアが同様の反応を示すかどうかは、今後の研究を待たなければならない。
反応性ミクログリアは、低酸素性虚血傷害後に神経毒性と神経保護の役割を果たすことができる。中大脳動脈閉塞(MCAO)誘発性虚血後のマウスにおいて、CX3CR1をノックアウトすることで、フラクタルカインを介した神経-ミクログリア間のシグナル伝達を阻害すると、ミクログリアの増殖、炎症性分子の放出、マクロファージの浸潤が減少し、虚血病変が小さくなった(Fumagalli et al 2013,Tang et al 2014)。対照的に、PLX3397によるミクログリアの枯渇と生体内の高解像度2光子カルシウムイメージングを組み合わせて、Szalay et al 2016)はMCAOの24時間後に、ミクログリアの枯渇が神経細胞のカルシウム反応とネットワーク活動を障害し、一方で細胞内のカルシウムレベルを上昇させ、最終的にマウスの神経細胞の損傷を悪化させることを示した。しかし、テトラサイクリン系の抗生物質であるミノサイクリンを末梢に投与すると、非特異的にミクログリアの貪食作用と炎症性メディエーターの放出を正常化し(Tikka and Koistinaho, 2001; Tikka et al 2001; Hanisch and Kettenmann, 2007)、げっ歯類の虚血モデルにおける神経細胞死を減少させることがわかった(Yrjänheikki et al 1998, 1999)。このように、「SARS-CoV-2 中枢神経系感染に対するミクログリアの仮説的反応」の項で述べたこと(中枢神経系ウイルス感染時のミクログリアの枯渇について)と同様に、ミクログリアの機能を完全に破壊すると傷害の回復が悪化するが、その炎症反応をダウンレギュレートすることで保護することができる。なお、COVID-19にはミノサイクリン治療が提案されている(Oliveira er al 2020)。
ミクログリア結節およびミクログリア反応性マーカー(IBA1,HLA-DR、CD68など)の免疫染色の上昇は、COVID-19患者の多数の脳の剖検でも検出され、最近および古い低酸素性/虚血性傷害を示した(Al-Dalahmah et al, 2020; Kantonen et al 2020; Matschke et al 2020)大脳皮質、海馬、髄質、小脳プルキンエ細胞層の間で顕著な神経細胞の損失を伴っていた(Al-Dalahmah et al 2020; Solomon et al 2020)。好酸球増多、縮小した神経細胞を伴う重度のグローバル低酸素性変化を示す患者では、ミクログリアのCD68陽性結節が下オリーブと歯状核の損傷細胞を取り囲んでおり、おそらく活発な食細胞除去を示していた(Al-Dalahmah er al 2020)。しかし、現時点では、観察された常駐免疫細胞の変化が、COVID-19に伴う低酸素性傷害に由来するものかどうかを評価することは困難である。反応性ミクログリアは、次に検討するように、末梢の免疫反応の悪化を含むSARS-CoV-2感染に伴う他の全身的な変化によって生じる可能性がある(Al-Dalahmah er al)。
ミクログリアはCOVID-19の全身性炎症反応に反応する
うまく調整された免疫反応は、ウイルス感染に対する最初の防御ラインを表している。しかし、この反応が悪化すると、ウイルスの侵入部位や全身レベルで有害なものとなる可能性がある。SARS-CoV-1やMERS-CoVについて既に報告されているように(Channappanavar and Perlman, 2017)不適応な自然免疫応答および適応免疫応答はCOVID-19の病理の特徴である(Qin et al 2020)。その最も明白な特徴は、表向きの炎症亢進であり、一般的に「サイトカインストーム」と呼ばれ、重度の罹患患者に蔓延し、多臓器不全の原因となっている(Bhaskar et al 2020,Moore and June 2020,Ruan et al 2020)。この現象の推定上の起源は、初期の免疫活性化、二次的な遅延した、しかしおそらくは延長した抗ウイルスIFN媒介反応、および制御不能な単球-マクロファージ-樹状細胞の過活性化ならびに組織浸潤からなる3段階のプロセスにある(Channappanavar and Perlman 2017,Merad and Martin 2020,Moore and June 2020)。このようなプロセスは、細胞レベルで血管および器官の損傷を誘発し、最適ではないT細胞およびB細胞応答によるウイルス負荷の全体的な非効率的処理に寄与する可能性がある(Channappanavar and Perlman, 2017)。したがって、COVID-19患者のサブセットでは、血清リンパ球の減少が観察される(Bhaskar et al 2020,Mathew et al 2020)。サイトカイン・ストームの枠組みの中では、広範な種類の炎症誘発性および抗炎症性サイトカインおよびケモカインの循環レベルの上昇(例えば IL1; IL1R1; IL-6; IL8; IL-7; IL-10; IL12; IFNG; Transforming growth factor b; CCL2; CXCL10; CXCL9; CX3CL10; CCR1)だけでなく、非サイトカインマーカー(C-reactive protein, CRP; 脳脊髄液2; D-dimer; ferritin)の循環レベルの上昇が、この時点までにCOVID-19患者で報告された(Heneka et al, 2020;Mathew et al 2020;MeradとMartin 2020;Ruan et al 2020)。) しかし、この全身性炎症反応のプロファイルは、個々のマーカーの観点から、コホート間で異なっていることに留意すべきである。これは、これらの初期研究の特定のプロファイリングの結果であるか、この反応の強い個人特異性を反映したものである可能性がある。
全身性サイトカインは、いくつかの経路を経て中枢神経系に伝達される。すなわち、(i)脳室周囲の器官などBBBの漏出領域を介した移動、(ii)脳ECに発現したサイトカイン特異的トランスポーターによる能動的輸送、(iii)セカンドメッセンジャーの産生につながる脳ECの活性化、(iv)迷走神経を介したシグナルの伝達、(v)末梢で活性化された免疫細胞を介した侵入、などである(Capuron and Miller, 2011)。中枢神経系では、IL1B、TNF、およびIL-6を含むこれらの可溶性物質の制御されたレベルが、ニューロンおよびグリア細胞の両方の適切な機能に必要である(Camacho-Arroyo et al 2009,Borsini et al 2015)。感染時には、全身のサイトカインが、視床下部-下垂体-副腎(HPA)軸の活性化や中核体温の上昇を介して神経内分泌反応を刺激し、最終的に無気力や食欲減退などの疾患特有の行動パターン(すなわち、疾病行動)を促進する(Szelényi, 2001; Dantzer, 2018)。一方、長期的には、脳実質におけるサイトカインレベルの上昇(図1)は、様々な疾患状態における神経毒性および神経変性病理のメディエーターとして機能する(Szelényi, 2001; Camacho-Arroyo er al)。
COVID-19の文脈では、病理学的なサイトカインの過剰は、血管リモデリングとBBBリークを引き起こし、末梢のウイルス感染に関連するDAMPsとPAMPsの侵入を増加させる可能性があり(図1)既存の疾患状態のためにBBBがすでに損なわれている人では、特に危険である可能性がある(Varatharaj and Galea, 2017)。これは、特に白質領域で微小出血が頻繁に発生するなど、COVID-19患者に存在するMRIで検出されたBBB関連の異常と一致する(Fitsiori et al 2020,Kremer et al 2020,Radmanesh et al 2020)。このBBB伝染性は、主に、(i)COVID-19合併症の危険因子である糖尿病で観察されるタイトジャンクションの変化(Hawkins et al 2007)などの全身事象(Guo et al 2020)または(ii)脳ECの直接的なウイルス感染を介して(Buzhdygan et al 2020)そしておそらく、(iii)COVID-19患者で以前に観察されたような凝固亢進とそれに伴う微小血栓の形成(Dolhnikoff et al 2020)によって引き起こされると考えられる。一方、JEV感染マウスでは、ウイルスの侵入と神経炎症反応がBBB障害に先行している可能性もある(Li et al 2015;Pezzini and Padovani 2020)。
脳のホメオスタシスと神経炎症における重要な役割を考慮すると、ミクログリアは環境擾乱に対して特に敏感である(「SARS-CoV-2 中枢神経系感染に対するミクログリアの反応(Putative Responses of Microglia to SARS-CoV-2 中枢神経系 Infection)」の項を参照)(Hanisch and Kettenmann, 2007; Hoogland er al 2015)。したがって、COVID-19期間中の循環サイトカインの増加は、ミクログリアの反応性を誘発または悪化させ(図1;Tremblay et al 2020)患者に存在する可能性のある直接的なウイルス性または低酸素性の傷害を悪化させる可能性が高い。全身性サイトカインストームが長期間続くと、慢性的に反応性の高いミクログリア状態になり、炎症性シグナル、貪食、酸化ストレスを介してニューロンの生存やシナプス結合の維持に悪影響を及ぼす可能性がある(Savage et al 2019)。したがって、IL-6,IL8,およびTNFの脳脊髄液および血清レベルが上昇した患者では、神経変性疾患および貪食に関連するミクログリアマーカーtriggering receptor expressed on myeloid cells 2(TREM2)も脳脊髄液で上昇しており、脊髄髄膜腔での活発な炎症プロセスを示している(Pilotto er al 2020a,b)。同様に、COVID-19患者の死後脳で見られた、IBA1,HLA-DR、およびCD68免疫反応の強度の増加によって特徴付けられる炎症指向のミクログリアクラスターの拡大、およびミクログリア結節の密度の増加は、この進行中のミクログリアシスと一致するであろう(Mukandala et al 2016;Matschke et al 2020)。ミクログリアシスは、さらにおそらくアストログリアシスと末梢Tリンパ球の脳浸潤を伴っており、COVID-19患者の小脳と脳幹内にほとんどが局在していた(Mukandala et al 2016;Matschke et al 2020)。同様に、マウスでは、脳幹はSARS-CoV-1やMERS-CoVの感染によって最も影響を受ける脳領域の一つである(McCray et al 2007,Netland et al 2008,DosSantos et al 2020)。脳幹は脳の重要な機能(心肺機能の調節、睡眠サイクル、意識など)を担っていることから、COVID-19に伴う呼吸困難の発症に関連していると考えられる(Nouri-Vaskeh er al 2020)。ただし、上述の研究で分析されたコホートはまだかなり小さいため、これらの観察結果を確認するにはさらなる研究が必要である。
ミクログリアを介した中枢神経系の炎症がCOVID-19関連の神経学的症状に寄与していると考えられる
データはまだ出てきていないが、現在、入院したCOVID-19患者の約30%が、倦怠感、頭痛、嗅覚(anosmia)や味覚(dysgeusia)の喪失などの神経学的症状を呈し(Helms et al 2020,Mao et al 2020)さらには虚血性脳卒中などのより重篤な合併症[有意に高い死亡率と関連する]を呈することが報告されている(Merkler et al 2020,Yaghi et al 2020)。これまでのセクションで述べてきたことを踏まえて、次に、COVID-19患者で観察された神経学的異常が、ウイルス、低酸素、炎症性の傷害に対するミクログリアの反応に起因する神経炎症とどのように関連しているかを提案する。
嗅覚と味覚の喪失
COVID-19患者の多くは、味覚障害または無味症の症状を示す(Eshraghi er al 2020)。味蕾は鼻腔上皮の幹細胞集団から再生されるが、その活動は炎症性サイトカインによって停滞することがある(Eshraghi er al)。 これに対応して、COVID-19が確認された患者では、TNF、IFNG、IL-6の血清レベルの上昇が見られる(Eshraghi er al 2020)。無嗅覚症が見られる他の疾患では、嗅球に投射する前脳基底部のコリン作動性ニューロンの損傷と関連しており、これが局所的なミクログリアに炎症促進状態を取らせ、全体的な神経炎症と細胞死に寄与している可能性がある(Mahalaxmi er al 2020)。このように、COVID-19患者では、炎症反応の悪化や中枢神経系の低酸素性傷害が、これらの症状に寄与している可能性がある。
脳症
脳のウイルス感染の結果としての炎症性メディエーターの産生、特にIFN(MacMicking, 2012)は、脳実質の炎症と神経学的機能障害を特徴とする疾患である脳炎と関連している(Alam et al, 2020)。COVID-19に関連した脳炎の症例が数例報告されているが、本症候群の診断に用いられた症状は、低酸素症、炎症、鎮静など、脳症につながる患者の他の状態に起因する可能性が示唆されている(Garg et al 2020,Iadecola et al 2020,Maas 2020)。誇張された全身性炎症(すなわち、サイトカインストーム)を呈する高齢の入院中のCOVID-19患者によく見られる、脳症は、拡散性の脳機能障害を特徴とする病理学的プロセスである(Garg et al 2020,Helms et al 2020,Najjar et al 2020)。これらの患者は、時々、抗SARS-CoV-2抗体と、IL-6およびIL8などの脳脊髄液中の炎症マーカーを呈する(Alexopoulos et al 2020,Farhadian et al 2020,Garg et al 2020)ことから、脳症が脳内のウイルス感染にも起因する可能性が示唆されている[ただし、包括的な研究は現在のところ不足している]。
脳脊髄液中に抗ウイルス抗体やサイトカインが存在することは、BBBが破壊されている可能性を示しており、これにより脳内への炎症性メディエーターの浸潤が増加している可能性がある。BBB伝染性の亢進は、COVID-19患者における微小出血などのMRI所見と一致する(「Microglia Respond to the Systemic Inflammatory Response in COVID-19」の項を参照)(Fitsiori et al 2020,Kremer et al 2020,Radmanesh et al 2020)。COVID-19患者の死後の脳の剖検(「Putative Responses of Microglia to SARS-CoV-2 中枢神経系 Infection」の項を参照)で裏付けられているように、相乗的であるか否かにかかわらず、これらの刺激はミクログリアの表現型の変化をもたらす可能性がある(Deigendesch et al 2020;Matschke et al 2020)。これと並行して、最近の報告では、COVID-19関連脳症の患者の脳脊髄液でTREM2タンパク質レベルが上昇し、脳脊髄液と血清の両方でIL-6,IL8,TNFのタンパク質レベルが上昇したことが示された(「Microglia Respond to the Systemic Inflammatory Response in COVID-19」の項を参照)(Pilotto er al 2020b)。この患者はステロイド治療にしっかりと反応し、観察された脳症が中枢神経系炎症誘発事象に関連しているという議論をさらに裏付けた(Pilotto er al 2020b)。さらなる研究が待たれるが、COVID-19では、反応性ミクログリアが、続く神経炎症によって脳症の予後を悪化させることに寄与している可能性がある。
ミクログリアのサイトカイン産生の増加は、BBBの破壊と関連しているか否かにかかわらず、神経細胞の興奮性と興奮毒性グルタミン酸シグナルの増強につながり、COVID-19患者に見られる脳症の臨床症状である発作を誘発する可能性もある(Nikbakht er al 2020)。さらに、これらの発作の発生は、(i)虚血性脳卒中-アンギオテンシンIIに対するミクログリアの反応が原因である可能性がある(「脳血管疾患」の項を参照)(ii)ミトコンドリアの制御異常-ミクログリアの活性酸素産生の増加が原因である可能性がある、などの他のミクログリア関連経路と関連している可能性がある(Nikbakht er al 2020)。マウスでは、過剰な細胞外グルタミン酸がミクログリアをリクルートし(Dissing-Olesen et al 2014,Eyo et al 2014,2018年)異なるてんかんモデルではその食細胞活性が損なわれる(Abiega et al 2016,Sierra-Torre et al 2020)。これらのモデルにおけるミクログリアのリクルートと食細胞のアンカップリングの両方は、ATPシグナルの破壊と関連していた(Eyo et al 2014,2018;Abiega et al 2016;Sierra-Torre et al 2020)。2020)「Microglia Mediate How the 中枢神経系 Is Affected by SARS-CoV-2 Infection」および「Microglia Could Determine How the 中枢神経系 Is Affected by COVID-19 Pathology」の項で説明したように、ウイルス性および低酸素性の傷害時に起こる可能性があると考えられる。したがって、COVID-19では、ミクログリアが発作の発症に関与するだけでなく、SARS-CoV-2-中枢神経系関連の傷害により、ミクログリアの修復活動が損なわれる可能性もある。
脱髄
末梢では、COVID-19に関連したいくつかの炎症性変化があり、その一つがNLRファミリーピリンドメイン含有3(NLRP3)フラマソームの活性化であり(Freeman and Swartz, 2020; van den Berg and te Velde, 2020)これは先に述べたサイトカインストームの発生に寄与している可能性がある(Mehta et al, 2020)。脳内では、このインフラマソームの活性化は、多発性硬化症(Soares et al 2019年)さらにはアルツハイマー病(AD)(「神経変性疾患」の項を参照)を発症または悪化させる危険因子であり(Tejera et al 2019;Heneka et al 2020)潜在的には、脱髄につながる炎症性表現型にミクログリアおよびマクロファージをシフトさせることを介している(Di Stadio et al 2020)。驚くべきことに、COVID-19のいくつかの症例では、多巣性の脳脱髄が観察されている(Handa er al 2020,Zanin er al 2020)。マウスでは、損傷後にミクログリアがミエリンを貪食し、再髄鞘形成の重要なステップとなる(Lampron et al 2015;Domingues et al 2020)。対照的に、脳脊髄炎のマウスモデルでは、ミクログリアの抗ウイルスIFNG反応が過剰であることが脱髄の主な原因であると考えられている(Savarin and Bergmann, 2018)。COVID-19における脱髄が、ウイルスまたは炎症を介したプロセス(複数)の結果であるかどうかはまだ調査されていないが、いずれの場合も、ミクログリアのサイトカイン産生および貪食がこの反応に関与していると考えられる。
脳血管障害
その数は急速に増加しているが、COVID-19に関連して少なくとも200例の脳血管障害が報告されており、その大半は虚血性脳卒中によるものである(Ellul et al 2020,Varatharaj et al 2020)。したがって、COVID-19患者の多数の脳の剖検において、新しいおよび古い低酸素/虚血性傷害が存在した(Al-Dalahmah et al 2020,Kantonen et al 2020,Matschke et al 2020,Schaller et al 2020,Solomon et al 2020,Weyhern et al 2020年。2020)時には大脳皮質、海馬、小脳プルキンエ細胞層(Solomon et al 2020)さらに脳幹(「Microglia Respond to COVID-19-Associated Hypoxia」の項を参照)における神経細胞の損失を伴う(Al-Dalahmah et al 2020;Weyhern et al 2020)。SARS-CoV-2に感染した患者の多くは、すでに脳血管系の合併症を患っているか、高リスクグループに属しているが、SARS-CoV-2は、回復力の高い若年層でも脳卒中のリスク/割合/有病率を増加させるようである(Ellul er al)。 COVID-19感染者における脳卒中の高い発生率は、SARS-CoV-2に関連したECsの損傷が、中枢神経系および全身における血栓および炎症経路を活性化することで部分的に説明できるかもしれない(Varga er al)。 あるいは、SARS-CoV-2は、ミクログリアが発現するアンジオテンシンI型受容体(AT1R)でのシグナル伝達を介して、炎症性サイトカインの放出を増加させ(Murta er al 2020)さらに血管収縮、神経炎症、酸化ストレス、および細胞死を誘発すると提案されている(Arroja er al 2016)。
全身性COVID-19や脳血管障害に起因する急性脳低酸素症は、ミクログリアの活動を、神経可塑性の異常に寄与する貪食の増加に向かわせる可能性がある(Serrano-Castro er al 2020)。マウスのミクログリアを薬理学的または遺伝的に枯渇させたところ、脳卒中関連の傷害が著しく減少したという報告がある(Fumagalli et al 2013,Tang et al 2014)。同時に、炎症は、免疫細胞の動員、瘢痕形成、アストロサイトの反応性を助け、傷害の回復に寄与する(Kim and Cho, 2016)。ミクログリアの表現型とサブタイプの不均一性は、低酸素/虚血傷害時に観察されるミクログリア細胞の神経毒性と神経保護の両方の一見相反する効果の説明として提案されている(Stratoulias et al 2019,Lyu et al 2020)。COVID-19の間、最近の領土の虚血病変とミクログリアの機能を評価する包括的な研究が不足しているにもかかわらず、低酸素性損傷を受けたすべての剖検患者は、とりわけ高血圧、糖尿病、腎不全、または肥満などの少なくとも1つの併存疾患の病歴も示した(Kantonen et al 2020,Matschke et al 2020,Schaller et al 2020,Solomon et al 2020,Weyhern et al 2020)。これらの虚血性病変が現在のCOVID-19感染に由来するかどうかは不明であるが、肺疾患や心疾患などの炎症の亢進に関連する併存疾患は、ミクログリアの反応性や炎症性サイトカインの放出に間接的に影響を及ぼす可能性がある(Patterson, 2015)。
ミクログリアがすでにプライミングされている状況で、SARS-CoV-2感染などの二次的な免疫チャレンジを受けると、ミクログリアの活動がさらに神経毒性に向けられる可能性がある(Serrano-Castro er al)。 プライミングされたミクログリアは、その生理的機能を異常に発揮し、神経新生、シナプス形成、脳回路の構造的および機能的な可塑性を損なうと考えられている(Norden et al 2015,Tay et al 2017b)。重要なことは、ミクログリアだけでなくアストロサイトの活動を媒介とする続く神経炎症が、神経組織を損傷し、シナプス可塑性を損ない、認知能力を決定的に低下させると考えられていることである(Lee et al 2008;Pistell et al 2010;Davydow et al 2013;Di Filippo et al 2013)。したがって、感受性の高い人では、SARS-CoV-2感染に対するプライミングされたミクログリアの炎症反応の悪化が、精神疾患や神経変性疾患などの疾患病理の発症の背景になっている可能性がある(Norden et al 2015;Tay et al 2017b)。さらに、COVID-19患者の脳血管イベントは加齢に最も多く見られ(Ellul et al 2020;Iadecola et al 2020)機能不全のミクログリア活性は若年者に比べて高齢者で上昇している(「神経変性疾患」の項を参照)。したがって、COVID-19患者の低酸素性傷害は、以前からの慢性疾患の結果である可能性があるが、我々は、SARS-CoV-2感染時に誘発された低酸素性により、すでに病的な中枢免疫制御がさらに影響を受け、おそらく活性化したミクログリアを介して傷害が悪化するという仮説を立てている。その結果、COVID-19に感染した人は、神経症状を発症するリスクが高くなると考えられる(Marshall, 2020)。
神経変性疾患
ミクログリアPRRシグナルは、特に感染後の初期の時点で、脳における抗ウイルスIFN応答の基本となる(「Putative Responses of Microglia to SARS-CoV-2 中枢神経系 Infection」の項を参照)(Nakagaki et al 2005;Wheeler et al 2018;Mangale et al 2020)。IFNは、ミクログリアに炎症性表現型を誘導し、世界的に最も一般的な認知症の原因であるADのマウスモデルにおいて、補体を介したシナプスプルーニングを上昇させることができる(Hong et al 2016;Naughton et al 2020;Roy et al 2020)。ヒトADの死後組織を解析したところ、プラークに関連したIBA1陽性のミクログリアは、インターフェロン誘導膜貫通タンパク質3とAXL受容体チロシンキナーゼの免疫陽性でもあり、ADにおけるIFN経路の活性化を示唆する結果が得られた(Roy er al 2020)。ヒトADの死後脳のRNA-seq解析でも、IFN経路と補体経路の間に強固な相関関係が見られた(Roy er al)。 同様の現象がSARS-CoV-2の感染でも起こる可能性があり、ウイルスに誘発されたIFNの増加が補体を介したシナプスの損失の増加につながり、精神疾患、老化、神経変性疾患のいずれにおいても、記憶障害や認知障害が生じる可能性がある。
同時に、先に述べたように、NLRP3インフラマソームの活性化は、COVID-19の特徴の一つである(Freeman and Swartz, 2020; van den Berg and te Velde, 2020)。ヒトおよびマウスでは、NLRP3インフラマソームはADにおいて重要な役割を果たしている(Tejera er al 2019)。ADに関連するヒトの変異を発現するマウスでは、NLRP3ノックアウトにより、ミクログリアによるアミロイド貪食が促進され、これらの細胞におけるアルギナーゼ1やIl4などの抗炎症因子のmRNA発現が誘導された(Heneka er al)。 また、同じADモデルにおいて、NLRP3ノックアウトは、体性感覚系の生体内試験 2-photon scanning imagingによれば、リポポリサッカライド(LPS)チャレンジ後のミクログリアの形態変化を防ぐことができた(Tejera er al 2019)。さらに、タウオパシーのマウスモデルでは、NLRP3は、AD病理のもう一つの重要な構成要素である神経原線維性タングルの形成を占めている(Ising er al 2019)。したがって、この複合体の活性化が進み、その後、炎症性因子が産生されることで、COVID-19の神経変性病理が誘発または悪化する可能性がある(Heneka er al 2020)。また、SARS-CoV-2感染者では、脳脊髄液においてTREM2が増加していることが確認されている(Pilotto er al 2020b)。ヒトゲノムワイド関連解析によると、ミクログリアにおけるTREM2の変異体は、ADのリスク増加と関連しており(Guerreiro et al 2013年)TREM2 脳脊髄液レベルは、ADの重要なバイオマーカーであるタウおよびリン酸化タウの脳脊髄液レベルと強く関連している(Cruchaga et al 2013)。これらの知見は、COVID-19患者における神経変性とそれに対応する認知機能低下のリスクを強調するものである(Heneka er al 2020)。
パーキンソン病は、多くの場合、黒質パーコンパクタにおけるドーパミン神経細胞の進行性損失につながるミスフォールドしたシヌクレインαの蓄積と関連している(Lecours et al 2018)。SARS-CoV-2とパーキンソニズムとの関連はまだ報告されていないが、他のウイルスは、部分的にミクログリアの反応性、貪食、および炎症性因子の放出を介して、一過性の形態またはPDを発症するリスクの増加と関連している(Sulzer et al 2020)。例えば、インフルエンザウイルス(中枢神経系に侵入するものとしないものの両方)によるマウスの鼻腔内感染は、黒質におけるIBA1陽性ミクログリアの増加をもたらし、神経細胞の一過性の機能低下または死と関連した(Jang et al 2009,Sadasivan et al 2015,Tulisiak et al 2019,Sulzer et al 2020)。さらに、COVID-19の間、サイトカインストームとAT1Rミクログリア活性の増加により、中枢神経系における炎症性サイトカインの放出が強化される可能性があり(Murta et al 2020)これにより、SARS-CoV-2感染者の脳において、タンパク質のミスフォールドと凝集、ミトコンドリア機能不全が悪化し、オートファジーの欠損が誘発される可能性がある(Lippi et al 2020,Sulzer et al 2020)。これにより、PDやADなどの神経変性疾患の発症が促進される可能性があるという。
このリスクは、COVID-19の最も重篤な経過をたどり、感染後の転帰が最悪で、死亡率が最も高い高齢者において特に重要である(Ruan er al 2020)。重要なのは、ECにおけるACE2の高い発現が、認知症と高血圧の病歴を持つCOVID-19症例で見られたことであり、これは感染後の転帰が悪いことも特徴である(Buzhdygan er al)。 実際、まだ十分に研究されていないが、COVID-19の神経学的症状は、慢性疾患(例えば、糖尿病、高血圧)またはより重篤な感染症を有する患者とともに、高齢の患者でより一般的であることが現在示されている(Mao er al 2020)。特に、高齢は、いわゆる「炎症老化」現象と関連しており、免疫系の効率が全体的に低下し、末梢および中枢神経系の両方で炎症マーカーが上昇することが特徴である(Hammond et al 2019,Domingues et al 2020)。高齢者はまた、ジストロフィー(すなわち、より小さな細胞体、一見断片的で曲がりくねったまたはビーズ状の突起)および反応性の形態を有するミクログリアの数の増加を示すことが多く(Streit et al 2004;Sierra et al 2007年)後者はミクログリアのプライミングの概念を部分的に支持する(BilboおよびTsang 2010;Norden et al 2015;Niraula et al 2017)。注目すべきは、老化したミクログリアがジストロフィー表現型の同義語として頻繁に使用されている一方で、この関連性が有効であるかどうかはまだ不明である(Angelova and Brown, 2019)。機能的には、老化した生物のミクログリアは、運動性が低く、デブリクリアランスを媒介する能力が低い(Hefendehl et al 2014,Safaiyan et al 2016,Flowers et al 2017,Marschallinger et al 2020)。チャレンジ、例えば、LPSまたはレーザー誘発性の焦点損傷にさらされると、老化したミクログリアは、反応が遅いにもかかわらず、過剰な炎症反応を生成することができる(Sierra et al 2007,Frank et al 2010,Damani et al 2011,Hefendehl et al 2014,Tejera et al 2019)。例えば、レーザーで誘発された網膜や大脳皮質の局所的な損傷に対して、加齢したマウスのミクログリアの反応が遅くなることで、組織の修復が妨げられ、慢性的な局所神経炎症の一因になっていることが示唆された(Damani et al 2011;Hefendehl et al 2014)。SARS-CoV-2感染後、サイトカインストームと低酸素によって悪化したと思われる老化したミクログリアの機能不全反応が、COVID-19で頻繁に報告されている臨床的合併症である1回の肺炎の後に(それまで認知機能の変化を示さなかった)老化した患者で観察された加速した認知機能低下の背景にあると考えられる(Shah er al 2013)。この効果の分子的基盤は、COVID-19に関連して観察された軸索変性とミエリン消失に関連している可能性がある(Handa er al 2020; Reichard er al 2020)。
以上のことから、SARS-CoV-2感染時にミクログリアが変化するという証拠がいくつかある。しかし、COVID-19の新規性を考慮すると、この病気の病因、特にその神経学的影響におけるミクログリアの役割は、まだ解明されていない。他のウイルス感染症から得られた証拠(神経栄養学的か否かにかかわらず)は、味覚喪失/scent、脳症、脳血管障害、てんかん、神経変性、および精神神経系の懸念におけるミクログリアの役割の可能性を指摘している(「ミクログリアは心理社会的ストレスに反応する」の項を参照)。さらに、既往の慢性疾患や高齢化によっても、ミクログリアが神経症状に悪影響を及ぼす方向に偏って変化する可能性がある。今後、COVID-19の中枢神経系における病因にミクログリアがどのように関与しているのか、そのメカニズムを明らかにしていくことが必要である。
COVID-19パンデミックによる心理社会的ストレスは中枢神経系に影響を与える
中枢神経系は心理社会的ストレスの影響を受けている
COVID-19パンデミックは、感染者にかかる神経学的な負担に加えて、感染者と非感染者の両方において、心理的ストレスの増加と関連している(Kempuraj et al 2020,Park et al 2020)。心理社会的ストレスとは、厳しい生活環境から生じる精神的、感情的、または生理的な負担の状態であり、持続的な不適応なストレス反応は、精神疾患を含む様々な疾患状態に関連している(Tian er al 2017)。パンデミック時の知覚されたストレスの程度を調査するために、研究では主に自己報告型の調査が用いられていた(Brooks er al 2020; Ellis er al 2020)。例えば、米国では、COVID-19患者62,354人の電子カルテから、SARS-CoV-2検出後の14~90日間に、不安障害、不眠症、認知症の初診または再発の有病率が、呼吸器感染症やウイルス感染症などの他の健康上の摂動に比べて有意に増加していることが明らかになった(Taquet er al)。 同時に、報告によって罹患者の割合は異なるものの、SARS-CoV-1感染の生存者は、感染から8年後までに、記憶障害、睡眠障害、ストレスレベルの上昇、抑うつ、不安、心的外傷後ストレス障害(PTSD)の症状を示すことがある(Wu et al 2005,Lee et al 2007,Hong et al 2009,Lam et al 2009,Moldofsky and Patcai 2011)。したがって、SARS-CoV-2感染による精神的な長期影響も予想される。
非感染者においては、COVID-19パンデミックはかなりの状況的ストレスを課している(Troyer et al 2020)。感染することや死ぬことへの恐怖、将来の不確実性はすべて、集団が生きる心理的苦痛の一因となっている(Li et al 2020b、Mazza et al 2020,Satici et al 2020)。社会的距離を置くことや隔離による社会的孤立、睡眠を含むライフスタイルの変化、経済不況、経済的損失、さらには退屈、誤った情報、パンデミックに関するメディア報道への過剰な露出などが、この負担をさらに大きくする可能性がある(Brooks et al 2020,Garfin et al 2020,Kim et al 2020,Thakur and Jain 2020)。これらの状況に加えて、学生であること、自己評価の低い健康状態、知覚されるストレス負荷が高いこと、COVID-19が疑われる家族、友人、その他の知人について心配していること、家族のサポートが少ないことなど、他のいくつかの状況もすべて、パンデミック中に抑うつ症状や不安症状を発症するリスクの増加と関連していた(Vindegaard and Benros, 2020)。したがって、過去の健康危機や経済危機においては、これらのストレス要因がストレス関連障害を悪化させ(Horesh and Brown, 2020)臨床的なうつ病、精神病、自殺傾向を引き起こす可能性があることが示されている(Chan et al 2006; Rhodes et al 2010; Pfefferbaum et al 2012; Ng er al)。
特定の集団は、ストレス因子にさらされた結果、悪化する可能性が高い(Holmes et al 2020)。影響を受けやすい集団には、
- (i)複数の合併症を持つ高齢者、
- (ii)家庭内暴力や虐待を受けた専業主婦や女性、
- (iii)既存のメンタルヘルス問題や学習困難を抱える人々、
- (iv)医療従事者、
- (vi)社会経済的に苦境に立たされているグループ
などがある(Holmes et al 2020)。残念なことに、COVID-19の調査では、精神疾患の既往がある人など、非感染の弱者グループを調べたものはまだわずかしかない。摂食障害の患者では、回答者の37.5%が症状を悪化させ、56.2%がさらなる不安を訴えた(Fernández-Aranda er al)。 また、中国の精神科病院では、外来患者2,065人を対象に、不安症状25.5%、抑うつ症状16.9%、不眠症状26.6%の有病率が報告されており、精神疾患の既往がある患者の20.9%が全体的な精神状態の悪化を示していた(Zhou et al 2020)。医療従事者については、大多数の論文が、不安感の増大、さらにはうつ病や強迫性障害(OCD)の症状を明らかにしている(Vindegaard and Benros, 2020)[ただし、一般的には縦断的な研究が不足しているのが現状です]。
ストレスは神経発達障害の著名な危険因子であるため(Bordeleau et al 2019,Comer et al 2020)COVID-19パンデミック中に生活する子どもたちのストレス負荷も調査する必要がある。カナダの青年1,054人を対象とした調査では、学校教育や仲間との関係に関心を持つ一方で、特に友人とのバーチャルな会合を長く続けている人ほど、孤独感や抑うつ的な感情をより強く感じるという結果が出ている(Ellis er al 2020)。病気の拡大を抑えるためには必要なことであるが、援助の専門家と被災者の間など、人と人との接触を制限することで、彼らのストレスを軽減できるリソースへのアクセスが減少する可能性がある。また、パンデミックによって気分障害が悪化する可能性のある子どもや、パンデミック中に習慣や慣れ親しんだ構造が変わることでライフスタイルが乱される自閉症スペクトラム障害(ASD)や注意欠陥多動性障害(ADHD)の子どもへの配慮も重要だ(Jefsen er al)。 全体として、隔離されている子どもたちは、身体活動の低下、不規則な睡眠パターン、好ましくない食生活を強いられる(Carroll et al, 2020c)これらに加えて、恐怖による慢性的なストレス、孤独感、ウイルス感染(COVID-19によるものと思われる)が、ASD、ADHD、精神病、うつ病、統合失調症を発症する強い危険因子を表している(Sormunen et al 2017;Bordeleau et al 2019;Reeve et al 2019;Comer et al 2020)。神経発達障害の危険因子としては、家族の所得が低いこと(Carlsson et al 2020)が挙げられるが、パンデミック時には大規模な失業者が出て(Blustein et al 2020)市場や銀行が大きく後退したことで、その数が増加した可能性がある(Goodell 2020)。
一般の人々のメンタルヘルスの苦痛については、より多くの研究がある。中国で発生したCOVID-19の初期段階における心理的な影響とストレスのレベルを評価したオンライン調査では、1,210人の被験者の回答によると、8.1,28.8,16.5%がそれぞれ中程度から重度のストレスレベル、または不安や抑うつの症状を抱えてた(Wang er al 2020a)。また、回答者の全体平均のImpact of Event Scale-Revised(IES-R)スコアは、PTSD症状の存在を示していた(Wang et al 2020a)。アイルランドの1,041人の回答者を対象とした別の研究では、17.67%がロックダウン中にPTSDの診断要件を満たしており、これは同じグループが並行して行った英国での研究(16.79%)と同様であった(Karatzias er al 2020)。中国で実施された約53,000人の回答者を対象とした大規模な集団ベースの調査では、約35%が心理的苦痛を経験していた(Qiu er al 2020)。また,約1万8,000人のアクティブユーザーによるWeibo(中国の代表的なオンラインソーシャルネットワーク)の投稿をOnline Ecological Recognitionのアプローチに基づいて分析したところ,パンデミックの際には,不安,抑うつ,憤りなどのネガティブな感情が増加し,幸福感や生活満足度などのポジティブな感情は有意に減少したことが明らかになった(Li er al 2020a)。さらに、2,458人の回答者を対象としたデンマークの研究では、世界保健機関の5つの幸福指数(WHO-5)(過去2週間に経験した心理的幸福の心理学的に有効な尺度)は 2016年に得られた結果と比較して、パンデミック中に有意に低いスコアが得られた(Sønderskov er al 2020)。同様に、うつ病の評価を求めるべき回答者の割合は 2016年の前回調査に比べて増加していた(Sønderskov er al)。 パンデミックの広範な影響を考慮すると、発展途上国や確立された脆弱なグループなど、他のコホートにおけるストレスレベルを調査する縦断的研究の必要性が強調され、それによって世界中のストレスレベルをより正確に理解することができる。さらに、ストレスに対する個人の反応を考慮すると、これらの研究にレジリエンスや脆弱性の測定方法を追加することが非常に重要であると考えられる。
ミクログリアの心理社会的ストレスへの反応
心理的ストレスが、ストレス関連の神経精神疾患に関与する多数の脳領域の末梢および全体で、炎症性メディエーターの産生を増加させることはよく知られている(Vecchiarelli et al 2016a; Wohleb and Delpech 2017; Johnson et al 2019)。急性であれ慢性であれ、ストレスは交感神経系、およびHPA軸の活動を誘発し、副腎からカテコラミンとグルココルチコイドをそれぞれ放出する(Sapolsky er al)。 ミクログリアは一般に、グルココルチコイド、サイトカイン、カテコールアミンの上昇に対して、その密度を変化させ、形態を変化させ、炎症促進分子を産生すること、すなわち反応性を示す(図1;Tian er al 2017)。このような変化は、急性ストレスが生体の意欲的な状態や認知機能に及ぼす影響だけでなく、神経細胞の樹状突起の萎縮、シナプスの消失、グルタミン酸の興奮毒性など、ストレスに長期間さらされることによる神経学的な影響と関連している(Frank et al 2019)。これに伴い、ミクログリアのストレス応答は、以下の病態に関与している
- ASDやADHDなどの神経発達状態(Bordeleau et al 2019)
- 大うつ病性障害(MDD)全般性不安障害(GAD)PTSDなどの精神神経疾患(Dantzerら。2008;Miller et al 2009;Haroon et al 2012;Maes et al 2012;Leonard 2014)
- 神経変性疾患、例えば、AD(Bisht et al 2018)やPD(Lecours et al 2018)
ストレスと神経発達障害
脳の発達の重要な時期に、環境因子(例えば、心理社会的ストレス)や遺伝的脆弱性にさらされると、神経発達障害の発症の引き金になる(Chaste and Leboyer, 2012; Karmiloff-Smith er al)。 これに対応して、睡眠不足、明るい光への暴露、LPSの注入、またはウイルス模倣ポリイノシン:ポリシチジル酸(Poly I:C)の注入によって誘発される出生前の母親のストレスのげっ歯類モデルは、炎症性マーカーのレベルが上昇し、出生後の脳におけるミクログリアの密度、成熟、および分布が損なわれ、最終的に神経発生、シナプスの刈り込み、および脳の機能的連結性に影響を与える子孫を生み出す(Bordeleau et al, 2019). また、細胞ストレスによって放出されるグルココルチコイドやDAMPは、ex vivoおよび生体内試験におけるミクログリアの炎症促進反応をプライムする(Frank er al)。 プライミングされたミクログリアは、食作用、細胞増殖、小胞放出に関連する遺伝子の発現が増加し、その後の課題にさらされると炎症反応が悪化する。プライミングは、COVID-19における末梢の急性炎症や循環サイトカインの増加によっても起こる可能性がある(「COVID-19における全身の炎症反応に対応するミクログリア」の項を参照)。このことは、SARS-CoV-2に感染した小児や青年が、COVID-19に対する脆弱性が低いと推定されているにもかかわらず(Lee et al 2020)脳の成熟の重要な時期にある場合に、特に関係する可能性がある。同じことが、ウイルスに感染した妊婦の胎児にも当てはまる。生理的なミクログリア機能の障害は、母親のストレス、および身体的または感情的なネグレクトを含む小児期のマルトリートメントが、MDD、PTSD、GADなどの後年の神経発達障害および成人の精神疾患の主要な危険因子である理由を部分的に説明することができる(Tay et al 2017a)。したがって、心理社会的ストレスによって脳の発達の重要な時期にミクログリアのサポートが損なわれると、乳幼児、小児、青年は、パンデミックの間およびその後に、より悪い神経発達の影響を経験する可能性が高いことが示唆され(Holmes et al 2020)おそらくSARS-CoV-2の同時感染によって増強されると考えられる(「ミクログリアを介した中枢神経系炎症がCOVID-19関連の神経学的症状に寄与する可能性」の項を参照)。
成人期および加齢期のストレスと精神的健康
成人期の心理社会的ストレスは、MDDやPTSDのリスクを高めるだけでなく、認知機能の老化、さらにはADやPDの進行を加速させる(Schneiderman et al 2005,Farrell et al 2017,Tay et al 2017a、Benson et al 2018,Barrero-Castillero et al 2019,Lähdepuro et al 2019)。これに対応して、初期の報告では、パンデミック中の一般集団におけるMDD、不安、およびPTSDの発生率の増加が示されている(Karatzias et al 2020,Li et al 2020a、Sønderskov et al 2020,Wang et al 2020a)。成熟したげっ歯類において、慢性予測不能ストレス(CUS)および社会的敗北ストレスモデルは、ストレス反応および感情処理に関連する領域内のミクログリア密度および形態学的変化の有意な増加を誘発することが示された(図1;Tynan et al 2010;Wohleb et al 2011,2013;Kopp et al 2013;Lehmann et al 2016;Tay et al 2017a;Nie et al 2018)が、多くの矛盾した報告がある(Tay et al 2017a)。同様のミクログリアの変化はヒトでも報告されており、死後の脳では、ASD、統合失調症、MDD、双極性障害の患者全体で、ミクログリア密度の増加、形態的変容、反応性ミクログリアやアストロサイトでアップレギュレートされるトランスロケータータンパク質18kDa(TPSO)の発現が認められている(Tay er al 2017a)。IBA1陽性またはHLA-DR陽性のミクログリア免疫染色の増加は、自殺で死亡した人の前頭前野、前帯状皮質、視床でも遭遇した(Steiner et al 2008,Torres-Platas et al 2014)。
ストレスによるミクログリアの密度と反応性の増加は、酸化ストレス、神経炎症、病的なシナプスリモデリングの悪化を説明する可能性があり、これらは共に精神疾患の発症に関連している(Zhao er al 2015; Milior er al 2016)。例えば、マウスでは、CUSは、IBA1陽性ミクログリアプロセスあたりの神経細胞要素を含む食細胞封入物の数を増加させることが示されており(Wohleb et al 2011,2013)これはシナプス刈り込みの増強を示唆している。シナプス消失が、MDD、統合失調症、老化、および神経変性疾患における認知機能低下の最良の病理学的相関関係であることを考慮すると(Terry et al 1991;Tay et al 2017a)ストレスに応答してミクログリアによって実行されるシナプスリモデリングを調節することで、心理社会的ストレスの有害な影響を緩和することができる可能性がある。そのためには、CX3CR1欠損マウスが慢性的なストレス曝露の有害な影響に対して抵抗性であることを示唆するいくつかの研究があることから、CX3CR1を介して、神経細胞とミクログリアの間のフラクタルカインシグナルを標的とすることが1つの選択肢となりうる(Tay er al 2017a)。具体的には、成体マウスにおいて、CX3CR1の欠損は、海馬CA1領域のニューロン可塑性に対するCUSの影響や、抑うつ様行動の出現を防止した(Milior er al)。 また、これらのマウスは、ストレスによって誘発される歯状回におけるミクログリアの過ラム化や、強制水泳パラダイム下での抑うつ様行動に対しても抵抗性を示すことがわかった(Hellwig er al)。 なお、この経路を遮断すると、生前および生後の発達時(Paolicelli et al 2011,Squarzoni et al 2014,Zhan et al 2014年)ウイルスや低酸素性の傷害時(「Putative Responses of Microglia to SARS-CoV-2 中枢神経系 Infection」および「Microglia Respond to COVID-19-Associated Hypoxia」の項を参照)に有害であると考えられるため、このアプローチの実現可能性を見極めるにはさらなる研究が必要である。
また、パンデミック(およびウイルス感染)に起因するストレスは、より高いシナプス刈り込み活性に関連するミクログリア、例えば「ダークミクログリア」の活動または発達を促進する可能性があり、これを特に標的とすることができる(Bisht et al 2016,El Hajj et al 2019,Savage et al 2020,St-Pierre et al 2020)。また、ストレスによって誘発されるミクログリアを介した神経伝達物質合成の変化もあり、全体として、神経炎症や神経細胞活動の変化が精神疾患の発症に寄与する神経環境を可能にしている。炎症刺激やストレスに反応して、ミクログリアでは、トリプトファンの代謝物であるキヌレニン[インドールアミン2,3-ジオキシゲナーゼ(IDO)経路由来]が、グルタミン酸のイオントロピック受容体アゴニスト[N-メチル-D-アスパラギン酸受容体(NMDAR)]であるキノリン酸を形成する(Capuron et al 2002,Schwarcz et al 2012,Vecchiarelli et al 2016b)。驚くべきことに、COVID-19ではトリプトファン代謝に関与する遺伝子の発現が増加しており(Gardinassi et al 2020)これはグルタミン酸の興奮毒性につながり、トリプトファンをセロトニン合成からキヌレニン代謝に振り向ける可能性があり(Capuron et al 2002,Schwarcz et al 2012,Vecchiarelli et al 2016b)不安、気分障害、精神病、認知機能の低下と関連している。これは、COVID-19に関連する全身性の炎症が寄与していると考えられる。
ミクログリアに対するストレスの影響は、曝露の種類、期間、頻度によって異なる(Yirmiya and Goshen, 2011; Calcia er al)。 パンデミック時には、無数の心理社会的ストレス要因がミクログリアに多様な影響を及ぼすと考えられるが、私たちは、例えば、加齢や慢性疾患、精神的苦痛の履歴などにより、すでに免疫反応のプライミングを受けている脆弱なグループが、より炎症性の高い結果を経験し、その結果、精神疾患のリスクが高まるという仮説を立てている。これらの人々に影響を及ぼす世界的なメンタルヘルス危機の潜在的脅威と、COVID-19ワクチンへのアクセスを含むターゲットケアを提供する政策の緊急の必要性を強調する。
考察と結論
COVID-19パンデミックは、ウイルス感染、低酸素性障害、SARS-CoV-2感染者におけるサイトカイン循環の増加、さらには心理社会的ストレスによって、非感染者と感染者の両方で中枢神経系に影響を与える可能性がある。
ミクログリアは、脳の生理学的および免疫学的機能に重要な役割を果たしているが、これらのストレスに対して様々な反応を示している。マウスコロナウイルス感染症(JMHV)モデルでは、CFSR1を阻害してミクログリアを減少させると、動物の死亡率の上昇、ウイルスの複製、T細胞の浸潤、脱髄などの有害な結果が促進される(Mangale er al)。 また、ミクログリアの枯渇は、脳卒中傷害を悪化させ、神経新生を減少させる(Lalancette-Hébert et al 2007,Szalay et al 2016)。これは、少なくとも中枢神経系ウイルス感染および中枢神経系損傷のいくつかのモデルにおいて、ミクログリア(他の細胞の中で)が保護的な役割を果たし、その存在の減少がさらに有害な効果を可能にすることを示している。
しかし、サイトカインストームが生じたり、慢性的な心理社会的ストレスにさらされたりすると、ミクログリアの機能が変化し、炎症性メディエーターの放出が増加して、神経疾患や精神疾患に関連する病的作用が生じることがある。これらの知見を総合すると、ミクログリア(およびそのさまざまなサブタイプ)が、文脈的に有益な状態から有害な状態へと一時的に切り替わる仕組みを理解する必要があることがわかる。
このような知見は、COVID-19パンデミックによる中枢神経系の有害な結果を軽減するために重要であり、神経発達、精神疾患、神経変性疾患に長期的な影響を及ぼす可能性がある。
また、今後の研究を待たなければならないが、例えば、高齢者や既往症のあるコホートなどの重要なグループでは、SARS-CoV-2を検出した際のミクログリアの炎症性活動をミノサイクリン(Oliveira et al 2020)などで調節することで、望ましくない神経学的結果を回避できる可能性がある。
精神疾患の既往歴がある人も同様で、ミクログリアのシナプスリモデリングの機能障害を軽減することで、パンデミックに伴う精神的苦痛の悪化を防ぐことができるかもしれない。
