Contents
プロバイオティクスと植物生菌による代謝・免疫力促進を通じたSARS-CoV-2を含むウイルス性呼吸器感染症の影響への栄養学的アプローチを調整する微生物群
www.mdpi.com/2076-2607/8/6/921/htm
pubmed.ncbi.nlm.nih.gov/32570850/
要旨
ウイルス性呼吸器感染症は急速に広がり、世界中で膨大な罹患率と死亡率を引き起こす可能性がある。これらの事象は、後天的な免疫システムを活性化するためのワクチン開発のタイムラグにより、公衆衛生に深刻な脅威をもたらしている。
現在のCOVID-19パンデミックで示されているように、ウイルス感染症に対する人々の症状反応の高い変動性は、ウイルス性呼吸器感染症からの罹患率の重症度を緩和する可能性を示している。
免疫機能の調節におけるプロバイオティクス・バクテリ)、プレバイオティクス食物繊維、その他の植物栄養バイオアクティブの役割を支持する証拠が増えてきている。
ヒトの研究は、ウイルス性呼吸器感染症の疫学と免疫病理学を理解するのに役立つが、ウイルス感染の混沌とした性質は、代謝系と免疫系のプレコンディショニングが有益である可能性がある機械論的研究を実施することを困難にしている。
しかし、最近の実験研究では、プロバイオティクス・バクテリアとプレバイオティクス食物繊維が植物の生物活性物質と一緒に、ウイルス性呼吸器感染症に対する自然免疫および後天的免疫応答を有意に変調することができる方法についての理解が大幅に向上している。
プロバイオティクス・バクテリアとプレバイオティクス食物繊維のシンバイオティクスの組み合わせは、主に酪酸などの短鎖脂肪酸(短鎖脂肪酸)の産生を増強することにより、利益の増大を促進する。
これらと特定の植物ポリフェノールは、ウイルス性呼吸器感染症を抑制し、急性呼吸窮迫症候群(ARDS)につながる可能性のある好中球反応を和らげるために免疫応答を調節するのに役立つ。
このレビューでは、ウイルスクリアランスのためのバランスのとれた免疫トーンを設定し、恒常性を強化するために、ターゲットを絞った栄養戦略の潜在的な影響についての現在の理解を強調している。
この知見は、公衆衛生戦術の開発や、ウイルス性呼吸器感染症の罹患率に対抗するための栄養学的アプローチとしてのプロバイオティクス・バクテリアおよびプレバイオティクス食物繊維成分を含む機能性食品の応用の指針となる可能性がある。
1. 序論
ウイルス性呼吸器感染症は、公衆衛生上の重要な問題である。ウイルス性呼吸器感染症は、毎年、世界的に深刻な罹患率と死亡率をもたらす感染症を引き起こしている。主なウイルス性病原体には、インフルエンザウイルス、呼吸器同期ウイルス(RSV)、コロナウイルス、アデノウイルス、ライノウイルスなどがある[1]。
インフルエンザウイルスは季節性呼吸器感染症の主な原因であり、世界で推定300万~500万人の重症患者および29万~60万人の死亡を伴う年間パンデミックを引き起こしている[2]。しかし、死亡率の低い他のウイルスもまた、その高い罹患率のために莫大な経済的負担を引き起こしている[1]。
新しいサブタイプや株のウイルスが常に出現するという脅威は、社会にさらに大きなリスクをもたらしている。これは、最近のパンデミックによって明確に示されており、新規コロナウイルス(CoV)-2は、感受性の高い人々に重症急性呼吸器症候群(SARS-CoV-2)を引き起こしている。
2019年12月下旬に中国の武漢で初めて報告され、世界中に急速に広がっており、350万人以上の症例が確認され、25万人以上の死亡が報告されている[3]。新型ウイルスのヒトからヒトへの感染、COVID-19肺炎および急性呼吸窮迫症候群(ARDS)の誘発[4]、およびその継続的な地理的拡大は、新興ウイルス感染症に対する我々の脆弱性を示す重要な注意喚起として機能する。
後天的な免疫系を働かせるためのワクチン接種は、一般的にウイルス性疾患から集団を保護するための最も効果的な手段と考えられている。
しかし、ウイルスの抗原性の急速な変化は、新しい株の出現につながり、ウイルス性疾患に対する適切な株別のタイムリーな保護を提供する努力を妨げている。さらに、リスクの高い集団、例えばインフルエンザ[5,6]に対するワクチンの有効性が低いか中程度であることが、年間死亡率の高さの原因となっている。
免疫不全の人は、重度の呼吸器感染症に罹患する傾向が高く、死亡率が高いことを示している[7,8]。免疫不全は、年齢 [9]、慢性炎症性疾患 [10]、代謝機能障害 [11]、またはストレス [12] と関連している可能性がある。機能の低下は、感染に対抗する免疫細胞の能力を低下させ、免疫応答の調節障害につながる可能性がある。
SARS-CoV-2感染症の患者のほとんどは、1週間後に息切れを伴う軽症~中等症である[13]。重症患者では、感染は急性呼吸不全、ARDS、代謝性アシドーシス、敗血症性ショックへと急速に進行する [13]。
COVID-19パンデミック時の重症患者のケアに必要な人工呼吸器などの主要機器の不足[14]は、医療機器や介入の配給の必要性にもつながっている[15]。このことは、特にリスクの高い集団における感染症への急性反応を抑制するための効果的なアプローチに向けた研究努力が緊急に必要であることを強調している。
宿主免疫の形成における常在菌の役割については、ますますコンセンサスが高まっている [16,17,18,19,20,21]。このことは、ウイルス感染に対する宿主免疫応答を調節するために、マイクロバイオータとその機能を調節する機会があることを浮き彫りにしている。
プロバイオティクス細菌(プロバイオティクス・バクテリア)やプレバイオティクス食物繊維(プレバイオティクス食物繊維)などの機能性食品成分が、微生物組成や代謝機能の有益な変化を誘導する可能性があることは、十分な証拠が裏付けている。
したがって、代謝および免疫上の利点を与えるために プロバイオティクス・バクテリア、プレバイオティクス食物繊維、および他の植物の生物活性物質を適用することは、広く実施することができる実用的な予防栄養戦略となり得る。
本レビューでは、ウイルス性呼吸器感染症の免疫病理に対する免疫力を付与するための予防戦略やアジュバントとして展開される可能性のあるメカニズムに関するエビデンスを明らかにすることを目的としている。
2. ウイルス性呼吸器感染症の免疫病因
ウイルス性呼吸器感染症 の免疫病理学的特徴を理解することは、ウイルス性呼吸器感染症 とそれに関連した損傷に対する免疫機能の改善を目標とした効果的な防御戦略の開発や特異的な治療法の設計を容易にするために非常に重要である(図 1)。
インフルエンザウイルス感染症および3つの主要なβコロナウイルス(CoV)パンデミック感染症(中東呼吸器症候群(Middle East Respiratory Syndrome: MERS)、重症急性呼吸器症候群(SARS: Severe Acute Respiratory Syndrome: SARS)-CoV-1、およびCOVID-19)から得られた証拠は、これらの疾患のいくつかの重要な免疫病理学的特徴を強調している[22,23]。
これらには、マクロファージ、好中球、樹状細胞(DC)、toll-like receptors(TLR)、サイトカイン、ケモカイン、CD4+およびCD8+ T細胞を含む急性炎症性反応の調節障害、組織リモデリング過程、および細菌性スーパーインフェクションの役割が含まれる [22]。
インフルエンザウイルスへの感染は、自然免疫細胞の流入やサイトカインやケモカインの過剰産生など、ウイルスクリアランスに必要な免疫学的反応の亢進を誘導する。ウイルス感染細胞を破壊するために細胞毒性機構を誘発することも必要であるが、これは有害であり、肺の免疫病理学につながる可能性がある [22,24,25]。
インフルエンザウイルス感染時の制御不能な自然免疫応答および過剰な好中球浸潤によって誘導される組織損傷は、重篤な罹患率および死亡率と関連している[22]。ミエロペルオキシダーゼ(MPO)活性の上昇(好中球流入の増加と一致)は、肺の組織損傷および内皮損傷を引き起こすことが確認されている[26]。
COVID-19肺炎におけるSARS-CoV-2感染肺における線維化の進展も報告されている[27]。COVID-19患者の肺における顕著な好中球浸潤は、「サイトカインストーム」の誘発に関与していることが示唆されている[28,29]。
好中球対リンパ球比(NLR)は、感染初期のCOVID-19患者の重症化を予測することが報告されている[13]。これは、スペインの高齢者集団における腹部肥満誘発性全身炎症の増加とNLRの上昇との間に強い関連性があることを確認した別の研究と一致している[30]。
したがって、NLRはウイルス性呼吸器感染症における疾患重症度の予後因子として使用される可能性があり、重症度の早期発見と感染症に対する患者の反応を助けるための介入の迅速な実施を促進する可能性がある。
図1
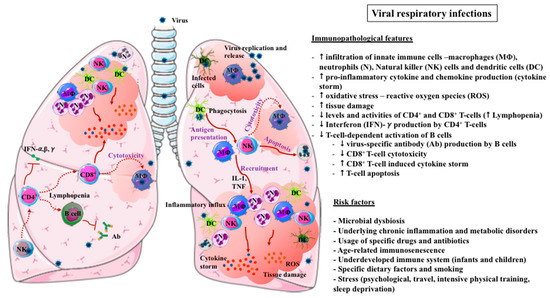
ウイルス性呼吸器感染症に関連する免疫病理学的特徴および危険因子。
活性酸素種(ROS)の発生を介したウイルス誘発性酸化ストレスもまた、炎症性サイトカインおよびケモカインの発現を増加させる因子であり[31]、肺細胞をバクテリア毒素媒介の壊死に感作する因子である[32]。
好中球の流入の増加とサイトカインストームは、その後のARDSと相まって、COVID-19患者の多臓器障害および死亡率と相関している[28]。
インターロイキン(IL)-2R、IL-6、腫瘍壊死因子(TNF)α、およびIL-10の血清中濃度が中等度のCOVID-19患者よりも重症のCOVID-19患者で顕著に増加していることもまた、サイトカインストームと疾患の重症度との関連を示唆している[29]。
マクロファージおよびDCを含む他の免疫細胞の制御不能な応答もまた、インフルエンザの肺免疫病理と関連している[22]。これらの観察は、自然免疫の過剰な活性化が有害であることを示しており、それらの最適な機能を調節するための戦略が標的とされるべきである。
適応免疫成分およびCD4+およびCD8+ T細胞は、ウイルスクリアランスおよび免疫調節に不可欠である。SARS-Co-V2感染は、循環リンパ球およびT細胞サブセットに著しい変化を引き起こすことが報告されている[29]。
リンパ球減少、特にCD4+およびCD8+ T細胞におけるリンパ球減少、およびCD4+ T細胞によるインターフェロン(IFN)-γ産生の減少は、CD8+ T細胞またはナチュラルキラー細胞ではなく、COVID-19の重症度の増加と関連している[29]。
CD4+ T細胞は、免疫細胞、特にCD8+ T細胞の欠失および増幅をオーケストレーションすることにより、免疫応答を調節する。CD4+ T細胞は、B細胞のT細胞依存的活性化を介してウイルス特異的抗体産生を媒介する[33]。
インフルエンザ感染症では、CD4+ T細胞によるIFN-γの産生がウイルスクリアランスに必要であることが示され、その結果、免疫病理学が改善された[22]。
一方、CD8+ T細胞は、標的細胞に対する細胞溶解活性やサイトカインやケモカインの分泌を介した細胞毒性作用を有する[34]。MERS-CoVは末梢血やヒトリンパ系臓器のT細胞に感染してアポトーシスを誘導し、リンパ球減少を引き起こす[35]が、これはSARS-CoV-1でも認められる[36]。
したがって、ウイルスのクリアランスと免疫恒常性の回復のためには、免疫調節を緊密にし、十分なレベルの自然免疫応答と適応免疫応答を効果的に獲得する戦略が優先されるべきである。
さらに、免疫不全患者の免疫活性が最適でないことを考慮して、ウイルスクリアランスのために十分な免疫応答を促進する治療法や予防的アプローチを開発し、追加的なダメージを与えないようにする必要がある。
3. 微生物異常症が引き起こすサブオプティマル免疫
免疫システムが十分に機能しているかどうかで宿主の免疫力が決まり、それによって侵入してくる病原体からの防御が決まる。免疫監視システムは、侵入の兆候を継続的に監視し、特定の病原体に対する防御を行うための適切な免疫応答のシグナルを送る。適切な免疫応答は、外部からの挑戦の後も免疫力を維持し、免疫の恒常性に戻る [37]。
腸内細菌叢への応答は、共通の粘膜免疫系を介して、呼吸器を含む遠隔の粘膜部位のホメオスタシスに影響を与えることが知られている[16,38,39,40]。主に微生物叢によって媒介される腸の免疫学的健康は、「腸-肺軸」を介して肺の健康に影響を与える [39,40,41,42,43]。
さらに、気道の粘膜表面に生息する微生物群集もまた、ウイルス性呼吸器感染症に対する宿主防御に寄与している[17,18]。急性ウイルス性呼吸器感染症は、これらの微生物群集の微生物異常と関連しており、免疫系の最適な機能に影響を与える。
インフルエンザウイルス感染中の微生物叢の変化は、二次的な細菌感染の発症に寄与し、適切な免疫応答がない場合の臨床経過の重症度を増加させる[44]。さらに、慢性炎症および関連する代謝機能障害に伴う免疫機能の変化もまた、宿主における自然免疫機能および後天的免疫機能の障害を促進することが知られている[10,11,45]。
病原体に対して適切な免疫応答を効果的に行うことができないと、宿主は感染症にかかりやすくなる。併存疾患(慢性肺疾患、糖尿病、高血圧、心血管疾患を含む)の有病率と高齢は、感染、ARDSや肺炎の発症、およびCOVID-19患者の高い死亡率を引き起こする[46]。
同様の因子は、インフルエンザウイルスなどの過去の感染症でも指摘されている[7,8,47]。慢性炎症および抗生物質の使用は、腸内細菌叢の障害を伴うことが知られており、その結果、腸内細菌叢の異常を引き起こし、免疫機能障害を悪化させる [17,48]。
さらに、腸内細菌叢の構成および機能の加齢に関連した変化は、免疫系の徐々に悪化する状態である免疫脱色と関連している[9]。免疫老化は、免疫系の自然免疫と適応免疫の両方に影響を与える。
この結果、高齢者では、感染症やワクチン接種に対して効果的な細胞応答や抗体応答を獲得する能力が徐々に低下し、感染因子に対する脆弱性が増大する[49]。
小児および乳児は免疫系が未熟であるため、ウイルス性呼吸器感染症を発症しやすい。腸および気道の早期の微生物のコロニー化は、重度のウイルス性呼吸器感染症に対する感受性に影響を及ぼす [50]。
成人の場合、たばこの喫煙 [51,52,53] および低食物繊維 [54,55] および高脂肪摂取 [56] を特徴とする欧米化された食事の消費を含む生活様式因子は、免疫機能の障害によるウイルス感染症の増悪を促進することと関連している。
喫煙は、SARS-CoV-1およびSARS-CoV-2の受容体であることが報告されているアンジオテンシン変換酵素2(ACE2)受容体をアップレギュレートする [53,57]。
喫煙は慢性閉塞性肺疾患(COPD)の主要な病因因子として確立されており、COPD患者は呼吸器ウイルス誘発性増悪の頻度と進行、死亡率の増加に対して著しく脆弱である[24]。さらに、ストレスに関連した生体機能異常もまた、宿主がウイルス性呼吸器感染症に対して感受性を持つようにする役割を持っている。
心理的、集中的な身体訓練、睡眠不足、および旅行に関連するストレス因子は腸内環境異常を引き起こし、旅行者、軍人、宇宙飛行士、およびエリートアスリートの間で呼吸器感染症と関連している[12,58,59,60]。
したがって、腸内および呼吸器系微生物群集の摂動は、ウイルス性呼吸器感染症に対する防御に不可欠な免疫恒常性と回復力の低下に大きく寄与している。
4. 免疫フィットネスのための機能性食品
免疫機能の低下とウイルス感染症の重症度との間に強い関連性があることを考えると、最適な免疫機能をサポートするための戦略の開発は、重篤な罹患率の保護と予防に有効である可能性がある。免疫の形成における腸内マイクロバイオータと食事の役割を支持する証拠が増えている[16,17,18,19,20,21,61,62]。
特定の食事成分によってマイクロバイオームの構成および代謝能力を調節することは、ウイルス性呼吸器感染症に対する免疫応答に影響を与える有望な戦略である。
プロバイオティクス・バクテリア、プレバイオティクスプレバイオティクス食物繊維、その他の植物由来の生理活性成分を含む機能性食品成分は、主にマイクロバイオータの調節と酸化ストレスへの影響を介して、免疫上の有益性と関連している[63,64]。
健康上の有益性を促進するという証拠があるにもかかわらず、機能性食品は、臨床現場でのヒトウイルス性呼吸器感染症への応用については、医薬品に比べてあまり注目されていない[65]。機能性食品は主に予防的なものであり、急性の病状に対する治療の選択肢ではないが、その有効性については不確実性があり、懐疑的な見方さえある。
これは主に、機能性食品の生物活性物質の試験結果にばらつきがあることに起因すると考えられる。しかし、機能性食品成分の種類が豊富であることや介入試験のデザインが異なることから、試験結果にばらつきがあることは予想されるが、特定の症例への適用が有効であることを否定するものではない。
特定の生理活性成分および/または組み合わせの免疫機構的有効性を解明した実験的証拠は、免疫力の促進を介してウイルス性呼吸器感染症を予防および/または治療するための効果的な食事アプローチを開発するための公衆衛生戦略の指針となる大きな可能性を秘めている。
5. プロバイオティクス
プロバイオティクスは、「適切な用量で投与されると、宿主の健康に利益を与える生きた微生物」[66]である。多くのプロバイオティクス細菌は腸内マイクロバイオータのメンバーであり、腸の健康とウェルビーイングを改善するために食品に取り込まれることが増えているものもある。
最近では、不活化したプロバイオティクス細胞、細菌性エキソ多糖類、および胞子の免疫原性の可能性さえも指摘されている[67,68,69,70,71,72]。
さらに、プロバイオティクスに富んだ食品やサプリメントの摂取は、一部では内因性微生物叢の代謝活動の変化を促進することによって、免疫機能に影響を与えることが示されている[73]。免疫調節を誘導するプロバイオティクス・バクテリアの能力は、免疫細胞との相互作用を介して直接、または挑戦された常在菌叢を支持することによって間接的にいずれかを媒介することができる[74]。
摂取されたプロバイオティクス・バクテリアは免疫系を刺激し、全細菌またはその細胞壁成分によって媒介されるシグナルのネットワークを開始する。
一旦投与されると、プロバイオティクス・バクテリアはTLRやその他の微生物パターン認識受容体(PRR)を介して腸管上皮細胞(IEC)や前頭葉に関連する免疫細胞と相互作用し、サイトカインやケモカインの配列の産生を誘発する。これらの分子は、その後、シグナル伝達経路の複雑なネットワークを介して他の免疫細胞と相互作用し、粘膜免疫系の活性化につながる。
特定のプロバイオティクス・バクテリアは、Tヘルパー1(Th1)および調節性T細胞(Treg)の機能を強化し[75]、ムチン産生、タイトジャンクションタンパク、およびゴブレット細胞を増加させることで上皮バリア機能を強化することが実証されている[76,77,78]。
いくつかの以前の報告[79,80,81]とは対照的に、現在の研究では、腸内細菌の多様性[82,83,84]の変化を誘導する際の特定のプロバイオティクス・バクテリアの効力をサポートしている。
プロバイオティクス主導の利点はまた、栄養素を放出する消化活動によって腸内細菌叢の他の有益なメンバーを相互に供給する能力とリンクしている。したがって、それらは、短鎖脂肪酸s[77,78,85]の生産の増加を含む代謝シフトを促進することができる。
マイクロバイオータ由来の短鎖脂肪酸は、腸の生理機能を維持し、代謝バランスに影響を与える重要な役割を果たすことが知られているため、これは実質的な健康上の利益をもたらす可能性がある[86,87]。したがって、プロバイオティクス・バクテリアの適用は、健康な免疫系をサポートするための戦略としての可能性を提供している。
実験的研究では、ウイルス性呼吸器感染症に対する保護において、特定のプロバイオティクス・バクテリア株の相当な効力があり得ることが示されている。粘膜系に対するプロバイオティクス・バクテリアの効果は腸管に限定されるものではなく、上気道を含む他の場所でクロスモジュレーション効果が確認されている。
保護は、全身および/または局所の細胞性免疫応答の誘導によって媒介される [88]。
特定のプロバイオティクス・バクテリアは、パイエルパッチから呼吸腺などの遠隔粘膜部位に移動するIgA分泌細胞の数を増加させることで、体液性免疫応答を刺激することも知られている[89]。
マウスモデルは、プロバイオティクスが利益をもたらす可能性のあるメカニズムの可能性を実証するのに役立ってきた。
ラクトバチルス[90,91,92,93,94,95]およびビフィズス菌[96]の生きたプロバイオティクス株または加熱処理したプロバイオティクス株をマウスに経口投与すると、肺または血清中のウイルスに対するサイトカイン産生が改善されることが実証されている。
さらに、多くの研究では、呼吸器上皮で直接局所的な自然免疫応答を刺激することにより、経鼻的に投与されたプロバイオティクス・バクテリアがマウスをウイルス性呼吸器感染症から保護する能力を支持している[92,97,98,99,100,101]。
また、マウスの呼吸器分泌物および血清中のウイルス特異的免疫グロブリンの合成および細胞性免疫応答を刺激するために、特定の熱殺菌株であるラクトバチルスおよびビフィズス菌の優れた有効性を確認した研究もある[67,68,69,70]。
同様に、ビフィドバクテリウム・ブレベYIT4064をマウスに経口投与すると、血清中の抗インフルエンザウイルスIgG抗体が増加し、感染から保護された[102]。
インフルエンザ感染マウスへのL. rhamnosusの舌下投与は、肺の粘膜分泌IgA産生、TおよびNK細胞活性、IL-12レベルを増強した[103]ことから、局所の細胞性および体液性免疫機能をサポートした。
しかし、マウスモデルは指標となるものであるが、マウスと比較してヒトの進化した生物学的な違いがあるため、結果をヒトの疾患への影響に翻訳する際には注意が必要である[104]。
プロバイオティクスの効果を検証するためには、直接ヒトでの試験が必要である。プロバイオティクス・バクテリア関連の利点のほとんどの証拠は、特定の病理学[105,106,107,108]の治療や管理で実証されている。
非疾患の対象者におけるプロバイオティクス・バクテリアの免疫調節効果および潜在的な予防活性を評価した研究は最小限にとどまっている。
インフルエンザワクチン接種への プロバイオティクス・バクテリア の補充は、健康な成人におけるワクチン効果を改善し [109,110]、ウイルス性呼吸器感染症 における プロバイオティクス・バクテリア の役割を支持している。
しかし、健康な被験者を対象としたプロバイオティクスサプリメントの無作為化比較試験のシステマティックレビューは、決定的なものではない。
研究や試験のメタアナリシスでは、混合した結果が報告されている [111,112,113]。
介入期間、被験者の年齢(小児、成人、高齢者)、投与量(106-1010cfu)、またはマトリックス(牛乳、ヨーグルト、カプセル)の違いが、相反する結果を部分的に説明しているかもしれない[88]。健康な集団における感受性の違い、またはその他の説明されていない危険因子が、試験で見られた健康転帰への影響に関するプロバイオティクス・バクテリアの有効性のばらつきを説明する可能性もある。
一般的に免疫系が十分に機能している健康な被験者に介入することで誘発される免疫反応の変化を実証することは難しいが、高齢者では最適な免疫力が得られないことがある。
感染症は、高齢者に多く見られるが、これは免疫の老化と呼ばれる免疫力の加齢に伴う低下のためである[9]。さらに、加齢に関連した微生物異常は、腸内の炎症を助長し、免疫調節能力に影響を与えることも知られている[49]。
B. lactis HN019を毎日摂取すると、健康な高齢者被験者においてNK細胞の腫瘍化活性と多形核(PMN)貪食能が増強され、ウイルス感染に対する免疫回復力が強化されることが報告されている。T細胞とB細胞の機能と割合の低下[9]に加えて、PMNとNK細胞を含む自然免疫構成要素についても加齢に伴う変化が報告されている[109]。
血液中のPMN細胞の90~95%を占める好中球は、高齢者では化学走性や貪食活性が低下していることが確認されている[110]。加齢に伴いNK細胞数は増加しているにもかかわらず、NK細胞のシグナル伝達能力、サイトカイン産生、共刺激分子のアップレギュレーションが低下することが報告されている[114]。NK細胞の免疫産生は、高齢者におけるウイルス感染症の罹患率の増加と関連している[115,116]。
免疫細胞の機能に直接影響を与えることに加えて、特定のプロバイオティクス・バクテリアは腸内細菌叢に有益な調節を誘導し、その結果として免疫状態に影響を与える可能性がある。
B. longum株は、血清中のTNF-α、TGF-β、およびIL-10レベルと相関する高齢者の特定のビフィズス菌種のレベルの変化を引き起こすことが実証されている[117]。
Bacillus coagulans BC30 プロバイオティクス・バクテリア胞子の毎日の摂取は、高齢者被験者における抗炎症性IL-10レベルの増加に伴うFaecalibacterium prausnitziiの個体数を有意に増加させることが示されている[118]。
B. coagulans BC30は、特定のアデノウイルスおよびインフルエンザウイルス暴露に反応してTNF-αのT細胞産生を増加させることがex vivo実験で確認されている[71]。
L. casei [120]およびL. plantaurm [121]もまた、高齢者のインフルエンザウイルスワクチン接種を改善することが評価され、示されている。
加齢に関連した微生物異常症もまた、短鎖脂肪酸を含む有益な代謝物を産生する際の腸内細菌叢の代謝能力に影響を与える [49,109]。
高齢者の腸内におけるバクテロイデス属、ビフィドバクテリウム、フェカリバクテリウム、アクカーマンシア、またはクロストリジウムクラスターXIVaの個体数の減少は、一般的に報告されている[49]。
高齢マウスにL. acidophilus DDS-1を補給すると、有益なAkkermansiaとLactobacillus種の相対的な豊富さが増加し、酪酸レベルが向上する一方で、同時にプロ炎症性サイトカインをダウンレギュレートする結果となった[82]。
これらの研究を総合すると、プロバイオティクス・バクテリア の適用が高齢者の免疫機能の回復を促す可能性があることが示されているが、プロバイオティクス・バクテリア の菌株特異的な効果については、さらなる研究が必要である。呼吸器感染症におけるプロバイオティクス・バクテリアの誘導効果は、乳児や小児でも示されている。
いくつかの研究では、特定の乳酸菌およびビフィズス菌プロバイオティクス・バクテリア株が、呼吸器感染症エピソードを経験する参加者の数、その平均期間、抗生物質の使用、および学校や保育園の欠席を減らす上で有益であることが明らかになっている[122,123,124]。しかし、明確な有益性は報告されていないという報告もある [125,126]。
保育園での曝露は、子どもの免疫系の未熟さとともに上気道感染症のリスクの増加と関連している[126]。
メタアナリシスでは、一般的な急性疾患を予防するためにプロバイオティクス・バクテリアを受けた乳児と小児は、抗生物質を処方されるリスクが低下していることが確認された[124]。
プロバイオティクス・バクテリアを補充した乳児用粉ミルクの利点に関する最近の系統的レビューでは、いくつかの有益な効果が考えられると結論づけられているが、日常的な使用を推奨するための既存の堅牢な証拠が不足していることが報告されている[127]。効果の真の欠如というよりも、特定のプロバイオティクス・バクテリア株と転帰に関するデータが少ないことが認められた。
乳児においては、プロバイオティクス・バクテリアを添加した粉ミルク(B. infantis R0033、B. bifidum R0071、およびL. helveticus R0052)が、分泌性IgA(sIgA)産生への効果を通じて粘膜免疫の発達を維持することが確認された[128]。
sIgAは母乳中の免疫グロブリンの90%を占め、腸粘膜を保護し、主に病原体と上皮層との接触を遮断して粘液層内に捕捉することで感染を防ぐ[129]。
この文脈では、プロバイオティクス・バクテリアは、病原体に対する防御の重要な最初のラインを欠いている粉ミルクを与えられた新生児の未熟な免疫システムに利益をもたらす可能性がある。
6. プレバイオティクス・プレバイオティクス食物繊維
欧米諸国の成人の間での果物および野菜の消費量の低下は、呼吸器疾患、肥満、糖尿病、心血管疾患、さらにはがんを含む慢性疾患のパンデミックの増加と一致している[130,131]。「欧米化された食生活」は、慢性的な局所および全身の炎症と強く関連しており、微生物異常症、改変された免疫、および弱体化した腸管バリア機能[63,132]につながる。
この食事は一般的に精製された炭水化物と脂肪が多く、果物や野菜からのプレバイオティクス食物繊維含有量が低い。基礎となる慢性疾患は、最近のMERS、SARS、およびCOVID-19主要ベータコロナウイルスパンデミックの罹患率および死亡率の高いリスクを説明するために指摘された[133,134]。
逆に、果物および野菜を豊富に含む食生活は、心血管疾患、代謝障害、および胃腸障害のリスクを低下させることが示されている[135,136,137]。したがって、植物ベースの食事、機能性食品、およびサプリメントは、呼吸器感染症から保護するための有望な戦略を提示する。
果物や野菜からのプレバイオティクスプレバイオティクス食物繊維は、腸内細菌叢を調節するために十分に確立されており、慢性炎症および代謝状態において多くの利点が報告されている[138]。さらに、プレバイオティクス食物繊維消費量の増加は、呼吸器関連疾患における死亡率の低下[139]および肺機能の改善[140]と関連している。
いくつかの研究では、プレバイオティクスサプリメントがウイルスワクチン接種に対して免疫応答の利点を付与する能力を報告している。フラクトオリゴ糖(FOS)、トリグリセロール、ビタミン、およびミネラルを補充したプレバイオティクス栄養処方は、介護施設の高齢者対象者の免疫機能を改善し、上気道感染症の持続時間を短縮することが示された[141,142]。
免疫原性の利点は、インフルエンザワクチンに対する反応の増強(特定のTリンパ球サブセットの活性化)、発熱の減少、および新たに処方された抗生物質の減少によって示された[141]。
対照的に、自由に暮らす高齢者にFOSを含むプレバイオティクスサプリメント(70%のラフチロース®と30%のラフチリン®)を給与しても、ワクチン接種に対する免疫反応には明確な効果がないことが確認された[143]。
長鎖イヌリンとオリゴフルクトースの特定の組み合わせ(Synergy1®)もまた、中年被験者におけるインフルエンザワクチン接種に対する抗体反応に限定的な効果を与えることが示された[144]。これらの研究におけるプレバイオティクスサプリメントの配合のばらつきが、参加者の状態と転帰のばらつきを説明している可能性がある。
プレバイオティクス繊維の種類、その複雑性(精製または全植物)、および追加された生物活性物質は、達成された利益にかなり影響を与える傾向がある [77,78]。腸内マイクロバイオータに影響を与え、免疫調節に影響を与えるプレバイオティクス食物繊維の確立された能力は、ウイルス感染症に対する有望な保護能力を示している。
ミクロバイオータ組成に影響を与え、酪酸、酢酸、およびプロピオン酸などの短鎖脂肪酸sを産生するために微生物発酵を受けるプレバイオティクス食物繊維の能力は、作用機序として頻繁に引用されている[87]。
イヌリンを豊富に含む高繊維質の食事を与えられたマウスは、生存期間を延長し、インフルエンザウイルス誘発性免疫病理学を減少させ、抗ウイルスT細胞応答を改善した[55]。これらの二重の効果は酪酸値と強く相関していた。
また、高繊維食は骨髄造血を変化させ、インフルエンザウイルス感染マウスの肺に交互に活性化されたマクロファージの蓄積をもたらすことが確認された。マクロファージはより少ないCXCL1ケモカインを生成し、気道への初期好中球流入を減少させ、その結果、誇張された組織損傷を回避することができた。
また、プレバイオティクス食物繊維の発酵はCD8+ T細胞の代謝を促進し、高繊維を摂取した感染マウスの活性化、遊走、細胞毒性活性、ウイルスクリアランスの増加によって示された[55,145]。大腸の急性炎症における好中球遊走の調節における短鎖脂肪酸sの保護的役割は、アセテートを用いた別の研究でも実証された[146]。
短鎖脂肪酸sは好中球遊走を調節し、アセテートはGPR43-/-マウスの腸組織における好中球の蓄積を抑制するのに失敗した。微生物由来の短鎖脂肪酸sの利点は、腸管上皮、脂肪組織、および単球や好中球を含む免疫細胞上で発現したGタンパク質共役型受容体(GPR)の直接的な作用を介して媒介されることが示唆されている[147]。
これらの研究は、短鎖脂肪酸sを介して個別の自然免疫、適応免疫、および体液性免疫の構成要素のバランスをとり、気道で最適な免疫トーンを設定して、組織の過剰な損傷を回避しながら効率的なウイルスクリアランスを促進する際のプレバイオティクス食物繊維補給の有効性を強調している[55]。
短鎖脂肪酸sの出力は、プレバイオティクス食物繊維の種類だけでなく、腸内の繊維発酵細菌の存在によっても大きく異なる。ヒトにおけるマイクロバイオータの変調および短鎖脂肪酸レベルに対する3つの発酵性繊維の効果を比較した研究では、耐性ジャガイモのデンプンは、イヌリンおよびトウモロコシからの耐性デンプンと比較して、高度に酪酸性であることが指摘された[148]。
異なる細菌の変化は、ビフィズス菌の個体数と酪酸産生種の豊富さに有利なジャガイモ耐性デンプンで誘導された。しかし、一般的に研究されている精製されたプレバイオティクス食物繊維は、果物や野菜に存在するものに比べて生化学的な複雑さが限られている[149]。
天然繊維の複雑性を有する全植物プレバイオティクスのサトウキビ繊維およびグリーンバナナ耐性デンプン粉のサプリメントは、急性大腸炎マウスにおいて短鎖脂肪酸レベルを上昇させ、局所炎症を減少させることが示されている[77,78]。
非精製プレバイオティクス食物繊維サプリメントは、急速および遅発酵性画分を有する可溶性および不溶性の両方の繊維を、天然の全植物性食品に存在する繊維をより正確に表す比率で含有している[77]。
したがって、プレバイオティクス食物繊維サプリメントは、予防接種に加えて、急性感染症の予防と保護のための公衆衛生戦略の中で実施される可能性がある。
7. シンバイオティクス
シンバイオティクスとして知られるプロバイオティクス・バクテリアとプレバイオティクスプレバイオティクス食物繊維の組み合わせは、健康上の利点を増大させる能力のために注目を集めている。シンバイオティクスは、相補的および/または相乗的な機能のいずれかによって、宿主に増強された利益を与えることが期待されている[150]。
プロバイオティクス・バクテリアまたはプレバイオティクスプレバイオティクス食物繊維のいずれかで所望の健康効果を達成する成功は、いくつかの要因に依存する。
プロバイオティクス・バクテリアの利点は、非常に種および株に特異的である。さらに、種/株および潜在的な効果に関係なく、投与されたプロバイオティクス・バクテリアは、胃酸および胆汁酸に生き残り、生きた生物に関連する利点を付与するために腸に到達しなければならない[75,151]。
肯定的な効果を持続させるためには、プロバイオティクス・バクテリアもまた、継続的な摂取から、または腸内で効果的に延長された滞留時間および複製を有することから存在する必要がある。さらに、短鎖脂肪酸産生を介してプレバイオティクス食物繊維の利益を誘導する能力は、繊維発酵性腸内微生物の存在に厳密に依存している[152]。
したがって、特定のプロバイオティクス・バクテリアまたはプレバイオティクスによるマイクロバイオータの複雑なネットワークおよびその代謝能力の実質的な変調の誘導は、シンバイオティクスで改善されるであろう。
これには、有効性と健康アウトカムを改善するために、プロバイオティクス・バクテリアとプレバイオティクスプレバイオティクス食物繊維を組み合わせて同時に補充することが含まれる[77,78]。
高齢者集団で実証されたウイルス性呼吸器感染症に対するシンバイオティクスの有効性の臨床的証拠があるが、この限られた数の研究の結果は様々である。
高齢者(脳卒中の既往歴あり)を対象に、プレバイオティクスのガラクトオリゴ糖(GOS)とビフィズス原性成長因子を含むシンバイオティクスを加熱処理した乳酸菌発酵乳と組み合わせて投与したところ、インフルエンザに対するワクチン接種反応が向上した[153]。
この研究では、シンバイオティクスの介入はビフィズス菌数に影響を与え、ワクチンに対する血清保護効果の持続性をより長く促進した。
対照的に、別の研究では、B. longum bv. Infantis CCUG 52486をプレバイオティクスGOSと組み合わせた場合、高齢者の季節性インフルエンザワクチン接種に対するNK細胞反応の年齢関連の変化を若年者と比較して減少させることができなかった[154]。若年者と比較して高齢者のB細胞およびT細胞プロファイルには取るに足らない影響しかなかった[155]。
シンバイオティクスの組み合わせは、若い被験者ではメモリーIgA+、メモリーIgG+、総IgG+のB細胞レベルを増加させたが、高齢者ではこれらの効果を再現することができず、T細胞サブセットを有意に変化させることもできなかった。
これらの観察は、介入の結果に影響を与える免疫機能の著しい変化と腸内環境の異常によって特徴づけられる免疫産生の重要な性質を強調している[156]。
このことは、加齢に伴うシンバイオティクスの応用のための成分を選択する際には、さらなる研究に基づくより正確なアプローチが必要であることを示唆しているかもしれない。
老化細胞のアポトーシスを誘導する化合物であるセンolyticsの応用は、様々な加齢に関連した病理学的疾患を治療するために、現在ヒトで臨床試験が行われている[157,158]。ケルセチン、フィセチン、ピペロロングミン、クルクミンなどの多くの解熱剤は、食品中の天然のファイトケミカル化合物として同定されている[159]。
加齢に伴う免疫機能の低下を改善するために、セノリティクスとシンバイオティクスを組み合わせることの有効性を決定するための研究努力が探究され得る。
ARDSの発症は、高齢者や慢性疾患を持つ人、COVID-19肺炎の患者の高い死亡率の原因となっている[46]。したがって、リスクのある患者の適切な免疫応答を促進する予防的な栄養戦略を設計することが賢明である。
例えば、短鎖脂肪酸産生の増強は、より効果的な免疫の開発をサポートするための重要なメカニズムとなり得る(図2)。腸由来の短鎖脂肪酸は、自然免疫細胞の機能に影響を与えるだけでなく、後天的な免疫成分にも影響を与えることが示されている。特筆すべきことに、短鎖脂肪酸は腸管に限定されず、循環系を介しても拡散する[160]。
細菌によって産生された短鎖脂肪酸は大腸で吸収され、大腸細胞によって利用されるか、門脈を介して輸送されて血液循環や他の臓器に到達する。
高繊維誘発性短鎖脂肪酸産生は、マクロファージおよびDC前駆体の強化された生成、および高度に貪食性DCによる肺のその後の播種によって特徴づけられる骨髄造血を変化させる[145]。
このタイプのDCは、Th2細胞エフェクター機能を誘導する能力が低下していることが報告されており、したがって、繊維給餌マウスにおけるアレルギー性気道炎症を解決している。
別の研究では、短鎖脂肪酸ブチレートがヒストン脱アセチル化酵素3(HDAC3)を阻害し、非炎症性の強化された抗菌活性を持つマクロファージを獲得した[161]。
マクロファージ代謝のシフトは、解糖の減少とラパマイシンの機械的標的(mTOR)活性の阻害によって示され、マクロファージの酪酸誘発抗菌活性を説明した。
同様に、マウスの急性肺損傷を緩和する酪酸ナトリウムの能力は、高可動性グループボックス1(HMGB1)放出の抑制とNF-κB活性化を介して示されている[162]。NF-κB活性化は、傷害および炎症に応答して炎症性メディエーターの発現の亢進を促進する一方で、HMGB1は後期のプロ炎症性メディエーターとして急性肺傷害の下流の発達に参加している。
さらに、重要な実験的証拠はまた、組織の炎症に影響を与えるT細胞の活性および分化を調節する短鎖脂肪酸sの役割を支持している[160]。さらに、短鎖脂肪酸はまた、細胞の代謝を促進し、遺伝子発現を調節して、抗体産生細胞における血漿B細胞の分化を促進する[54]。
したがって、微生物発酵を介して短鎖脂肪酸sをブーストすることは、感染症時の炎症を制御し、ホメオスタシスを強化するための適切な粘膜および全身の自然免疫応答および獲得免疫応答を改善する上で有望な可能性を持っている。

共生生物誘発性短鎖脂肪酸(短鎖脂肪酸s)がウイルス性呼吸器感染症を減衰させるために自然および獲得免疫応答を調節することができる潜在的なメカニズム。
共投与されたプレバイオティクスプレバイオティクス食物繊維を効率的に代謝することによって上昇した短鎖脂肪酸sを増強することができるプロバイオティクス・バクテリアを使用して共生の組み合わせを選択すること、他の腸内微生物発酵器をサポートすること、または腸内プロバイオティクス・バクテリアの滞留時間を延長することを考慮する必要がある。
炎症を起こした腸内の一次および二次発酵体の個体数の減少は、バイオシスの顕著な特徴の一つである。このような状態では、プレバイオティクス食物繊維のみの補充は、利益を付与するために短鎖脂肪酸の有意なレベルを生成するには不十分である[152]。
同様に、プロバイオティクスの介入だけでは、投与されたプロバイオティクスの成長および活性に影響を与える繊維基質が存在しない場合には、限られた効果しかないかもしれない。
プロバイオティクスの胞子は、植物全体のプレバイオティクスプレバイオティクス食物繊維とのシンバイオティクスの組み合わせで、大腸の全長に沿って酪酸産生を増強した[77,78]。対照的に、化学的に誘導されたマウスの大腸炎モデルでは、プロバイオティクス・バクテリア B. coagulansもプレバイオティクス単独でも、同じレベルのこの効果をもたらすことができなかった。
様々な植物繊維を代謝して短鎖脂肪酸および乳酸を産生するB. coagulansの能力は、以前に決定されている [163,164,165]。B. coagulans(バチルス・コアグランス)の胞子を全植物のサトウキビ繊維[77]またはグリーンバナナの耐性デンプン[78]とシンバイオティクスの組み合わせで摂取すると、炎症性浸潤を減少させ、タイトジャンクションタンパク質の破壊を防ぐことで、短鎖脂肪酸レベルの増強とともに、大腸上皮に化学的に誘導された損傷からの保護を誘導した。
B. coagulansの投与は、高齢者におけるFOSおよびGOSとの組み合わせで、ex vivoでの糞便微生物叢の有益な変化をもたらすことも示されている[166]が、別の生体内試験(in vivo)研究[167]では、豚の酪酸産生を増強し、免疫機能の改善を誘導するのに適したシンバイオティクスの組み合わせが同定された。
ポテト耐性デンプンは、豚のGI管内の乳酸菌やAnererostipes hasrusなどの二次発酵菌を刺激し、短鎖脂肪酸の産生を増加させることが報告されている。
したがって、発酵可能なプレバイオティクス食物繊維とそれを代謝できるプロバイオティクス・バクテリアを送達することができるシンバイオティクスは、ウイルス性呼吸器感染症の免疫病理に対する最適な免疫応答をサポートするための魅力的な戦略である(図2)。
8. ポリフェノール系植物バイオアクティブ
プレバイオティクス食物繊維に加えて、果物や野菜に存在するビタミン、微量栄養素、ポリフェノールを含むファイトケミカルが食事の一部として摂取される。フィトケミカルも同様に、ウイルス性呼吸器疾患の重症度に対処するための栄養戦略においてかなり重要であることが示されている[62,168,169]。
特定のポリフェノールが微生物相の組成に影響を与える能力とは別に、ポリフェノールは抗酸化作用、抗炎症作用、および抗ウイルス作用も付与する [170,171,172]。
ポリフェノールの抗ウイルス効果は、ウイルス複製に対する直接的な抑制効果、または免疫調節/抗酸化反応の誘導によって媒介されることが実証されている[170,171]。酸化ストレスは、急性呼吸器ウイルス感染症における肺組織の損傷や上皮バリア機能障害に関与していることが示唆されている。
蓄積された証拠は、自然免疫応答と適応免疫応答の両方に緑茶に豊富なエピガロカテキン-3-ガレート(EGCG)の優れた免疫調節効果を明らかにしている[173]。EGCG の補充は、TLR4 シグナルの阻害と炎症性細胞の遊走を減少させることを介して豚インフルエンザウイルスによって誘導される急性肺損傷を軽減するために実験的に証明されている[174]。
緑茶カテキン代謝物は、生体内試験(in vivo)でCD4+ T細胞とNK細胞の活性を高めることが示されている[175]。また、大腸に到達したときに、ポリフェノールはまた、このように彼らの代謝と免疫機能に影響を与える、腸内細菌叢[176]と相互作用することが知られている[177]。
実験的研究から得られたこのような証拠は、免疫機能や腸内細菌叢に影響を与える植物由来の生物活性物質の実質的な能力を示しているが、ウイルス関連のヒト疾患に関する研究は限られているため、この分野でのさらなる研究の必要性を浮き彫りにしている。
9. 結論
宿主免疫の形成におけるマイクロバイオータの不可欠な役割を支持する強力な証拠がある。組織損傷、肺炎、ARDS、多臓器不全、死亡を含むウイルス性呼吸器感染症の重篤な免疫病理学は、制御された免疫応答の異常と炎症の悪化によって誘導される。さらに、基礎となる慢性炎症とそれに伴う生体機能障害は、罹患率と死亡率のリスクを増加させる。
細菌の組成と活性を調節するために組み合わせたプロバイオティクス・バクテリア、プレバイオティクス食物繊維、および栄養学的に供給された植物のバイオアクティブを採用することは、ウイルス性呼吸器感染症に関連する急性病的疾患に対する強化された保護のための実用的なアプローチである。
互換性のあるプロバイオティクス・バクテリア、プレバイオティクス食物繊維、および生物活性物質の選択された相乗的な組み合わせの使用は、ウイルスクリアランスのために適切なレベルで自然免疫応答と後天的免疫応答をバランスさせ、ホメオスタシスを強化するための一貫性を向上させることができるかもしれない。
ウイルス性呼吸器感染症における免疫の健康状態や疾患の重症度に影響を与える能力に関する実験的研究から得られた証拠は、ヒトでの効果を確認するために、より明確な臨床研究が必要である。
この知見は、公衆衛生上の推奨事項や、急性のウイルス感染に対する免疫力とウェルビーイングの強化を目的とした食事戦略の開発の指針となる可能性がある。

