Contents
Microbial co-infections in COVID-19: Associated microbiota and underlying mechanisms of pathogenesis
pubmed.ncbi.nlm.nih.gov/33962007/
2021年5月4日
概要
重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)を原因とする新型コロナウイルス感染症2019(COVID-19)は、現在進行中の壊滅的なパンデミックで全世界に衝撃を与えている。SARS-CoV-2以外のウイルス、細菌、古細菌、真菌など、多くの微生物が共に進化し、SARS-CoV-2と共に複雑な分子病態を形成していることが知られている。しかし、重症のCOVID-19患者の重症化につながる他の微生物の共同病原体の関与とその分子メカニズムについては、まだ十分に検討されていない。
実験室でCOVID-19が確認された症例では、共同感染の発生率は最大で94.2%に達するが、SARS-CoV-2感染宿主の共同感染の運命は、宿主の防御免疫と免疫病理学のバランスに依存することが多い。
SARS-CoV-2の共同感染者としては、Streptococcus pneumoniae、Staphylococcus aureus、Klebsiella pneumoniae、Haemophilus influenzae、Mycoplasma pneumoniae、Acinetobacter baumanniiなどの細菌が主に確認されている。レジオネラ・ニューモフィラ、クラミジア・ニューモニエに続いて、インフルエンザ、コロナウイルス、ライノウイルス/エンテロウイルス、パラインフルエンザ、メタニューモウイルス、B型インフルエンザウイルス、ヒト免疫不全ウイルスなどのウイルスが登場する。
共用病原体(特に肺微生物)SARS-CoV-2,宿主の間のクロストークは、最終的にCOVID-19の診断、治療、予後の難易度を高める重要な要因である。同時に、共感染した微生物は、自然免疫応答と適応免疫応答の両方を変化させることで、宿主の防御機構から逃れるための新たな戦略を用いて、SARS-CoV-2の病態をさらに悪化させる可能性がある。
SARS-CoV-2の効果的な患者管理、治療、封じ込めのためには、COVID-19における共同感染をより深く理解することが重要である。そのため、このレビューでは、COVID-19における一般的に報告されている微生物の共同感染者、その感染パターン、共同感染の可能性のあるメカニズム、および結果を包括的に調査する必要がある。
このように、SARS-CoV-2の発症過程における可能性のある共同病原体とその分子メカニズムを明らかにすることは、現在のパンデミックにおけるSARS-CoV-2呼吸器感染症が疑われる場合の診断法、適切な治療法および予防的介入法の開発に光を当てることになるだろう。
1. はじめに
新型コロナウイルス感染症2019(COVID-19)は 2019年12月に中国の武漢で出現したSARS-CoV-2を原因とする急速に伝達される肺炎様疾患であり、現在世界中でパンデミックしている[1,2]。ポジティブセンスのエンベロープ型RNAウイルス(SARS-CoV-2)は、SARS-CoV-1や中東呼吸器症候群コロナウイルス(MERS-CoV)など、これまでに知られているコロナウイルスとは遺伝的に異なるウイルスである[[1][2][3]]。SARS-CoV-1や中東呼吸器症候群コロナウイルス(MERS-CoV)などのウイルス[[1][2][3]は,中国で発生した直後から,1918年から 1920年にかけてのスペイン風邪に次いで,過去100年間で最も死亡率の高いヒトの病原体の1つとして浮上した恐ろしいウイルスである。SARS-CoV-2感染症は,世界中で公衆衛生上の課題となっており,世界保健機関(WHO)はこの病気を国際的に懸念される公衆衛生上の緊急事態と宣言している[1,2]。2003年に発生したSARSと2012年に発生したMERSは,致死率がそれぞれ9.6%と34.4%であったが,6カ月以内に収束させることができた。今回のCOVID-19は、2021年4月7日までに217の国と地域に影響を与え、全世界で133,688,126人以上の症例が確認され、2,901,038人が死亡している(https://www.worldometers.info/coronavirus/?utm_campaign=homeAdvegas1?)。したがって、このCOVID-19パンデミックの急速な広がりは、この憂慮すべき病原体による入院や死亡の数を減らすために、ワクチンや抗ウイルス治療法を迅速に開発することの重要性を浮き彫りにしている[6]。
多くの呼吸器系ウイルス感染症では、共感染や重感染がよく見られる[6,7]。細菌の共感染は、あらゆるウイルス感染症に感染した患者の死亡率を著しく増加させる[6,8,9]。以前、集中治療を受けているMERS-CoV患者においても、細菌の共感染が報告されていた[10]。SARS-CoV-2と他の微生物との共感染は、COVID-19の正確な診断、治療、予後を複雑にし、さらには死亡率を上昇させる可能性があるCOVID-19の病態における非常に重要な因子である[11]。臨床試験やメタゲノム調査では、COVID-19患者においてSARS-CoV-2と一緒に他のウイルス、細菌、古細菌、真菌が共存していることが示されていた[[11], [12], [13]]。COVID-19で死亡した患者の約50%が二次的な細菌感染症を患っており[12,14]、COVID-19の病態生理的な進行をさらに強めている。SARS-CoV-2の効果的な患者管理、治療、封じ込めのためには、COVID-19における共同感染症の理解を深めることが重要である。したがって、COVID-19患者の併存感染の調査を強化する必要がある。さらに、COVID-19については、感染拡大を防ぐための有用な戦略、適切な臨床検体の収集、感染経路、ウイルスの動態、有効な薬物治療など、いくつかの問題がまだほとんどわかっていない。しかし、細菌、古細菌、ウイルス(ベータコロナウイルス属以外)真菌など、他の呼吸器系病原体との共感染の可能性については、まだ明確にはわかっていない。COVID-19の症例を管理する臨床医にとって、これらの二次的な病原体が共同感染を引き起こすこととの関連性は重要な関心事となるはずである。米国疾病予防管理センター(CDC)の新興感染症セクションは、他の呼吸器系病原体の検査を推奨しており、SARS-CoV-2の迅速検査が広く普及していない場合には、他の感染症の証拠がCOVID-19の可能性のある患者の評価に役立つことを示唆している[15]。
先の2つのコロナウイルス(SARS-CoV-1とMERS-CoV)インフルエンザウイルス、そしてSARS-CoV-2は、高熱、咳、頭痛、さらには肺炎など、非常に類似した呼吸器症状を示する[[16], [17], [18], [19]]。最近の臨床研究やin silico研究では、ウイルスの同時感染には、主にエンテロ/ライノウイルス(hRV)ヒトメタニューモウイルス(hMPV)呼吸器シンシアルウイルス(RSV)シフォウイルス、アルファパピローマウイルス、ミオウイルス、トンブスウイルス、ビクトリウイルス、パーティウイルス、クリソウイルス、トチウイルスなどの呼吸器系ウイルス、およびその他のコロナウイルス(SARS-CoV-2以外)が含まれることが示されている[11,20]。COVID-19の同時感染は、呼吸器のマイクロバイオームのホメオスタシスを変化させ、その結果、感染症を誘発し、免疫細胞を刺激してより重篤な炎症を引き起こすこともある[11,20]。また、COVID-19患者の腸内細菌の多様性は、日和見病原体の相対的な存在感が増し、有益な共生物の相対的な存在感が低下している[21]。最近のメタゲノム研究では、COVID-19患者の鼻腔ぬぐい液には、細菌、古細菌、非COVIDウイルスが同時に存在することが明らかになっている[11]。SARS-CoV-1やMERS-CoVの初期のパンデミック時には、侵襲的人工呼吸を受けている患者は細菌の共感染を起こしやすく、死亡率も高かった[16,18]。したがって、細菌の共同感染は、COVID-19の重症化と死亡率を促進する重要な要素であると考えられる[22]。死亡した患者を対象とした最近の研究では、敗血症(100%)が主な合併症の1つとして作用していることが示されており[23]、COIVD-19患者の予後やその後の治療において、共感染が非常に重要であることを示している。さらに、パンデミックおよび季節性インフルエンザにおいて、共同感染はより重篤な転帰と関連している[24]。インフルエンザ関連の細菌感染症全体が、市中肺炎(CAP)症例の最大30%を占める可能性が示唆されている[25]。COVID-19を発症した入院患者を対象としたいくつかの研究では、大多数の患者が経験的に抗生物質を使用していることが指摘されている[24,26,27]。しかし、COVID-19患者では、プロカルシトニンやC反応性タンパク質など、細菌感染に関連する炎症性の血清マーカーが増加するという証拠があるが、対応する細菌の共同感染はなかった[24,28]。一方、いくつかの記述的研究では、常在微生物群の生態系は、侵入したウイルスを制御したり、制御されたりすることができ、刺激的または抑制的な効果を促進することが示されている[23,29,30]。さらに重要なことは、この複合感染微生物は、SARS-CoV-2感染症の新たな治療法を開発するための新たな戦略にもなりうるということである。COVID-19の結果に対する重要性を示す証拠が増えているにもかかわらず、SARS-CoV-2負荷に対する共感染クリアランスの効果については、まだ系統的なレビューや批判的な議論がなされていない。このシステマティックレビューでは、SARS-CoV-2パンデミックに関連する微生物の共感染、およびCOVID-19における共感染の可能な分子メカニズムに関する知識を更新し、微生物の共感染を強調している。
2.論拠とレビュー方法
現在までに、SARS-CoV-2のゲノミクス、起源、ゲノム進化、分子診断、ワクチンおよび/または治療法に関する何千もの報告がなされている。しかし、COVID-19に関連する微生物(ウイルス、細菌、真菌、古細菌)の共感染とCOVID-19患者への影響、COVID-19患者における共感染者の特徴、およびその基礎となる分子メカニズムに関する包括的なレビューは不足している。そこで、我々は、共感染、共感染微生物の特定、およびその病態について厳密な文献調査を行った。COVID-19疾患との共感染の概念と証拠,およびこの包括的なレビューの理論的根拠については,序論
で述べた。本レビューの後半部分は,PubMed central,Google Scholar,ResearchGate,bioRxiv,medRxiv,Preprints archives,世界保健機関(WHO)COVID-19ブログ,米国国立衛生研究所(NIH),米国疾病対策センター(CDC),Clinical Trials Registryデータベース,COVID-19 vaccine and therapeutics tracker(https://biorender.com/covid-vaccine-tracker)に掲載されている文献をもとに,首尾一貫して整理した。本レビューの内容としては、COVID-19の中での共感染の証拠と意義、共感染の検出と可能な分子メカニズムについて論じたオリジナルの研究論文を検討した。また、本文献調査では 2019年12月下旬に中国・武漢市でCOVID-19が発生した当初から 2021年4月7日までに発表されたケーススタディ、ケースシリーズ、観察研究を対象とした。文献調査は、タイトル、アブストラクト、フルアーティクルの適格性を審査して行った。SARS-CoV-2感染症における同時感染の分子メカニズムの提案を図1に表した。
図1
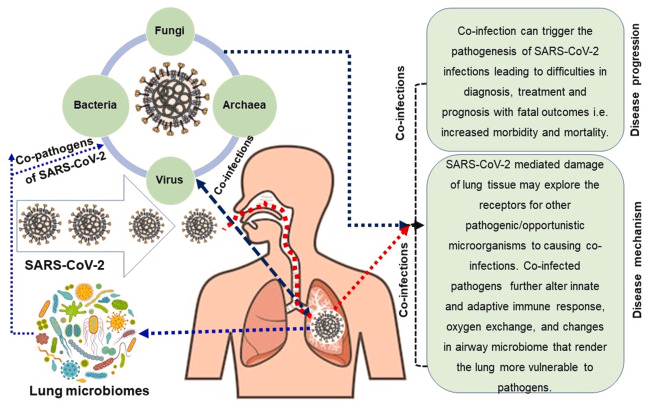
SARS-CoV-2と呼吸器系マイクロバイオームとの相互関係が、COVID-19患者の共感染を引き起こしている。COVID-19患者は、ウイルス(SARS-CoV-2以外)細菌、古細菌、真菌など、さまざまな微生物ドメインに共感染している可能性がある。これらの多様な微生物群集は、SARS-CoV-2感染症の病態生理と疾患進行を同時に複雑にしている。
3. COVID-19の入院患者における微生物の共同感染
共存感染とは,2種類以上の病原体が同時に細胞や宿主に感染することであり,重感染とは,1つの病原体が宿主に感染する前に,2つ目の病原体に感染することである[31]。いずれの場合も、感染した宿主の運命は、宿主の防御免疫と免疫病理のバランスに左右されることが多い[32]。ヒトにおける共感染の普遍的な広さや発生率は不明だが、ありふれたものであり、時には単独感染よりも多いと考えられている[33]。例えば、Van der Hoek et al 2004)は、呼吸器系の共感染では、ヒトコロナウイルス(hCoV)の負荷が単一感染の場合よりもはるかに低いことを報告しているように、共感染した病原体は一次病原体の集団を変化させることがある[34]。共存感染は、ウイルス、細菌、古細菌、真菌などの複数の感染因子によって起こる可能性があり(図1)最初の発病と同時に起こるようである[35]。共存感染症の罹患率は、以前から特定のコホート(年齢や性別など)で研究されており、しばしば単独感染症よりも悪化すると報告されている[36]。最近では、いくつかの観察研究やコホート研究により、COVID-19患者の51~2%に肺合併症が発生し、そのうち82.6%が死亡し、死亡の独立した危険因子は男性の性別、65歳以上であることが報告された[37]。しかし、COVID-19患者の年齢と性別のコホート間の死亡における共感染の発生については、まだ調査されていない。COVID-19における共感染は、年齢層によって説明されていない可能性があり、COVID-19の重症度における説明できない不均一性は、疾患の重症度、患者の併存疾患、治療の違い(副腎皮質ホルモンの投与など)入院前および入院中の抗生物質の使用、またはその他の未確認の共変量の研究間の違いに起因する可能性がある。しかし、COVID-19の経過の後半に発症する二次的な細菌や真菌の感染症は過小評価されている可能性が高い。
3.1. COVID-19の入院患者におけるウイルス共感染
呼吸器系疾患のウイルス感染症では、他のウイルスとの共感染が非常に多い。呼吸器系ウイルスの共感染の有病率は、3.0%から68.0%まで様々である[20,38]。いくつかの臨床研究では、SARS-CoV-2のウイルス共感染が、異なる国の他のウイルスと発生したことが示されている[23,26]。Lin et al 2020)は、深圳第三人民病院において、3.2%のSARS-CoV-2患者がウイルス共感染を起こしていたと報告している[20]。SARS-CoV-2感染症と他のウイルス、細菌、真菌との関連も報告されている[13]。バクテリオファージは、細菌を宿主とする自然界に存在するウイルスで、比較的無害な細菌が病原体となる上で、極めて重要な役割を果たしている[19,39]。バクテリオファージは見過ごされているヒトの病原体であり、多くのヒトの病気を誘発したり悪化させたりする原因となっている[19]。COVID-19を引き起こすSARS-CoV-2株は、ヒトの古典的なコロナウイルスであるSARSコロナウイルス分離株Tor2(SARS-CoV Tor2)と隣接した関係を示しており、最近の研究結果と一致している[40]。最近のメタゲノム研究では、Hoque et al 2020)が、COVID-19サンプルが16のウイルス属(ベータコロナウイルス属以外)と単独で関連しており、そのうち、Tombusvirus、Victorivirus、Partitivirus、Chrysovirus、TotivirusがSARS-CoV-2の共感染に最も多く関連する属であると報告している[11]。
3.1.1. SARS-CoV-2 とインフルエンザ:その混同
インフルエンザは急性かつ感染力の高い呼吸器系疾患であり、世界中で重大な罹患率と死亡率の原因となっている。毎年,世界人口の約9%がインフルエンザに罹患し,最大で10億人が感染し,300万人から500万人が重症化し,30万人から65万人が死亡すると言われている[41].今回のSARS-CoV-2によるCOVID-19パンデミックでは,発熱,頭痛,咽頭痛など,インフルエンザと同様の症状が見られる。COVID-19パンデミックの初期段階では、SARS-CoV-2とインフルエンザの共感染はあまり注目されなかったが、インフルエンザとSARS-CoV-2の共感染に関する最初の報告[42]によると 2020年1月にインフルエンザ陽性患者の0.4%だけがSARS-CoV-2に感染していた。COVID-19患者のインフルエンザウイルスによる共感染の発生率は、中国以外の異なる国からも頻繁に報告されている[27]。日本の78歳の女性の症例報告では、SARS-CoV-2にインフルエンザAが重複感染していることが示されており[43]、患者の渡航歴や病状を考慮した上で、病因物質を特異的かつ正確に検出する必要性が高まっている。別の研究では、入院中のCOVID-19陽性患者の4.35%にインフルエンザの併発が認められた[44]。血液学的スクリーニングにおける異常は報告されなかったが、酸素吸入、オセルタミビル、抗菌剤による治療後、侵襲的な人工呼吸器、集中治療室(ICU)でのケア、体外式膜酸素供給治療を行うことなく、すべての共同感染者が臨床的に治癒した[44]。中国・江蘇省で行われた別のレトロスペクティブ研究では、実験室でCOVID-19が確認された患者の94.2%が共感染しており、特に31%がインフルエンザウイルスに共感染していたことが明らかになった[45]。バルセロナの病院で行われたCOVID-19患者に関する最近のレトロスペクティブコホート研究では、市中感染したA型インフルエンザウイルスに感染していた患者はわずか0.4%であったのに対し、市中感染した細菌感染症に感染していた患者は3.1%で、そのうち4.7%は院内感染による重症化であったことが示された[46]。しかし、冬のシーズンにインフルエンザとCOVID-19が同時に発生したことで、複数の症例で共感染の存在が確認され、必然的にSARS-CoV-2とインフルエンザウイルスの両方の同時検査診断設備が重視されることになった。COVID-19と典型的なインフルエンザの症状が両極端であることから、COVID陽性の患者、特に最近インフルエンザパンデミック地域を旅行した人は、インフルエンザとの同時診断が必要となっている。
3.1.2. COVID-19 患者における B 型肝炎の併発
COVID-19に関連する肝合併症は、既存の肝合併症(例:肝硬変、肝不全、肝細胞がん)を持つB型肝炎ウイルス(HBV)共感染者の間で特に問題となっている[47,48]。COVID-19患者のうち、呼吸器症候群を発症する前に肝炎の症状が出ていた人の間では、いくつかの研究で共同感染が記録されている[49,50]。SARS-CoV-2の病因についてはまだ理解が進んでいないが、初期の研究では、このウイルスは主に肝細胞上のアンジオテンシン変換酵素2(ACE2)受容体に結合するか、サイトカインストームの活性化を通じて免疫介在性の肝障害を引き起こすことが示唆されている[51]。COVID-19が肝障害を引き起こし、アラニンアミノトランスフェラーゼ(ALT)アスパラギン酸アミノトランスフェラーゼ(AST)総ビリルビンを上昇させる可能性があることは、特にICUを必要とする重症のCOVID-19症例では明らかになっている[[52]、[53]、[54]]。COVID-19患者における肝機能の異常は、重症度や死亡リスクの上昇とも関連している。興味深いことに、中国の武漢市では、非呼吸器系の感染症によるウイルス共感染が報告されており、急性COVID-19患者の12.2%にB型肝炎ウイルス感染が併発していたと述べている[23]。重症のCOVID-19患者における肝硬変の割合と肝機能の異常上昇は、ALT、AST、γ-グルタミルトランスフェラーゼ(GGT)値の上昇、プロトロンビン時間(PT)の中等度の上昇、総ビリルビン(TB)値の上昇など、COVID-19患者におけるB型肝炎との同時感染の所見と一致していた[55,56]。重度のCOVID-19患者における肝機能障害の可能性は、肝組織へのウイルスのトロピズム、薬物毒性、全身性炎症によるものであることが示唆されている[54]。したがって、重症COVID-19患者のB型肝炎感染を幅広くスクリーニングすることは、疾患の進行分析や、肝機能異常の顕著な診断指標を持つ患者の効果的な治療計画の適用に、より有用であると考えられる。
3.1.3. SARS-CoV-2とデング熱:死のコンビ
アルボウイルス性デング熱がパンデミックしているスイスやフランスなどの温帯諸国でのSARS-CoV-2の感染拡大は、現代の旅行履歴を用いて説明されている[57]。フランスでは、SARS-CoV-2のRT-PCRによる最初の診断検査では、患者のインフルエンザ様症候群で陰性となり、1週間後には発熱、疲労、食欲不振、下痢などのCOVID-19症状の重篤な臨床症状が出現して陽性となった[57]。びまん性 maculopapular exanthemaの出現により、臨床医はLeptospira spp.やリフトバレー熱ウイルス、デングウイルス、チクングニアウイルス感染症のスクリーニングを行ったところ、1型デングウイルスのRT-PCRが陽性であることが示された。シンガポールの2人の患者に関する別の報告では、デング熱の迅速血清検査が偽陽性となり、後にSARS-CoV-2が陽性となった患者の呼吸器系合併症を加速させる可能性があることが明らかにされている[58]。当初、発熱が悪化し、血小板減少が増加し、デングの血清反応が陽性であったため、臨床医は誤った判断をした。最近になってデング特異的免疫グロブリンが検出されなかったが、鼻咽頭スワブのRT-PCR検査でSARS-CoV-2が陽性であった。南米のいくつかの国では、COVID-19の症例が徐々に増加するとともに、かなりの数のデング熱の症例が報告されている。ブラジルの研究では、COVID-19の緊急対応のために疫学的血清サーベイランス対応チームが大規模に動員されたため、デング熱症例が過少報告された可能性があり、COVID-19発生時のデング熱の報告や治療に間接的に影響を与えた可能性があるとされている[59]。この研究では、ブラジルにおけるデング熱・COVID-19管理のためのサーベイランス・治療・予防計画を統合した強固な国家戦略を求めている。コロンビアの別の研究では、COVID-19パンデミックの最初の20週間におけるデング熱とSARS-CoV-2の2つの疫学的特徴を分析している[60]。SARS-CoV-2感染時にデングの侵入と複製を阻止するというウイルスの干渉が、COVID-19に感染していない、あるいは軽度の感染者における臨床的デングの発症減少に寄与している可能性もある[61]。エクアドルからの最新の報告によると、大規模な沿岸地域におけるデング熱の生態疫学的動態と高い風土病・疫病の伝播は、診断・治療・予防措置のために公衆衛生施設に患者が大量に集まることで、緩和キャンペーンやCOVID-19封じ込め対策に大きな影響を与えることが明らかになっている[62]。これらの報告は、温帯のパンデミック地域の居住者や旅行者におけるデングウイルス感染症の血清サーベイランスの緊急性を示している。また、COVID-19の中では、物理的な距離の取り方や公共の移動性の低下がデング熱感染の抑制に寄与している可能性があると述べられている[63]。
3.1.4. 慢性ウイルス性疾患を有するCOVID-19患者 HIV と HCV
COVID-19,ヒト免疫不全ウイルス(HIV)、C型肝炎ウイルス(HCV)の三重苦は、21世紀の主要かつ持続的なグローバルヘルスの課題の一つである。HIV、HCV、そしてコロナウイルスのような新たに出現した感染症のパンデミックは、HIVとHCBまたはHCVの高負荷国で重なることが予想される[64]。COVID-19がHIV/HCV共感染者にどのように発現するかは、まだ不明である[64]。HIVとHCVに感染している集団は、COVID-19に感染している場合、重篤な反応のリスクが高まる可能性がある。将来的には、COVID-19に関連した肺病変がHIVやHCVのリスクを高め、HIV-HCV-COVID-19の共感染というまさに悪循環を誘発する可能性がある[64,65]。COVID-19が世界中に広がり続ける一方で、多くの地域がSARS-CoV-2への感染リスクに直面しており、HIV/HCV高保有国におけるHIV/HCV治療の連続性を維持するための障害や課題は増加している[64]。実際、免疫力が低下しているHIV感染者では、COVID-19の病原性が促進される可能性がある[65]。最近では、コロナウイルスに関連した下気道感染症(LRTI)と、免疫力が低下した人の死亡リスクの増加との間に、実質的な関連性があることが示されている[64]。スペインでは,男性3名とトランスジェンダー2名の計5名がHIVとSARS-CoV-2に同時感染したことが報告されている[32]。興味深いことに,HIV/SARS-CoV-2感染者は,SARS-CoV-2に感染したHIV陰性患者と臨床的,検査的,放射線的に類似した特徴を持っていた。SARS-CoV-2が大パンデミックしている現在、HIV感染者が多い国、特にHIV感染者が70%を占めるサハラ以南のアフリカでは、このような情報不足が懸念されている[32]。この患者は4年前にHIV-1とHCVの共感染歴があったため,抗SARS-CoV-2免疫反応の追跡調査では,抗体反応は遅れていたが,SARS-CoV-2 RNAのRT-PCR検査は繰り返し陰性であった[66].しかし、患者の免疫状態の低下により、SARS-CoV-2に対する体液性反応の発現が遅れていたが、抗HIV治療薬や抗HIV薬による活性化IFN-γの上昇がSARS-CoV-2の感染を抑制し、RT-PCR検査でRNAが検出されない状態が続いている可能性がある[66]。したがって、ウイルス感染歴があり、免疫不全状態や抗ウイルス治療薬を使用していると、抗体反応が遅れ、COVID-19の診断が不明確になる可能性がある。
3.1.5. SARS-CoV-2とhCoV-HKU1の共存
常在するヒトコロナウイルス(hCoV)は、インフルエンザA/B、呼吸器シンチアルウイルス(RSV)メタニューモウイルス、エンテロウイルス、アデノウイルスなどの他の呼吸器系ウイルスとの間で、共感染や連続感染を起こしたり、検出されたりすることが知られている[67]。インドネシアで報告されたCOVID-19患者のヒトコロナウイルスHKU1による重篤な共感染例では、hCoV-HKU1とSARS-CoV-2が連続して感染していたことが示されており、フィルマレイの呼吸器パネル(RP)検査で確認された[67]。このように、臨床医はCOVID-19患者のhCoV共感染に注意する必要がある。急速に発展するこのアウトブレイクでは、診断を下すためには高度な疑念が必要であり、それによってCOVID-19の拡大を抑制し、コントロールすることができるのである。
3.2. COVID-19の入院患者における細菌、古細菌、真菌の感染症
1918年に発生したインフルエンザ[4]や2009年に発生したH1N1パンデミック[68]など、よく研究されている他の呼吸器ウイルス感染症と同様に、今回のSARS-CoV-2のパンデミック発生も、二次的な微生物感染症と関連していることが報告されている[11,12,69]。SARS-CoV、MERS-CoV、集中治療を受けているインフルエンザ患者などの呼吸器疾患では、以前から細菌の共感染が報告されていた[10,70]。いくつかのレトロスペクティブ・スタディでは、1918年のスペイン風邪のパンデミックの際、細菌性肺炎が罹患率と死亡率の主な原因であったことが示されている[71]。以前の研究では 2009年から 2012年にかけてのインフルエンザA(H1N1)のパンデミック時の細菌性共同感染症の有病率は23.0%であった[68]。最近の研究では、実験室でインフルエンザ感染が確認された症例のうち、約65%が細菌の共同感染を合併していることが知られている[72]。
細菌性共同感染症は、ある感染体によって引き起こされた一次感染の最中または後に、患者に発症する。細菌感染症はCOVID-19においても重要な役割を果たしており、病気の重症度や致死率の増加と関連している[35]。それにもかかわらず、これまでSARS-CoV-2肺炎に伴う急性呼吸不全でICUに入院した患者における細菌性共同感染症の発生率はあまり研究されていない[73,74]。SARS-CoV-2は、主に鼻咽頭から人体に侵入し、その後徐々に肺に移動して感染を開始する。COVID-19の病態生理は、ウイルスを排除するための免疫反応の異常に起因すると考えられている[75,76]。ウイルスと細菌の共感染と呼吸器疾患の重症度との間に明確な関連性があることを考えると、SARS-CoV-2と気道における宿主のマイクロバイオームとの相互作用が、日和見感染を促進するウイルス感染とどのように相関しているかをよりよく理解することが急務である[77]。しかし、SARS-CoV-2と、COVID-19疾患の最終的な重症度に重要であると考えられている鼻腔常在菌との相互作用の結果については、ほとんど知られていない。COVID-19の重症入院患者における細菌感染の有病率は、メタアナリシスの結果では約14%であった[78]。最近の北米での研究では、ICUに入院したCOVID-19患者17人の細菌併存率は41%であったと報告されている[79]。呼吸器系ウイルスに感染していた患者における、細菌性肺炎に関連した共同感染の発生率は11%から35%の間であった[72]。最近、(Fu et al 2020)は、ICUに収容されたCOVID-19患者のうち、13.9%が細菌の併発に苦しんでいたと報告した。COVID-19患者の細菌性共同感染の割合は様々であるにもかかわらず、非生存者の間では有病率が50%にもなる可能性がある[80]。SARS-COV-2に関する一連のレトロスペクティブなケーススタディでは、重症患者と非重症患者にそれぞれ7.7%と3.2%の細菌と真菌の共感染が確認された[54]。イタリアでは,SARS-CoV-2感染により死亡した重症患者16,654人を対象に実施された研究で,これらの症例の11%が細菌と真菌の共感染を伴っていたことが示されている[81].
COVID-19の病態生理中に肺炎球菌、黄色ブドウ球菌、またはその他のコロニー化細菌に共感染すると、生得的および適応的な抗菌性の宿主防御が損なわれ、物理的および免疫学的バリアーが一時的に損なわれて、二次的な細菌性肺炎を引き起こし、既存の合併症を持つ人々や以前は健康だった人々に重篤で致命的な疾患をもたらす[82]。COVID-19肺炎における細菌の共同感染に関するデータはまだ出ていないが、サンプル中の細菌病原体の検出とCOVID-19患者の疾患の重症度との間に関連性が認められている。最も一般的に確認されている細菌性病原体は、Acinetobacter baumannii、Klebsiella pneumoniae、Mycoplasma pneumoniae、Legionella pneumophila、Streptococcus pneumoniae、Clamydia pneumoniaeであり[11,70,83,84]、最も一般的に確認されている真菌性病原体は、Aspergillus flavus、Candida glabrata、Candida albicansである[78]。さらに、入院中のCOVD-19患者では、黄色ブドウ球菌、インフルエンザ菌、肺炎球菌、肺炎連鎖球菌、髄膜炎菌 [83,84] などの細菌性病原体や、プロテウス属、エンテロバクター属、シトロバクター属なども報告されている。最近のマイクロバイオーム研究では、Hoqueらが、バングラデシュと中国のCOVID-19患者において、それぞれ527および306の細菌属を報告している[11]。さらに、緑膿菌と大腸菌は、病院で感染したスーパーインフェクションに関連する多剤耐性(MDR)病原体として最も頻繁に分離されるものである[46]。驚くべきことに、COVID-19患者の糞便サンプルからもSARS-CoV-2のRNAが検出された。このことは、SARS-CoV-2の消化管感染や、糞便-経口感染経路の可能性に疑問を投げかけるものである[85,86]。さらに、消化器系におけるACE2 mRNAの高い発現レベルは、SARS-CoV-2と、マイクロバイオームの多様性が高く、免疫抑制や細菌の共同感染の可能性がある消化器系との強い相互作用を明らかにした[85,86]。SARS-CoV-2が消化管におけるマイクロバイオームの多様性の調節にどのような役割を果たしているかは、さらなる研究が必要な重要な問題である。SARS-CoV-2の腸管細胞への感染は、腸内細菌叢の変化を引き起こす可能性がある。Guらは、COVID-19患者の腸内細菌群が、健常者のそれと比べて著しく減少していることを報告している[87]。この細菌叢の変化(有益な常在菌の減少)は、COVID-19患者ではStreptococcus、Rothia、Veillonella、Actinomycesなどの日和見病原菌の存在量が有意に多いことに反映されており、一方でBlautia、Romboutsia、Collinsella、Bifidobacteriumなどの有益な共生菌の存在量は相対的に非常に低いままであった[87]。
口腔咽頭カンジダ症(OPC)のCOVID-19入院患者を対象とした研究では、C. albicansが70.7%と最も多くの病原体を占め、C. glabrata(10.7%)C. dubliniensis(9.2%)C. tropicalis(3%)C. krusei(1.5%)などの他の真菌がこれに続いた[88]。一方、Chenらは、中国のCOVID-19患者99人における真菌性共同感染症の有病率が5%であり、その内訳はAspergillus flavus1例、Candida glabrata1例、C. albicans3例であったと報告している[23]。Yangらは、重篤なCOVID-19患者の5.8%(3/52)がA.flavus、A.fumigatus、C.albicansの真菌共同感染を有していたことを明らかにした[89]。さらに、COVID-19患者における非特異的な共感染症の発生率は8~15%であることが中国の異なる研究で報告されているが、それが細菌感染症なのか真菌感染症なのかは明らかではない[52,90]。SARS-CoV-2感染者のかなりの割合が、典型的な院内病原体によるMDRに関連した感染症を併発していた[91]。SARS-CoV-2感染症の合併症として、肺アスペルギルス症やカンジダ症などの真菌由来の感染症が報告されている[46]。現在までに、COVID-19関連肺アスペルギルス症(CAPA)が30%以上の症例で報告されている[78]。
現在までに報告されている呼吸器感染症のほとんどは、ウイルス、細菌、および真菌の病原体に限定されているが [5,78,90,92]、古細菌を含むその他の付随する微生物成分も多数発見されている [11,93]。細菌とは異なり、これらの共同病原体の発生率、多様性、構成は、COVID-19の感染体に比べて常にはるかに低い。メタゲノム調査では、COVID-19患者のサンプルに含まれる古細菌属として、Methanosarcina、Methanocaldococcus、Thermococcus、Methanothermobacter、Haloarcula、Staphylothermus、Natronomonas、Ferroglobus、Caldivirga、Halobacterium、Natrialba、Methanosphaerula、Picrophilusの存在が確認されている[11,93]。
4. COVID-19における共感染の分子メカニズム
共存感染は、ほとんどの呼吸器系ウイルス疾患の病因、罹患率、死亡率を増大させる可能性がある[35]。表1は、COVID-19における一般的に報告されている微生物の共感染、その感染パターン、共感染の可能性のあるメカニズム、および転帰を示している。COVID-19患者の共感染は、この病気の臨床結果を複雑にする可能性もある。SARS-CoV-2は、上気道と下気道を裏打ちする細胞のACE2タンパク質に結合してヒトの細胞に侵入する。最近、Leeらは、ACE2受容体タンパク質が気道上皮細胞の運動性繊毛内に強固に局在することを報告しており、これは宿主の呼吸器感染時にSARS-CoV-2ウイルスが侵入する初期または初期の細胞内部位を表していると思われる[94]。しかし、上気道における繊毛のACE2発現は、患者の人口統計(年齢、性別、喫煙)臨床的特徴、併存症/共感染症、または投薬の有無によって影響を受ける[94]。驚くべきことに、COVID-19患者におけるこれらの追加感染症の具体的な分子動態はまだ明らかになっていないが、いくつかの研究では、各国のCOVID-19患者における併発/超感染症のモデルを提案している[26]。入手可能な文献に基づいて、我々はCOVID-19患者における共同感染のもっともらしいメカニズムを提案する(図1,表1)。
表1 COVID-19における一般的に報告されている微生物の共同感染者、その感染パターン、および考えられる共同感染のメカニズムと転帰を示している。
| 重複感染の種類 | 共病原体 | 感染経路 | 人から人への感染 | 重複感染と病因の考えられるメカニズム | 考えられる結果 |
|---|---|---|---|---|---|
| ウイルス | インフルエンザ | 呼吸器 | はい | インフルエンザウイルスによって引き起こされるACE2のIFN誘発性過剰発現は、SARS-CoV-2感染を助長する[ 112 ]。 | インフルエンザの同時感染は、COVID-19の過炎症状態を引き起こす可能性がある。急性心臓損傷の発生率が高いことが報告された[ 113 ]。 |
| HBV | 体液 | はい | COVID-19による肝臓組織の損傷と炎症反応の増加は、宿主細胞受容体を過剰発現させることにより、HBVの同時感染を助ける可能性がある[ 114 ]。また、既存の慢性HBVの再活性化を促進する可能性もある[ 115 ]。 | ALT、AST、TBIL、ALP、およびγ-GTの上昇。[ 116 ]肝障害のリスクが高い。[ 117 ] | |
| デング熱 | 蚊が刺す | 番号 | NR | 症状の重症度を高める[ 118 ]。白血球、好中球、リンパ球、血小板の数が減少し、最終的には死亡率が高くなる[ 119 ]。 | |
| HIV | 体液 | はい | (HIV患者で観察されるように)Tリンパ球媒介免疫の抑制は、COVID-19同時感染中の疾患重症度の増加と死亡率の上昇の予後につながる[ 120 ]。 | ART下のHIV患者は、軽度のCOVID-19症状を示する。しかし、ART未経験の患者は急性COVID-19臨床症状を示する[ 121 ]。重複感染により、最高体温が高くなり、発熱時間が長くなり、胸部CT画像の改善時間が長くなることが報告されている[ 122 ]。 | |
| HCV | 体液 | はい | SARS-CoV-2EおよびHCVp7タンパク質はどちらも、同様のイオンチャネルを形成し、宿主への攻撃の成功と、重複感染時の効果的な複製を保証する[ 123 ]。 | 実際の結果は日付まで報告されない。一部の治験中のCOVID-19薬は、HCV関連の非代償性肝硬変患者に悪影響を与える可能性があると推測されている[ 124 ]。 | |
| ライノウイルス | 呼吸器 | はい | 主要な疾患の原因となるライノウイルス血清型HRV-A16感染は、IFNb1を誘導することにより、上皮細胞におけるACE2およびTMPRSS2の発現をアップレギュレートする。このイベントは、SARS-CoV-2感染とさらなる疾患の重症度を促進する[ 125 ]。 | 重複感染の結果として重大な病気を発現している若い患者で1例が報告されている[ 126 ]。 | |
| アデノウイルス | 呼吸器 | はい | SARS-CovV-2 Eおよびアデノウイルス6Kタンパク質の同様のイオンチャネル形成能力は、重複感染を促進する[ 123 ]。 | ARDSを含む予後不良の結果[ 127 ] | |
| バクテリア | 肺炎連鎖球菌 | 呼吸器 | はい | 人間の上気道トラックの日和見正常植物相 | 重度の呼吸困難とそれに続く胸水および壊死性肺炎[ 128 ]、より高い死亡率[ 129 ]。 |
| 黄色ブドウ球菌 | 呼吸器/消化器/接触 | はい | ヒト上気道、腸粘膜および皮膚の日和見正常植物相 | 壊死性肺炎[ 130 ]。 菌血症とより高い死亡率[ 131 ] |
|
| 緑膿菌 | 連絡先 | はい | HAIを引き起こす日和見病原体は、主に衛生状態の悪さ、人工呼吸器、尿道カテーテル法に関連している。 | NR | |
| アシネトバクター・バウマンニ | 連絡先 | はい | 機械的換気 | NR | |
| クレブシエラニューモニアエ | 呼吸器/接触 | はい | 人間の口、皮膚、腸の日和見正常植物相 | 致命的な敗血症[ 132 ] | |
| マイコプラズマニューモニアエ | 呼吸器/接触 | はい | NR | 重度の肺炎[ 133 ]。罹患率、死亡率、および疾患の重症度の増加[ 134 ] | |
| クラミジア肺炎 | 呼吸器/接触 | はい | NR | 重度の肺炎[ 133 ]。 | |
| レジオネラニューモフィラ | 消化器/呼吸器 | はい | NR | アスパラギン酸アミノトランスフェラーゼ、血中尿素窒素、クレアチニン、乳酸デヒドロゲナーゼ、C反応性タンパク質の上昇[ 135 ] | |
| インフルエンザ菌 | 呼吸器/接触 | はい | 人間の上気道トラックの日和見正常植物相 | NR | |
| 髄膜炎菌 | 呼吸器/接触 | はい | NR | けいれん[ 136 ]、C反応性タンパク質の上昇、頭痛、項部硬直、悪寒、錯乱、手足の新しい化膿性発疹[ 137 ] | |
| 結核菌 | 呼吸器 | はい | COVID-19によって生成されたサイトカインストームは、潜在性結核を再活性化するか、活動性結核の発症を促進する可能性がある。結核によって引き起こされる肺の損傷も、SARS-CoV-2によって引き起こされる病気の重症度を悪化させる可能性がある[ 138 ]。 | 重複感染は、疾患の重症度と疾患の進行率に関連している[ 139 ]。2.17倍高い死亡リスクと25%低い回復リスクが報告された。また、死亡までの時間が短く、回復までの時間が長いことがわかった[ 140 ]。 | |
| 真菌 | アスペルギルス属。 | 呼吸器 | 番号 | COVID-19の間に放出される炎症誘発性サイトカイン(特にIL-6とIL-10)は、組織壊死とARDSを引き起こし、最終的に患者をアスペルギルス症に対してより脆弱にする[ 141 ]。 | 侵襲性肺アスペルギルス症、致死率が高い(64.7%が報告されている)[ 141 ] |
| カンジダ属。 | 周産期/連絡先 | 番号 | 人間の皮膚に見られる日和見病原体。 | カンジダ血症と死亡率の増加[ 142 ]。 |
IFN:インターフェロン、ACE2:アンジオテンシン変換酵素2,SARS-CoV-2:重症急性呼吸器症候群新型コロナウイルス,COVID-19。コロナウイルス感染症2019;HBV:B型肝炎ウイルス;HIV:ヒト免疫不全ウイルス;HCV:C型肝炎ウイルス;ALT:アラニントランスアミナーゼ;AST: AST:アスパラギン酸トランスアミナーゼ、TBIL:総ビリルビン、ALP:アルカリホスファターゼ、γ-GT:γ-グルタミルトランスフェラーゼ、ART.抗レトロウイルス療法;CT:コンピュータ断層撮影;HRV-A16:ヒトライノウイルスA16;TMPRSS2:膜貫通型プロテアーゼ、セリン2;IFNb1。ARDS:Acute respiratory distress syndrome、HAI:Hospital Acquired Infections TB:Tuberculosis、IL-6:Interleukin 6,IL-10:Interleukin 10,NR:Not Reported。
呼吸器系ウイルスは、日和見菌のアウトグロースによる二次的な細菌感染と共同していることが多い。COVID-19患者における共感染の具体的な分子メカニズムはまだ明らかになっていないが、ウイルスによる気道の損傷、細胞の減少、杯細胞の過形成、粘液分泌の変化、繊毛運動の頻度・機能・クリアランスの低下、酸素交換の減少、免疫系の損傷などが考えられる[27,45,95]。共存感染すると、C反応性タンパク質(CRP)およびプロカルシトニン(PCT)のレベルが上昇する[5]。ウイルス感染は、組織的にも機能的にも呼吸気道にダメージを与える[69,96]。共存感染のメカニズムには、ウイルスによる気道損傷、細胞損失、杯細胞過形成、粘液分泌の変化、繊毛運動頻度の低下、粘膜繊毛クリアランスの低下、粘膜繊毛機能の不調和、酸素交換の低下、免疫系の損傷などがある[69,96,97]。また、ウイルス感染は、細菌の付着を促進し、タイトジャンクションや上皮バリアーの完全性を破壊して細菌のパラセル移動を促進し、自然免疫反応と適応免疫反応の両方を変化させ、肺をSARS-CoV-2感染に対してより脆弱にする[20,38]。多くのウイルスは気道上皮を破壊し、他のウイルスの共感染を助長する[98]。COVID-19患者はHIVとの共感染により、免疫システムが崩壊したため、病気の進行が長くなり、特異的な抗体の生成が遅くなった[99]。SARS-CoV-2感染症は肝障害を引き起こす可能性があり[5],そのため,HCVやHIVを含む特定のウイルス感染症にすでに罹患している患者では,薬剤性肝障害(DILI)が発生しやすいとされている[23]。したがって、SARS-CoV-2に関連した他のウイルスとの共感染の発症と転帰は、特に高齢者の場合、宿主の免疫反応に大きく左右される[23]。ウイルスの共感染は、細菌の同時感染を促進するウイルスの素因が呼吸器内で発生する様々な分子メカニズムと関連している。呼吸器の上皮細胞は、ウイルス感染時に様々なメカニズムで細菌の付着を助けるが、病気の重症度は、ウイルス、細菌株、他の共同病原体、宿主の免疫力によって異なる。呼吸器系ウイルスは、宿主細胞の膜タンパク質の発現をアップレギュレートすることで、その結合を促進する[69]。Respiratory Syncytial Virus (RSV)は、Haemophilus influenzaeやStaphylococcus pneumoniaと直接結合することが報告されており、その結果、細菌が上皮単層に接近し、宿主細胞の受容体に補足的に付着することになる。さらに、感染時に宿主細胞膜上にRSV糖タンパク質が発現・局在することで、肺炎球菌が結合する際の細菌の受容体としてさらに機能する可能性がある[100]。以前の研究では、インフルエンザウイルスがマウスを黄色ブドウ球菌による肺炎にかかりやすくすることが示されており、その場合、ウイルスと細菌の両方の負荷が共同感染中に増加した[100,101]。RSV,パラインフルエンザウイルス-3,インフルエンザウイルスなどの呼吸器系ウイルスは,初代および不死化上皮細胞に感染すると,細菌の付着を増加させることが報告されている[69].RSVやアデノウイルスの感染時には,表面糖タンパク質接着分子-1(ICAM-1)の発現が上昇し,その結果,ヒト鼻咽頭細胞(HEp-2)や肺炎球II型細胞(A549)における肺炎球菌の付着が増加する。肺炎球菌の上皮細胞への付着が強化されると、細菌が蓄積され、他の細菌の共感染を促進する可能性がある[69,102]。メタン生成古細菌は、嫌気性細菌と共存し、密接に相互作用している[39]。メタン生成古細菌は、H2 + CO2,ギ酸、またはアセテートなどの低分子化合物を利用するため、これらの基質の生産者と共生関係にある。メタン生成古細菌の存在やレベルの上昇は、多菌群集の構成を変化させ、微生物叢の病原性を変化させると考えるのが妥当である[39]。いくつかの先行研究では,ウイルスと細菌の宿主に古細菌の共感染が頻繁に検出されることが報告されているが[92,103],異なる分類群や環境におけるウイルス共感染の変動を説明する要因についての系統的な検証はまだ不足している.
最近の研究では、COVID-19に感染した患者は、リンパ球が減少し、血漿中のインターロイキン6(IL-6)IL-1β、MCP-1,IP-10,顆粒球コロニー刺激因子(G-脳脊髄液)などの炎症性サイトカインが増加していることが示唆されている。高濃度の炎症性サイトカインは、呼吸不全や多臓器不全だけでなく、ショックを引き起こす可能性があると提唱されており、炎症性メディエーターを評価するいくつかの試験が進行中である[104]。サイトカインストーム(高サイトカイン血症)は、免疫系の過剰な活性化を示すもので、これは併発した感染症によって誘発されたり、悪化したりすることがある。これは、炎症性サイトカインが肺胞(ガス交換と酸素供給を担う肺の小さな袋)を損傷することで、肺組織の壊滅的かつ回復不能な破壊につながる可能性がある。SARS-CoV-2による肺組織の損傷は、他の病原性微生物や日和見菌の受容体を探索し、二次感染を促進する可能性がある。ウイルスがこのような役割を果たす具体的な領域としては、隠蔽されていた受容体の解除や接着タンパク質のアップレギュレーションによる細菌の接着力の増強、細菌の傍細胞移行を促すタイトジャンクションの完全性の崩壊と上皮バリアーの完全性の喪失、ムチンや鉄などの栄養素の利用可能性の増加、自然免疫反応と適応免疫反応の変化、細菌に対する防御の無効化、そして最後に、肺を病原体に対してより脆弱にする気道マイクロバイオームの変化などが挙げられる[105]。さらに、SARS-CoV-2感染は、リンパ球、特にB細胞、T細胞、NK細胞にダメージを与え、病気の期間中、免疫系の機能低下を引き起こすことになる[26]。リンパ球と宿主の免疫機能の低下は、さらなる超・二次感染の主な原因となる可能性がある[106]。重症患者では共感染率が高いため、非重症群と比較して死亡率がより顕著である[106,107]。インフルエンザと肺炎球菌の共感染のメカニズムについては、インフルエンザウイルスが肺胞マクロファージの減少を引き起こし、これにより細菌の接種量が少なくなって生産性の高い感染を確立できることが示されており[108]、その結果、細菌の共感染の重症度は肥満などの既存の宿主因子によって悪化することがわかっている[109]。より重症の患者では、侵襲的なカテーテルによる治療を受ける可能性が高く、その結果、アシネトバクター・バウマンニ、大腸菌、緑膿菌、腸細胞菌などの多剤耐性病原体との共感染に対する感受性が高くなる [110]。さらに、COVID-19の病態生理の際、SARS-CoV-2ウイルスは多数の細胞内タンパク質と相互作用することができ(ウイルス-宿主間のインタラクトーム)無関係なウイルス、細菌、古細菌、真菌の間でもタンパク質間の相互作用が可能である[110]。共存感染により、異種のウイルスや病原体の間で遺伝子交換が行われ[111]、組換え病原体やキメラ病原体が生成される可能性がある。この組換え効果は、ウイルスの進化、疾患の動態、抗ウイルス療法に対する感受性、そして最終的には宿主の運命に影響を与える可能性がある[110]。 まだ研究されていないが、SARS-CoV-2やそれに伴う共存感染でも同様のメカニズムの事象が見られ、COVID-19の病態生理を悪化させている可能性がある。さらに、宿主の生態、宿主の分類や系統、宿主の防御機構、SARS-CoV-2との共感染の相互作用など、4つの要因がCOVID-19の病態生理と重症化に重要な役割を果たしていると考えられる。病因となるこれらの分子イベントの関連性や重要性は、交差感染、培養共感染、単一細胞共感染によって異なると考えられる[92]。全体として、上皮性肺障害、免疫系の調節不全、長期入院などのいくつかの危険因子により、重症のCOVID-19患者では超感染症が発症する可能性がある程度予想される[78]。しかし、SARS-CoV-2感染者における微生物共同感染症の有病率、発生率、特徴などの実際のシナリオは、まだ解明・分析されていない。このレビューでは、COVID-19の多様な臨床症状の根底にある共同感染の免疫学的メカニズムを理解することが、合理的な治療戦略を設計する上で重要なステップであることを強調している。そのため、SARS-CoV-2の複製と自然免疫反応の誘導が、ヒトや動物の上気道(URT)のマイクロバイオームの構成に及ぼす影響については、地域全体の規模での詳細な解明と分析が必要である。SARS-CoV-2感染症に罹患している重症患者のリスク要因や、二次感染、三次感染の疾患スペクトラムをより深く理解し、評価するためには、さらなる広範な調査が必要である。
5.結論と今後の展望
SARS-CoV-2感染患者では、様々な微生物との共感染が一般的に見られ、COVID-19の重症度や死亡率に大きく影響している。しかし、共感染している生物、それらのクロストークや宿主との最終的な相互作用についての理解は不十分である。COVID-19の共感染は、ウイルス、細菌、真菌、古細菌など複数のドメインの微生物と関連している。
SARS-CoV-2の病態生理における共感染の具体的な分子イベントはまだ不明であるが、共感染した病原体は、呼吸気道の損傷、細胞の減少、杯細胞の過形成、粘液分泌の変化、繊毛運動の頻度・機能・クリアランスの低下、酸素交換の減少、免疫系の損傷などに関与している可能性がある。さらに、ウイルス感染は細菌の付着を促進し、タイトジャンクションと上皮バリアの完全性を破壊して細菌のパラセル移動を促進し、自然免疫反応と適応免疫反応の両方を変化させ、肺をSARS-CoV-2感染に対してより脆弱にする。
この総説は、COVID-19患者における共感染の包括的なシナリオを提供しているが、地理的気候条件の異なる多様なCOVID-19患者グループにおける共感染病原体の疫学、臨床的および実験的特徴に焦点を当て、COVID-19患者の転帰に対する共感染微生物の影響を評価するために、さらなる研究が必要である。
