Methylene Blue Inhibits the SARS-CoV-2 Spike–ACE2 Protein-Protein Interaction–a Mechanism that can Contribute to its Antiviral Activity Against COVID-19
オンラインで公開 20211月13日
ncbi.nlm.nih.gov/pmc/articles/PMC7838506/
ダミール・ボジャジッチ、1 オスカー・アルカサル、1 ペーター・ブッフワルド、1 ,2 ,*.
要旨
タンパク質-タンパク質相互作用(PPI)の潜在的な低分子阻害剤(SMI)を同定するために有機色素の化学空間に興味を持っていたため、現在進行中の COVID-19 パンデミックの原因となっているこのコロナウイルスのウイルス付着と侵入を開始する最初の重要なステップである SARS-CoV-2 スパイクタンパク質とそのコグナートレセプター ACE2 との相互作用に対する阻害活性を評価するために、そのような化合物のスクリーニングを開始した。その一環として、メチレンブルーは、メトヘモグロビン血症の治療薬としてFDA(アメリカ食品医薬局)によって承認されている三環系フェノチアジン化合物であり、他の医療用途(光によって活性化された場合の輸血前の血液製剤中のウイルスの不活性化を含む)にも使用されているが、この相互作用を阻害することを発見した。クロロカイン、シラメシン、スラミンはこのアッセイでは阻害活性を示さなかったが、我々のタンパク質ベースのELISA型セットアップでは、低マイクロモル半最大阻害濃度(IC50 = 3 μM)で濃度依存的に阻害されることが確認された。PPIのプロミスキュラーなSMIであることを以前に示したエリスロシンBもまた、この相互作用を阻害した。メチレンブルーは、同様のIC50(3.5μM)でACE2発現細胞へのSARS-CoV-2スパイクベアリングシュードウイルスの侵入を阻害した。このPPI阻害活性は、ACE2発現細胞への付着を阻害することで、光のない環境下でもSARS-CoV-2に対する抗ウイルス活性に寄与する可能性があり、安価で広く入手可能な本薬は、経口薬や吸入薬としてCOVID-19の予防・治療薬として有用であると考えられる。
キーワード
ACE2,抗ウイルス剤、クロロキン、COVID-19,メチレンブルー、蛋白質-蛋白質相互作用、SARS-CoV-2,スパイク蛋白質
序論
重症急性呼吸器症候群-コロナウイルス2(SARS-CoV-2)は、新規なベータコロナウイルス属であり、ヒトに感染することが知られている7つのコロナウイルス(CoV)の中で最も新しいものであり 2020年3月に世界保健機関(WHO)によってパンデミック宣言され、世界的に広がり続けているCOVID-19の原因となっている(Liu et al 2020;MathesonおよびLehner 2020;MooreおよびJune 2020)。4つのCoV(HCoV 229E、OC43,NL63,およびHKU1)が、ヒトの感冒症例の約3分の1の原因となっているが、3つのCoVは、かなりの死亡率に関連した最近のパンデミックを引き起こしている。SARS-CoV-1(2002-2003,約10%の死亡率)MERS-CoV(中東呼吸器症候群コロナウイルス 2012,約35%の死亡率)そして現在はSARS-CoV-2(2019-2020)であり、致死性は低いが感染性は高いと考えられている(Guy er al)。 SARS-CoV-2は、100年に一度の感染力を誇る(Tiwari et al 2020)が、すでに数千万人規模の感染症を引き起こし、世界中で数百万人規模の死亡者を出している。現在の初期の推定によると、感染者の約3%が入院を必要とし,0.5%が死亡するとされているが、この範囲は年齢に強く依存しており、20歳未満では0.001%から80歳以上では8.3%まで増加している(Salje et al 2020)。したがって、可能性のある予防的または治療的治療法に大きな関心が寄せられている。コロナウイルスのライフサイクルにおいて、治療的介入のためのいくつかの可能性のある標的があり、これには、ウイルスの付着および侵入、コーティング解除、gRNA複製、小胞体(ER)およびゴルジ体における翻訳、アセンブリー、およびウイルスの放出が含まれる(Guy et al 2020)。ウイルスの付着および侵入は、それらが複製サイクルの最初のステップであり、比較的アクセス可能な細胞外部位で行われるので、特に有望である;したがって、それらは、いくつかのウイルスに対する介入目的のために探索されてきた(MelbyおよびWestby 2009)。CoVは、そのグリコシル化スパイク(S)タンパク質を用いて、細胞表面の受容体に結合し、膜融合およびウイルスの侵入を開始する。SARS-CoVおよびSARS-CoV-2の両方について、Sタンパク質は、その受容体結合ドメイン(RBD)を介してアンジオテンシン変換酵素2(ACE2)に結合し、次いでヒトプロテアーゼによるタンパク質分解活性化によって細胞内への侵入を媒介する(Lan et al 2020;MathesonおよびLehner 2020;Shang et al 2020;Sivaraman et al 2020)。このRBD-ACE2タンパク質-タンパク質相互作用(PPI)の遮断は、感染効率を混乱させ得る;例えば、SARS-CoV-2 RBDタンパク質は、ACE2受容体を発現する標的細胞へのSタンパク質媒介のSARS-CoV-2シュードウイルスの侵入を遮断することが示された(Tai et al 2020)。抗体は、かなり効果的なPPI阻害剤となり得、そしてそれらは、標的特異性が高く、生体内で比較的安定である。しかし、それらは細胞内標的に到達することができず、他のすべてのタンパク質療法と同様に、溶解性の低さ、免疫原性の傾向、長い排泄半減期、経口バイオアベイラビリティの欠如、製品の不均一性、および製造および貯蔵安定性の問題の可能性などの問題によって妨げられている。これらは外来タンパク質であるため、特定の患者において強い免疫応答を誘発し(Suntharalingam et al 2006;Wadman et al 2006;Leader et al 2008年)臨床使用が承認されたとしても、低分子医薬品よりも市販後の安全性の問題を抱える傾向がある(Downing et al 2017)。低分子阻害剤(SMI)は、PPIの同定がより困難であるが、特定のPPIに対して有効であり、有用な代替品を提供できることは、現在では十分に確立されている。現在、前臨床開発中のSMIによって標的とされる40以上のPPIがあり、そのようなSMIは2つの臨床使用が承認されている(Venetoclaxおよびlifitegrast)(ArkinおよびWells 2004;Milroy et al 2014;Scott et al 2016;BojadzicおよびBuchwald 2018)。
PPIの潜在的なSMIを同定するための有機色素の化学空間への関心のために(Margolles-Clark et al 2009a; Margolles-Clark et al 2009b; Ganesan et al 2011; Song et al 2014; Chen et al 2017; BojadzicおよびBuchwald 2018; Bojadzic et al 2018; Bojadzic et al 2018; Bojadzic et al 2018)。2018年)我々は、このCoVのウイルス付着および侵入を開始する最初の重要なステップである、SARS-CoV-2スパイクタンパク質とそのコグネートレセプターACE2との間の相互作用を阻害する能力のために、そのような化合物のスクリーニングを開始した。その一環として、後天性メトヘモグロビン血症などの治療薬として承認されている三環系フェノチアジン化合物であるメチレンブルー(Clifton and Leikin, 2003; Schirmer et al 2011; Bistas and Sanghavi, 2020)がこの相互作用を阻害することを見出し、濃度依存的に阻害することを確認した。このことは、安価で広く入手可能なSARS-CoV-2に対するこの色素ベースの薬剤の抗ウイルス活性に寄与することができ、特に非工業国においてCOVID-19の予防および治療に有用である可能性がある。
材料と方法
結合アッセイ
ここで使用したメチレンブルー及びその他の試験化合物は、Sigma-Aldrich社(米国ミズーリ州セントルイス)から入手し、そのまま使用した。不純物(およびカタログ番号)は以下の通りであった:メチレンブルー>95%(M4159)クロロキン>98.5%(C6628)エリスロシンB 90%(198269)シラメシン>98%(SML0976)サンセットイエローFCF 90%(465224)およびトリパンブルー60%(302643)。スラミン(>99%;猫番号1472)は、Tocriss Biosciencie(Biotechne、ミネアポリス、MNN、米国)からのものであった。結合アッセイに使用したACE2-FcおよびHisタグタンパク質を有するSARS-CoV-2 S1またはRBDは、Sino Biological (Wayne, PA, United States)から入手した;カタログ番号。10108-H05H、40591-V08H、および40592-V08H)から入手した。) 結合阻害アッセイを、以前に記載されたものと同様の96ウェル無細胞フォーマットで行った(Margolles-Clark et al 2009b; Ganesan et al 2011; Song et al 2014; Chen et al 2017)。簡潔に、マイクロタイタープレート(Nunc F Maxisorp、96ウェル;Thermo Fisher Scientific、Waltham、MA、米国)を、PBS pH 7.2で希釈した100μL/ウェルのFc共役ACE2受容体で4℃で一晩コーティングした。これに続いて、SuperBlock(PBS)(Thermo Fisher Scientific)の200μL/wellで室温で1時間ブロッキングした。次いで、プレートを洗浄液(PBS pH 7.4,0.05% Tween-20)を用いて2回洗浄し、タグ付きリガンド(SARS-CoV-2 S1またはRBD)および結合緩衝液(100mM HEPES、pH 7.2)で希釈した試験化合物を100μL/wellの総量を与えるために添加する前に乾燥タップした。1時間のインキュベーション後、3回の洗浄を行い、スーパーブロック(PBS)で希釈した(1:2,500)抗His HRPコンジュゲート(BioLegend; San Diego, CA, Unites States; catalog no. 652504)でさらに1時間のインキュベーションを行い、結合したHisタグ付きリガンドを検出するために使用した。プレートを、HRP基質TMB(3,3′,5,5′-テトラメチルベンジジン)の100μL/ウェルの添加の前に4回洗浄し、最大15分間暗所で保持した。20μLの1M H2SO4を用いて反応を停止し、450nmで吸光度を読み取った。メッキしたACE2受容体の濃度は、SARS-CoV-2 RBDでは1.0μg/ml、SARS-CoV-2 S1では2.0μg/mlであった。阻害アッセイに使用したリガンドの濃度は、RBDでは0.5μg/ml、S1では1.0μg/mlであった。これらの値は、応答を最適化するための予備的な試験(すなわち、半最大応答(EC50)に近い条件で高十分なシグナルを生成するために)に基づいて選択された。CD40-CD40LおよびTNF-R1-TNF-αに対する結合評価を、以前に記載されたように実施した(Bojadzic et al 2018)。DMSO中の10mMでの化合物のストック溶液を使用した。
SARS-CoV-2シュードウイルスアッセイ
アッセイには、製造元の指示に従って、Montana Molecular (Bozeman, MT, United States; カタログ番号 C1100R および C1100G) のアッセイを使用した。HEK293T細胞(ATCC、Manassas、VA、米国、カタログ番号CRL-1573)を、100μLの完全培地(10%ウシ胎児血清を添加したDMEM)中で、1ウェルあたり5×104細胞の密度で96ウェルプレートに播種した。ACE2 BacMam Red-Reporterウイルス(1.8×108 VG/ml)と完全培地に調製した2 mM酪酸ナトリウムを含む導入混合物を添加し(1ウェルあたり50μL)37℃、5% CO2で24時間インキュベートした。培地を除去し、PBSで一度洗浄し、選択された濃度のメチレンブルーを含む100μLの新鮮な培地に交換し、37℃および5%CO2で30分間プレインキュベートした。Pseudo SARS-CoV-2 Green-Reporterシュードウイルス(3.3 × 108 VG/ml)および完全培地に調製した2 mM酪酸ナトリウムを含む導入混合物を添加し(50 μL/ウェル)37℃および5% CO2で48時間インキュベートした。培地を除去し、PBSで1回洗浄し、150μLの新鮮な培地に交換し、細胞を37℃および5%CO2で48時間インキュベートした。細胞の蛍光は、EVOS FL顕微鏡(Life Technologies、Carlsbad、CA、米国)を使用して検出し、対応する色のために閾値を設定した後、粒子の分析ツールを使用してImageJ(米国国立衛生研究所、Bethesda、MD、米国)(Schneider et al 2012)で定量化した。
統計とデータの適合
すべての結合阻害および細胞アッセイは、プレートごとに少なくとも二重に試験し、アッセイは少なくとも2つの独立した実験として実施した。以前と同様に(Ganesan et al 2011;Song et al 2014;Chen et al 2017年)結合データをパーセント阻害に変換し、半最大値(中央値)有効濃度または阻害濃度(EC50,IC50)を確立するために、GraphPad Prism(GraphPad、La Jolla, CA, United States)で非線形回帰を使用して、標準対数阻害剤対正規化応答モデル(Buchwald 2020)で適合させた。
結果
免疫細胞の活性化と制御に不可欠なコシグナリングPPIのSMIを同定するための研究の一環として、私たちは、特に強力なタンパク質結合体を豊富に含む有機色素の化学空間が有用な出発点となり得ることを発見した。したがって、この新規で感染力の強いコロナウイルスのウイルス侵入に不可欠な最初のステップである SARS-CoV-2 S タンパク質-ACE2 PPI の阻害剤の可能性を探ることは論理的であると思われた。最初のステップとして、我々は、プレート上にコートされたFc共役レセプター、および溶液中にFLAGまたはHisタグ付きリガンドを有する、我々の以前の研究で使用されたものと同様の無細胞ELISA型96ウェルフォーマットを使用して、スクリーニングアッセイを設定することの実現可能性を探った(Margolles-Clark et al 2009b; Ganesan et al 2011; Song et al 2014; Chen et al 2017)。アッセイ条件を確立するために、まず、ACE2-FcおよびSARS-CoV-2 S1またはHisタグを有するRBDを用いて、そのようなフォーマットを用いて濃度-反応性評価を実施し、それらは、両方の結合が、S1よりもRBDの方がわずかに強い結合を有する古典的なシグモイドパターンに従うことを示した(図1)。データのフィッティングにより、有効濃度の中央値(EC50s)および結合親和定数(K d)はそれぞれ5および13 nM(127および1,008 ng/ml)の推定値が得られた – これは、製造元の仕様と、表面プラズモン共鳴(SPR)研究(Sivaraman et al 2020)に一般的に基づいて、低ナノモル範囲(4-90 nM)である公表値との良好な一致である。
図1 SARS-CoV-2 スパイク蛋白質 S1 および RBD と ACE2 の結合の濃度-反応曲線
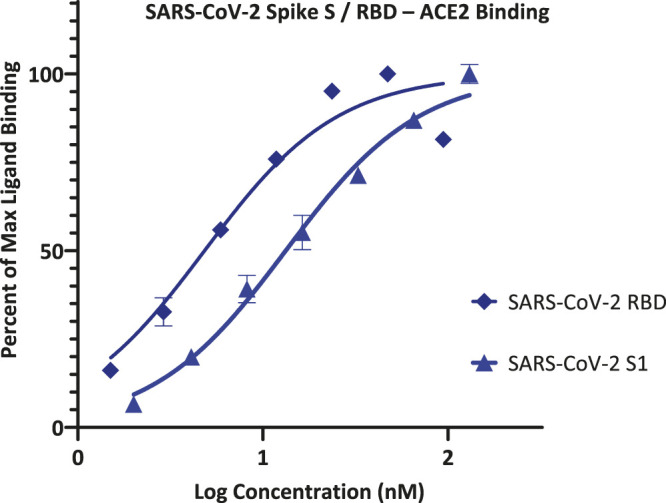
Fc標識したACE2をプレートに塗布し、His標識したS1またはRBDを添加して得られたデータは、抗His-HRPコンジュゲートを用いて検出された結合量で示されている(2つの実験の平均値±SD、重複して)。
したがって、阻害スクリーニングのためにこの形式を使用することができ、より強い結合を示したので、SARS-CoV-2 RBD-HisとhACE2を使用することにした。実際、このアッセイセットアップは、この同じPPI(CoV-S-ACE2)の抗体介在性遮断に基づく、特異的かつ感度の高いSARS-CoV-2サロゲートウイルス中和試験として機能することが最近示されたものと非常に類似している(Tan et al 2020)。このセットアップを手にして、我々は、社内ライブラリーからの代表的な有機色素に加えて、異なる作用機序によるSAR-CoV-2の阻害に関心があるかまたは考えられているいくつかの化合物、例えば、クロロキン、シラメシン、およびスラミン(Colson et al 2020; Gordon et al 2020; McKee et al 2020; Salgado-Benvindo et al 2020; Xiu et al 2020)の予備的なスクリーニングを行った。5μMでのスクリーニングは、ほとんどが活性を持たず、したがって、ウイルスの付着に必要なS-タンパク質-ACE2結合を阻害する可能性が低いことを示した。それにもかかわらず、いくつかの活性を示した; 興味のある選択された化合物のそれらは、対応する化学構造と一緒に図2に示されている。FDA(アメリカ食品医薬局)承認の食品着色料であるエリスロシンB(ErB、FDおよびC赤No.3)は、以前に他のキサンテン色素と共にPPI阻害剤としてプロミスキュラーであることを示した(Ganesan et al 2011)ので、可能性のあるポジティブコントロールとして含まれており、それは確かにここで強い阻害を示した。特に注目すべきは、多様な医療応用の歴史を持つメチレンブルー(MeBlu)(Clifton and Leikin, 2003; Schirmer et al 2011; Bistas and Sanghavi, 2020)もまた、有望な阻害活性を示した。
図2 我々のスクリーニングアッセイにおけるSARS-CoV-2 RBDのhACE2への結合に対する選択された化合物の阻害効果
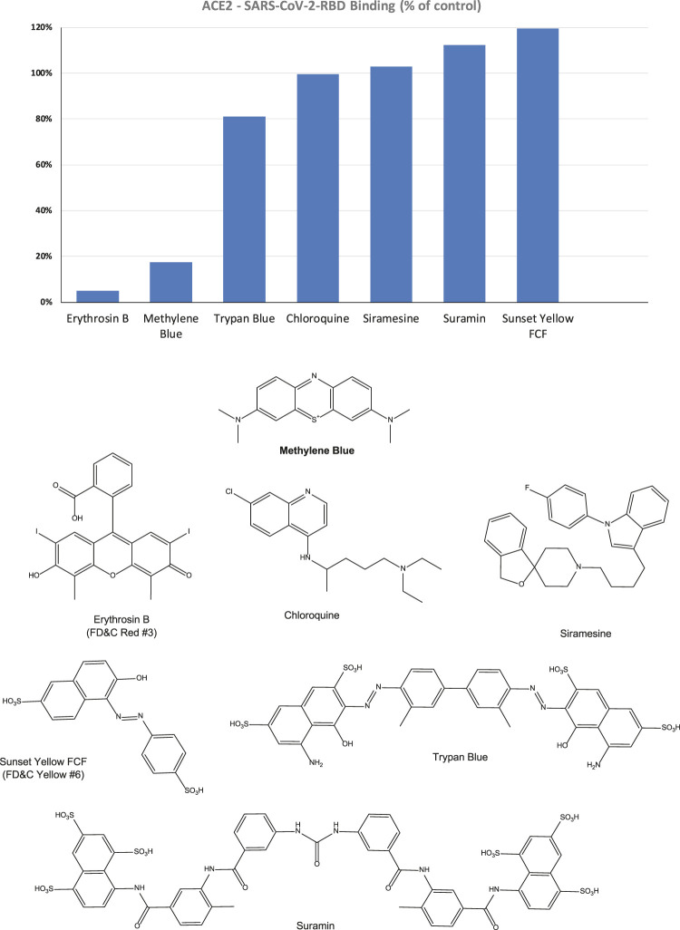
5μMの濃度で得られたパーセント阻害値は、コントロール(100%)に正規化して示した。PPI(Ganesan et al 2011)の公知のプロミスキュラーSMIであるエリスロシンB、および不活性である可能性の高い食品着色料であるサンセットイエローFCF(FDおよびCイエローNo.6)を、それぞれ陽性および陰性の対照として含めた。化学構造は比較のために示した。
そこで、その活性を確認するために、薬理学および実験生物学の実験ガイドライン(Curtis et al 2018;Michel et al 2020)に準じて推奨されているように、詳細な濃度-反応性評価を行った。図3に示すように、これは、MeBluが3.0μM(95%CI:2.5〜3.6μM)の推定IC50を有する濃度依存的な方法で実際に阻害されることを確認したのに対し、クロロキンおよびスラミンは、このアッセイにおいて阻害活性を示さなかった。主にマラリアの予防及び治療に使用される抗寄生虫剤及び免疫抑制剤であるクロロキンは、SARS-CoV-2に対する潜在的な抗ウイルス活性を有する(議論の対象となる)ため、含まれていた(Colson et al 2020)。アフリカ睡眠病(トリパノソーマ症)および河川盲目症(オンコセルカ症)の予防的治療のために承認されている抗寄生虫薬であるスラミンは、それがウイルスの結合または侵入を防ぐことにより、細胞培養におけるSARS-CoV-2感染を阻害すると主張されていたので、組み入れられた(Salgado-Benvindo et al 2020)(また、我々はそれがCD40-CD40L PPIを阻害することを以前に発見したので(Margolles-Clark et al 2009a))。ErBはまた,0.4μMのIC50で阻害され、これは、前に試験した他のPPI(1〜20μM)のために発見されたよりも、おそらくわずかに高い活性を有するこの化合物によるプロミスキュアスPPI阻害の我々の以前の観察と一致している(Ganesan et al 2011)。可能性のあるネガティブコントロールとして含まれるアゾ染料およびFDA(アメリカ食品医薬局)承認の食品着色料であるサンセットイエローFCF(FDおよびCイエローNo.6)は、実際には阻害活性を示さなかった。
図3 選択された化合物による SARS-CoV-2 RBD の ACE2 への結合の濃度依存的阻害
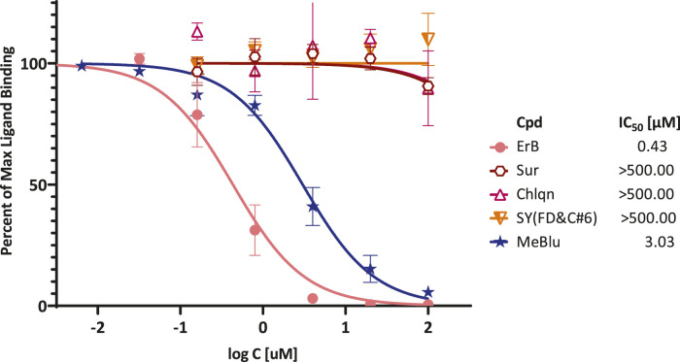
プレート上にFc共役ACE2をコーティングし(1μg/ml)Hisタグ付きRBD(0.5μg/ml)を添加し、被験化合物の濃度増加の存在下で結合した量を検出したELISA型アッセイで得られた濃度-反応曲線。前と同様に、エリスロシンB(ErB)およびサンセットイエローFCF(SY(FD&C#6)をそれぞれ陽性対照および陰性対照として含めた。データ(2回の実験の平均±SD)を正規化し、標準阻害曲線でフィットさせ、得られたIC50値を右図に示す。
次に、MeBluがSARS-CoV-2 Sスパイク蛋白質を有する偽ウイルスのACE2発現HEK293T細胞への侵入を阻害することを示すことができた。このBacMamベースのシュードウイルスアッセイは、シュードウイルスがACE2および赤色蛍光レポーターを発現する宿主細胞の核を標的とした明るい緑色の蛍光タンパク質を発現するため、ウイルスの侵入を定量化することができる一方、ヒト細胞内では複製しないため、バイオセーフティレベル1の封じ込めを用いて取り扱うことができる。シュードウイルスの侵入は、核内での緑色蛍光の発現によって示され、侵入が遮断されると、細胞核は暗いままである。MeBluは、3.5μM(95%CI:1.6-7.4μM)の推定IC50で明らかな濃度依存性の阻害を示した(図4)。48時間曝露したこのアッセイでは、MeBluは高濃度(45μM)では、ACE2の発現全体には影響を及ぼさないものの、生存率に影響を与える細胞毒性の兆候を示した(赤いバー、図4)。ここで得られたMeBluのIC50(3μM)は、通常の臨床用量(例えば、500mg p.o.後のピーク血中濃度19μM、排泄半減期は約14時間(Walter-Sack et al 2009)またはトラフ濃度6μM(Walter-Sack er al 2009)または207mg/日(69mg、t.i.d.)の経口投与後の健康なヒトボランティアにおける6-7μMのトラフレベル(Baddeley et al 2015)ウイルス付着に対するこの抑制効果は、SARS-CoV-2およびおそらくSARS-CoVおよびα-コロナウイルスHCoV NL63のような他のACE2結合性CoVに対するMeBluの抗ウイルス活性に寄与する可能性がある。
図4 メチレンブルーによるACE2発現細胞へのSARS-CoV-2シュードウイルスの侵入の濃度依存的阻害

A)MeBluがACE2(プラス赤色蛍光)を発現する宿主細胞(HEK293T)へのSARS-CoV-2 Sタンパク質(プラス緑色蛍光タンパク質レポーター)を有するBacMamベースのシュードウイルスの侵入を阻害することを示す連続希釈実験からの画像。赤色の存在量(上段)はACE2発現細胞数に比例し、緑色の存在量(下段)は感染細胞数に比例する。B)シュードウイルス(緑)とACE2発現(赤)の対応する定量化は、半対数スケールで示され、3.5μMのIC50を示す古典的なシグモイド曲線(2つの独立した実験からの平均データ)でフィットする。
考察
ここでの結果は、PPI阻害のためのSMI足場を同定するための出発点として、強力なタンパク質結合剤を含むことが知られている有機色素の化学空間に依存するという我々の戦略の有用性を再確認するものである。この戦略を用いて、我々は、CD40-CD40L(Margolles-Clark et al 2009b)およびOX40-OX40L PPI(Song et al 2014)のための最初のSMI、ならびにPPIの最初のプロミスキュアスSMI(Ganesan et al 2011)を同定したように、共シグナリング相互作用を標的とすることにおいてかなりの進歩を達成した。有機色素は、タンパク質結合のための特権的な構造を含み(Che et al 2006;FletcherおよびHamilton 2006;Hershberger et al 2007)化学空間が有望なPPI阻害剤の化学空間とよく対応していない通常のドラッグライクなライブラリとは対照的に(Neugebauer et al 2007;Reynès et al 2010;Sperandio et al 2010)それらは、PPIのSMIを同定するための良い出発点である。しかしながら、ほとんどの染料は、その強い色およびアゾ染料の場合には、その迅速な代謝分解(Levine, 1991; Feng et al 2012)のために、治療的開発には不向きである;したがって、それらの臨床的可能性を最適化するためには、さらなる薬効化学が必要である(Chen et al 2017)。
さらに重要なことに、我々の結果は、先進国のいくつかの治療用途で臨床的に使用されている有機色素であるMeBlu(CliftonおよびLeikin 2003;Schirmer et al 2011;BistasおよびSanghavi 2020)およびマラリアのような特定の発展途上国の用途のための追加の可能性を有する(Dicko et al 2018)は、宿主細胞上のACE2とそのスパイクタンパク質のPPIをブロックすることによって、SARS-CoV-2のウイルスの付着および侵入を阻害することができることを示唆している。MeBluは、メトヘモグロビン血症の治療のための臨床使用のためにFDA(アメリカ食品医薬局)によって承認された三環式フェノチアジン色素であり、高齢者患者における尿路感染症の予防;癌患者におけるイホスファミド誘発性神経毒性;冠動脈手術中に起こる一種の分布性ショックである血管弛緩症候群;および神経、神経組織、および内分泌腺の術中可視化などの他の用途にも使用されている(Schirmer et al 2018;Bistas et al 2018;Bistas et al 2018;Bistas et al 2018;Bistas et al 2018)。2011; Bistas and Sanghavi, 2020)。) MeBluはWHOの必須医薬品リストに含まれており、1891年以来マラリアの治療に使用されてきたため、実際には医療で使用された最初の完全合成医薬品であった(Schirmer er al)。 第二次世界大戦中は、クロロキンに取って代わられるまで、この薬が使用されていた。MeBluはまた、クロルプロマジンや三環系抗うつ薬の開発のリード化合物としても機能した(Schirmer et al 2011)。さらに、抗マラリア薬への応用への関心が復活しており(Dicko et al 2018年)タウタンパク質の凝集抑制作用が考えられるため、アルツハイマー病(AD)などの神経変性疾患の治療への可能性がある(Schirmer et al 2011)。注目すべきことに、MeBluは、血漿中の病原体を不活化するために開発された最初の方法の一部でもあり、1991年以来、光と組み合わせてウイルスを不活化するために使用されてきた(Lozano et al 2013)。MeBluは核酸鎖内にインターカレートしており、光の印加により、その励起により、グアニシンを酸化して核酸鎖を切断する反応性の高い一重項酸素が生成される(Lozano et al 2013)。したがって、光の存在下では、MeBluは広範囲のウイルス活性を有し、輸血前の血液製剤中のウイルスを不活化するために使用されている。
注目すべきことに、紫外線誘発活性化がない場合でも、MeBluが試験管内試験で抗ウイルス活性を有する可能性があることを示す最近の証拠もある。例えば、あるグループは、MeBluが、Vero E6細胞およびSARS-CoV-2を暗闇で20時間インキュベートしたときに、低マイクロモル濃度でウイルス活性を示すことを発見した(Cagno et al 2020)。別のグループはまた、非光活性化MeBluが,0.25の感染多重度(MOI)で0.3±0.03μMのIC50で、Vero E6におけるSARS-CoV-2複製を試験管内試験で阻害することを発見した(Gendrot et al 2020)。MeBluがSARS-CoV-2-S-ACE2 PPIを阻害する能力は、特に、MeBluが低マイクロモルのIC50でSARS-CoV-2偽ウイルスのACE2発現細胞への侵入を阻害することを示したことから、このような活性に寄与する作用機序である可能性がある(図4)。MeBluのこのPPI阻害活性が、ここで発見されたように生体内で同様のレベル(IC50≒3μM)で保持されている場合、それは、ヒトにおける薬物動態研究によって示されるように、典型的な用量(例えば、200 mg/日)に続く血中で得られる範囲内である。例えば、ある研究では、MeBluのピーク血中濃度は500mg p.o.後に19μMであり、排泄半減期も約14時間と十分以上であった(Walter-Sack et al 2009)。別の研究では、207mg/日(69mg、p.o.、t.i.d.として投与)の1日総経口投与後、6-7μMのトラフ濃度が得られた(Baddeley et al 2015)。したがって、経口投与は、適切な濃度(例えば、>7μM)を提供し得、そしていくつかの呼吸器治療のために後進国で探索されてきた(Gollwarkar 2020)吸入適用は、さらに有利であり得る。MeBluは一般的に安全であるが、用量依存性の毒性を示し、吐き気、嘔吐、溶血、およびその他の望ましくない副作用は、7mg/kgを超える用量(すなわち、500mgを超える用量)で起こり始める(Clifton and Leikin, 2003; Bistas and Sanghavi, 2020)。また、特定の集団、例えば、セロトニン再取り込み阻害薬を服用している人、および遺伝性グル経過-6-リン酸デヒドロゲナーゼ欠乏症(G6PD欠乏症)を有する人には禁忌である(Schirmer et al 2011;BistasおよびSanghavi 2020)。
しかしながら、MeBluは、我々のアッセイにおいて、低~中マイクロモルの力価でCD40-CD40LおよびTNF-R1-TNF-α PPIも阻害したことに注意しなければならない(データは示されていない);したがって、MeBluは、その有用性を制限するやや乱雑なPPI阻害剤である可能性がある。その3環フェノチアジン骨格は、エリスロシンBの3環キサンテン骨格に似ている(図2)。これは、以前に、ローズベンガルやフロキシンのような他の構造類似キサンテン色素とともに、プロミスキュアスなPPI阻害剤として作用することを示した(Ganesan er al)。 MeBluは確かにポリファーマコロジーを示し、多数の標的に作用する(Schirmer et al 2011);しかしながら、これらの多くは、COVID-19患者において更なる有益な効果を有し得る(SciglianoおよびScigliano 2020)。その主な作用機序は、酸素を不可逆的に結合するメトヘモグロビン血症の状態にあるときに酸化されたヘモグロビンの第二鉄型(Fe3+)を第二鉄型(Fe2+)に還元することである(Bistas and Sanghavi, 2020)。これは、ヘモグロビンの酸素結合能を増加させ、したがって、組織への酸素送達を増加させる-COVID-19患者にとって重要な利益である。COVID-19患者はしばしば低酸素レベルを示し、典型的には呼吸困難のない生活とは相容れない現象である-サイレント低酸素血症(または公的メディアでは幸福な低酸素血症)と呼ばれる(Tobin et al 2020)。これに関連していると思われるが、MeBluは肝硬変および重度の肝肺症候群の患者において低酸素血症および高力学的循環を改善することが明らかになった(Schenk et al 2000)。MeBluは、いくつかの成功を収めて、先進国ではない国々で肺炎および他の呼吸器疾患の治療に使用されている(Golwalkar, 2020)。
さらに、MeBluは、最近、PD-1-PD-L1共シグナリングPPIの下流にあるPD-1-SHP2 PPIを低マイクロモルの力価でブロックし、細胞障害性Tリンパ球に対するPD-1の抑制活性を打ち消し、細胞障害性、活性化、増殖、およびサイトカイン分泌活性を回復させるのに十分に効果的であることが示された(Fan et al 2020)。この共シグナリング経路(PD-1)を標的とするこの作用機序は、枯渇状態からのT細胞のホメオスタシスおよび機能の回復に寄与し得る(Barber et al 2006;VardhanaおよびWolchok 2020)これは、COVID-19患者の高死亡率の原因となるもの(Di Cosimo et al 2020;Liu et al 2020;Ye et al 2020)のような抗ウイルス反応の間に、ウイルスクリアランスを改善し、炎症性免疫応答および関連するサイトカインストームを再導入することに関心がある(Di Cosimo et al 2020;Liu et al 2020;Ye et al 2020)。
臨床応用に関しては、1つの有望な適応は、がん治療の一環としてMeBluを投与された2,500人のフランス人患者のコホートの報告から得られている(Henry er al)。 MeBluは、イランの重篤なCOVID-19患者を対象とした第1相臨床試験(NCT04370288)において、3種類の薬物の最終治療オプションのアドオンカクテル(MeBlu 1mg/kg、ビタミンC 1500mg/kg、N-アセチルシステイン 2000mg/kg)の一部として、この組み合わせがNO、メトヘモグロビン、酸化ストレスのリバランスをとることができるという仮説に基づいて検討されている。5人の患者のうち4人は治療に対して良好な反応を示した(Alamdari et al 2020)。
結論として、我々の有機色素ベースのライブラリーのスクリーニングは、MeBluを、SARS-CoV-2スパイクタンパク質とそのコグナートレセプターACE2(このコロナウイルスのウイルス侵入を開始する最初の重要なステップであるPPI)との間の相互作用の低マイクロモルインヒビターとして同定した。MeBluは強力なポリファーマコロジーを示し、PPI阻害剤としてはやや乱用されているかもしれないが、このPPIを阻害する能力は、光がなくてもSARS-CoV-2に対するMeBluの抗ウイルス活性に寄与する可能性があり、安価で広く入手可能なこの薬剤は、経口薬または吸入薬としてCOVID-19の予防および治療に有用である可能性がある。
