Contents
Metabolic features of the cell danger response
www.sciencedirect.com/science/article/pii/S1567724913002390
ハイライト
- 細胞危険応答(CDR)は、脅威に対する古代の代謝反応の観点から定義されている。
- CDRは炎症、自然免疫、酸化ストレス、ERストレス反応を網羅している。
- CDRは細胞外ヌクレオチド(プリン作動性)シグナルによって維持されている。
- CDRの異常な持続性は、多くの慢性疾患の中心にある。
- 抗プリン作動性療法(APT)は、動物モデルで多くの慢性疾患に有効であることが証明されている。
要旨
細胞危険応答(CDR)は、害から細胞と宿主を保護する進化的に保存された代謝応答である。これは、恒常性維持のための細胞の容量を超える化学的、物理的、または生物学的な脅威に遭遇することによって引き起こされる。利用可能な資源と機能的能力の間の結果として生じる代謝のミスマッチは、細胞の電子の流れ、酸素消費、酸化還元、膜の流動性、脂質のダイナミクス、バイオエネルギー、炭素と硫黄資源の割り当て、タンパク質の折り畳みと凝集、ビタミンの可用性、金属の恒常性、インドール、プテリン、1-炭素とポリアミンの代謝、およびポリマー形成の変化のカスケードを生成する。
危険信号の第一波は、ATPおよびADP、クレブスサイクル中間体、酸素、および活性酸素種(ROS)のような代謝中間体の放出で構成され、プリン作動性シグナリングによって持続される。危険が排除または中和された後、抗炎症性および再生経路の振り付けシーケンスは、CDRを反転させ、治癒するために活性化される。
CDRが異常に持続すると、全身の代謝と腸内マイクロバイオームが乱され、複数の臓器システムの集合的なパフォーマンスが損なわれ、行動が変更され、慢性疾患の結果。過去のストレス遭遇の代謝記憶は、ミトコンドリアおよび細胞の高分子量の変化の形で保存され、その結果、マイトセルホルミシスとして知られているプロセスを介して機能的な予備能の増加をもたらす。
CDRの全身性の形態、およびその拡大形態である純血性生命脅威応答(PLTR)は、最終的には脳幹の中枢によって調整される脳内の古代の経路によって直接制御下にある。全身の代謝の化学感覚的統合は脳幹で行われ、正常な脳、運動、前庭、感覚、社会性、言語の発達のための前提条件となっている。
CDRを理解することで、慢性疾患、発達障害、自己免疫疾患、退行性疾患などの幅広い疾患の病因に関する古い概念を再構築することができる。これらの障害には、自閉症スペクトラム障害(自閉症スペクトラム障害注意欠陥多動性障害、ADHD、喘息、アトピー、グルテンをはじめとする多くの食物および化学物質過敏症症候群、肺気腫、トゥレット症候群、双極性障害、統合失調症、心的外傷後ストレス障害(PTSD)などが含まれる。慢性外傷性脳症(CTE)外傷性脳損傷(外傷性脳損傷てんかん、自殺念慮、臓器移植生物学、糖尿病、腎臓・肝臓・心臓病、がん、アルツハイマー病やパーキンソン病、全身性エリテマトーデス、関節リウマチ、多発性硬化症、原発性硬化性胆管炎などの自己免疫疾患が含まれる。
1. 序論
細胞が脅威に対応できる方法は限られている。これの重要な結果は、進化的選択が脅威の多様な形態への同様の細胞応答を保持するということである。細胞危険応答(CDR)は、細胞が傷害や細胞を殺す可能性のある化学的、物理的、または微生物の脅威に遭遇したときに活性化される進化的に保存された細胞の代謝応答である。一般的な微生物の脅威は、ウイルス、細菌、真菌、および寄生虫である。物理的な脅威には、熱、塩分、pHショック、紫外線、電離放射線などがある。化学的な形態の危険性には、鉛、水銀、カドミウム、ヒ素、ニッケルなどの重金属や微量金属、可塑剤ビスフェノールAのような特定の求電子性芳香族化学物質、臭素化ジフェニルエーテル(BDEs)のような化学難燃剤、クロルピリホスやDDTのような特定のハロゲン化殺虫剤などがある。特に小児期の心理的外傷はまた、細胞危険応答を活性化させ、慢性炎症を生じさせ、多くの障害のリスクを増大させる(Ehlert, 2013)。これらの因子と感受性遺伝子型の混合物は相乗効果を持つ。トリガーの総負荷は代謝によって統合され、CDRを調節する。ミトコンドリアは、正常な代謝に利用可能な電子流量の誘導変化に応じて、これらのすべての脅威を感知するように進化している。このレビューでは、ミトコンドリアと核との間のコミュニケーションを強調し、細胞外、細胞間コミュニケーションの多くの経路が、最終的にはミトコンドリアの代謝に追跡可能であることを示す。細胞危険応答は、全身代謝と微生物代謝の化学感覚的統合を介して脳内で調整されている。CDRの異常な持続は、最終的に臓器機能や行動の変化につながり、慢性疾患につながる。
低分子の栄養素と代謝物は、CDRの主な原因となる。タンパク質、糖鎖、RNA、エピジェネティック、遺伝的変化は不可欠であるが、二次的なものであり、代謝の主要な推進因子を参照して初めて理解することができる。CDRに関連するミトコンドリア関連タンパク質(Arnoult et al 2011)糖鎖(Angata et al 2012)マイクロRNA、遺伝学、エピジェネティクス(Knight 2013)の自然免疫と炎症に興味のある読者は、これらのトピックに関する最近のレビューを参照してほしい。
2. 歴史的基盤
このレビューに記載されている細胞危険応答の概念は、過去60年間に相対的に分離して発展してきた6つの研究の川の合流点から発展してきた。簡潔に言うと、これらは以下の通りである。
1)プリンおよびピリミジン代謝における遺伝的障害が、神経薬理学および免疫学の現在の概念では説明できない、異なる行動および免疫学的表現型を生成するという認識、
2)ATP、ADP、UTPおよびUDPのような細胞外プリンおよびピリミジンは、ユビキタスイオンチャネルおよびGタンパク質共役受容体(GPCR)に結合し、神経伝達からコルチゾール産生、炎症に至るまでのすべてを制御するという認識。
3) 免疫系は自己と非自己を区別するために進化したのではなく、むしろ細胞傷害をもたらす脅威に対応するために進化してきたという認識
4)最も適応的な戦略はウイルスと宿主の共進化的な交渉であり、宿主の曝露前の状態が感染症の病理学の大部分を決定するというウイルス学の分野からの認識。
5)ミトコンドリア医学の分野では、細胞外のヌクレオチドは最終的にはミトコンドリアにたどり着くことが可能であり、ミトコンドリアの最も古い機能の一つは細胞防御であり、自然免疫の基本的な構成要素として細胞の危険性を検出し、それに対応することであるという認識がある。
6) 人間をはじめとするすべての動物は、協力する細胞の生態系であり、地球上で最も複雑な生態系であっても、物理的な生息地、資源の利用可能性、補完的な生物多様性、侵略的な種の排除、代謝最終産物のリサイクルと除去などの関連する強制変数に注意を払うことで、理解し、より回復力を高めることができるという概念。
2.1. 生化学的遺伝学
生化学遺伝学は、1902年にアーキボルド・ギャロッド卿がアルカプトン尿症のメンデル遺伝に関する報告書を発表したことに始まる成熟した医学の亜専門分野であり(Garrod 1902)1960年代以降、先天的な代謝異常を持つ子供や成人のケアに専念してきた。ウィリアム・ナイハンは生化学遺伝学の分野の父の一人であり、今日の分野の多くの指導者のメンターでもある。ナイハン博士は、レッシュ-ナイハン病(レッシュとナイハン 1964)として知られている深遠に行動を変化させたプリン体代謝における遺伝的欠陥の最初の例を発表した。ちょうど数年後、彼は、ホスホリボスピロリン酸合成酵素(PRPPS)スーパー活性症候群(Nyhan et al 1969)として知られているプリン合成の遺伝的増加に起因する自閉症のような行動を持つ子供の最初の例を発表した。両方の障害は、de novoプリン生合成の深遠な増加をもたらした。最近、プリンおよびピリミジン代謝の遺伝的欠損によって生じる複雑な行動および免疫学的症候群が検討されている(Micheli et al 2011,Nyhan 2005)。プリンおよびピリミジンの障害がこれらの症候群を産生するという事実は十分に確立されているが、これらの複雑な神経免疫発達障害の発生を説明するための統一的な機序論
は存在しない。
2.2. プリン作動性シグナル伝達
彼はATP(Burnstock et al 1972)の刺激放出によって媒介非アドレナリン作動性、非コリン作動性(NANC)シグナリングの最初の例を説明したときにピュリン作動性シグナリングは、1970年代初頭にジェフリー-バーンストックによって開拓された。懐疑論は、細胞外ATPが実際に神経伝達物質である可能性があることを初期の頃は高かった。身体のすべての神経組織および非神経組織に広く分布している19の異なるプリン反応性受容体のクローニングにより、この初期の懐疑論は健全に消滅した(Burnstock and Verkhratsky, 2009, Burnstock et al 2010, Burnstock et al 2011)。今日では、プリン反応性シグナル伝達の役割は、既知のあらゆる基本的な細胞コミュニケーション、ストレス応答、自律神経、前庭、および感覚統合経路に事実上拡大し続けている(Bours et al 2011, Burnstock 2012, Choo et al 2013, Halassa 2011, Junger 2011, Pimentel et al 2013)。
2.3. 免疫細胞の危険性
Polly MatzingerとEphraim Fuchsは1990年代初頭に耐性と免疫反応性の細胞危険モデルを開発し、なぜ効果的な適応免疫反応が細胞の危険と損傷の条件下で最もよく発現するのかを説明した(Dreifus 1998, Matzinger 1994)。この免疫学の危険理論は、腫瘍免疫学への貢献から、移植片対宿主病、アレルギー、喘息、次世代アジュバントに至るまで、過去20年間に多くの実りある洞察を生み出してきた(Fuchs and Matzinger, 1996, Matzinger and Kamala 2011, Seong and Matzinger, 2004)。
2.4. ウイルス学
1950年代のポリオのパンデミック以来、感染症の大部分は宿主を死滅させたり、永久に機能を停止させたりしないことがわかってきた。ポリオの場合、感染者の150人に1人から1800人に1人が麻痺性疾患を発症するだけである(Nathanson and Kew, 2010)。ポリオウイルス感染症の99%以上は無症状であるか、自己限局的な上気道感染症(「風邪」)やインフルエンザのような腹部症状を引き起こす。栄養不良と自然免疫状態は、ポリオウイルスへの曝露が麻痺性疾患を引き起こす確率を決定する主要な要因である。ダーウィンはさらに踏み込んだ。彼は、病気が明らかになっていないところに、ヨーロッパの探検家が船に乗って持ち込んだ病気によって、多くの先住民が荒らされていることを認識したのである。先住民は、ヨーロッパの探検家には影響を与えなかった病気に対する生来の感受性を持っていたのである。彼は1836年にオーストラリアを訪問した際に、この現象を指摘している。
私が滞在していた間に島々で猛威を振るっていた病気のほとんどが船によって持ち込まれたことは、議論の余地のない事実であり、この事実を顕著にしているのは、この破壊的な輸入品を運んできた船の乗組員の間に病気が現れなかったということである(Darwin, 1839)。
1990年代以降のウイルス遺伝子構造の包括的な研究により、事実上すべての種類の動物ウイルスが、ミトコンドリアの「危険警報システム」を阻止し、抑制し、中和し、あるいは回避するための機械をゲノムに組み込んでいることが明らかになってきた(Corcoran et al 2009, Ohta and Nishiyama, 2011, Scott, 2010)。この遺伝的洞察は、抗ウイルスシグナル伝達、および細胞防御におけるミトコンドリアの役割に明るい光を投げかけている。このレビューでは、細胞の危険応答の開始と維持におけるミトコンドリアの役割を、細胞全体、および全身の代謝における協調的な変化の文脈の中に置いて、神経発達、行動、および慢性疾患の変化につながる。
2.5. ミトコンドリア医学
長年にわたり、ミトコンドリアの酸化的リン酸化の先天的エラーの治療は、細胞のATP生産を回復させることに向けられてたが、成功は限られてた。1998年にオーストラリアのメルボルンで開催されたある記念すべき会議で、著名な酵母遺伝学者、生化学者、ミトコンドリア生物学者であるアンソニー・リネイン博士が立ち上がり、(言い換えれば)「もし我々が知的に正直であれば、ある病気の患者に合理的に設計された治療法を試しても、それが何度も失敗するならば、病気の症状の原因を説明するために、古い考えを捨て、新しいパラダイムを探さなければならない」とコメントしたのである。ミトコンドリアは、代謝の車輪のハブに位置し、それぞれの細胞タイプに合わせて調整された1500種類のタンパク質を含み、代謝における500種類以上の化学反応を触媒している。神経変性エピソードとミトコンドリア疾患の感染との関連性は 2000年代初頭に認識され、定量化された(Edmonds et al 2002)。ミトコンドリアが細胞防御および自然免疫の最前線を代表することが発見されたことにより、神経学的挫折と感染との間のこの接続が理解され始めた(Seth et al 2005,West et al 2011)。最終的には、細胞のすべてのリン酸化ヌクレオチドは、ミトコンドリアにおける反応に追跡可能である。このことは、ミトコンドリアをプリン作動性シグナル伝達のためのヌクレオチドの基本的な供給源にしている。
2.6. 生態学と医学
最も複雑な生態系のダイナミクスは、物理的な生息地、資源、補完的な生物多様性、破壊的な生物多様性(侵略的種代謝最終産物のリサイクルと除去などを含む、離散的な強制変数のセットの関数として理解することができる。代謝、そして実際には全身の機能と発達は、受胎から老年期に至るまで整然と変化する相互に関連した複雑な経路の網と考えることができる。生態学者は、生態系の状態を変化させたり、回復力を維持したり、後継者育成を促進したりする推進要因、強制変数、または状態変数を特定することに焦点を当てている。推進要因とは、少量の変化で生態系全体の相互作用や性能に大きな変化をもたらす、物理的、化学的、生物学的な離散的な存在である。例えば、太陽光、海洋温度、pH、CO2,溶存酸素濃度などの要因は、サンゴ礁の生態系の健全性に劇的な変化をもたらする(Riegl et al 2009)。
分析のスケールを細胞レベルにまで下げると、化学の詳細がより重要になり、応答の時定数は、陸上生態系では数年から数秒から数ヶ月に短縮される。物理的な生息地は、脳の相互依存構造のように、各器官の相補的な微小生息地で確立される。種は、相補的で相互依存的な代謝を発達させる組織内で分化した細胞型になる。細胞内では、専門化されたタンパク質や酵素が、小器官と呼ばれる相補的で相互依存的なコンパートメントやミクロハビタット、ネットワークの中の栄養層に組織化されている。これらの細胞内栄養層は、栄養分のリサイクルに必要なタンパク質と、二次代謝物やポリマーの合成に必要なタンパク質、つまりより大きな構造体とより小さな構成要素とを区別している。細胞内の資源は、タンパク質、脂肪、炭水化物、核酸などの化学的構成要素である。より一般的には、細胞内の資源と電子のトラフィックフローパターンが、その細胞の健康状態、アラーム、または病気の状態を決定する。
代謝における状態変数とは?代謝では、pH、CO2,酸素も重要な状態変数である。しかし、α-ケトグルタル酸(AKG)のような代謝中間体や補酵素、ビタミンも状態変数である。ビタミンCの欠乏は、壊血病として知られるコラーゲンプロリン水酸化および神経伝達物質代謝の欠陥を生じる。チアミンの欠乏は、ベリベリおよびウェルニッケ・コルサコフ症候群を引き起こすグルコース、ピルビン酸およびアミノ酸代謝の欠陥を生じさせる。治療が成功した前後の複雑な疾患状態ごとに、高度な質量分析法とメタボロミクス法を系統的に適用することで、代謝における他のドライバーや状態変数が発見される。
生態学では、生態系は様々な理由で破綻したり、不健康になったりすることがある。修復生態学の分野では、複雑なシステムの支配する力学を特定し、システムの健康と回復力を回復するために修正できる個別の要因を特定することに関心がある(Gunderson, 2000)。医学においても同じことが言える。慢性炎症と細胞危険応答の制御における重要な強制変数は、プリン作動性シグナル伝達である。
3. 細胞危険応答
ATP合成、ヌクレオチド代謝、および関連するプリン体シグナルが乱されている場合、細胞応答の調整されたセットは、細胞が微生物の攻撃や物理的な害から自分自身を守るために進化したことをトリガされる。この細胞危険応答(CDR)の要素は、それを研究するために使用される分析のレベルとツールを反映した多くの名前が付けられている。CDRには、小胞体(ER)ストレス応答(Liu et al 2008)アンフォールドタンパク応答(Lee and Glimcher 2009)ミトコンドリアアンフォールドタンパク応答(Haynes et al 2013)ヒートショックタンパク応答(Kim et al 2006)統合細胞ストレス応答(Integrated cell stress response)が含まれる。2006統合細胞ストレス応答(Silva et al 2009)酸化ストレス応答(Lushchak 2010)酸化遮蔽応答(Naviaux 2012)自然免疫(West et al 2011)および炎症(Zhou et al 2011)。これらは、ウイルス攻撃後の細胞と宿主の生存を改善するという、最も基本的で最も古くからの役割を持つCDRを考慮することで、統一された、機能的に調整された応答として理解することができる。急性CDRは少なくとも8つの機能的変化をもたらす。
- 1) 細胞内病原体による細胞資源の乗っ取りや集合を防ぐために、ネットポリマー合成からモノマー合成へと細胞の代謝をシフトさせる、
- 2) 細胞の膜を硬くし、病原体の侵入を制限するために損傷領域を囲む、
- 3) 抗ウイルス・抗菌化学物質を細胞周囲環境に放出する、
- 4) 細胞内病原体を除去するためにオートファジーとミトコンドリア分裂を増加させる。
- 5)DNAメチル化やヒストン修飾を変化させて遺伝子発現を変化させる、
- 6)内因性レトロウイルスやLINE(long interspersed nuclear element)などの移動性遺伝要素を動員して遺伝的変異を作り出す、
- 7)近隣細胞や遠方のエフェクター細胞に危険を警告する、
- 8)宿主の行動を変化させて親族への感染拡大を防ぐ、治癒を促進する睡眠パターンを変化させる(図1)。
図1. 急性細胞危険応答の機能
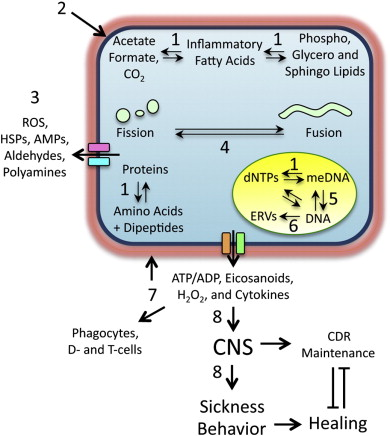
急性CDRには、細胞の構造、生理、代謝、遺伝子発現の8つの機能変化が含まれている。これらは以下の通りである。
- 1)細胞内病原体による細胞資源の乗っ取りや集合を防ぐために、細胞代謝を高分子合成からモノマー合成にシフトする、
- 2)細胞膜を硬くしてスーパーインフェクションや病原体の退出を制限する、
- 3)細胞周囲環境に抗ウイルス・抗菌化学物質を放出する、
- 4)オートファジー、ミトコンドリア分裂、マイトファジーを増加させて、細胞内病原体や生体発生中枢の除去を促進する、というものである。
- 5)DNAメチル化やヒストン修飾を変化させて遺伝子発現を変化させ、
- 6)内因性レトロウイルスやLINEを動員して遺伝子変異を生じさせ、
- 7)細胞外ヌクレオチド、H2O2,エイコサノイド、代謝物、サイトカインで近隣細胞や遠方のエフェクター細胞に危険を警告し、
- 8)宿主の行動を変化させて親族への感染拡大を防ぎ、治癒を促進するための睡眠パターンを変化させる。
略語。HSPs:ヒートショックプロテイン;AMPs:抗菌ペプチド;D細胞。樹状細胞;ERVs:内因性レトロウイルス;LINEs:long interspersed nuclear element;meDNA:methylated DNA;dNTPs:デオキシヌクレオシド三リン酸塩;中枢神経系:中枢神経系。
3.1. CDRの古代と現代のトリガー
先カンブリア紀の海では、次世代にDNAを伝えることができる細胞は、ウイルスや他の微生物の病原体に感染したり、若い生物圏の備品である化学的・物理的な力に幅広くさらされたりしても、うまく生き延びた細胞だけでした。初期の細胞は、RNAとDNA合成に加えて、代謝機能の多様な配列のためにATPと他のヌクレオチドを合成した。単一細胞の内部のATPの濃度は、通常、約1-5 mM ・細胞外環境(< 5-10 nM)よりもほぼ100万倍以上である。細胞が傷ついたり、ウイルスによって溶解したとき、ATPや他のヌクレオチドや代謝産物が周囲に放出され、危険と病原体の存在を知らせる明るい化学的な “フレア “の警告を他の細胞に作成した。
細胞が壊れたり、溶解したりする前に、感染した真核細胞のミトコンドリアは、宿主細胞内のビルディングブロックからウイルスRNA、タンパク質、およびDNAを作るためのポリマー合成のためのウイルス生合成センターへの電子(NADHおよびNADPHとして)と炭素の転用を検出することによって、侵入した微生物の存在を感知している。この「電子盗み」は、電圧降下、またはミトコンドリアでの酸化的リン酸化のために細胞内で利用可能な電子の流れの減少として感知される。代謝的な結果は、ほぼ瞬間的なものである。ミトコンドリアは急速に酸素消費量を減少させ、それは電子の流れに結合される。ミトコンドリアはすべての真核細胞の酸素吸収源であるため、細胞内の溶存酸素濃度が上昇し始める。これにより、細胞の酸化還元化学がより酸化的になる(Naviaux, 2012)。酸化性の高い環境は、単量体ビルディングブロックのポリマーへの組み立てを強く阻害し、感染したウイルスによるRNA、タンパク質、DNAの合成効率を急速に低下させる。また、酸化環境は、メチオニンの硫黄やシステイン、ホモシステイン、グルタチオンなどのチオールの酸化、多くの酵素系における鉄硫黄クラスターの分解をもたらし、中間代謝に不可欠な補酵素Aのチオールの利用可能性を低下させる。
電子の流れと硫黄酸化をモニタリングするミトコンドリアの能力は、ミトコンドリアを一般化された細胞の「危険警報」として理想的に適している。その迅速な代謝は、ミトコンドリアを細胞の「炭鉱のカナリア」にしている。細胞内で親電性または亜硫酸親水性として作用する微量または重金属は、ミトコンドリアの反応を引き金にして、ウイルス感染に似た反応を起こす。同様に、1850年代以降、染料、殺虫剤、医薬品、工業薬品などとして多くの分子が合成されてきた。その多くは多芳香族やハロゲン化されたものである。共役環系、多重二重結合、および非局在化π軌道電子雲を持つこれらの現代の化学物質は、高度に求電子性であり、CDRを活性化することもできる細胞内の電子盗聴を生成する。CDRは一般的なものであるが、高度に進化した反応であり、合成分子が受容体に結合したり、正常な代謝やホルモンのシグナリングと競合したり妨害したりしたときに発生する、より特異的な分子効果を複雑にすることがよくある。化学的脅威と生物学的脅威の混合物は相乗効果を発揮することがあり、危険な引き金の総負荷がCDRの大きさと形態に影響を及ぼすことがある。危険が検出されると、ミトコンドリアは、それ以上の傷害から細胞を保護するために細胞の代謝を変更する。これは、細胞膜を硬くし、活性酸素種(ROS)の産生を活性化し、病原体の複製を制限し、危険の広がりを制限する効果を持つ中間代謝の多くの異なる経路の変化を作り出すことによって達成される(Naviaux, 2012)。これらの経路は新生児や成長期の小児では未熟であり(Wood et al 2010)末梢組織の炎症や自然免疫に限らず、神経発達を変化させ(Landrigan et al 2012)他の慢性小児疾患のリスクを高める影響をもたらする。
3.2. 夏と冬の代謝
代謝の季節変動の大きな傾向は、私たちの祖先に作用した進化的な力を考慮することで、文脈の中に配置することができる。カロリーの利用可能性の季節的変化がルールだった。夏は、環境が豊富なカロリーを提供し、それが運動によって収穫されたときに、たっぷりとした時間でした。この時期は細胞が成長するための自然な時期であり、その間にビルディングブロックが重合して新しい細胞を生成し、バイオマスを増加させてた。運動をすることで、追加されたバイオマスが機能的に効率的であることが確認された。夏の間の細胞内のマスター燃料センサーは、mTOR(mammalian target of rapamycin)である(Yang and Ming, 2012)。mTORは、環境から取り込まれた新しい材料を利用してタンパク質合成と成長を促進し、mTORはオートファジーによる使用済みまたは損傷した細胞資源の内部リサイクルを阻害する。mTORによってサポートされる経路は、ヤヌスに直面している。分裂可能な細胞では、mTORは炎症を起こさずにネットポリマー合成で急速な成長を促進する。使用済みまたは損傷したタンパク質、脂質、糖鎖、RNA、DNAは、豊かな夏の生態系から得られる新鮮なビルディングブロックからの新しい合成によって希釈される。肥大化せずに過剰カロリーを処理できない分化細胞では、mTORの過剰は、酸化または凝集したタンパク質のような古くて損傷した高分子の蓄積をもたらし、脂質、タンパク質、グリコーゲン、核酸のような細胞内ポリマーの単量体ビルディングブロックからの容赦ない蓄積に熱力学的なブレークとして作用する慢性的な炎症酸化状態を作り出す。
冬はカロリー制限の時期であり、生存を保証するためには、夏と秋に蓄えられた資源を効率よく使わなければならない時期であった。冬のマスター燃料センサーはAMPK(AMP活性化プロテインキナーゼ)である(Salminen and Kaarniranta, 2012)。AMPKはエネルギー効率を最適化し、オートファジーで細胞内物質のリサイクルを刺激する。このサイクルは、毎晩および絶食中に、より少ない範囲で発生する。AMPKによって活性化された経路は、損傷したタンパク質、脂質、糖鎖、RNA、DNAを分解するように働くため、再生をサポートし、抗炎症性である。AMPKは、新しく合成されたモノマーとリフレッシュされたビルディングブロックから、これらの高分子の再合成を促進する。モノマー合成とポリマー合成は、冬のメンテナンスのためにバランスよく行われている。歴史的に、1980年代以前には、ほとんどのヒト栄養学の研究は、欠乏症の障害に焦点を当てていた。1980年代以降、人間の栄養学の研究の多くは、カロリー過剰の障害にリダイレクトされている。実際に糖尿病、癌、心臓病などの年齢関連疾患をガードするために発見されている遺伝子の多くは、カロリー過剰と物理的な運動不足と組み合わせると、mTORによって調整された “夏の遺伝子 “は、慢性疾患や炎症につながる一方、AMPKによって調整された “冬の遺伝子 “であることが判明している。技術の進歩と工業的規模の農業慣行は、世界中の人口の健康のための両刃の剣となっている。多くの先進国では、現在、カロリーの利用可能性、減少した運動、および冬のカロリー制限の歴史的規範の不在の「果てしない夏」を経験している。これは、大人と子供の両方で肥満の現代的な疫病につながっており、細胞の炎症にトレーサブル慢性疾患の成長の潮に。
4. CDRの代謝機能
以下、図2を参照しながら読み進めていく。パネルAとBは、通常は「健康な発生」、還元状態、高分子合成、再生(図中上向き)の方向に傾いている代謝の21の分岐点を示している。しかし、細胞がウイルスなどの微生物病原体に感染すると、代謝は自然免疫、炎症、酸化条件、モノマー合成にシフトし、病原体が資源を寄生し、ポリマーを組み立てて自己複製しようとする努力に対抗する。この細胞危険応答(CDR)の間の代謝のシフトは、図の下方向に示されている。これらの変化が、細胞分裂および成長中の娘細胞への蓄積されたバイオマスの分布の文脈で起こる場合、重大な細胞損傷を伴わない限り、炎症は回避される。問題は、これらの条件が、成長のための能力が限られている分裂後の組織において活性化されるときに生じる。図2ABの代謝分岐点のリストは、包括的であることを意図したものではなく、分岐点代謝物のすべての代謝運命が論じられているわけではない。読者は、より包括的な議論のために、関心のある分岐点代謝物のそれぞれの局所的なレビューを参照してほしい。
図2 細胞危険応答の代謝特徴
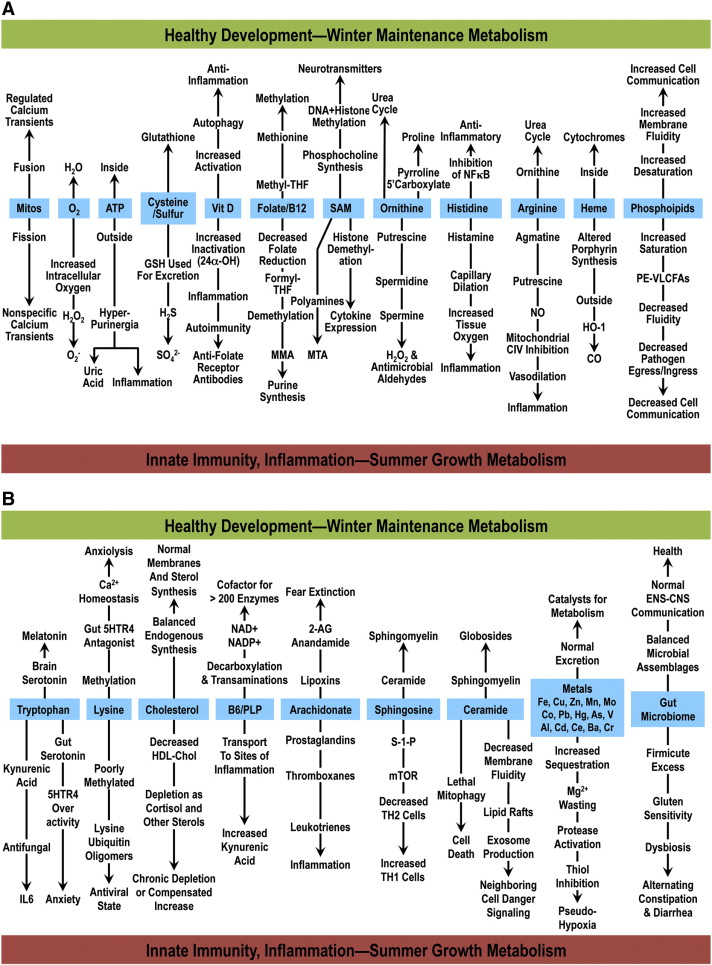
A. ミトコンドリアからリン脂質までの12の分岐点代謝物。表示されている代謝物とエフェクターのそれぞれは、2つ以上の代替経路で代謝される。図中の上方向に示された経路は、健全な発育に特徴的なものである。これらの代謝経路は、制限された資源やエネルギーの維持・保存が不可欠な冬季のようなカロリー制限下でも活動している。図の下半分に示されている代謝経路は、夏の豊富な時期に特徴的であるように、栄養や資源が制限されていない時期に活性化する。細胞分裂が起きれば、炎症を起こすことなく健全に成長するが、細胞分裂が起きない場合は、炎症を起こすことなく健全に成長する。しかし、脳のような多くの分化した組織のように細胞分裂が容易に起こらず、運動が制限されると、自然免疫疾患や慢性炎症が生じる。
B. トリプトファンから腸内マイクロバイオームへの9つの分岐点代謝物とエフェクター。図の下半分に示されている反応は、CDRに特徴的なものである。パネルAおよびBに示されているCDR代謝物およびそれらの代謝運命のリストは、完全であることを意図したものではない。他の代謝物、エフェクター、および代謝運命もまた存在し、示されたものと協調的に制御され、危険時に細胞を防御するために代謝メモリによって調整されている。CDRが病的に持続すると、慢性疾患が生じる。
4.1. ミトコンドリア
ミトコンドリアは、CDRの条件下で断片化し、細胞内カルシウム過渡現象の非効果的な制御および伝播をもたらす(Eisner et al 2010)。細胞が損傷を受け、ミトコンドリアタンパク質が細胞外空間に放出されると、フォルミルメチオニンを開始するミトコンドリアタンパク質は、フォルミルペプチド受容体を介して炎症を刺激することができる(Rabiet et al 2005)。細胞外ミトコンドリアDNAはTLR9受容体を介して自然免疫を活性化し(West et al 2011)好酸球による感染時に抗菌ネットとして特異的に放出される(Yousefi et al 2008)。
4.2. 酸素
ミトコンドリアの酸素消費量が減少すると、溶存細胞質酸素が上昇し、NOX4を含む多くの酵素系による活性酸素種(ROS)産生を活性化する(Hecker er al)。 増加した溶存酸素、スーパーオキシドおよび過酸化水素は、中枢性炎症調節因子NF-κB(Lluis et al 2007)および多機能トランスグルタミナーゼ2(Caccamo et al 2012)を含む多くのタンパク質を活性化する。活性酸素は本質的に炎症性であると考えられることもあるが、慢性炎症性疾患の最も破壊的な遺伝的形態の一つは、感染に応答して活性酸素を産生できないものであるということは興味深いことである。慢性肉芽腫性疾患(CGD)は、食細胞NADPHオキシダーゼ2(NOX2)のサブユニットの遺伝的欠損によって引き起こされ、そのために、抗菌および抗真菌防御のために相当量のスーパーオキシド、過酸化水素、および次亜塩素酸を産生することができなくなる(Kuijpers,Luttter 2012)。別の例では、活性酸素は防御的であり、関節リウマチ、多発性硬化症、甲状腺炎、1型糖尿病などの自己免疫疾患における炎症の重要な抑制因子として現在認識されている(Hultqvist et al 2009)。
4.3. ATP
ATP、ADP、UTP、およびUDPのようなプリン作動性シグナル伝達ヌクレオチドは、ストレス下の細胞から大量に放出され、炎症を活性化する(Xia et al 2012)。ATP、他のヌクレオチド、および代謝物の放出を増加させるために、細胞を破壊または溶解する必要はない。ATPおよび尿酸ナトリウム結晶は、NLRP3インフラマソームアセンブリの活性化剤である(Riteu et al 2012)。ATPを介したピュリン作動性シグナル伝達は、ACTH刺激とは独立して、副腎皮質からのコルチゾール合成および放出を直接刺激する(Kawamura et al 1991)。
4.4. システインと硫黄
硫黄代謝は、グルタチオンがグルタチオン化調節(McLain et al 2013)と肝臓第II相解毒反応(Zamek-Gliszczynski et al 2006)で消費されるようにシフトされ、システインは、H2S、タウリン、および硫酸塩排泄(Stipanuk and ueki,2011)に迂回されている。重要な補償として、CDRの増加した血漿酸化状態は、血液脳関門を越えて必要なシステインを脳に輸送するために使用されるシスチン(CySSCy)へのシステイン酸化に有利である(Bridges et al 2012,Lewerenz et al 2013)およびグルタチオン合成のためにマクロファージに(Kobayashi et al 2012)。
4.5. ビタミンD
カルシウムとリンが正常に体内に貯蔵されているにもかかわらず、ビタミンDの代謝はCDRによって大きく変化する。腎臓のミトコンドリアP450酵素である1αヒドロキシラーゼは、25-ヒドロキシビタミンDをホルモン活性な1,25-ジヒドロキシビタミンDに活性化させるために必要であり、もう一つのミトコンドリア酵素である24αヒドロキシラーゼは、エンドトキシンのような細胞の危険な脅威によって増加する(Shanmugasundaram and Selvaraj, 2012)。これは、活性ビタミンDの濃度を低下させ、炎症を増加させてCDRに寄与するが、抗甲状腺抗体(Kivition et al 2011)を含む可能性のある自己抗体の発症リスクを増加させ、抗葉酸受容体抗体のような他の自己抗体の発症に寄与する可能性がある。
4.6. 葉酸とB12の代謝
葉酸とビタミンB12の代謝は、ミトコンドリア機能、硫黄代謝、グリシン、セリン、ヌクレオチド合成、DNAとヒストンのメチル化と密接に関連している(Naviaux, 2008)。ヒトゲノムによってコードされた2700以上の酵素のうち(Romero et al 2005年B12を必要とするのは2つだけであるが、B12の吸収、輸送、および代謝に特化した15以上のタンパク質が存在する(Nielsen et al 2012)。そのうちの1つがメチルマロニルCoAムターゼである。これはミトコンドリアに位置し、B12のアデノシル形態であるアデノシルコバラミンを使用して、メチルマロニルCoAをクレブスサイクルへの輸入のためにサクシニルCoAに変換する。もう一つのB12依存性酵素であるメチオニン合成酵素(MS)は、サイトゾルにあり、ホモシステインからメチオニンを合成するために、B12のメチル形態であるメチルコバラミンを使用する。メチオニンは、タンパク質の合成を開始するために、またはS-アデノシルメチオニン(SAM)の合成のための前駆体として使用することができる。最終的に葉酸、グルタチオン、およびメチオニン代謝の代替経路を介してフラックスは、細胞の酸化還元態勢によって決定される。CDRの酸化条件の下で、SAMは、活性酸素および抗ウイルスおよび抗菌ポリアミンアルデヒドの合成および放出を助けるためにポリアミン合成に優先的に指示される(Bachrach 2007)。これは、SAM/SAH比を低下させ、同時にDNAメチル化反応に対するSAMの正味の利用可能性を低下させる。ヒストンの遺伝子および細胞型特異的な脱メチル化は、十文字ヒストン脱メチル化酵素によるCDRの酸化条件によって刺激され、TNF-αのようなプロ炎症性サイトカインの発現を増加させる(Kruidenier et al 2012)。さらに、CDRの酸化条件は、フォルミルテトラヒドロフォレートとメチルテトラヒドロフォレートの比(fTHF/mTHF)およびメチレンテトラヒドロフォレートとmTHFの比を増加させる。これは、それぞれfTHRおよびメチレンTHFからの1-炭素供与を必要とするIMPおよびdTMPのようなヌクレオチドのde novo合成を有利にする。結果として生じるIMP合成の増加は、プリン体シグナル伝達のためのATPのようなプリンヌクレオチドを作るために使用することができる。CDRの酸化条件は、RNAおよびDNAのポリマーへの集合は化学的に好ましくないので、得られたヌクレオチドが代謝およびシグナリング目的のためのモノマーとして優先的に使用されることを確実にする。
4.7. SAM
S-アデノシルメチオニン(SAM)は、DNA、ヒストンおよび神経伝達物質のメチル化反応のための普遍的なメチル供与体として使用される。SAMデカルボキシラーゼによる脱炭酸後、dcSAMは、ポリアミンおよびメチルチオアデノシン(MTA)合成のための必須アミノプロピル供与体として使用される(Fontecave et al 2004)。CDRが活性化されると、SAMの大部分は、過酸化水素および3-アミノプロパナール、および3-アセトアミノプロパナールのような強力な抗菌性アルデヒドを合成するために使用され得る、スペルミジンおよびスペルミンのようなポリアミンの合成に転用される(Cervelli et al 2012)。SAMは、病原体mRNAの成熟のためのメチル供与体として、侵入した病原体によって簒奪され得る。S-アデノシルホモシステイン(SAH)は、SAM媒介メチル化反応の強力なフィードバック阻害剤である。SAM/SAH比を減少させることにより、CDRは病原体の複製に不利な細胞内環境をさらに強化する。アデノシンおよびいくつかのプリンヌクレオシドおよびヌクレオチドは、いくつかの合成抗ウイルス薬の標的であることが知られている重要な酵素であるSAHヒドロラーゼ(SAHH)を阻害することにより、低いSAM/SAH比を維持するのに役立つ(De Clerck,2009)。
4.8. オルニチン
オルニチンは肝臓のアルギナーゼI、および他の多くの組織のアルギナーゼIIによってアルギニンから合成される非防御性アミノ酸である。CDRが活性化されると、オルニチンはB6依存性酵素オルニチン脱炭酸酵素(ODC)によってプトレシンに脱炭酸され、スペルミジンやスペルミンのようなすべての高分子量ポリアミンに使用されるポリアミンになる。ODCの持続的な活性化は、エリテマトーデスの動物モデルにおける炎症の増加および自己抗体の発達に寄与する(Hsu et al 1994)。
4.9. ヒスチジン
CDRの急性活性化は、B6依存性酵素ヒスチジン脱炭酸酵素を刺激してヒスタミンを産生する。ヒスタミンは強力な血管拡張剤であり、炎症部位への増加した酸素と免疫効果細胞の送達を促進する。ヒスタミンはまた、アレルギーや自然免疫の抗寄生虫肢における肥満細胞と好酸球の機能にとっても重要です(FulkersonとRothenberg 2013)。
4.10. アルギニン
アルギニンは代謝においていくつかの運命をたどっている。それは、テトラヒドロビオプテリン依存性一酸化窒素合成酵素の基質である。結果として生じる一酸化窒素(NO)ガスは、ミトコンドリアのチトクロムc酸化酵素の強力かつ可逆的な阻害剤であり、複合体IVとしても知られている(Forstermann and Sessa, 2012)。アルギニンはまた、天然の抗うつ神経伝達物質であるアグマチンを合成するために脱炭酸することができる(Bernstein et al 2012)。CDRの条件下では、アグマチンは加水分解されて尿素と抗ウイルスポリアミンであるプトレシンを生成する(Bernstein et al 2012)。
4.11. ヘム
ヘムは赤血球ヘモグロビン中に豊富に存在するが、呼吸鎖複合体II、III、およびIVのミトコンドリアのシトクロム中にも重要な補酵素基として存在する(Kim et al 2012)。CDRを活性化する一連の事象の中で、赤血球およびミトコンドリアのヘム中心は、損傷を受けた細胞から放出される。細胞外空間では、ヘムはヘムオキシゲナーゼI(HO-1)によって代謝されて一酸化炭素(CO)を生成し、鉄とビリベルジンを放出する。NOと同様に、COはミトコンドリア複合体IVの強力な阻害剤である。非真皮細胞では、ヘムはポルフィリン生合成のフィードバック阻害剤である(Ajioka et al 2006)。
4.12. リン脂質
すべての真核細胞の膜は、大部分がリン脂質で構成されている。これらの大部分は、グリセロール骨格、2つの脂肪酸側鎖、およびリン酸塩を含む極性の頭部基からなるホスホグリセロ脂質である。細胞膜の流動性は、脂肪酸側鎖の熱パッキングの生物物理学的帰結である。一般的に、側鎖が短く多価不飽和(シス二重結合が多い)であればあるほど、細胞膜は流動性が高い。逆に、炭素側鎖が長く、飽和度が高いほど、膜は硬くなる。血漿中では、ホスホエタノールアミンを含む飽和超長鎖脂肪酸(PE-VLCFAs)がより豊富である(Pastural et al 2009)。細胞の危険な条件下では、十文字デメチラーゼ(Liu et al 2012)とヘムオキシゲナーゼI(Nie et al 2013)の両方がリポキシゲナーゼ発現をアップレギュレートする。膜中の脂肪酸の二重結合は、リポキシゲナーゼによる過酸化の標的である。CDRの条件下では、細胞膜は、より長い、より多くの飽和脂質と短い多価不飽和脂質の漸進的な交換によって硬化される。ホスホリパーゼD2の活性化は、Gタンパク質の活性化のカップリング(Mahankali et al 2011)およびホスファチジン酸としての強力なシグナル伝達脂質の放出(Peng and Frohman 2012)を導く。多くのピューリン作動性および他の自然免疫シグナル伝達受容体がGタンパク質結合受容体であるため、膜へのPLD2の早期トランスロケーションは、CDRの初期段階でピューリン作動性シグナル伝達をプライミングする効果を有する。
4.13. トリプトファン
トリプトファンの多くの代謝運命は、CDR の初期および後期の両方で重要な分子となっている。トリプトファンは、水酸化(トリプトファン水酸化酵素)経路を介してセロトニンとメラトニンに、またはジオキシゲナーゼ(インドールアミン2,3-ジオキシゲナーゼ、IDO)経路を介してキヌレン酸、キノリン酸、ナイアシン、ピリジンヌクレオチド(NAD +、NADP +)に代謝することができる。セロトニンの総体内の店舗の約90%は、腸内の腸内ロマフィン細胞で合成され、また、ADP、ATP、ヒスタミン、カルシウムが含まれている緻密な、δ顆粒の形で血小板で輸送されている。トリプトファンの腸内微生物代謝は、インドールの大規模なファミリーの合成で結果を出すが、そのうちのいくつかはまた、キヌレニンに代謝されることができる。キヌレニン酸は、アリール炭化水素受容体の内因性リガンドおよびIL-6の相乗的誘導剤として作用し(DiNatale et al 2010好中球の抗真菌活性のような自然免疫機能を刺激し、TH2細胞を刺激する一方で、TH1阻害性の調節性T細胞(Treg)の刺激によって適応免疫を減衰させる(Mandi and Vecsei 2012)。
4.14. リジン
抗ウイルスCDRは、ヒストン上のリジンの翻訳後状態と、RIG1(レチノイン酸誘導遺伝子1)として知られている二本鎖RNA結合タンパク質、およびミトコンドリア抗ウイルスセンサー(MAVS)のような免疫エフェクタータンパク質によって強く制御される(Jiang er al)。 リジンユビキチン化は、MAVSへの効率的な結合およびインターフェロン誘導に必要なRIG1のオリゴマー化を促進する。SAM媒介のリジンメチル化は、タンパク質を安定化し、ユビキチン化を阻害し、CDRの一部であるプロテアソーム媒介のタンパク質ターンオーバーの増加に対抗するように働く。食事性リジンは、腸内セロトニン受容体4(5HTR4)のアンタゴニストであり、抗不安性であり(Smriga and Torii, 2003CDRに対抗する。
4.15. コレステロール
未エステル化コレステロールは、好中球のせん断ストレス耐性と活性化を増加させる(Zhang et al 2011)。低コレステロールは好中球のカルシウム活性化と酸化バーストを阻害する(Kannan et al 2007)。また、高コレステロールは、アミロイドβペプチド(アミロイドβP)の細胞毒性効果に対して神経細胞をより抵抗性にする(Arispe and Doh, 2002)。多くの真核細胞の形質膜は、約50mol%の未エステル化コレステロールで構成されており、このコレステロールは、リン脂質の可溶化を助けるために、小さな極性の頭部基(単一の水酸基)を持つ膜内空間充填剤として作用する。コレステロールは、細胞周囲環境を連続的にサンプリングするカベオラと呼ばれるミクロドメインにGM1ガングリオシドとともに蓄積する。細胞が活性化されると、GM1とコレステロールが濃縮して脂質ラフトを形成し、多くのタンパク質がより効率的な抗微生物防御のためにラフトにパッチを当てて濃縮される。フォルミルペプチド受容体やNADPHオキシダーゼ(NOX)のようなCDRタンパク質は、効率的な活性酸素産生のために脂質ラフトに集合する(Jin and Zhou, 2009)。
4.16. ビタミンB6
ビタミンB6の活性代謝物であるピリドキサール5′-リン酸(PLP)の低血漿レベルは、炎症およびCDRの共通の特徴である(Paul et al 2013)。PLPは、キヌレニンの形成後、キノリン酸とNAD +およびNADP +の合成につながるトリプトファン代謝のジオキシゲナーゼ(IDO)経路の4つの反応における補酵素である。PLPはまた、リンパ球の化学吸引剤スフィンゴシン-1-リン酸(S1P)を不活性化するための酵素S1Pリアーゼによって必要とされる。PLPの低レベルの全身レベルは、キヌレニン/トリプトファン比を増加させる効果があり、炎症を起こした組織でS1Pを増加させ、それによって活性なCDRを維持する。
4.17. アラキドン酸
脳細胞、神経細胞、上皮細胞のようにミトコンドリアが特に豊富な細胞は、Sn-2位にアラキドン酸を含むプラスミトコンドリア脂質も豊富である。これは、活性CDRの間、プロスタグランジン、ロイコトリエン、および他の炎症性脂質合成のためのアラキドン酸の放出のためのホスホリパーゼA2(PLA2)アイソフォームのための好ましい基質である(Ong et al 2010)。
4.18. スフィンゴシン
いくつかの細胞内病原体は、スフィンゴシン1-リン酸(S1P)の合成および移動を阻害するか(Thompson et al 2005)またはミトコンドリアでの分解を刺激するメカニズムを進化させてきた(Degtyar et al 2009)。S1Pは、リン酸化されたスフィンゴ脂質であり、ホスホセリンの頭部基に連結された単一の脂肪酸を含む。細胞内S1Pは、オートファジーと細胞内寄生虫の排除の間にカルシウム依存性の酸性化を促進し、核内のヒストンアセチル化を調節するファゴソームに輸送される(Lucki and Sewer, 2012)。細胞外S1Pは、5つのGタンパク質連結受容体に結合し、アポトーシスを抑制するように作用し、リンパ球の産生部位や炎症部位からの脱出を防ぎ(Takabe et al 2008聴覚および前庭機能の正常な発達に不可欠である(MacLennan et al 2006)。S1Pは、Tregsを阻害し、TH1を刺激し、mTORを活性化することにより、キヌレニンの免疫調節効果に対抗する(Liu et al 2010)。
4.19. セラミド
セラミドは、GM1ガングリオシド、スフィンゴシン、およびS1Pの前駆体である。セラミドは、合成のためにミトコンドリアを必要とし(NovgorodovおよびGudz 2011細胞死につながる条件下でミトコンドリアを標的とする(Sentelle et al 2012)。CDRの細胞死または細胞生存の結果は、S1Pとセラミドの間のバランスに部分的に依存する。
4.20. 金属
正常な代謝は、Mg2 +、Ca2 +、Fe2 +、Cu+、Zn2 +、Mn2 +、Mo4 +、Se2 +、およびCo2 +のような多数の金属の存在に決定的に依存しており、これらはヌクレオチドや他の代謝物、およびタンパク質と相互作用して構造を安定化し、有機金属反応中心を形成する。Pb、Hg、As、V、Ni、Al、Cd、Ce、Crのような他の多くの金属は有毒である。細胞の健康の還元酸化還元条件下では、通常、排泄が曝露を上回るため、これらの有毒金属は蓄積されない。CDRが活性化されると、酸化性の細胞内条件が隔離を有利にし、有毒な量の微量金属および重金属が蓄積され、容易に動員されない。多くの有毒金属は、その正電荷のために電気泳動性として作用するだけでなく、スルファロフィル(システインの遊離チオール、およびグルタチオンと容易に硫化物を形成する)としても作用する。これにより、遊離チオールは通常の代謝反応に利用できなくなり、レドックス感知タンパク質のペプチド内システイン残基が架橋されておらず、ジスルフィド結合が正常に形成されず、ジスルフィド結合を安定化させるはずの通常の酸素濃度下では、タンパク質の還元形態の三次元構造が有利になるという偽hypoxiaとして知られる状態を引き起こす可能性がある。これらの効果に加えて、鉛および水銀のような金属のより特異的な神経毒性効果がよく知られている(Ibrahim et al 2006)。慢性的に活性なCDRによって機能性ビタミンDが減少すると、マグネシウムの不顕性腎消耗が起こりうる(Sutton and Domrongkitchaiporn, 1993)。
4.21. 腸内マイクロバイオーム
健康な代謝は、発生履歴や現在の環境条件、個人が利用できる遺伝資源などをもとに、フィットネスのための最適な化学的解決策を計算する生存エンジンとして機能する。私たちが血液や尿を採取するとき、私たちは実際に宿主-微生物システムの集合的な代謝を採取していることになる。この集団的代謝はまた、遺伝子発現に長期的な変化をもたらす体細胞のDNAのエピジェネティックな改変を制御している(Naviaux, 2008)。ヒトのメタボタイプは、細胞がコミュニケーションに使用する約400~1200の化学単語からなる動的に調節されたコア語彙で構成されている。これらは、質量が2000 Da未満の低分子代謝物である。これらの代謝物の化学量論的比率は、サンプリング時の健康状態を反映している。成人のヒトの体は約1014個のヒト細胞と約1015個の細菌細胞で構成されており、これらの細胞は日和見病原体から私たちを守り、健康を維持するための生きた盾として機能している。私たちのマイクロバイオームの約99%は腸内にある。私たちのマイクロバイオームのバイオマスは約1.5kg、体重の約2%である。腸内マイクロバイオームを構成する細菌、古細菌、希少真菌、原生生物、無脊椎動物のメタゾアンを合わせると、約4.5×1011 Gbの遺伝的複雑性があり、ヒトのハプロイドゲノムの約150倍の遺伝情報が含まれている。これは、腸内マイクロバイオームの代謝多様性がヒトの宿主をはるかに超えていることを示す証拠である。
マイクロバイオームの構成と機能は、宿主の発生履歴、食生活、健康状態、活動によって継続的に形成される生態系と考えるのが最適である。他の生態系と同様に、マイクロバイオームの健康状態と種の構成は、物理的な生息地、資源、補完的な生物多様性、破壊的な生物多様性(侵略的種および代謝最終産物のリサイクルと除去を含む一連の強制変数によって決定される。宿主が病気になると、マイクロバイオームも病気になる。CDRの慢性的な活性化は、遠位腸の物理的な生息地と、食事栄養素の形での資源の利用可能性の両方を変化させる。例えば、自閉症スペクトラム障害(自閉症スペクトラム障害)の子供では、腸内二糖分解酵素の発現が低下するため、遠位腸の微生物群がショ糖、乳糖、マルトースなどの単純二糖類をより多く受け取るようになる(Williams et al 2011)。さらに、腸を覆う細胞におけるCDRに関連する酸化状態の増加は、プロリンおよびグルタミンに富む、処理されたグリアジン33-メルペプチドの取り込み、細胞内処理、および折り畳みの変化につながり(koguma et al 2007)グルテン感受性の増加につながる(Jacobs 2007)。これらおよび他の要因は、腸内の透過性および種の組成を変化させるために結合する。自閉症スペクトラム障害の子どもたちの間では、このことが一般的に、腸内環境の異常や便秘と下痢の交互の発作につながる。また、マイクロバイオームの健康と機能をモニタリングする腸内神経系(ENS)と中枢神経系との間のコミュニケーション異常の結果として、行動の変化にもつながる。病んでいるマイクロバイオームを回復させることは、不足している種や代表的でない種を追加することと同じくらい単純なことではない。複雑な微生物生態系に持続的な変化をもたらすためには、腸の物理的な生息環境と供給される栄養資源の両方を持続的に変化させなければならない。
5. CDRの解決
危険が取り除かれたり、中和されたりすると、自然に2つのことが起こる。第一に、失われた細胞を交換し、正常な臓器機能を回復させるための抗炎症・再生経路が活性化される(Heber-Katz and Stocum, 2013)。次に、CDRの原因となった暴露の代謝記憶は、脳が記憶を保存する方法に似た方法で、ミトコンドリアのバイオマス、細胞のタンパク質、脂質、その他の高分子の含有量、細胞構造、体細胞のエピジェネティックな修飾を介した遺伝子発現の耐久性のある変化の形で保存される(Naviaux, 2008)。この代謝記憶はまた、分裂細胞ホルミシスと呼ばれている(Naviaux, 2012)。宿主の遺伝子型、および暴露の性格、発生時期、大きさ、および頻度の混合物によって決定される条件の下では、CDRの機能不全形態は、慢性疾患につながる持続することができる。CDRは最初は適応的で、ミトコンドリアと細胞の密接な相互作用によって調整されているが、環境の危険がなくなると不適応になるので、これは “アナックロード適応性ミト細胞機能不全 “と呼ばれることができる。
6. 疾患への影響とまとめ
CDRが解決に失敗すると、慢性疾患の結果。最初の学期に始まり、脳幹は、神経発達と全身の代謝の化学感覚的統合を担当している。CDRとそれに伴う代謝変化が持続する場合、出生後、正常な発達の軌跡が変化する可能性がある。CDRの病理学的持続に起因する疾患のいくつかが含まれている。自閉症スペクトラム障害(自閉症スペクトラム障害注意欠陥多動性障害(ADHD)食物アレルギー、喘息、アトピー、肺気腫、トゥレット症候群、双極性障害、統合失調症、心的外傷後ストレス障害(PTSD)外傷性脳損傷、慢性外傷性脳症(CTE)。自殺願望、虚血性脳損傷、脊髄損傷、糖尿病、腎臓、肝臓、心臓病、癌、アルツハイマー病、パーキンソン病、および全身性エリテマトーデス、関節リウマチ、多発性硬化症、原発性硬化性胆管炎などの自己免疫疾患。CDRの病的持続は、誘因物質がなくなった後に起こりうる。これは、ホルミシスおよび代謝記憶、体性エピジェネティックな変化(Blumberg et al 2013)またはその両方の結果であり得る。ピュリン作動性シグナル伝達は、CDRの多面的な代謝特徴を維持する上で重要な役割を果たしているようである。この観察は、抗ピューリネリック療法(APT)を用いた自閉症スペクトラム障害の古典的な動物モデルにおいて、16の多系統の自閉症様特徴のすべての修正に成功したことにつながった(Naviaux et al 2013)。
上記の慢性CDR障害は、広範囲の標的組織および細胞型において異常を生じる。宿主の遺伝子型および健康状態、ならびに曝露の発生時期および性質によって、特定の疾患を発症するリスクが決定される。多くの場合、細胞危険曝露の混合物が必要とされるようである。異常が小児期や若年成人期に現れ、構造的異常を生じるほど長くは続かない場合、現在、静的で、不可逆的で、治療に反応しにくい、あるいは退行性であると考えられている多くの疾患が、実際には、抗CDR治療によく反応する動的な機能状態である可能性がある。上記に挙げた疾患の多くは、動物モデルで既にAPTに対する反応が示されている(表1)。APTの重要な注意点は、CDRの物理的、化学的、生物学的な引き金が除去または中和されていない場合、持続的なCDRを阻害するように設計された治療法は、混合した効果をもたらす可能性があるということである。例えば、CDRがPBDE難燃剤への周産期暴露に対する反応である場合(Blumberg et al 2013年PBDEが影響を受けた子供の生活空間から除去されていない場合、持続性CDRは適応性があり、anachroadaptiveではない可能性がある。このような状況下でのAPTは、正味の害をもたらす可能性がある。
表1. 抗プリン作動性療法によって修正または改善された疾患
疾患種 抗プリン作動性療法 参考文献
- 自閉症マウス スラミン・ナビオー (et al 2013)
- 脊髄損傷 ラット ブリリアントブルーG (et al 2009)
- 外傷性脳損傷 ラットとマウス MRS2179 (Choo er al)。
- 虚血性脳損傷 ラット (Suramin Kharlamov er al)。
- グルタミン酸興奮毒性 ラット スラミン・ベズヴェニュク( et al 2000)。
- てんかんマウス A438079 (Engel er al)。
- 関節リウマチラット (Suramin Sahu er al)。
- 慢性疼痛ラット P2X3-15h (Cantin et al 2012)
- 多発性硬化症マウス スラミン・ノバレス・リ(1996)
- Lupus erythematosis Mice Suramin Ballok and Sakic (2008)
- 血管形成術後の再狭窄 ウサギ スラミン・グレイら(1999)
- デュシェンヌ型心筋症 マウス スラミン・デ・オリベイラ・モレイラ (et al 2013)
- 心不全 ラット アピラーゼ マリーナ (et al 2013)
- アルコール性肝疾患・肝硬変ラット (Suramin He et al 2013)
- 喘息のモルモット スラミン小熊 (et al 2007)
- 肺気腫マウス スラミン・チッコ (et al 2010)
- 糖尿病性腎疾患 ラット スラミン・コラパティ (et al 2012)
図1,図2ABに示されているCDRの代謝機能のそれぞれは、個別に特定の治療法を用いて、あるいはサプリメント、食事や活動量の変化、あるいはアダプトゲン療法を組み合わせて、よりグローバルに対処することができる(Panossian and Wikman, 2009)。しかしながら、CDRは、プリン反応性シグナル伝達によって調節される機能的応答であるように見えるので、プリン反応性アンタゴニストの薬理学が拡大され、天然物が探索され、19の既知のクラスのプリン反応性受容体の1つ以上を選択的に標的とする新しい抗炎症薬が開発される、複雑な疾患治療学の新しい章が想像されるであろう。
