Contents
Melatonin: Clinical Perspectives in Neurodegeneration
www.ncbi.nlm.nih.gov/pmc/articles/PMC6646522/
オンラインで公開2019年7月16日
概要
神経変性疾患の予防は、現在、我々の学会の主要な目標であり、すべての好気性生物に存在する系統発生的に保存された珍しい分子であるメラトニンは、この点で検討に値する。メラトニンは、時間生物学的特性と細胞保護特性の両方を兼ね備えている。時間生物学的特性として、メラトニンは生物学的リズムの位相と振幅を変化させることができる。細胞保護分子としてのメラトニンは、神経変性疾患や老化で見られる低度の炎症性損傷を回復させる。血中のメラトニン濃度が低いと、老化が進行する。アルツハイマー病やパーキンソン病(PD)の実験モデルでは、メラトニンによって神経変性が抑制される。また、メラトニンは、脳のリンパ系による有害タンパク質の除去を促進する。限られた数の臨床試験では、メラトニンのアルツハイマー病やPD、特に病気の初期段階での可能性が支持されている。動物実験から得られた計算では、細胞保護作用のあるメラトニンの投与量は40-100mg/日の範囲である。したがって、この範囲のメラトニン用量を用いた対照試験が早急に必要である。また、メラトニンの適応外使用についても検討した。
キーワード:加齢、アルツハイマー病、糖質系、メラトニン、軽度認知障害、神経変性、酸化ストレス、パーキンソン病
はじめに
アルツハイマー病や前頭側頭型認知症のように認知機能が著しく低下する疾患や、パーキンソン病やハンチントン病、筋萎縮性側索硬化症のように運動機能が著しく低下する疾患は、認知機能、運動機能、感覚機能のいずれかのニューロンが対称的に失われることが特徴である。これらの疾患における神経細胞死は、フリーラジカルを介した変性、ミトコンドリア機能障害、低度の炎症、興奮毒性など、相互に関連したプロセスに起因すると考えられている(1, 2)。神経変性の予防には、抗酸化物質を定期的に摂取することが提案されているが、その効果は疑問視されている(3)。このような背景から、メラトニンの使用による細胞保護作用を考慮する必要がある。
メラトニンは、系統発生的に保存された珍しい化合物で、既知のすべての好気的な植物に存在しており、時間生物学的特性に加えて、細胞保護分子としての重要性が期待されている(4)。松果体は、循環するメラトニンの明確な供給源であり、血漿メラトニンの減少は、ヒトの高齢化の特徴の1つである(5)。この記事では、神経変性疾患におけるメラトニンの臨床利用に焦点を当てている。基本的な生物学的データについては、ヒトに使用可能なメラトニンの用量との関連性に限定している。
メラトニンの基礎生物学
「クロノバイオティクス」とは、概日リズムを同期させたり、振幅を増大させたりする能力を持つ薬物と定義されており、メラトニンはその典型である(6, 7)。メラトニン合成の明暗差は、メラトニンのクロノバイオティクスとしての本質的な役割を定義している(8)。メラトニンは、深夜に視交叉上核(SCN)から生じる覚醒傾向を抑制することで、「眠りの扉を開く」(9, 10)とされている。一方、メラトニンは暗闇の化学的コードであり、神経内分泌系にとって重要な情報である(11)。
哺乳類では、循環するメラトニンはほぼ松果体に由来するが(5)メトキシインドールはほとんどの細胞、組織、器官で局所的に合成されている(12)。実際、メラトニンは、ミトコンドリアを持つすべての動物細胞で産生されているという強力な証拠がある(13, 14)。メラトニンは、フリーラジカルの除去や、細胞を保護するための免疫反応の調節などに関与している(15)。
メラトニンの時間生物学的作用には、Gタンパク質に関連する膜受容体スーパーファミリー(G-protein coupled receptors, GPCR)に属するMT1およびMT2受容体が関与している(16)。MT1およびMT2受容体は、SCN、海馬、視床、網膜、前庭核、大脳皮質および小脳皮質で同定されている(17)。
さらに最近では、GPR50という別のメンバーが、MT1およびMT2と高い配列相同性を示すメラトニン受容体サブファミリーに含まれている(18)。しかし、GPR50は、メラトニンやその他の既知のリガンドとは結合しない。むしろ、互いの間や他のGPCRとホモ・ヘテロマーを形成している(19)。
メラトニンはミトコンドリアで生成・代謝されるだけでなく、最近、虚血・再灌流による脳損傷に対するメラトニンの神経保護作用は、膜ではなくミトコンドリアに存在するMT1受容体によって媒介されることが主張されている(20)。MT1のようなGPCRは、細胞外のシグナルを細胞内に伝達する細胞表面の受容体として知られているので、これは注目に値する。
両親媒性の物質であるメラトニンは、細胞膜を伝染することができる。細胞質では、メラトニンはカルモジュリンやチューブリンと相互作用する(21)。メラトニンは細胞核にも入り、その受容体部位はオーファン受容体スーパーファミリーのRZR/RORに属すると考えられていた(15)。しかし、RZR/RORはメラトニンと結合しないことが明らかになっている。むしろ、メラトニンはこの転写因子を介して間接的に作用する可能性がある。例えば、サーチュイン-1(SIRT-1)の活性化を介して、サーカディアン・アクセサリー・オシレーター成分であるRORαに影響を与えるなどである(22)。
メラトニンの細胞保護活性は、受容体を介したものを上回る。ほとんどの細胞に存在するメラトニンの量は、循環しているメラトニンの量よりもはるかに多い(12)。現在、ミトコンドリアのメラトニン合成能力が確認されているが、細胞内のメラトニンが細胞外に出ることはない。実際、細胞内のメラトニン濃度を変化させるのに必要なメラトニンの投与量は、クロノバイオティクスとして採用されているものよりもはるかに高い(23, 24)。
細胞培養では、10-8〜10-9Mの用量で生理学的に適切なメラトニンの効果が見られ、これらの濃度はほぼ完全または完全な受容体飽和には十分である(25,26)。しかし、動物における神経保護作用や抗炎症作用に関する研究のほとんどは、受容体の飽和を明らかに超える薬理学的用量を用いている。
この総説では、動物実験での神経変性に対するメラトニンの効果を、ヒトへの投与量の可能性と関連づけて検討している。アルツハイマー病とメラトニンに関する細胞株の研究では、アルツハイマー病の予防においてもメラトニンを介した重要なメカニズムが明らかにされていることに留意する必要がある。プロテアスタシスの機能障害、オートファジーの破綻、インスリン、ノッチ、Wnt/β-カテニンのシグナル伝達経路の異常など、神経変性におけるシグナル伝達機構の破綻を回復させるメラトニン活性に関する包括的な総説が発表されたばかりである(27)。
受容体とは無関係に、メラトニンには抗酸化作用と消去作用がある(28)。メラトニンには内在性のフリーラジカル消去活性があり、また代謝されてより高い抗酸化力を示す化合物になる。さらに、メラトニンは、プロオキシダント酵素の合成を阻害し、アンチオキシダント酵素の合成を促進する。メラトニンは、ビタミンCやビタミンEの酸化的ダメージからの保護能力を上回る(29)。メラトニンはまた、虚血時にミトコンドリア膜の安定化を介して、フリーラジカルの消去とは無関係に細胞保護作用を発揮する(24)。
メラトニンによる免疫調節には、炎症促進作用と抗炎症作用がある(30-32)。抗炎症作用は、脳梗塞、虚血・再灌流、敗血症などの高次の炎症や、老化や神経変性過程などの低次の炎症で見られるため、医学的にも非常に興味深い。
メラトニンの抗炎症作用は、核内因子κB(NF κB)のDNAへの結合を阻害すること(炎症性シグナルの合成を低下させる)シクロオキシゲナーゼ(Cox)(21)主にCox-2を阻害すること(33)誘導性一酸化窒素合成酵素(iNOS)の発現を抑制すること(34)によって発揮される。その他のシグナル伝達経路としては、インフラマソームNLRP3の活性化の防止、核因子赤血球2関連因子2のアップレギュレーション、toll-like receptor-4の活性化と高可動性グループボックス-1のシグナル伝達の抑制などが関与している。また、メラトニンによるSIRT-1のアップレギュレーションも重要な意味を持つようだ。これらのメラトニンの効果を総合すると、炎症性サイトカインのレベルが低下し、抗炎症性サイトカインの産生が増加することになる(31)。
メラトニンによる神経保護作用には、γ-アミノ酪酸(GABA)作動性システムが関与している可能性がある。実際、メラトニンは抗興奮作用や鎮静作用を示し(35,36)メラトニンがGABA作動性受容体の活性化を介してアミロイドβ(アミロイドβ)ペプチドの毒性から神経細胞を保護するという情報もある(37)。メラトニンによるGABA活性の上昇は、メラトニン受容体拮抗薬のルジンドールでは阻害されないが、ベンゾジアゼピン系拮抗薬のフルマゼニルでは阻害されたことから、メラトニンによるGABAA受容体のアロステリックモジュレーションが示唆されている(38)。
メラトニンは、抗刺激性の活性も示す。例えば、メラトニンは、電離型グルタミン酸受容体アゴニストであるカイネイトによる神経細胞死を防ぎ(39)、メラトニンの投与は、海馬CA1神経細胞を一過性前部虚血(40)や高用量のグルココルチコイドから保護する(41)。ルジンドールやMT2アンタゴニストである4-phenyl-2-propionamidotetralin (4-PDOT)の効果が認められないことから、メラトニンの抗興奮毒性活性にメラトニン受容体が関与しているとは考えられない(42)。
本論文で取り上げたアルツハイマー病およびパーキンソン病の動物モデルに加えて、メラトニンは、カドミウムの毒性(43,44)高気圧性高酸素(45,46)δ-アミノレブリン酸による毒性(47)γ線(48)局所的な虚血(49)脳外傷(50,51)およびいくつかの神経毒から生じる神経細胞の損傷を軽減することが示されている(52)。
ADモデル動物におけるメラトニン活性
アルツハイマー病は、細胞外ではAßが形成された老人斑が、細胞内ではタウタンパク質のリン酸化による神経原線維のもつれが蓄積していることが特徴である(1, 2)。Aßは、加齢に伴う酸化ストレスの増加や細胞のエネルギー代謝の変化に脆弱になったアルツハイマー病の神経細胞の変性を促進する。リン酸化されたタウタンパク質は、微小管の集合を促進し、微小管の安定化に重要な役割を果たしている(1, 2)。
39-43アミノ酸残基のAßは、アミロイド前駆体タンパク質(APP)に由来する。メラトニンはいくつかの細胞株でAPPの成熟を阻害する(53)。
表1は、アルツハイマー病のトランスジェニックモデルにおけるメラトニンの効果をまとめたものである。これらのデータは、メラトニンがAPPとAßの代謝を主に病的過程の初期段階で調節することを示している。これらの異なるトランスジェニックモデルで使用されたメラトニンの用量から、体表面積で正規化することにより、75kgの成人に対するメラトニンのヒト等価用量を算出することができる(54)。注目すべきは、表1の結果から算出された理論上のヒト等価投与量は、ヒトで使用されているものよりも2~3桁大きいことである。ただし、これらの研究には、アルツハイマー病症例の5%を占めるだけの遺伝性のアルツハイマー病に特徴的な変異を持つ遺伝子の発現変化が含まれているので、注意が必要である。老化が促進されたOXYSラットは、加齢に伴うアミロイドβの凝集とτタンパク質のリン酸化の進行、ミトコンドリア機能障害、シナプスの消失、神経細胞の死、それに伴う認知機能の低下を特徴とする散発性アルツハイマー病(アルツハイマー病患者の95%を占める)の適切な非トランスジェニックモデルであると考えられる(72)。驚くべきことに、非常に低用量のメラトニン(0.04mgを毎日p.o.)がこれらの変化をすべて防ぐのに有効であった(73)。観察された投与量の不一致を解決するには、さらなる研究が必要である。
表1 アルツハイマー病のトランスジェニックモデルに対するメラトニンの効果
| 参考文献 | 設計 | 結果 | 75kgの成人に対するメラトニンのヒト等価用量 |
|---|---|---|---|
| 松原ほか (55) | 生後4か月のAPP695トランスジェニックマウスは、飲料水中の50 mg / kgのメラトニンを8,9.5,11,および15.5か月間投与された。 | メラトニンの投与は、β-アミロイドの予想される時間依存性の上昇を部分的に阻害し、タンパク質の異常なニトロ化を減少させ、生存率を増加させた | 300mg /日 |
| Feng etal。(56) | 生後4か月のAPP695トランスジェニックマウスは、飲料水中の10 mg / kgのメラトニンを4か月間投与された。 | メラトニンは、ステップダウンおよびステップスルーの受動的回避テストによって示されるように、トランスジェニックマウスの学習および記憶障害を打ち消した。さらに、トランスジェニックマウスの前頭皮質および海馬におけるコリンアセチルトランスフェラーゼ活性の低下は、メラトニンによって防止された。 | 60mg /日 |
| クインら。(57) | 14ヶ月齢のトランスジェニック(Tg 2576)マウスは、飲料水中の3.6 mg / kgのメラトニンを4ヶ月間投与された。 | 皮質レベルアミロイドβでも、脂質過酸化生成物の脳レベルでも、未処理のトランスジェニックマウスとメラトニン処理のトランスジェニックマウスの間に違いはなかった。メラトニンは、アミロイド斑沈着の年齢の後に開始された場合、抗アミロイドまたは抗酸化効果を生み出すことができない | 20mg /日 |
| Feng etal。(58) | 生後4か月のAPP695トランスジェニックマウスは、飲料水中の10 mg / kgのメラトニンを4か月間投与された。 | メラトニンは、トランスジェニックマウスにおける脳のチオバルビツール酸反応性物質の増加、グルタチオン含有量の減少、およびアポトーシス関連因子のアップレギュレーションを防止した | 60mg /日 |
| ガルシアら。(59) | 生後5か月の女性トランスジェニック(Tg2576)は、アルミニウム(1 mg / g)またはメラトニン(飲料水中10 mg / kg /日)に6か月間暴露された。 | 一般的な運動活動に対するアルミニウムの影響は見られなかった。より低い馴化パターンがメラトニン処理動物で観察された。アルミニウムで治療されたTg2576マウスは、メラトニン治療によって変更されていない効果である学習障害を示した | 60mg /日 |
| Olcese etal。(60) | メラトニン(飲料水中20 mg / kg)を2〜2.5か月齢のAPP / PS1トランスジェニックマウスに5か月間投与した。 | メラトニンを投与されたトランスジェニックマウスは、作業記憶、空間参照学習/記憶、および基本的なニーモニック機能の認知障害から保護された。免疫反応性アミロイドβ沈着は、メラトニン処理トランスジェニックマウスの海馬および嗅内皮質で減少した。メラトニンは海馬の腫瘍壊死因子-αを減少させ、抗酸化酵素の皮質mRNA発現を正常化した | 120mg /日 |
| ガルシアら。(61) | 生後5か月の雌のトランスジェニック(Tg2576)は、アルミニウム(1 mg Al / g食餌)またはメラトニン(飲料水中10 mg / kg /日)に6か月間暴露された。 | 海馬におけるアルミニウムの酸化促進効果はメラトニンによって妨げられた | 60mg /日 |
| Spuch etal。(62) | 生後9ヶ月の雄APP / PS1トランスジェニックマウスを使用した。タクリン-メラトニンハイブリッド(マウスあたり2μl、50μg/ ml)を各側脳室に定位注射し、6週間後に動物を殺した。 | タクリン-メラトニンハイブリッドの脳内投与は、APP / Ps1マウスの脳実質におけるアミロイドβ誘発性細胞死とアミロイド負荷を減少させた。アミロイドβの病状の減少は、認知機能の回復を伴った | – |
| Bedrosian etal。(63) | メラトニン(1 mg / kg)を、生後4週間から9か月のトランスジェニックアミロイド前駆体タンパク質(APPSWE)マウスに毎晩投与した。 | 不安様行動の時間的パターンは、高齢マウスおよびトランスジェニックAPPマウス、すなわち、暗期の終わり近くの成体マウスと比較して運動活動の上昇、および前脳基底部アセチルコリンエステラーゼ発現の時間依存性変化に現れた。メラトニン治療は、高齢またはトランスジェニックマウスに見られる修飾に影響を与えなかった | 6mg /日 |
| Dragicevic etal。(64) | 18〜20ヶ月齢のAPP / PS1トランスジェニックマウスは、飲料水中の20 mg / kgメラトニンを1ヶ月間投与された。 | メラトニン治療は、いくつかの脳領域でミトコンドリアのアミロイドβレベルを低下させた。これは、海馬、皮質、または線条体から単離されたミトコンドリアにおけるミトコンドリア呼吸数、膜電位、およびATPレベルのほぼ完全な回復を伴った。 | 120mg /日 |
| Bañoetal。(65) | 3.5〜5.5か月齢のAPP / PS1ダブルトランスジェニックマウスに、メラトニン(5 mg / kg)またはラメルテオン(2 mg / kg)を飲料水または再ペレット化食品でそれぞれ5.5か月間投与した。 | 海馬の酸化ストレスマーカーを含む、測定された概日および行動パラメーターの多くは、トランスジェニックマウスでは有意な影響を受けないであった。メラトニンは体温と自発運動のために24時間でτを維持したが、ラメルテオン治療は効果がなかった。脳組織分析は、メラトニンまたはラメルテオンで治療されたトランスジェニックマウスにおける海馬タンパク質酸化の有意な減少を明らかにした | 30mg /日 |
| Dragicevic etal。(66) | 11〜12ヶ月齢のAPPswマウスに100mg / kgのメラトニンを1ヶ月間投与した | メラトニン治療は、呼吸数、膜電位、活性酸素種の産生、およびATPレベルのアッセイにおいて、脳ミトコンドリア機能のほぼ完全な回復をもたらした。 | 600mg /日 |
| ガルシアメサ他 (67) | 6ヶ月齢の3xTg-ADマウスに10mg / kgを6ヶ月間投与した。物理的な運動は、ハウジングケージ内のランニングホイールへの無料アクセスによって実装された | メラトニンと運動の両方が可溶性アミロイドβオリゴマーを減少させたのに対し、メラトニンのみが過剰リン酸化タウを減少させた。両方の治療法は、認知障害、脳の酸化ストレス、およびミトコンドリアDNAの減少から保護した。ミトコンドリア複合体の減少に対しては、運動とメラトニンの併用治療のみが効果的であった。 | 60mg /日 |
| マッケナ等。(68) | 飲料水中の50mg / kgのラメルテオンをB6C3-Tg(APPswe、PSEN1dE9)85Dbo / Jマウスに6か月間投与した。 | 大脳皮質または海馬におけるADマウス(水迷路)またはアミロイドβ沈着物の認知能力に対するラメルテオンの効果の欠如 | – |
| ディパオロら。(69) | 生後5か月の雌のトランスジェニック(Tg2576)は、アルミニウム(1 mg Al / g食餌)またはメラトニン(飲料水中10 mg / kg /日)に14か月間暴露された。 | メラトニンは、アルミニウムに曝露されたトランスジェニックマウスの学習と空間記憶を改善した | 60mg /日 |
| Gerenu etal。(70) | 生後4ヶ月のダブルトランスジェニック雌APP / PS1マウスに、クルクミン/メラトニンハイブリッド(Z-CM-I-1)(50 mg / kg)を強制経口投与した。動物は12週間連続して週5回治療された | Z-CM-I-1は、海馬と大脳皮質におけるアミロイドβの蓄積を減少させ、炎症反応と酸化ストレスを減少させた。Z-CM-I-1は、シナプスマーカータンパク質脳卒中後認知症95とシナプトフィジン、およびミトコンドリア電子伝達系の複合体I、II、IVの発現も増加させた。 | 150mg /日 |
| ニーら (71) | 生後10ヶ月のトリプルトランスジェニックマウス(3xTg-アルツハイマー病)にメラトニン(飲料水中10mg / kg /日)を1ヶ月間投与した | メラトニンは、3xTg-ADマウスの不安とうつ病のような行動を改善した。海馬グルタチオンS-トランスフェラーゼP1(不安関連タンパク質)およびコンプレクシン-1(うつ病関連タンパク質)はメラトニンによって有意に調節された | 60mg /日 |
体重75kgの成人に対するメラトニンのヒト換算投与量は、体表面積で正規化して算出している(54)。
メラトニンがどのようにしてアミロイドβの生成を抑制するのかは、まだ解明されていない。メラトニンは、Aß40およびAß42と相互作用し、進行性のβシートやアミロイド線維の形成を阻害する可能性がある(74, 75)。このような相互作用はメラトニンの抗酸化作用とは無関係のようである(74)。
二次シートの形成を阻害することで、メラトニンは、タンパク質分解によって引き起こされるペプチドのクリアランスを促進すると考えられる。GSK-3はAßの生成とタウのリン酸化を促進する共通のシグナル伝達経路であることから、メラトニンはプロテインキナーゼ(PK)Cの活性化(76,77)とGSK-3経路の阻害を介してAPPとタウの処理を制御する可能性がある(78)。Aßによる神経毒性や細胞死にはフリーラジカルが関与しているが、メラトニンは試験管内試験でも生体内試験でも細胞を酸化的損傷から効果的に保護する(79, 80)。
ワートマニン(84)、カリクリンA(85, 86)、オカダイン酸(87-89)に暴露したN2aおよびSH-SY5Y神経芽細胞において、メラトニンはプロテインキナーゼおよびホスファターゼを介したタウの過リン酸化を効果的に抑制するとともに、これらの薬剤による酸化ストレスにも拮抗する(90, 91)。PK A (92), PK C (93), Ca2+/calmodulin-dependent kinase II (94), mitogen-activated protein kinaseの制御は、メラトニンの抗酸化作用とは関係のない他の作用である(95)。
脳のホメオスタシスにとって重要な現象は、グリンパティック系による老廃物の排出である。「グリンパティック系」とは、血管周囲のアストロサイトがその末端にアクアポリン-4(AQP4)を持っているために、脳の細胞外空間(ECS)でリンパ管のような活発な水の交換が行われていることを意味する(96)。AQP4-/-マウスでは、アミロイドβペプチドの排除が強く抑制されていることから(97)、AQP4駆動によるグリンパでのアミロイドβクリアランスの発生は可能と思われる。
睡眠時には、アミロイドβペプチドの排泄が大幅に増加する(98)。したがって、アルツハイマー病の併存疾患として見られる睡眠障害は、アミロイドβクリアランスの失敗を介して、疾患の発症および進行に寄与している可能性がある。睡眠不足は、脳ECSからのアポリポタンパクEのクリアランスを阻害する(99)。さらに、外傷性脳損傷モデルにおいて、AQP4が欠損すると、細胞外タウの存在と神経細胞のもつれの形成が増大することが示され、大脳皮質系がタウタンパク質のクリアランスに関与していることが示された(100)。
Pappollaらは、アルツハイマー病トランスジェニックマウスにメラトニンを投与すると、アミロイドβの脳内クリアランスが増加することを示している(101)。これと関連して、メラトニンは患者の徐波睡眠を維持することが知られている(102)。実際、脳卒中や外傷性脳損傷のようなアルツハイマー病以外の様々な神経疾患にも、リンパ系の機能障害が関係している(103)。
ミクログリアの活性化によって引き起こされる炎症性サイトカインの発現の上昇は、アルツハイマー病の病因に関与していると考えられている(1, 2)。NF kB、Aß、一酸化窒素によって誘発されるミクログリアの炎症性サイトカインの放出は、メラトニンによって効果的に阻止される(83)。NF-kBのDNAへの結合もメラトニンによって阻害された(22, 31)。
アルツハイマー病におけるメラトニンの臨床応用
脳脊髄液(脳脊髄液)中のメラトニン濃度は、アルツハイマー病の前臨床段階でも低下している(104)。血中メラトニンは、軽度認知障害(MCI)およびアルツハイマー病患者の神経心理学的評価と負の相関を示す(105)。メラトニンの相対的な欠乏は、神経変性の原因とも結果とも考えられる。いずれにしても、メラトニンの喪失は、病気を悪化させ、「日暮れ」に見られるような早期の概日リズムの乱れを引き起こす(106)。サンダウンとは、午後遅くから夕方にかけて、焦燥感、徘徊、無秩序な思考、知覚や感情の障害、注意力の低下などの症状が現れることである。メラトニンを時間差で投与したり、明るい光を浴びるなどの時間療法的な介入により、アルツハイマー病患者の日暮れが緩和され、睡眠が改善される(107,108)。
アルツハイマー病に見られる不規則な睡眠・覚醒は、メラトニンによって効果的に治療される(表2)。睡眠障害のある認知症患者10人中7人に、メラトニン3mgを就寝時に3週間投与したところ、日暮れの有意な減少と入眠時刻の変動の減少が認められた(109)。
表2 メラトニンによるアルツハイマー病患者の治療を含む研究
| 科目 | 設計 | 研究期間 | 処理 | 測定済み | 結果 | 参考文献 |
|---|---|---|---|---|---|---|
| 10人の認知症患者 | 非盲検試験 | 3週間 | 就寝時に3mgのメラトニン経口/毎日 | 世話人によって完成された睡眠と覚醒の質の毎日のログ | メラトニンで治療された睡眠障害のある認知症患者の10人中7人は、日没の有意な減少と入眠時間の変動の減少を示した。 | (109) |
| 14人のアルツハイマー病患者 | 非盲検試験 | 22〜35か月 | 就寝時に6〜9mgのメラトニンを1日1回経口投与 | 世話人によって完成された睡眠と覚醒の質の毎日のログ。神経心理学的評価 | 日没は12人の患者でもはや検出できず、2人の患者で弱まったが持続した。睡眠の質の有意な改善が見られた。彼らがメラトニンを投与されている間、病気の認知的および行動的兆候の進行の欠如 | (110) |
| アルツハイマー病の一卵性双生児 | 症例報告 | 36ヶ月 | 患者の1人は就寝時にメラトニン9mg経口/日で治療された | 神経心理学的評価。ニューロイメージング | メラトニンを投与されていない双子では、メラトニンで治療された双子と比較して、睡眠と認知機能が著しく損なわれている。 | (111) |
| 11人のアルツハイマー病患者 | 非盲検試験 | 3週間 | 就寝時に3mgのメラトニン経口/毎日 | 看護師によって完成された睡眠と覚醒の質の毎日のログ | 3つのシフトすべてで興奮行動の有意な減少。日中の眠気の大幅な減少 | (112) |
| 14人のアルツハイマー病患者 | 非盲検プラセボ対照試験 | 4週間 | 就寝時またはプラセボで6mgのメラトニン経口/日 | 世話人によって完成された睡眠と覚醒の質の毎日のログ。アクチグラフ | メラトニンを投与されたアルツハイマー病患者は、プラセボ群と比較して夜間活動の割合が大幅に減少したことを示した | (113) |
| 25人のアルツハイマー病患者 | ランダム化二重盲検プラセボ対照クロスオーバー試験 | 7週間 | 就寝時に6mgの徐放性メラトニンpoまたはプラセボ | アクチグラフ | メラトニンは、総睡眠時間の中央値、覚醒回数、睡眠効率に影響を与えなかった | (114) |
| 45人のアルツハイマー病患者 | 非盲検試験 | 4ヶ月 | 就寝時に6〜9mgのメラトニンを1日1回経口投与 | 世話人によって完成された睡眠と覚醒の質の毎日のログ。神経心理学的評価 | メラトニンは睡眠を改善し、日没を抑制した。これは、併用薬に関係なく見られる効果である。 | (107) |
| 157人のアルツハイマー病患者 | ランダム化プラセボ対照臨床試験 | 2ヶ月 | 就寝時に2.5mgの徐放性メラトニン、または10mgのメラトニンまたはプラセボ | アクチグラフ。睡眠の質に関する介護者の評価 | プラセボと比較して、メラトニン群では、夜間の総睡眠時間の増加と入眠後の覚醒の減少の有意でない傾向が観察された。主観的な測定では、睡眠の質の介護者の評価は、プラセボと比較して、2.5mgの徐放性メラトニングループで有意な改善を示した | (115) |
| 20人のアルツハイマー病患者 | 二重盲検プラセボ対照試験 | 4週間 | プラセボまたは3mgメラトニン経口/毎日就寝時に | アクチグラフ。神経心理学的評価 | メラトニンは睡眠時間を大幅に延長し、夜間の活動を減少させた。メラトニンにより認知機能が改善された | (116) |
| 7人のアルツハイマー病患者 | 非盲検試験 | 3週間 | 就寝時に3mgのメラトニン経口/毎日 | アクチグラフ。神経心理学的評価 | 昼夜のリズム障害または日没の完全寛解が4人の患者で見られ、他の2人では部分寛解が見られた。 | (117) |
| 17人のアルツハイマー病患者 | ランダム化されたプラセボ対照試験 | 2週間 | 就寝時にメラトニン3mgを1日1回経口投与(7人の患者)。プラセボ(10人の患者) | アクチグラフ。神経心理学的評価 | メラトニン治療群では、アクチグラフの夜行性活動と興奮はベースラインと比較して有意な減少を示した | (118) |
| レム睡眠行動障害を発症したアルツハイマー病の68歳の男性 | 症例報告 | 20ヶ月 | 就寝時に5〜10mgのメラトニンを1日1回経口投与 | 睡眠ポリグラフ | メラトニンはレム睡眠行動障害の抑制に効果的でした | (119) |
| 50人のアルツハイマー病患者 | ランダム化されたプラセボ対照試験 | 10週間 | 朝の光曝露(2,500ルクス、1時間)および夕方の5mgのメラトニン(n = 16)またはプラセボ(n = 17)。対照被験者(n = 17)は、通常の室内光(150〜200ルクス)を受けた。 | 夜間睡眠変数、日中睡眠時間、日中活動、日中:夜間睡眠比、および休息活動パラメータは、アクチグラフを使用して決定された。 | 光線療法だけでは、夜間の睡眠、日中の覚醒、または休息活動のリズムは改善されなかった。光線療法とメラトニンは、日中の覚醒時間と活動レベルを増加させ、休息活動リズムを強化した | (120) |
| 41人のアルツハイマー病患者 | ランダム化されたプラセボ対照試験 | 10日間 | メラトニン(8.5mgの即時放出および1.5mgの持続放出)(N = 24)またはプラセボ(N = 17)を午後10時に投与 | アクチグラフ | プラセボと比較して、睡眠、概日リズム、または興奮に対するメラトニンの有意な効果はなかった | (121) |
14名のアルツハイマー病患者に6~9mg/日を2~3年間投与した別の研究では、睡眠の質が改善された(110)。夕暮れ症候群は2名の患者を除いて検出されなくなった。また、メラトニン投与により、認知機能の改善と健忘症の軽減が認められた。アルツハイマー病の一卵性双生児を36カ月間追跡調査した症例報告では、メラトニンを投与した双生児の睡眠と認知機能が改善したことが報告されている(111)。
メラトニンによる睡眠改善と日暮れの緩和の有効性は、アルツハイマー病患者を対象とした非盲検およびプラセボ対照試験で報告されている(107,112,113,115-120)。また、完全に進行したアルツハイマー病患者にメラトニンを投与した場合、否定的な結果が発表されている(114,121)。実際、アルツハイマー病患者では、睡眠や焦燥感に大きな個人差があることが多い。
アルツハイマー病におけるメラトニンの使用に関する発表結果のレビュー(122)では、睡眠改善、日暮れの減少、認知機能低下の改善におけるメラトニンの有効性の可能性を支持する7つの報告(公開研究5件、症例報告2件)(N = 89人の患者)が得られた。6件の二重盲検無作為化プラセボ対照試験(N=210人)では、4件(N=143人)で睡眠の質の向上、日暮れの減少、認知機能の改善が認められたのに対し、2件(N=67人)では有意な効果が認められなかった(122)。2つのメタアナリシスにより、メラトニン療法は認知症患者の睡眠改善に有効であるという見解が支持された(123, 124)。また、メラトニン作動薬であるラメルテオンは、集中治療室に入院している高齢患者のせん妄に有効であった(125)。
メラトニンが完全に発達したアルツハイマー病の治療に価値があるかどうかは、まだ定義されていない。留意すべき点は、今回調査したグループの病理学的不均一性は、おそらくこの段階では非常に高いということである。したがって、もっと早い段階で得られた情報の方が価値があるかもしれない。
MCIの患者は、日常活動の維持を伴う認知機能の欠損を有する。MCIから認知症への移行率は年間10〜15%と推定されているため、MCIはリスクのある人を特定し治療するための臨床的に重要な段階である(126)。
表3に示すように、MCI患者から発表されたデータでは、メラトニンの投与によって認知機能や睡眠の質が改善することが一貫して示されている。例えば、私たちは、35人のMCI患者に3~9mg/日のメラトニンを補助剤として最長2年間投与したところ、認知症状や抑うつ症状、睡眠の質が有意に改善したことを報告した(130)。MCIと診断された61人の外来患者にメラトニン3~24mgを1日1回、15~60ヶ月間投与したところ、Beck Depression Inventoryのスコアが有意に低下し、神経心理学的テストや睡眠・覚醒の主観的評価の成績が向上したことが報告されている(134)。表3の結果を総合すると、メラトニンは臨床の場でMCIの治療に有用な補助薬であることがわかる。
表3 メラトニンによるMCI患者の治療を含む研究
| 科目 | 設計 | 研究期間 | 処理 | 測定済み | 結果 | 参考文献 |
|---|---|---|---|---|---|---|
| MCIの10人の患者 | 二重盲検、プラセボ対照、クロスオーバー試験 | 10日間 | 就寝時に6mgのメラトニン経口/毎日 | アクチグラフ。神経心理学的評価 | メラトニンは休息活動のリズムを高め、睡眠の質を改善した。合計スリープ時間は影響を受けない。以前に学んだ項目を覚える能力は、落ち込んだ気分の大幅な減少とともに改善された | (132) |
| 加齢に伴うMCIの26人 | 二重盲検プラセボ対照パイロット試験 | 4週間 | 就寝時に1mgのメラトニンpoまたはプラセボ | ベースライン時と4週間時の睡眠アンケートと一連の認知テスト | メラトニン投与は、報告された朝の「安静」と夜行性覚醒後の入眠潜時を改善した。また、California Verbal LearningTest-干渉サブテストのスコアも改善された。 | (133) |
| 加齢に伴うMCIの354人 | ランダム化二重盲検プラセボ対照試験 | 3週間 | 就寝2時間前の徐放性メラトニン(サーカディン、2 mg)またはプラセボ | リーズの睡眠評価とピッツバーグ睡眠アンケート、臨床的グローバル改善スケールスコアと生活の質 | PR-メラトニンは、睡眠の質、朝の覚醒、入眠潜時、および生活の質の有意かつ臨床的に意味のある改善をもたらした。 | (134) |
| 60人のMCI外来患者 | 非盲検、後ろ向き研究 | 9〜24か月 | 35人の患者が就寝時に毎日3〜9mgの速放性メラトニン製剤を経口投与された。標準的な薬に加えてメラトニンが与えられた | 睡眠と覚醒の質の毎日のログ。初期および最終的な神経心理学的評価 | メラトニン治療を受けた患者では、異常に高いベックうつ病目録スコアが低下し、同時に覚醒状態と睡眠の質が改善した。メラトニンで治療された患者は、神経心理学的評価において有意に優れたパフォーマンスを示した | (135) |
| 加齢に伴う認知機能低下のある189人 | 長期、二重盲検、プラセボ対照、2×2階乗ランダム化試験 | 1〜3。5年 | 一日中明るい(1,000ルクス)または薄暗い(300ルクス)光による長期の毎日の治療。Evenin Gメラトニン(2.5 mg)を、またはプラセボ投与 | 認知および非認知症状、日常生活動作の制限、および6か月ごとに評価される副作用の標準化された尺度 | 光は認知機能の低下を弱め、抑うつ症状を改善した。メラトニンは入眠潜時を短縮し、睡眠時間を延長したが、うつ病のスコアに悪影響を及ぼした。明るい光とメラトニンの併用治療が最高の効果を示した | (108) |
| 加齢に伴う認知機能低下のある22人 | 前向き、無作為化、二重盲検、プラセボ対照、研究 | 2ヶ月 | 参加者は2ヶ月のメラトニン(5mg経口/日)と2ヶ月のプラセボを受け取りました | 睡眠障害は、ノースサイド病院睡眠医学研究所(NHS(英国保健医療局)MI)テストで評価された。行動障害は、Yesavage Geriatric DepressionScaleとGoldbergAnxietyScaleで評価された。 | メラトニン治療は睡眠の質のスコアを大幅に改善した。メラトニン投与後、うつ病も大幅に改善した | (136) |
| 25人のMCI外来患者 | 無作為化二重盲検プラセボ対照試験 | 12週間 | 11人の患者がメラトニン(10mg)とトリプトファン(190mg)を含むドコサヘキサエン酸-リン脂質の油性エマルジョンを受け取りました | 方向性と認知機能、短期および長期記憶、注意力、実行機能、視覚構築および視覚空間能力、言語、および気分の初期および最終的な神経心理学的評価 | MCIの高齢者は、プラセボと比較して、メラトニンとトリプトファンを含むDHA-リン脂質の油性エマルジョンを12週間補給すると、認知機能のいくつかの測定値に有意な改善が見られた。赤血球の抗酸化能力と膜脂質組成は治療後に改善された | (137、138) |
| 96人のMCI外来患者 | 非盲検、後ろ向き研究 | 15〜60か月 | 61人の患者が就寝時に毎日3〜24mgの速放性メラトニン製剤を経口投与された。標準的な薬に加えてメラトニンが与えられた | 睡眠と覚醒の質の毎日のログ。初期および最終的な神経心理学的評価 | メラトニン治療を受けた患者では、異常に高いベックうつ病目録スコアが低下し、同時に覚醒状態と睡眠の質が改善した。メラトニンで治療された患者は、神経心理学的評価において有意に優れたパフォーマンスを示した。メラトニンで治療された61人の患者のうち6人だけがベンゾジアゼピンの併用治療を必要としたのに対し、メラトニンを投与されていない35人のMCI患者のうち22人 | (139) |
| 不眠症の併存症の有無にかかわらず、軽度から中等度のアルツハイマー病と診断され、標準治療(メマンチンの有無にかかわらずアセチルコリンエステラーゼ阻害剤)を受けている80人の患者 | ランダム化二重盲検並行群間試験 | 28週間 | 患者はプラセボで2週間治療され、その後ランダム化(1:1)されて、2 mgの徐放性メラトニンまたはプラセボを24週間毎晩投与され、その後2週間のプラセボが投与された。 | アルツハイマー病評価尺度-認知(ADAS-Cog)日常生活動作(手段的日常生活動作(I日常生活動作))ミニメンタルステート検査(MMSE)ピッツバーグ睡眠品質指数(PSQI)および毎日の睡眠日誌によって評価される睡眠、および安全パラメータが測定された | メラトニンで治療された患者は、プラセボで治療された患者よりも有意に優れた認知能力を示した。PSQI、コンポーネント4で測定した睡眠効率も優れてた。治療期間が長いほど、違いはより顕著でした | (140) |
| 大うつ病性障害のDSM-IV-TR基準を満たす142人の患者が登録された | 二重盲検、プラセボ対照、ランダム化試験 | 6週間 | 併用療法:(ブスピロン15mgとメラトニン-3mg)vs。ブスピロン15 mg単剤療法、vs。プラセボ | ベースライン、2週目、4週目、および6週目のエンドポイントでの重症度(CGI-S)および改善(CGI-I)QIDS-SR16,および不安のハミルトン評価尺度(Ham-A)の臨床的グローバル印象 | 治療の割り当てに関係なく、治療応答者は非応答者よりも総CPFQで有意に改善した。CPFQスコアの認知的側面は、他の2つのグループよりも併用療法を支持した | (141) |
| 65歳以上の139人の患者。股関節形成術が予定されている年齢 | 前向きコホート研究 | 7日 | 患者は、手術の1日前の就寝時刻の1時間前、および術後さらに5日間連続して、1mgの経口メラトニンまたはプラセボを毎日投与するように無作為化された。 | ミニメンタルステート検査(MMSE)スコア、主観的な睡眠の質、一般的な幸福、術後の倦怠感、および痛みの視覚的アナログ尺度を含む被験者の評価を、術前および1,3,5,7日目に評価した。手術後 | 対照群のMMSEスコアは手術後に有意に減少した。メラトニングループのMMSEスコアは、7日間のモニタリングの間変化しないであった。さらに、メラトニン群と比較した場合、主観的な睡眠の質、一般的な幸福、および倦怠感の有意な術後障害が対照群で見られた。 | (142) |
MCI患者におけるメラトニンの治療効果を説明するメカニズムは、まだ定義されていない。高齢者における徐波睡眠の促進は、睡眠の回復期に関連するリンパ系の機能、または成長ホルモンや神経トロフィンの分泌を増加させることにより、MCIに有益である可能性がある。
メラトニンがMCIの予防や治療に効果があるかどうかは、さらなる分析が必要である。認知症の予防薬としてのメラトニンの可能性と有用性を探り、さらに調査するためには、多施設二重盲検試験が必要である。使用するメラトニンの用量は、表1に示すように、前臨床データから得られたメラトニンのヒトへの等価用量を考慮して再評価する必要がある。残念ながら、PubMed(ClinicalTrials.gov Search results 01/03/2019)に掲載されている初期状態のメラトニンに関連する64の臨床試験(募集中および非募集中)のうち、このクエリに向けられたものはない。
PDモデル動物におけるメラトニン活性の研究
黒質部(SNpc)におけるドーパミン(DA)を含むニューロンの進行性変性は、パーキンソン病を特徴づける(143)。レビー小体は、DAニューロンだけでなく、脳幹のノルアドレナリン系ニューロン、瀬状核のセロトニン系ニューロン、特定のコリン系ニューロンにも見られることから、パーキンソン病は様々な神経伝達系に影響を及ぼす進行性の疾患であると考えられている。このことは、泌尿器系、消化器系、呼吸器系、循環器系の障害、無嗅覚症、精神神経系、視覚系、睡眠系の障害など、パーキンソン病の非運動症状の多さを説明している。実際、パーキンソン病の非運動性の前臨床段階は20年以上に及ぶこともあり、この点で神経保護の関連性が明らかになっている(144)。
パーキンソン病の病因に見られる炎症サインには、ミクログリアの活性化、アストログリア症、リンパ球の浸潤などがある(145)。NF-κB、インターロイキン(IL)-1,IL-6,Cox-2,腫瘍壊死因子-α、iNOS、インターフェロン-γなどのいくつかの炎症性メディエーターは、グリア細胞によって産生される(2)。
パーキンソン病をはじめとするレビー小体病は、線維状のα-シヌクレインが凝集することが特徴である(146)。タンパク質の折り畳みと凝集はフリーラジカルによって促進されるため、ミトコンドリアの機能障害がこのプロセスに関与している(147, 148)。
脳内DA機能の変化の動物モデルを開発するために、6-ヒドロキシドーパミン(6-OHDA)や神経毒である1-メチル-4-フェニル-1,2,3,6テトラヒドロピリジン(MPTP)をラットの黒質線条体経路に注射した(149)。
MPTPは,ヒトやヒト以外の霊長類にもパーキンソン病を引き起こす可能性があるため,動物モデルでパーキンソン病を再現するには,他の神経毒の中でもMPTPが好まれる。MPTPはアストロサイトに選択的に取り込まれ、メチル1-4フェニルピリジニウム(MPP+)に代謝され、この陽イオンはフリーラジカルの生成を増加させ、ATPを枯渇させ、アポトーシスを引き起こす。MPTPの毒性はSNpcニューロンに選択的に作用し、非ヒト霊長類では線条体スパインの消失を引き起こした(150)。このような線条体スパインの消失は、パーキンソン病のヒトの死後脳における一貫した神経病理学的所見である。MPTP処理したサルは、パーキンソン病の最良の実験モデルと考えられているが、黒質線条体ドーパミン系以外の神経細胞の消失が一貫して見られないのが大きな欠点である(151)。
表4には、パーキンソン病のいくつかの実験モデルにおけるメラトニンの生体内試験効果が示されている。ほとんどの実験で、実験的パーキンソン病の予防と治療におけるメラトニンの役割が支持されている。表1の場合と同様に、パーキンソン病患者の場合と比較するために、体表面積を正規化して算出した75kgの成人に対するメラトニンのヒト等価投与量を引用している(54)。ここでも、動物実験のデータから得られた理論上のヒト等価投与量は、ヒトでの使用量よりもかなり大きい。
表4 パーキンソン病の動物モデルにおけるメラトニンの生体内試験効果。
| 参考文献 | 設計 | 結果 | 75kgの成人に対するメラトニンのヒト等価用量 |
|---|---|---|---|
| バートン等。(152) | SNcへの6-OHDA注射を受けたウィスターラットをメラトニン(1および10 mg / kg、ip)で治療した。 | メラトニン治療は、アポモルヒネ誘発性の回転行動を抑制した | 12および120mg |
| Acuña-Castroviejoetal。(153) | MPP +の注射を受けたC57BL / 6マウスは、メラトニン(10 mg / kg、ip)で治療された。 | メラトニン治療は、線条体におけるMPTP誘発脂質過酸化およびTH陽性ニューロン喪失を防止した | 60mg |
| ジンら (154) | SNcにMPP +を注射したSprague-Dawleyラットをメラトニン(10 mg / kg、ip)で治療した。 | メラトニン治療は脂質過酸化を減少させ、MPP +によって誘発されるDAニューロンの喪失から保護した | 120mg |
| Joo etal。(155) | 線条体に6-OHDA注射を受けたSprague-Dawleyラットにメラトニン(3および10 mg / kg、ip)を投与した。 | メラトニン治療は、線条体のDA合成とレベルの6-OHDA誘発性変化を打ち消した | 36および120mg |
| キムら (156) | 線条体への6-OHDA注射を受けたSprague-Dawleyラットをメラトニン(3または10 mg / kg、ip)で治療した。 | メラトニン治療は運動障害を軽減し、ドーパミン作動性ニューロンの6-OHDA誘発性喪失から保護した | 36および120mg |
| Dabbeni-Sala etal。(157) | SNcへの6-OHDA注射を受けたSprague-Dawleyラットをメラトニン(50±7.5μg/ h、sc)で治療した。 | メラトニン治療は、アポモルヒネ誘発性の回転行動とミトコンドリア損傷を防ぎました | 15mg |
| Aguiar etal。(158) | 線条体に6-OHDA注射を受けたウィスターラットにメラトニン(2,5,10,および25 mg / kg、ip)を投与した。 | メラトニン治療は、アポモルヒネ誘発性の回転行動と線条体DAおよびセロトニンレベルの枯渇を防ぎました | 24〜300 mg |
| Chen etal。(159) | MPP +の注射を受けたウィスターラットをメラトニン(10mg / kg、ip)で治療した | メラトニンはMPP +誘発毒性を減少させ、GSHレベルを回復させた | 120mg |
| Khaldy etal。(160) | MPP +の注射を受けたC57BL / 6マウスは、メラトニン(5または10 mg / kg ip)で治療された。 | メラトニンは黒質線条体ニューロンのミトコンドリア複合体I活性の損傷を保護した | 30および60mg |
| シャルマ等。(161) | 線条体に6-OHDA注射を受けたSprague-Dawleyラットを、飲料水中のメラトニン(4μg/ mL)で処理した。 | メラトニンは運動障害を正常化し、TH免疫反応性を増強した | 6mg |
| シン等。(162) | 線条体への6-OHDA注射を受けたSprague-Dawleyラットをメラトニン(0.5mg / kg、ip)で治療した。 | メラトニン治療は、アポモルヒネ誘発性の回転行動を防ぎました | 6mg |
| サラバナンら (163) | Sprague-DawleyラットにロテノンをSNに注射した。メラトニン(10,20,または30 mg / kg)を腹腔内投与した | メラトニンはミトコンドリアのヒドロキシルラジカルのレベルを低下させ、SNのGSHレベルと抗酸化酵素活性を保護した | 120,240,および360 mg |
| Huang etal。(164) | MPP +の注射を受けたウィスターラットをメラトニン(10mg / kg、ip)で治療した | メラトニンは、MPP +によって誘導されるアポトーシスからDAニューロンを保護した | 120mg |
| Tapias etal。(165) | C57BL / 6マウスはMPTPの単回注射を受けた。メラトニン(20mg / kg)を皮下投与した | メラトニン治療は、MPTPによるミトコンドリアのNO増加を防ぎ、脂質過酸化を抑制し、線条体とSNcの複合体I活性を保護した。 | 120mg |
| Patki etal。(166) | C57BL / 6マウスはMPTP腹腔内注射を5週間受けた。メラトニン(5mg / kg)を腹腔内投与した | メラトニンは、MPTPによって誘発されるDAニューロンの喪失と自発運動の欠損から保護し、SNcのミトコンドリア呼吸、ATP産生、および抗酸化酵素レベルを回復させた。 | 30mg |
| Singhal etal。(167) | マネブとパラコートで治療されたスイスのマウスは、メラトニン(30 mg / kg / day、ip)を投与された。 | メラトニン治療は脂質過酸化とTH陽性ニューロンの変性を保護し、アポトーシスを防ぎました | 180mg |
| Gutierrez-Valdez etal。(168) | 内側前脳束への6-OHDA注射を受けたウィスターラットをメラトニン(10mg / kg、経口)で治療した。 | メラトニン治療は、ジスキネジアを引き起こすことなく運動能力を改善した。メラトニンはまた、TH陽性ニューロンと線条体のニューロンの超微細構造を保護した | 120mg |
| Brito-Armas etal。(169) | SNcに変異型ヒトα-シヌクレインをコードするレンチウイルスベクターを注射したSprague-Dawleyラットは、メラトニン治療(10 mg / kg / day、ip)を受けた。 | メラトニン治療はTH陽性ニューロンの喪失を防ぎました | 120mg |
| Zaitone etal。(170) | スイスのマウスはMPTPの4回の注射を受けた。メラトニンは経口投与された(5または10mg / kg /日) | メラトニン治療は、運動能力、線条体DAレベル、GSH、および抗酸化酵素活性を回復し、脂質過酸化を減少させた。メラトニンはL-ドーパに対する運動反応を改善した | 30および60mg |
| Bassani etal。(171) | Wistarラットにロテノンを腹腔内注射した。メラトニン(10mg / kg)を腹腔内投与した | メラトニン治療は、SNcおよびDAの線条体レベルのTH陽性ニューロンを保護する | 120mg |
| Yildirim etal。(172) | 内側前脳束への6-OHDA注射を受けたウィスターラットをメラトニン(10mg / kg、ip)で治療した。 | メラトニンはドーパミン作動性ニューロンの酸化的損傷とアポトーシスを防ぎました | 120mg |
| Naskar etal。(173) | MPTPで治療されたBALB / cマウスは、メラトニン(10,20,または30 mg / kg、ip)を投与された。 | メラトニンは、SNcにおけるMPTP誘発性のTH陽性ニューロンの喪失から保護し、L-DOPAの治療効果を高めた | 60,120,および180 mg |
| Ozsoy etal。(174) | 内側前脳束に6-OHDA注射を受けたウィスターラットをメラトニン(10mg / kg /日、ip)で治療した。 | メラトニン治療は、抗酸化酵素活性と脂質過酸化の変化からDAニューロンを保護した | 120mg |
| Carriere etal。(175) | SpragueDawleyラットにロテノンを注射した。メラトニン(4.0μg/ mL)は飲料水で与えられた | メラトニン治療は、ロテノン後の線条体とSNcの運動障害とTH陽性ニューロンの喪失を保護した | 6mg |
| Li etal。(176) | WistarラットにSNcおよび腹側被蓋野に6-OHDAを注射し、メラトニン(5 mg / kg)を腹腔内注射した。 | メラトニンはDAニューロンの損傷を防ぎました | 60mg |
| Lopez etal。(177) | MPTPを受けているC57BL / 6マウスにメラトニン(10 mg / kg sc)を投与した。 | メラトニン投与は、その抗炎症特性とは無関係に、ミトコンドリアの酸素消費の混乱を防ぎ、NOS活性を増加させ、MPTPによって誘発される自発運動を減少させた。 | 60mg |
| ポール等。(178) | SNcにホモシステインを注射したウィスターラットは、メラトニン治療(10,20,または30 mg / kg / day、ip)を受けた。 | 黒質のDA喪失から保護されたメラトニンの治療とSNにおけるミトコンドリア複合体I活性の改善 | 120,240,および360 mg |
体重75kgの成人に対するメラトニンのヒト換算投与量は、体表面積で正規化して算出している(54)。
表4にまとめた研究のほとんどは、メトキシインドールによる前処理を行っているため、メラトニンの神経保護作用がドーパミン神経細胞の死滅を防ぎ、その結果として運動機能障害が発生することに依存している(表4)。さらに、パーキンソン病の動物モデルにおいて、神経変性の防止とは関係なく、メラトニン投与による運動機能の改善を観察できなかった研究もある。例えば、Bassaniらは、メラトニンを28日間投与したところ、チロシンヒドロキシラーゼ陽性ニューロンとDAレベルが保たれ、ロテノン浸潤ラットの抑うつ様行動が改善されたが、運動機能障害は有意に改善されなかったと報告している(171)。
パーキンソン病患者では、メラトニン3mgを4週間投与することで、睡眠の質が改善されたが、運動症状には影響がなかった(179)。さらに、WillisとArmstrong(180)は、6-OHDAまたはMPTPを注射したラットに、徐放性メラトニン製剤を脳室内に投与して効果を評価したところ、メラトニンは確かに運動能力を悪化させたと報告している。驚くべきことに、他の研究では、メラトニン受容体のアンタゴニストであるML-23を投与したところ、パーキンソン病の動物モデルの運動障害が増強されたことが報告されている(181)。パーキンソン病の運動症状に対するメラトニン拮抗薬の有益な効果は、メトキシインドールによるDA放出の抑制によって説明できる(182)。
これらの矛盾にかかわらず、PD関連の神経変性に対するメラトニンの予防活性は一般的に認められている(183-185)。例えば、メラトニンはα-シヌクレインの形成を阻害し、カイニン酸による神経毒性(186)や亜ヒ酸によるアポトーシス(187)を抑制した。また、メラトニンは、アンフェタミン投与後のDA含有ニューロンにおけるα-シヌクレインの発現増大を抑制した(188,189)。メラトニンはα-シヌクレインのフィブリル形成を阻害し、プロトフィブリル形成と二次構造転移を抑制し、α-シヌクレインの細胞毒性を低下させることにより、既に形成されたフィブリルを不安定にした(169, 190)。
オートファジーとリソソームのネットワークによるクリアランスが不十分であれば(146)神経毒性を持つα-シヌクレインのオリゴマーの蓄積と拡散を説明することができる。さらに、ユビキチン-プロテアソームシステム、シャペロンを介したオートファジー、プロテアーゼによる細胞外クリアランス、リンパ系を介した一般循環への流入など、他のクリアランス経路が損なわれる(146)。
以上のように、リンパ系による老廃物の除去は、脳の回復プロセスに大きく貢献している。グリンパティック系におけるAQ4水チャネルの役割は極めて重要であると思われるが、驚くべきことに、パーキンソン病の脳ではAQ4の発現が著しく低下している(191)。脳脊髄液のα-シヌクレインレベルがパーキンソン病患者の症状と逆相関しているのはこのためであろう(192)。急速眼球運動による睡眠行動障害(RBD)は、パーキンソン病の前駆症状であるため、睡眠不足と血流クリアランスの障害との関連は、パーキンソン病の場合には重要である。動物にメラトニンを投与すると、グリンパクリアランスが増大し(101)、患者の睡眠も維持される。不思議なことに、メラトニンは、脳内の異常なタンパク質クリアランスに影響を与える無数の薬剤の中には含まれていなかった(146)。
症状的には、パーキンソン病の有効な治療法は、血液脳関門を通過するDAの前駆体であるL-ジヒドロキシフェニルアラニン(L-DOPA)を補充することである。しかし、-L-DOPAの長期投与は、ジスキネジアなどの運動性の副作用を引き起こす(193, 194)。さらに、L-DOPAを大量に投与すると、6-OHDAのような神経毒分子が生成される。そのため、L-DOPAの摂取量を減らしたり、副作用を補ったりする努力が求められている。MPTP処理マウスでは、L-DOPAではなくメラトニンが線条体の脊柱密度を回復させたことから、パーキンソン病におけるL-DOPA療法のアジュバントとしてメラトニンを適用することが支持されている(173)。
パーキンソン病におけるメラトニンの臨床使用
パーキンソン病の運動症状を明らかにするためには、SNpcのドーパミン作動性細胞の約3/4が失われる必要がある。しかし、低嗅覚、抑うつ、RBD(レム睡眠時に鮮明で激しい動きをすることが特徴)などの非運動症状は、パーキンソン病の発症に何年も先行しており、予後を悪くする指標となる(144)。実際、RBDを示す患者の65%までが、10〜13年後にパーキンソン病を発症している(195)。
表5は、パーキンソン病におけるメラトニンの使用を報告した臨床研究をまとめたものである。就寝時に3~12mgのメラトニンを毎日投与することで、RBDの治療に有効である(198~206)。メラトニンを投与したRBD患者の睡眠ポリグラフ(PSG)では、アトニアを伴わないRエポックの数とレム睡眠中の動作時間が有意に減少し、クロナゼパムを投与した患者で見られたR睡眠中の筋緊張の持続とは対照的であった。これらのデータに基づき、RBDにおけるメラトニンの使用をレベルBで推奨する臨床的コンセンサスが得られた(207)。
表5 メラトニンによるPDおよびRBD患者の治療を含む研究
| 科目 | 設計 | 研究期間 | 処理 | 測定済み | 結果 | 参考文献 |
|---|---|---|---|---|---|---|
| 40人のパーキンソン病患者 | 非盲検プラセボ対照試験 | 2週間 | 就寝時に5〜50mgのメラトニンを1日1回経口投与。すべての被験者は、安定した用量の抗パーキンソン病薬を服用していた | アクチグラフ | アクチグラフによって明らかにされたように、プラセボと比較して、50mgのメラトニンによる治療は夜間の睡眠を有意に増加させた。50mgまたはプラセボと比較して、5mgのメラトニンの投与は主観的な報告で睡眠の有意な改善と関連していた | (196) |
| 18人のパーキンソン病患者 | 非盲検プラセボ対照試験 | 4週間 | 就寝時に3mgのメラトニン経口/毎日 | 睡眠ポリグラフ検査(PSG)。ピッツバーグ睡眠品質指数とエプワース眠気尺度による主観的評価 | 最初の評価では、14人の患者が質の悪い睡眠EDSを示した。入眠潜時の増加(50%)アトニーのないレム睡眠(66%)睡眠効率の低下(72%)がPSGで見られた。メラトニンは主観的な睡眠の質を大幅に改善した。運動機能障害はメラトニンを使用しても改善されなかった | (179) |
| 認知症を伴わず、睡眠障害を訴えるパーキンソン病患者38人 | 非盲検試験 | 6週間 | グループ1(n = 20)は、以前のドーパミン作動性グループ2(n = 18)に加えて3 mgのメラトニンを投与され、夜間に2mgのクロナゼパムを投与された。 | ベースライン時および試験終了時の睡眠ポリグラフ検査(PSG)。PD睡眠尺度(PDSS)およびエプワース眠気尺度(ESS)による主観的評価。MMSE、5単語テスト、桁スパン、ハミルトンスケールを使用した神経心理学的テスト | ベースラインと比較して、メラトニンとクロナゼパムは患者の睡眠障害を軽減した。日中の眠気(ESS)は、クロナゼパム群で有意に増加した。メラトニンで治療された患者は、クロナゼパム群と比較して、研究期間の終わりに、MMSE、5単語テスト、ハミルトンスケールでより良いスコアを示した。6週目の終わりのPSGの合計ポイントスコアの変化は、メラトニンで治療されたグループに有利でした | (197) |
| 1人のRBD患者 | 症例報告 | 5ヶ月 | 就寝時に3mgのメラトニン経口/毎日 | アクチグラフ、PSG | アクチグラフによって測定されるように、睡眠中の運動活動の有意な減少。2ヶ月の治療後、PSGはレム睡眠の増加を除いて大きな変化を示さなかった | (198) |
| 6人の連続したRBD患者 | 非盲検の前向き症例シリーズ | 6週間 | 就寝時に3mgのメラトニン経口/毎日 | PSG | 1週間以内に5人の患者でPSGが大幅に改善し、治療終了後も数週間または数か月間延長された。 | (199) |
| 14人のRBD患者 | 非盲検の前向き症例シリーズ | 変数 | 就寝時に3〜9mgのメラトニンを1日1回経口投与 | PSG | 13人の患者とそのパートナーは、メラトニン投与後の問題のある睡眠行動に対する抑制効果に気づいた。PSG所見における%強壮レム活動はメラトニン投与後に減少した。10人のRBD患者のメラトニン濃度は最大値で30pg / mL未満であり、メラトニン分泌が少ない平均33.5 pg / mLRBD患者はメラトニン療法に反応する傾向があった。 | (200) |
| 14人のRBD患者 | 後ろ向き症例シリーズ | 14ヶ月 | 就寝時に3〜12mgのメラトニンを1日1回経口投与 | PSG | 8人の患者が12ヶ月の治療を超えてメラトニンの継続的な利益を経験した | (201) |
| 45人のRBD患者 | 後ろ向き症例シリーズ | すべて最初はクロナゼパムで治療された。メラトニンを使用した場合、就寝時に1日10mgを経口投与した。 | 21人の患者がクロナゼパムを服用し続け、8人が別の薬を使用し、4人が症状を適切に制御するために薬の組み合わせを必要とした | (202) | ||
| 25人のRBD患者 | 後ろ向き症例シリーズ | 27〜53か月 | 就寝時に6mgのメラトニン経口/毎日 | クロナゼパムで治療されたRBD患者(n = 18)と比較して、メラトニンを投与された患者は、傷害が大幅に減少し、副作用が少ないと報告した。 | (203) | |
| 8人のRBD患者 | 二重盲検プラセボ対照試験 | 4週間 | 就寝時にメラトニン3mgを1日1回経口投与。 | PSG | アトニーのないレム睡眠の30秒エポックの数の減少とRBDエピソードの頻度の減少 | (204) |
| 1人のRBD患者 | 症例報告 | 5年 | 就寝時に2mgの徐放性メラトニンを毎日経口投与 | PSGおよびDAトランスポーターシンチグラフィー(DaTSCAN) | 当時72歳の男性は 2011年にパーキンソン病に罹患していると臨床的に疑われた。DaTSCANはDAトランスポーター密度の低下を明らかにし、PSGはRBDの診断を確認した。メラトニン治療の6か月後、RBDの臨床的兆候は見られなかった。2014年のコントロールPSGは、アトニーを伴う正常化されたレム睡眠を確認した。2013年と2015年に追加のDaTSCANが実行され、DAトランスポーター密度の正規化が示された | (205) |
| 閉塞性睡眠時無呼吸を併発している4人のRBD患者 | オープンラベル | 4週間 | 就寝時に2mgの徐放性メラトニンを毎日経口投与 | PSG | 治療により、すべての患者でRBD症状の関連する臨床的改善がもたらされたが、これまでのところ、睡眠関連の呼吸障害の治療は行われていない。アトニー発生のないレム睡眠は、おそらく未治療の併存疾患のために高かった。 | (206) |
特発性RBDからPDへの移行率の高さに基づいて、RBDにおける神経保護剤の臨床試験を求める意見もある(195)。実際、クロナゼパムを投与されたRBD患者のシヌクレイノパシーへの転換率は高い(208, 209)。メラトニン治療を受けたRBD患者に匹敵するデータはまだないが、KunzとBesによる最近の観察結果は考慮に値する(205)。この研究者らは、72歳の男性RBD患者に1日2mgの徐放性メラトニンを投与したところ、DAトランスポーター密度(DAトランスポーター・シンチグラフィーで評価)が数年にわたって増加したことを報告した。6ヶ月間の緩やかな改善の後、RBDの臨床的およびPSG的徴候は消失した。メラトニン投与前のスキャンでは明らかにパーキンソン病の兆候が見られたのに対し、2年後に記録されたスキャンでは境界線上にあると考えられ、最初のスキャンから4年後にはパーキンソン病の兆候は全く見られなかった。この結果は、メラトニンがシヌクレイノパシーにおいて神経保護的な役割を果たしている可能性があると解釈された(205)。
L-DOPA治療を受けたパーキンソン病患者では、夜間のメラトニン分泌が段階的に増加することが報告された(210, 211)。L-DOPA治療を受けた患者は、おそらく神経変性に対する適応反応として、昼間のメラトニン分泌が増加した(211)。パーキンソン病における過剰な眠気の原因として概日機能障害を調べることを目的とした研究では、メラトニンの概日リズムの鈍化が報告された(212)。パーキンソン病患者ではメラトニンリズムの振幅が減少しており、主に日中の過剰な眠気を呈していた。したがって、メラトニンや明るい光を時間差で浴びるなど、サーカディアン機能を改善するための時間生物学的アプローチは、パーキンソン病の非運動症状に対する補助療法として役立つ可能性がある。
メラトニンと線条体のモノアミン(DA、セロトニン)との相互作用の可能性を介して、パーキンソン病の運動性変動と循環メラトニンレベルの日内変動との関連性が推測されている(213)。パーキンソン病患者の半数近くが、治療開始から5年後にL-DOPAによる運動合併症を発症した。上述の実験的パーキンソニズムで得られた結果を考慮すると、パーキンソン病におけるL-DOPAの治療量を減らすための補助剤としてメラトニンを使用することは検討に値する(214)。
淡蒼球を刺激すると、パーキンソン病患者の運動症状や合併症が改善し、日中の血漿メラトニン濃度の上昇が抑制されることから、パーキンソン病におけるウェアリングオフ現象は、メラトニンの運動抑制効果の喪失と関連している可能性がある(215)。本レビューの主題に関連して、遺伝的感受性と生活習慣の要因(例えば、喫煙)が、夜勤の勤務年数が長いとパーキンソン病のリスクが減少し、メラトニンレベルが低下するという疫学的事実を説明するために取り入れられている(216)。
パーキンソン病患者は、扁桃体と黒質におけるメラトニンMT1およびMT2受容体密度の低下を示した(217)。パーキンソン病で見られる睡眠・覚醒サイクルの変化にメラトニン作動系の乱れが関与している可能性を裏付けるものとして、パーキンソン病患者40人を対象に行われたアクチグラフ研究では、メラトニン(50mg/日、就寝時)が夜間の睡眠を増加させることが示された。5mgのメラトニンを服用した患者では、主観的に評価した睡眠の有意な改善が報告された(196)。
別の研究では、18人のパーキンソン病患者が基礎PSGを実施した後、メラトニン(3mg)またはプラセボを4週間、就寝1時間前に投与するよう無作為に割り付けられた(179)。メラトニンは主観的な睡眠の質を有意に改善したが、運動機能障害は改善されなかった(179)。
パーキンソン病のMPTPサルモデルで行われた重要な実験的研究では、PSGでモニターした睡眠障害に対するメラトニンとL-DOPAの効果が評価された(218)。メラトニンとL-DOPAを併用することで、MPTP治療を受けたサルで見られた夜間の睡眠の断片化と日中の睡眠エピソードが有意に抑制されたことから、メラトニン治療はパーキンソン病患者の睡眠障害を治療する可能性があることが示された。
就寝前に1〜1.5時間の光照射(1,000〜1,500ルクス)を行うことで、パーキンソン病患者の徐脈や硬直が減少し、興奮や精神的な副作用も減少した(219)。著者らは、明るい光でメラトニンの分泌を抑制することで、パーキンソン病の症状を治療する価値があるかもしれないと結論づけている(220)。しかし、光線療法を受けたうつ病患者に見られるように、人工光が治療効果を発揮するメカニズムは、メラトニン分泌の抑制だけではない可能性がある(221)。いずれにしても、概日リズムは、パーキンソン病の新たな診断・治療ターゲットと考えられている(212, 222)。
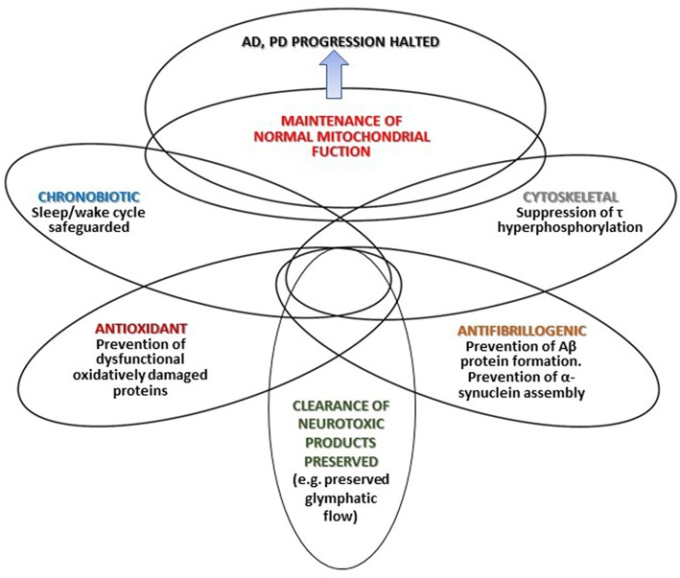
図1は、メラトニンがアルツハイマー病およびパーキンソン病の進行を止める可能性のあるさまざまなメカニズムをまとめたものである。図中に描かれた交点は、メラトニンの複数の効果と、本文で述べたさまざまな重なり具合(相互関係や相互影響)を表している。
図1 メラトニンがアルツハイマー病およびパーキンソン病の進行を止める可能性のあるさまざまなメカニズム
おわりに
メラトニンには催眠作用と睡眠作用があることから、不眠症の治療に使用することが推奨されている(223, 224)。いくつかのメタアナリシスがこのような治療的役割を支持している(225-227)。不眠症のエビデンスに基づく治療に関するBritish Association for Psychopharmacologyのコンセンサスでは、55歳以上の患者に催眠薬が適応される場合、メラトニンが第一選択の治療法であると結論づけられている(228)。
この記事で述べたように、2~5mgのメラトニンを1日に使用した研究は、動物実験から得られた神経変性保護のデータと適切に比較するには不適当である。メラトニンは極めて毒性が低く、その安全性は非常に高い。メラトニンを腹腔内注射した場合の致死量50(LD50)は、マウスで1,131mg/kg、ラットで1,168mg/kgであった。しかし、ラットでは3,200mg/kgまでのメラトニンを経口投与しても、ラットおよびマウスでは1,600mg/kgまでの皮下注射をしても、LD50は構築できなかった(229)。ヒトでは、メラトニンの安全性は高く、通常は極めて良好な忍容性を示している(表6)。現在のところ、細胞保護剤としてのメラトニンの使用に関心のある現職の医師にとっての唯一の選択肢は、この薬剤の適応外である。
表6 メラトニンの適応外処方の安全性
| 臨床状態 | メラトニン投与量 | 参考文献 |
|---|---|---|
| 皮膚の色素沈着過剰 | 1g /日poで1ヶ月 | (230) |
| パーキンソン病 | 0.25および1.25mg / kg iv | (231) |
| 筋萎縮性側索硬化症 | 60mg /日経口13ヶ月 | (232) |
| 筋萎縮性側索硬化症 | 300mg /日、2年間直腸 | (233) |
| 筋ジストロフィー | 70mg /日で9ヶ月 | (234) |
| 多発性硬化症 | 4年間50〜300mg /日経口 | (235) |
| 肝臓手術 | 50mg / kg | (236) |
| 健康な人 | 80mg / hで4時間 | (237) |
| 健康な女性 | 300mg /日で4ヶ月 | (238) |
| 健康な人の用量増加 | 10〜100 mg po | (239) |
| 健康な人の用量増加 | 10〜100 mg po | (240) |
適応外薬とは、例えば米国のFood and Drug Administrationのように、認可された医薬品を登録、管理、モニタリングする行政機関が記載した適応症や用法用量に含まれない薬物使用と定義されている(241)。ラベル外医薬品の使用は、集中治療室、小児科、精神科、腫瘍科でよく見られる(242-245)。一般的に、適応外医薬品の使用を禁止する法律はなく、ほとんどの法律で適応外医薬品の処方が法的に認められている(246)。
アルゼンチンでは、1995年に医薬品・食品・医療技術庁(ANMAT)が、メラトニン(3mgのカプセルまたは錠剤)を市販薬として承認した。2017,ANMATは、メラトニン2mgの徐放性製剤(CircadinR)を処方薬として認可した。ANMATは、パッケージのリーフレットに記載されていない適応症に対する薬の使用を認可することはできないが、他の臨床状況に対する薬の適応が禁止されているわけではない。ANMATによると、適応外処方は、「主治医が、経験と利用可能な科学的知識に基づいて、治療の基準がないか、あっても入手が非常に困難な健康問題に対する答えを提供する必要性に駆られて、専門的な活動を十分に発揮して行う唯一の責任」とされている。
多くの国で、メラトニンはサプリメントや栄養補助食品として使用されている。実際、欧州食品安全機関(EFSA)は、メラトニンが入眠潜時を短縮するというヘルスクレームを支持している(247,248)。このように、メラトニン、メラトニンを多く含む食品やバイオエキスの開発が可能になった。
植物にメラトニンを過剰発現させると、種子の発芽が促進され、植物を生物的・非生物的ストレスから保護することができ(249-251)遺伝子操作された植物は人間の栄養学に利用できる可能性がある。これと並行して、メラトニンの長期使用による毒性を評価する必要がある。
結論として、動物実験から、神経変性疾患のようにメラトニンの潜在的に有用な効果のいくつかは、明らかになるには大量のメラトニンを必要とする。動物モデルや細胞モデルでメラトニンがどのように作用するかについての実験データがどれだけ集められても、ほとんどの場合、メラトニンが時間生物学的薬剤として作用するのか、内因性抗酸化物質として作用するのか、あるいは免疫調節化合物として作用するのかはわかっていない。これは検討に値する重要な注意点である(252)。
メラトニンは極めて毒性が低く、成人での安全性は非常に高いのであるが、メラトニンがラットの新生児下垂体性腺刺激ホルモンからのLH分泌を阻害することが知られていることを考慮すると、子供へのメラトニンの使用には注意が必要である(253)。ヒトで同様の効果がまだ報告されていないとしても、高用量の外因性メラトニンの投与が生殖系の発達に影響を及ぼす可能性は否定できない。
