Contents
Mechanism of neuroprotection by trehalose: controversy surrounding autophagy induction
www.nature.com/articles/s41419-018-0749-9
要旨
トレハロースは、2つのグルコース分子がα,α-1,1-グルコシド結合で連結された非還元性二糖類である。トレハロースは、特にパーキンソン病やハンチントン病などの様々な神経変性疾患の動物モデルにおいて、神経保護の役割を果たしていることから、過去数十年にわたり注目されていた。
トレハロースの神経保護効果の根底にあるメカニズムについては、未だ解明されていない。一般的な仮説は、トレハロースがオートファジーを誘導し、それによってタンパク質の凝集体を除去することで神経細胞を保護するというものである。いくつかの動物実験では、神経変性疾患モデルにおいて、トレハロース投与後にオートファジーの活性化とタンパク質凝集体の減少が示され、オートファジー誘導仮説を支持しているように思われる。
しかし、細胞を用いた研究では、トレハロースがオートファジーを誘導し、タンパク質凝集体を減少させるとする研究が多いものの、オートファジー誘導説の根拠となる十分な証拠が得られていないという弱点がある。さらに、オートファジーのフラックスを徹底的に調べた最近の研究では、トレハロースがオートファゴソームからオートリソソームへのフラックスを阻害することが示されており、オートファジーに対するトレハロースの直接的な効果についての論争が巻き起こっている。
本総説では、トレハロースの基本的な性質と神経変性疾患への影響に関する研究をまとめた。また、オートファジー誘導説に関連する論争についても議論し、トレハロースが神経保護にどのように作用するのかを説明しようとする。
事実
- トレハロースは、パーキンソン病やハンチントン病などの様々な神経変性疾患の動物モデルにおいて、神経保護作用を示すことが示されている。
- トレハロースによる神経保護のメカニズムについては、オートファジー誘導と凝集体クリアランスが主な仮説となっている。
- トレハロースは、細胞モデルにおいて、オートファゴソームからオートリソソームへのオートファジーフラックスを阻害する。
- トレハロースは全身レベルでの間接的なメカニズム、例えば腸内細菌叢への影響を介して神経保護効果を発揮する可能性がある。
公開されている質問
- トレハロースによる神経保護のメカニズムとは?
- トレハロースはどのようにしてオートファジーのフラックスをブロックするのか?
- トレハロースが腸内細菌叢に及ぼす影響は?
- トレハロースの化学的シャペロン活性は神経保護機能にどのような影響を与えるのか?
はじめに
トレハロース(O-α,-D-グルコピラノシル-[1 → 1]-α-D-グルコピラノシド)は、2つのα-グルコースユニット間のα,α-1,1-グルコシド結合からなる二糖類である(図1a)。酸やα-グルコシダーゼでは加水分解されにくい非還元性の安定な糖である。その不活性な特性から、タンパク質や他の生体分子と容易に相互作用しないことが保証されている1,2。
図1:トレハロースの代謝
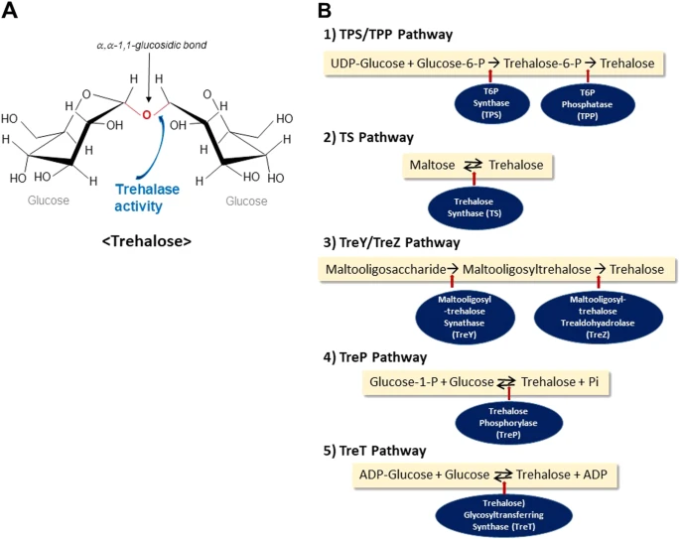
a トレハロースの構造。トレハロースは、α,α-1,1-グルコシド結合で結ばれた2つのグルコース単位からなる。トレハロースは安定な非還元性糖であり、トレハラーゼという酵素によって容易に加水分解される。トレハロースを合成する5つの経路を示す。最も一般的な経路は、(1)”TPS/TPP”経路で、トレハロース-6-リン酸を形成し、これが脱リン酸化されてトレハロースになる。(2) トレハロース合成酵素(TS)はマルトースからトレハロースを合成する。(3) マルトオリゴ糖はTreY/TreZ経路によりトレハロースからトレハロースに分解される。(4) トレハロースホスホリラーゼ(TreP)はグルコース-1-リン酸を利用してトレハロースを形成する。(5) ADP-グルコースはトレハロース糖転移合成酵素(TreT)によってトレハロースからトレハロースに利用される。
トレハロースは脊椎動物を除くほとんどの生物で検出されている3。脊椎動物のゲノムにはトレハロースの生合成や貯蔵に関わる遺伝子は1つもない3。なぜ脊椎動物はトレハロースを合成しないのか?進化の過程でトレハロースを合成する能力を失ったのではなく、そもそもトレハロースを合成する能力を獲得したことがないようである。脊椎動物と無脊椎動物は、顕著に分岐した祖先を持っており、進化の初期段階では別々のラインに従っている。ほとんどの無脊椎動物は原始体から来ているが、脊椎動物やエキノデルマータのような一部の無脊椎動物は重水素体から来ている。重水素由来の原始生物はトレハロース合成遺伝子を持たない3。
トレハロースの顕著な特徴は、親水性、化学的安定性が高く、グルコシダーゼによる酸加水分解や開裂に強いという非還元性に由来する。さらに、トレハロースは、部分的に変性したタンパク質のリフォールドを助ける分子シャペロンとして機能することが示された4,5。
トレハロースがオートファジー誘導剤として、また神経変性疾患の様々なモデルにおける病理学的変化に対するプロテクターとしての最近の報告は、魅力的な治療オプションとしてこの二糖を示唆した。本レビューでは、これらの研究を慎重に評価し、トレハロースによる神経保護の可能性について考察する。
トレハロースの構造と生化学的特性
トレハロースの化学的安定性は、他の類似の二糖類であるショ糖(27 kcal/mol)と比較して低エネルギー(1 kcal/mol)である1,1-グリコシド結合に由来する。酵素トレハラーゼが存在しない限り、それは容易にグルコース単位に加水分解されない6。トレハロースのグリコシド結合は、他の二糖類よりも大きな柔軟性を持っており、それは簡単に生体分子の他の極性基と適合するために糖を容易に2。トレハロースは、他の糖類に比べて水和のための最高の能力を持っている。その結果、それは水分子の近くに水分子を配置したり、水分子の交換で極性生体分子との直接相互作用によって膜脂質の安定化を高めることができる7,8。
水置換、ガラス転移、化学的安定性2:トレハロースがタンパク質を安定化させる3つの示唆されたメカニズムがある。トレハロースは、細胞が脱水状態9にあるときにタンパク質の表面から水分子の排除によってタンパク質の変性を阻害する。乾燥状態では、水分子を交換し、タンパク質10と直接水素結合を形成することにより、折り畳まれた状態でタンパク質を維持する。また、乾燥状態では高温で安定な非吸湿性ガラスを作るというトレハロース特有の性質により、タンパク質の構造を維持することができる11。異なる酵母種におけるトレハロースの蓄積量は、熱と脱水を生き残る能力に関連している12,13。線虫では、脱水の発症時にトレハロースが蓄積する14。トレハロースは、ストレスが緩和されると急速に分解され、通常のレベルに低下させる。
トレハロースは、したがって、無脊椎動物1,12,13,15の多くの種の極端な温度、栄養欠乏、浸透圧、および脱水に耐え、生命プロセスの自然な安定化剤として機能する。トレハロースは、多くの生物のための優れた乾燥剤として機能する。人工的にトレハロースを生産しても、ヒトの一次線維芽細胞は、5日間16までの乾燥状態に維持することができる。
無脊椎動物のトレハロース
エネルギー源
トレハロースは、脊椎動物を除く原核生物と真核生物のほとんどの生物で合成される。それは、アンヒドロ生物学的生物15の開発の特定の段階で必要とされる余分なエネルギーを提供する。いくつかの細菌の胞子は、胞子12の乾燥重量の〜25%までトレハロースを蓄積する。細菌は、外因性炭素源としてだけでなく、細胞壁3の構造成分としてトレハロースを使用することができる。酵母や真菌では、それは休眠中に予約されている17。成長している植物では、トレハロースが存在する主要な二糖類である18。それは、総糖類の80〜90%を構成する、血漿中の主な糖である19。また、昆虫の飛行のための重要なエネルギー源である15。
トレハロースの代謝
トレハロースの生合成経路は 5 つ知られている(図 1b)20。まず、トレハロース合成生物が用いる最も一般的な経路である「TPS/TPP」経路は、トレハロース-6-リン酸(T6P)合成酵素(TPS)21を利用したものである。UDP-グルコースからのグルコース単位は、TPSによりグルコース-6-リン酸に移行し、T6Pを形成する。その後、トレハロース-6-リン酸ホスファターゼ(TPP)によって脱リン酸化され、トレハロースが生成される。第二に、トレハロース合成酵素(TS)は、Pimelobacter sp、Pseudomonas syringae、Thermus caldophilusのようないくつかの細菌では、分子内でマルトース、2つのグルコース単位(α-(1,4))を持つ別の二糖類、トレハロース(α-(1,1))22に配置される。第三に、いくつかの細菌の”TreY-TreZ”経路はトレハロース23にマルトオリゴ糖を含むデンプンやグリコーゲンを変換する。第四に、トレハロースホスホリラーゼ(TreP)のいずれかがグルコース-1-リン酸とグルコースにトレハロースを加水分解したり、種24に応じて可逆的に作用する。そして最後に、トレハロース糖転移合成酵素(TreT)は、いくつかの原始細菌25においてADP-グルコースとグルコースからトレハロースを形成する。
発達
植物では、トレハロースは、成長と発達18を制御する。トレハロース-6-リン酸(T6P)の生産に障害を受けた変異体は、シロイヌナズナ(A. thaliana)26で胚発生を完了することができなかった。T6Pのレベルはまた、植物の開花期を制御する27,28。
トレハロースは、昆虫の成長と発達のために重要な主要な糖であり、開発3の特定の段階で総炭水化物プールの約20%を表す。線虫は、ライフサイクルの特定の段階で2.5%の乾燥重量までトレハロースを格納することができ、最高濃度は、卵と幼虫の段階3で発見された。
トレハロース糖脂質
トレハロースは、マイコバクテリアやコリネバクテリアなどの細菌や線虫の幼虫にα,α-トレハロースジエステルとして存在している。これらのトレハロース糖脂質は、過酷な環境条件から身を守る役割を担っていると考えられている。それらは最初に結核菌で発見され、”コード因子”と呼ばれる用語は、最初に細菌の病原性におけるそれらの重要な機能を表現するために造語されている29。これらの「コード因子」は後にトレハロースジミコレートであることが判明した30,31。トレハロース糖脂質の第二のクラスは、硫酸エステル32の形でスルホ脂質である。トレハロース糖脂質は、細菌の膜壁に組み込まれ、細胞外空間にさらされている。彼らはFcRγ-Syk-Card9依存性経路を介してマクロファージを結合し、活性化する。トレハロース糖脂質の生物学的機能としては、感染性、抗腫瘍効果、アジュバント機能、抗菌活性、肉芽腫や血管新生を誘導する能力などがある33。
植物-微生物、植物-昆虫の共生
ほとんどの細菌や真菌はトレハロースを産生するが、中にはトレハロースの代謝に依存して感染力を維持しているものもある。イネいもち病の原因菌であるMagnaprothe oryzaeは、TPS1遺伝子が削除されると病原性を失う34。緑膿菌株PA14は、線虫、昆虫、植物、脊椎動物に感染する多宿主病原体である。トレハロース合成活性を欠く
植物における細胞外トレハロースの増加は、昆虫、線虫、または寄生植物の感染の兆候である可能性がある36,37,38,39。植物は防御機構を活性化することで、そのような攻撃に備える必要がある。植物と他の生物との間のこれらの相互作用は、植物自身のトレハロース代謝18にかなりの影響を及ぼす可能性がある。
ストレス応答
トレハロースは、それが構造的な役割を果たすと考えられているマイコバクテリアやコーリンバクテリアの細胞壁に存在している。多くの細菌では、トレハロースは浸透圧ストレスと極端な温度20,40,41への適応応答に関与している。酵母は炭素源としてトレハロースを利用し、生物学的ストレス42,43,44に応答する。
植物や昆虫などの高等生物は、無水化、浸透圧ストレス、極端な温度に応答してトレハロースを利用する45,46。植物では、このようなストレス下でのトレハロースの蓄積は、トレハロース生合成に関わる遺伝子の転写活性化やトレハラーゼ酵素の不活性化と関連している47。
ケミカルシャペロン
トレハロースは、ネイティブタンパク質を安定化し、試験管内試験でのストレスの間に膜の完全性を保持する2,6。酵母はヒートショック時にトレハロースを蓄積し、タンパク質の熱変性や凝集から保護するが、高濃度では、トレハロースは分子シャペロンによる変性タンパク質の再活性化を阻害する4。
加水分解酵素トレハラーゼ
酵母のトレハラーゼとして、中性トレハラーゼ1(NTH1)NTH2,酸性トレハラーゼ(ATH1)の3つのトレハラーゼがこれまでに同定されている。NTH1は機能的な酵素活性を持つ細胞質タンパク質であり、主にトレハロースの加水分解に関与している。NTH2 は NTH1 のホモログであるが、酵素活性を欠く。ATH1 は液胞タンパク質で、pH 4.5 で活性化される。細胞ストレス時に活性化される。NTH1 遺伝子の変異は細胞内にトレハロースを高レベルで蓄積するが、細胞の生存能力と極端な熱からの回復能力は損なわれており、ストレス時のトレハロースレベルは生命プロセスのために厳密に制御されなければならないことを示唆している48,49。
脊椎動物におけるトレハロース
トレハロースの代謝
脊椎動物はトレハロースを合成または保存しないが、小腸15で活性加水分解酵素、トレハラーゼを保持する。トレハラーゼは、腸粘膜や腎臓のブラシ境界膜、肝臓、そしておそらく血液50などの特定の場所に存在する。脊椎動物は妊娠期に酵素を発現する。最高濃度に達するのは離乳後である。出生時からのトレハラーゼのレベルは成人期を通じて残る51。腸管トレハラーゼは、摂取したトレハロースの迅速な分解に関与している。植物や菌類を含むヒトの食事を構成する様々な生物にはトレハロースが含まれている。乳糖不耐症と同様に、トレハラーゼの濃度が低いと、吸収不良や下痢などの消化器症状を引き起こす52。このような患者がプロバイオティクスのSaccharomyces boulardii(サッカロマイセス・ブラウディ)を摂取すると、腸内のトレハラーゼ活性が増加し、これらの症状が軽減された53。
尿中トレハラーゼは腎臓障害の特異的なマーカーであることが提案されている。糖尿病では、トレハラーゼ活性の上昇やトレハラーゼ遺伝子の遺伝的変異が指摘されている54,55。ヒトのトレハラーゼ(TREH)は、酵母の酸トレハラーゼ1(ATH1)と共通の顕著な特徴を持っている56。TREH は酵母 ATH1 変異体の表現型を改善したが、NTH1 や NTH2 は改善しなかった。ATH1 は液胞に存在し、細胞外トレハロースの加水分解を触媒する57,58。これらの結果は、ヒトトレハロース遺伝子TREHが外因性トレハロースの利用に関与するストレス応答遺伝子として作用する可能性を示唆している56。
神経保護とタンパク質凝集におけるトレハロース
糖タンパク質と糖脂質の糖類は、脳内で重要な役割を果たしている。彼らは、脳の発達、シナプス形成、シナプス伝達、および神経伝達物質の生産59,60を支援する。さらに、いくつかの糖類は、動物およびヒトの研究で脳機能を強化した。酵母や植物由来の食事性多糖類は、健康な若年者や中年者の認知機能や気分を改善した61,62,63。
トレハロースの神経保護特性は動物実験でも言及されている。トレハロースを含む成長培地で線虫を成長させると寿命が延びた64。神経学的欠陥を有するマウスモデルは、行動および神経生物学的欠陥から部分的に回復した65。トレハロースの経口投与により運動機能障害が改善され、ハンチントン病(HD)のマウストランスジェニック(tg)モデルの寿命が延長した66。スーパーオキシドジスムターゼ1(SOD1)変異体tgマウスは、トレハロース投与により有意に寿命が延長し、神経細胞の生存率が向上した67。パーキン-/-/タウVLWマウスでは、脳内のリン酸化されたタウ陽性神経斑とアストログリア症が有意に減少した68。1-メチル-4-フェニル-1,2,3,6-テトラヒドロピリジン(MPTP)マウスのパーキンソン病(PD)モデルにおいて、トレハロースは線条体ドーパミンレベルの低下を抑制し、神経膠原病を予防した69。
トレハロースがオートファジー活性化剤およびタンパク質凝集抑制剤であることの証拠
トレハロースが神経保護試薬としてヒトおよび動物実験で最初に観察されたことから、次のような試験管内試験および生体内試験での研究が行われるようになった。酵母の研究では、変性タンパク質の凝集のための潜在的な阻害剤として最初に記載された4。トレハロースは、ネイティブ状態のタンパク質を直接安定化させるだけでなく、すでに変性したタンパク質の凝集を減少させた。HD tgマウスモデルでは、トレハロースは、大脳と肝臓のポリグルタミン凝集体を減少させた66。アミロイドβペプチドの試験管内試験凝集もトレハロースの存在下で抑制された70。SOD1変異体tgマウスにトレハロースを経口投与したところ、脳内のSOD1凝集体の蓄積量の減少が認められた67。
一方、トレハロースがオートファジーを誘導するのではないかとの報告もある71。オートファジーとは、リソソームが介在する分解プロセスで、損傷を受けた細胞成分を除去することである。これには、ミトコンドリア、小胞体(ER)ペルオキシソームなどの損傷を受けた小器官や、誤って折り畳まれたり凝集したりしたタンパク質、細胞内病原体などが含まれる72。オートファジーには、これまでにマクロオートファジー、シャペロン媒介オートファジー(CMA)マイクロオートファジーの3つの主要なタイプが記述されている73。オートファジーの障害は、がん、炎症性疾患、神経変性疾患など多くの疾患と関連している。飢餓、成長因子枯渇、酸化ストレスなどの環境ストレスは、mTORの阻害を通じてマクロオートファジーを活性化する。このようなストレスは、オートファジー遺伝子の転写活性化とオートファゴソーム合成の下流活性化につながる(図2)。
図2:オートファジーの経路。
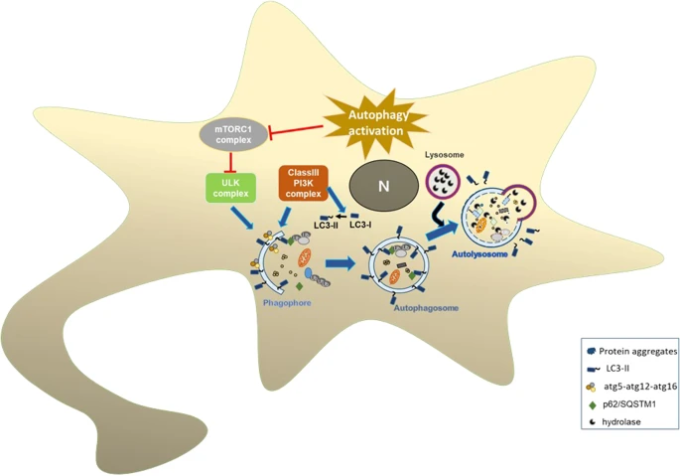
オートファジーの活性化は、オートファゴソーム形成につながるmTORC1複合体を阻害する。Atg5-atg12-atg16複合体はファゴフォア膜の伸長を助ける。細胞質のLC3-Iは脂質化されたLC3-IIに変換され、オートファゴソームの内膜と外膜に結合する。成熟したオートファゴソームが形成され、リソソソームとの融合の準備が整います。リソソソームのハイドロラーゼはオートファゴソームの内容物を分解する。
プリオン感染細胞にトレハロースを投与した研究では、LC3-IIレベルが上昇し、オートファジーが活性化されたことが示唆された74。同じ研究では、PrPSc凝集体の自発的な産生が減少し、その細胞内局在が変化した。Parkin-/-/TauVLWマウスにおけるトレハロースの経口摂取は、オートファジーの基質であるp62/SQSTM1の有意な減少をもたらし、線条体ではドーパミンレベルが低下した。トレハロースは細胞死を防ぎ、プロテアソーム阻害剤であるエポキソマイシンによって誘導されたポリユビキチン化タンパク質を減少させた75。エポキソマイシンによって誘導されたオートファジー阻害もトレハロースによって緩和され、LC3-IIおよびp62/SQSTM1は正常レベルに戻った。α-シヌクレイン tg マウスでは、腹腔内注射ではなくトレハロースの経口摂取により、オートファジーが誘導され、α-シヌクレイン凝集体が減少した76。
これらの研究は、トレハロースがオートファジー誘導剤として作用し、トレハロースの神経保護効果は、有毒なタンパク質凝集体のクリアランスにつながるオートファジー活性化の結果である可能性があるという仮説を支持した。
トレハロースは直接的なオートファジー誘導剤なのか?
かなりの数の研究がトレハロースがオートファジー誘導剤であることを提案している一方で仮説の妥当性を疑問視し、これらの研究にはいくつかの制限もある。これらの研究のほとんどは、オートファジー誘導とオートファジーフラックスの阻害を区別しようとしていない。オートファジーが開始されると、オートファゴソームは細胞質に形成される。細胞質のLC3(LC3-I)は脂質化されたLC3(LC3-II)に変換され、オートファゴソームの内膜と外膜の両方に結合する(図2)。成熟したオートファゴソームはリソソームと融合し、内膜のLC3-IIを含むオートファゴソームの内容物がリソソーム酵素によって分解される。したがって、オートファジーのフラックスは、LC3-IIレベルの一過性の上昇から始まるが、オートファジーのフラックスが続くにつれてLC3-IIのターンオーバーは、最終的には細胞内のLC3-IIタンパク質の定常状態レベルにつながる77。オートファジーが成功裏に完了すると、ポリユビキチン化されたオートファジー基質の受容体であるp62/SQSTM1のレベルも低下するであろう。
(Sarkar er al)。71 による研究では、トレハロースはオートファジー誘導効果があることが報告されており、LC3-II のレベルが上昇していることが示されている。他のいくつかの研究では、ウエスタンブロッティングや免疫細胞化学で LC3-II レベルの上昇が観察されている75,78。オートファゴソーム形成の増加とオートファジーフラックスの遮断の両方がLC3-IIレベルの上昇につながる可能性があるため、GFP-LC3パンククタの数の増加は、オートファジー誘導が起こったと推定するには十分ではない。
このような問題を回避するために、mRFP-GFPタンデム蛍光タグ付きLC3(tfLC3)が現在広く使用されている79。しかし、GFPは酸性で分解性のあるリソソソーム環境に送達されると蛍光を失う。オートファゴソーム中のtfLC3タンパク質がリソソソームに到達すると、GFPの蛍光は弱まり、RFPシグナルのみが残る。したがって、オートファジー誘導によるオートファゴソームの増加は、リソソームへのオートファジーフラックスが阻害されないため、オートファゴソーム(黄色の蛍光)とオートリソーム(赤色の蛍光)の両方で上昇を示すことになる(図3a)。しかし、オートリソソーム形成を阻害してオートファゴソームを増加させると、オートファゴソームの数は増加し(黄色)オートリソームの数は増加しない(赤色)。我々の最新の研究では、オートファゴソームとオートリソソームの検出を区別するために tfLC3 を利用し、オートファジーフラックスに対するトレハロースの影響を分析した。その結果、SH-SY5Y 神経細胞にトレハロースを投与すると、オートファゴソームの数は増加したが、オートリソソソームの数は増加しなかった。別の最近の研究では、tfLC3を用いて、トレハロース処理により、H4グリオーマ細胞において、オートファゴソームからリソソソームへのLC3の非効率的な送達が引き起こされたことが示されている81。p62/SQSTM1などのオートファジー基質のレベルを調べることは、オートファジープロセスの成功を評価するもう一つの方法である。オートファジーの完了は、オートファジー基質の分解につながる。Parkin-/-/TauVLWマウスとSOD1 tgマウスの研究では、トレハロースを含む水を与えた動物では、線条体と脊髄運動ニューロンでそれぞれp62/SQSTM1タンパク質のレベルが低下していた67,68。しかし、動物実験での観察に反して、トレハロースは H4, HegG2, 293 細胞において LC3-II と p62/SQSTM1 の両方の実質的な蓄積をもたらした81。これらの細胞モデルでの研究は、トレハロースが直接的なオートファジー誘導剤であるかどうかという疑問を提起し、オートファジーフラックスのブロッカーとして作用する可能性を切り開いた。我々の最近の研究でも、トレハロース処理によりLC3-IIとp62/SQSTM1の両方のレベルが増加したという同様の結果が示された80。
図3:オートファジーの制御
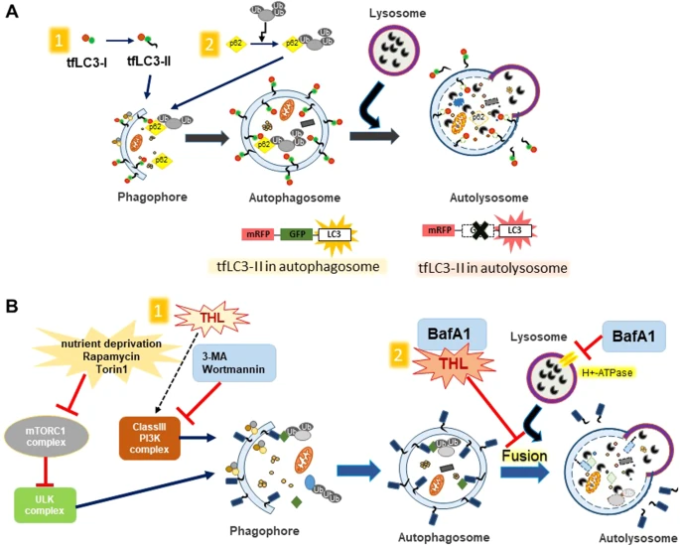
a オートファゴソームとオートリソソームの区別。mRFP-GFPタンデム蛍光タグ付きLC3(tfLC3)は、リソソームに送達される前にGFPとRFPシグナルの両方に蛍光を発する(黄色)。tfLC3のGFPは、酸性で分解性のあるリソソソーム環境ではその蛍光を失う(赤)。オートファジー誘導は、オートファゴソーム(黄色)とオートリソソーム(赤)を一緒に増加させるが、これは、リソソソームへのオートファジーフラックスが妨げられないためである。オートファゴソームとリソソームの融合をブロックすると、オートファゴソーム(黄色)の数だけが増加する。オートファジーはmTORC1複合体の阻害とクラスIII PI3K複合体の活性化により開始される。3-メチルアデニン(3-MA)やワルトマンニンは、mTORC1複合体の阻害によりオートファジーを阻害する。トレハロースはPI3Kを介してオートファジーを活性化する可能性がある。BafA1とトレハロースは、オートファゴソームとリソソームの融合を阻害し、オートファジーの最終段階を阻害する可能性がある。
バフィロマイシンA1(BafA1)は、液胞型H+ ATPase阻害剤であり、オートファゴソームとリソソームが融合するオートファジー過程の後期を阻害するためによく使用される。LC3-II値はBafA1投与により上昇する。また、リソゾモトロピー剤であるクロロキンもオートファゴソームとリソソームの融合を阻害し、オートファジーを阻害する。トレハロース修飾オートファジー71に対するBafA1の効果を調べた研究がある。Httタンパク質をトランスフェクトしたCOS-7細胞をトレハロース(100mM、48時間)とBafA1(200nM、4時間)で処理した。その結果、BafA1とトレハロースを一緒に処理した場合、各試薬を単独で処理した場合よりもLC3-IIレベルが増加した。別の研究では、トレハロース(100 mM、48 時間)と BafA1(200 nM、4 時間)で処理した ScN2a 神経細胞では、それぞれを単独で処理した場合よりも、両方の試薬を一緒に処理した場合の方が LC3-II 濃度が高くなるという同様の結果が得られた78。これらの結果は、トレハロースがオートファジー活性化剤であることを示す主な証拠となった。
しかし、オートファジーブロッカーとしての BafA1 の使用は、短時間(< 6 時間)の処理では、オートファジーを完全にブロックするには不十分であるかもしれないという懸念を提起した82。BafA1の時間的検討では、BafA1の短期投与ではリソソームの酸性化が阻害されたが、長時間の投与ではリソソームとオートファゴソームの融合が阻害された後にのみ、リソソソームの酸性化が阻害された。そのため、BafA1を長期間(ほとんどの細胞タイプで> 6時間)処理して、オートファゴのフラックスを阻害することが推奨されていた。我々の最近の研究でも、同様の実験を行ったが、BafA1をより長い時間(12時間以上)処理した80。その結果、トレハロースとBafA1を併用した場合の効果は、BafA1単独の場合と同様であり、オートファジーフラックスの阻害剤としてのトレハロースの役割が示唆された。
オートファジー活性化と神経保護の分子経路の解明を目的としたトレハロースに関する最近の研究が報告された。トレハロースは、溶質担体 2A(SLC2A)タンパク質の阻害によりグルコース/果糖の取り込みを阻害し、肝ステアトーシスを減少させた83。グルコース取り込みの障害は、オートファジーに影響を与える飢餓と同様の効果がある。
細胞がトレハロースをどのように取り込むかについてはほとんど知られていない。SLC2A8(GLUT8)は哺乳類のトレハローストランスポーターとして提示され、肝細胞におけるトレハロースとトレハロース誘導オートファジーの取り込みに部分的に責任がある84。しかし、N2A神経芽腫細胞におけるトレハロース誘導性LC3-II蓄積は、SLC2A8が神経細胞の細胞膜に局在していないため、SLC2A8依存性ではなかった。これらの研究から、神経細胞では肝細胞に比べてトレハロースの取り込み機構が異なり、オートファジー経路上で異なる作用をしている可能性が示唆された。
要約すると、トレハロースの投与が脳内でオートファジーを誘導すると思われる動物モデルでの観察とは異なり、トレハロースを神経細胞を含む培養細胞に直接投与した場合には、オートファジー誘導剤というよりも、オートファジーフラックスブロッカーの役割を果たしているように思われる80。tfLC3染色およびオートファジーマーカーであるLC3-IIおよびp62/SQSTM1の免疫ブロッティングは、トレハロースがリソソソーム活性を損ない、オートリソソームを介した分解を妨害する可能性があるという結論を支持するものであり、リソソモトロピック阻害剤と同様の作用をする(図3b)。
トレハロースの他の経路への影響
オートファジーは、哺乳類細胞におけるトレハロースの作用機序のキープレイヤーとして最も注目されている。しかし、他の細胞プロセスにおけるオートファジーの役割を示唆する研究がいくつか報告されている。トレハロースは、ラットの初代アストロサイトおよびオリゴデンドロサイト培養において、リポ多糖類(LPS)およびインターフェロンγ(INFγ)による酸化ストレス後に PARP-1 および PARP-2 の発現をダウンレギュレートし、酸化ストレス条件下でのトレハロースの抗アポトーシス機能を示唆している85。レビー小体型モデルマウスによるトレハロース摂取は、HSP90やSigmaR1などのシャペロン分子のレベルを上昇させ、タンパク質フォールディングにおけるトレハロースの役割を示唆している76。酸素-グルコース遮断(OGD)は、酸化ストレスとERストレスの両方の抑制を介してプロテアソーム活性を阻害する。トレハロースは、プロテアソーム活性を維持しながら、OGD誘導オートファジーを阻害した86。
トレハロースはまた、特定のストレス条件下で生成された真核細胞の細胞質内のRNA-タンパク質複合体であるストレス顆粒を、調節することができる。これらのストレス顆粒の機能は、RNAを分解から保護し、それによって細胞死やストレスシグナル伝達を防ぐと考えられている。ストレス顆粒の形成は、真核生物開始因子2(eIF2)のリクルートによって開始され、eIF2-GTP-tRNAiMet三元複合体を形成する。ストレス顆粒に含まれる多くのタンパク質は、ALSなどのヒトの疾患では制御異常を起こしている。ストレス顆粒の長期蓄積は、タンパク質の凝集を増加させ、神経変性疾患の発症につながる可能性がある。トレハロースは効率的にp-eIF2α経路を介してストレス顆粒の分解を促進し、トレハロースの神経保護効果は、ストレス顆粒87の制御を含む可能性が示唆されている。
トレハロースはタンパク質凝集体のクリアランスに直接影響を与えるのか?
トレハロースによる神経保護とオートファジー誘導は、トレハロースがオートファジーの活性化を介して凝集体のクリアランスを促進するという仮説につながった。いくつかの研究では、2つのプロセスを一緒にリンクしようとしたが、提供された証拠は決定的なものではなかった。このセクションでは、このテーマに関する文献を批判的に評価し、トレハロースが直接集合体クリアランスを促進できるかどうかを検討する。
Sarkarら.71は、トレハロースがオートファジー誘導効果を持ち、培養細胞における変異型ハンチンやα-シヌクレインなどのタンパク質凝集体のクリアランスを促進することを最初に報告した。同様の観察が行われ、トレハロース処理により、エポキソマイシン75によって誘導されたポリユビキチン化されたタンパク質凝集体が減少することが示された。同じ研究では、NB69神経芽腫細胞におけるタウとαシヌクレインの凝集体の減少も示された。しかし、これらの研究では、凝集体の定量的な分析には限界があったかもしれない。例えば、α-シヌクレインの免疫ブロッティングは、モノマーの減少のみを示した。高分子量のα-シヌクレイン凝集体は表示されなかった。後者の研究では、リン酸化されたタウの量を総タウ量(tau-5抗体)に正規化しておらず、リン酸化されたタウも総タウも同様のパターンで変化しているように思われた。しかし、前者の研究のpolyQタンパク質の場合、免疫ブロッティングの結果、ドデシル硫酸ナトリウムポリアクリルアミドゲル電気泳動ゲルのウェルに高分子量タンパク質の凝集体が残っていることがわかった。異なる方法での凝集体のさらなる特徴付けは、凝集体のクリアランスにおけるトレハロースの役割に関する議論を強化したであろう。
田中ら66による別の研究では、GFP融合ポリQタンパク質を発現するNeuro2Aマウス神経芽腫細胞におけるポリグルタミン凝集体に対するトレハロースの効果を調べた。トレハロースおよび他の低分子を脂質ベースの一過性細胞透過法により細胞内に直接送達した。その結果、トレハロース処理により、凝集体を有する細胞数が減少し、細胞生存率が向上することが示された。しかし、人工的な細胞送達システムを使用することで、生体内では発生しないかもしれない高レベルのトレハロースを細胞内に許容している可能性がある。
別の研究では、プリオンに安定的に感染し、トレハロースで処理された細胞は、核周囲にコンパクトで丸い包接体染色を有する対照細胞と比較して、細胞の周辺部でより拡散的で分散したPrPScの染色パターンを示した74。この研究で注目すべきことの一つは、トレハロースは、他の研究で一般的に使用される50〜100 mMと比較して、低濃度(〜50μM)で処理されたことである。コンパクト/円形および分散構造のさらなる特徴付けは、これらの構造がタンパク質の凝集体を表しているか、単に細胞の特定の小器官へのPrPScの限定的な局在を表しているかどうかを決定するのに役立つであろう。トレハロースをより長い培養期間(6回まで)処理しても、本研究ではPrPSc凝集体のプロテイナーゼK(PK)抵抗性は変化しなかったが、トレハロースは低濃度ではタンパク質凝集に影響を与えないことを示唆している。
興味深いことに、最近のいくつかの研究では、凝集体クリアランスにおけるトレハロースの役割と矛盾する結果が報告されている。ヒートショック後の部分的に変性したタンパク質は、トレハロースの存在下で効率的にリフォールディングされ、それによって酵母の凝集を抑制した4。しかし、トレハロースを継続的に存在させると、酵母ではタンパク質のリフォールディングが阻害された。アミロイド前駆体タンパク質(APP)を用いた研究では、トレハロースが細胞内のAPPや他の長寿命タンパク質の分解を減少させることが示された81。これらの効果は、カテプシン D などのリソソソームヒドロラーゼ活性の低下と関連している。最新の研究では、SH-SY5Y 細胞の培地にトレハロースを添加すると、α-シヌクレインの凝集が増加し、リソソソームの完全性も損なわれた80。不思議なことに、トレハロースが存在する場合、タンパク質の凝集と細胞の毒性との間にはほとんど相関関係がなく、トレハロース処理条件下で形成された凝集体は毒性がないか、あるいはトレハロースが細胞を凝集体の毒性から保護していることを示唆している。α-シヌクレインのあらかじめ形成されたフィブリル(PFF)に曝露されたマウスの初代皮質ニューロンでは、リン酸化されたS129形態の豊富さが増加し、細胞の生存率が低下していた88。トレハロースはこれらの細胞のα-シヌクレイン凝集体を除去することができなかった。しかし、トレハロースは非処理細胞と比較して基底細胞の生存率を増加させた。これらの結果は、トレハロースの保護効果がタンパク質凝集に対する効果とは無関係に作用する可能性を示唆している。
トレハロースによる神経保護の直接 vs. 間接的メカニズム
トレハロースの投与は、動物モデルにおいて神経保護効果があることが研究で示されている。トレハロースを投与した場合、神経変性疾患を有する動物は、神経病理が減少し、行動表現型が緩和され、長生きした。また、これらの動物実験では、オートファジーの活性化とタンパク質凝集体の減少が示された。炎症反応は減少し、グリオシスはトレハロースに反応して減少した。疾患モデルの脳の特定領域では、より多くのニューロンが生存していた。しかしながら、細胞では、オートファジー活性化とタンパク質凝集体の減少とトレハロースとの関連性については、まだ議論の余地がある。オートファジーフラックスとタンパク質凝集体の慎重な分析から、これまでの仮説とは異なり、トレハロースはオートファジーフラックスを阻害し、培養細胞内のタンパク質凝集体のレベルを減少させるのではなく増加させることが示唆された。これらの結果は、神経変性疾患の動物モデルにおけるオートファジー誘導と凝集体クリアランスの原因は、トレハロースの神経細胞への直接的な影響に起因するものではない可能性を提起した。トレハロースの神経保護効果は間接的なものかもしれない。
トレハロースの神経保護作用のメカニズムは何か?トレハロースが培養で直接取り込まれるのとは逆に、飲料水で動物に処理されたトレハロースは、腸内でトレハロース酵素によって加水分解される可能性が高いと考えられる。トレハロースの一部が血流に入ったとしても、脳へのトレハロースのアクセスを制限する血液脳関門(BBB)がある。
一つの可能性は、トレハロースの効果が腸のレベルで発揮されることである。例えば、トレハロースは腸内微生物叢に影響を及ぼす可能性がある。トレハロースは有害なストレスから微生物を保護し、生存を高めることができる。腸内細菌叢が中枢神経系を含む多くの生理学的システムに広範な影響を及ぼすことを示す証拠が長年にわたって蓄積されており、トレハロースが微生物叢-腸-脳のシグナル伝達89を介してその神経保護的役割を発揮する可能性が高まっている。この仮説と整合するように、トレハロースの経口摂取のみがマウスの脳にオートファジーを効率的に誘導し、腹腔内注射ではなかったことから、トレハロースの神経保護効果は消化管(GI)系を必要とすることが示唆されている76。
一方で、トレハロースが血流に乗って脳に入り、神経細胞に直接神経保護機能を発揮する可能性も否定できない。血漿中のトレハロース検出と糖尿病との関係が報告されている54,55。また、肝臓や腎臓でも検出されているが、これらの臓器でのトレハロースの機能は未だ不明である。Martano er al)。90による最近の研究では、マウスの脳、特に海馬と皮質でトレハロースを検出した。内因性トレハロースはアストロサイトとニューロンの両方で検出されたが、加水分解酵素トレハラーゼはニューロンのみに局在していた。アストロサイトはトレハロースを取り込んで細胞外に放出することができた。しかし、脊椎動物にはトレハロース合成酵素が存在しないため、トレハロースの供給源は不明であった。これらの結果から、トレハロースは腸から血液や他の担体を介して脳に移動し、神経細胞に直接作用する可能性が考えられる。トレハロースが脳に到達すると、ニューロンや他の細胞に直接作用してタンパク質の折り畳みに影響を与えたり、ストレス応答を活性化するためのシグナル分子として作用したり、オートファジーや細胞死のメカニズムを制御したりする可能性がある。しかし、神経細胞や他の脳細胞におけるトレハロースの濃度が、これまでの試験管内試験研究のほとんどが行ってきたレベルに達するかどうかは疑問である(図4)。
図4:脳内トレハロース機能の仮説を示す模式図
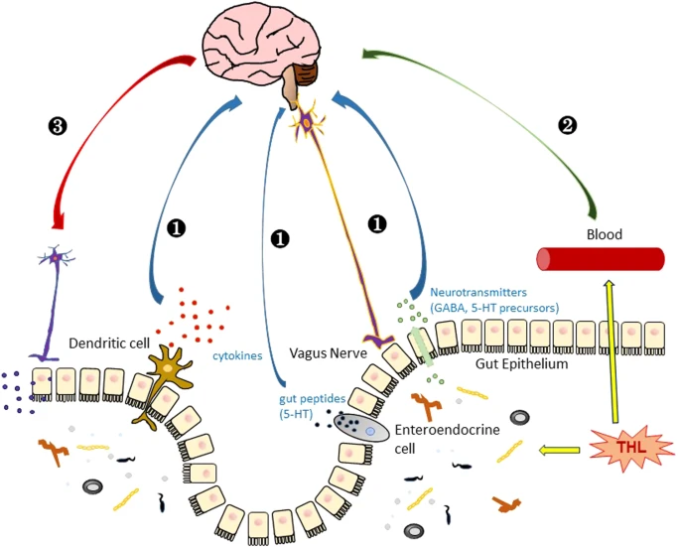
(1) トレハロースは、樹状免疫の活性化や神経伝達物質や迷走神経を介して脳に運ばれる可能性のある腸管ペプチドの分泌によって脳に信号を送る腸内微生物の調節を介して、間接的に脳機能に影響を与える91。(2) トレハロースが直接脳に運ばれ、血液脳関門を通過して神経細胞に影響を与える。(3) 脳はトレハロースの機能を調節するために腸管系に信号を送る
結論
トレハロースの神経保護効果は、多くの異なる神経変性疾患モデルにおいてかなり一貫している。トレハロースが神経細胞に直接作用してオートファジーを誘導し、それによってタンパク質凝集体のクリアランスを促進するという仮説が立てられている。しかし、文献を精査した結果、トレハロースが直接オートファジーを誘導できるかどうかという疑問が生じた。最近の論文では、実際に、神経細胞をトレハロースで処理すると、オートファゴソームからオートリゾソームへの進行が阻害されることが示されている。さらに、トレハロースを動物に投与した場合、脳実質にどの程度の量のトレハロースが送達されるかは明らかにされていない。我々は、トレハロース摂取が神経変性疾患モデルにおいて、直接的または間接的なメカニズムにより神経保護効果を発揮することを提案している。今後、トレハロースを介した神経保護作用のメカニズムを解明することで、神経変性疾患の新規治療法の開発につながる可能性がある。
