Manufacturing of Novel Vaccines during a Global Pandemic
midapam.substack.com/p/manufacturing-of-novel-vaccines-during?s=r
Plamena
正しい視点を持つことは、どんな種類の問題でも理解するための鍵になる。この投稿は、新規mRNAワクチンの何百万回分もの製造に関する情報を提供することを目的としている。念のため伝えるが、mRNAワクチンはまさに遺伝子治療薬である。
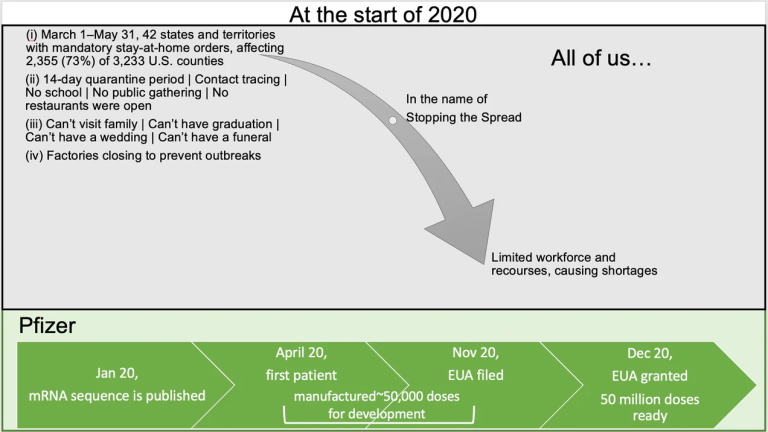
思い出してほしい・・・2020年の始まりに、我々全員が、私利私欲を捨て、権利を停止し、家に閉じ込められることで責任ある行動をとるよう求められた・・・このことは、読み進める上で、重要な事実だ・・・。
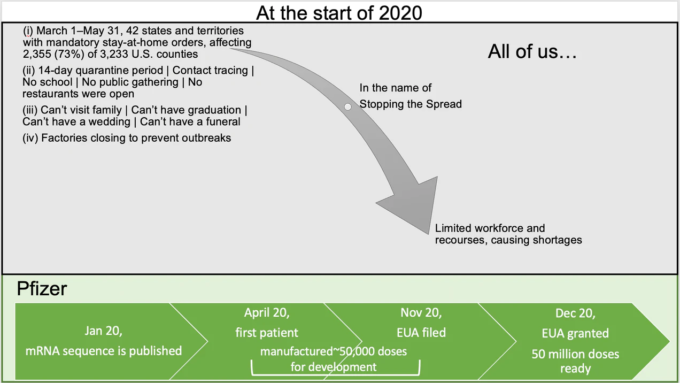
このような状況を考えると、我々誰もが、特に医薬品開発に携わる人たちが気になるはずの疑問がある。
PFE / BioNTechは、物資や労働力が著しく不足している中、どのようにしてmRNAワクチンを開発し、12ヶ月足らずで5000万回分以上を製造することができたのだろうか?
この投稿は、この質問に明確に答えることはできないが、可能な限りの答えを探そうとする探究心を刺激することを期待している …
LNP製造の歴史的概要
LNPの技術は、主に脂質で構成される細胞膜をベースにしている。脂質は、水に溶けない部分(疎水性)と水に溶ける部分(親水性)を持つ分子であり、LNPは、この脂質に着目した技術である。このような分子は、粉末や油として乾燥させることができ、ベッドサイドで簡単に水に戻すことができる。そして、リポソームと呼ばれる高次の球状小胞に自己組織化する。[Stephen Allan, Evonik, 2020].
- 1995年以降に承認されたLNPを含む20の医薬品
- 主にがん領域の薬剤、すなわちLNPは血流を通して分布する。
- COVID-19ワクチンが承認されるまで、mRNAワクチンはなかった。
- siRNA-コンジュゲート(mRNAではない!)を含むデリバリーシステムが関心を集めている、LNPを使用するほとんどの治療法は、遺伝子治療、セルターゲットおよび他のナノ医薬品のための非ウイルス製剤である。
- 2018,希少疾患の人の多発性神経障害治療薬「オンパトロ®」が承認~LNPでsiRNAを少量生産(LNPはアキュイタスが開発)
製剤開発における留意点…
…最終的なフォーミュレーションを完成させるのに時間がかかる
- 機能性:脂質成分の組成。例えば、イオン化可能なカチオン性脂質は一般に核酸の細胞内デリバリーを最大化する役割を果たし、ペイロードのカプセル化に一役買う。炭化水素鎖の長さ、不飽和度、リンカー部位、脂質のプロトン利用性(pK値)なども、効力や有効性に影響を与える要因である。
- 安定性:LNPの機能性を決定するためには、高分子PEG鎖と2つの疎水性脂質の尾部からなるポリエチレングリコール脂質を組み込む必要がある。
- 脂質を合成するために使用される原材料の品質、脂質の種類と供給元は、不純物プロファイル、粒子特性、粒子安定性、および最終製剤の放出プロファイルに直接影響を及す。原材料が一貫して良好でない場合、製剤の品質にばらつきが生じる可能性がある。
脂質ナノ粒子(LNP)製造の課題…
… 最終的な製造工程を正しく理解するのに時間がかかる
LNPの製造 – 通常は押し出しベースのプロセスで、多くのリポソーム製剤には好ましいが、mRNAでは難しい [Evonik, 2020] 。
- 適切な製造パラメータの選択は些細なことではなく、さまざまなパラメータに関する経験が必要である[Roces et al 2020]。
- 流量比(FRR)と総流量(TFR)は、製造される粒子の物理化学的特性に大きな影響を与える。
- 総流量を増やすか、流量比を大きくすると、粒子径が小さくなる可能性がある。
- 「成分」を選択するには、成分が互いに、またmRNAとどのように相互作用するかについての知識が必要である[Roces et al 2020]。注:COVID-19パンデミック開始時点では、mRNAはヒト用LNPにカプセル化されていなかった。最終的なLNPの特性は、アミノ脂質(カチオン性またはイオン性)バッファーの選択(クエン酸緩衝液pH6またはTRIS pH7.4)核酸ペイロードの種類(PolyA、ssDNAまたはmRNA)によって影響される。
BNT162b2の限定公開された製造情報を覗き見る
EUA、承認済み添付文書、BLAで公開されている製造情報はごく限られたものである。私の過去の経験から、BLAの化学、製造、管理(CMC)セクションは、ロットリリースと安定性の仕様とデータ、試験方法とバリデーション、製剤成分と製造プロセス、mRNA/LNP製剤と希釈剤の安定性などの情報の専有性が認識されているため、大幅に編集される。製品がどのように製造され、品質管理されているかを理解する上で鍵となるのは、この編集された部分なのである。これまでのところ、以下のことが分かっている(EUAからの抜粋。BLAからのCMC情報はこれまで公開されておらず、CMC部分の目次すらない)。
- 各DS製造施設の最低3つのプロセス性能適格性(PPQ)原薬(DS)バッチのインプロセス、放出、特性データが提供された。
- 原薬(DS、最終製品の前段階の成分)の製造工程がワクチン開発中に変更されたが、包括的な分析比較評価が実施され、提出されたデータはその比較可能性を裏付けるものであった。
- 原薬(DP)の製造工程は、商業的ニーズに対応するため、従来のクラシカルプロセスからバッチサイズの拡大(より多くのRNA投入に対応可能)を伴うアップスケールプロセスに変更された。DPのバッチリリースデータを比較し、6つの代表的なクラシカルプロセスのDPバッチと1つのアップスケール・プロセスのDPバッチの詳細な分析比較評価を行った結果、緊急用DP製造にアップスケール・プロセスを使用することが支持された。比較バッチの数は最低でも 2 つ、より一般的には 3 つ必要であった。
- プロセスの性能と一貫性を示すため、各製造拠点から最低 3 つの GMP 商業スケール製剤ロットの分析証明書 (CoA) がスポンサーに要求された。EUAの審査では、4つの製造拠点からのデータが入手可能であった。さらに、ワクチンの供給とアベイラビリティをサポートするため 2020年12月17日から12月23日の間に、さらに2つの製造拠点からのデータをEUAに提出することとした。
- 承認後、スポンサーは EUA で配布される DP ロットの CoA をロット配布の 48 時間前までに提出し、審査を受けることになっていた。
- 安定性試験は、EUA 下でのワクチンの使用をサポートするために計画された。BNT162b2 活性物質と医薬品ロットを使用して作成された利用可能なすべての安定性データは、ファイザー-バイオNTech COVID-19 ワクチンの緊急配備をサポートするものである。
- 放出および安定性モニタリングのために開発され使用された分析手順は、原薬/製剤の品質管理に使用することが適切かつ許容されると判断された。緊急供給DSおよびDPの放出に使用されたすべての分析手順は、適切に認定されている。
- これらの各施設について、FDAは機器、設備、品質システムおよび管理、容器閉鎖システム、およびその他の情報を要求し、検討した。
正しいことをするためには、時間がかかる…
…のか?
最後に少し、
- BNT162b2は市販の脂質を使用しているが、「独自の特注脂質」も使用している。脂質ナノ粒子とmRNAの形状や組成を制御するために「非常にエキゾチックな混合技術」を使用している。「独自の性質上、他の製薬会社は容易に製造に割り込むことができない。」[www.chemistryworld.com, 2020].

これらすべてが、ロックダウンや検疫のために資源がまばらな時期に、製造ロジスティクスの課題を生み出している。
- ALC-0159とALC-0315は、PFE/BioNTech BLAによれば、新規かつプロプライエタリである。
- 文献によると、これらの成分には反応があり、マウスでは高い炎症性があることが示唆されている。(https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8604799/pdf/main.pdf)
- 文献によると、肝臓、脾臓、副腎、卵巣に蓄積することが示されており、これはBLA(2.6.5項)でも確認されている。
- PFE/BioNTechは 2020年第1四半期から2020年12月の間に6つの製造拠点を設立することができた
- 安定性については、EUAでは規定されていない
- EUAの時点で分析手順がバリデートされていない。
- COVID-19の制限により、直接の品質検査は行われなかった
以上の情報から、製剤、試験、安定性、スケールアップした製造など、最終製品をきちんと作るには相当な時間がかかると思われる。実際、他のワクチン開発プロジェクトの例でも、ミッションの達成には数年を要すると指摘されている。しかし、BNT162b2/ Comirnatyの場合、非臨床実験と世界中で4万人以上を対象とした臨床試験を行いながら、これらすべてを12カ月以内に当該規模で行うことができた。
…私の専門的な好奇心が刺激される…