Contents
www.ncbi.nlm.nih.gov/pmc/articles/PMC5436183/
Julio C Rojas1、2,F Gonzalez-Lima1
要旨
赤色から近赤外の光エネルギーを利用した低レベル光治療(LLLT)は、眼科、神経内科、精神科などの治療に応用できる新しい科学的アプローチとして近年注目されている。LLLTを中心とした治療革命は、光生物学や生体エネルギー学の基礎科学分野の進歩に大きく後押しされている。この論文では、分子、細胞、神経組織レベルでのLLLTの作用機序を説明する。チトクロームオキシダーゼ活性の光電子変調は、LLLTの作用の最も重要な一次機構である。チトクロム酸化酵素は、電磁スペクトルの近赤外領域に赤の光の主な光受容体である。また、特に網膜と脳の神経細胞のための細胞のバイオエネルギーのための重要なミトコンドリア酵素である。証拠は、LLLTが二次的にミトコンドリア機能、神経内シグナル伝達系、および酸化還元状態を調節することによって神経代謝を高めることができることを示している。生体内網膜および経頭蓋効果の非侵襲的な生体内試験(in vivo)を含む神経組織上のホルモン効果に関連するLLLTの線量推定についての現在の知識は、また、提示される。最近の研究は、網膜疾患、脳卒中、神経外傷、神経変性、およびメモリと気分障害でLLLTの潜在的な利点をサポートするレビューされている。ミトコンドリア機能不全は、神経変性の鍵となる役割を果たしているので、LLLTは、ミトコンドリア障害の結果を打ち消すことによって、網膜と脳の損傷に対して潜在的な重要なアプリケーションを持っている。生体内での経頭蓋デリバリー時に、LLLTは、チトクロームオキシダーゼとスーパーオキシドジスムターゼ活性の増加によって測定されるように、脳の代謝と抗酸化有益な効果を誘導する。LLLTによって誘導された脳血流と認知機能の増加はまた、ヒトで観察されている。重要なのは、有益な効果を発揮するエネルギー密度で与えられたLLLTは、悪影響を引き起こすことはない。このことは、視覚、神経学的、心理学的条件を治療するための新しいパラダイムとしてLLLTの価値を強調し、神経細胞のエネルギー代謝が目と脳の神経治療の主要なターゲットを構成する可能性があることをサポートしている。
キーワード:光生体調節、チトクロム酸化酵素、神経治療、網膜疾患、神経疾患、認知・気分障害
序論
低レベル光治療(LLT)は、様々な病態における実験的治療応用のための新しいツールとして、近年注目を集めている。神経治療の分野における現在のパラダイムシフトは、神経系の機能を変更する試みにおいて、この革新的なアプローチを検討することを可能にした。患者、研究所、メディア、および世界中の産業は、伝統的に患者のケアに限られた治療の貢献を持っていた神経学と他の医療分野でLLLTの潜在的な治療アプリケーションに注意を払っている。近年では、LLLTの使用は、痛みや創傷治癒の領域を超えて拡張されており、最近の研究では、網膜疾患、脳卒中、神経変性、神経筋疾患、および記憶や気分障害の潜在的な利益をサポートしている。このような治療革命は、光生物学の分野での進歩と、21世紀に入ってからの生体エネルギーへの関心の再燃に後押しされている。光化学、遺伝学、情報学、神経画像学における現在の進歩は、光や他の形態の電磁放射が生体組織に及ぼす影響を様々なレベルの分析で定量化し、区別することを可能にしている。
過去40年間の発展の中で、「光を使って治療する」という概念は、西洋の現代の生物医学者にとっては難解で疑わしい意味合いを持ってた。LLLTの最近の原稿に評判の良い生物医学ジャーナルからのレビュアーのコメントで示されているように、光治療の “不思議な効果 “は、占星術とメスメルの動物磁気学の伝統の中で思考の笑える学校として分類されているという不幸を持ってた。私たちは常に、一見無害な、あるいは些細な生物学的効果を持つ光にさらされている。光の生物学的効果が実証されたとしても、これらは非常に可変的であり、非伝統的な用量反応曲線を示したり、伝統的な薬力学的パラダイムの中での機械論的説明を欠いている。最近のレビューでは、「広範な不確実性と混乱は、分子、細胞、組織レベルでのLLLTの作用機序について存在する」と述べている1 したがって、LLLTは科学的な魅力を欠いているし、主流の医学への入り口を拒否されていることは驚くべきことではない。疑いの余地が認められている場合でも、LLLTは簡単にサイエンスフィクションの構築物や希望的観測とみなされる可能性がある。しかし、LLLTの潜在的な臨床的価値に関する説得力のあるデータが利用可能である。ミトコンドリア機能の調節を示唆するLLLTの作用機序に関する健全な理論が進められており、光と組織の相互作用が網膜や脳を含む代謝活性の高い興奮性組織に特別な意味を持つことが利用可能なデータで裏付けられている。神経系と網膜の力学的光組織相互作用について学ぶことはまだたくさんあるが、証拠はLLLTがミトコンドリア機能、神経細胞内シグナル伝達系、および酸化還元状態を調節することによって神経代謝を高めることができることを示している。このレビューでは、簡単にLLLTの神経生物学的効果の基礎となる現在提案されている光化学的メカニズムを説明する。非侵襲的な生体内試験(in vivo)経頭蓋効果を含む神経系におけるその可変的な効果に関連するLLLTの線量評価についての現在の知識の要約も提示されている。主要な試験管内試験(in vitro前臨床、および臨床研究の要約は、細胞毒性、ミトコンドリア機能不全、および網膜と中枢神経系の低酸素/虚血を含む病原性条件の数でLLLTの保護と強化効果をサポートすることが示されている。LLLTのデータは、それが正常および機能不全の神経組織で効果的な、再現性のある、そして意味のある変化を発揮することができることを示唆している。これは、視覚、神経学的、心理学的条件を治療するための新規かつ有用なパラダイムとしてLLLTの価値を強調し、神経細胞のエネルギー代謝が目と脳の神経治療のための主要なターゲットを構成する可能性があることをサポートしている。
LLLTとは?
光は、波動性と粒子性の両方の性質を持つ電磁放射の一種である。生物は、空間を移動する電磁場の周期的な振動からなる電磁放射の広大な海の中に浸かっており、それによってエネルギーを伝達することができる。したがって、光は発光エネルギーと呼ばれるエネルギーの一形態である。電磁放射の波は一方向のベクトルを持ち、波長(λ=連続するピークや谷間の距離周波数(1秒間の振動数振幅(谷とピークの差)によって特徴づけられる。周波数、振幅、波長の異なる波が複雑に混ざり合ったものが、生物を含む物体に吸収され、散乱され、反射される。1つの波長だけの光は単色と呼ばれている。現代の量子物理学では、電磁波は光子で構成されており、光子は3×108m/秒の速度で移動するエネルギーの粒子(クアンタ)である。光の明るさは光子の数であり、光の色はそれぞれの光子に含まれるエネルギーである。LLLTは、生物学的機能を変調したり、非破壊的かつ非熱的な方法で治療効果を誘導するために赤から近赤外波長(λ= 600〜1100 nm)にレーザーや発光ダイオード(LED)からの指向性の低消費電力と高光量の単色または準単色光の使用として定義することができる2、3 LLLTの効果は、細胞の生物学的機能の後続の変調と代謝エネルギーに発光エネルギーの変換を意味する。したがって、LLLTは一般的に光生物学的変調として知られている。また、神経細胞を対象とした場合には、光電子変調と呼ばれることもある。LLLTは、一般的にレーザーに関連付けられた高エネルギー光子送達の従来の効果とは異なり、エネルギーのより大きな放出によって媒介され、解剖、アブレーション、凝固、および気化を介して加熱および組織の破壊をもたらす。レーザーのこれらの一般的に知られている破壊的な効果と比較して、LLLTは、電磁放射のエネルギー含有量がその波長に反比例するため、「低レベル」としてカタログ化されている。さらに、ターゲット組織は、一般的に、切除アプリケーションのために提供されるエネルギーと比較すると、低放射輝度(すなわち、組織のcm2あたりの低ワット)にさらされている。LLLTによって提供されるエネルギー用量は、加熱および組織破壊についての懸念を引き起こすには低すぎるが、まだ彼らは細胞機能を変調するのに十分な高さである。実際、光生物学的変調アプリケーションに使用される典型的な放射照度は、皮膚状態のための局所光力学療法で使用されるものと重複している4 。初期の実験では、ニューロンにおける電気活動の光ニューロモデュレーションが熱効果とは無関係に達成できることが実証された5。
試験管内の細胞は電磁スペクトルの様々な波長に反応するが、生体内での有益な反応は、より狭い波長範囲内で優先的に観察される。明らかに、可視光(400-700 nm)は目を貫通し、特殊な光色素(ロッド、コーン、およびいくつかの神経節細胞)を含む網膜細胞を活性化する。しかし、それは600 nm以下の光への生体内での曝露(そのような青や緑の光など)は、光受容のために特化されていない他の神経細胞に有益な効果を持つことができるかどうかは不明である。近赤外波長範囲への赤は、専門化された光色素を持っているように見えない細胞における生体内試験(in vivo)の有益な効果を誘導するのに最も効果的であることが示されている。これは、組織を透過するための異なる波長の能力に起因する部分がある:バイオレットや紫外線のような低い波長は透過率が低いように見えるが、赤や赤外の範囲の波長はより高い透過率を持っている。また、600nmより短い波長のエネルギーは、一般的に生体内の生体組織で散乱され、メラニンに吸収される傾向があるのに対し、水は1150nmより高い波長のエネルギーを大きく吸収する6。後述するように、この窓はまた、感受性の高い細胞内分子を励起するために発光エネルギーの能力と一致している6。このプロセスはエネルギー変換と呼ばれ、光によって励起された分子が電子的に励起された状態になり、一時的にその構造と機能を変化させることを意味している。このプロセスはエネルギー変換と呼ばれ、光によって励起された分子が電子的に励起された状態になり、その構造や機能が一時的に変化することを意味している。
LLLTの光生物学
LLLTのプロパティー
環境中の電磁波の主な発生源は太陽光である。太陽エネルギーには、可視スペクトルの全波長を含む電磁スペクトル内の波の豊富な組み合わせが含まれている。太陽エネルギーは多方向性があり、エネルギー波が空間的にも時間的にも同期していないことを意味する。LLLTは単色である点で太陽エネルギーとは異なり、潜在的に高い特異性と標的化された分子の生体変調を可能にする(図1)。一方、レーザーは、単色、単方向性、コヒーレントな電磁放射を特徴としており、かなりのレベルの集中エネルギーの送達を可能にしている。このため、レーザーの多くの生物医学的用途は、組織の非常に不連続な領域にわたってエネルギーの破壊的効果があることを特徴とする。レーザーの利点には、組織への高い浸透性、効率的な光ファイバ結合、および高い単色性がある。
図1 低レベルの光の特性
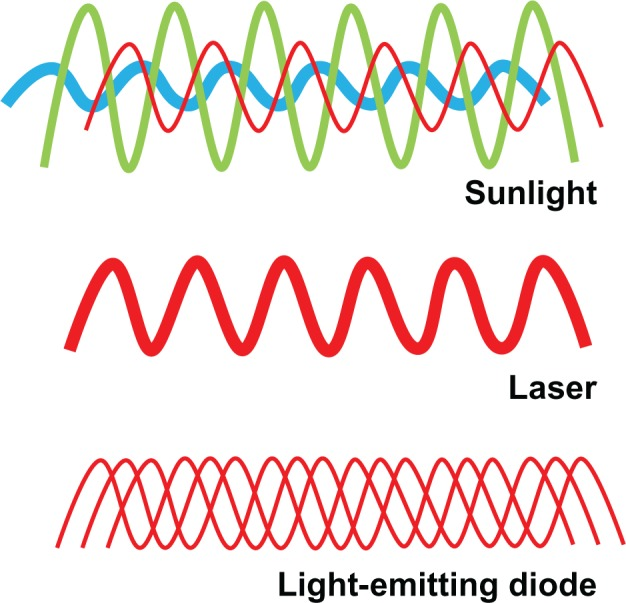
太陽光は、可視スペクトル全体に渡る波長を持つ非干渉波の組み合わせで構成されている。これに対し、レーザーは空間的にも時間的にも同期した単一波長(単色)の波を放射する。このように波長のコヒーレンスが高いため、高い出力密度でエネルギーを伝送することができる。最後に、低レベルの光は、共通のターゲットポイントにつながる異なる経路をとる単色または準単色の波で構成されている。波長、放射暴露、放射照度、および分画スキームは、低レベル光治療のアプリケーションに関連しているが、著者らは、非コヒーレンスがいくつかの神経代謝目的に有利である可能性を紹介している。非コヒーレンスは、活性化または傷害に応答して神経代謝を変調するために必要な時間の間に比較的低い電力密度で “治療 “波長での神経組織の曝露を可能にする、たとえこの時間が延長されている場合でも。
LLLTは、レーザーと同様にLEDアレイによって生成することができる。両方のソースは、目と脳の光生物学的変調に使用されている。レーザー光源は、単一の波長でコヒーレント光エネルギーの100%を生成する。彼らは高い組織の浸透を可能にし、彼らは内接領域のエネルギー伝送の利点を提供している一定のビーム幅を生成する。例えば、HD Laser™ CG5000(HD Laser Center、 Dallas、 TX)として知られる食品医薬品局(FDA)の認可を受けたレーザーは、ビームサイズが45mm、出力密度が最大1.6W/cm2、波長が1064nmで、組織への浸透性を最大限に高めている。レーザーのビーム幅は、より大きな領域にエネルギーを届けることができる光ファイバーに結合することで変更することができる。まだ、レーザーで処理することができる組織の領域は、いくつかの経頭蓋アプリケーションのために不十分である可能性があり、繰り返される単一のビーム露光は、通常必要である。LEDは、狭い範囲の波長(4〜10nm)の間の光の約95%を生成し、光はコヒーレントではない。LEDのビーム非コヒーレンスは、レーザーと比較して、1cm2のターゲット表面に送達されるエネルギー量に大きな違いがあることを説明している。レーザーが組織損傷を引き起こす可能性のある熱を発生させるのに対し、LEDはごくわずかな量の熱を発生させるため、熱損傷のリスクを低減させることができる8 が、レーザー出力を正しく選択すれば、低放射照度でも熱損傷のリスクはない。LEDは、効率的なエネルギー送達を可能にする人間工学に基づいた機能を持つアレイに取り付けることができる。LEDアレイとダイオードレーザーはコンパクトで携帯性に優れており、これは臨床現場での使用に適しており、LEDはFDAによってヒト試験では重要でないリスクのステータスを達成している。
LLLT研究に関連する主要な線量パラメータは、より標準化され始めている。LLLTの効果に関する混乱は文献で明らかであり、LLLTに関連するパラメータの標準化の欠如に起因している。投与量の詳細が明らかになるまでは、特定のLLLTの使用に関連するすべてのパラメータを報告するのが慣例となるべきである(表1、図2)。投与量が効果の主な決定要因である従来の薬理学とは対照的に、LLLTはまた、出力密度、エネルギー密度、周波数、分画、波長、接触モダリティ、ソース、および標的組織の物理化学的特性に依存している。
図2 光と組織の相互作用の原理
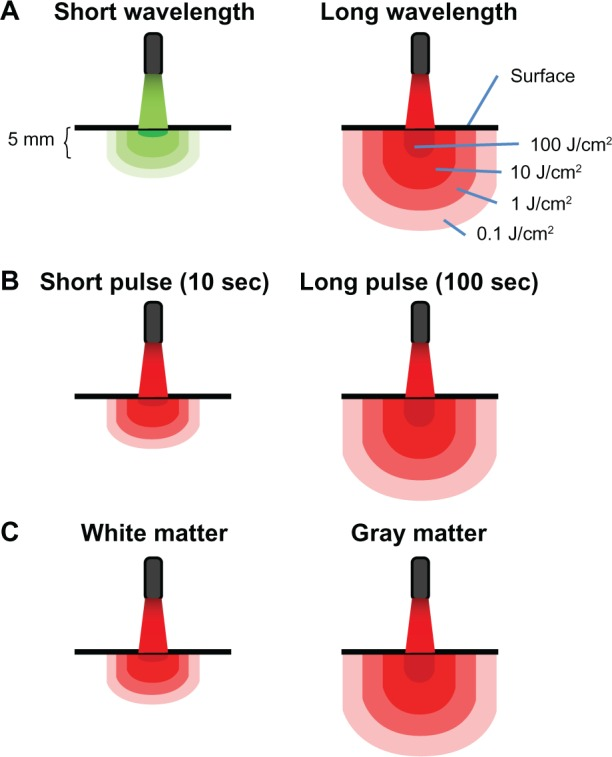
A)短い波長の光は組織への浸透性が低い。高い波長の光は高い組織透過性を示し、より深い構造物に治療レベルのエネルギーを供給する。高い波長にさらされた表面構造は、抑制的なエネルギー密度(例えば、100 J/cm2)にさらされることがあるが、表面を標的とした一定のパワー密度の光は、回折(波の曲がり)により、比例して高い組織体積で再分配される。光を多重に散乱させることで、波を拡散させることができ、治療量を増やすことができるため、より低い印加エネルギーで、より高い深度で効果的なエネルギー密度を得ることができる。B)放射曝露量(J/cm2)は、照射量(W/cm2)と時間の積であるため、一定の照射量の結果として組織に送達されるエネルギーは、曝露時間を長くすることで増加させることができる。したがって、組織への浸透もまた、露光時間によって影響を受け得る。低レベル光治療の源が高い露光時間で使用される場合、深部構造物は、アブレーション効果を回避しつつ、生体調節可能な量のエネルギーで治療することができる。C)最後に、組織は、光受容体の含有量、透過率、および緩和時間において異なる。これは、光の浸透における種間および領域間の変動(例えば、脳内の灰白質対白質)を説明する。さらに、神経組織のような代謝活性の高い組織では、光受容体の酸化還元状態の変化により、緩和時間にばらつきが生じることがある。これは、組織への浸透性に影響を与えるだけでなく、神経組織の活性化状態に応じて、低レベル光治療に対する神経組織の感受性にも影響を与える可能性がある。
表1 低レベル光治療(LLLT)の主なパラメータ
| パラメータ | 単位 | 説明 |
|---|---|---|
| 波長 | nm(ナノメートル) | 波長(λ)は、波のピーク間の距離だ。光は波の振る舞いを伴うエネルギーの一形態だ。光受容体は、異なる波長に対して異なる感度を示す。最も効果的なLLLT波長範囲は600〜1100nmである。人間の目に見える光は400〜700nmである。波長が長いほど、エネルギーは低くなる。 |
| エネルギー | J(ジュール) | エネルギー(E)は、プランク定数(h)6.626×10 −34 J秒(E = hv)による放射の周波数(v)である。光子のエネルギーは、放射線の周波数に依存する(Ephoton = hv)。光子は、質量がゼロでエネルギーの量子(原子によって得られるまたは失われる最小のE)を持つ電磁放射の粒子だ。エネルギー(J)=電力(W)×時間(秒)。 |
| 力 | W(ワット) | 単位時間あたりに転送または流れるエネルギー量(J)(W = J /秒)。 |
| 放射照度 | W / cm 2 | 表面積あたりの電力(W)(cm 2)。パワー密度または光の「強度」とも呼ばれる。放射照度=電力(W)/面積(cm 2)。 |
| 放射暴露 | J / cm 2 | 表面積あたりのエネルギー(J)(cm 2)。単位時間(秒)あたりの電力密度に相当する。フルエンス、エネルギー密度、または軽い「線量」とも呼ばれる。したがって、「線量」は曝露時間の変化によって簡単に変えることができる。ただし、同じエネルギー密度(J / cm 2)では、放射照度(W / cm 2)または時間のいずれかが変動すると、組織に異なるLLLT効果が生じる可能性がある。 |
| 曝露時間 | 秒 | 標的組織が光にさらされる時間。 |
| 波型 | 連続対パルス | 連続波は、経頭蓋アプリケーションに有利な場合がある。パルス波は熱効果を減少させる可能性がある。パルス平均電力=ピーク電力(W)×パルス幅(秒)×パルス周波数(Hz)。 |
| フラクションプロトコル | 分数の数 | 総投与量は、治療セッションまたは特定の期間の一部に分割し、特定の時間間隔(たとえば、分、時間、日)で区切ることができる。 |
| 絞り | 光ビームの面積 | 並列、収束、または発散することができる。開口部は、効率と組織浸透に影響を与える可能性がある。 |
| 配信モード | ビーム源から標的組織までの距離 | タイプ:浅い(または非接触)、接触、および深い。より広い領域を露光する必要がある場合は浅い方が望ましいが、発光ダイオードの組織浸透は低くなる。深部送達は、標的組織に対するビーム源の圧力を意味する。 |
図3 低レベル光治療(LLLT)のホルメティック効果
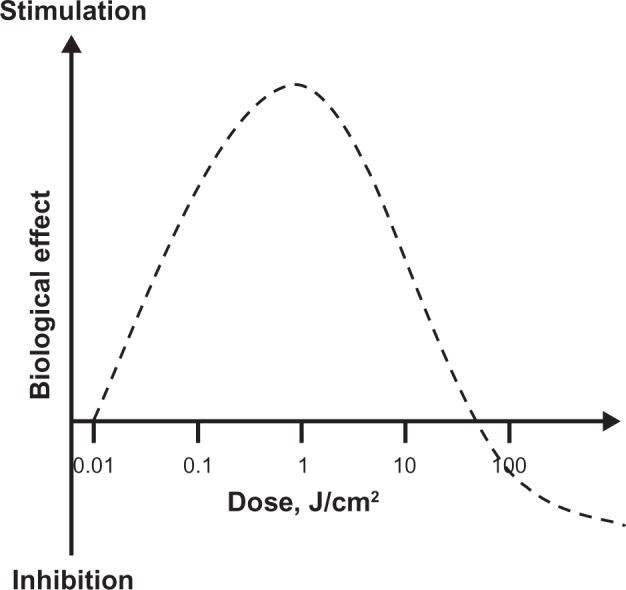
LLLTは古典的な線形の用量反応薬理学的効果を誘発しない。LLLTの効果は逆U字型の用量反応曲線によって特徴づけられる。線形効果は無視できるかもしれないが、最大の刺激効果は通常、中間用量で観察される。しかし、高用量では抑制効果が観察されるため、直線的な関係は維持されない。実際、非常に高用量のLLLTの抑制効果はコントロール条件(例えば、組織破壊)よりも悪いかもしれない。組織における光の調節効果に関する重要な観察は、中間線量での最大応答は、ベースライン条件と比較して生物学的変数の2倍以下の増加を表す傾向があるということだ。しかし、これらの効果は、特にエネルギー代謝が神経組織に関与している場合には、大きな関連性を持つことが示されている。したがって、ホルミシスはLLLTの神経治療アプリケーションの開発に不可欠な概念である。
光受容体と光受容体
電磁放射の豊富さを考えると、それは有機システムがそれを使用して、生物学的機能を維持するためのメカニズムを進化させていることは驚くべきことではない。電磁放射の取り込みは、実際には、地球上の生命を可能にする重要なプロセスである。生細胞による光エネルギーの取り込みは、光量子によって励起される生体分子の存在に基づいている。このような分子を電磁放射で励起し、その後のエネルギー変換を行うことが、任意の光生物学的効果のための条件となる。生物系には、光を吸収することができる分子には、特殊なものと非特殊なものの2種類があることがわかっている。エネルギー変換のための相当程度の特殊化を持つ高効率分子は、光受容体として知られている。これらには、クロロフィル(植物の光合成の過程で重要ロッドおよびコーンオプシン(視覚機能に重要な網膜光受容体メラノプシン(生体時計の調節に重要な一部の網膜神経節細胞に見られる)などの光色素分子が含まれる。
一方、光を吸収することができるが、光受容体器官とは統合されていない非特殊な分子は、光受容体と呼ばれている。光受容体は光を吸収する可能性があるが、通常は光処理とは直接関係のない代謝経路の一部である。光受容体は、光受容体よりもユビキタスで豊富である。実際、光受容体は生体システムに人工的に導入することが可能であり、初期の概念としてニールス・フィンセンが光治療法を開発し、1903年にノーベル生理学・医学賞を受賞している13 。LLLT光生物学の理論の中心的な概念は、その作用機序が主に光受容体機能の変調によって媒介されていることだ。光受容体の特性の同定と特徴付けは、光生物学の分野で進行中の作業であるが、光生物学の最近の研究では、光受容体の効果的な刺激が生理学的および臨床的な関連性のある効果を誘導することができることをサポートしている。この考え方は、光を吸収して細胞の機能や構造を変化させる光受容体分子が、目のような特殊な感覚器官だけでなく、実質的にすべての生きている細胞に存在することに由来する(図4)。
図4 網膜の光受容体と光受容体に対する光の差動効果
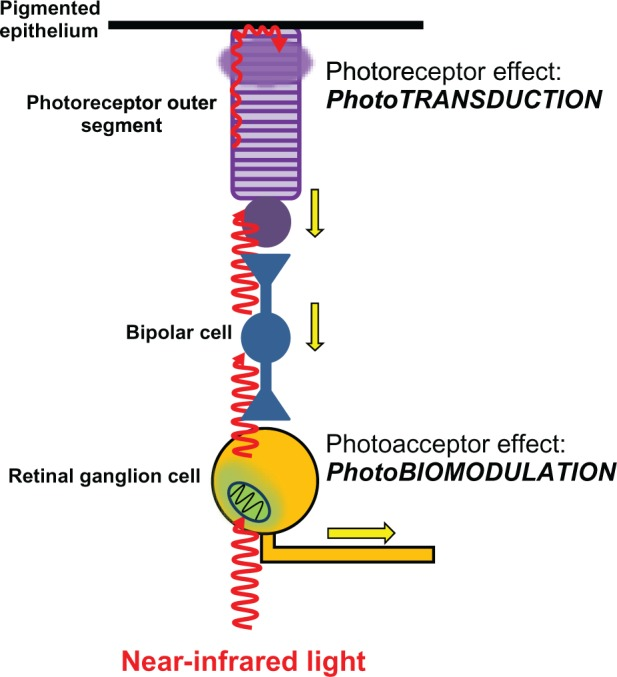
光は網膜に到達し、網膜の異なる層を通過して一番外側の光受容体層に到達する。その後、光は杆体と円錐体の中の光受容体ロドプシンを励起し、光伝達のプロセスを誘発する。光伝達は、光受容体細胞の過分極、神経伝達の変化、双極細胞や神経節細胞の活動電位(黄色の矢印)を引き起こす。これらの効果は、視覚情報処理の開始を表している。光はまた、網膜神経節細胞を含むニューロンの光受容体を直接興奮させることができる。赤色から近赤外スペクトルの主な光受容体は、ミトコンドリア呼吸酵素チトクロム酸化酵素である。神経細胞のチトクロム酸化酵素に対する光の効果は、視覚処理とは独立した細胞の生体エネルギー機構の調節を誘導する。しかし、光生物学的な調節は、ニューロンの生理学と恒常性に大きな意味を持っている。
LLLTの光生物学におけるもう一つの重要な概念は、発色団のことだ。発色団とは、光の吸収を担う光受容体や光受容体分子内の特定の部位のことだ。発色団は通常、タンパク質構造内の有機補酵素や金属イオンであり、ボルツマンの法則に従って基底状態から励起状態へと励起可能な電子を含んでいる14 。細胞内では、発色団は共鳴系と金属錯体から構成されている。共鳴系では、ロドプシンに結合した発色団である網膜のように、単結合と二重結合を交互に持つ構造の中で光による電子励起が起こる。あるいは、金属錯体では、電子励起は、遷移金属の結合を可能にする開環または閉環したピロール環内で起こる。発色団と呼吸酵素との関連は、機能的な神経制御に大きな意味を持っている。発色団の異常な酸化還元反応性は、タンパク質の歪みと構造的に結合している。発色団を含む酵素の場合、これにより、電磁的自由エネルギーの流れを基質変換の化学的エネルギーの流れに非常に効率的に結合させることが可能になる14、15 。後述するように、哺乳類の組織では、外部光子なしで自然に機能するように適応しているにもかかわらず、特定の発色団の感光性が生理的意義を維持していることは驚くべき発見である16 。例えば、クロロフィルaのポルフィリン環は430nmと662nmに吸収のピークを持っている。同様に、人間の網膜のコーンは、異なるスペクトル感度を持つ3つのオプシンのいずれかが含まれており、発色団11-シス-網膜またはビタミンAの誘導体である11-シス-3、4-ジヒドロレチナール、にリンクされているため、430nm(青530nm(緑および560nm(赤)の波長に最大に敏感であるコーンがある。ヤング-ヘルムホルツ三色理論によると、我々が知覚する色は、主に脳に網膜内のコーンから送信される “青、緑、赤 “の信号の相対的な貢献によって決定される。
また、光の受光が視覚機能とは無関係に生物学的システムに重要な影響を及ぼすこともよく知られている。ヒトを含む哺乳類網膜内の光受容は、桿体および錐体細胞の活動に限定されるものではなく、少数の本質的に感光性の網膜神経節細胞にまで及んでいる。網膜の内層にあるこれらの神経節細胞は、概日同調や瞳孔反射を含む様々な非画像形成光反応のために環境照度に関する情報を提供する光受容体として機能している17 。興味深いことに、松果体にはロドプシンやメラノプシンに似た光受容体であるピノプシンが含まれている。ピノプシンは、青色光(470 nm)に敏感なオプシン分子と網膜発色団から構成されている19 。ピノプシンを介して、環境光は、視覚経路とは無関係にメラトニンのリズミカルな産生を制御する内因性概日リズムペースメーカーをリセットすると考えられている。
LLLTの分子生物学的標的
初期の研究では、LLLTは細胞培養の生きた細胞に顕著な効果(試験管内試験(in vitro)効果)があることが示された。例えば、LLLTで処理した線維芽細胞は、代謝、DNA合成、および成長率の加速を示している20。試験管内試験(in vitro)での結合組織に対するこれらの顕著な肯定的な効果は、炎症の治療や生体内試験(in vivo)での創傷治癒の改善にLLLTを適用することにつながった。LLLTの顕著な効果が最初に記述されて以来、注目されてきた問題は、細胞内のどのような分子や分子がLLLTの効果を担うような特徴を持っているかということだ。前述したように、赤から近赤外領域の波長は、生体内で最も重要な応答を生成することが発見されており、その結果、その光生物学的応答の観点から最も特徴的である。哺乳類の組織における光受容体の中で最も特徴づけられたものの一つは、ヘモグロビンである。ヘモグロビンは、その酸化還元状態に基づいて異なる光吸収を示す。この特性は、その定量化を可能にし、パルスオキシメーターの原理および臨床における酸素化モニタリングの他の方法である。しかし、LLLTは、培養中の線維芽細胞、上皮細胞、HeLa細胞、およびニューロンにおいて有益な効果を示している。ヘモグロビンは排他的に赤血球で発現しているので、このことは、ヘモグロビンとは異なる代替の細胞内分子がLLLTの効果を媒介する主な光受容体でなければならないことを示唆している。ヘモグロビンのほかに、赤から近赤外域で最も一般的な光受容体は、ヘム含有金属タンパク質であるミオグロビンとチトクロームオキシダーゼである。それにもかかわらず、スーパーオキシドジスムターゼ、チトクロムc、チトクロムb、一酸化窒素合成酵素、カタラーゼ、グアニル酸シクラーゼ、クリプトクロムなどの他の分子も光受容能を有することが示されている8。これは、単一の分子標的と特定の有効波長との対応が単純ではないという事実によって複雑になっている。たとえば、このような還元ニコチンアミド-アデニンジヌクレオチド(NADH)-デヒドロゲナーゼなどのフラボタンパク質は、近赤外スペクトル領域にバイオレットから青と赤の両方で光受容体として同定されている21同時に、末端酸化酵素と内因性抗酸化酵素スーパーオキシドジスムターゼはまた、異なる光受容体の吸収スペクトルで明らかに重複を表す高波長(670〜680 nm)で吸収ピークを示している21、22 これは、特定の分子が大部分の生物学的効果を媒介することが判明した場合でも、他の可能な光受容体もまた、特定の応答を引き出すために少なくともある程度貢献することができることを意味する。
特に注目すべきは、神経系の実験は、LLLTの効果を媒介する主要な光受容体の正体についての手掛かりを提供する最初のものであった。加藤ら23は、鳥の脳内のミトコンドリアは、生殖腺の成長に関連する光生物学的プロセスのための光受容体として働く可能性があることを示唆した。その後の実験では、単離されたミトコンドリアが赤や近赤外の単色光の照射に敏感であることが示された。例えば、単離されたラット肝臓のミトコンドリアに光を照射すると、アデノシン三リン酸(ATP)合成と酸素消費量が増加した。光はミトコンドリアの光学特性を変化させ、ミトコンドリアにおけるアデノシン二リン酸/ATP交換、リボ核酸(RNAタンパク質合成を増加させ、酸素消費を増加させる25 。これらのデータは、LLLTの効果を媒介する一次光受容体がミトコンドリアに局在しているだけでなく、細胞内でLLLTを吸収する分子が呼吸鎖の構成要素である可能性を示唆している25。
ミトコンドリアの光受容体をさらに同定するために、アクションスペクトル解析を行った。アクションスペクトルとは、波長の関数としてLLLTに対する生物学的反応の記述である。例えば、培養中のHeLa細胞のRNA合成の速度は、他の波長では効果を発揮しないのに対し、特定の波長で増加させることができる。通常、波長の範囲(すなわち、バンド)は、応答を誘導するのに有効であり、最大の効果を誘導する波長は、この範囲内で見つけることができる。次に、作用スペクトルのバンドを、可視域から近赤外域の金属-リガンド系吸収スペクトルのバンドと比較することができる。この作用スペクトル分析の方法は類推に基づいており、非常に類似した吸収スペクトルを持つ光受容体を区別するものではない。しかし、その使用は、LLLTの効果を媒介する主な光受容体を特定するための大きなヒントを提供した。HeLa細胞におけるRNA合成の作用スペクトルは、400〜820 nmの範囲でいくつかのピークを示している。範囲580〜860 nmは、620 nm、680 nm、770 nm、および820 nmでよく定義された最大値を持つ620〜680 nmと760〜830 nmの範囲で2つのダブレットバンドを示している。細胞代謝の調節に参加している生体分子と遷移金属とその錯体のためのスペクトルデータの比較分析は、スペクトルの領域400-450 nmと620-680 nmは、金属リガンド系における電荷移動を伴う錯体のものと一致することを明らかにした。データは、2つの可能なシナリオを示唆した:いずれかの複数の光受容体は、このスペクトルパターンを担当しているか、または単一の光受容体分子は420から450 nmと760から830 nmの吸収ピークを持つ複数の金属-リガンド発色団を提示す。第二の選択肢と矛盾しないように、作用スペクトルのすべてのバンドは、ミトコンドリア酵素チトクロム酸化酵素の吸収スペクトルと一致している21。
現在、チトクロム酸化酵素は、電磁スペクトルの赤から近赤外領域の光の主要な光受容体であることが認められている26、27 。チトクロム酸化酵素は、細胞の生命エネルギー、特に網膜と脳の神経細胞にとって重要な酵素だ28 。シトクロム酸化酵素は、膜貫通電気化学的勾配を形成するレドックス結合プロトンポンプと、エネルギー貯蔵分子 ATP の合成のための速度制限ステップの両方の役割を果たし、効率的なエネルギー伝達装置を構成している。シトクロム酸化酵素の活性は神経細胞の機能を確実に定量化するために広く利用されており、代謝活性の最もよく知られた神経細胞内マーカーとなっている。シトクロム酸化酵素には4つの酸化還元金属中心が存在する。CuA、CuB、Hem a、およびHem a3である。シトクロム酸化酵素の触媒サイクルでは、電子は水溶性のシトクロムcからCuAへ、次にHem aへ、そして酸素が水に還元される二核中心a3-CuBへと順次移動する。620nm(範囲613.5-623.5 nmの範囲825 nm(範囲812.5-846 nmの範囲760 nm(範囲750.7-772.3 nmの範囲および680 nm(範囲667.5-683.7 nmの範囲それぞれCuA還元、CuA酸化、CuB還元、およびCuB酸化に対応している:これらの金属中心は、酵素のための異なる光吸収ピークを決定する。酵素の酸化還元状態は、完全に還元された状態から完全に酸化された状態まで様々であり、1つ、2つ、または3つの金属中心の酸化を含む中間状態がある(混合価数酵素)。特定の配列におけるこれらの中心の電子励起は、チトクロム酸化酵素内の電子の流れに差動的な影響を与える。これは、DNA合成速度の変化によって示されるように、光生物学的な直接的な相関関係を持っている。逐次照射を用いた実験の結果、チトクロム酸化酵素は完全に還元された状態や完全に酸化された状態では一次光受容体になり得ず、中間形態のいずれかにある場合にのみ一次光受容体になることが示されている32、33 。完全に酸化された形態や還元された形態はLLLTに対して鈍感であるのに対し、部分的に還元された酵素はLLLTにより吸光度とプロトンポンプ活性が増加することが示された26 。このように、赤色から近赤外領域の単一波長を使用する場合と比較して、生物学的応答を誘導するのには最適ではない。異なる酸化状態でのチトクロム酸化酵素の吸収スペクトルは、LLLT.32への生物学的応答の作用スペクトル(波長の関数としての光応答)を平行にすることが発見されている神経組織では、チトクロム酸化酵素は、その吸収スペクトルの最も豊富な金属タンパク質と波長ピーク(670 nmと830 nm)は非常に触媒活性のピークと試験管内試験(in vitro)でATP含有量と相関している8。
LLLTの作用機序
この酵素は酸化的エネルギー代謝に関与する重要な分子であり、ニューロンは代謝エネルギーを生産するためにチトクロム酸化酵素に依存しているので、チトクロム酸化酵素がLLLTの主要な光受容体であるという事実を、有益な目と脳の効果と和解させることは容易である。細胞呼吸システムの主要な構成要素であるこの酵素を制御することで、全細胞の生理機能に大きな影響を与えることが期待されている。この考えに沿って、光励起中および光励起後の細胞内効果が数多く報告されている。これらのデータに基づいて、LLLTの作用機序に関する機構論的仮説が進められてきた。LLLTの作用機序は、一次作用(光曝露中)と二次作用(光曝露後)に分けられる。
一次効果
一次効果とは、光によって励起された際に光受容体に生じる直接的な光化学的変化を指す。一次効果は光に依存しており、標的組織が光に曝されている間のみ発生する。現在の証拠は、少なくとも3つの異なる一次効果を支持するために利用可能である。最初に、最も重要な一次効果は、呼吸鎖の構成要素の酸化還元変化である。LLLTはチトクロム酸化酵素の還元または酸化を誘導することができる。チトクロム酸化酵素の酸化還元状態の変化は、電子の流れの変化を意味する。LLLTはチトクロム酸化酵素の存在下でチトクロムcの酸化を増加させ、酸素消費量とミトコンドリア膜電位の増加を引き起こし、ミトコンドリア透過性遷移孔を活性化させる21、20。第二の可能性のある一次効果は、直接光力学的作用を介した一重項酸素と一電子自動酸化を介したスーパーオキシドイオンを含むフリーラジカルの生成である21、20。この効果の意義は、活性酸素は呼吸の有害な副産物だけでなく、細胞のシグナル伝達に重要な役割を持っているということだ。LLLTの第三の主な効果は、電気または光振動に基づく吸収発色団の局所的な過渡的な「加熱」である21 。このような振動の効果はより一般化され、水を含む標的組織内のすべての分子に影響を与えるようである。LLLTは、水素結合を強化し、共鳴分子間エネルギー移動による迅速なエネルギー移動を可能にする大型の水素結合ネットワークを誘導することができる。このように、LLLTはブラウン運動にバイアスをかける非平衡電気揺らぎを引き起こし、熱伝達なしで電子ポンピングをサポートするメカニズムを誘導することができる14。
二次効果
LLLTの二次効果は一次効果の結果として発生し、細胞の恒常性を変化させる生化学反応のカスケードを含む34、35。二次効果は、酵素機能と遺伝子発現の後続の変調を伴うセカンドメッセンジャーの活性化を特徴とする。二次効果は、光曝露後数時間から数日後に発生する可能性があり、マクロ効果の増幅をもたらすシグナル伝達経路の活性化が関与していることが特徴的である。これらはカスケード反応の一部として発生するため、二次効果は多元的である傾向がある。LLLTはミトコンドリアから核への逆行性シグナル伝達経路を活性化する。このシグナル伝達経路は、光受容体を含むミトコンドリアから核に情報を送ることで、ストレスに対する適応的な反応を誘導し、遺伝子発現のレベルを変化させることで応答することができる。この経路の初期段階では、NAD/NADH比とミトコンドリア膜間電位の上昇、一酸化窒素の解離、ATPプールの改変が提案されている。ATPのさえ小さな変化は、細胞の代謝を変更する。ATPはまた、キナーゼのその後の活性化と、環状アデノシン一リン酸レベルを変更し、内側のカルシウム電流と細胞内stores.35からのカルシウムの放出を誘導するためにP2受容体(P2XとP2Y)を活性化する。これらの二次効果の下流の結果は、遺伝子発現の変化に関与し、これは、マイトジェネリックシグナル、表面分子の発現、および炎症性、酸化還元状態、およびアポトーシスを制御するタンパク質の発現に影響を与える(図5)。
図5 低レベル光治療(LLLT)の細胞内作用機序
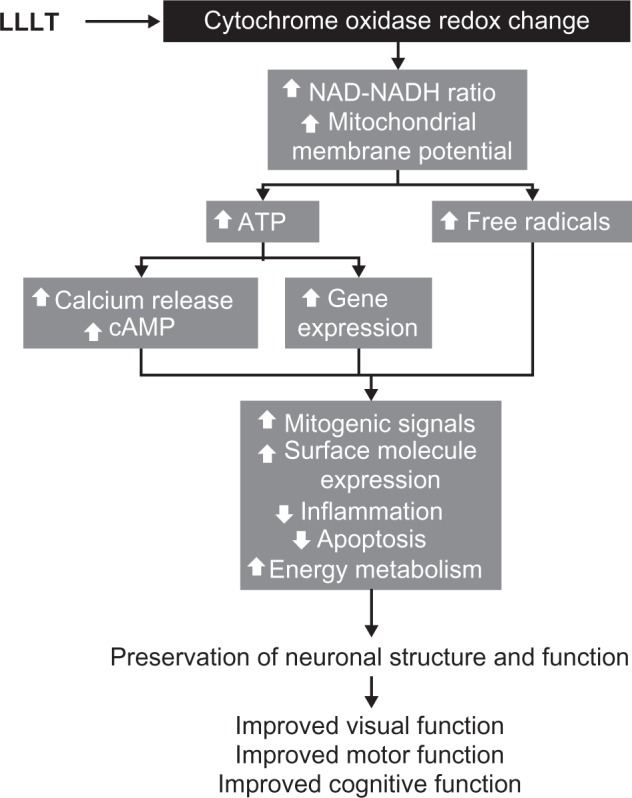
光生物学的調節は、細胞内多能性効果のカスケードをもたらす。光はチトクロム酸化酵素の発色団に吸収され、その酸化還元状態の変化を誘導する。ミトコンドリア内膜の酵素の酸化還元反応により、電子の流れが加速され、ニコチンアデニンジヌクレオチド(NADH)の消費量が減少し、ミトコンドリア膜電位が上昇する。これらの変化は、アデノシン三リン酸(ATP)の合成を促進し、フリーラジカルの生成を増加させる。増加したATPの可用性は、カルシウムと環状アデノシン一リン酸(cAMP)の形成のリリースを誘導するキナーゼの活性化を可能にする。カルシウム、cAMP、およびフリーラジカルは、セカンドメッセンジャーとして作用し、核レベルで異なる代謝経路を活性化することができる。細胞環境に応じて、これらの細胞の変化は適応的であり、臨床的な改善につながる神経生理学の強化を促進する。
LLLTの神経組織への影響
証拠の成長している体は、神経組織におけるLLLTの強化または保護の役割をサポートしている。神経細胞は、持続的な好気性エネルギー生産に大きく依存している高度に専門化された細胞である。神経細胞におけるミトコンドリアの好気性代謝は、神経伝達における細胞膜の再分極、シナプス形成、および細胞の生存を含む電気生理学的、神経可塑性、および神経保護機能の基礎となっている。また、エネルギー代謝は、ニューロンネットワークの適切な機能、時空間のデータ統合、視覚を含む感覚処理、運動機能の活性化、記憶などの高次認知機能の発現にも重要である。ミトコンドリアの酸化的代謝の障害は、神経細胞の機能障害、神経学的障害、神経変性と関連していることが実証されている36 。
最近の研究では、神経組織上のLLLTの効果はまた、チトクローム酸化酵素活性の強化によって少なくとも部分的に媒介されていることが確認されている。LLLTに曝露したラットの神経細胞培養物は、チトクロームオキシダーゼ活性の増加を示した9。LLLTによって誘発されるチトクロームオキシダーゼの増加は、筋肉などの代謝要求の高い他の組織で観察されたものと平行している37。さらに、LLLTは部分的にシアン化カリウム、シトクロム酸化酵素阻害剤によってブロックされた酵素活性を復元し、有意に神経細胞死を減少させた9。このことは、神経細胞の代謝に対するLLLTの増強効果は、シトクロム酸化酵素活性の増強に限定されるものではなく、ATP産生の増強、36神経伝達、8遺伝子発現、38、39および試験管内試験(in vitro)での細胞死の防止などの拡張効果を発揮する可能性があることを示している40、41
線条体と皮質ラットの神経細胞培養物をミトコンドリア複合体Iを阻害するロテノンと1-メチル-4-フェニルピリジニウム(MPP +)毒素に曝露したときに保護効果が観察された。LLLTは、有意に細胞のATP含有量を増加させ、細胞死を受けているニューロンの数を減少させ、未処理のものと比較して、ロテノンまたはMPP +にさらされたニューロンの活性酸素種と活性窒素種の発現を減少させた41.さらに予防的な試験管内試験(in vitro)LLLTは、ミトコンドリア毒素によって誘導される神経変性からニューロンを保護することで非常に効果的であることが証明されている9、36、38、40 LLLTの前処理は、線条体と皮質ニューロンの両方でロテノンまたはMPP +誘導アポトーシスを抑制する38 LLLTはまた、正常に動物モデルで神経の修復と神経損傷の軽減のために採用されている42 とそれは臨床的にヒトの痛みを和らげるために使用されている。
神経組織上のLLLTの二次的な効果の数も含めて、記述されている。(1)抗アポトーシスタンパク質Bcl-2の発現増加とプロアポトーシスタンパク質Baxの発現減少38 (2)アミロイドβタンパク質への曝露後のアポトーシス細胞の数の減少44 (3)毒素によって不活性化された皮質ニューロンの機能の改善9。 47 生体内試験(in vivo)では、LLLTは外傷後の末梢神経と中枢神経の再生を誘導し、42、47、48は神経炎症を減少させ、42はメタノール誘発性の光受容体変性を防ぎ、12は複合体I阻害によって誘導される網膜神経変性を防止する。
眼におけるLLLTの有益な生体内試験(in vivo)効果
光組織の浸透は、ターゲット組織の種類、波長、およびLLLTのソースの両方に依存する(図2)。網膜は、これらのrequirements.51-53を満たすためにミトコンドリア由来のATPに主に依存している非常に高いエネルギー需要を持つニューロンが含まれている。ミトコンドリアは、細胞呼吸、エネルギー代謝、イオンバランスを統合し、エネルギー維持と細胞生存のための恒常的に首尾一貫した適応を行っている。したがって、他の神経細胞集団と同様に、網膜神経細胞は、酸素またはグルコースの枯渇、およびATPを生成するためにそれらの両方を使用するミトコンドリア機械系の機能不全を含む、酸化ストレスおよびエネルギー枯渇につながるイベントに対して非常に脆弱である54、55。過去30年間に蓄積された証拠は、遺伝的要因と環境的要因の両方によって誘導されるミトコンドリア機能不全が、視神経症の主な形態的特徴である網膜神経変性の病因に重要な役割を果たしていることを示唆している56 。
緑内障や加齢黄斑変性症などの一般的な眼疾患や、アルツハイマー病などの神経変性疾患でさえも、ミトコンドリア機能障害によって誘導される視神経障害を特徴とすることがますます認識されるようになってきている60-62。また、最も一般的な原発性ミトコンドリア障害であるリーバー視神経障害は、失明の約2%を占めている63 。また、網膜および視神経の変性に起因する失明を特徴とする多くの遺伝性および後天性疾患も、ミトコンドリア機能不全と関連している。リーバーの遺伝性視神経障害のほかに、視神経障害とミトコンドリア障害を特徴とする遺伝性疾患には、リー症候群、64、65 フリードライヒ失調症、59、66 筋弛緩性てんかん、67 ミトコンドリア脳筋症-乳酸過敏症および脳卒中様症候群、68 遺伝性痙性麻痺、69 および難聴-ジストニア-視神経萎縮症候群などがある。同様に、ミトコンドリア機能不全と関連した視神経障害を特徴とする後天性疾患には、タバコ・アルコールによる弱視、クロラムフェニコール、エタンブトール、一酸化炭素、クリオキノール、シアン化物、ヘキサクロロフェン、イソニアジド、鉛、メタノール、プラスモシド、またはトリエチル錫による中毒などがある66。
LLLTの眼への有益な効果は、ウサギとラットの外傷性視神経損傷モデルで低エネルギーヘリウムネオンレーザー照射を用いた初期の研究で検証されている71、72。受傷直後にLLLTを開始した場合、視神経機能はより有意な改善を示し、治療開始を2時間、5時間、24時間に遅らせると効果が徐々に失われた。さらに有意なことに、受傷直前に開始されたLLLTは、外傷後の神経損傷を遅らせる効果もあった。これらの研究は、その有益な効果が重症の神経では観察されなかったのに対し、LLLTは中程度の損傷を受けた神経に有効であったことを示したので、これらの研究も重要であった。このことは、光に応答することができる生理学的に実行可能な神経基質が必要であることを示唆している。LLLTが神経細胞の修復を誘導することで作用した可能性は低いが、むしろ、光は免れた神経線維の機能を強化することで作用した可能性がある。
ミトコンドリアのエネルギー代謝の混乱が主要なメディエーターである傷害の状況でLLLTが網膜保護を提供する可能性があるという最初の証拠は、メタノールによって誘導された網膜傷害のモデルを使用して実証された12。これらの変化は、光受容体の毒性と一致している。LLLTは、電気網膜応答のわずか28%の減少によって示されるように、メタノールによって誘導される機能障害を防止した。LLLTはまた、メタノールによって誘発された網膜構造の破壊を保護した。メタノールは網膜浮腫、ミトコンドリアを含む光受容体の内側のセグメントの腫脹、および光受容体の核の形態的変化を誘発した。対照的に、LLLT共役ラットは対照ラットと区別がつかない網膜組織学を示した。これらの効果は、670nmと5分、25分、および全身性メタノール投与後50時間を与えられた3つのフラクションに分割された12 J / cm 2のエネルギー密度でLEDを使用して誘導された。これらのパラメータはまた、培養や創傷治癒における視覚ニューロンの細胞増殖を誘導するのに有効であることが知られている12。
最近の研究では、LLLTが加齢黄斑変性症の予防に臨床的に関連している光毒性の影響を防ぐのに有効である可能性があるという証拠が示された。LLLTの光受容体保護効果は、光毒性によって損傷が誘発された場合にも明らかになる。3時間1800 lxでの白色光は、色素沈着ラットの網膜の外側の核層に重大な損傷を引き起こす。この構造的損傷は、網膜電図のb波の減衰を伴う。LLLTは、外側核層の損傷の延長を減少させ、網膜電図のb波の振幅を維持した。LLLTは670 nm、9 J/cm2、60 mW/cm2のLLLTを5日前と5日後にアルビノラットに明るい光で光毒性を与えた。網膜の光毒性損傷は、外核層の25%〜75%の菲薄化、光受容体の変性、網膜色素上皮の損失、および微小グリアの浸潤を特徴としている。この一連の実験では、光毒性損傷の前にLLLTを投与することで、非投与群で観察された形態学的変化の防止に非常に効果的であった。また、光毒性に対するLLLTの網膜保護効果には、ミクログリア侵襲の減少、ストレス関連分子の減少、神経保護分子の増加などが含まれていることが示された。LLLTの保護効果は、フラッシュ誘発網膜電図で決定されたように機能レベルでも観察された。驚くべきことに、LLLTの保護効果は長続きし、光受容体の機能は損傷後1ヶ月と遅くまで保存された。また、LLLT単独では感光体機能に有意な影響を与えず、ストレス関連因子の発現にも影響を与えなかった。LLLTによる光毒性による光受容体細胞死の予防は、光損傷によってアップレギュレートされた175の遺伝子のうち126の発現の減少と関連している75。
LLLTはまた、開発中の光受容体の変性を誘導するロドプシン変異を特徴とする網膜色素変性症のラットモデルで保護効果を示している。ラットの仔は、光受容体の発達の臨界期に5日間670 nm、50mW / cm 2、および4 J / cm 2でLLLTで処理した。LLLTは、網膜チトクロム酸化酵素と神経保護因子スーパーオキシドジスムターゼと毛様体神経栄養因子の濃度を増加させた。このモデルでは、LLLTはまた、70%の光受容体細胞死の割合を減少させた。
最近の証拠はまた、LLLTは網膜神経節細胞の変性から保護し、この効果は行動的に意味のあることをサポートしている。これは、ミトコンドリア複合体I阻害剤ロテノンによって誘導される網膜変性の生体内試験(in vivo)モデルで実証されている。ロテノンはまた、ラットの二者択一視覚課題において、逃走潜時と試行成功率にも障害を与える。これらの行動障害は、神経節細胞および網膜神経線維層の変性と相関している。これらの変化は、網膜と中枢視覚経路の代謝能力の低下として明らかな機能的脱分化を誘発する。すべてのこれらの機能的および構造的変化は、用量依存的な方法でLLLT 630 nmによって防止された。ロテノン注射後の6つの画分(画分ごとに3.6 J / cm 2、1日1画分)で与えられた21.6 J / cm 2の合計高用量は、視覚機能障害と網膜神経変性を防止するのに有効であった。LLLTはまた、上側の小室、側方の帯状核、一次視覚野、および二次視覚野の代謝能力の保存として観察された神経毒によって引き起こされる代謝脱分化を防止した。これに対して、ロテノン注射後に3画分(1画分あたり3.6J/cm2)で10.8J/cm2の総低LLT用量を投与しても、網膜の変性を防ぐ効果は認められなかった。しかし、網膜がロテノン投与の2日前にLLLTで予防的に治療されたとき、低LLLT用量は網膜神経変性と視覚機能障害の予防に効果的であった。
霊長類の研究では、傷害後1時間後、24時間後、72時間後、96時間後にLLLTを投与した場合、光凝固によって誘発される網膜の機能的および形態的傷害を減少させるのに有効であることが示されている。LLLTはまた、鼓膜(加齢黄斑変性の黄色い沈着物)の動員と眼圧の低下を誘導し、これらの有益な効果は治療後数ヵ月後に明らかになった77。
表2 眼に対する低レベル光治療の生体内試験(in vivo)での有益な効果
| 光源 | 波長 | 用量 | 効果 | 関連性 | 参照 |
|---|---|---|---|---|---|
| He-Neレーザー | 632.8 nm | 10.5 mW、ビーム幅1.1 mm×2分、毎日2週間 | 視神経挫滅損傷後の保存された構造と機能(ラット、ウサギ) | 視神経の外傷 | Schwartz et al、71 Assia et al、72 |
| GaAlAs LED | 670 nm | 28 mW / cm 2、12 J / cm 2(3分割) | 全身のメタノール光受容体毒性後の保存された構造と機能(ラット) | メタノール中毒 | Eells et al、12 |
| GaAlAs LED | 633 nm | 2 mW / cm 2、21.6 J / cm 2(6分割) | 硝子体内ロテノン注射後の保存された構造と機能(ラット) | レーバー遺伝性視神経症 | Rojas et al、49 |
| GaAlAs LED | 670 nm | 16 J / cm 2(4分数) | レーザー網膜光凝固術後の保存された構造と機能(サル) | レーザー誘発網膜損傷 | Eells et al、76 |
| GaAlAs LED | 670 nm | 50 mW / cm 2、20 J / cm 2(5分割) | P23H-3ラット(ラット)の保存された構造 | 網膜色素変性症 | Eells et al、76 |
| GaAlAs LED | 670 nm | 50 mW / cm 2、360 J / cm 2 ( 4分割) | 光毒性後の保存された構造と機能(ラット) | 光による網膜の損傷 | Qu et al、73 |
| ILPD | 904 nm | 4500 mW / cm 2、45,000 J / m2、3MHzでパルス | 黄斑変性症の86歳の男性(ヒト)の機能改善 | 加齢性黄斑変性症 | Rodriguez-Santana et al、77 |
脳におけるLLLTの有益な生体内試験(in vivo)効果
経頭蓋効果
光が脳に浸透して生物学的効果を発揮する能力は、中枢神経系の構造物に存在する光受容体分子を発見した後に初めて推測された。例えば、松果体にはピノプシンという光受容体があり、周囲の光の変化に敏感で、概日リズムの調節に関係していると考えられている19 。光が頭蓋を透過して脳に到達することが実証されている78 。630 nmから800 nmの間の波長の光子は、皮膚、結合組織、筋肉、骨、脊髄などの比較的透明度の低い組織の層でも28 mmまで移動することが示されており、生きているラットの腹側表面では総エネルギー密度の約6%が検出可能である42、80。灰白質では、赤色光および近赤外光の透過は、表面から 1 mm の位置で最大 80%まで光学パワーが減衰する Beer-Lambert の法則に支配されている81 。しかしながら、固体臓器では、この深さでの近赤外光の実際のパワー密度は、後方散乱と建設的干渉により、入射面でのパワーの最大 3 倍と推定されている82 。組織への光の透過は、波長だけでなく、ターゲット組織の光学特性にも依存する。81 可視および近赤外スペクトルの範囲内では、中枢神経系と末梢神経系の両方の白質が入射光の大部分を反射し、低レベルの吸収と短い透過深度を示すことが示されている83 。最後に、光の透過性は波長や特定の組織に依存するだけでなく、種間での透過性にも大きな差が見られている。81 光と組織の相互作用のこの大きな違いの原因は、水分とタンパク質の含有量の違いによって説明することができるが、この観察は、動物モデルで生成されたLLLTデータがヒトに適用されるときに考慮する必要がある明らかなトランスレーショナルな意味合いを持っている。最後に、LLLTの送達モダリティもまた、経頭蓋生体内試験(in vivo)アプリケーションに関連している(表1)。例えば、LEDとの非接触送達モダリティは、全身の治療を含む広範な表面の露出を可能にする。LEDのモンタージュは、潜在的に人間の頭全体と全身のLLLTのための人間工学的配慮を持って構築することができる。対照的に、レーザー光源と組み合わせた接触モダリティは、局所的なエネルギー送達が必要な場合に理想的かもしれない。これは、広範囲の照射では接続性が損なわれる可能性のある機能不全神経ネットワーク内の特定のノードの細胞機能を高めるのに有利である。同様に、局所的な経頭蓋的LLLTは、切除後の腫瘍部位に隣接する健康な組織の神経保護のために、残留腫瘍の光生物学的変調を誘発するリスクなしに利用できる可能性がある。経頭蓋適用では、常に眼は適切にレーザー光から保護される必要がある。
Rojasら49は、生体内での経頭蓋デリバリー時に、LLLTは、チトクローム酸化酵素とスーパーオキシドジスムターゼ活性の増加によって測定されるように、全脳の代謝および抗酸化有益な効果を誘導することを実証した最初の人であった。それは、これらの効果は、生体内試験(in vivo)でLLLTの使用で観察されている神経保護と機能強化効果の数に関連している可能性がある。以下に提示されたデータは、LLLTは、エネルギー代謝の障害を特徴とする神経血管、神経変性、および精神疾患の治療に使用される可能性があることを原理実証を示している。注目すべきは、有益な効果を発揮することが示されているエネルギー密度で経頭蓋的に与えられたLLLTはまた、組織学的または行動学的な悪影響を誘発することが示されている。生体内で脳を刺激するためにLLLTの使用に関する前臨床データは、この技術は安全であることをサポートしている。有益な効果を誘導するために観察されたものよりも100倍高い大規模なエネルギー密度で有害な行動効果を誘導することができるが、総エネルギーが断続的なエネルギーpulses.85を使用して配信されている場合でも、高用量の悪影響を減衰させることができる。
脳卒中と神経外傷
一過性虚血に対するLLLTの生体内試験(in vivo)神経保護効果の説得力のある証拠は、魚住らによって行われた最近の研究によって提供されている;86 LLLTは経頭蓋的に配信された脳血流を増加させることができた。LLLTは、808 nmと0.8 W/cm2、1.6 W/cm2、および3.2 W/cm2で与えられた片半球の3 mmの露出フィールド上で45分間。偽被験者と比較して、脳血流は1.6 W/cm2で30%増加したが、最も低く、最も高い電力密度では効率が悪かった。脳血流の増加は、一酸化窒素産生の有意な増加を伴っていた。一酸化窒素合成酵素阻害剤NG-ニトロ-L-アルギニンメチルエステル塩酸塩を被験者に投与すると、LLLTによって誘導される脳血流の増加が抑制された。同様に、LLLTによって誘発された脳血流の後期増加は、N-メチル-D-アスパラギン酸競合アンタゴニストMK-801とグルタミン酸伝達の阻害によって減衰した。これらの観察では、血流の増加は、一酸化窒素の生産の増加に二次的であり、神経細胞の活性化に関連していることをサポートしている。また、マウスの両側総頸動脈閉塞モデルを用いて、生体内での脳血管灌流の低下に対するLLLTの神経保護効果が実証された。彼らは、15〜45分間の近赤外治療は、脳卒中のこのマウスモデルでは30%の局所脳血流を増加させたことを示した。驚くべきことに、正常状態と灌流低下状態の脳血流量は、治療した半球と治療していない半球の両方で増加していた。また、LLLTで前処理された被験者は、安定した体温、心拍数、呼吸数で、閉塞の期間中に改善された残留脳血流を示した。最後に、頸動脈閉塞によって誘導された一過性の脳虚血は、海馬のCA1フィールドの細胞の84%で、皮質ニューロンの27%で細胞死を産生した96時間後のインシュルト。対照的に、LLLTは、一過性虚血の後、それぞれ、海馬と大脳皮質で44%と8%にアポトーシス細胞の数を減少させることにより、有意な神経保護効果を持っていた。注意のために、これらの実験では、一過性虚血に対するLLLTと神経保護は、一酸化窒素合成酵素の発現の増加と関連していなかったことを示した。このことは、一酸化窒素濃度の観察された増加は、一酸化窒素合成酵素に依存しないメカニズムの産物であったことを示唆している。一酸化窒素合成酵素に依存しない一酸化窒素形成のメカニズムは、キサンチンオキシダーゼまたはチトクロムによる亜硝酸塩の還元を含む。前述のように、LLLTは生体内試験(in vivo)49で脳のチトクロム酸化酵素の発現を増加させ、LLLTによって誘導される細胞内シグナルの活性化は、一酸化窒素の濃度に依存しているように思われる。
DeTaboadaら88は、測定可能な運動神経学的障害を誘導する片側頸動脈閉塞のラットモデルで脳卒中後24時間与えられたLLLTの神経保護効果をテストした。LLLTは、0.9 J / cm 2のエネルギー密度と7.5 mW / cm 2のパワー密度で808 nmで与えられた病変に同側半球に、病変とは対照的に、またはその両方。28日後、LLLTは平均38%の神経学的回復を促進し、これらの効果は脳室下帯の神経細胞の増殖と遊走の増加と関連していた88。
LLLTはまた、総頸動脈に直接マイクロクロットを注入することによって誘導された塞栓性脳卒中のウサギモデルにおける行動障害の改善にも有効であった90。治療は、2cmのプローブと10分間7.5mW/cm2の電力密度で808nmで与えられた。LLLTは、治療後24時間後に測定したときにコントロールと比較して有意に赤字を改善した。この効果は耐久性があり、塞栓後3週間観察された。LLLTが塞栓術の24時間後に開始されたときには有益な効果は観察されなかった。LLLTを連続波ではなく、1kHzで300マイクロ秒または100Hzで2マイクロ秒の周波数のパルスとして投与した場合、6時間後に有益な効果が観察された91。さらに、血栓溶解療法はコントロールに比べて出血の発生率を増加させたのに対し、LLLTは血栓溶解療法によって誘発される出血の発生率を30%減少させ、単独で投与した場合は出血率に影響を与えなかった92 。この塞栓性脳卒中モデルでは、塞栓術の3時間後にナイーブなウサギに比べて虚血皮質のATP含量が45%減少していた。連続パルスとして与えられたLLLTは、偽塞栓群とナイーブなウサギと比較して22.5%のATP含有量の絶対的な増加に比べて皮質のATP含有量の41%の増加をもたらした。この効果は、より高いLLLTのエネルギーがパルスとして配信されたときに最大化された。5と35倍以上のエネルギーが配信されたときに、皮質ATPの量は、偽塞栓群と比較して157%と221%、それぞれ増加した93
94 NeuroThera Effectiveness and Safety Trial-1では、脳卒中発症から24時間以内に投与された虚血性脳卒中の90日間の転帰を改善するために、808nmのLLLTの安全性と有効性が検証された。この研究には,米国衛生研究所脳卒中スケール(NIHSS)スコアが7~22の患者120例が含まれていた。血栓溶解療法を受けている患者は除外した。主要アウトカム指標は、90日目の完全回復(NIHSS 0-1)またはNIHSSスコアの9点以上の低下であった。治療時間の中央値は18時間であった。治療を受けた79人の患者のうち、38%が最終的なNIHSSスコア0-1と9点以上の改善の両方を達成したが、20%は9点以上の改善しか認められず、11%は9点以上の改善なしに最終的なスコア0-1を達成し、30%はどちらのエンドポイントも達成しなかった。対照群41人のうち、対応する割合は29%、7%、15%、49%であった。94 しかし、660人の患者をLLLT群と偽薬群に無作為に割り付けた大規模な多施設二重盲検試験では、良好な転帰に有意な差は認められなかったが、90日後の障害がLLLT群で少ないという良好な傾向が観察された。この2つ目の研究では、LLLTはベースラインのNIHSSスコアが低かった患者に有益であったようである。
これらの実験は、チトクローム酸化酵素と一酸化窒素に対するLLLTの効果が虚血やおそらく他の代謝性障害に対するLLLTの神経保護作用に大きな役割を果たしていることを示す生体内試験(in vivo)での証拠を提供している96 とヒトの外傷性脳損傷後に発見されたLLLTの利点のような。現在の臨床試験では、虚血性脳卒中後の片麻痺患者のリハビリテーションにおける経頭蓋的LLLTの有益な効果が調査されている。
パーキンソン病
LLLTの保護効果は、神経変性のパラダイムでも実証されている。Shawら99は、LLLTがパーキンソン病の治療に応用できる可能性を示した。このグループは、神経毒1-メチル-4-フェニル-1、2、3、6-テトラヒドロピリジン(MPTP)によって誘導されたドーパミン作動性変性のマウス生体内試験(in vivo)モデルでLLLTの場合、神経保護効果をテストした。LLLTは、670 nmと40 mW / cm 2でMPTP腹腔内注射後15分を与えた。2 J/cm2の総投与量は、30時間以上にわたって均等に間隔をあけて9秒の4つのフラクションで配信された。頭蓋骨に到達する電力密度の約10%が脳に達した。MPTP注射の2日後、生理食塩水処理したコントロールと比較して、黒質のドーパミン作動性細胞の数の45%の減少があった。LLLTは完全に黒質のドーパミン作動性細胞の損失を防止した。MPTPの用量を2倍にすると、60%のドーパミン作動性細胞のさらに深い減少があった。しかし、LLLTは、コントロールに比べてわずか30%にこの高いMPTP用量によって引き起こされる神経変性を制限した。この研究は、LLLTが生体内のドーパミン作動性毒素に対する神経保護効果を誘導するだけでなく、その効果が脳の深部の構造に到達することを示す証拠を提供した。
認知と感情状態
LLLTの最も魅力的な実験的アプリケーションの中には、正常な脳機能の強化と記憶喪失や気分障害の治療に関連するものがある。認知障害や認知症に伴う神経変性は、神経変性過程の初期段階で局所的な脳の代謝欠損を有することが示されている。100、101 同様に、大うつ病や心的外傷後ストレス障害などの気分障害の表現型は、前頭前野領域の代謝能力の低下と関連していることが示されており、前頭前野への電気刺激は抗うつ効果があることが示されている。LLLTは、機能障害を示す領域の代謝能力を高めることが期待されており、その結果、特定の表現型の発現に関与するネットワークの機能的接続性を高めることができる。これは、LLLTが神経変性の影響を受けやすい組織で持つ可能性のある潜在的な神経保護効果に加えて、である。Michalikovaら104は、食欲のある空間ナビゲーションタスクでテストされた中年マウスのLLLTを使用してワーキングメモリの改善を実証した。このようなメモリの改善は、探索活動や不安応答に非特異的な効果がない場合に発生した。この研究では、10画分、1日1画分で与えられた1072 nmでLLLTを使用していた。しかし、そのような電力密度やエネルギー密度などの他のLLLT用量パラメータが報告されていない。LLLTで処理されたマウスは、選択を行うには、より高いレイテンシーを示したが、改善された正しい選択率と。実際、LLLTを投与された中年マウスの記憶性能は若いマウスと同等になった。これらのデータは、LLLTが情報処理速度が低下した状態での作業記憶タスクの獲得を容易にすることで特に有用である可能性があることをサポートしている、そのような老化などの条件で。
また、ヒトでの実験データは、LLLTがヒトの認知・情動障害の治療に有効である可能性があることをサポートしている。パイロット研究では、額に経頭蓋的に適用されたLLLTは、前頭皮質の血流を増加させ、大うつ病の患者のグループでうつ病のスコアの63%の減少を誘導することができたことを示した。有益な抗うつ効果は1回の治療で2週間後と4週間後に見られた。LLLTは、810 nm、250 mW/cm2.84の電力密度で1つのフラクションで与えられた。さらに、633 nmと870 nmでLEDクラスタと額と頭皮にLLLTは、注意力を改善し、維持するために報告されている、実行機能、および慢性外傷性脳損傷.97を持つ2人の患者の記憶。認知効果をテストする前に、22.2mW/cm2の電力密度を持つLLLTを2ヶ月間、または4ヶ月間毎日、1回の配置につき10分間適用し、これらの患者は最大5.5年間、自宅で毎日の治療を継続している。驚くべきことに、これまでのところ、ヒトにおけるLLLTの使用では副作用は報告されていない(表3)。
表3 低レベル光治療の脳への有益な生体内試験(in vivo)経頭蓋効果
| ソース | 波長 | 用量 | 効果 | 関連性 | 参照 |
|---|---|---|---|---|---|
| レーザ | 808 nm | 1.6 W / cm 2、4320 J / cm 2 | 片側BCCAO(マウス)後の脳血流量の増加と海馬および皮質神経細胞死の減少 | 無酸素性脳損傷 | 上住ほか、86 |
| レーザ | 808 nm | 7.5 mW / cm 2、0.9 J / cm 2、1ポイントあたり2分 | 神経学的回復の改善、MCAO後の脳室下神経増殖の増加(ラット) | アテローム血栓性脳卒中 | DeTaboada et al、88 Oron et al、89 |
| レーザ | 808 nm | 25 mW / cm 2、15,000 J / cm 2 、連続 | 運動機能の改善と血餅注射の3時間後の脳卒中の有効血餅用量の減少(ウサギ) | 塞栓性脳卒中 | Lapchak et al、90 |
| レーザ | 808 nm | 25 mW / cm 2、15,000 J / cm 2、1KHzでパルス | 皮質ATPの増加、血餅注射の6時間後の脳卒中の有効血餅用量の減少(ウサギ) | 塞栓性脳卒中 | Lapchak et al 91 – 93 |
| レーザ | 808 nm | 1ポイントあたり1J/ cm 2 | 虚血性脳卒中後90日での臨床転帰の改善(ヒト) | 虚血性脳卒中 | ランプルら、94 |
| レーザ | 808 nm | 10または20mW/ cm 2、1.2〜2.4 J / cm 2 、シングルポイントで2分間 | 閉鎖性頭部外傷の5日後の運動行動の改善、および外傷後28日での脳病変サイズの12.1%から1.4%への減少(マウス) | 外傷性脳損傷(急性) | Oron et al、96 |
| 導いた | 633および870nmLEDクラスター | 22.2 mW / cm 2、13.3 J / cm 2 、配置ごとに10分 | 2〜4か月の治療後の慢性的な軽度の外傷性脳損傷の2人の患者の認知の改善(ヒト) | 外傷性脳損傷(慢性) | Naeser et al、97 |
| レーザ | 670 nm | 4分割で40mW/ cm 2、2 J / cm 2 | MPTP毒性後の黒質ドーパミン作動性細胞喪失の減少(マウス) | パーキンソン病 | Shaw et al、99 |
| レーザ | 1072 nm | 6分×10日 | 中年マウス(マウス)の空間ナビゲーションのための作業記憶の改善された獲得 | 軽度認知障害、アルツハイマー病 | Michalikova et al、104 |
| 導いた | 810 nm | 250 mW / cm 2、60 J / cm 2 | うつ病スコアの低下、前頭前野血流量の増加(ヒト) | うつ病、前頭前野機能 | シファーら、84 |
LLLTの脳機能改善への応用研究は、今後も増加が期待されている。この技術の使用は、最適なLLLTパラメータと治療プロトコルを探してさらなる研究の恩恵を受けるであろう。現在の前臨床データは、正式な無作為化プラセボ対照試験の実現可能性をサポートし、これらはおそらく近い将来に開発される。
結論
LLLTまたは光生物学的変調は、生物学的機能を変調するために近赤外波長に赤のレーザーやLEDからの低消費電力と高光量の使用を指する。チトクロム酸化酵素は、このミトコンドリア酵素は、酸化的エネルギー代謝のために重要であり、ニューロンは、その代謝エネルギーを生成するためにチトクロム酸化酵素に依存しているので、有益な目と脳の効果を持つLLLTの主な光受容体である。また、チトクロム酸化酵素の光誘起酸化還元機構は、神経細胞に他の一次的、二次的なホルモン応答を引き起こし、神経治療の目的に有益である可能性がある。眼に対するLLLTの有益な生体内試験(in vivo)効果は、視神経外傷、メタノール中毒、視神経障害、網膜損傷、網膜色素変性症、光毒性、および加齢黄斑変性で発見されている。脳上のLLLTの有益な生体内試験(in vivo)経頭蓋効果は、無酸素性脳損傷、アテローム血栓性脳卒中、塞栓性脳卒中、虚血性脳卒中、急性外傷性脳損傷、慢性外傷性脳損傷、神経変性、加齢に関連した記憶喪失、および認知と気分障害で観察されている。有害な副作用は、動物と人間のLLLTのこれらの有益なアプリケーションで報告されていない。著者らは、LLLTは、眼科、神経学的、心理学的条件の広い範囲のための神経治療の約束を持つチトクロームオキシダーゼ上の近赤外光への赤の作用の科学的に健全なメカニズムに基づいて、安全で有益なアプローチであると結論付けている。
