Contents
- Long-Term Respiratory and Neurological Sequelae of COVID-19
- 要旨
- 背景
- SARS-CoV-2 による肺障害
- 急性呼吸窮迫症候群(ARDS)における肺胞損傷とびまん性肺胞損傷(DAD)
- 凝固障害による肺胞微小循環の血栓症
- プロ炎症性サイトカインによる気道障害
- COVID-19肺炎の長期後遺症
- SARS-CoV-2による神経障害
- SARS-CoV-2による中枢神経系の損傷の間接的証拠
- SARS-CoV-2の神経侵襲機構
- 嗅神経チャネルとシナプスを介したウイルスの移動
- 血液脳関門(BBB)の血管内皮細胞と免疫細胞
- SARS-CoV-2関連神経障害の根底にある分子メカニズム
- プロ炎症性サイトカインと「サイトカインストーム」
- ミトコンドリアの経路
- オートファジー
- 神経変性疾患とSARS-CoV-2
- アルツハイマー病 (AD)
- パーキンソン病(PD)
- 多発性硬化症(MS)
- 結論
Long-Term Respiratory and Neurological Sequelae of COVID-19
www.ncbi.nlm.nih.gov/pmc/articles/PMC7643287/
オンラインで公開2020年11月1日
要旨
2019年後半に中国でコロナウイルス感染症2019(COVID-19)が初報告されて以来、重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)の感染が急速に拡大し、数百万人の死者を出す世界的なパンデミックとなっている。当初、大量の感染者が発生したため、死亡率を低減するためには、世界的な医療資源を投入して急性期患者の支持療法を行うことが求められてた。安全で有効な抗ウイルス剤の臨床試験が進行中であり、ワクチン開発が加速しているが、SARS-CoV-2感染の長期的な後遺症がますます認識され、懸念されている。
SARS-CoV-2の体内への侵入は上気道および下気道が主であり、COVID-19肺炎が最も一般的であるが、急性肺障害に続いて肺線維症や慢性肺機能障害が起こり、QOL(生活の質)が低下する可能性がある。また、SARS-CoV-2感染は中枢神経系(CNS)および末梢神経系(PNS)に関与し、直接的または間接的に神経細胞を損傷し、長期的な神経学的後遺症をもたらすことが報告されている。
本総説では、SARS-CoV-2感染による長期後遺症の発生メカニズムを、肺損傷、神経細胞損傷、神経変性疾患(アルツハイマー病、パーキンソン病、多発性硬化症など)の3つの主要領域に分けて解説するとともに、SARS-CoV-2感染の急性期以降の患者モニタリングの必要性を強調し、これらの長期後遺症の予防、診断、管理の根拠を示すことを目的としている。
MeSHキーワード
COVID-19,神経系、呼吸器系、SARSウイルス、重症急性呼吸器症候群
背景
2019年後半に中国でコロナウイルス感染症2019(COVID-19)が初報告されて以来、重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)の感染が急速に拡大し、数百万人の死者を出す世界的なパンデミックを引き起こしている[1]。安全で効果的な抗ウイルス剤の臨床試験が進行中であり、ワクチン開発プログラムが加速されている一方で、SARS-CoV-2感染の長期的な後遺症がますます認識されるようになり、懸念が高まっている[2]。
SARS-CoV-2 の感染および伝播は、他の呼吸器ウイルスのパターンには従わなかった。SARS-CoV-2の感染は 2019年と2020年の冬 2020年の暑い夏、そして2020年の秋にかけて増加した。空気中および接触による高い伝播率と表面上のウイルスの持続性が、急速な伝播と感染制御の難しさ、およびCOVID-19の発症を説明している[3]。現在利用可能な証拠によると、SARS-CoV-2は体内のあらゆる臓器に影響を与え、急性臓器障害と長期的な後遺症をもたらし、後者の影響は最近になって明らかになってきたばかりである[4]。高齢者や病弱者におけるCOVID-19による死亡率の高さに加え、本疾患による長期後遺症や感染後の免疫不足による再感染の可能性が大きな懸念材料となっている[4-6]。現在、主に支持療法に頼っているSARS-CoV-2感染症の治療に特化した抗ウイルス剤はないが、スパイクタンパクドメインなどのウイルス特有の特徴を利用したワクチンの開発プログラムが加速している[7]。
SARS-CoV-2の最も一般的な感染部位は、ウイルスを吸入した際の上気道と下気道であり、肺障害の重症度は感染の重症度と密接に関係している[8-10]。’ポストコービッド’、または’慢性コービッド’、および肺間質性線維症による肺機能の徐々にの喪失は、当初はCOVID-19から回復したと考えられていた人々の日常生活の質に深刻な影響を及ぼす可能性がある[8-10]。また、中枢神経系(CNS)と末梢神経系(PNS)はともにSARS-CoV-2による急性障害を受け、長期的な障害も示す[8]。COVID-19による神経細胞の損傷は、神経系の慢性変性疾患の原動力となっている可能性がある[8]。COVID-19の直接的または間接的な影響にかかわらず、COVID-19に続く中枢神経系の損傷は永久的なものである可能性がある。
このレビューは、
- 肺損傷
- 神経細胞損傷
- アルツハイマー病 (AD)パーキンソン病(PD)多発性硬化症(MS)を含む神経変性疾患
の3つの主要領域におけるSARS-CoV-2感染の長期的な後遺症の発生に関与するメカニズムについて最新の情報を提供することを目的とし、これらの潜在的な長期的な後遺症の予防、診断、および管理のための根拠を提供するために、SARS-CoV-2感染の急性期以降の患者モニタリングの必要性を強調している。
SARS-CoV-2 による肺障害
呼吸器系はSARS-CoV-2感染の最前線である[9,10]。ウイルスは3つの方法で肺を傷害する:びまん性肺胞損傷(DAD)を伴う急性呼吸窮迫症候群(ARDS)びまん性血栓性肺胞微小血管閉塞、および炎症性メディエーター関連気道炎症である[9,10]。これらの複合作用の結果として、肺胞酸素化障害、低酸素血症、アシドーシスが生じる。効果的な治療法がない場合、この酸素化不良の結果は、呼吸不全による患者の死、または患者が回復した場合の永続的な肺損傷の後遺症のいずれかである[9-11]。
急性呼吸窮迫症候群(ARDS)における肺胞損傷とびまん性肺胞損傷(DAD)
SARS-CoV-2は、細胞表面のアンジオテンシン変換酵素2(ACE2)受容体に結合して2型肺炎球を直接攻撃し、破壊する[4]。細胞損傷の程度は、ウイルス複製の影響だけでなく、プロ炎症性サイトカインの放出にも依存し、その結果、2型肺炎球の機能が損なわれることがある[4,10]。
これら2つの作用により、細胞機能が低下し、その後、細胞死(壊死)またはアポトーシス、滲出液、肺炎球の脱落、ヒアライン膜の形成が起こり、これはびまん性肺胞損傷(DAD)に特徴的なものである[10]。また、間質性浮腫や単核球や多核球の炎症性浸潤も肺胞機能障害の一因となる[10-12]。その結果、COVID-19肺炎/ARDSの典型的な病態生理学的特徴は、肺胞ガス交換と酸素化が著しく損なわれていることである[13]。
凝固障害による肺胞微小循環の血栓症
拡散による効果的な肺胞ガス交換は、肺胞上皮の完全性と正常な機能、および肺胞毛細血管の特許性を有する正常な微小循環に依存する [13,14]。SARS-CoV-2は、肺胞ガス交換の2つの主要な機能的構成要素である肺胞上皮の完全性、および肺胞微小循環の特許性と機能にダメージを与える [15,16]。ACE2受容体はSARS-CoV-2の細胞内への侵入を促進し、ウイルスが血管内皮細胞を直接標的とするための「橋渡し」としても機能し、内皮細胞の活性化をもたらす[4]。炎症性サイトカインおよびケモカインの放出と相まって、活性化された内皮細胞は、フォン・ウィレブランド因子(vWF)および細胞間接着分子(ICAM)-1,P-セレクチン、E-セレクチンなどの接着分子のアップレギュレーションを示す [12,16]。これらの変化は、血小板および白血球の凝集および補体系の活性化に続く[16]。したがって、血栓症の直接接触経路を活性化する好中球細胞外トラップ(NETS)は、組織因子(TF)の放出を誘導する補体の活性化を伴って放出される[16]。さらに、内皮細胞低酸素誘導因子(HIF)がTFをアップレギュレートし、血小板凝集体が血栓形成をもたらす[16]。
プロ炎症性サイトカインによる気道障害
SARS-CoV-2は肺胞ガス拡散機能を損なうだけでなく、気道炎症を誘発して気道の換気機能を低下させる。気管支肺炎とCOVID-19肺炎との共通の関連は、SARS-CoV-2が気道換気機能に影響を与えることの直接的な証拠となる[8,9]。気管支、気管支、気管支の炎症性浸潤の報告 [14-17] は、COVID-19の非喫煙者における上気道のシンチグラフィ上の炎症の増加と相まって、SARS-CoV-2が気道に与える直接的な損傷を支持している [18]。
COVID-19肺炎の長期後遺症
COVID-19とSARS-CoV-2のパンデミックが1年未満で進行しているため、SARS-CoV-2感染の長期的な後遺症を特定して調査することは困難であるが、いくつかは明らかになりつつある。しかし 2003年にSARS-CoV-1感染から回復した患者の追跡調査からいくつかの結果が報告されており、SARS-CoV-2感染による長期的な後遺症を示唆している可能性がある[17,18]。SARS-CoV-2は病原性と侵襲性を高め、現在では世界中で数百万人が感染しているため、COVID-19の長期的な後遺症の可能性を早期に予測し、関連する予防および介入戦略を策定することを試みることが重要である。
2003年には、世界中で8,000人以上の症例と900人以上の死亡者がSARS-CoV-1の感染によってもたらされた。97人のSARS-CoV-1生存者を登録した追跡調査では、1年間の追跡調査で28%の患者で胸部X線上の異常が確認され、画像診断上の肺異常の重症度は肺機能障害の程度と密接に関連しており、SARS-CoV-1生存者の全体的なQOLは年齢を一致させた比較群よりも悪化していた[17]。SARS-CoV-1生存者を2年間追跡した研究 [18] および15年間追跡した研究 [19] でも同様の結果が得られた。すべてのフォローアップ患者の肺換気機能にはさまざまな程度の障害がみられ、3分の1以上の患者で肺拡散機能が有意に障害されていた[17-19]。肺コンピュータ断層撮影(CT)スキャン上の典型的な肺線維性病変には、空気の捕捉、グラウンドグラスオパシティ(GGO)網目化、牽引性気管支拡張症が含まれていた[20]。肺室内中隔および肺室間中隔の肥厚もSARS-CoV-1の生存者によく見られ、重度の損傷後に肺が自己修復および継続的なリモデリングを受けていることを示唆している [21]。重度の肺損傷後に生じる線維性変化は、肺の修復およびリモデリング能力の本質的な表れである。SARS-CoV-1患者を対象としたこれらの先行研究から得られた知見によると、生存者の約3分の1は有意な肺線維化を有していた[18,19]。
世界保健機関(WHO)のデータによると 2020年9月23日までに、世界のCOVID-19症例の総数は31,664,104人に達した[22]。死亡者数を差し引いた後の保守的な計算では、SARS-CoV-2に感染した生存者の3分の1が重篤な肺線維症を発症し、肺線維症の慢性的な後遺症を発症する可能性のある人の数は、推定10 230 628人に達することが示されている[22]。また、COVID-19パンデミックは終了しておらず、SARS-CoV-2の感染者数は日々増加している。このパンデミックが続けば、SARS-CoV-1感染後の慢性肺線維症の生存者数はさらに増加すると考えられる。
肺線維症の進化は、肺水腫、肺細胞の脱落、ヒアリン膜またはDADの形成、炎症、組織化の初期段階から、ガス拡散の障害を伴う線維化と間質のリモデリングを含む肺の修復の後期段階まで、重篤な傷害を受けた後も治癒し続ける可能性を示している[23]。SARS-CoV-2感染後、SARS-CoV-1感染による影響と同様に、肺胞内血栓症の形成と気道炎症性ウイルス障害がさらに肺線維症の発症に寄与している[23-25]。SARS-CoV-2は、トランスフォーミング成長因子β(TGF-β)を含む線維化シグナル伝達分子のアップレギュレーションを促進することにより、肺線維症を誘発する可能性がある[24,25]。SARS-CoV-1のヌクレオカプシドタンパク質は、TGF-β発現のアップレギュレーションを直接促進することができる[24-27]。しかし、SARS-CoV-1はACE2を減少させることでアンジオテンシンII(Ang II)クリアランスを減少させ、Ang IIはTGF-β発現を誘導することができる[25]。これら2つの作用の最終的な結果は、TGF-β媒介性肺線維化である。SARS-CoV-2とSARS-CoV-1のヌクレオカプシドタンパク質の類似性は90%と高い[26,27]ことから、SARS-CoV-2も同様の分子機構を持つと推測できる。提案されているSARS-CoV-2の呼吸器感染による長期的な影響を図1に示す。
図1 SARS-CoV-2 感染に伴う呼吸器障害
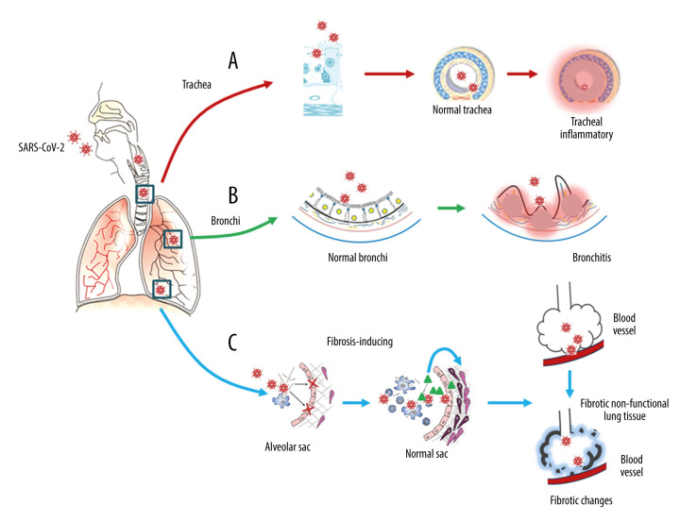
SARS-CoV-2は気管(A)から気管支(B)肺胞嚢(C)までの呼吸器系の3つの主要な場所で炎症性変化を誘導する。呼吸器系は、プロ炎症性の「サイトカインストーム」に続く急性炎症を経験し、長期的な線維化の変化が続く。肺線維化は、トランスフォーミング増殖因子β(TGF-β)のアップレギュレーションと慢性炎症と関連している。
SARS-CoV-2誘発性肺線維症の潜在的なリスクを考えると、COVID-19生存者のための早期かつ効果的な予防策を準備し、実施することが重要である[18]。アプローチには、SARS-CoV-2の感染拡大の効果的な予防、ウイルス複製の阻害、炎症反応の遮断、および早期に肺線維症を予防するための治療が含まれる。これら4つのアプローチは、COVID-19肺炎の長期的な結果としての肺線維症の効果的な予防を達成するための重要な戦略であることが証明される可能性がある。
SARS-CoV-2による神経障害
COVID-19の患者数が急増し、さまざまな症状や徴候が出現する中、神経障害の報告が徐々に注目されるようになってきた[28,29]。当初、SARS-CoV-2は緻密な血液脳関門(BBB)を通過することが非常に困難であると考えられていたが、そうではない。COVID-19患者の脳病理に関する死後の研究とヒトBBBの高度な3Dマイクロ流体モデルの使用は、3つの重要な知見を同定した[29,30]。
- 第一に、SARS-CoV-2スパイク(S)タンパク質結合受容体であるACE2は、脳微小血管内皮細胞で広く発現している[29,30]。
- 第二に、Sタンパク質は、程度の差はあれ、BBBの完全性を直接損傷することができる[29,30]。
- 第三に、Sタンパク質は、BBBの機能を変化させる微小血管内皮細胞の炎症反応を誘導することができる[29,30]。
これらの知見は、SARS-CoV-2がBBBを変化させて脳内に入り込み、神経学的症状の出現、致死的な微小血栓の形成、およびCOVID-19に関連した脳炎の発生さえも支持している[29,30]。COVID-19のこれらの神経学的関連は、初期の神経学的変化の臨床報告を支持し、長期的な神経学的後遺症の発生の潜在的な基礎を支持する。さらに、BBBを横断するために、SARS-CoV-2は、シナプスを介した伝達、視神経および嗅神経チャネル、および血管内皮細胞によって脳に侵入する可能性がある[29,30]。
SARS-CoV-2による中枢神経系の損傷の間接的証拠
2003年にパンデミックしたSARS-CoV-1感染症は、軸索変動型ギラン・バレー症候群、虚血性脳卒中、痙攣発作など、様々な神経障害を引き起こすことが報告されている[30-32]。研究によりSARS-CoV-1の脳組織内での直接複製が確認され、SARS-CoV-1患者の脳の病理解剖では、皮質神経細胞と視床下部神経細胞の細胞質にウイルスが存在していることが示された[33]。SARS-CoV-1による脳炎患者の脳組織の病理学的変化には、神経細胞の壊死、グリア細胞の過形成、単球およびT細胞の浸潤が含まれていた[34]。
SARS-CoV-1はACE2トランスジェニックマウスにおいても脳神経細胞の死を直接引き起こすことが示されたが、脳炎の病理学的変化は認められなかった[35]。これらの結果は、SARS-CoV-2による脳損傷のメカニズムの可能性を間接的に示すものである。
SARS-CoV-2の神経侵襲機構
SARS-CoV-1 および SARS-CoV-2 の両方において、これらの高病原性コロナウイルスは、ウイルス S タンパク質を介して脳に侵入し、ACE2 受容体に結合することができる [4]。細胞内でのACE2受容体の発現は、ウイルスの細胞トロピズムを決定する [4,35-37]。動物およびヒトの脳組織の異なる部位でのACE2発現の分布が、脳全体の神経細胞、アストロサイト、オリゴデンドロサイトに広く発現していることから、脳におけるこの分子的発症を支持する研究が増えてきている[36]。これらの知見は、SARS-CoV-2が脳内に侵入して神経細胞障害を引き起こす分子機構を支持するものである[36-38]。
嗅神経チャネルとシナプスを介したウイルスの移動
嗅神経は、嗅覚の完全性を維持するustentacular細胞[37]と嗅上皮の幹細胞[38]がすべてACE2と膜貫通型セリンプロテアーゼ2(TMPRSS2)を高発現していることから、SARS-CoV-2が脳に侵入する経路の可能性があると考えられている[7,36]。ACE2およびTMPRSS2は、SARS-CoV-2が嗅球およびustentacular細胞(支持細胞)に結合し、その後脳内に移動する際の役割を果たしている可能性がある[38,39]。
ニコチン性神経細胞のプロセスも関与していると考えられている[7]。これまでの研究では、SARS-CoV-1 [39]、MERS-CoV [40,41]、HCoV-OCR43 [41]など、いくつかのウイルスが嗅神経細胞を介して脳に侵入することが示されている。これらの先行研究はまた、SARS-CoV-2が嗅覚経路を介して脳に侵入できるという間接的な証拠を提供している。
神経細胞膜および細胞質上でのACE2の発現もまた、SARS-CoV-2のシナプス間移動のメカニズムを提供する[42]。ACE2トランスジェニックマウスでは、SARS-CoV-1が嗅球を介して脳内に急速に侵入し、トランスシナプスを介して急速に移行し、炎症性浸潤を起こさずに脳神経細胞を直接破壊することが報告されている[35]。SARS-CoV-1以外にも、HCoV-OC43やHEMAGglutinating Encephalomyelitis virus 67(HEV67)鳥類気管支炎ウイルスなど、他のウイルスでも経シナプス的に移行する性質が確認されている[43]。SARS-CoV-2ウイルスはACE2受容体に結合すると、逆行性の軸索を移動して中枢神経系に到達する [44]。ウイルスがシナプス裂け目に到達すると、膜コーティングが媒介するエキソサイトーシスとエンドサイトーシス、小胞輸送により、ニューロンからニューロンへ、ニューロンからサテライト細胞へのシナプスを介したウイルスの移動が起こる [44,45]。さらに、微小管に依存する急速な逆行性または前向性の細胞内軸索輸送は、さらなるウイルス移動のための構造的基盤を提供する[43,46]。
血液脳関門(BBB)の血管内皮細胞と免疫細胞
BBBは、SARS-CoV-2が脳に侵入する別の経路であると考えられている[47,48]。ウイルスがBBBを通過するには、血管内皮細胞経路と免疫細胞経路の2つの方法がある[29]。血管内皮細胞は、タイトジャンクションを介してBBBの透過性を調節する[29]。全身の血管内皮細胞におけるACE2の広範な発現は、SARS-CoV-2がBBBを透過して脳に侵入する分子機構を提供する[29]。電子顕微鏡画像は、SARS-CoV-2がACE2受容体に結合し、エンドサイトーシスおよびエキソサイトーシスによって血管内皮細胞に侵入し、それによってウイルスの細胞間移動を達成することを示している[47]。しかし、ウイルスは血管内皮細胞移行の過程では複製されず、神経細胞、グリア、血管などの標的細胞に到達するまでウイルスの複製が遅れ、複製を開始する前にACE2に結合する[48]。
血管内皮を標的とすることに加えて、免疫細胞はSARS-CoV-2がBBBを横断する別の経路として機能する可能性がある[49]。このアプローチは「トロイの木馬」メカニズムと呼ばれているが、これには少なくとも2つの条件が必要である:
ACE2を発現する免疫細胞、およびSARS-CoV-2が複製しない条件である[49]。
リンパ球、顆粒球、単球などの免疫細胞はすべてACE2を高度に発現している [50-53]。最近、abassiら[54]は、SARS-CoV-2が表面のACE2と結合することでマクロファージの細胞質に侵入できることを示した。ウイルスを含むマクロファージは、複製のために中枢神経系などの他の場所に移動する「トロイの木馬」メカニズムを用いて機能していた[54]。この最近の研究から得られた知見は、感染した免疫細胞がSARS-CoV-2をBBBを越えて脳内に運ぶ別の経路であることを示唆している[54]。これらの知見にはさらなる研究による裏付けが必要であるが、SARS-CoV-2は免疫系の細胞を利用して全身に広がり、BBBを横断することができる可能性があり、これはヒト免疫不全ウイルスによく似たプロセスである。
SARS-CoV-2関連神経障害の根底にある分子メカニズム
SARS-CoV-2がどのような侵入方法を用いても、最終的に目的地に到達すると、それは急速に複製し、その後、その独特のメカニズムを用いて細胞死または機能障害を引き起こす[50]。急速なウイルス複製、直接的な細胞損傷、サイトカインを含む免疫系および炎症性メディエーターの活性化は、COVID-19の急性症状の原因と考えられ、SARS-CoV-2感染の長期的な後遺症を説明する可能性がある。
プロ炎症性サイトカインと「サイトカインストーム」
炎症性メディエーターの全身的な増加は、現在「サイトカインストーム」と呼ばれており、COVID-19患者の一部に見られる多臓器障害を説明できるかもしれないし、SARS-CoV-2の中枢神経系への影響も説明できるかもしれない [55]。
多数の炎症性サイトカインの放出は、血管透過性、異常な血液凝固、および多臓器不全を増加させる [55]。これらのサイトカインはまた、中枢神経系における微小血管透過性を増加させ、BBBを介してSARS-CoV-2の脳内への侵入を促進する役割を担っている可能性がある[28,29]。
「サイトカインストーム」はまた、凝固系を活性化することで微小血栓の形成を促進する可能性がある [55,56]。神経学的病変を有するCOVID-19患者の脳画像所見は、内側側頭葉の神経放射線学的パターン、脳白質の多巣性病変、および微小出血を示している[57]。現在の脳画像法には、流体減衰反転回復法(FLAIR)脳磁気共鳴画像法(MRI)の使用がある [57]。
ミトコンドリアの経路
ミトコンドリアは、正常な細胞機能と細胞ダイナミクスを維持し、細胞の恒常性を維持する重要な細胞小器官である。細胞のミトコンドリアの機能障害は、細胞のアポトーシス、壊死、機能不全を引き起こす。
SARS-CoV-2感染は、いくつかの方法で細胞レベルでの臓器損傷をもたらす。SARS-CoV-2 RNAゲノムとすべてのサブゲノムRNAは宿主のミトコンドリアマトリックスに統合し、ウイルス複製と生命負荷の増大をもたらすウイルス-ミトコンドリア相互作用をもたらし、細胞ミトコンドリア内のSARS-CoV-2 RNA転写物はミトコンドリア機能を「ハイジャック」して免疫応答を抑制し、ウイルス複製を促進する [58-60]。
最終的に、神経細胞を含む感染細胞は、酸化ストレスとカルシウムイオンの流入により、ミトコンドリアの機能が損なわれた状態で、壊死、アポトーシス、または機能不全を起こす可能性がある[61,62]。感染した宿主細胞の壊死およびアポトーシスは、ウイルスの生存を低下させるように見えるかもしれないが、これらの影響は中枢神経系への損傷をもたらす。宿主が生存していれば、ウイルスは流されて別の宿主に感染し、慢性的な神経学的損傷は宿主の死よりもウイルスにとって有益である[63-65]。脳内SARS-CoV-2感染の長期的な病態についてのこの説明は、長期的な神経学的後遺症についても説明できるかもしれない。
オートファジー
オートファジーとアポトーシスの間の因果関係を考えると、これらの間のSARS-CoV-2の役割の可能性はより複雑であるように思われる。最大限の複製と拡散を達成するために、ウイルスは非常に特殊な生存法則を形成している。ウイルスは、独自の手段によって潜伏期間中にウイルスに感染した宿主細胞の完全性を維持し、感染した宿主細胞のオートファジーおよびアポトーシスプログラムの開始をさらに阻止し、最終的にはより多くの子孫ウイルスの放出のための保証を提供する[65,66]。逆説的に言えば、ウイルスは、細胞破壊の残骸をさらなる増殖のための乗り物として、または免疫攻撃を回避するための戦略として使用する目的で、積極的にオートファジーおよびアポトーシスを誘発しない[65]。SARS-CoV-2とオートファジーとの関係は現在のところ不明であるが、相互に有益な相互作用の可能性を完全に排除することはできない[65]。
オートファジーとアポトーシスは、ウイルスと宿主の間の激しい戦いの中で起こる。感染した宿主細胞は、オートファゴソームを大量に集めてオートファジーと連動したアポトーシスを活性化し、ウイルス複製のループを断ち切ることを目的としている[63,66]。したがって、ウイルスは感染初期に感染した宿主細胞におけるオートファゴソームの形成や凝集を遅らせ、複製に利用できる時間を利用するために最善を尽くしていると推測されている。しかし、感染が継続し、オートファゴソームの数が増加すると、ウイルスはオートファゴソームの形成と凝集を促進してアポトーシスプログラムを活性化させることに転じ、それにより、ウイルスの拡散を促進するためのキャリアとしての細胞残骸のより良いアポトーシス利用を促進する。病態発生におけるアポトーシスおよびオートファジーの役割に関するさらなる研究は、急性および慢性の神経学的後遺症に対する治療法の開発に意味を持つかもしれない[67,68]。提案されているSARS-CoV-2感染の長期的な神経学的影響を図2に示す。
図2 SARS-CoV-2感染に伴う神経損傷
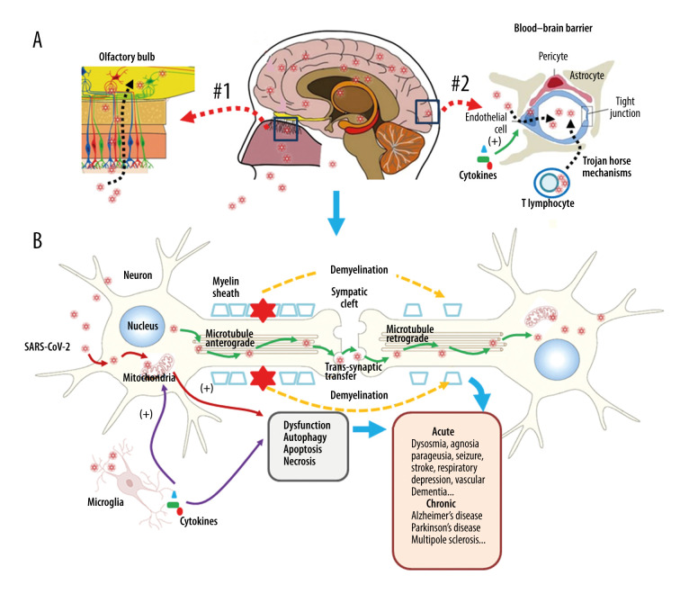
SARS-CoV-2は、嗅覚経路(Aの#1)と血液脳関門(BBB)経路(Aの#2)の2つの主要な経路を介して中枢神経系(CNS)に侵入する。ウイルスは、炎症性サイトカインによって誘発される血管透過性の亢進を利用したエンドサイトーシスによって直接中枢神経系に移動し、「トロイの木馬」メカニズムを介した間接的な移動を行うことができる。
B)その膜受容体であるACE2に結合した後、SARS-CoV-2は神経細胞の細胞質に取り込まれ、細胞質に局在するアンジオテンシン変換酵素2(ACE2)と結合するようウイルスRNAはミトコンドリアに入るか、オートファゴリソソームde
形成され、オートファジーおよび/またはアポトーシスを開始する。ミクログリアや免疫細胞は炎症促進性サイトカインを産生し、その結果、ミトコンドリアの機能がさらに異常をきたする。ウイルスがニューロンに侵入すると、シナプスへの前向性および逆行性の広がりを伴って軸索微小管と結合し、シナプス間のトランスシナプス移動およびエンドサイトーシスによって次のレベルのニューロンに侵入する。ウイルスと「サイトカインストーム」の両方が神経細胞のミエリン鞘を破壊し、急性および慢性の神経病理を引き起こす。
神経変性疾患とSARS-CoV-2
神経変性疾患とは、主に脳の神経細胞に影響を及ぼす様々な疾患を含む包括的な概念であり、生活の質の低下につながる重要な要因の一つである。SARS-CoV-2が神経変性疾患の原因となるのか、あるいは早期発症を促進するのかはまだ明らかになっておらず、わずか数ヶ月で結論を出すことも難しい。
しかし、脳内の幅広い部位でACE2受容体が高発現していることは、SARS-CoV-2が急性脳障害を引き起こす初期の標的となるだけでなく、その後の神経変性変化の基礎となる可能性もある[68]。この可能性は、SARS-CoV-2感染の病態において、ウイルスおよびニコチン性アセチルコリン受容体複合体の機能的阻害が存在することを示した最近の研究から得られた知見によって裏付けられている[7]。
アルツハイマー病 (AD)
年齢以外にも、アルツハイマー病の重要な危険因子が多数存在する[69]。最近発表された研究では、ウイルス感染とアルツハイマー病の間の潜在的な因果関係に焦点が当てられている [70]。SARS-CoV-2による中枢神経系への損傷が確認されていることから、認知機能への長期的な影響が懸念されている[71,72]。SARS-CoV-2感染、アルツハイマー病およびその他の神経変性の後遺症との関係を明らかにするためには、さらなる長期的な研究が必要となる可能性がある。
神経炎症性反応、シナプスの剪定、および神経細胞の喪失はアルツハイマー病の構造的基礎であり[73]、SARS-CoV-2感染はこれらのプロセスを加速させる可能性が高い。
グルタミン酸反応とGABA作動性反応の間の不均衡によって引き起こされる興奮毒性反応は、神経細胞の喪失とさらなる脳組織の損傷を促進する潜在的なメカニズムである[74]。グルタミン酸作動性ニューロンとGABA作動性ニューロンにおけるACE2の同時発現は、SARS-CoV-2感染が中枢神経系における両方のシグナル伝達経路のバランスに影響を与えうることを示している[36, 68]。
さらに、SARS-CoV-2のシナプス間移動と軸索の逆行性または前向性移動は、ウイルスがゆっくりと拡散的に脳全体に浸潤することを可能にし、急性感染から数ヶ月後、数年後の慢性化と神経変性変化を促進することも示唆されている[42,44,45]。
パーキンソン病(PD)
アルツハイマー病と比較して、パーキンソン病(PD)を引き起こす可能性のある黒質線条体に局在する中枢神経系の損傷は、より限定的であるように思われる [75]。しかし、いくつかの最近の研究では、パーキンソン病患者は運動機能障害を示すだけでなく、認知機能や記憶機能も著しく損なわれていることが示されている[76-78]。また、パーキンソン病の病因は神経炎症、シナプスの剪定、およびニューロンの喪失と関連しており[75]、アルツハイマー病との共通点がある[79,80]。しかしながら、パーキンソン病では、異なる中枢神経系部位が損傷を受け、異なるタイプのニューロンがより深刻な影響を受ける [81]。現在のところ、SARS-CoV-2がパーキンソン病を引き起こすまたは促進するという直接的な証拠はないが [82]、中枢神経系のさまざまな部位でのACE2の広範な発現が、SARS-CoV-2がパーキンソン病の発生を媒介または促進する分子的基盤を提供していることに留意すべきである。
SARS-CoV-2感染の晩期合併症としてのパーキンソン病の発症との関連を支持する臨床研究からの証拠は現在のところ限られている。多汗症および無呼吸もまた、パーキンソン病の前駆臨床症状であり[83]、COVID-19患者の初期症状であり、鼻づまりおよび鼻漏を伴わずに発症する[84-87]。最近発表された症例報告では、稀な両側性基底核出血損傷の画像変化を伴う脳症の症状を呈したCOVID-19患者が記載されている[87]。したがって、アルツハイマー病や他の神経変性疾患については、SARS-CoV-2感染とパーキンソン病の関係を明らかにするために、より長期的な研究が必要である。
多発性硬化症(MS)
多発性硬化症(MS)は、炎症によって引き起こされる局所性灰白質脱髄およびびまん性の脳神経変性と関連している [88]。SARS-CoV-2によって引き起こされる神経学的変化に関する現在の知見は、MSで見られるものといくつかの類似性を示している。
第一に、SARS-CoV-2感染によって引き起こされる炎症性の「サイトカインストーム」は、中枢神経炎症性障害の開始因子である[89]。
第二に、SARS-CoV-2は脳および脊髄の脱髄を引き起こす可能性がある[90]。最近発表された症例報告では、SARS-CoV-2感染がMSと同様の徴候および症状と関連していることが示された [91]。
これまでの研究では、コロナウイルス感染とMSの発症との関連が示されている [92]。SARS-CoV-2感染と脱髄性神経疾患との関連が存在する場合、MSを含むこれらの疾患の治療には免疫療法が用いられるため、治療上のジレンマが生じることになる[93]。SARS-CoV-2感染とMSとの関係を明らかにするためには、より長期的な研究が必要であろう。
結論
2020年10月現在、SARS-CoV-2感染によるCOVID-19は、中国・武漢での最初の症例が確認されてから1年足らずで世界的なパンデミックとなっている。本レビューでは、SARS-CoV-2感染の長期後遺症に関与するメカニズムについて、肺損傷、神経細胞損傷、神経変性疾患の3つの主要領域での現状を明らかにした。
臨床研究、実験室研究、治療薬候補の臨床試験、ワクチン開発プログラムが加速している。SARS-CoV-2ウイルスは、その感染力と病原性を高める多くのユニークな性質を持っている。パンデミックのこのような初期段階では、COVID-19の潜在的な長期的な後遺症が実現し始めたばかりである。
このレビューでは、COVID-19に罹患した患者のより長期的な臨床フォローアップデータの必要性と、患者ケアの現場で顕在化するであろう長期的な後遺症の管理に注意を払う必要性が浮き彫りになった。最後に、この障害の経済的影響については、患者ケアとともに事前に検討しなければならない。
