Contents
Long COVID hallmarks on [18F]FDG-PET/CT: a case-control study
pubmed.ncbi.nlm.nih.gov/33677642/
要旨
目的
本研究では、全身[18F]FDG-PET/CTを用いて、長尺COVIDの病態生理を解明することができるのではないかと考えた。
方法
感染回復後30日以上、少なくとも1つの持続的な症状を訴えた成人のLong-COVID患者13例をプロスペクティブに登録した。PET/CT陰性のメラノーマ患者26例を対照とした(対照と症例の比率は2:1)。全身画像の定性および半定量解析を行った。2群間の差を検定するために、フィッシャー厳密検定およびMann-Whitney検定を適用した。ボクセルベースの解析は、症例と対照群の脳代謝を比較するために行われた。症例はさらに有病率の高い症状に応じてグループ分けされ、それに応じて分析された。
結果
4/13例のLong-COVID患者では、CT画像に軽度の[18F]FDG取り込みを示す肺の異常が認められた。多くの健康な臓器/実質のSUVとSUV比は両群間で有意に異なっていた(p ≤ 0.05)。Long-COVID患者では、右海馬傍回と視床で脳の代謝低下が認められた(ボクセルレベルでの補正なしのp < 0.001)。特定の領域の代謝低下は、持続的な無呼吸/老衰、疲労、および血管の取り込みを特徴とした(ボクセルレベルで未補正p < 0.005)。
結論
18F]FDG PET/CTは、Long-COVIDの多臓器性を認め、基礎となる全身炎症の仮説を支持した。全身画像では、いくつかの「標的」と「非標的」の組織で[18F]FDGの取り込みが増加していることが示された。我々は、PET時に持続的な訴えに関連した脳の代謝低下の典型的なパターンを発見し、脳と全身の炎症性変化の時間的順序が異なることを示唆した。このことから、Long-COVIDの病態生理を明らかにする上で、全身[18F]FDG PETの潜在的な価値が強調された。
序論
18F]FDGポジトロン断層撮影法([18F]FDG-PET)は、もともと脳の代謝を評価するために開発されたものであるが、腫瘍の画像化で有名になった。それにもかかわらず、現在では感染症や炎症を含む多くの臨床症状に使用されており、優れた結果が得られている[1]。SARS-CoV-2感染症における[18F]FDG-PET/CTの初期の有望なデータがあるにもかかわらず[2]、この技術の主な利点は、患者の管理に影響を与えるというよりも、肺炎の偶発的な診断に関連していると思われる[3]。SARS-CoV-2感染症の第1波の初期には,SARS-CoV-2感染症回復後の持続的な症状や長期後遺症(Long-COVIDや慢性コービッド症候群と呼ばれる)を訴える患者が増加していることが報告されている[4,5,6,7].SARS-CoV-2感染中または感染後早期に脳の高代謝・低代謝が記録されている[8,9,10]。さらに、最近では、持続的な機能的愁訴を有する患者の大脳辺縁部および傍辺縁部、脳幹、小脳において、脳の低代謝が報告されている[11]。Long-COVIDの病態生理はまだ不明である。一部の患者では、口腔咽頭スワブが陰性であってもウイルスRNAが長く持続し、便中に検出されることがある [12]。COVID-19感染に関連した多系統炎症性症候群が報告されており [13, 14]、ウイルスが制御不能な免疫反応を引き起こす可能性があることを示唆している。最後に、肺や脳、心臓、腎臓などの他の臓器の損傷が死後に報告されている [15]。この証拠は、持続的な症状の病態生理の根底にあるメカニズムに疑問を投げかけている。実験的研究では、感染や炎症に関与する細胞でグルコーストランスポーターの発現が高い可能性があることが示されている[16]。18F]FDGによる炎症および感染病巣の同定能力は、炎症反応に関与する細胞の解糖活性に関係しているようである[16]。腫瘍で観察されたものとは異なり、炎症中のデオキシグルコースに対するグルコーストランスポーターの親和性は、サイトカインや成長因子によって増加しているようである[17]。さらに、細胞傷害(代謝フレア)から生じる細胞ストレスは、グルコース消費を増加させ、その結果、[18F]FDGの取り込みを増加させる可能性がある[16]。したがって、[18F]FDGは高感度であり、Long-COVIDを調べるのに理想的である。最後に、PET/CTはハイブリッドな全身評価、安全性、患者のコンプライアンスという利点がある。本研究では、全身[18F]FDG-PET/CTを行うことで、Long-COVIDの病態生理についての知見が得られるのではないかと仮説を立てた。
方法
研究デザインと母集団
本観察的症例対照研究では,当院の外来でフォローアップを受けた成人のLong-COVID患者のうち,感染回復後30日以上持続する症状を少なくとも1例示したすべての患者を対象に,プロスペクティブなスクリーニングを行った。全体では、15名の患者のうち13名がインフォームドコンセントに署名して登録された(補足表1 s)。18F]FDG-PET/CT は感染回復後 98 ± 33 日後(診断後 132 ± 31 日後)に全登録患者で実施された。
ヒューマニタス臨床研究センターの倫理委員会が本試験を承認した。対照群は、施設データベースから、年齢と性別をマッチさせた外科的治療を受けたメラノーマ患者(I期=11人、II期=9人、III期=6人)2019年9月以前に感染した腫瘍学的陰性全身画像(頭頂部から足先まで)-同一スキャナーで-、手術以外の腫瘍学的治療を受けていない、神経障害の既往歴がない-を選択した。対照群を選択するための制限日(すなわち2019年8月31日)-パンデミックに関する最新の疫学的データに基づいて設定された-は、潜在的なバイアスを回避することを目的とした。表 1 に患者のベースラインの特徴をまとめた。
表1 ベースライン患者の特徴
[18F]FDG PET/CT
PET/CTは、炎症および感染症における[18F]FDGのEANM/SNMMIガイドラインに従って実施した[16]。簡潔に、空腹時の患者に[18F]FDGを静脈内投与してから約60分後に、統合型GE Discovery PET/CT 690スキャナー(General Electric Healthcare, Waukesha, WI, USA)を使用して全身画像(頭頂部から足先まで)を感染した。対照群の[18F]FDG-PET/CTは、良好な臨床実践[18]に従って、同じスキャナを使用して全身画像として感染した。
全身画像解析
全身画像は、経験豊富な核医学専門医(MS)がXeleris™ワークステーション(General Electric Healthcare, Waukesha, WI, USA)を使用して定性および半定量的に解析した。視覚的評価と半定量分析のための同じプロトコルを、症例と対照の両方に適用した。まず、炎症や感染症における[18F]FDGに関するEANM/SNMMIガイドライン[16]で推奨されているように、画質(例えば、アーテファクト、[18F]FDGの生合成分布)を視覚的に評価した。その後、PET/CTは、以前に詳述したように現行のガイドライン[16]に従って陰性または陽性と定義した[19]。陽性所見は臓器・実質ごとに記載し、肝臓の生理的取り込み量(それぞれ低値、等値、高値)を参考に3点満点(軽度、中等度、高値)で目視で評価した。特定の基準は、血管および骨髄の取り込み増加(すなわち陽性)を評価するために使用された。18F]FDG取り込みの線形パターンは、大腿動脈以外の少なくとも1つの血管領域で中等度とスコア付けされ、血管取り込みを示唆するものと考えられた。骨髄への取り込みは、MIP時に長骨(上腕骨と大腿骨)に明らかな場合は存在すると考えられた。最大値、最小値、および平均標準化された取り込み値(SUVmax、SUVmin、SUVmean)は、陽性所見および健康な臓器と実質について記録された。健康な臓器および実質における[18F]FDG取り込み値(すなわちSUVmax)は、肝臓SUVmax、および大静脈SUVmeanをバックグラウンドとして使用して補正し、対応する比率を計算した。健康な肺実質の半定量的パラメータ(SUVmax、SUVmin)を異なるレベル(上層、中層、下層)で記録し、解剖学に応じた代謝パターンを評価した。血管[18F]FDG取り込みの半定量的評価(総血管スコアおよび標的対背景比)は、以前に詳述したように、現行のガイドライン[20]に従って実施した[19]。PET/CT画像のCT成分を検査し、[18F]FDG取り込みに関係なく異常を記録した。
脳画像の解析
脳画像は、以前に述べたように全身[18F]FDG-PET/CTから抽出され[21, 22]、SPMソフトウェア(Wellcome Department of Cognitive Neurology, London, UK)[23]で前処理のために解析フォーマットに変換された。
脳[18F]FDG-PET画像は、SPM8を使用してTalairach空間およびTournoux空間へのアフィンおよび非線形空間正規化に処理された。空間正規化を除き、SPMのデフォルトの選択はすべて従った。H215O SPMのデフォルトテンプレートは、Della Rosaら[24]によって記述されているように、最適化された脳[18F]FDG-PETに置き換えられた。空間的に正規化された画像のセットは、SPM処理によって生じるアーチファクトや不完全なフィットの存在を除外するために、各患者についてチェックされ、その後、8mmの等方性ガウスフィルタで平滑化され、回状解剖学の個々のバリエーションをぼかし、S/N比を増加させた。
データ収集
18F]FDG PET/CTの時点で、Long-COVIDが再評価され、全例で確認された。すべての患者は、ベースライン(すなわちCOVID-19感染前)よりもある程度の日常生活動作の制限を訴えていた。18F]FDG投与前に以下の情報を収集した:人口統計学(年齢、性別、体重、身長)SARS-CoV-2感染症の診断および回復時期、発症および持続する症状、利用可能な臨床検査および診断検査、併存疾患、および併用薬。
対照群については、人口統計学(年齢、性別、体重、身長)腫瘍学的病歴、併存疾患、および併用薬を収集した。
スキャンデータ(スキャン日、[18F]FDG注入前の血糖値、[18F]FDG投与活性、注入から取得までの間隔時間)を症例および対照者について収集した。
統計解析
感度[25]に基づいて、95%信頼区間と95%検出力を持つように募集する患者数を12人と推定した。母集団は、5%のスクリーニング不合格を考慮して13人に増やした。分析の一貫性を高めるために、上述の基準を用いて各症例について2つの対照を選択した。ベースライン患者の特徴(すなわち、試験開始時)を要約するために、頻度表を使用した。18F]FDG-PET/CT陽性を主要エンドポイントとして使用した。
症例と対照を比較する分析の前に、技術的なPET/CTパラメータ(PET前の血糖値、注入された[18F]FDG活性、[18F]FDG注入とスキャンの間の間隔時間)の比較可能性を検証した。分割表を作成し、関心のある結果に応じてグループ(症例と対照)を分類した。量的変数の正規分布は、平均±標準偏差として要約した。非正規分布変数は中央値と範囲として報告した。2つのグループ(症例対対照)間の差を検定するために、フィッシャー厳密検定およびMann-Whitney 検定を適用した。2つ以上のグループを比較する場合は、Kruskal-Wallis 検定を用いた。Spearmanの順位相関係数は、関心のあるアウトカムと患者のベースライン特性との関連を探った。p値≤0.05は統計的に有意と考えられた。全身の統計解析にはStata 16.1を用いた。
患者の脳代謝は、低代謝または高代謝の領域の存在を評価するために、SPMの2標本t-検定を用いて対照群と比較した。身長閾値p<0.001(無補正)は有意と考えた。100ボクセルの最小サイズの有意なクラスタのみを考慮した。Long-COVID患者は、発症時の有病率の高い臨床症状、またはPET時に持続した臨床症状、および視覚的な全身PET分析に基づいてさらにサブグループ化された。臨床症状とPETによるカテゴリーの両方において、症例の3分の1以上を含むカテゴリーのみをサブグループ解析に使用した。疾患発症時およびPET/CT時の各症状の有無を独立して検討した。サブグループ解析の探索的な性質を考慮して、ボクセルレベルでは保守的ではない高さの無補正閾値p < 0.005が認められた。多重比較の場合には、家族単位の誤差補正が適用され、タイプIとタイプIIの誤差のバランスをとるためにp値<0.05が認められた[26]。
結果
PET前血糖値(100±29対98±16mg/dl)投与された[18F]FDG活性(366±25対354±18MBq)[18F]FDG注入から画像までの間隔(66±10対63±6分)については、COVIDロング群とメラノーマ群との間に差は認められなかった。
全身画像
すべての患者で正常な[18F]FDGの生体分布が観察された。全身画像の結果は、長骨COVID患者では1/13,対照群では3/26でそれぞれ陰性(すなわち、トレーサー蓄積の予想される領域外での取り込みの増加領域はなかった)であった。長骨における血管二値パターンおよびびまん性骨髄[18F]FDG取り込みは、長骨COVID患者で跳躍したが(図1)それらの有病率は、メラノーマ患者と比較して差がなかった。表2に解剖学的部位別に集計した視覚解析結果を示す。具体的には、長尺COVID患者ではPET/CTで血管(61%)と骨髄(46%)で軽度から中等度の[18F]FDG取り込みが認められた。関節に大きな[18F]FDGの取り込みが11/13例で認められた。Long-COVID13例中4例では、CT画像で両側肺の異常が認められたが、これは回復したCOVID-19肺炎で典型的に観察されるもので、軽度の[18F]FDG取り込みを示した(SUVmax = 1.52,範囲0.85~1.79,図1)。持続的な両側肺異常を有する患者は、酸素を投与された4人であった(感染回復からPET/CTまで96±30日)。強烈な[18F]FDG取り込みが1例の両甲状腺葉(右>左)に認められた。唾液腺では中等度の[18F]FDG取り込みが1例に認められた。2人の患者は、肺、縦隔リンパ節、軟部組織、乳房で中等度/高値の[18F]FDG取り込みを示したが、それらの併存疾患に関連していた。消化管および筋肉では、びまん性の非特異的[18F]FDG取り込みが観察された(それぞれ54%および10%)。Long-COVID患者における視覚解析の結果を表3に詳述する。
図1 持続的な疲労を有する2人のLong-COVID患者における[18F]FDG-PET/CT画像
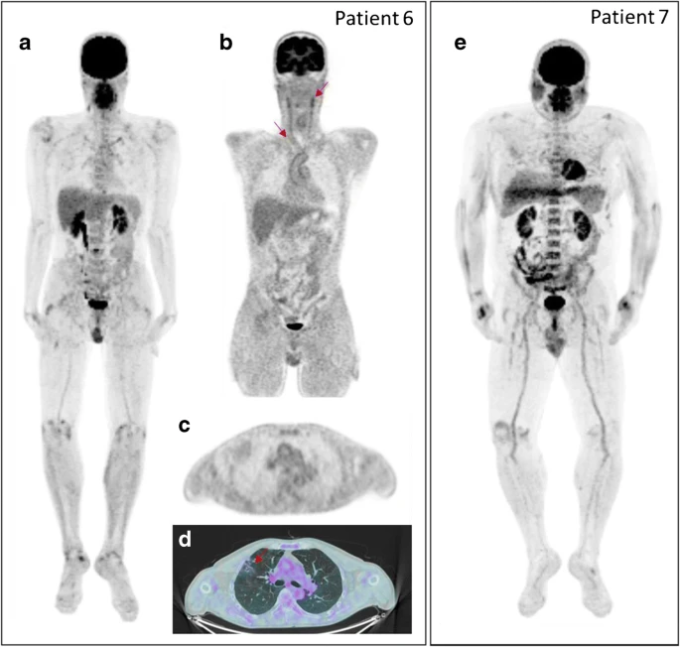
患者6のMIP画像(a)は、関節および血管における中等度の[18F]FDG取り込みを示しており、コロナPET画像(bの赤矢印)で確認された(b.軸方向PET(c)および融合PET/CT(d)画像は、軽度の[18F]FDG取り込みを特徴とする肺の異常を示している(赤矢印)。患者7のMIP画像(e)は、関節、骨髄、唾液腺での高~中等度の[18F]FDG取り込みを示している。
表2 視覚解析の比較(Long-COVID対対照群)
表3 Long-COVIDでの視覚解析結果
対照群では、関節、血管、骨髄で[18F]FDGの取り込みがそれぞれ73%、46%、27%に認められた(図2)。その他の所見は、軟部組織の術後炎症(8%)子宮筋腫(8%)などであった。1人の患者が大きな肝嚢胞を呈した。消化管および筋肉では、びまん性の非特異的[18F]FDG取り込みが観察された(それぞれ92%および15%)。表4は、対照群のPET/CTによる視覚解析をまとめたものである。
図2 女性メラノーマ患者(対照群)の[18F]FDG-PET/CT画像
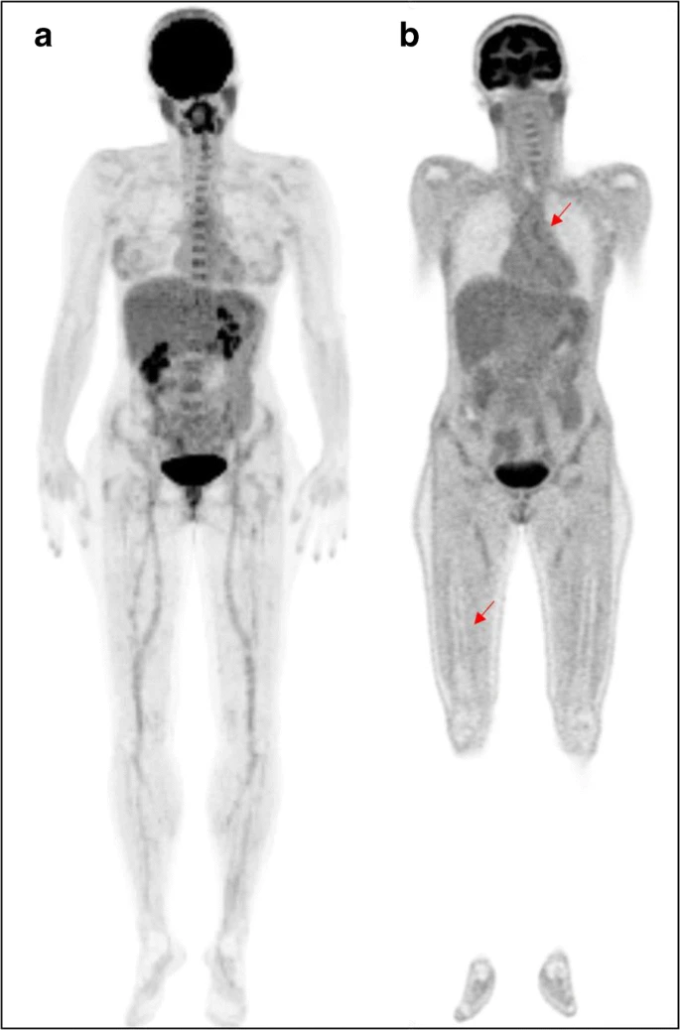
MIP画像(a)は、軽度から中等度の[18F]FDGの関節、血管、骨髄への取り込みを示しており、コロナPET画像で確認されている(bの赤い矢印)。
表4 対照群における視覚解析の結果
7領域合計血管スコアは両群で差がなく(7±2対7±2)その結果、同程度の関与領域数となった。
算出されたSUVの54%において、健康な臓器/実質を参照したSUVと比率は、Long-COVID群では対照群よりも高かった。計算されたSUVの45%では、健康な臓器/大脳皮質のパラメータは、Long-COVID患者よりも対照群の方が高かった。分析されたSUVの残りの1%では、健康な臓器/実質のSUVは両群で同一であった。絶対値として収集されたすべての半定量的PETパラメータのうち、脳SUVmax、骨髄SUVmax、肺実質SUVmax、副腎SUVmax、下頸静脈SUVmeanは症例と対照群で異なっていた(補足表2 s)。肝臓SUVmaxは両群で同等であった(SUVmax=2.88,範囲2-3.45,長COVID;SUVmax=3.05,範囲1.79-4.15,対照群)。健康な臓器と実質のSUVを、肝臓のSUVmaxをバックグラウンドとして正規化した場合、以下の比率は、骨髄/肝臓、脳/肝臓、結腸/肝臓、副腎/肝臓、肺/肝臓、食道/肝臓、頸動脈/肝臓、胃/肝臓の2群で有意に多様であった(補足表2 s)。健康な臓器と実質のSUVを大静脈SUVmeanをバックグラウンドとして正規化した場合、以下の比率はLong-COVID群の方が対照群よりも高かった。肺/馬静脈、胸椎/馬静脈、腰椎/馬静脈、骨髄/馬静脈、心臓/馬静脈、肝臓/馬静脈、脾臓/馬静脈、小腸/馬静脈、膵臓/馬静脈。腎臓/下肢静脈、前立腺/下肢静脈、筋肉/下肢静脈、膀胱/下肢静脈、皮膚/下肢静脈、甲状腺/下肢静脈、耳下腺/下肢静脈、およびエトモイド領域/下肢静脈(補足表2 s)。騎馬静脈のSUVmeanをバックグラウンドとして用いて計算された24血管領域のターゲット対バックグラウンド比は、Long-COVID群ではメラノーマ患者よりも有意に高かった(補足表2 s)。
感染の急性期に酸素を必要とした患者を除き、Long-COVID患者のベースラインの特徴、症状の持続期間や種類、臨床検査、PET/CT所見との間には相関関係は認められなかった。健康な肺実質における肺[18]FDG取り込み量の増加は、定性分析では明らかではなく、CT異常が残存している患者と残存していない患者では差は認められなかった(p=0.414)。解剖学的には、半定量的なパラメータでは肺上部から下部への傾向が見られ、有意差は認められなかった(図3)。
図3 Long-COVIDのグループにおける絶対SUVmaxパラメータ
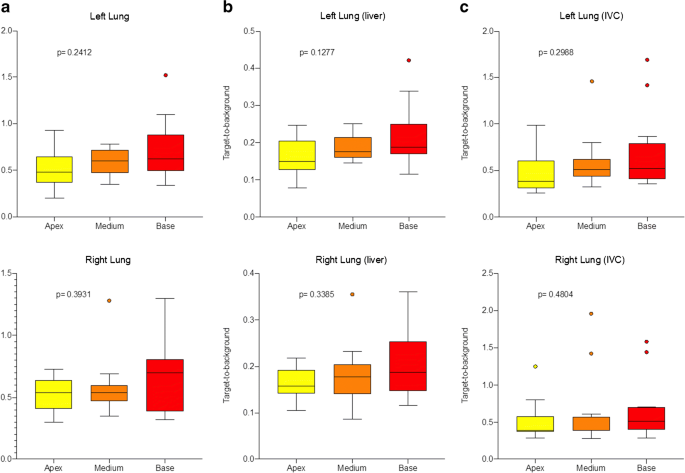
(a)肺SUVmax/肝SUVmax(b)および肺SUVmax/舟状静脈SUVmean(c)の比率として表される左右の肺半定量パラメータのボックスアンドウィスカープロット
脳のイメージ
Long-COVID患者では、対照群と比較して相対的な代謝低下を示す脳領域は見られなかった。
逆に、Long-COVID患者では、メラノーマ患者と比較して右海馬傍回(Brodmann領域30と36)と右視床で相対的な代謝低下が認められた(未補正p<0.001)。
両半球の海馬傍回(Brodmann領域27と36)と眼窩前頭前野皮質(直腸回、BA 11)では、有意な代謝低下が認められた(未補正p < 0.005)。軽度から中等度の血管性[18F]FDG取り込みを示す患者のサブグループでも、代謝低下の同じ領域(右半球に限定されるが)が強調されていた(p < 0.005)。持続的な疲労を示す患者では、右海馬傍回(Brodmann領域30)脳幹(黒質)および両半球の視床で相対的な代謝低下が認められた(未補正p<0.005)。
患者を疾患発症時にみられる症状、または肺、血管領域、骨髄、および関節における[18]FDGの測定値に基づいてグループ分けした場合、対照群との間に有意差は認められなかった。
Long-COVID患者のグループ全体における有意な代謝低下のクラスターとサブグループ解析を図3に報告する。座標およびzスコアの詳細は、補足表3 sに報告されている(図4)。
図4 脳[18F]FDG PET解析。13人のLong-COVID患者
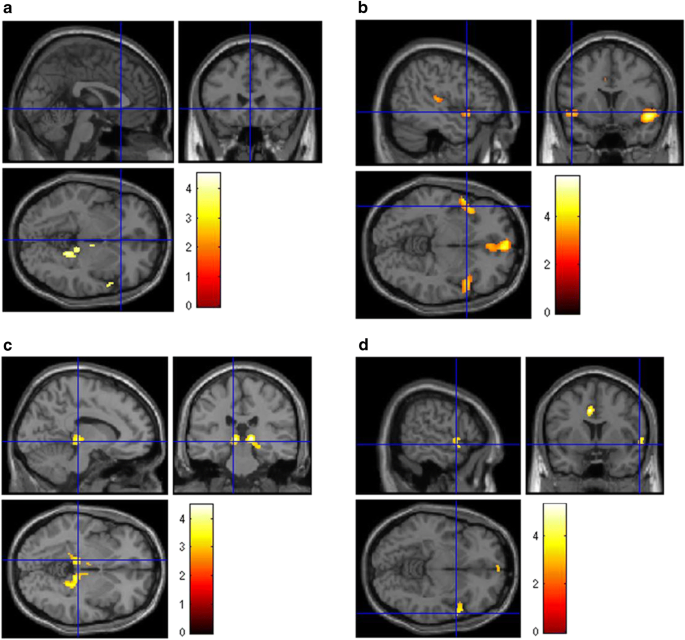
(a)と、無呼吸(b)疲労(c)または軽度から中等度の血管[18F]FDG取り込み(d)の持続を示す患者のサブグループにおける代謝低下の領域を対照群と比較した。有意差のある領域は、Z値の点で色分けされている。タライラック座標およびさらなる詳細は、の表3に掲載されている。
議論
これらの結果から、Long-COVIDは多臓器疾患であることが確認された。Long-COVIDを示唆する典型的な視覚PET/CTパターンは得られなかったが、半定量的およびボクセルベースの脳解析はSAR-CoV-2感染に関する最近の仮説を支持し、Long-COVIDの病態生理についての新たな知見を与えた。Long-COVID患者では、多くの健康な臓器や実質が対照群に比べて高い[18F]FDGを示した。これらの所見から、「標的」と「非標的」の臓器や実質が関与するびまん性の炎症が示唆された。特筆すべきは、肝SUVmaxが両群で同程度であったのに対し、冠静脈SUVmeanは対照群よりもLong-COVID患者の方が低かったことで、両群の違いを過大評価している可能性があることである。しかし、胆嚢静脈SUVmean(すなわち血中プール)の低下は、[18F]FDGの利用可能性の低下(炎症が高いほど[18F]FDG組織の取り込みが高く、循環する[18F]FDGが低い)に起因している可能性がある。腎機能データと除脂肪体重が不足していたため、騎馬静脈SUVmeanの違いの他の原因を探り、我々の推測を検証する機会がなかった。
一方、肝臓はCOVID-19の標的臓器の一つに挙げられている[15, 27]。したがって、肝臓は損傷を受けている可能性があり、その結果、[18F]FDGの取り込みが信頼できなくなり、最終的には標的間の有意性が過小評価されることになる。
注目すべきは、多臓器の炎症性症候群による相対的な代謝低下が一部の臓器で認められたのに対し、脳の代謝を解析したところ、逆に代謝低下のみの領域(すなわち大脳辺縁系、前頭前野眼窩、脳幹)が認められたことである。これらの所見は、地形的にも病態生理学的にも健全なものである。大脳辺縁系および眼窩前頭前野の代謝低下は、COVID-19感染時に無呼吸を呈した患者で報告されている[28]。最近では、Long-COVIDで両側直回・眼窩回、扁桃体、海馬、脳幹、両側小脳の代謝低下が報告されている[11]。我々の所見では、Long-COVIDにおける脳機能障害の領域が確認され、自己免疫性脳炎と同様にPET時に症状が持続することが示された[29]。COVID-19感染時に記載された代謝亢進脳領域の一部は、long COVIDでは代謝低下を示した [9,10,11]。このミスマッチは、SARS-CoV-2感染によって引き起こされた炎症性変化の後に発生した神経細胞/シナプス機能不全を示唆しており、長期的な後遺症の基質となっている可能性がある。さらに、持続的に血管取り込み量が増加している患者における代謝低下領域の関連性は、疾患の経過における脳と全身の炎症性変化の時間的順序が異なるという仮説を支持した[30]。この証拠は、Long-COVIDの病態生理を明らかにする上での全身[18F]FDG PETの潜在的な価値をさらに強調している。
我々は、COVID-19の回復後早期に報告されているように、肺でより高い[18F]FDGバックグラウンドを発見し、びまん性の実質細胞の炎症を示唆している[31]。興味深いことに、この所見はCOVID-19肺炎転帰とは関連しておらず、持続的なCT肺異常のある患者とない患者では同等であった。しかし、分子所見と形態学的所見のミスマッチは、MERS-CoV動物モデルを含む感染と炎症において頻繁に記述されてきた[32]。Long-COVIDでは、びまん性肺実質炎症はCOVID-19誘導性凝固障害[33, 34]または肺胞容積減少障害に関連している可能性がある。
COVIDを長期投与した患者では、化学療法後、長期化した貧血や細菌性貧血など、いくつかの条件で典型的に観察されるように、びまん性の均質な骨髄[18F]FDGの取り込みを示した[35,36,37]。特筆すべきことに、我々の患者の中には長期化した貧血を起こした患者はいなかった。COVID-19患者では、骨髄性骨髄性過形成が死後に報告されている[15]。さらに、MERS-CoV動物モデルでは、長期間にわたって高い骨髄[18F]FDG取り込みが報告されている[32]。さらに、前臨床データでは、リンパ組織における[18F]FDGの取り込みが、いくつかのウイルス感染症の転帰を予測することが示されている[32, 38]。骨髄への取り込みとベースラインの患者の特徴との間に相関関係は認められなかったが、COVID-19の生存者であっても、感染回復後に長期間(3ヶ月以上)症状が続くという好ましくない予後を示していると考えるべきである。骨髄への取り込みの場合は予後がさらに悪くなることが予想される。
血管の取り込みは両群で同程度であった。しかし、上述したように、肝臓(すなわち、血管取り込みの程度を視覚的にスコア化するための基準臓器)は、最近のエビデンス[31]で示唆されているように、Long-COVIDではまだ炎症を起こしている可能性があり、最終的な結果に影響を与える可能性がある。一方、半定量分析では、血液プール(すなわち、頸静脈SUVmean)をバックグラウンドとして使用した場合、症例と対照との間に統計的に有意な差が示された。血管炎および血管障害は、最近、COVID-19の病態生理に呼び出されている[33,34]。COVID-19関連多系統炎症性症候群の症例の増加が、小児(PIMS-TS)[13]および成人(MIS-A)[14,39]で報告されている。PIMS-TSは一般的に回復した小児および青年に発生し、他のコロナウイルスおよび川崎病で報告されているように、ウイルスの免疫応答による引き金となることを示唆している[13]。
免疫応答を活性化するSARS-CoV-2感染は、多系統炎症性症候群を決定し、最終的にはLong-COVIDとして提示される可能性がある。
左副腎の取り込みは、症例では対照群に比べて低かった。感染(例:結核)後に副腎不全が起こる可能性があり、SARS生存者では低コルチゾール症を含むいくつかの合併症や障害が診断されているので、このデータは興味深いものである[40]。それにもかかわらず、臨床検査や典型的な徴候が得られなかったため、これ以上の推測はできなかった。
対照群では、高率の患者の関節、血管、骨髄で軽度の[18F]FDG取り込みの増加が観察され、加齢に関連した炎症との関連性が示唆された [41]。我々の集団における持続的な症状は、呼吸困難(69%)疲労(62%)加齢臭・無呼吸(31%)関節痛(23%)頻脈(15%)その他(31%)であった。逆に、文献[4, 42]によると、疲労が最も多いようである。これらの所見は、Long-COVIDは全身性感染症で典型的に見られる症状の幅広いスペクトルを特徴としていることを証明している。
最近のプロスペクティブな報告では、感染後1週間に5つ以上の症状を経験した中年肥満女性を含む、Long-COVID発症のリスクプロファイルが記述されている[42]。我々の集団はこの記述に当てはまらなかった。なぜならば、男性の大多数(61%対39%)が感染初週に6つ以下の症状を経験したからである(85%対15%)。それにもかかわらず、年齢(59±13歳)とBMI(>27.5)は転帰予測因子と一致した。
限界
SUVmaxは日常的に使用されているが、絶対値としての信頼性はいくつかの欠点によって妨げられている。目標対背景比は、SUVmaxを正規化し、その固有の欠陥に対処するための簡単な方法である。しかし、それにもかかわらず、ターゲット対背景比はいくつかの要因の影響を受けて失敗する可能性がある。一方で、定量化することで比較が可能となり、観察者間および観察者間の一貫性が向上する。
本研究では、13名という患者数は決して多くはないが、プロスペクティブに設計されており、「アドホック」なサンプルサイズの計算が行われている。しかし、Long-COVID患者は、感染の重症度、治療法、持続的な症状、期間にばらつきがあった。さらに、データの欠落により、炎症亢進、予後因子、PET/CT所見との相関が妨げられていた。しかし、SARS-CoV-2感染の病態生理に関するデータが限られていた第1次パンデミック波(2020年2月~4月)に感染した患者であり、患者の管理は主に介護者のロジスティックに関連した一貫性のないものであった。すべての患者は、関連性や重症度にばらつきがあり、ベースラインと比較して日常生活に支障をきたすような広範囲の症状を訴えていた。それにもかかわらず、我々の患者はプロスペクティブに登録されており、「現実の」データとして代表的なものであった。さらに、ロバストな結果を得るために、我々は各症例について年齢と性別をマッチさせた2人の対照者を選択するケースコントロール研究を設計した。交絡因子を制限するために、我々は、神経障害の既往歴がなく、同じスキャナーを使用し、同じモダリティ/プロトコルを使用して、当院でフォローアップされた腫瘍学的に陰性の患者を選択した。他のウイルス感染からの回復は、対照群としてより大きな価値があったであろう。
結論
今回の結果は、Long-COVIDの管理に影響を与えるものと思われる。18F]FDG PET/CT検査では、Long-COVIDの多臓器性が認められ、基礎となる全身炎症の仮説を支持した。全身画像では、いくつかの「標的」および「非標的」組織で[18F]FDGの取り込みが増加し、脳の代謝低下の典型的なパターンが示された。脳の代謝低下は、活動的な感染時にパンデミックする症状というよりも、PET時の持続的な愁訴と関連していた。この所見により、[18F]FDG PET/CTが進行中の臨床症状を捉え、密接に相関することが確認され、脳および全身の炎症性変化の異なる時間的順序が示唆された。
