Contents
Ligands of Therapeutic Utility for the Liver X Receptors
www.ncbi.nlm.nih.gov/pmc/articles/PMC5373669/
要旨
肝X受容体(LXR)は、血管系疾患や代謝性疾患、神経変性疾患から脂質代謝に起因する癌に至るまで、様々な病態を治療するための潜在的な治療標的として認識されるようになってきている。LXRを介して作用し、求められる薬理学的成果を達成するリガンドの発見に向けた取り組みが強化されている中、いくつかのリード化合物が既に様々な疾患介入を目的とした臨床試験で試験されている。
より強力で選択的なLXRリガンドは、低分子ライブラリのスクリーニング、合理的設計、および経験的な薬理化学的アプローチから出現し続けているが、脂質代謝に対するLXR活性化の望ましくない影響を最小限に抑えるという課題が残っている。
本レビューでは、既知の内因性リガンド、天然に存在するリガンド、および合成リガンドの概要を提供する。また、リガンドの相互作用エネルギーとLXRβリガンド結合ドメインの重要なアミノ酸残基に基づいて、より特異的なLXRβリガンドを設計するための分子モデリングの観点からの考察も提供している。
キーワード
肝臓X受容体、LXRα、LXRβ特異的リガンド、動脈硬化、糖尿病、アルツハイマー病、癌、脂質代謝、分子モデリング、相互作用エネルギー
1. 肝臓X受容体の構造と機能
核内受容体(NR)は、動物の転写調節因子の中でも最も豊富なクラスの一つである。核内受容体は、正常時だけでなく病理学的な環境においても、恒常性、生殖、発生、代謝などの多様な生物学的機能を制御している。核内受容体は、リガンド活性化転写因子であるホルモン受容体(HR)としても知られており、これらのプロセスを制御するシグナル伝達分子と転写応答との間に直接的なリンクを提供している[1]。核内受容体は、ヒトでは48のリガンド活性化転写因子のグループを構成している。
肝臓X受容体(LXR)は、オキステロールセンサーとして作用する核内受容体であり、コレステロールや脂質代謝に関与する遺伝子を制御している。LXRはコーディング遺伝子に基づいて、LXRα(NR1H3)とLXRβ(NR1H2)に分類される[2]。LXRαは肝臓で最も多く発現し、腎臓、小腸、脾臓、副腎ではそれ以下の範囲で発現している[3,4]。対照的に、LXRβはユビキタスに発現している[5]。
LXRαは447[4]からなり、LXRβは461[6]アミノ酸を含む。LXR分子は、4つの機能ドメインを有すると見ることができる。(1)リガンド非依存性活性化機能ドメイン(AF-1)、リガンドの非存在下で転写を刺激しうるアミノ末端リガンド;(2)2つの亜鉛フィンガーを含むDNA結合ドメイン(DBD)。(3) リガンド結合および受容体の二量化に必要な疎水性リガンド結合ドメイン(LBD)、および(4) リガンド結合に応答して転写を刺激するカルボキシ末端リガンド依存性トランザクティベーション配列(活性化機能-2(AF-2)ドメインとも呼ばれる) [7]。LXRαおよびLXRβのDBD領域およびLBD領域は、それぞれ75.6%および74%の配列同一性を有する[8]。LXRαのLBDは、すべての既知の核内受容体に共通する3層のαヘリックスサンドイッチ構造を特徴とし、10個のαヘリックスを含む[9]。LXRαおよびLXRβはともに、レチノイドX受容体(RXR)とのヘテロダイマーとして機能する。LXR/RXRは、LXRアゴニストまたは特異的なRXRリガンドである9-シスレチノイン酸のいずれかによって活性化され得る「寛容性ヘテロダイマー」である。LXR/RXR複合体は、標的遺伝子のプロモーター領域のLXR応答エレメント(LXRE)に結合し、それは4または1ヌクレオチド(DR4またはDR1)で区切られた6量体ヌクレオチドAGGTCAの2つの直接リピートからなる。これらの標的遺伝子を介して、LXRは正常および病理学的機能に関与する様々な生物学的プロセスを制御している。多数のLXR標的遺伝子が同定されており、ATP結合カセット(ABC)トランスポーターアイソフォームA1,G1,G5,G8,アポリポタンパク質E(ApoE)コレステロールエステル転移タンパク質(CETP)脂肪酸合成酵素(FAS)チトクロームP450アイソフォーム7A1(CYP7A1)-コレステロール7α-ヒドロキシラーゼ、および炭水化物調節エレメント結合タンパク質(ChREBP)などが挙げられる[11]。
LXRの主な機能はコレステロール代謝の調節である。LXRのアゴニストは、インスリン感受性を高め、インスリン分泌を刺激する。LXRの活性化は炎症や自己免疫反応を抑制する。さらに、薬理学的研究や遺伝子操作により、LXRがアテローム形成を阻害することが示されている[12]。また、LXRはレニン分泌の調節[13]、中枢神経系におけるアミロイドβ形成の阻害[14]、生殖腺および副腎における生殖腺機能およびステロイド生成の調節[15]、ケラチノサイトの増殖および分化[16]、腫瘍細胞の増殖の阻害[17]にも関与している。LXRによる転写活性の制御は、リガンドに依存しない抑制、直接活性化、リガンド依存性活性化、トランス抑制の4つのモデルによって説明することができる。LXRによる遺伝子転写の特異的な活性化/抑制は、細胞と遺伝子に依存する。アゴニストの非存在下では、LXR-RXRヘテロダイマーは、共抑圧因子N-CoR(核内受容体コアプレッサー)およびSMRT(レチノイン酸受容体および甲状腺受容体のサイレントメディエーター)のリクルートによって転写を阻害する[10,18]。リガンド結合は共抑圧因子の解離を開始し、適度な活性化をもたらし、転写の刺激につながる。リガンド結合は共活性化因子のリクルートに続き、この状態では転写レベルが最も高くなる。転写抑制モデルでは、LXRは炎症性遺伝子の発現をネガティブに制御する能力を持っている。このような転写抑制のメカニズムは完全には解明されていないが、シグナル伝達物質や転写活性化因子である核因子NF-κBや、COX2, MMP9, IL-6, MCP-1, iNOS, IL-1βなどの炎症性遺伝子の転写を誘導するアクチベータータンパク1の活性を阻害することで、サイトカインに対する炎症反応を抑制することが知られている[19,20,21,22,23,24]。その結果、内因性LXR活性の変化は、動脈硬化、癌、多発性硬化症、アルツハイマー病やパーキンソン病などの神経疾患、関節炎、皮膚疾患など多くの病態で証明されている(図1)。
図1 肝X受容体は様々な病態に関係している可能性がある
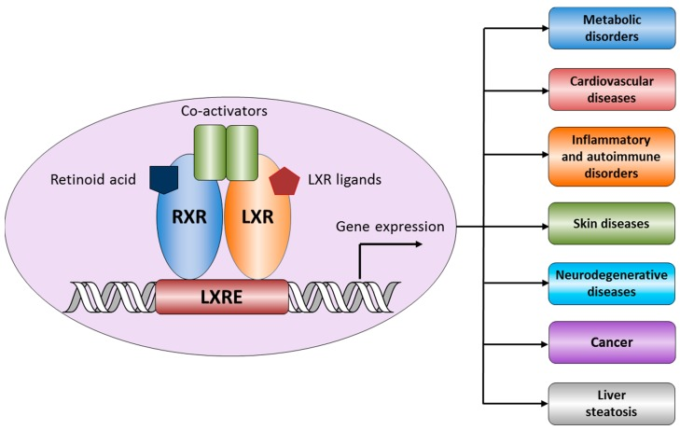
1.1. LXRと動脈硬化
LXRの生理的リガンドは、酵素反応、活性酸素種(ROS)に依存したコレステロールの酸化、および消化過程によって内因性に産生されるオキステロールである。オキシステロールのLXRへの高い親和性は、「コレステロールセンサー」としての生理学的役割を定義している。リガンド結合したLXRは、逆コレステロール輸送、胆汁酸へのコレステロール変換、および腸内コレステロール吸収に関連する標的遺伝子の発現を増加させる。これらの遺伝子のいくつかは、ATP結合カセット(ABC)トランスポーターA1およびG1,ステロール応答エレメント結合タンパク質-1c(SREBP-1c)アポリポタンパク質E、リン脂質輸送タンパク質、コレステロール7α-ヒドロキシラーゼ、およびFASおよびステアロイル-CoAデサチュラーゼ(SCD)などの脂質形成に関与するいくつかの他の遺伝子である[25,26,27,28,29,30,31]。LXRαノックアウトマウスを高コレステロール食で遺伝子研究を行ったところ、肝臓でのコレステロール代謝に障害が見られ、それに対応する血漿中コレステロール値の上昇が見られたことから、動脈硬化におけるLXRアゴニストの治療的役割が示唆された。LXRアゴニストによる治療は、総コレステロールの減少および/または高密度コレステロールの上昇を伴う生体内試験でのアテローム性動脈硬化の減衰をもたらした[28,32,33,34,35,36,37]。LXRによる脂質形成遺伝子のアップレギュレーションは、マウスの血漿および肝トリグリセリド(TG)レベルを増加させ、ヒト成熟脂肪細胞における脂質蓄積を増加させた。LXRアゴニストを用いた研究では、抗動脈硬化作用はTGレベルの上昇を伴うか、あるいは脂肪形成への影響を伴わないことが示されており、いくつかのLXRアゴニストは血管壁への直接的な作用を通じて、脂肪形成とは無関係に抗動脈硬化作用を示している可能性が示唆されている。実際、LXRアゴニストは主要な炎症性遺伝子TNFa、IL-1b、IL-6,COX2,iNOSおよびNF-κBのネガティブな調節因子であり、動脈硬化性プラーク/裂傷の調節とプラーク蓄積の反転を導く[19,20,21,22,38,39]。
1.2. LXRと癌
LXRリガンドは、最初に前立腺がん細胞に対して抗増殖効果を示すことが示された。同様の効果は、乳がん細胞、大腸がん細胞、慢性リンパ性白血病でも証明された。急性骨髄性白血病細胞では、より微妙な効果が認められた。LXRリガンドの抗増殖効果は、脂質代謝および炎症/免疫における役割に起因すると考えられる。コレステロールは、メバロネート経路の酵素の増加に伴い、前立腺腫瘍細胞に蓄積することが示されている。これはHGM-CoA還元酵素のアップレギュレーションに起因しており、腫瘍の成長に不可欠な要素であるde novoコレステロール合成につながる。LXRの活性化はコレステロールの恒常性を緩和し、LNCaP前立腺癌細胞の増殖を抑制した[40,41]。LXRリガンドでがん細胞を処理すると、p27タンパク質(サイクリン依存性キナーゼ阻害剤)のレベルが上昇し、S期キナーゼ関連タンパク質(SKP2)が減少し、細胞周期の停止をもたらした[40,42]。このようにして、卵巣癌細胞をLXRリガンドに曝露するとアポトーシスが誘導される。乳がん細胞では、LUXRリガンド処理によってp27とp21のレベルは変化しなかったが、SKP2の転写物とタンパク質のレベルは減少した[22,43]。LXRリガンド治療は、ER+乳癌細胞において最も重要な増殖因子であるERαの転写とタンパク質レベルを減少させることが明らかになった[44]。
LXRアゴニストは、マウス/ヒト初代マクロファージおよびマウス脂肪組織においてVEGFの発現を誘導するが、VEGFの基底発現は、LXR-/-マウスにおける血管障害の欠如から証明されるように、LXRが関与していないように思われる。しかしながら、腫瘍の微小環境はLXRリガンド治療によって影響を受けており、内皮細胞は血管新生に関連した血管内皮増殖因子受容体2の分布/シグナル伝達の障害を示し、それに伴って管形成、増殖および細胞移動の減少を示した[45,46]。この抗血管新生作用は、VEGFR2のコンパートメントとシグナル伝達の障害を媒介とする内皮コレステロールの恒常性に対するLXRの作用の結果であると考えられる。このように、内皮コレステロールの変化は、脂質ラフト/洞内の複雑なシグナル伝達経路とLXRの相互作用に起因するVEGFR2シグナル伝達に影響を及ぼす。LXRβは、癌細胞における血管新生および転移性浸潤の阻害に関連するApoEの発現をアップレギュレートすることが知られている。実際、MCF7乳がん細胞やメラノーマ細胞のLXRリガンド処理は、腫瘍増殖抑制につながるApoEの増加を示した[47,48]。
1.3. LXRとアルツハイマー病
ApoEは中枢神経系(中枢神経系)の主要な脂質トランスポータータンパク質である [49]。ApoEタンパク質は脂質粒子と結合し、アミロイドペプチド輸送のキャリアとして作用することで、中枢神経系の内外に脂質粒子を輸送することが提案されている。LXRは、アストロサイトにおけるApoEとABCA1の発現を調節し、それによってApoEの全体的な発現とその脂質レベルを制御することが知られている。最近では、LXRアゴニストによる治療は、アルツハイマー病におけるアミロイドβ輸送を促進してアミロイドのクリアランスをもたらすApoEおよびABCA1のアップレギュレーションをもたらすことが示されている[14,50,51,52]。脳に浸透することができるLUXRリガンドの開発は、それ自体で、または他のアルツハイマー病治療薬との組み合わせで、莫大な治療の可能性を持つことになるだろう[53,54]。
2. 肝臓X受容体のリガンド
2.1. 内因性アゴニスト
オキシステロール(図2)は、LUXRを活性化する2つの異なるリガンドタイプからなる哺乳類のLUXRの内因性リガンドであることが発見された[55,56]。オキシステロールの酸化誘導体の下に来る最初のタイプは、20(S)-、22(R)-、24(S)-、25および27-ヒドロキシコレステロール、および24(S)-、25-エポキシコレステロールを含む。これらのオキシステロールは,0.1〜0.4μMの範囲のKd値を有するLUXRに結合する。
図2 LXRを活性化する代表的な内因性リガンド
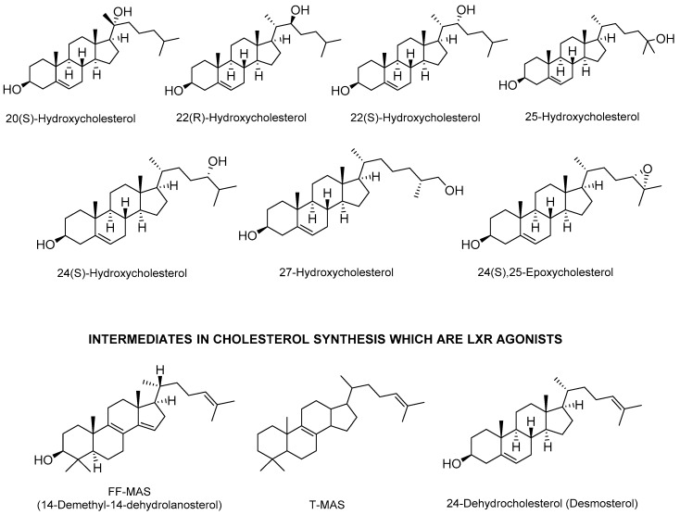
24(S)-ヒドロキシコレステロールは、脳内に豊富に存在することからセレブロステロールとしても知られており、24-ヒドロキシラーゼによって合成される。これは、LXR制御遺伝子ABCA1の効率的な活性化因子であることが証明された[57,58]。27-ヒドロキシコレステロールは、Cyp27a1によってコードされるP450酵素ステロール27-ヒドロキシラーゼによってコレステロールから生成される。それはさらに、27-ヒドロキシラーゼによってアルデヒドおよびカルボン酸(コレステノイン酸)に酸化される。27-ヒドロキシコレステロールとコレステノイン酸の両方がLXRのリガンドである[59,60,61]。25-ヒドロキシラーゼによって合成された25-ヒドロキシコレステロールは、LXR媒介経路の強力な調節因子である。また、LXLR依存性遺伝子LPL、ABCG5およびABCG8の発現にも影響を与える[62]。
LXRを活性化するオキシステロールの第二のタイプは、コレステロール生合成の中間体である。24(S),25-エポキシコレステロールは、メバロネート経路のシャントで産生される特異的なオキシステロールである。24(S),25-エポキシコレステロールの欠損は、LXR標的遺伝子ABCA1の発現を低下させる[63]。デスモステロールやザイモステロールなどの他の中間体もLXRを活性化する[64]。
減数分裂を活性化するステロールは、LXR活性化を介して卵子の減数分裂を刺激することが報告されている[37]。例としては、卵巣で生成されるコレステロール合成の中間体であるステロール4,4-ジメチル-5a-コレスタ-8,14,24-トリエン-31i-ol(FF-MAS)と、近縁のC29-ステロール(4,4-ジメチル-5a-コレスタ-8,24-ジエン-3p-ol) (T-MAS)が挙げられる[65]。
2.2. 内因性アンタゴニスト
また、いくつかの内因性LUXRアンタゴニストも同定されている(図3)。アラキドン酸および他の脂肪酸は、培養ラット肝腫細胞において、外部リガンドT0901317による内因性SREBP-1c遺伝子の活性化過程を競合的に阻害した。アラキドン酸は、トランスフェクトされたヒト胚性腎293細胞において、合成LUXR依存性プロモーターの活性化をブロックすることが示された。試験管内試験では、アラキドン酸および他の不飽和脂肪酸は、競合的にLXRの活性化をブロックし、これは、補活剤由来のペプチドへのLXRのリガンド依存性結合を測定した蛍光偏光アッセイに反映されている[66,67]。
図3 LXRを阻害する代表的な内因性リガンド(アンタゴニスト)
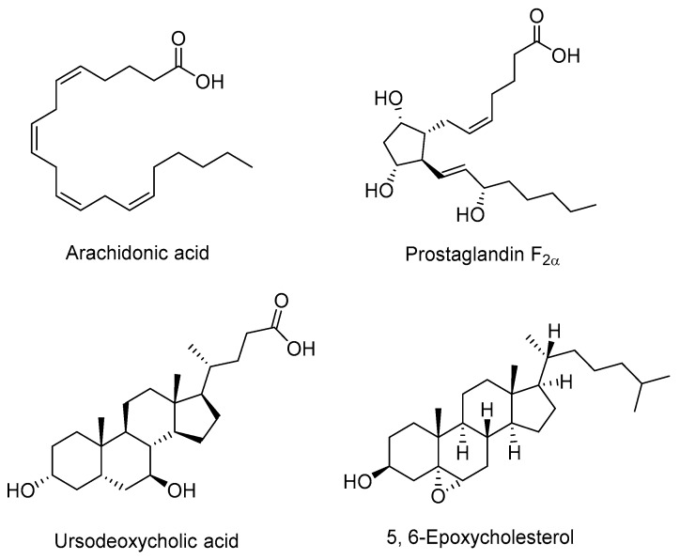
プロスタグランジンF2α(PGF2α)は、アラキドン酸のシクロオキシゲナーゼ代謝物の一つである。PGF2αは、T0901317で誘導されたLXRα-LBDおよびLXRβ-LBDの活性化を、それぞれ12.6μMおよび15μMのIC50値で用量依存的にアンタゴニストした。また、T0901317によって誘導されたABCA1およびABCG1プロモーター活性の活性化にも拮抗した[68]。小型ヘテロ二量体パートナー相互作用型ロイシンジッパータンパク質(SMILE)は、核内受容体(NR)ファミリーの核内コアプレッサーとして同定されている。ウルソデオキシコール酸(UDCA)は、LUXRαを阻害することにより、用量依存的にSMILEタンパク質レベルを増加させる胆汁酸である[69]。5α,6α-エポキシコレステロール(5,6-EC)は、ヒトの循環および動脈硬化性病変に見られるコレステロールの自己酸化の産物である。LXR-コファクター相互作用アッセイにおいて、5,6-ECはLUXR-LBDに直接結合し、LUXRαおよびLUXRβの両方への多数のコファクターのリクルートを阻害した。また、5,6-ECはLXR介在遺伝子とのアンタゴニスト挙動を示す[70]。
2.3. 天然物および誘導体
2.3.1. 天然アゴニスト
植物または真菌から精製された様々な化合物がLXRの活性を調節することが示されている。これらの天然に存在する化合物は、高トリグリセリド血症などのいくつかの副作用を最小限に抑えながら、潜在的な治療効果を提供しうる[71]。エルゴステロール、ブラジカステロール、カンペステロール、β-シトステロール、スティグマステロールおよびフコステロールを含む植物ステロールは、天然に存在するステロールであり、哺乳類のコレステロールに相当する植物性ステロールである(図4)。植物ステロールで腸細胞を処理すると、LXR標的遺伝子の発現が増加することが示唆されている[72]。スタンオールおよびステロールは腸内ABCA1発現を増加させ(シトスタノール244%、シトステロール273%、カンペステロール213%、フコステロール166%)コレステロール吸収を減少させ、LXRが腸内コレステロール代謝の食事調節の標的であることを示唆している[72,73]。しかしながら、最近の研究では、食事性植物ステロールおよびスタノールが腸管腔内のコレステロール吸収を阻害することが示されており、これはLXRとは独立したものである[74]。選択された植物ステロールのEC50値は、LXRの広く使用されている合成アゴニストであるGW3965Aと比較して、表1に記載されている。
図4 天然に存在するLXRリガンドとして選択された植物ステロールとテルペン

表1 選択された植物ステロールのEC50値は、コアクチベーターペプチドリクルートアッセイで評価された。
| フィトステロール | EC 50(nM) | |
|---|---|---|
| LXRα | LXRβ | |
| シトステロール | 42 | 26 |
| カンペステロール | 43 | 28 |
| フコステロール | 33 | 42 |
| シトスタノール | 136 | 110 |
| カンペステノール | 122 | 124 |
| GW3965A | 197 | 41 |
海藻類に豊富に含まれるステロールであるフコステロールは、コレステロール低下作用を有し、血漿中の高密度リポタンパク質(HDL)活性を増加させる。フコステロールは、HEK293細胞において、LXRα(200 µMで155%増、p<0.05)とLXRβ(200 µMで83%増、p<0.05)の両方の活性化を有意に誘導した[75]。HepG2細胞において、フコステロール(200 µM)は、ABCA1,ABCG1,ABCG5,ABCG8およびコレステリルエステル転移タンパク質(CETP)mRNA発現をそれぞれ2.4倍、13.2倍、1.5倍、1.3倍および0.8倍増加させた(p < 0.05)。
エルゴステロールまたはブラジカステロールに由来するYT-32((22E)-エルゴスト-22-エン-1α,3β-ジオール)は、LUXRαに直接結合し、10μMの濃度でACTRおよびDRIP205とLUXRαの相互作用を刺激する。また、1.1μMのEC50値でLXRβを活性化する。合成LUXRアゴニストT0901317とは異なり、YT-32は血漿中のトリグリセリドレベルを増加させることなく、腸内のコレステロール吸収を阻害する。このように、YT-32は選択的に腸内コレステロール代謝を変調する[76]。
ジテルペンは、植物や昆虫に広く分布する天然のステロイドである(図4,表2)。アカント酸(AA)は、Acanthopanax koreanum Nakaiの根の樹皮から単離されたピマラジエンのジテルペンである。AAは、LXRαおよびLXRβを活性化し、NF-κB転座を阻害することにより、動物におけるCCl4誘発性肝線維化を調節する。また、AAはLXRの活性化を介してラット肝細胞(HSC-T6)の増殖を阻害することも明らかにされている[77]。
表2 ジテルペノイド、ステロイド、トリテルペノイドのLUXR活性
| 名前 | LXRSPAバインディングIC50(µM) | 補因子協会HTRF *アッセイ、EC 50(µM) | トランス活性化最大。フォールドインダクション | |||
|---|---|---|---|---|---|---|
| LXRα | LXRβ | LXRα | LXRβ | LXRα | LXRβ | |
| カント酸 | 0.25 | 1.49 | 0.18 | ≥50 | 15.9(100 µM) | 5.6(100 µM) |
| ビペリドン | 0.10 | — | ≥15 | —– | ——– | ——– |
| ポリカルポール | 0.12 | ≥15 | 0.030 | ≥50 | —– | —– |
| ゴーゴストーン誘導体 | 0.07 | 0.2 | 0.05 | ——– | 13(10 µM) | 2.2(10 µM) |
* HTRFアッセイ:均一時間分解蛍光アッセイ。
Travesらは、アカント酸関連ジテルペン(DTP 1-5)でマクロファージを刺激すると、LXR標的遺伝子の発現およびコレステロールの流出が、GW3965およびT0901317のような合成アゴニストで観察されるのと同程度のレベルに誘導されることを報告している[78]。シンチレーション近接アッセイを用いて、表2に示すように、アカント酸、ポリカルポール、ゴルゴステイン誘導体およびビペリドン誘導体は、HEK293細胞においてLXRαを選択的に活性化した[79]。
漢方薬から単離されたいくつかの天然リガンド(図5)もまた、LXRに対する活性を示している(表2)。例えば、漢方薬Gynostemma pentaphyllumから単離されたダンマランサポニンであるギノサポニンTR1 ((20S)-2α,3β,12β,24(S)-pentahydroxydammar-25-ene 20-O-β-d-glucopyranoside)は、LXRアゴニストである。また、LXRβよりもLXRαに対して選択的な活性を示す。HEK293細胞において、ギノサポニンTR1は10μMの濃度でLXRαに対するルシフェラーゼ活性の有意な上昇を誘導した。また、同濃度レベルでTHP-1由来マクロファージにおけるABCA1およびApoE遺伝子の発現を増強し、コレステロールの流出を促進した[80]。
図5 LXRリガンドとしての選択された天然化合物の構造

ポドカルピン酸は、植物の樹脂に由来する天然の非ステロイド性LXRアゴニストである[81]。LXRシンチレーション近位結合アッセイから、その二量体無水物およびイミドなどのポドカルピン酸誘導体は、1-2 nMの濃度でLXRαおよびLXRβの両方に結合すると結論づけられた。HEK-293細胞上での細胞ベースのトランザクティベーション研究は、無水物二量体が両方の受容体に対して1 nMのEC50値を示し、αおよびβLXR受容体のそれぞれ50倍および8倍の最大誘導を示したことを示している。より安定で強力なイミドは、ハムスターにおいて、血漿中の総コレステロール値を28%増加させ、同時にHDL-コレステロールを22%増加させ、LDLを11%減少させた。同様の結果はマウスでも観察され、HDL-コレステロールレベルが19%増加した[82]。
さらに最近では、ホウオウ(マグノリア・オフィシナリス)の樹皮から抽出されたホノキオールが、レポーターアッセイでLXRトランザクティビティを誘導することが示されている。ホノキオールは、U251-MG細胞およびTHP-1細胞において、ABCA1 mRNAおよびタンパク質レベルを用量依存的に3倍増加させることが示された。ホノキオールはTHP-1マクロファージにおけるABCG1とApoEのmRNAレベルをそれぞれ2.9倍と3倍、タンパク質レベルをそれぞれ4.5倍と7倍増加させる[83]。同様に、ホノキオールは腹膜マクロファージにおけるABCA1遺伝子の発現を増加させる[84]。
パエオニフローリン(Paeonia lactiflora Pall)は、抗高脂血症作用、神経保護作用、抗肝線維症作用を有する生薬である紹興薬の有効成分の一つである。レポーターアッセイでは、パエオニフローリンは8.7μMのEC50値でGAL4プロモーターをトランザクティブすることが示されている。また、PLTP プロモーター、ABCA1 プロモーター、ラット CYP7A1 プロモーターにも、それぞれ EC50 値が 21.6 µM、11.9 µM、66 µM でトランザク トすることが示された [85]。これらの結果は、パイオニフロリンがLXRαアゴニストとして作用する可能性を示唆している。
シェガン(Belamcanda chinensis)から単離されたイリステクトリゲニンBは、20 µMでLXRα(+540%)とLXRβ(+331%)の両方の転写活性を用量依存的に有意に誘導した。イリステクトリゲニンBは、HDLへのコレステロールの流出を増加させ、マクロファージの細胞コレステロール濃度を低下させた。また、ABCA1およびABCG1 LXR応答性遺伝子のmRNA発現レベルを10 µMの濃度でそれぞれ2.0倍および1.9倍に有意に増加させた[86]。
2,4,6-トリヒドロキシ安息香酸エチル(ETB)をCeltis biondiiから単離し、LUXRαおよびLUXRβの転写活性に直接結合して刺激することを示した。ETBは、EC50値がそれぞれ80.76および37.8μMで、100μMでLXRα(+64%)およびLXRβ(+55%)の両方の転写活性を有意に誘導した。ETBは、用量依存的にTHP-1,RAW 264.7マクロファージおよび腸管細胞におけるHDLへのコレステロール流出を増加させ、細胞コレステロール濃度を減少させた。100 µM の濃度で、ETB は、HepG2 細胞の脂質増加を誘導することなく、THP-1 由来のマクロファージでは 7.4 倍、RAW 264.7 マクロファージでは 2.1 倍、それぞれ ABCA1 mRNA 発現を増加させた [87]。
多くの果物や野菜に含まれる天然フラボノイドであるシアニジンは、細胞の脂質代謝を調節することが知られている。シアニジンは、LXRαのトランザベーションを32%(50μMで)59%(100μMで)LXRβのトランザベーションを33%(100μMで)誘導した。シアニジンとLXRαおよびLXRβとのKD値は、それぞれ2.16および73.2μMで測定された。シアニジンは、EC50値3.48μMでLXRαを活性化し、125.2μMでLXRβを活性化した。また、シアニジンは、ABCA1,SREBP-1cおよびABCG5を含むLXR応答遺伝子をそれぞれ2.5倍(100 µM)、3.6倍(100 µM)および1.4倍(100 µM)活性化した。また、THP-1細胞およびHepG2細胞において、100 µMの濃度で細胞性TGの濃度をそれぞれ21%および23%減少させた[88]。
茶やハーブに存在する小さな香りの化合物であるシネオールは、LXRのトランザクティベーションを刺激することが示されている。CHO-K1細胞をシネオールで処理すると、LXRαのトランザベーションが75%以上、LXRβのトランザベーションが100%以上誘導された。RAW 264.7マクロファージにおいて、シネオールは細胞コレステロールレベルを低下させることができた。また、シネオールはLXR応答遺伝子のmRNA発現を有意に増加させた。驚くべきことに、シネオールで刺激した肝細胞では、LXR応答遺伝子FAS、SREBP-1cおよびSCD-1の発現が著しく低下していた。これらの結果は、シネオールが肝脂質形成を誘導することなくLXRを選択的に活性化する部分的アゴニストのように作用していることを示唆している[89]。
植物やハーブの誘導体とは別に、パキシリンやエルゴスタン-4,6,8,22-テトラエン-3-オン(ノルウェーの土壌から単離されたエロスタン誘導体)のようないくつかの真菌の誘導体もまた、LXRに対するアゴニスト活性を有することが示されている[90]。
2.3.2. 天然アンタゴニスト
過去10年間のLXRリガンド開発の主な焦点は、治療に有用なアゴニストにあったが、最近の報告では、いくつかの天然由来のアンタゴニストが出現し、トリグリセリドを減少させ、脂肪肝状態を改善する能力を示し、LUXRアンタゴニストの治療薬としての潜在的な有用性を示唆している。
図6は、LXRアンタゴニストとして作用するいくつかの天然由来の化合物を示している。グッタフェロンはIC50値が3.4μMでLXRαの活性を阻害し、IC50値が15μMを超えるとLXRβの活性を阻害し、これはLXRαに対する5倍の選択性を示している。しかし、グッタフェロンは共活性化アッセイではLXR活性を示さなかった[91]。リカルディンC(RC)およびリカルディンF(RF)は、レバーワートBlassaia pusillaから単離された非ステロール天然LXRアンタゴニストである。RCはLXRβの選択的アンタゴニストであり、10 µMの濃度でTHP-1マクロファージにおけるABCA1の発現と細胞コレステロールの流出を2倍、ABCG1を2.6倍、SREBP-1cを1.6倍に増強することができる。リカルディンFは、両方のLXRアイソフォームのための天然のデュアルアンタゴニストである[92]。
図6 LXRアンタゴニストとして選択された天然化合物の構造

ナリンゲニンは、グレープフルーツ、オレンジ、トマトに含まれるフラボノイドである。Goldwasserらは、ナリンゲニンがLXRαアゴニストT0901317の存在下でLXRαに対してアンタゴニスト活性を示すことを確認した。4.7nMのT0901317で刺激したHEK 293 T細胞において、126μM濃度で28.4%、400μM濃度で39.1%LXRα活性を阻害した。また、ABCA1,ABCG1,HMGR、FAS遺伝子のmRNAのアバンダンスをそれぞれ92%、27%、43%、41%減少させた[93]。
ゲニステインは、LUXRモジュレーターとして作用することがわかっている大豆由来のフラボンである。他のイソフラボンと同様に、ゲニステインはリン酸化を促進することで間接的にLXR活性を調節すると考えられている。ゲニステインはLXRαの活性化を抑制することで、SREBP-1cやABCA1の発現を低下させた。同時に、LXRβの活性化によりABCG5およびABCG8の発現を増加させることが示され、このように2つの異なるLXRに対して相反する作用を示すことが示された[94]。
魚介類に豊富に含まれるタウリン(2-アミノエタンスルホン酸)は、高コレステロール血症や動脈硬化に栄養的な意味合いを示すことが知られている。Hoang ら[95]は、タウリンが CHO-K1 細胞の LXRαに直接結合し、その転写活性を 100 µM 濃度で +90% 刺激することを報告した。また、タウリンは、FAS や SCD-1 などの脂肪酸合成遺伝子を誘導しないことで、肝細胞の細胞コレステロールや TG レベルを低下させたことも確認されている。タウリンは、ステロール調節エレメント結合タンパク質1タンパク質(SREBP-1c)[95]の核転座を阻害することでこれを達成した。
漢方薬の大黄(Rheum palmatum L.)は、アントラキノン様成分であるレイン(4,5-ジヒドロキシアントラキノン-2-カルボン酸)を含み、これは両方のLXRに対して拮抗活性を示すことが発見された[96]。ルシフェラーゼ活性アッセイでは、アゴニストGW-3965によって刺激されたLXRαおよびLXRβの転写活性を用量依存的に阻害することが示された。このことは、Rheinが肝臓におけるSREBP-1cまたはその標的遺伝子の発現を阻害していることを示唆している[96]。
金谷らは、白ボタン茸(WBM)で処理したマウス肝臓において、脂肪酸生合成経路がダウンレギュレートされたことを報告している。その結果、T0901317(LUXRアゴニスト)とWBM抽出物を併用して処理すると、LUXRルシフェラーゼ活性が有意に低下した。さらに、HepG2細胞におけるLXRシグナル伝達の抑制は、WBMによるFASおよびELOVL6発現のダウンレギュレーションを媒介していることも明らかになった[97]。
LXRβアゴニストGW3965の存在下でのLXRβのトランザクティビティの選択的阻害は、クディン茶抽出物によるアンタゴニスト性を明らかにした。クディン茶抽出物を投与したマウスでは、肝臓および脂肪組織において、ABCA1,ABCG1,LPLおよびApoEを含むLXRβ標的遺伝子のmRNA発現が有意に抑制された[98]。また、オクラ多糖類は、ATP結合カセットトランスポーターG1,ApoE、CYP7A1などのLXR標的遺伝子の発現を抑制することで、肥満C57BL/6マウスのLDL-cレベルを低下させることが知られている[99]。
Kimらは、Parthenocissua tricuspidata (Virginia creeper)およびEuscaphis japonica (Korean sweetheart tree)のメタノール抽出物(MEH184およびMEH185)が、アゴニストT0901317および22(R)-HCの両方の存在下でLXRαの転写活性を阻害したことを報告している[99]。これらの抽出物はいずれもLXRαの標的遺伝子として確立されているFAS、アルツハイマー病D1/SREBP-1c、LUXRα mRNAの発現を劇的に低下させた[100]。
2.3.3. 合成LXRリガンド
様々な病態におけるLXRの有効性を証明する複数の知見により、新規かつ強力なLXRモジュレーターの開発が進められていた。T0901317(図7)は、第三級スルホンアミドとビストリフルオロメチルカルビノールからなる非ステロイド性合成リガンドであり、LXRの活性化とその補因子のリクルートに関与する重要な水素結合活性を可能にしている[101]。この合成リガンドは、ABCA1発現を誘導し、癌細胞の増殖を減少させ、アミロイドβ(アミロイドβ)ペプチド産生をダウンレギュレートすることが証明されている。T0901317は非常に効果的なLXR活性化剤であるように見えるが、このリガンドはプレグナンX受容体(PXR)とファルネソイドX受容体(FXR)の活性化剤であり、RORαとRORγの阻害剤でもあり、この特定の合成リガンドの選択性には疑問が残る[102,103]。
図7 代表的な合成LUXRαリガンドの構造

GW3965は、Fraderaら[104]によると、LXRαを活性化するためのEC50値が648±179nMであり、より選択的にLXRαを活性化することが示されている別の非ステロイド性の第3級ベンジルアミドである。グラクソ・スミスクライン社によって開発されたこのリガンドは、動脈硬化性発症、虚血誘発性脳損傷、および他の関節炎および炎症性発症の予防におけるその利点について試験されてきた。GW3965はLXRαに対する選択性を高めてこれらの利点を提供する一方で、リガンドはマウス被験者において高トリグリセリド血症効果と関連しており、治療への使用の可能性を妨げている[29,105]。
T0901317およびGW3965は、LXRの活性化について広範囲に研究されており、そのように、複数の研究グループおよび企業は、LXRリガンド結合ポケット内で相互作用する新たな強力な化学的足場を求めて、以前の合成分子と比較するために、新規リガンドを開発してきた。グラクソ・スミスクラインは、GSK3987の合成により、これらのLXR活性化剤の開発を続けてきた。GSK3987は、置換3-(フェニルアミノ)-1H-ピロール-2,5-ジオンまたはマレイミドであり、強力なLXRαおよびLXRβデュアルアゴニストおよびABCA1誘導剤であることが証明されており、LXRβを活性化するEC50値は40 nMである。新しいリガンドの有効性は、以前に確立されたLXRアゴニストとほぼ同等であるが、高トリグリセリド血症はGSK3987の懸念事項として残っている[106]。
Chaoらは、T0901317の改変に基づいて新規なN-フェニル第三級アミンを開発した。提案されたリガンド(3FAL)の1つをLUXRβ内で共結晶化し、受容体内の相互作用の可能性のある領域を明らかにし、GSK9772は、以前の合成リガンドを悩ませていたトリグリセリドの蓄積を伴わない、リポゲンシグナル伝達経路のトランザクティベーションよりも、LUXR媒介の炎症性遺伝子発現のトランスレプレッションに対する10倍の選択性を有する、抗炎症活性を有すると主張されるLUXRモジュレーターであることが明らかにされた[107]。
Fraderaらは、GW3965のLXR結合を、ベンズイソオキサゾール尿素(3IPUで結晶化)およびベンズイソオキサゾール誘導体(3IPSで結晶化)であるF3methylAA/L783483の結合と比較した。このクラスの化合物は、炎症および心血管疾患の治療に有効であることが示され、これらのリガンドのドッキング研究は、LXRホモダイマーおよびLXR:RXRヘテロダイマーとの補因子シグナリングの可能性のあるメカニズムを提示した[104]。LXRアゴニストとしての評価のために、2つの芳香環(5AVI)と3つの芳香環(5AVL)を持つ安息香酸tert-ブチルアナログを合成した。5AVLに結晶化したリガンドは、マウスとシノモルグスザルの両方において、血中トリグリセリドレベルに影響を与えることなく、血中ABCA1 mRNAの発現を誘導することが明らかになった[108]。
T0901317アナログにピロール基を導入した新しいクラスのLXRβ部分アゴニストが報告されている[109]。2つの結晶構造、4DK7および4DK8(図8)は、これらのリガンドを比較する2つの別々の配向が、両方ともLXRβのリガンド結合部位を封鎖しているように見えることを明らかにし、受容体の活性化を確認している[9]。Bernotasらは、スルホン置換基を有する4-(3-アリールオキシアリール)キノリンを調製し、T0901317に匹敵する効力を有し、LXR結合部位に対して高い親和性を有することを証明した。J774マウス細胞を用いたアッセイでは、PPAR活性化を伴わないABCA1 mRNAの増加が明らかになったが、これはWyethが合成したキノリン系LUXRリガンドでは望ましくない効果であった[110]。Kickらは、ピラゾールまたはイミダゾール官能基のいずれかを含む選択的LXRβ部分アゴニストを開発した。4RAKで結晶化した最も強力なリガンドは、ヒト血中で1.2μMのEC50のex vivoでABCA1を誘導し、マウスでテストしたときに有意なトリグリセリドの上昇はない[111]。
図8 代表的な合成LXRβリガンドの構造

鄭らは、構造に基づいたドラッグデザインプラットフォームContourを利用して、2-(メチルスルホニル)ベンジルアルコールとピペラジンコアを主成分とするLXRβアゴニストを合成した。そのような化合物の1つ(514V、図8)は、LXRαに対する27倍の選択性を示し、アトピー性皮膚炎の治療のために現在臨床試験中である[112]。
より最近の研究では、LXR活性化およびアルツハイマー病に関連した治療の可能性に焦点を当てた合成アゴニストが見られる。Stachelらはビスピペリジンとイソプロピルトリフルオロマンデラート基を含むLXRβ選択的アゴニストを合成し、ラットに投与すると、脳への浸透、脳内のアポリポタンパクEおよびABCA1レベルの上昇、およびアミロイドβペプチド産生の顕著な減少を可能にし、すべてがトリグリセリドレベルに影響を与えることなく[54]。Ticeらによって合成されたLXRモジュレーターもまた、LUXRβに結晶化した化合物5KYAと5KYJで、脳内のABCA1レベルを増加させることが試験されている。これらの特定の化合物はすべて2,4,5,6-テトラヒドロピロロ[3,4-c]ピラゾールコアを含み、これらのモジュレーターのための新しい足場として作用する[113]。
3. LXRリガンド設計の考察-分子モデリングの観点から
二つのLXRアイソフォームのリガンド結合ドメインは、74%の配列同一性を持ち、それらの結合ポケットの第一層に同一の残基(すなわち、ほとんどのリガンドと直接接触する残基)を持つ非常に類似したものである[8]。以下の議論では、タンパク質の2つの形態の間の強い構造的類似性を念頭に置きながら、LXRβの構造に焦点を当てる。LXRαの残基番号は、LXRβの残基番号からマイナス14でオフセットされていることに注意すべきである(例えば、LXRβのTrp457はLXRαのTrp443である)。
X線結晶構造解析は、LUXRの構造が他の核内受容体と一致していることを明らかにし、12個のαヘリックスが3層のサンドイッチフォールドを形成していることを示している(図9) [101]。結合ポケットの体積は560-1090Å3の間であると報告されており[8,103]、この体積は結合したリガンドの大きさや性質に強く依存する。報告されているこの広い範囲の体積は、LUXRによって示される大きな可塑性を示している。この可塑性は、LXRの結合ポケットの異常に大きいサイズと一緒に、ステロイド受容体の結合ポケットは一般的に420-550Å3の範囲の体積を持っている-サイズと形状が大きく変化するリガンドを収容することができる受容体の結果となっている。
図9 肝臓X受容体の3層サンドイッチフォールドを形成する12のαヘリックス。

LXRの活性化のメカニズムは、多くの研究が行われているエストロゲン受容体[8,102]のような他の核内受容体の活性化と一致している。アゴニストが結合すると、活性化機能2(AF2)としても知られるらせん12は、結合ポケットを閉じ、共役タンパク質が結合できる溝を作るコンフォメーションを想定している[114]。結合ポケットの閉鎖が、His435(ヘリックス11)とTrp457(ヘリックス12)との間のアゴニスト結合時に確立されるR-H—π相互作用(R = CまたはN)によって媒介されるという強い構造的(結晶学的)証拠がある[101]。
結合ポケットは、図10に示すように、全体に配置された多くの非極性の脂肪族および芳香族残基を有する大部分が疎水性である。結合ポケットの親水性領域は、タンパク質表面に近接しているため、溶媒にアクセス可能な、いくつかの極性および荷電したアミノ酸を所有している。この親水性領域は、らせん1と5,およびらせん5と6の間に見られるβシート領域の近くに位置している。また、疎水性領域内で、親水性領域に直接対向する結合ポケットの側に、受容体の活性化に責任のある中程度の極性のHis435およびTrp457アミノ酸(らせん11および12)が見出されていることにも留意すべきである。
図10 最適化された3KFC結晶構造に基づくLXRβの結合ポケット

ここでは、密度汎関数理論(DFT-D)による結合エネルギー計算を用いて、LXRβと様々なアゴニストリガンドとの複合体の安定化に大きな役割を果たす特定のリガンド-リド相互作用を決定した。これらの計算は、タンパク質データバンク(PDB)から得られた7つのLXRβ結晶構造に対して行われ、それぞれの結晶構造は異なるアゴニストリガンドを持つ。この研究で用いた7つのPDB構造は、1PQC [103]、1PQ6 [103]、3KFC [110]、4DK7 [109]、4DK8 [109]、3L0E [115]、5HJP [54]であり、分解能は2.3Å(3L0E)から2.8Å(1PQC)である。これらの中でも特に注目すべきは、1PQCと1PQ6構造であり、これらの構造は、それぞれT0901317[116]とGW3965[117]という強力なアゴニスト活性を持つことが知られている合成リガンドを含んでいる。7つの結晶構造のいずれか1つに含まれるリガンドの4Å以内のアミノ酸がDFT-D研究のために考慮され、合計40個のアミノ酸がこの基準に適合した。
すべてのペアワイズ結合エネルギー計算は、Cuby4インターフェース[120]を介してORCA分子電子構造パッケージ[119]を使用してBLYP-D/def2-TZVP[118]レベルの理論で実行された。誘電率4.0のCOSMO暗黙のソルベーション法を用いて、タンパク質の内部環境を模倣した [121]。このアプローチは、以前に報告されたいくつかの研究で採用されている[122,123]。ここでは、アミノ酸のバックボーンの窒素とβ-炭素に水素原子を付加するという最も単純なキャッピングスキームが採用された。立体衝突の影響を最小化するために、すべての構造の側鎖は、背骨原子の位置を固定した状態でシミュレーテッドアニーリング法を用いて最適化された。これらの最適化は、Yasara分子モデリングスイートを用いて、Amber99力場を用いて実施した(http://www.yasara.org)。
図11は、すべての7つの結晶構造にわたって平均化された40個のリガンド-リジッド複合体のペアワイズ相互作用エネルギーを与える。ここでは、約3.0 kcal/mol以上の平均相互作用エネルギーを示す11の特に強い相互作用、Phe329-Trp457(図11に示す順序で)が関与していることがわかる。これら11の相互作用のうち、Phe329 (-5.66 kcal/mol)、Arg319 (-5.11 kcal/mol)、Phe271 (-4.87 kcal/mol)、His435 (-4.15 kcal/mol)が関与するものが特に強い。興味深いことに、これらの相互作用のうち2つは、Phe329とPhe271に関連するものは完全に疎水性の相互作用であり、2つは極性の相互作用、すなわち正電荷のArg319とHis435の複素環に関連する相互作用である。ここでは、Arg319とHis435が11の極性残基の中で唯一の2つの極性残基であることに注目すべきである。Arg319は、結合ポケットの親水性領域に位置する残基の一つであり、タンパク質表面の近くに存在する。上述のように、His435とTrp457の間の強い接触の確立は、リガンドを介したLXRアゴニズムに役割を果たしていると考えられている。これら2つのアミノ酸とリガンドの直接的な相互作用が、受容体の活性型コンフォメーションを安定化するために強い役割を果たしているという仮説は妥当であるように思われる。
図11 LXRβ結合ポケット内のリガンドと40個のアミノ酸のペアワイズ相互作用エネルギー

1.0kcal/molから2.5kcal/molの範囲の中等度の相互作用エネルギーを持つ16のリガンド-リド相互作用、Leu345-Ala343がある。これらの残基のほとんどは、リガンドと分散型の相互作用を形成する芳香族または脂肪族アミノ酸であり、例外は、Ser278(中性極性、-2.21 kcal/mol)Gln438(中性極性、-1.38 kcal/mol)Lys331(正極性、-1.26 kcal/mol)およびGlu315(負極性、-1.07 kcal/mol)である。Val439-Asn351の9つの残基はリガンドと弱い相互作用を形成し、相互作用エネルギーは1.0kcal/mol未満であった。Thr328,Lys337,Ser342,Glu281の4つの残基は、リガンドと軽度の反発性を示す。最も強い反発はGlu281であり、相互作用エネルギーは+0.63 kcal/molであった。すべての計算は、側鎖(背骨ではなく)原子のみが最適化された結晶構造に基づいているため、このような軽度の反発性相互作用が発生しても不思議ではない。
図12は、4つの異なるリガンド、3KFC、5HJP、1PQC(T0901317)および1PQ6(GW3965)で発見されたものとの11の最も強いリガンド-残基相互作用のための相互作用エネルギーを示している。ここに示されたデータの中で最も注目すべき点は、4つの系すべてにおいて特に強いリガンド-リド相互作用が見られるのは、Phe271(〜4-5 kcal/mol)とHis435(〜3.5-6 kcal/mol)が関与するものだけであるということである。1PQC構造のための相互作用は、ここではいくつかの残基のために顕著に弱いであるが、それは、それが強力なアゴニストであることが知られているものの、T0901317がこの研究で考慮されたリガンドの中で最小であることを考慮に入れた場合、おそらく驚くべきことではない。1PQC構造を無視すると、1PQ6/Ala275と1PQ6/Leu274を除くすべてのリガンド-リジン相互作用は、少なくとも2kcal/molの結合エネルギーを持っており、これらの相互作用のそれぞれがリガンド結合に大きく寄与していることがわかる。
図12 LXRβの結合ポケット内のリガンドと11個の選択されたアミノ酸の相互作用エネルギー

図10に示すように、最適化された3KFC結晶構造は、LXRβとリガンドの間の典型的な相互作用の例として取られ、この構造は、図12で考慮された11個のアミノ酸について、最も一貫して強いリガンド-リド相互作用を示すので。ここでは、結合ポケットの疎水性の性質が見られ、Phe329,Phe271,Met312,およびLeu330が主要な接触点であり、主にこれらの残基によって示された(一般的に)強い相互作用によって反映されるように、結合キャビティの中央領域の(疎水性の)性質と形状を決定している。図12に示されている最も驚くべき結果の一つは、リガンドとAla275の間の強い引力であり、これも結合ポケットの中央領域に位置している。その小さなサイズを考えると、一般的にこのアミノ酸は、リガンドと強いファンデルワールス接触を形成しないと考えられている。ここでは、Ala275がリガンドの二環式基と強い分散接触を形成していることがわかる。Arg319とThr316を含む結合ポケットの溶媒にアクセス可能な領域では、正のArg319側鎖とリガンドの電子陰性スルホニル基との間に強い相互作用が形成される。スルホニル基はLUXRリガンドで一般的に見られるものであり、一般的には結合ポケットのこの親水性領域に向かって配向していることに注意すべきである。
リガンド、His435とTrp457との重要な相互作用は、図10にも示されている。ここでは、ヒスチジンイミジゾール環とトリプトファンインドール構造の複素環との間にC-H…π相互作用が成立している。この相互作用の確立、ヘリックス12(AF2)とヘリックス11の間の接触を確立することが、LXRアゴニズムの原因であると考えられている。これらの残基とリガンドとの相互作用については、His435とリガンドCF3基との間には明らかにN-H–F水素結合が存在し、リガンドとTrp457との間にはπ-π接触が存在する。また、His435と配位子との間には(より強い)N-H—N型の水素結合が存在する可能性が高く、このような相互作用も存在する可能性があることに留意すべきである。
図13は、His435-Trp457,配位子-His435,配位子-Trp457の相互作用エネルギーを示している。ここに示されたデータの最も興味深い点は、両方とも部分的なアゴニストを表す4DK7と4DK8(他の5つの構造は完全なアゴニストを含む)を除くすべての構造について、His435-Trp457の相互作用エネルギーがかなり強い(〜2.0 kcal/mol以上)という事実であり、両方とも有意に低い結合エネルギーを持っている。この知見は、His435-Trp457相互作用がLXRアゴニズムを媒介しているという仮説を支持するものである。リガンド-残基相互作用とLXRアゴニズムとの関係はあまり明確ではない。例えば、リガンド-His435相互作用は5つの構造で強い(3.0kcal/mol以上)が、3L0E(完全アゴニスト)と4DK8(部分アゴニスト)では有意に弱い。リガンド-Trp457相互作用はすべて2.0~4.0 kcal/molの範囲であり、部分アゴニストよりもフルアゴニストの方が特に好ましいということはなかった。
図13 His435-Trp457,リガンド-His435,リガンド-Trp457相互作用の計算された相互作用エネルギー

4. 概要
脂質の恒常性維持におけるLXRの役割についての知見の増大と同時に、ホルモン受容体の選択的かつ強力なリガンドの開発は、LXR調節の臨床応用に向けて大きな前進を遂げてきた。
LXRは現在、逆コレステロール輸送経路の主要な制御因子として知られており、アゴニストリガンドを介したLXRの活性化は、コレステロールフラックスを制御し、それによって心血管疾患を予防し治療するための実行可能なアプローチである。
LXRはまた、脂質形成および全身循環におけるグルコースバランスの維持において中心的な役割を果たしており、2型糖尿病および代謝性疾患の治療のための潜在的な機会を提示している。しかしながら、LXRの活性化はまた、肝臓でのトリグリセリド合成を促進し、血漿中のトリグリセリドレベルを上昇させ、心血管疾患介入のためのLXRアゴニストの開発に大きな課題を提示する。
一方、肝臓ではLUXRαが支配的に発現していることから、LUXRβ選択的リガンドの開発が必要とされている。このような観点から、我々はリガンドの相互作用エネルギーとLXRβリガンド結合ドメインの重要なアミノ酸残基を調べた。このような多様な相互作用は、LXRβ受容体への選択性と特異性を高めるために、より強力な分子を設計するために考慮されるべきであると考えている。
