Contents
Lifestyle Modifications and Nutritional Interventions in Aging-Associated Cognitive Decline and Alzheimer’s Disease
www.ncbi.nlm.nih.gov/pmc/articles/PMC6966236/
Gurjit Kaur Bhatti、1 Arubala P. Reddy、2 P. Hemachandra Reddy、3、4、5、6、7 and Jasvinder Singh Bhatti8、*.
要旨
アルツハイマー病(Alzheimer’s Disease: アルツハイマー病)は、難治性の神経変性疾患の一種で、アミロイドβ(アミロイドβ;プラーク)とタウの高リン酸化が神経原線維のもつれ(NFT)として脳内に蓄積し、神経細胞の死、認知機能の低下、記憶力の低下が起こることを特徴としている。先進国におけるアルツハイマー病の高い有病率は、個人や社会への社会的・経済的負担に関連した主要な公衆衛生上の課題となっている。早期診断とアルツハイマー病の正確な病態生理を決定するための選択肢が限られているため、効果的な治療戦略を見つけることが大きな課題となっている。アルツハイマー病の病態に関連したいくつかの危険因子が同定されているが、その役割はまだ確定的ではない。アミロイドβとタウを標的とした薬剤の最近の臨床試験では、アルツハイマー病病態の治療法を見つけることができないであった。したがって、認知機能の低下や認知症、特にアルツハイマー病の有病率の指数関数的な増加を抑えるためには、効果的な予防戦略が必要である。新たな治療ターゲットの探索は科学界にとって大きな課題であるが、多くの代謝性疾患や神経変性疾患の予防における生活習慣の介入や栄養補助食品の役割は、文献でも高く評価されている。本論文では、アルツハイマー病の病態に関与する分子メカニズムと、食事、運動、カロリー制限(CR様々な生理活性化合物を含む生活習慣や栄養介入が認知機能低下や認知症に及ぼす可能性のある改善作用についてまとめた。本論文では、認知機能の低下や偶発的なアルツハイマー病の発症を抑制し、生活の質を向上させるという利点を提供する可能性のあるアルツハイマー病病態の変調における非薬理学的介入の役割についての洞察を得ることができるだろう。
キーワード アルツハイマー病、酸化ストレス、炎症、食事、運動、ライフスタイル、栄養補助食品、抗酸化物質
序論
医療インフラの改善と疾患の早期診断により、人間の平均寿命は世界的に伸びている(Oeppen and Vaupel、 2002)。しかし、加齢に伴う疾患の負担も、今後数十年の間に指数関数的に増加すると考えられている(Beard er al 2016)。老化は、様々な遺伝的・分子的メカニズムによって制御されるプロセスである。認知症は、高齢化に伴う障害の主な原因の一つである。認知症の中で最も支配的な形態であり、認知症の60〜80%を占めるアルツハイマー病は、神経細胞の外側にアミロイドβ(アミロイドβ;プラーク)が蓄積し、脳内の神経細胞内でタウタンパク質や神経原線維タングル(NFT)のリン酸化が亢進し、認知機能の低下、記憶喪失、ひいては神経細胞死に至ることを特徴とする多因子性の神経変性疾患である。高齢化に伴い、加齢に伴う神経変性疾患の負担は世界中で指数関数的に増加している(Prince et al 2015)。アルツハイマー病の病態生理には、年齢、教育、社会経済状態、家族歴、遺伝子変異、酸化的損傷、神経炎症などの複数の危険因子が関与している。現在、アミロイドβおよびタウタンパク質を標的とした薬理学的治療薬は臨床試験で失敗しており、現在までにアルツハイマー病の治療薬はない。アルツハイマー病に対する薬理学的治療の失敗により、本疾患の予防のために非薬理学的介入が注目されている。代謝疾患や神経変性疾患には、ミトコンドリア機能障害、酸化ストレス、炎症経路、カルシウムの恒常性など、多くの共通分子メカニズムが存在する。これらの経路を標的とした予防戦略は数多く存在し、糖尿病、肥満、心血管疾患(心血管疾患がんなどの代謝性疾患の負担軽減に非常に有効であることがわかっている。本レビュー記事では、高齢者におけるアルツハイマー病発症の予防戦略として、アルツハイマー病に関与する分子メカニズムと、運動、地中海式食事(MD栄養補助食品、生理活性化合物などの生活習慣や栄養面での介入に焦点を当てている。認知症の発症を予防または遅らせるためのこれらの介入は、個人、社会、医療従事者に大きな影響を与える可能性がある。
アルツハイマー病の有病率と経済的負担
現在の人口動態の傾向は、世界人口の中で高齢者(65歳以上)が大幅に増加しており、認知症発症の大きなリスクをもたらしていることを示している。以前の研究では、世界人口の約6%が認知症に苦しんでいることが示されている(Prince er al)。 アルツハイマー病協会の最近の推計によると、世界では5、500万人が認知症を患っており、毎年1、000万人以上がこの致命的な病気を発症していることが明らかになっている。この数は2050年には8、800万人増加すると予測されている(アルツハイマー協会、2019)。この病気はアメリカ人に多く見られる。現在、2019年には、あらゆる年齢層のアメリカ人のうち580万人がアルツハイマー型認知症で生活しており、この数は2050年には3倍に増加すると予測されている。65歳以上の人は約560万人。65歳以上のアメリカ人の10人に1人がアルツハイマー病に悩まされていることになる。このような高齢者人口におけるアルツハイマー病の発生率と有病率の増加は、個人、社会、介護者、連邦政府への経済的負担に関連した大きな公衆衛生上の課題となっている(Hurd er al)。 図1は、認知症の人々のためのヘルスケア、長期ケア、ホスピスケアを含む年間支出を示している。最近の推計では、アルツハイマー病の全体的な維持費が大きく増加し、2019年の2、900億ドルから 2050年には1兆1、000億ドル以上に増加すると予測されている(Alzheimer’s Association、 2019)。しかし、教育状況、たばこの喫煙、座りっぱなしのライフスタイル、うつ病、高血圧、糖尿病、脂質異常症、肥満など、修正可能なリスク決定要因を減らすことは、米国での認知症の約50万例の予防に役立つ可能性がある(GBD 2015 Neurological Disorders Collaborator Group、 2017)。
図1 認知症の人の健康管理、長期療養、ホスピスケアなど年間支出額

アルツハイマー病の病態に関わる分子メカニズム
アミロイドβプラークとタウ高リン酸化
アルツハイマー病の病態生理には、脳内の2つの主要なタンパク質、すなわちアミロイドβタンパク質とタウタンパク質が関与している。39~43アミノ酸残基からなるアミロイドβタンパク質は、脳内で細胞内で産生される。アミロイドβの蓄積とクリアランスの不一致により、脳内にプラークが形成される。アミロイドβは、アルツハイマー病病理の進行や認知障害の進行に重要な役割を果たしている(Hardy、 1997; George-Hyslop and Rossor、 2001)。アミロイドβ、アミロイドβ前駆体タンパク質(アミロイドβPPおよびプレセニリン(PS1およびPS2)をコードする遺伝子の遺伝子変異は、脳内での異常なアミロイドβ凝集をもたらす。アルツハイマー病では、脳細胞の細胞外領域におけるアミロイドプラークまたは老人性プラークとしてのアミロイド線維の蓄積が、シナプス損傷、神経細胞機能障害、および炎症反応の原因となっている(Lesné et al 2013)。タウタンパク質は、ネイティブにアンフォールドされた微小管関連タンパク質のファミリーであり、染色体17q21上に位置し、微小管の組み立てと安定化に重要な役割を果たしている。アルツハイマー病の病理学では、タウタンパク質の強烈な過リン酸化はNFTの形成を引き起こし、記憶や学習中枢に関連する脳の領域で微小管の分解と神経細胞の損失につながる(Kolarova et al 2012)。
ミトコンドリアの機能低下
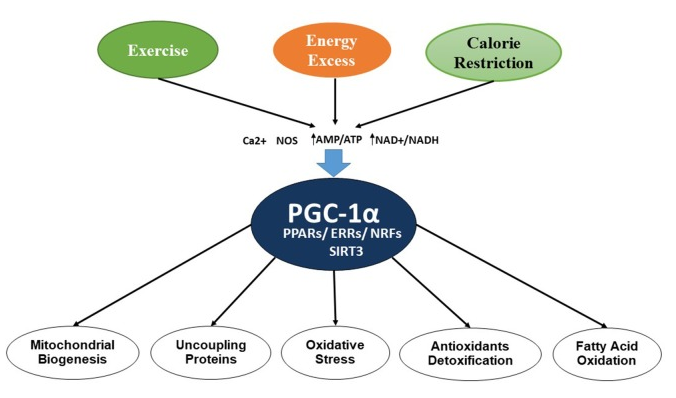
ミトコンドリアは、細胞内に存在する二重膜の細胞内小器官であり、栄養素を代謝することで重要な役割を果たしていることが知られている。彼らはまた、彼らはアデノシン三リン酸(ATP)を生成するように、細胞または「エネルギー通貨」のパワーハウスとして知られている。いくつかの研究では、ミトコンドリア機能不全が神経変性疾患の主要な病理状態として関与していることが示唆されている。ミトコンドリア機能不全は、ミトコンドリアの生合成および動態のプロセスの変化を伴い、多くの病理学的状態につながる。ミトコンドリアの生合成では、ミトコンドリアの数とサイズが増加し、これはペルオキシソーム増殖因子活性化受容体(PPAR)-γ共活性化因子-1α(PGC-1α)によって制御され、いくつかの転写因子および核呼吸因子(NRF-1およびNRF-2)を含む他のタンパク質が関与している。アンカップリングタンパク質(UCP2転写因子A(TfamPPAR、甲状腺ホルモン、グルココルチコイド、エストロゲン、およびエストロゲン関連受容体(ERR)αおよびγ(HockおよびKrallli、2009)。AMP活性化プロテインキナーゼ(AMPK)もまた、細胞内エネルギー代謝の調節に寄与する(Reznick and Shulman、 2006; Bhatti er al 2017a)。図2は、様々な転写因子や他のタンパク質によるミトコンドリア生合成の調節過程を示している。
図2 転写因子とPGC-1αによるミトコンドリア生合成の制御
ミトコンドリア動態とは、ミトコンドリアが分裂と融合のプロセスを連続的に経ることで、その形状、構造、機能を維持するプロセスである(Chan、 2006; Westermann、 2010; Archer、 2013; Roy er al)。 ミトコンドリアの融合では、Mitofusin1と2、optic atrophy1(Opa1)を含む3つのGTPase遺伝子がこのプロセスを制御しているのに対し、ミトコンドリアの分裂はFis1とDrp1という2つのGTPase遺伝子によって制御されている。ミトコンドリアの生合成と動態が障害されると、ミトコンドリアの正常な機能が障害され、結果として細胞内のエネルギー生成が低下する。これまでの研究から、ミトコンドリアの動態の障害は、老化や老化に伴う代謝性疾患や神経変性疾患に重要な役割を果たしていることが明らかになっている(Reddy、 2011)。ミトコンドリアのバイオジェネシスの際には、形成された欠損ミトコンドリアがマイトファジーと呼ばれるプロセスによって除去される。欠損したミトコンドリアはリソソームと融合し、オートファジー-リソソームシステムによって除去される(Ding and Yin、 2012)。老化は、ミトファジーを損なうことにより、欠陥ミトコンドリアの蓄積、酸化的不均衡、およびアポトーシスに寄与する(Chistiakov er al)。 ミトコンドリアの生合成および動態の変化はまた、細胞内の活性酸素種(ROS)の過剰生産をもたらし、最終的には酸化的損傷を引き起こす。オートファジーは、リソソームが介在する分解経路であり、欠陥のある小器官の排除を促進し、脂質やタンパク質を含む様々な細胞成分を再利用する(Shintani and Klionsky、 2004)。オートファジーの障害は、疾患状態でのアミロイドβタンパク質の蓄積につながる可能性がある。オートファジーの欠損は、アルツハイマー病を含む加齢に伴う神経変性疾患に寄与する可能性がある(Martinez-Vicente、 2015; Zare-Shahabadiら、 2015)。新たな証拠のストランドは、哺乳類標的ラパマイシン(mTOR)シグナル伝達経路の混乱が、老化および神経変性疾患の中心であるオートファジー、グルコース代謝、細胞増殖、およびミトコンドリア機能を含む複数の細胞機能に影響を与えることを示している(Perluigi et al 2015)。この説得力のある証拠は、脳内のmTORを標的とすることが、アルツハイマー病の創薬を可能にするもう一つの有望な戦略である可能性を示している。アルツハイマー病患者の脳におけるPI3K/AKT/mTOR経路の制御異常とオートファジーの欠陥は、新薬開発の標的になるかもしれない。ReddyとOliver(2019)は最近、アミロイドβとリン酸化されたタウの蓄積がアルツハイマー病におけるオートファジーとマイトファジーの欠陥を誘導することを実証した。
加齢に伴い、フリーラジカルの過剰な生成による酸化的損傷が抗酸化能を低下させ、プロ炎症反応が加齢に関連した病理学的状態につながる。脳は、これらの酸化性バイオマーカーの影響を非常に受けている。さらに、通常、脳は他の臓器に比べて酸化能力が低い。認知症では、アミロイドβやタウなどの神経毒性ペプチドの蓄積が脳組織にダメージを与える可能性がある(Kapogiannis and Mattson、 2011; Mao and Reddy、 2011)。ミトコンドリアは、いくつかの代謝プロセスにおいて重要な役割を果たしている。ミトコンドリアの構造および機能の変化は、いくつかの加齢に伴う神経変性疾患につながる可能性がある(Reddy、 2006、 2011; Roy er al 2015)。様々な活性酸素の生成とその消去は、ミトコンドリアで行われる日常的な機能である。細胞内でのフリーラジカルの生成と無害化能力の間のアンバランスは、酸化ストレスと呼ばれている。クレブのサイクルでは、電子はNアルツハイマー病HとFアルツハイマー病H2によって貢献される。これらの電子は、その後、電子輸送鎖(ETC)を介して移動し、ミトコンドリア内膜を横切る電気化学的勾配を発生させ、ATPの形でエネルギーを生成する(Andreyev er al)。 図3は、細胞内でのフリーラジカルの生成とATP生合成の過程を示している。しかしながら、このプロセスはまた、スーパーオキシドアニオン(-O2ヒドロキシルラジカル(-OH一酸化窒素(NOおよび反応性窒素種(Droge,2002;Valkoら,2006)のようないくつかの反応性種の過剰生成をもたらす。これらの活性酸素の過剰生産は、タンパク質、脂質、およびDNAを損傷する可能性があり(ベックマンおよびエイムズ、1999これはミトコンドリアにおけるATP生合成および他の機能を混乱させる(Droge、2002;Murphy、2009)。細胞は、酵素的または非酵素的メカニズムのいずれかによって活性酸素の過剰生産によって誘導される酸化的損傷を中和する傾向がある。活性酸素を無害化することが知られている主な酵素は、スーパーオキシドジスムターゼ(SODカタラーゼ(CATグルタチオン還元酵素(GRおよびグルタチオンペルオキシダーゼ(GPx)である。一方、酸化的なダメージから細胞を守る働きをするのは、グルタチオン(GSHビタミンEやビタミンC、カロテノイド、ポリフェノール、フラボノイドなどの非酵素的なメカニズムが多い。
図3 細胞内でのフリーラジカル発生とアデノシン三リン酸(ATP)生合成の過程

神経炎症
アルツハイマー病の病態は、ミスフォールドされたアミロイドやタウタンパク質の凝集に限定されるものではなく、いくつかの免疫学的メカニズムも脳内に関与している。これらのミスフォールドされたタンパク質によって誘導される神経炎症は、アルツハイマー病のもう一つの重要な特徴であり、ペプチドとともに治療戦略として標的にされる可能性がある(Heneka er al)。 脳内のアミロイドβプラークおよびNFTを含むこれらのミスフォールドタンパク質は、トール様受容体(TLR)およびCD4細胞と相互作用することにより、自然免疫応答を開始する。アルツハイマー病発症の初期段階での神経炎症については、かなりの証拠がある(安野 et al 2008)。最近の研究はまた、TREM2およびCD33を含む多くの免疫受容体遺伝子の変異体が、アルツハイマー病の発症における役割を確立した(Griciuc et al 2013; Guerreiro et al 2013; Jonsson et al 2013)。フリーラジカル、NO、サイトカイン、およびいくつかのタンパク質分解酵素の過剰は、神経炎症に関連する責任因子であり、神経細胞死を促進する可能性がある(Cherry et al 2014; Yuste et al 2015)。これらの手段のすべては、加齢に伴う認知機能の低下およびアルツハイマー病の病理学において極めて重要である。
神経変性疾患のエピジェネティック制御
エピジェネティクスという用語は、ストレス、食事、または不利な環境因子への暴露を含む環境刺激に応答して、DNA配列を変化させることなく、遺伝子発現における有糸分裂的および減数分裂的な遺伝的変化を指す(Babenko et al 2012; Griñan-Ferré et al 2016)。主なエピジェネティックメカニズムは、DNAメチル化、ヒストンの翻訳後修飾、およびノンコーディングRNA分子によって媒介される遺伝子発現の調節である(Moore et al 2013; HolochおよびMoazed、2015; Hwang et al 2017)。DNAメチル化は、DNAメチル化酵素という酵素の助けを借りて、シトシンのC5位にメチル基を付加して5-メチルシトシンを形成することを伴う、よく知られたエピジェネティックなメカニズムである。DNAメチル化は、遺伝子抑制に関与するタンパク質をリクルートしたり、転写因子のDNAへの結合を阻害したりすることで、遺伝子の発現を制御している(Moore er al 2013)。ヒストンは、DNAに関連する最も豊富なタンパク質であり、互いに凝集してヒストン八量体を形成し、DNAを包み込んでヌクレオソームを形成する(Bannister and Kouzarides、 2011)。ヒストンのN末端尾は、アセチル化、メチル化、リン酸化、ユビキチン化、アルツハイマー病Pリボシル化など、いくつかの翻訳後修飾を受けることがある。これらの変化は、クロマチン構造に影響を与え、遺伝子の転写を促進または抑制する(Bannister and Kouzarides、 2011)。DNAメチル化およびヒストン修飾に加えて、非コードRNA分子によって媒介される遺伝子発現の調節は、多くの組織で起こる(PeschanskyおよびWahlestedt、2014;HolochおよびMoazed、2015)。
グローバルなDNA改変研究は、様々な神経変性疾患、特にアルツハイマー病の複雑な病因におけるエピジェネティックメカニズムの潜在的な役割を強調している(Bradley-Whitman and Lovell、 2013; Coppietersら、 2014; Roubroeksら、 2017)。核内DNAに加えて、ミトコンドリアDNA(mtDNA)がエピジェネティックなメカニズムによって制御され得るという証拠が増えている(Hroudová et al 2014; Blanch et al 2016; Stoccoro et al 2017)。いくつかの研究は、神経変性疾患の病因に対するエピジェネティック修飾の影響を実証している(Urdinguio et al 2009; Gruber、2011; GangisettyおよびMurugan、2016; Bassi et al 2017; SmithおよびLunnon、2017; Stoccoro et al 2017)。2017;SmithおよびLunnon、2017;Berson et al 2018;Gangisetty et al 2018;Lardenoije et al 2018;Lascano et al 2018;Qazi et al 2018;StoccoroおよびCoppedè、2018)。) エピジェネティックなメカニズムがアルツハイマー病のリスクを媒介することを示唆する証拠が増えている。実験モデルにおける熱心な研究は、エピジェネティックメカニズムを調節するための分子的介入が、高齢までの認知維持を促進するための治療的応用を有する可能性を示唆している(Griñan-Ferré et al 2016)。
修飾可能なリスク因子
新たなエビデンスは、鎮静的なライフスタイル、中心性肥満、脂質異常症、インスリン抵抗性、高血圧、糖尿病、および心血管疾患などの伝統的な心代謝性危険因子が、認知機能の低下およびアルツハイマー病の進行と関連していることを示唆している(Cholerton et al 2013; de la Torre、2013; Chen et al 2014; Geijselaers et al 2015; Xu et al 2015; Tamarai et al 2019)。逆に、カロリー制限(CR抗酸化物質に富んだ食事成分、および特定の食事パターンは、代謝性疾患および神経変性疾患の進行を制限する可能性がある(Everitt et al 2006;Calder et al 2011)。これらの修飾可能な因子を結びつける分子機構については、既に我々の先行研究で議論されている(Bhatti et al 2017b)。図4は、以前の研究(Chakrabarti et al 2015)で示されたように、アルツハイマー病病理学における様々な分子メカニズムに影響を与える様々な修飾可能なリスク決定因子を示している。
図4 アルツハイマー病病理学における様々な修飾可能なリスク決定因子

アルツハイマー病の薬理学的治療
現在臨床試験中の多くの実験的治療法は、アミロイドβプラーク、タウ高リン酸化、酸化的損傷、ミトコンドリア機能不全、神経伝達、カルシウムホメオスタシス、細胞シグナル伝達、抗炎症経路などのアルツハイマー病の分子機構を標的としている(Arvanitakis et al 2008; Leoutsakos et al 2012; Latta et al 2015; Bhatti et al 2017a; Hsu and Marshall、2017)。しかしながら、認知機能低下、軽度認知障害(MCIまたは認知症に対する効果的な薬理学的治療戦略は、現在のところ利用可能ではない。アミロイドβペプチドの蓄積とタウの高リン酸化は、アルツハイマー病の主要な特徴である(Reddy and Oliver、 2019)。アミロイドβペプチドおよびタウ高リン酸化を標的とした薬剤のいくつかの臨床試験は、いずれも肯定的な結果を示すことができなかった。バイアスのリスクが低いか中程度と評価された2009年1月から 2017年7月までの51のユニークな臨床試験の最近のシステマティックレビューでは、現在利用可能な認知症、高血圧、糖尿病の治療薬、すなわち非ステロイド性抗炎症薬、スタチン、エストロゲン/黄体ホルモン剤などの抗炎症薬は、正常な認知機能を有する人やMCIを有する人の認知機能低下を改善も遅らせることもなかったことが立証された(Fink et al 2018)。このエビデンスは、正常認知またはMCIを有する患者における認知保護のためのこれらの薬理学的管理アプローチの範囲が限られていることを示している。認知トレーニング(11試験)および身体運動(16試験)に焦点を当てた臨床試験の最近の研究では、認知機能低下または認知症の予防に対して満足のいく結果は得られなかった(Brasure et al 2018年;Butler et al 2018)。興味深いことに、運動、食事、認知トレーニングの多面的介入を含むランダム化比較試験では、リスクのある高齢者の認知機能低下を予防した(Ngandu et al 2015)。
アルツハイマー病病理学における非薬物的介入
認知症を治すための有効な薬理学的治療法はないため、アルツハイマー病を予防したり、アルツハイマー病の負担を軽減したりする非薬理学的介入の実施がより重要視されてきた。運動、CR、抗酸化サプリメント、食事、栄養補助食品、植物由来の生理活性化合物などの非薬理学的介入は、肥満、糖尿病、心血管疾患s、癌などの修正可能な危険因子の低減に有効であることが、様々な動物およびヒトの観察研究から明らかになっている。多くの食事介入は、インスリン感受性を改善することが知られており、それによって炎症がさらに減少し、認知機能が改善される(Bayer-Carter et al 2011年;Kelly et al 2011)。アルツハイマー病の修正可能な危険因子を標的とする介入は、アルツハイマー病の発生率を減少させることが期待されている(Xu et al 2015)。生活習慣の介入は、様々な分子メカニズムを調節することにより、高齢化した集団の罹患率と死亡率を減少させるようであり、様々な代謝性疾患や加齢に関連する疾患のための有望な非治療的手段である可能性がある(Norton er al 2014)。最近の研究では、認知機能低下およびアルツハイマー病の上昇した発生率および有病率は、鎮静型ライフスタイル、喫煙、中年期高血圧、中年期肥満、および糖尿病を含む様々な心代謝性危険因子を標的とした効果的な戦略によって減少する可能性があることが示唆されている(Norton et al 2014)。したがって、ライフスタイルと栄養学的介入は、アルツハイマー病の有効な一次予防戦略である可能性がある。ここでは、生活習慣や栄養介入の認知機能低下やアルツハイマー病への影響を媒介する可能性のあるメカニズムについて考察する。
食事療法の介入
その抗酸化特性および抗炎症特性に富む健康的な栄養食品成分は、免疫系を調節することが知られており、認知機能障害およびアルツハイマー病の進行に関与する神経炎症性イベントを修正する可能性がある(McGrattan et al 2019)。これらの栄養補助食品および食事パターンは、認知機能低下の予防またはアルツハイマー病への進行の遅延における有望なアプローチを構成する可能性がある(Canevelli et al 2016)。オメガ3脂肪酸、栄養補助食品、ミネラル、微量栄養素、およびビタミンなどのいくつかの食事成分は、健康および疾患におけるそれらの役割について検討されている(Wilson et al 2017)。これらの食事介入は、糖尿病、肥満、心血管疾患s、癌などの病態生理に改善的な役割を果たすことが知られている。食事介入は、加齢に伴う神経変性疾患において、アミロイドβ形成、タウ過リン酸化、酸化ストレス、エピジェネティック制御などの分子機構を修飾する。食事は、DNAメチル化、アセチル化、ヒストン修飾、およびmiRNA発現の変化を調節することにより、エピジェネティックなメカニズムを修飾し、それによりエピジェネティックな変化に関与する特定の遺伝子の発現に影響を与えることができる(Park et al 2012年;Abdul et al 2017)。
多価不飽和脂肪酸(PUFAs)
脂質は脳の必須成分であり、その約3分の1は必須多価不飽和脂肪酸(PUFAs; Benatti er al)。 彼らは、神経細胞膜の重要なコンポーネントを構成し、細胞間の最適なコミュニケーション、細胞シグナル伝達、および神経保護を可能にする、膜の流動性に関与している(Bazan、2005)。必須PUFAsは、抗酸化作用、抗興奮作用、抗炎症作用を持ち、脳の発達と機能において重要な役割を果たしている。PUFAの状態の異常は、アルツハイマー病を含む神経精神医学的な健康と疾患に暗示されている(Liu et al 2015)。認知機能の低下に関するオメガ3脂肪酸に関する多くの研究が行われており、相反する結果が示されている。長鎖オメガ3系PUFAsは、認知症のない人の認知機能障害リスクの低下に関与していることが示されている(Fotuhi er al 2009)。しかし、他の臨床試験の結果はあまり決定的ではなかった。Thomasら(2015)は最近、過去10年間に実施された対照研究の知見をまとめ、オメガ3脂肪酸の補給は認知機能低下の初期段階でのみ有利であることを示唆した。別の研究では、魚の摂取量(週100g以上)が中国人集団(65歳以上)の認知機能低下の進行を遅らせる可能性があることが示された(Qin er al)。 認知症や認知障害のない60歳の参加者にオメガ3系PUFAを補給した別の無作為化臨床試験では、認知機能に有意な改善は見られなかった(Sydenham et al 2012)。最近、無作為化プラセボ対照試験では、マルチドメイン介入の有無にかかわらず、オメガ3 PUFAサプリメントの長期使用は、3年間の認知機能低下に有意な影響を与えなかったと報告されている(Andrieu et al 2017)。
クルクミン
クルクミンは、主にインドや中国で生産されるCurcuma longaの根茎から単離される(Ammon er al 1992)。アジアの香辛料であるウコンの主な活性化合物であり、様々な生化学的経路の調節を通じて疾患予防に重要な役割を果たすことが知られている(Prasad et al 2014; Kunnumakkara et al 2017)。ウコン粉末は、その抗酸化作用、抗炎症作用、抗菌作用、抗ウイルス作用、抗真菌作用、および抗癌作用のために、多くの疾患に対する伝統的な薬として使用されている(Sikora et al 2010; Rahmani et al 2018)。カレーに含まれるクルクミンの頻繁な使用は、米国の集団と比較して、より良い認知パフォーマンスとインドの高齢者集団におけるアルツハイマー病の低い有病率と関連している可能性がある(Ganguli et al 2000年; Ng et al 2006)。最近の研究では、クルクミンは、その強力な抗酸化作用、抗炎症作用、および神経保護作用のために、アルツハイマー病におけるアミロイドβに対する保護的役割を果たすことが確立されている(Sundaram et al 2017; Reddy et al 2018)。34人のアルツハイマー病患者を対象としたクルクミン(1~4g/日)の無作為化プラセボ対照二重盲検臨床試験では、有意な効果は示されていない(Baum et al 2008)。同様に、36人の認知症患者を対象としたクルクミン(2または4 g/日)の別の無作為化臨床試験では、有意な効果は示されなかった(Ringman et al 2012)。クルクミンは、クラスIのHDAC(HDAC1、HDAC3、HDAC8)の発現を有意にダウンレギュレートし、Raji細胞のアセチル化ヒストンH4レベルをアップレギュレートし、それによってエピジェネティックな制御を調節した(Liu et al 2005)。クルクミンは、特定のエピジェネティック酵素を阻害することが示されている(Reuter er al 2011; Vahid er al 2015)。いくつかの研究の結果は、クルクミンは非常に強い神経保護特性を有するが、神経変性疾患に対する将来の治療戦略のためには、そのバイオアベイラビリティを改善する必要があることを示した。
フラボノイド
フラボノイドは、ポリフェノール構造を有する天然化合物であり、果物、野菜、穀類、樹皮、根、茎、花、茶、ワインなどに多く含まれている(Panche er al)。 その化学組成によると、フラボノイドは、フラボノール、フラボン、フラバノン、フラバノール、アントシアニン、イソフラボン、カルコン、ジヒドロカルコンなどの様々なサブクラスに分類される。いくつかの研究は、フラボノイドが強力な抗酸化性、抗炎症性、抗変異原性、および抗発がん性の特性を示すことを示唆している(Pietta、 2000; Pancheら、 2016)。これらの特性により、フラボノイドは、癌、アルツハイマー病、心血管疾患sの病理学において予防的な役割を果たしている(Benavente-García and Castillo、 2008)。フラボノイドは、主にその強力な抗酸化特性のために、プロ炎症性サイトカインの発現を減少させ、エピジェネティック制御を調節し、炎症性バイオマーカーをダウンレギュレートし、神経損傷および他の多くの疾患を予防する能力を有している(Lee et al 2009; Almeida Rezende et al 2016; Hua et al 2016; Fernandes et al 2017; Qadir et al 2017; Spagnuolo et al 2018)。フラボノイドのこれらの特徴のすべては、神経変性疾患に対する有望な治療的介入を可能にする。いくつかの天然物は、癌および心血管疾患に対して潜在的なエピジェネティック修飾特性を有することが示されているが、神経疾患におけるエピジェネティック経路を修飾することが示されている天然物阻害剤は非常に少ない。
ケルセチンは、赤ワイン、玉ねぎ、緑茶、りんご、ベリー類、イチョウ葉、アメリカンエルダーなど、ほとんどの植物や食品に存在する植物性フラボノイドである。ケルセチンの神経保護作用の根底にある分子機構は、生体内試験(in vivo)および試験管内試験(in vitro)研究によって示されるように、核因子(Nrf2パラオキソナーゼ-2、c-Jun N末端キナーゼ(JNKプロテインキナーゼC、マイトジェン活性化プロテインキナーゼ(MAPK)シグナル伝達カスケード、およびPI3K/Akt経路を介したサイトカインの可能なアップおよび/またはダウンレギュレーションを含む(Zaplatic et al 2019)。ココアは、植物フラボノイドの豊富な供給源であり、健康な個体における認知機能の低下に対する神経保護作用を示している(Sorond et al 2008年;Lamport et al 2015)。65歳以上の参加者531人を対象とした臨床試験では、48ヶ月間のチョコレート摂取は認知機能低下のリスクを41%低下させることと関連していた(Moreira et al 2016)。アントシアニンは黒大豆の種皮に含まれる生理活性化合物であり、いくつかの疾患を抑制することが報告されている。最近の研究では、アントシアニンの補充は、PI3K/Akt/Nrf2/HO-1経路を介して、アルツハイマー病のマウスモデルにおける酸化ストレス、神経変性、記憶障害を緩和することを確立した(Ali et al 2018)。
カフェインは認知障害を逆転させ、高齢APPマウスの脳アミロイドβレベルを低下させる(Azam et al 2003年;Arendash et al 2009)。アミロイドβプラークのこの減少は、アルツハイマー病のマウスモデルにおけるプロテインキナーゼA活性の刺激、phosphor-CREBレベルの増加、およびphosphor-JNKおよびphosphor-ERK発現の減少に起因する可能性があり、脳内の生存カスケードを促進する(Zeitlin et al 2011)。興味深いことに、MCI患者の血中カフェイン濃度の上昇は、認知症への進行の欠如と関連している(Cao et al 2012)。集団ベースの研究では、1日3~5杯のコーヒーを飲むことで、アルツハイマー病と認知症の発症を65%減少させる可能性があると報告されている(Eskelinen er al 2009)。動物データではカフェインの認知に対する保護効果が推奨されているが、ヒトでの研究は一貫性がないままである。男性3、494人を対象とした研究では、中年期のコーヒーとカフェインの摂取は認知機能障害とは関係がないことが示された(Gelber er al 2011)。ポルトガルの研究では、カフェイン摂取と認知機能低下の減少との関連性が示されたが(Santos er al)。
レスベラトロール
ブドウや赤ワインに含まれるポリフェノールであるレスベラトロールは、その強い抗酸化作用や抗炎症作用により注目を集めている(Gambini et al 2015年;Sawda et al 2017)。レスベラトロールは、いくつかの生体分子と結合する能力を有する分子構造により、これらの特性を示す。レスベラトロールは、クラスIIIのHDACであるサーチュイン1(SIRT1)を活性化することが知られており(Baur、 2010それによって活性酸素によって誘導される炎症および酸化的損傷から細胞を保護する(Cantóら、 2009)。レスベラトロールは、グルコースの取り込みとミトコンドリアの生合成によるエネルギー代謝を促進する転写活性化因子PGC-1αを活性化する(Lagouge et al 2006年;Kumar and Lombard、2015年;Parihar et al 2015)。最近の研究では、母親のレスベラトロール補充とビタミンDの組み合わせは、アミロイド原性経路、神経炎症、タウリン酸化、エピジェネティックな変化、および細胞シグナル伝達経路を介して、SAMP8マウスの子孫の認知障害を防ぐことができることが実証されている(Cheng et al 2017; Izquierdo et al 2019)。別の研究では、海馬神経変性および記憶能力におけるレスベラトロールの改善作用が示された(Gomes et al 2018)。レスベラトロールの長期補充に関するいくつかの臨床試験では、認知機能の低下の改善と海馬の機能的連結性の改善が報告された(Witte et al 2014)。レスベラトロールの補給と認知機能低下、MCI、アルツハイマー病に対するその可能性のある神経保護効果に関するいくつかの臨床試験が進行中である(Tome-Carneiro et al 2013)。その強力な抗酸化性、抗炎症性、および神経保護特性のために、レスベラトロールの補充は、認知欠損およびアルツハイマー病の増加する有病率と戦うために有望な治療手段である可能性がある(Cheng et al 2017)。
クルクミン、レスベラトロール、エピガロカテキン-3-ガレート、ゲニステイン、フェニルイソチオシアネート、インドール-3-カルビノールなどのこれらの食物生理活性化合物のすべては、HDACおよびHAT活性の調節およびヒストンおよび非ヒストンクロマチンタンパク質のアセチル化を含むエピジェネティックメカニズムを調節する能力を有する(Vahid et al 2015)。
ミネラル
カルシウム、マグネシウム、カリウムなどの食物ミネラルの欠乏は、認知機能障害や認知症に関連する重要な細胞プロセスの多種多様な重要な役割を果たしている(小澤 et al 2012; Cherbuin et al 2014)。実質的な証拠は、より高いレベルの食物ミネラルが、2型糖尿病、高血圧、脳卒中、および認知機能の低下を含む多くの代謝性疾患に対する保護的役割を果たすことを示している(Iso et al 1999年; LarssonとWolk、2007年; Villegas et al 2009年; Barbagallo et al 2011)。説得力のある証拠は、マグネシウムの欠乏が、炎症性細胞によるフリーラジカルの形成の大幅な増加を介して様々な組織の酸化ストレスを誘発し、それが記憶力をさらに損ない、そしてアルツハイマー病の病理学に寄与する可能性があることを示している(Durlach、 1990; Bardgettら、 2005; Vuralら、 2010; Barbagalloら、 2011)。これまでの研究では、マグネシウムの補給がアミロイドβPPの処理を修飾し、α-セクレターゼ切断経路を刺激し(Yu et al 2010認知機能障害における潜在的な保護的役割を果たすことが実証されている(Cilliler et al 2007)。認知機能低下やアルツハイマー病の病態におけるマグネシウムの保護的役割を確認するためには、さらによく設計された臨床試験が必要である。
ビタミン補給
ビタミンは神経系で重要な機能を果たしており、認知機能の維持やアルツハイマー病の発症を遅らせるのに役立つかもしれない(McCleery et al 2018)。ビタミンサプリメントは、心血管疾患やがんなどの慢性疾患の負担を軽減するのに非常に効果的であることがわかっている。これらの食事介入は、多くの疾患において、酸化ストレス、ミトコンドリア機能不全、炎症性経路、カルシウムの恒常性維持など、疾患の病態における様々な分子メカニズムを標的としている。最近の研究では、疾患の病態に関与する多くの分子メカニズムの変調により、老化、MCI、アルツハイマー病におけるビタミンの役割が実証された(Fenech、 2017)。認知機能低下やアルツハイマー病の一次予防に対するビタミンサプリメントの有効性を検討した無作為化臨床試験は非常に少なく、アルツハイマー病における食事介入に関する数少ない臨床試験から矛盾した結果が報告されている。4、052人の男性を対象としたβ-カロチンサプリメントと認知機能の無作為化試験では、認知機能に有意な効果は認められなかった(Grodstein et al 2007)。しかし、認知機能障害におけるビタミンBの補給については、混合した結果が報告されている。75歳以上の男性299人を対象とした葉酸、ビタミンB6、ビタミンB12の無作為化臨床試験では、認知機能に有意な効果は認められなかった(Ford er al 2010)。同様に、2、835人が参加した9つのRCTのメタ分析では、葉酸と他のビタミンB群を併用してもしなくても、認知機能に有意な効果は認められなかった(Wald er al 2010)。一方、別の研究では、葉酸とビタミンB12を一緒に摂取することで認知機能が有意に改善することが示されている(Walker er al)。
ミトコンドリアを標的とした抗酸化物質
認知機能の低下やアルツハイマー病で産生される過剰な活性酸素は、生合成や動態の変化に代表されるミトコンドリア機能不全と関連している(Calkins et al 2011)。ミトコンドリアを標的とした薬剤は、老化および神経変性疾患における有望な治療戦略である可能性がある(Reddy、 2008)。過去10年の間に、ミトコンドリアを標的とした抗酸化物質の多くが、ミトコンドリアの生合成とバイオエネルギーを高めることによって脳疾患の発症を遅らせるためのサプリメントとして市場に出回っている。これらのミトコンドリア標的抗酸化物質は、酸化ストレスマーカーおよびミスフォールドされたタンパク質を調節することにより、心臓病、肥満、糖尿病関連合併症、およびアルツハイマー病を含む様々な病理学的状態を改善することが知られている(Manczak et al 2010;Reddy et al 2011;Bhatti et al 2017a;Reddy et al 2017)。現在市場で入手可能なミトコンドリア標的抗酸化分子のいくつかは、MitoQ、MitoVitE、MitoTempo、MitoPBN、およびMCATであり、これらは、フリーラジカル形成を制限し、多くの疾患におけるミトコンドリア機能不全を改善する可能性を有する。
地中海ダイエットのパターン
生活習慣と食生活は、多くの疾患の主要な危険因子として認識されている。健康的な食事モデルとして広く受け入れられているMDは、植物性食品の大量消費、脂肪の主な供給源としてのオリーブオイル、魚、乳製品、鶏肉の低から中程度の消費、赤身および加工肉の低消費、および食事とのワインの低から中程度の消費を特徴としている。以前の研究では、MDは、心血管疾患、糖尿病、肥満、癌、および神経変性疾患を含むいくつかの疾患における低い罹患率および死亡率と関連していることが示された(Roman et al 2008年;Temple et al 2019年;Witlox et al 2019)。これらの食事介入は、体重、血圧、および脂質レベルを含むいくつかの心血管リスク決定因子に影響を与える(Rees et al 2019; Temple et al 2019)。これまでの研究では、MDへのより高いアドヒアランスが糖尿病および心血管疾患の発症リスクを低下させる可能性があることが示されている(Esposito et al 2017)。MDの調節作用は、アルツハイマー病病理における炎症および代謝異常に関与する分子機構を介して媒介される(Akiyama er al)。 2000; Esposito er al)。 2004; Scarmeas er al)。 2006; Gu er al)。 2010)。食事由来の生理活性成分は、ヒストンやクロマチン構造を変化させることでDNAメチル化を調節する(Bassett and Barnett、 2014)。また、最近の研究では、地中海式の食事パターンに従うことで、多くのタイプの癌のリスクが減少する可能性があることが示唆されている(Farinetti et al 2017年;Jones et al 2017年;Schwingshackl et al 2017)。
ライフスタイルの修正
身体活動
座りっぱなしのライフスタイルは、21世紀の様々な疾患の危険因子の一つと考えられている(Blair、 2009)。身体活動は、エネルギー消費をもたらす骨格筋によって生じるあらゆる身体運動と定義される(Caspersen er al 1985)。身体活動的な人は健康であり、多くの病気にかからない(Colberg er al 2016)。最近の研究では、修正可能な7つの危険因子の有病率を10年ごとに10%ずつ相対的に減少させると、2050年のアルツハイマー病の有病率が世界的に8.3%減少する可能性があることが示された(Norton et al 2014年;Luck and Riedel-Heller、2016)。このような予防策は、生活習慣病の負担に大きな影響を与える可能性がある(Ashby-Mitchell et al 2017)。身体活動は、生体エネルギープロセスにおける様々な転写因子を活性化することによりミトコンドリア機能不全を減少させることにより、多種多様な心代謝性疾患および神経変性疾患の有病率を制限することができる潜在的に効果的なトレーニング介入の一つである(Barbieri er al)。
定期的な運動は、様々な細胞シグナル伝達経路を活性化し、骨格筋のミトコンドリアの健康状態を改善するのに役立つ(Russell er al)。 血糖値や体重をコントロールし、血圧を維持し、脂質異常症を軽減し、筋肉や骨の健康を改善することが知られている。別の研究では、トランスジェニック動物の脳内での認知機能の低下とミスフォールドタンパク質の蓄積の減少が示された(Pietropaolo et al 2008)。別の研究では、動物やヒトの研究で証明されているように、身体運動が脳の神経可塑性を誘導し、認知機能を改善することが示されている(Hötting and Röder、 2013)。身体活動は、PGC-1αとニコチンアミド・アデノシン・ジヌクレオチド(Nアルツハイマー病)依存性脱アセチル化酵素SIRT1を介して細胞のエネルギー恒常性を制御する(Rodgers et al 2005)。CRまたは運動は、エネルギーを減少させ、AMP/ATP比を増加させ、これは、細胞内の5′-アデノシン一リン酸活性化プロテインキナーゼ(AMPK)を活性化する。これらの事象はさらに、リン酸化を介して転写因子PGC 1の刺激を引き起こし、最終的にミトコンドリアの生合成を誘導する(Jäger er al 2007)。老化に伴い、筋肉量の減少と筋活動の低下がある。定期的な運動を行うことで、加齢に伴う筋力低下の発症を抑え、健康的な老化を促進することができる(Cartee er al)。
カロリー制限
カロリー制限(CR)は、代謝の健康を改善することにより脳の老化に有効である別の潜在的に有望な非薬理学的介入である(Wahl et al 2019)。CRは、活性酸素および酸化的損傷の有害な影響を中和することにより効果的である(BarjaおよびHerrero、2000;Zainal et al 2000;Barja、2002;Civitarese et al 2007)。CRは、サーチュインを標的として、様々な疾患の発症を予防することが示されている。以前の研究では、長期CRが雌Tg2576マウスのβアミロイドおよびγセクレターゼを有意に減少させ(Schafer et al 2015年アルツハイマー病病理学的に予防的な役割を果たすことが示された。観察試験およびRCTは、ヒトにおけるCRが心代謝性障害の病態生理に関与する複数の代謝因子を改善することを示している(Fontana、 2008)。CRは、重要な栄養感知経路および炎症性経路を阻害することにより、それらの特性を増強することにより、これらの調節を発揮する(Most et al 2017)。したがって、身体活動および運動と同様に、CRはまた、多くの加齢に関連した慢性疾患の予防のための有望な栄養介入として考えられるかもしれない。
結論と今後の展望
世界的に高齢化が加速しており、加齢に伴う疾患が懸念されている。世界的に認知症の発症・有病率が急増していることは大きな問題であり、社会的・経済的負担につながっている。残念ながら、現在のところ、永続的な治療法はない。アミロイドβやタウを含む主要な分子機構を標的としたいくつかの薬理学的治療薬は、ヒト臨床試験で満足のいく結果が得られていない。したがって、認知機能の低下を遅らせ、アルツハイマー病への進行を食い止めることが急務となっている。糖尿病、肥満、心血管疾患、癌を含む多くの加齢に関連した代謝性疾患に有効であることが証明されている生活習慣や栄養療法などの非薬理学的介入は、認知症の予防に役立つ可能性がある。臨床試験のいくつかの結果が不満足なものであるのは、異なる研究間の方法論の不均一性によるものかもしれない。これらの非薬理学的介入は、慎重に実施されれば、指数関数的に増加するアルツハイマー病の発症率を減少させ、本人や社会の経済的負担を軽減する上で非常に効果的であると考えられる。アルツハイマー病の分子メカニズムと効果的な治療標的の解明に大きな注目が集まっている。また、認知機能障害やアルツハイマー病に対する新薬や非薬理的介入の有効性を確認するために、大規模な無作為化臨床試験を実施する必要がある。今後10年間は、アルツハイマー病の有効な治療法を発見するための重要な時期となる。
