概要
はじめに
認知症のタイプのひとつレビー小体型認知症。
このサイトでは認知症の中でもアルツハイマー病を中心に取り上げているが、アルツハイマー病という診断であってもレビー小体型認知症やパーキンソン病のような臨床症状を見せる患者さんも多いことに気がついてきた。
誤診の多いレビー小体型認知症
レビー小体型認知症は、初期の段階ではアルツハイマー病、血管性認知症と混同されやすい。レビー小体型認知症単独で生じることもあれば、アルツハイマー病やパーキンソン病と併発することもある。
www.nia.nih.gov/health/what-lewy-body-dementia
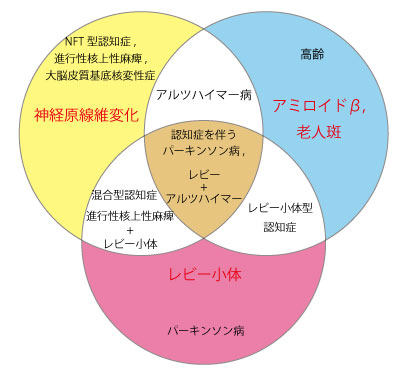
実は多い複合病理
また臨床基準によって混合型と診断されなくとも、病理学的に診断から推察されるものとは異なる毒性タンパク質が関与している可能性もある。そういったタイプで診断的な区別をつけるためにムリに線をひこうとすることは、根本治療を考えていく上ではあまり有益でないかもしれない。
タウとαシヌクレインの相互作用
アミロイドβ、αシヌクレイン、タウタンパク、TDP-43はそれぞれ直接または間接的に相互作用し、毒性および疾患の進行を促進しあう可能性がある。相互作用の証拠が多いのはタウとαシヌクレイン間。
レビー小体型認知症患者をリコード法の診断基準で検査したところ、タイプ3であることが判明した症例も複数報告されている。
そういうわけでアルツハイマー病とも深く関連するレビー小体型認知症とパーキンソン病について、主に治療法を探ってみるということを軸に調べてみた。
、、のだが、そんなアルツハイマー病と双璧をなすといってもいい二大疾患が簡単にまとまるわけもない(汗)
メモ書きとして書いていきたい。
レビー小体型認知症とは
レビー小体型認知症は1912年にドイツの神経科医フレデリック・レビー博士によって名前を付けられた。レビー博士がパーキンソン病患者の脳から脳機能を破壊する異常タンパク質(αシヌクレイン)の沈着を発見したことによる。
αシヌクレインの役割
αシヌクレインの生理学的な役割は明確にはわかっていないが、シナプス前末端に局在していることから神経伝達物質の放出、シナプス活性の調節に関わっている可能性が示唆されている。
αシヌクレイン過剰発現はレビー小体型認知症の発症起因につながるが、直接的に毒性をもつのは誤って折りたたまれたαシヌクレイン凝集物(特にαシヌクレインオリゴマー)であり、強い神経毒性によってレビー小体型認知症のみならずパーキンソン病の発症原因にも寄与する。
毒性によって凝集が加速
αシヌクレインはそれ自体でも凝集する傾向があるが、原線維を形成する速度に影響を与える多くの因子がある。知られているものに金属、農薬、脂質、低いpH(酸性)、細胞膜、分子クラウディング(高分子混み合い)などの条件下で凝集が促進される。
また、凝集を防ぐプロテアソームの機能不全も凝集に寄与する。
パーキンソン病でも見られるαシヌクレイン
αシヌクレインはレビー小体型認知症だけではなく、パーキンソン病においても沈着が認められている。沈着部位の違いから症状の現れ方も異なるが、タンパク質レベル(組織病理学的)ではきわめて近い疾患。
αシヌクレイン
αシヌクレインは主にシナプス前末端に存在し、中枢神経において豊富に発現するタンパク質。神経伝達、シナプスの恒常性の調節に関わっていると考えられている。
サイトゾルにモノマーとして存在する証拠が多数だが、四量体として存在し、四量体αシヌクレインが不安定化しやすく凝集形成をするという報告もある。
神経変性と神経保護両方の役割をもつαシヌクレイン
www.ncbi.nlm.nih.gov/pubmed/15681812
ミクログリアとαシヌクレインの複雑な関係
www.ncbi.nlm.nih.gov/pubmed/25284317
αシヌクレインの神経細胞への有毒メカニズム

www.sciencedirect.com/science/article/pii/S0925443914002014
複合病理
最近の研究では、アルツハイマー病と診断された患者でもかなり割合でαシヌクレイン病理を示すことが報告されている。
www.ncbi.nlm.nih.gov/pubmed/24252435/
www.ncbi.nlm.nih.gov/pubmed/9811326/
ADでは扁桃体にαシヌクレインが凝集
アルツハイマー病患者のαシヌクレイン凝集は大部分が扁桃体に限定されており、レビー小体型認知症やパーキンソン病とは異なる。アルツハイマー病のレビー病理は、パーキンソン病のような軸索末端や樹状突起ではなく、主にニューロンの細胞体に形成されている。
アルツハイマー病のレビー病理は、アルツハイマー病進行の末期を反映している可能性があるが、遺伝的要因やライフスタイルによる要因によって反映されている可能性もある。
www.ncbi.nlm.nih.gov/pubmed/15068176/
www.ncbi.nlm.nih.gov/pubmed/10727692/
パーキンソン病・レビーのアルツハイマー病
パーキンソン病、レビー小体型認知症患者においてしばしば(PDで最大50%)アルツハイマー病の病状が観察されることがいくつかの研究で示されている。
www.ncbi.nlm.nih.gov/pubmed/23900411/
αシヌクレイン凝集体の量よりも、アルツハイマー病病状がパーキンソン病患者の認知機能の低下と相関していた。
www.ncbi.nlm.nih.gov/pubmed/21596773/
www.ncbi.nlm.nih.gov/pubmed/11956955/
アルツハイマー病病状を有するパーキンソン病、レビー小体型認知症患者では、アルツハイマー病病状がない患者よりも、皮質領域、辺縁領域において高いαシヌクレインレベルを有する。
www.ncbi.nlm.nih.gov/pubmed/23037886/
www.nature.com/articles/npjamd20153
進行に伴って増えるレビーの混合
臨床的にアルツハイマー病の可能性が高い(probable AD)179人の高齢者(平均年齢87歳)のうち82人(46%)が複数の病理を有していた。 軽度認知症(MCI)であっても、健忘型MCIで23%(N=75)非健忘型MCIで15%(N=59)の患者に複数の病理が見出された。
MCIの診断を受けた患者でのアルツハイマー病とレビーの複合病理は2.2%
アルツハイマー病の可能性が高いと臨床的に判断された患者のうち10%でアルツハイマー病とレビーの複合病理を有しており、アルツハイマー病、梗塞、レビーの3つの病理を有する患者は4.5%存在した。
アルツハイマー病とレビーの複合病理
- アルツハイマー病+レビー 16.7%
- アルツハイマー病+レビー+血管性認知症 7.2%
- アルツハイマー病+レビー+タウオパチー 0.6%
- アルツハイマー病+レビー+海馬硬化症 0.2%
- アルツハイマー病+レビー+血管性認知症+海馬硬化症 0.5%
- アルツハイマー病+レビー+血管性認知症+タウオパチー 0.2%
- 全体の合計(レビー小体型認知症を含むアルツハイマー病)25.4%
22人のうち4人のみが純粋アルツハイマー病
www.ncbi.nlm.nih.gov/pmc/articles/PMC3893373/
高齢者に多い複合病理
αシヌクレインとアミロイド、タウの相互作用
タウ → プロテアソーム障害 → αシヌクレイン、TDP-43
A152T変異体タウ(可溶性タウ)がプロテアソーム活性を損ない、タウだけでなくプロテアソームの基質の蓄積も引き起こす。プロテアソーム基質の蓄積はαシヌクレイン、TDP-43にも影響を及ぼす。
αシヌクレイン → タウ リン酸化
αシヌクレインはタウの過剰リン酸化を誘導し、神経原線維変化を形成することができる。
www.ncbi.nlm.nih.gov/pubmed/19369384/
αシヌクレイン ↔ タウ
αシヌクレインとタウの間に相乗的な関係を示す多数のデータ
アミロイドβ、タウ、およびα-synが互いに凝集、リン酸化および蓄積を促進しあい、認知低下を促進する。
www.ncbi.nlm.nih.gov/pmc/articles/PMC3308018/
αシヌクレイン → アミロイドβ分泌
αシヌクレインは、APPのβ/γプロセシング促進によってβアミロイドの分泌を増加させる。
journals.plos.org/plosone/article?id=10.1371/journal.pone.0171925
アミロイドβ42 → αシヌクレイン リン酸化
アミロイドβ42はアミロイドβ40よりも顕著にαシヌクレインのリン酸化を促進する。
www.ncbi.nlm.nih.gov/pubmed/25452767/
アミロイドβとアルファシヌクレインは正常な細胞内の同じ区画には通常存在しないため、直接的に相互作用する機会は限られている。しかし、疾患が進行し細胞が損傷すると両者のタンパク質は、局在化が変化し直接的に相互作用する可能性がある。
alzres.biomedcentral.com/articles/10.1186/alzrt109

www.ncbi.nlm.nih.gov/pmc/articles/PMC321759
レビー/パーキンソン病 発症要因
腸内神経
腸内細菌叢・胃腸管・粘膜
細胞外である腸内神経系のαシヌクレインがパーキンソン病の初期部位の一つである可能性。
www.ncbi.nlm.nih.gov/pubmed/23278133/
炎症性腸疾患
炎症性腸疾患(IBD)はパーキンソン病の発症率と関連する。
www.ncbi.nlm.nih.gov/pubmed/26919462
迷走神経経由
胃の迷走神経を切除した患者は、パーキンソン病から保護されていた。
αシヌクレインが迷走神経を介して脳に広がるという強力な証拠。
www.sciencedaily.com/releases/2015/06/150623103609.htm
概日リズム障害
概日リズム障害が、リーキーガットを引き起こす。
onlinelibrary.wiley.com/doi/10.1111/acer.12943/full

www.sciencedirect.com/science/article/pii/S0014299917303734
遺伝的要因
アレイすべて含めた場合
アルツハイマー病 60% レビー小体型認知症 31%、パーキンソン病 28%
APOE領域を除外した場合
アルツハイマー 42%、レビー小体型認知症 22%、パーキンソン病 42%
アルツハイマー病、レビー小体型認知症はAPOEからの影響を強く受ける。
www.ncbi.nlm.nih.gov/pubmed/22892372/
www.ncbi.nlm.nih.gov/pubmed/26643944/
レビー小体型認知症:SNCA、SCARB2、GBA、APOE4
www.ncbi.nlm.nih.gov/pubmed/15451224
パーキンソン病 ゲノムワイド関連研究
SNCA; rs2736990
PARK16、rs823128
LRRK2周辺rs1491923
www.ncbi.nlm.nih.gov/pubmed/19915575/
Ala30Pro
www.ncbi.nlm.nih.gov/pubmed/9462735/
E46K
www.ncbi.nlm.nih.gov/pubmed/14755719/
パーキンソン病:PINK1,Parkin遺伝子変異によるマイトファジー障害
変異型αシヌクレイン
低い尿酸値
血漿尿酸値を上昇させる食事はパーキンソン病の発症リスク低下と有意に関連する。
www.ncbi.nlm.nih.gov/pubmed/18326873/
血漿尿酸値はパーキンソン病患者において有意に低い。
www.ncbi.nlm.nih.gov/pubmed/17443703/
SNP rs1165205(SLC17A3)は、変化した脊髄液宙の尿酸レベルと弱く関連
対照群では脳脊髄液中の尿酸レベルは、アミロイドβ42と正の相関、しかしレビーでは相関が観察できなかった。
www.ncbi.nlm.nih.gov/pubmed/21765209/
レビー小体型認知症患者の血清および脊髄液中の尿酸値と認知機能低下の関連
content.iospress.com/articles/journal-of-alzheimers-disease/jad110587
ミトコンドリア
レビー小体型認知症では、ミトコンドリアはレビー小体に引き込まれ分解されミトコンドリアの完全性が失われる。このことは微小管の退縮と、軸索輸送の減少をもたらすことを示唆する。
パーキンソン病におけるαシヌクレインの凝集は神経核に対してより有害な作用を及ぼすようであり、シャペロンオートファジーのmiRNA誘導がダウンレギュレーションされることで、αシヌクレイン病理に重要な役割を果たす可能性がある。
細胞内に蓄積するαシヌクレインは、レビー小体型認知症、パーキンソン病いずれも核DNAと相互作用するが、両者でその作用が異なるようである。
onlinelibrary.wiley.com/doi/abs/10.1111/bpa.12344
www.lbda.org/go/toxicity-mechanism-identified-parkinsons-disease
αシヌクレインのプリオン様増殖
αシヌクレインはプリオンのように増幅し広がっていくことが示唆されている。

www.ncbi.nlm.nih.gov/pubmed/20308987/
誤って折りたたまれたαシヌクレインが近接する他のαシヌクレインの折りたたみにも異変を起こす感染性をもつ。
www.nature.com/articles/nature12481
α-シヌクレインの凝集促進因子 in vitro
農薬、ポリカチオン、ヒストン、金属イオン、グリコサミノグリカン、ドデシル硫酸ナトリウム、有機溶媒
α-シヌクレインの凝集阻害因子
小分子、熱ショックタンパク質、PAMAMデンドリマー、β-シヌクレイン、γ-シクレイン、シヌクレイン、カテコールアミン、リン脂質、リファンピシン、トレハロース、酸化的修飾
www.ncbi.nlm.nih.gov/pubmed/24552879/
様々な要因の組み合わせによるαシヌクレインへの影響が、αシヌクレインの臨床的、病理学的な不均一性を説明するかもしれない。
www.ncbi.nlm.nih.gov/pubmed/21720849/
脂質膜との相互作用
折り畳まれていないαシヌクレイン
α-シヌクレインは、通常折り畳まれていないランダムに構造化されたモノマー(単量体)として細胞質内に存在する。
病理学的条件下では、αシヌクレインモノマーは凝集により不溶性に変わる。
脂質膜との結合による毒性変化
これらがリン脂質二重層または脂質膜のような脂質表面に結合すると、αシヌクレインが、細胞に毒性があると考えられている折り畳まれた種に変化すると考えられている。
www.ncbi.nlm.nih.gov/pubmed/9545270/
αシヌクレインは、脂質が豊富な膜の領域に優先的に結合すると考えられおり、これらの領域は脂質ラフトと呼ばれる。
脂質ラフトはαシヌクレインの結合そしてオリゴマー化を促進するプラットフォームとして機能するように思われる。
www.ncbi.nlm.nih.gov/pubmed/15282274/
4量体αシヌクレインの神経毒説
www.ncbi.nlm.nih.gov/pubmed/21841800/
オートファジー障害
レビー小体型認知症におけるオートファゴソームタンパク質の変化(Atg)
www.ncbi.nlm.nih.gov/pubmed/21684337
認知症におけるオートファジー レビー小体型認知症、前頭側頭型認知症、血管性認知症
www.ncbi.nlm.nih.gov/pubmed/22150925
オートファジー-リソソーム経路は、αシヌクレインの分解だけではなく凝集にも関与しており、オートファジーーリソソーム経路の障害は、αシヌクレイン分泌を増強し有害な微小環境をもたらす。
www.ncbi.nlm.nih.gov/pubmed/25484190
オートファゴソーム障害
www.ncbi.nlm.nih.gov/pubmed/26260450
mTOR、Atg7
mTOR、Atg7の欠陥によるオートファジー障害がαシヌクレインモデルマウスの神経変性と関連する。
www.ncbi.nlm.nih.gov/pubmed/20174468/
プロテイナーゼK
プロテイナーゼK耐性のαシヌクレイン凝集体蓄積によるパーキンソン病、レビーの早期の神経変性。
www.ncbi.nlm.nih.gov/pubmed/20563819/
リソソーム障害
シヌクレイノパチーによるリソソーム分解経路の機能不全
www.ncbi.nlm.nih.gov/pubmed/23682122/
軸索輸送障害
αシヌクレイン凝集体によるシナプシン-1の軸索輸送妨害
www.ncbi.nlm.nih.gov/pubmed/20554859/
微小管
αシヌクレインはチューブリンの微小管への重合を誘導する。変異型αシヌクレインではその機能を失う。
www.ncbi.nlm.nih.gov/pubmed/15345814
グルタミン酸受容体の過剰活性
αシヌクレインが海馬CA3に豊富に存在するmGluR5の輸送を妨害することにより、受容体の過剰活性化をもたらし、ニューロンの毒性細胞死に寄与しうることをシアする。 治療薬候補mGluR5アンタゴニスト
www.ncbi.nlm.nih.gov/pubmed/21103359/
αシヌクレインのリポ酸化
αシヌクレインの脂質酸化は、レビー小体型認知症におけるαシヌクレイン凝集およびレビー小体の神経突起形成に先行する初期の事象である。
www.ncbi.nlm.nih.gov/pubmed/17166629/
シナプス変性の進行メカニズム
アミロイドβ、αシヌクレインオリゴマー
シナプスタンパク質の減少(初期)
シナプス小胞の減少(初期)
↓
タウオリゴマー
栄養因子の減少(中期)
ミトコンドリア輸送の低下(中期)
↓
酸化ストレス
シナプス前終末の喪失(中期)
樹状突起スパインの喪失(中期)
↓
神経炎症
神経細胞脱落(後期)

www.ncbi.nlm.nih.gov/pmc/articles/PMC3973539/
レビー小体型認知症の症状
低血圧
レビー小体において、典型的なパーキンソン病の症状が発症する数十年間から、低血圧、REM睡眠行動障害などの症状を発症していると推定されている。
パーキソニズム症状があわられる数年前から腸内神経にシヌクレイン沈着が認められているため、疾患が嗅粘膜または胃腸管から始まっている可能性を示唆する。
www.ncbi.nlm.nih.gov/pubmed/22550057/
レム睡眠行動障害
レム睡眠障害はαシヌクレイン障害で98%特異的に見られる。
αシヌクレイン障害では、レム睡眠行動障害がかなり特異的に見られるので、睡眠ポリグラフ検査でレム、ノンレムの状態を調べてみると、より確度が高くなる。
昼間の眠気
昼間に眠気が強い人ほど、物理的な動作などの機能的な障害が大きい。
MMSEのスコアとは無関係、投薬とも関係がない。
www.ncbi.nlm.nih.gov/pubmed/17586786
昼間の眠気は、パーキンソン病運動機能障害のあるアルツハイマー病患者に見られる。
軽度のアルツハイマー病においてパーキンソン病的な特徴が見られる場合、昼間の眠気につながりえる。
www.ncbi.nlm.nih.gov/pubmed/21388877
昼間の眠気は、アルツハイマー病よりも、レビー小体の認知症でより一般的。
メイヨークリニック
www.lbda.org/content/daytime-sleepiness-more-common-dementia-lewy-bodies-alzheimers
レビーの77~87%で、認知機能に上下の変動、動揺が見られる。(介護者の報告)
アルツハイマー病では67~73%
早期の臨床的な特徴
過眠症・低体温症
過眠症、日中に過度の眠気を示す。早い時期に起こる低体温症、
レビーはバイオマーカーのみに基づいて診断されてはならない。
低用量クエチアピンは、他の抗精神病薬よりも比較的安全
www.ncbi.nlm.nih.gov/pmc/articles/PMC5496518/
幻覚
レビー小体型認知症患者の60~70%で幻覚が起こる。
幻覚はアルツハイマー病よりも早く生じる。発症後2~3年
アルツハイマー病の幻覚は通常、より脅迫的で恐怖性のある内容を伴う。
しかしレビー小体型認知症では、常にではないが、曖昧さのない脅威を伴わない誤解するような事象だったりする。
例えば、影を見てそれが人だとか動物だと勘違いするなど。
これらに対して、コリンエステラーゼ阻害剤は安全で効果的な治療方法
レビー小体型認知症の診断
診断のむずかしさ・誤診率
レビー小体の診断基準による診断は不正確、12~32%の精度
レビー小体は認知症全体の4%とされているが、この数字は過小評価の可能性があり、メタアナリシスでは20%程度となっている。
パーキンソン病を併発する認知症は全体の4%を占める。
レビー小体もパーキンソン病もαシヌクレインの蓄積によるものであるが、認知機能が低下する前段階ではパーキンソン病として診断されてしまう。
レビー小体の症状の多くは一般的な認知症診断基準では認られない。
そのため以下の5つのカテゴリーで分類することがより有効である。
・認知症症状
・神経性の精神疾患
・運動能力
・自律神経
・睡眠
レビーとアルツハイマー病を分ける基準項目
・昼間に眠気と無気力感が見られる。
・昼寝が2時間以上
・宙を見つめる時間が長い。
・経験した話しにまとまりがない。
この中で3つか4つ該当する場合83%の確率でレビー、12%の確率でアルツハイマー病、0.5%で健常者。
パーキンソン病患者では89%が便秘か下痢を有する。
アルツハイマー病がレビーに変化する?
タウまたはαシヌクレイン凝集化合物を使用 > 毒性の高い可溶性タウが増える > プロテアソーム活性が阻害 > αシヌクレインが増加 > αシヌクレインオリゴマー、フィブリルが増加 > αシヌクレインの再帰的増殖 > アルツハイマー病にレビーやパーキンソン病的症状を呈する?
αシヌクレインの沈着進行過程
Braak stages
- 段階1 舌咽神経核および迷走神経、または嗅球のいずれか
- 段階2 髄質と橋状突起
- 段階3 中脳および扁桃体 この時点で、パーキンソン病の典型的な運動症状が一般的に現れる。
- 段階4 側頭皮質
- 段階5~6 新皮質
レビー小体型認知症および進行性パーキンソン病において観察される認知障害に寄与する。少数の症例がこのパターンに適合せず、アルツハイマー病患者の扁桃体に単独でレヴィ病変が生じる。そうでない場合はきわめて一般的なタイプの進行をたどる。
www.ncbi.nlm.nih.gov/pubmed/20187227/
予後
レビーの疾患進行速度は一般にアルツハイマー病よりも早いが、予後の個人差はアルツハイマー病よりも変動が大きい。
www.ncbi.nlm.nih.gov/pubmed/21500280/

