Contents
Learning from the past: development of safe and effective COVID-19 vaccines
pubmed.ncbi.nlm.nih.gov/33067570/
発行:2020年10月16日
Shan Su, Lanying Du & Shibo Jiang
Nature Reviews Microbiology volume 19, pages211-219 (2021)Cite this article
概要
重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)の急速な感染拡大に伴い,COVID-19ワクチンの開発を目指して,同様に迅速な対応が行われている.しかし,ワクチンの開発には,有効性と安全性の包括的な評価が不可欠であり,過去のワクチン開発キャンペーンから学ぶことができる。本展望では、呼吸器シンシチアルウイルス、デングウイルス、SARS-CoV、中東呼吸器症候群コロナウイルスに対するワクチン開発の歴史の中で、ワクチン関連疾患の増強の例をまとめ、しっかりとした安全性と有効性のプロファイルの重要性を強調し、COVID-19ワクチン候補の前臨床および臨床評価、ならびにワクチンの設計と最適化のための推奨事項を提示する。
はじめに
2019年12月以降、重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)が世界中で急速に広まっている。SARS-CoV-2の感染の強さと速さは、かなりの罹患率と死亡率をもたらし、世界中の公衆衛生システムと世界経済にかなりの圧力をかけている。そのため、COVID-19に対するワクチンや治療薬の開発は最優先事項であり、非常に活発な分野となっている1。ワクチンは、比較的低コストで大規模な集団の疾病を予防することができるため、COVID-19の影響を軽減するための強力なツールとなる。
2020年3月16日、Moderna社のmRNA COVID-19ワクチン(mRNA-1273)とCanSino社の非複製アデノウイルス5型(Ad5)ベクター付きCOVID-19ワクチン(Ad5-nCoV)が第I相臨床試験に入った2,3。2020年4月には、シノバック(PiCoVacc)北京生物製品研究所(BBIBP-CorV)武漢生物製品研究所(Sinopharm-Wuhan inactivated vaccine)が製造した不活化COVID-19ワクチン、およびイノビオ社のDNAワクチン(INO-4800)が第I相臨床試験に入った4。その1カ月後には、さらに5つの候補が第I相臨床試験に入り、100以上のCOVID-19ワクチン候補が実験室または前臨床試験に入ってた5。COVID-19ワクチンの開発がこれまでにないスピードで進んでいることは心強い限りである。しかし、我々や他の人々は、COVID-19ワクチン候補の一部の安全性について懸念を抱いている6,7。
高用量のmRNA-1273ワクチンは、免疫病理を増強することなく、マウスに適応したSARS-CoV-2チャレンジによる感染からマウスを保護する8。PiCoVacc9およびBBIBP-CorV10は、マウス、ラットおよび非ヒト霊長類において中和抗体(中和抗体s)を誘発し、高用量群の非ヒト霊長類は、抗体依存性増強(ADE)を伴わずにSARS-CoV-2による感染から完全に保護された。また、オックスフォード大学とアストラゼネカ社が開発したチンパンジーのアドベノウイルスを用いたワクチン(ChAdOx1 nCoV-19)11と、ハーバード・メディカル・スクールが製造したDNAワクチン12は、免疫病理の増強を伴わずに、SARS-CoV-2にチャレンジした非ヒト霊長類のウイルス量を減少させる効果があった。これまでに、Ad5-nCoV3,mRNA-1273(参考文献2)ChAdOx1 nCoV-19(参考文献13)Pfizer社とBioNTech社が開発したmRNAワクチン(BNT162b1)14など、いくつかのCOVID-19ワクチンの第I/II相臨床試験が終了している。報告された結果によると、これらのワクチンはいずれもスパイクタンパク(Sタンパク)と受容体結合ドメイン(RBD)に対する抗体を誘導し、その中にはシュードタイプや生のSARS-CoV-2を中和する抗体も含まれていた。中和抗体の力価はRBD結合IgGの濃度と強い相関関係があるという報告もある15,16。ごく最近では、アストラゼネカ社がChAdOx1 nCoV-19ワクチンの第3相臨床試験を予期せぬ副反応のために休止することを発表したが、英国では試験が再開されている。さらに、ロシアでは最近、組換えAd26と組換えAd5ベクターを用いた異種混合プライムブーストCOVID-19ワクチンを、非無作為化の第I/II相試験を行った上で、数万人規模での使用を承認した17。ワクチンの安全性は、第3相臨床試験においても、今後のワクチンの応用においても、特に以下に述べるように、ワクチンを接種した人が自然に感染したときに発生するワクチン関連の免疫病理については、重要な問題である。
1960年代、科学者たちは、抗ウイルス剤が動物ウイルスのウイルス感染力を例外的に増加させる可能性があることを発見した18。抗体のFc受容体(FcR)に結合して体内に取り込まれることで、ウイルスの感染力が増強されるというこの現象は、「抗体依存性増強」(ADE; Box 1)と呼ばれ、フラビウイルス19,20やその他のウイルスの感染で広く報告された21,22。その後、補体の活性化や炎症性サイトカインの放出など、より抗体FcRを介した作用が重篤な疾患に関与することが報告された23。また、ワクチンを接種した動物が、対応するウイルスにチャレンジした後にADEが観察されている24。例えば、ネコ伝染性腹膜炎ウイルス(FIPV)のSタンパク質をリコンビナントポックスウイルスベクターで発現させたワクチンを接種したネコは、FIPVにチャレンジした際、コントロール動物よりも早く死亡した25。また、ネコFIPVと反応する高力価抗体を含むネコ血清を用いた受動免疫でも、FIPVチャレンジ後の発病が早まったことから26,ワクチンによる発病増悪はADEに起因すると考えられる。ADEとは別に、ワクチン接種後の同種ウイルスチャレンジによって誘発される2型Tヘルパー細胞(TH2細胞)ベースの免疫病理学的反応も病気の悪化につながる可能性がある27。
このパースペクティブでは、抗体依存性およびTH2細胞依存性の疾患増悪を表現するために、「ワクチン関連疾患の増強」(VADE;囲み記事1)という用語を用いている(図1)。ここでは、呼吸器シンシチアルウイルス(RSV)デングウイルス(デングウイルス)SARS-CoV、中東呼吸器症候群コロナウイルス(MERS-CoV)に対するワクチン開発の歴史におけるVADEの例をまとめている。それぞれの例は、COVID-19ワクチンを安全に開発するための手がかりとなり、前臨床および臨床での厳格な安全性試験の必要性を強調している。
図1: ワクチン関連疾患の増強メカニズム
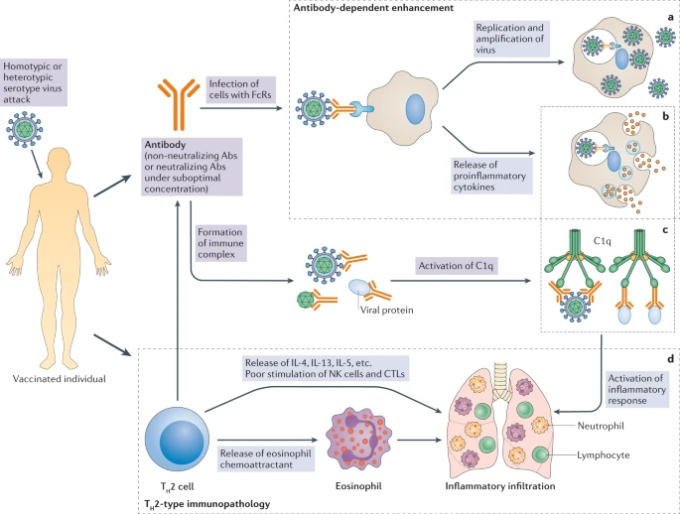
ワクチン接種は、免疫を受けた人に体液性および細胞性の免疫反応を引き起こす。正常な状態では、同種のウイルスが免疫を受けた体に侵入すると、ワクチンによって誘導された中和抗体(Abs)や特異的T細胞によって、それぞれ中和または除去される。ワクチン関連疾患の増強という観点では、ワクチンは主に、中和しないAbsや中和するAbsの低力価(最適濃度以下)あるいは2型Tヘルパー細胞(TH2細胞)に偏ったT細胞反応を誘導する。これらのワクチン接種を受けた人が、ホモタイプまたはヘテロタイプの血清型ウイルスにチャレンジすると、抗体は直ちにウイルスを認識し、2つの方法で抗体依存性の疾患増悪を媒介する。まず、ウイルスと抗体の複合体は、FcRを介した内在化により、樹状細胞や単球などのFcRを持つ細胞に侵入する可能性があり、これは「抗体依存性増強」(ADE)と呼ばれている。デングウイルスのように、FcRを持つ細胞に対して生得的なトロピズムを持つウイルスの場合、ADEによって、抗体を持たない状態よりもウイルス量が増加する。 a|ウイルスは侵入後、複製するかしないかにかかわらず、有害な免疫反応を活性化し、炎症性サイトカインを放出する可能性がある。b | ADEとは別に、抗体-抗原複合体は、C1q経路の活性化を通じて補体経路を刺激し、炎症反応をさらに強めることがある c | ワクチン関連疾患の増強には、TH2細胞に偏った免疫反応が関与することもある。活性化したTH2細胞は、抗体産生の活性化に寄与する。しかし、インターロイキン-4(IL-4)IL-13,IL-5,および好酸球化学誘引物質を放出するため、肺への好酸球の浸潤と炎症性サイトカインの産生をもたらす。 d|TH2細胞偏重の免疫反応では、ナチュラルキラー(NK)細胞とCD8+細胞傷害性Tリンパ球(CTL)の刺激が乏しい。過剰なサイトカインの放出(パートb)補体経路の活性化(パートc)好酸球の過剰な動員のすべてが、好酸球、好中球、リンパ球による肺への浸潤、炎症性サイトカインの産生(パートd)につながり、急性肺損傷や急性呼吸窮迫症候群を引き起こすのである。
Box 1 疾患の強化に関する重要な用語
ADE
抗体依存性増強(ADE)とは、抗体のFc受容体によるウイルスの内在化を媒介として、ウイルス特異的な抗体の存在下で、ウイルスの複製やサイトカインの放出がより広範に行われることをいう。ADEはフラビウイルスをはじめ、HIVやインフルエンザウイルスなどのウイルス感染症で広く報告されている。
ERD
ERD(呼吸器疾患増強/Enhanced respiratory disease)とは、呼吸器合胞体ウイルスやインフルエンザウイルスなどの呼吸器系ウイルスに感染した際に、それまでの免疫反応により臨床症状が重くなることを言う。ERDは通常、好酸球を過剰に含む気管支周囲の単球浸潤として現れる。ERDは、ワクチン接種後の同型または異型の血清型ウイルス感染、自然感染、母親の受動免疫の伝達の際に起こる。
VADE
ワクチン関連疾患の増強(VADE)は、ADEとERDと一部重なる。ERDとは対照的に、VADEはワクチン関連の状況のみに関与し、さらに重要なことに、それは呼吸器系疾患に限定されない。例えば、ヘテロタイプ-セロタイプのデングウイルス感染症は、ワクチン接種を受けた人に重篤なデング出血熱を引き起こす可能性がある。この現象はVADEと関連しているが、ERDは含まれていない。VADEは、抗体依存性および2型Tヘルパー細胞依存性のメカニズムに起因する。
RSV ワクチンの教訓
RSVワクチンの悲劇的な失敗を繰り返さないために、コロナウイルスワクチンのADEを十分に評価すべきだという警告がなされている28。ホルマリンで不活化したRSV(FI-RSV)をベースにした最初のRSVワクチンが臨床試験に入ったのは1965年のことであるが、その頃は天然痘29やポリオ30に対するワクチンのように、不活化または弱毒化したウイルスをベースにしたワクチンの開発がすでに成功していた。FI-RSVワクチンの忍容性は良好で,当初は中程度の免疫原性があるように思われた。しかし,FI-RSVワクチンは試験参加者を保護するどころか,その後のRSV自然感染時に逆説的な疾患強化効果(ERD:Enhanced Respiratory Disease)を示した(囲み記事1)。FI-RSVワクチンを接種した20人の乳児のうち,16人が入院を必要とし,うち2人はその後死亡したが,対照群の21人のうち入院したのは1人だけであった31。その後、FDAは緊急にRSVワクチンのすべての臨床研究を中止した。
このRSVワクチン試験におけるERDのメカニズムを明らかにするため、FI-RSV接種後の体液性および細胞性免疫反応を分析した。FI-RSVは、RSV糖タンパク質の結合を誘導したが、中和抗体sは誘導せず、好酸球増多、CD4+T細胞反応の誇張が見られた32,33。最初のFI-RSV試験から30年後の1990年代になって、CD4+T細胞と好酸球の過剰な増殖に寄与するTH2細胞に偏ったT細胞反応からなる、ワクチンに対する炎症反応の増強が確認された27,34,35。このTH2細胞に偏ったパターンは、ナチュラルキラー細胞やCD8+細胞傷害性Tリンパ球の刺激を低下させ、RSV抗原に対するTH2細胞反応や炎症反応を防ぐことができる36,37。最近の研究では、ホルマリン固定によるカルボニル基がTH2細胞反応の増強をもたらしたと考えられている38。しかし、ERDはホルマリンで固定されていないRSV FおよびG糖タンパク質を免疫した実験動物でも観察され39,40,ホルマリン固定が病原性炎症の決定因子ではないことが示唆された。これまでの研究では、FI-RSVはインターロイキン-5(IL-5)やIL-13などのTH2細胞様のサイトカインプロファイルを優位に誘導するのに対し、ERDを起こさない生RSVはIL-10などの1型Tヘルパー細胞(TH1細胞)様のサイトカインプロファイルを優位に誘導することが示されていた(参考文献27,41)。さらに、いくつかの弱毒性RSV生ワクチンや、ウイルスやDNAベクターで発現させたいくつかのRSV抗原は、ヒトにおいてERDを誘発しないか、わずかに誘発するだけであった42,43,44。特定の抗原のみがERDを誘発する理由の一つは、RSVの表面糖タンパク質が多様な構造を持ち、その結果、異なる免疫反応を誘発することにあると考えられる45,46,47。実際、いくつかの研究では、曝露される抗原部位が輸液前と輸液後の表面タンパク質で異なることや、共通の部位を標的とする抗体であっても両方の構造に同じようには結合しないことが示されている48。特に、別の研究では、抗原濃度が高く、ワクチンにTH1細胞を活性化するアジュバントが含まれていれば、融合後のFタンパク質も融合前のFタンパク質も、ワクチンを接種した綿毛ラットを保護することが報告されている49。TH2細胞に偏った免疫反応とは別に、抗体を介した作用もERDの一因となる。FI-RSVによって誘導された非抗体は抗原と結合し、抗体-抗原複合体はその後、補体経路を刺激して、炎症反応をさらに強める50。
2019年には、プレフュージョンコンフォメーションで安定化したRSV Fタンパク質を発現するアデノウイルスベクター(Ad26.RSV.preF)をベースにしたRSVワクチンが、高齢者のRSV予防のためのFDA Breakthrough Therapy Designationプログラムに合格した。Ad26.RSV.preFは、成体マウスおよび新生児マウスにおいて、高濃度の中和抗体を誘導し、インターフェロン-γ(TH1型サイトカイン)とTH2型サイトカイン(IL-4,IL-5,IL-10)の比率が高いことを特徴とする長期的なTH1細胞ベースの免疫を誘導した51。しかし、Ad26.RSV.preFの臨床試験は60歳以上の成人を対象に行われただけであり52,乳幼児用のRSVワクチンは未だに実現していない。このように、RSVワクチンを探求してきた50年の歴史の中で、我々は、その時々の緊急性にかかわらず、大規模な応用の前にワクチンの包括的な安全性を追跡することが絶対に必要であることを学んだ。RSVの経験から、抗原のどのような特徴が病気の悪化を引き起こすかはまだ分かっていないが、抗原のコンフォメーションやプレフュージョンとフュージョンの状態が重要であることは分かっている。また、TH2細胞に偏った免疫反応は有害であることもわかっていた。例えば、抗原によって誘導されたTH2細胞様のサイトカインプロファイル、例えばIL-5やIL-13は、動物モデルやヒトにおいて、CD4+T細胞を活性化するが、ナチュラルキラー細胞やCD8+T細胞をあまり刺激しないことがある。このようなTH2細胞に偏った免疫反応は、ウイルス感染時にVADEを引き起こす可能性がある。さらに、結合抗体よりも中和抗体sを誘導することが重要であることもわかっていた。
デング熱ワクチンの教訓
RSVと同様に、デング熱ワクチンの開発は、不活化ウイルスベースのワクチンから始まった。1920年代、BlancとCminopetrosは、胆汁とデングウイルスの混合液を試験参加者に接種した53。しかし、このワクチンでは、その後のデングウイルスチャレンジから参加者を守ることはできなかった。その後、多くの研究が、自然のデングウイルス感染が、患者の同種のデングウイルスに対する高力価で持続的な中和抗体反応を引き起こすことを発見した54,55。ある研究グループは、マウスの脳にデングウイルスを連続的に継代することで、弱毒化したデングウイルス株を得た56。この弱毒化ワクチンの1回の投与は、ワクチン接種を受けたボランティアに中和抗体を誘導するのに十分であった。デングウイルスには4つの血清型(デングウイルス1~デングウイルス4)があり、抗原性エピトープにはかなりの類似性がある。誘導された中和抗体は、同種のウイルス感染から患者を保護するだけでなく、異種のデングウイルスに対しても交差反応性を示した。しかし、後者の防御は3ヶ月から2年と短命であった57。重要なのは、交差特異的な抗体が、いったん最適でない濃度に落ちると、異種のデングウイルスに自然感染した後、重篤なデング症状を引き起こすリスクが、ナイーブな人よりも高くなったことである58。
この現象は広く調査された。交差反応性の抗体は異種のデングウイルスと結合し、その結果、単球、マクロファージ、樹状細胞などのFcRを持つ標的細胞へのウイルスの侵入を促進する19,59。一方、疫学調査では、重症デングの発生は、交差反応性抗体価の一定範囲(デングウイルス抗体価1:21〜1:80)と関連していることが示された60,61。侵入促進はともかく、非中和抗体、あるいは最適濃度以下の中和抗体は、デングウイルス粒子と複合体を形成し、FcRを介した免疫制御経路を介して炎症反応を誘発し62,重症デングのリスクをさらに高める可能性がある。
ヘテロタイプの血清型のデングウイルスによる再感染がADEを引き起こすことは明らかであった。したがって、デングワクチン開発の次の課題は、4つのデングウイルス血清型すべてに対する中和抗体sを誘導することであった。最初の4価デングワクチンであるCYD-TDVの臨床試験が開始されたのは、最初の不活化デングワクチンがヒトで試験されてから77年後の2006年のことであった(NCT00384670)。CYD-TDVは、黄熱病のバックボーンにデングウイルスの4つの血清型を発現させた組換え弱毒生ワクチンである63。2018,FDAは、すべての血清型(デングウイルス1-デングウイルス4)によるデングを予防するためのCYD-TDVワクチンを承認した。しかし、過去にデングウイルスに感染していない人へのこのワクチンの投与は認められなかった。この決定がなされたのは、臨床分析の結果、血清陰性のワクチン接種者は、血清陰性の非接種者に比べて、重症デングのリスクが高いことが明らかになったからである64。
デングウイルスはFcRを持つ細胞に感染することができるが、SARS-CoV-2はそうではないので、ウイルス感染と疾患のADEはCOVID-19よりもデング熱の方が顕著である可能性があるが、COVID-19では軽度であるか、あるいは存在しないかもしれない。さらに、デング熱の病態生理はCOVID-19のそれとは比較にならない。したがって、デング熱のVADEメカニズムはSARS-CoV-2のそれとは関係ない可能性がある。しかし、デング熱ワクチンの開発という長く困難な課題から、貴重な教訓を得ることができる。まず、中和活性とは別に、ワクチンによって誘導される抗体の力価を十分に評価する必要があることがわかっている。低い抗体価は、デングウイルス感染58やRSV感染50で観察されたように、防御を提供する代わりに、その後の感染でADEを引き起こした。次に、103個のSARS-CoV-2のゲノムを集団遺伝学的に解析した結果、SARS-CoV-2はORF1abとORF8の異なる遺伝子変異に基づいて2つの主要な型(L型とS型)に進化したことが示された(参考文献65)。さらに、SARS-CoV-2の進化の初期段階で、ORF8に382ヌクレオチドの欠失が発見された(参考文献66)。Sタンパク質にD614Gの変化を持つSARS-CoV-2の変異株は、世界的なパンデミックで最もパンデミックした67。ヒトの集団では6種類以上のヒトコロナウイルスがパンデミックしており、野生の動物種ではさらに多くのウイルスがパンデミックしている。SARS-CoV-2の継続的な変異と組み換えにより、SARS-CoV-2の他の血清型、あるいは別の新規コロナウイルスが誕生するかどうかは、今のところ不明である。したがって、分岐したコロナウイルスからの防御が可能なワクチン候補が理想的である。第三に、大規模なコホートから得られた臨床データによると、デング熱ワクチンの性能と有効性は、血清型、ベースラインの血清状態、年齢によって影響を受ける可能性があることが明らかになった63,68。これらの結果は、COVID-19のワクチン候補は、安全性と有効性を確認するために多様な動物モデル(つまり、若い動物と年老いた動物、男性と女性の動物)で総合的に評価されるべきであり、ヒトの研究参加者は多様な集団を反映させるべきであるという警告を意味している。このことは、COVID-19の重症度が年齢や性別によって異なり、高齢者や男性は一次感染時に重症化するリスクが高いことからも、さらに強調されている69。
SARSおよびMERSワクチンの教訓
SARS-CoV-2とSARS-CoVのゲノムは79.6%の配列同一性を有しており70,細胞に侵入する際には同じ受容体であるアンジオテンシン変換酵素2(ACE2)を利用する71。したがって、すでに研究されているSARSワクチンによる免疫反応は、COVID-19候補ワクチンの評価に有用であると考えられる。2003,SARS-CoVのウイルス粒子が分離され、ウイルスのゲノム配列が公開された直後、SARSワクチンの設計が始まった。COVID-19ワクチン開発者と同様に、研究者たちはまず、不活化ウイルス、組換えサブユニットタンパク質、組換えベクターをベースにしたSARSワクチンを求めた。2003年には、SARS-CoVのS1タンパク質、膜(M)タンパク質、ヌクレオカプシド(N)タンパク質を発現するAd5ベクターベースのワクチンがアカゲザルで試験された。これらのワクチンは、SARS-CoVに特異的なT細胞および中和抗体反応を誘導した72。Ad5-SARS-CoV-Sは、フェレットのウイルス量を大幅に減少させ、重度の肺炎を予防した73。SARS-CoV Sタンパク質を発現する組み換え改変ワクシニアウイルスAnkaraベクターは、フェレットにおいて迅速かつ活発な中和抗体反応を誘発したが、SARS-CoVにチャレンジした後、免疫したフェレットの肝臓で強い炎症反応が起こった74,75。さらに、不活化ウイルスや組み換えベクターを用いたSARSワクチンは、マウスモデル76,77,78において、その後のSARS-CoVチャレンジで好酸球やTH2細胞に偏った免疫反応を誘導することが明らかになったが、これはRSVワクチンによる幼児のERDを彷彿とさせる。同様に、不活化SARS-CoVワクチンとSARS-CoV Sタンパク質由来のペプチドワクチンは、いずれもSARS-CoVチャレンジ後にアカゲザルの重篤な肺障害を誘発した79。SARS-CoVのSタンパク質をコードするDNAワクチンは、マウスモデルおよび第I相臨床試験において、CD4+およびCD8+ T細胞と中和抗体の反応を誘発した80,81。
ADEはSARSワクチンでも観察された。組換えSARS-CoV Sタンパク質をベースにしたSARSワクチンは、ハムスターをSARS-CoV感染から守ったが、Sタンパク質特異的抗体は、試験管内試験でFcR依存性にB細胞への侵入を媒介した82,83。さらに、希釈したSARS-CoV Sタンパク質特異的抗体は、HL-CZヒトプロモノサイト細胞株において、ウイルスの感染力と細胞質効果の増加をもたらした84。ADEを除いて、抗体を介した不均衡なマクロファージの活性化は、生体内試験での明らかな肺傷害と関連することが報告されている。SARS-CoV Sタンパク質特異的抗体は、SARS-CoV感染後に病原性免疫応答を誘発し、疾患の重症度を高めることが示されている24。注目すべきは、抗S IgGを介したADEの証拠は試験管内試験でのみ観察されたことである。そのため、ADEは、生体内の他の抗体やTH2細胞を介した免疫病理に比べて、それほど重要な問題ではないと考えられる。
MERS-CoVは、SARS-CoVやSARS-CoV-2を含むBetacoronavirus属に属している。2012年にサウジアラビアでウイルスが初めて確認されて以来、MERSワクチンの開発には、サブユニットワクチン、ウイルスベクターやDNAベースのワクチン、不活化ワクチンや弱毒生ワクチンなど、多くのワクチン技術が適用されてきた85。それらの多くは十分な免疫反応を誘導し、ワクチンを接種した動物をその後のMERS-CoV感染から守ることができた86。しかし、2つの研究では、不活化MERS-CoVを接種したマウスがウイルスチャレンジ後にTH2細胞に偏った免疫応答を起こし、好酸球浸潤が増加したことが独立して報告されている87,88。いくつかの証拠から、MERS Sタンパク質特異的抗体がADEを媒介することが証明されている。組換えMERS-CoV S1によって誘導されたモノクローナル抗体は、細胞表面のIgG FcRと結合し、FcRを外因的に発現しているHEK293T細胞やFcRを内因的に発現しているマクロファージ(THP-1単球から誘導)へのウイルス侵入を、正統的なウイルス受容体依存性経路を介して媒介した89。MERS-CoVに感染したウサギは、中和活性を持たないMERS-CoV Sタンパク質特異的抗体を発現し、再感染に対する動物の保護を行っていたが、気になることに、MERS-CoVに再感染したウサギは、補体の活性化に伴う肺の炎症の亢進を示した90。全体的に見て、VADEの兆候はSARSワクチンよりもMERSワクチンの方が目立たない。現在、1種類のDNA MERSワクチン(INO-4700)と2種類のウイルスベクターを用いたMERS Sタンパク質ベースのワクチンが第I相臨床試験で良好な安全性を示し、MERS-CoVに対する体液性および細胞性免疫反応を誘導している91,92,93。上述したSARSとMERSのワクチン開発におけるVADE現象は、RSVとデングウイルスから学んだ教訓をさらに強調するものである。まず、SARS-CoV-2のワクチン候補は、バランスのとれたT細胞反応を誘導する必要がある。特に、ワクチン接種後のTH1細胞とTH2細胞の免疫反応を動物とヒトで評価する必要がある。次に、希釈されたSARS-CoV Sタンパク質特異的抗体のみがウイルス感染力の増加をもたらしたという現象84は、VADEが免疫された被験者の抗体価に関係していることを示している。
VADEの想定されるメカニズム
現在のところ、VADEの出現はウイルス、宿主、抗原に強く依存するため、そのメカニズムは明確には定義されていない。しかし、ワクチンには、生体内でVADEを誘発するいくつかの共通点がある。まず、デングウイルスやエボラウイルスなど、FcRを持つ細胞を標的にして増殖するウイルスに感染した場合のワクチンは、VADE94,特にADEを誘発する可能性が高い。これまで、SARS-CoV-2の活性感染に対して、Bリンパ球やTリンパ球だけでなく、単球も感受性があると報告した研究は1件のみで、この報告は査読されていない95。したがって、この懸念を解消するためには、さらなる努力が必要である。第二に、炎症性障害を引き起こすようなウイルスの感染に対するワクチンは、VADEを引き起こす可能性が高い。例えば、SARS-CoVやRSVなど96。COVID-19の患者の約13.9%が重症肺炎97に進行し、その際、炎症反応が病理学的に寄与していた。無作為化試験において、COVID-19患者に抗炎症作用のあるデキサメタゾンを投与し、さらに通常の治療を行った群では、通常の治療のみを行った群に比べて28日死亡率が低かったという予備的な報告がある98。しかし、病態は宿主特異性が高いと思われるため、どの患者が急性呼吸窮迫症候群に進行するかを予測できる確定マーカーは確認されていない。同様に、どの抗原がVADEを引き起こすかを予測することも困難なままである。第三に、非中和抗体、すなわち不十分な中和抗体sを引き起こす抗原は、VADEの原因となる可能性が高い。COVID-19から回復した患者には、RBD特異的IgGと中和抗体sの両方が検出されることがいくつかの証拠によって示されている(参考文献99,100)。しかし、抗体反応の持続時間や、その後の自然感染に対する長期的な保護の可能性は不明である。SARS-CoV-2感染に対する抗体反応の動態については、様々な報告がなされている。例えば、ある研究では「重度の感染症はより早い段階でのセロコンバージョンと関連している」101と報告されているのに対し、別の研究では「重症患者では、遅れてはいるがより強い抗体反応が観察された」102と報告されている。また、米国とエクアドルで最近発生したSARS-CoV-2再感染の2例は、2回目の感染でより重篤な症状を示したが103,104,香港と欧州で発生した2例は2回目の感染でより軽度の症状を示した105,106。注目すべきは、香港の患者では1回目の感染ではセロコンバージョンが得られなかったことであり、これが2回目の感染の最も重要な決定要因であると考えられる。結論として、COVID-19患者の抗体動態はまだ完全には解明されていない。そのため、動物モデルや臨床試験でワクチン候補の免疫反応を慎重に評価する必要があるが、これについては次に説明する。
COVID-19 ワクチンの意義
COVID-19 ワクチンの安全性と有効性を評価するための動物モデル
中和抗体s58の低力価とCD8+T細胞12の活性化不全は、いずれもVADEのリスクファクターであるため、ワクチンは生体内試験で体液性および細胞性の反応を誘発する効果が高いものでなければならない。一方で、安全性の評価には2つの大きな障壁があると考えられる。第一に、VADEは主に同種または異種のウイルス株による後続のチャレンジまたは自然感染時に現れ、その発生はしばしば最適レベル以下に低下した抗体価に関連しているため、通常、VADEの観察には長い時間がかかる47。第二に、実験動物が人間の反応を正確に表しているかどうかは不明である。過去にRSV、デング、SARS、MERSワクチンを開発した経験と教訓から、我々は安全で効果的なCOVID-19ワクチンの開発者に以下のような提言をする。
まず、COVID-19ワクチン候補の安全性を多様な動物モデルで評価する必要がある。ワクチン候補に対するヒトの免疫反応を正確に再現できる動物モデルは存在しないため、複数の動物モデルで評価することで、病原性反応を見逃すリスクを回避することができる。第二に、COVID-19ワクチンの評価では、SARS-CoVとSARS-CoV-2に交差反応する抗体を用いて、異種ウイルス株へのチャレンジを行うべきである(参考文献107)。第三に、同じ動物モデルで異なる年齢で実験を繰り返す必要がある。これまでの研究では、デング熱ワクチンの性能と有効性は、血清型、ベースラインの血清状態、年齢によって影響を受けることが証明されている63,68。不活化SARS-CoVとミョウバンアジュバントで免疫した加齢マウスでは、主にTH2細胞に偏った免疫病理が観察された76。SARS-CoVのSタンパク質を発現させたベネズエラウマ脳炎ウイルスレプリコン粒子は、若いマウスでは異種のSARS-CoVの感染に対して短期的に完全に防御することができたが、ワクチンを接種した老化した動物では限定的な防御しか見られなかった108。高齢者はCOVID-19に対して最も脆弱な集団であることを考えると、高齢化した動物モデルやヒトでの安全性と有効性の評価が不可欠である。第四に、動物実験や臨床試験は、併存疾患のある動物モデルやヒトでも行う必要がある。併存疾患のあるCOVID-19患者は、併存疾患のない患者に比べて臨床転帰が悪いことが示されており、併存疾患の増加は臨床転帰の大幅な悪化と相関していることを考慮している109。
COVID-19 ワクチンの安全性と有効性を評価するためのパラメータ
これまでに、コロナウイルスワクチンの安全性と有効性を評価するために必要なパラメータとして、中和抗体の幾何平均値、中和抗体値と非中和抗体値の比、抗体親和性、T細胞反応プロファイル、上気道および下気道のウイルス量、ウイルス抗原と免疫細胞マーカーの免疫組織化学による肺の病理組織の特徴などが提案されている110。最適でない濃度の中和抗体sは効果的に中和されず、SARS-CoV-2の感染を促進する可能性があるため、ワクチンによって誘導される中和抗体sの力価は、有効性と安全性の評価において最も重要な指標である111。MooreとKlasseは、「SARS-CoV-2 S-proteinワクチンがヒトを保護するためには、どの程度の基準となる血清抗体価と中和抗体価に到達しなければならないかは不明である」とレビューで結論づけている。上述の動物チャレンジ実験から、殺菌免疫にはおよそ100から500の範囲の血清中和抗体 ID50力価が必要であることが示唆されている」112。また、血清中和抗体値が1:189以上のワクチンを接種したマウスの肺組織には、検出可能なSARS-CoV RNAが存在しないことにも気付いた113。FDAは、受動的治療のための回復期血漿の中和抗体値を1:160以上にすることを推奨している(ref.114)。したがって、有効かつ安全なCOVID-19ワクチンは、生きたSARS-CoV-2感染に対して、少なくとも1:160の中和力を持つ抗血清をマウスモデルで誘導できるはずであると提案する。SARSワクチン76,77,78やMERSワクチン87,88によるVADEの最も強力な指標の一つである肺の好酸球ろ過の亢進は、ウイルスチャレンジや自然ウイルス感染後のCOVID-19ワクチンの安全性を評価する際にもモニターすべきである。Chenら115の報告によると、安全なSARSワクチンを接種したマウスの肺における好酸球の含有量は、ウイルスチャレンジ後の浸潤細胞の5%以下であることが望ましい。したがって、ワクチンを接種したマウスの肺におけるウイルスチャレンジ後の好酸球浸潤率が5%以上であることを、VADEの推定パラメータとして考えるべきであると提案する。ワクチンによる中和抗体反応がどのくらい持続するかは、ワクチンの安全性と有効性を評価するためのもう一つのパラメータである。Seowらは最近、ピーク時の中和抗体力が低かった回復した患者の中和抗体力が2~3ヵ月で検出不可能なレベルにまで衰えたことを報告しており116,中和抗体の持続時間は長くない可能性を示している。一方、アイスランドで行われた大規模な研究では、SARS-CoV-2に対する抗ウイルス抗体は少なくとも4カ月間は持続することが示された117。また、別の研究では、SARS-CoV-2のSタンパク質特異的メモリーB細胞と循環している濾胞性ヘルパーT細胞が、血漿中和活性と正の相関関係にあることが分かっている118。したがって、この2つの指標は、ワクチン接種後のSARS-CoV-2に対する免疫応答の持続性をモニタリングするのに有用であると考えられる。我々の以前の研究では、RBDベースのSARSワクチンで免疫したマウスの血清中の中和抗体は、6ヶ月間高い力価(1:580)を維持できることが示された113。したがって、COVID-19ワクチンによって誘発された中和抗体応答は、ワクチン接種したマウスで少なくとも6カ月間は持続するはずだと提案する。
安全で効果的な COVID-19 ワクチンを設計するための最適な抗原
安全で効果的な COVID-19 ワクチンを開発するためには、理想的な抗原を選択する必要がある。Sタンパク質は、主要な中和エピトープを含み、ウイルス粒子の表面に位置するため、現在開発中のほとんどのCOVID-19ワクチン候補の主要な抗原となっている。しかし、SARS-CoVの全長Sタンパク質には、ADEに関連するものを含む非中和抗体や、有害な免疫反応を誘導することができるいくつかの免疫優勢部位も含まれている78,79,83,84,119,120。例えば、SARS-CoV Sタンパク質のRBDのカルボキシ末端に近い位置にあるS597-603エピトープを標的とした抗体は、免疫を受けていないマカクの抗体と比較して、Vero E6細胞のSARS-CoV感染を著しく増強した79。また、SARS-CoV Sタンパク質のRBDサブユニットは、マウスモデルにおいて、明らかなVADEを伴わずに、強い中和抗体反応を誘発し、SARS-CoVチャレンジから保護した121,122。我々の以前の研究では、RBDにはSタンパク質の主要な中和エピトープが含まれており、S1サブユニットや完全長のSタンパク質と比較して、高濃度の中和抗体を誘導するが、非中和抗体のレベルは低いことが示されている123,124,125,126,127。SARS-CoV RBDにアジュバントとしてAlhydrogel(1:25)を加えたマウスモデルでは、VADEの兆候を伴わない強い防御が誘導されたが、SARS-CoV Sタンパク質全長は弱い防御と強いVADEを誘導した115。一方、コロナウイルスに感染した患者の血清から単離された中和抗体sのほとんどは、RBDを標的としている128,129。さらに、SARS-CoV-2のRBDは、マウスにおいてADEを伴わない強力な中和反応を引き起こした130。COVID-19,SARS、MERSに対するRBDダイマーワクチンは、対応するウイルスに対する中和抗体反応を誘発し、パイロットスケールの生産では高い収率を示した131。我々の最近の研究では、脂質ナノ粒子をカプセル化したRBDベースのmRNA COVID-19ワクチンは、強固なT細胞応答を誘発し、生きたSARS-CoV-2感染に対して非常に強力な中和抗体を誘発し、マウスへのブースト免疫後70日で中和抗体力は1:540であった132。また、これらの抗体は、ヒトSARS-CoV株Tor2およびGD03,ならびにパームハクビシン株SZ3のAタンパク質を発現するSARS-CoVシュードウイルスをクロス中和することができ、このRBDベースのmRNAワクチンは、SARS-CoV-2およびSARS-CoVの両方の感染を予防する安全で効果的なワクチンとして、さらに開発される可能性があることが示唆された。また、脂質ナノ粒子をカプセル化したSARS-CoV-2 RBDベースのmRNAワクチン(ARCoV)は、マウスと霊長類で強固な中和抗体sおよびTH1細胞ベースの細胞応答を誘発し、マウスに適応したSARS-CoV-2チャレンジに対して完全に防御することができた133。
さらに、いくつかのグループが、SARS-CoVや他のヒトコロナウイルスに対するRBD標的抗体や交差反応性抗体の同定を報告しており、RBDには保存されたエピトープが存在する可能性が示されている。ある研究では、SERS患者由来の8つのRBD標的抗体が、真正のSARS-CoV-2,SARS-CoV、WIV1コロナウイルスを中和し、半最大発育阻止濃度はそれぞれ0.05-1.4,0.004-0.06,0.076-1.7 μg ml-1であった134。別の研究では、SARS患者のメモリーB細胞から、RBD特異的な抗体S309を分離した。この抗体は、SARS-CoV-2およびSARS-CoVの感染を強力に中和した135。SARS-CoVのヒト株(GD03)およびパームハクビシン株(SZ16)由来のRBDは、ウサギにおいて、SARS-CoVおよびSARS-CoV-2と強く反応し、強力に中和する抗体を誘発した。これらの研究は、RBDを用いたワクチンの開発をさらに後押しするものである。RBDの最適化は、非中和抗体エピトープを糖化137で覆い、中和抗体エピトープを脱糖138で露出させることで、保護免疫力を高め、非中和抗体を誘導する可能性を低減させることが期待され、最適化されたRBDは、安全で効果的なCOVID-19ワクチンを開発するための理想的な抗原であることを示唆しているが、他のアプローチも安全で効果的であることが判明するかもしれない。
結論と展望
1796年5月、一人の少年に牛痘感染者の菌が接種され、ワクチンの歴史が始まった。それ以来、ワクチンは天然痘、狂犬病、ポリオなどの多くのウイルス性疾患の対策に役立ってきた。しかし、RSV、デングウイルス、SARS-CoV、MERS-CoVなど、いくつかのウイルスについては、VADEという現象がワクチン開発の大きな障壁となっている。現在、COVID-19の蔓延が止まらないため、いくつかの国では安全性に関する包括的な評価を行わずにローカルワクチンの承認を急いでる。SARS-CoV-2のように伝達性は高いが症例致死率が低いウイルスのワクチンは、エボラウイルスのように伝達性は低いが症例致死率が高いウイルスのワクチンよりも、より多くの健康な人が使用しなければならないため、通常、安全性に対するハードルは高くなるはずである。
2020年7月15日、WHOは、COVID-19ワクチンへの迅速かつ公平・公正なアクセスを世界中で保証するための仕組みであるCOVID-19ワクチン・グローバル・アクセス(COVAX)イニシアティブに150カ国以上が参加していることを発表した139。COVID-19ワクチンは、年齢、性別、人種、合併症の有無にかかわらず、世界中のすべての人にとって安全でなければならないため、COVID-19ワクチンの安全性のハードルはさらに高くなる。仮にCOVID-19ワクチンの副反応率がわずか1%だとすると、全世界の人々がワクチンを接種した場合、約7800万人が影響を受けることになる。COVID-19ワクチンを世界中に配布する場合、副反応率は極めて低く抑える必要がある。さまざまな動物モデルや臨床試験での包括的な安全性評価と、抗原やアジュバントの合理的な設計が、VADEの発生率低下に貢献するだろう。
