Ivermectin, ‘Wonder drug’ from Japan: the human use perspective
2011年2月10日
pubmed.ncbi.nlm.nih.gov/21321478/
アンディ・ランプ*1・大村智*1
要旨
1970年代後半に発見されたアベルメクチンのジヒドロ誘導体であるイベルメクチンは、東京・北里研究所で日本の土壌から分離された単一の微生物のみから生まれた先駆的な薬剤であり、世界中の数十億人の人々の生活と福祉の向上に計り知れない影響を与えていた。当初は動物用医薬品として導入され、商業用家畜やコンパニオンアニマルの内外の幅広い寄生虫を死滅させる。それはすぐに、何世紀にもわたって熱帯地域の貧しい人々を悩ませてきた世界で最も悲惨な、見苦しい病気の2つとの戦いに理想的であることが発見された。それは今、世界的に両方の病気を排除するためのキャンペーンの唯一のツールとして無料で使用されている。また、他のいくつかの人間の病気の克服にも成功しており、その新たな利用法が絶えず発見されている。本稿では、イベルメクチンが動物用医薬品として大成功を収めた後、人間にも広く使用されるようになるまでの経緯を詳しく見ていきたいと思う。
キーワード
アベルメクチン、イベルメクチン、作用機序、オンコセルカ症、リンパ系フィラリア症、薬剤耐性
序論
人類の健康と福祉に最大の恩恵をもたらしたペニシリンとアスピリンの2つは、おそらく最も有益な影響を与えた薬である。しかし、イベルメクチンもまた、その汎用性、安全性、そして世界中、特に世界で最も貧しい人々の何億人もの人々に与えてきた、そして今も与え続けている有益な影響に基づいて、これらの価値ある候補者と並んで考慮することができる。アベルメクチンとイベルメクチン(22,23-ジヒドロアベルメクチンB)の発見、開発、商業化、イベルメクチンの提供、オンコセルカ症やリンパ系フィラリア症との闘いへの使用に至るまでの経緯については、私たちが執筆したレビューを含め、いくつかの広範な報告書が発表されている1-6) 。
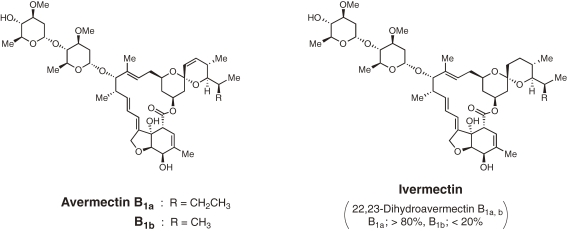
1970 年代後半に初めて登場したイベルメクチンは、アベルメクチンの誘導体であるイベルメクチン(図1)1 )は、これまでにない画期的な薬剤であった。イベルメクチンは、内外の幅広い線虫や節足動物に強力に作用し、全く新しいクラスの抗寄生虫剤の先駆けとなった世界初の殺虫剤であった。1970年代初頭、私たち(当時、東京・北里研究所の抗生物質研究グループ長だった大村)の一人が、米国の製薬会社メルク・シャープ・アンド・ドーメ(MSD)と共同研究を行うという、新しい国際的な官民連携が開始された。研究契約に基づき、北里研究所の研究者が土壌サンプルから生物を分離し、試験管内試験で生物活性の予備評価を行った。その後、有望な生理活性サンプルをMSDの研究室に送り、さらに生体内試験試験を行ったところ、強力で有望な新規生理活性が発見され、その原因が新規化合物によるものであることが確認され、「アベルメクチン」と命名された7)。 1) 日本の土壌サンプルから得られた新しい抗寄生虫剤を発見するための革新的な国際共同研究の成果として、非常に安全でより効果的なアベルメクチン誘導体であるイベルメクチンは、1981年に動物用医薬品として発売された。イベルメクチンは、消化器系の丸虫、肺虫、ダニ、シラミ、ツノバエなどの幅広い寄生虫に有効である7-12) 。その影響を象徴するように、牛群の約80%が感染しているブラジルでは、年間約20億ドルの損害が発生している13) 。今日、イベルメクチンは世界中で数十億頭の家畜やペットの治療に使用されており、食品や皮革製品の生産量を増加させるとともに、何十億頭ものコンパニオンアニマル、特に犬や馬の健康を維持するのに役立っている。動物用医薬品の分野では「ブロックバスター」と呼ばれ、10億米ドル以上の年間売上を達成し、20年以上にわたってその地位を維持している。それは非常に有用であり、適応性があるので、それはまたそれが非標的生物に否定的な影響を与えることができる水産養殖業の魚のシラミを扱うために、例えば、時々、違法に、ラベル外で使用されている。また、農業分野でも広く使用されている2) 。
図1 アベルメクチンとジヒドロ誘導体であるイベルメクチンの分子図
イベルメクチンは、1988年に初めてヒトのオンコセルカ症の治療に使用されて以来、世界中の何十億人もの人々の栄養、一般的な健康、ウェルビーイングを改善し、ヒトの健康においてさらに「不思議な薬」であることが証明された。非常に効果的で幅広いスペクトルを持ち、安全で忍容性が高く、簡単に投与できる(1年に1回の経口投与)など、多くの点で理想的であることが証明されている。本剤は、オンコセルカ症、ストロンギロイジダ症、アスカリア症、皮膚幼若虫移動症、フィラリア症、 Gnathostomiasis、Trichuriasisなどの各種内部線虫感染症のほか、ペディキュラ症(シラミ感染症)疥癬(ダニ感染症)などの外寄生虫感染症の経口治療にも使用されている。 14) イベルメクチンは、熱帯地域の何十億人もの貧しい人々や恵まれない人々の生活を苦しめているオンコセルカ症とリンパ系フィラリア症という、世界的に見て最も見苦しく壊滅的な2つの病気を間もなく撲滅する2つの世界的な病気撲滅キャンペーンの重要な柱となっている。今後10年間で、2億人以上の人々が、世界的に協調した革新的な大量医薬品管理(MDA)プログラムを通じて、毎年または半期ごとにこの薬を服用することになると考えられる。実際、民間セクターの製薬会社である多国籍企業メルク社と公共セクターの企業との間の前例のないパートナーシップにより、イベルメクチンの発見、開発、展開が行われている。15) 現在、イベルメクチンが唯一の制御手段となっているオンコセルカ症対策の国際的な取り組みについて、ユネスコの世界科学報告書は、「この病気との闘いにおける進展は、発展途上国におけるこれまでの公衆衛生キャンペーンの中で最も勝利に満ちたものの一つである」と結論づけている。)
オンコセルカ症
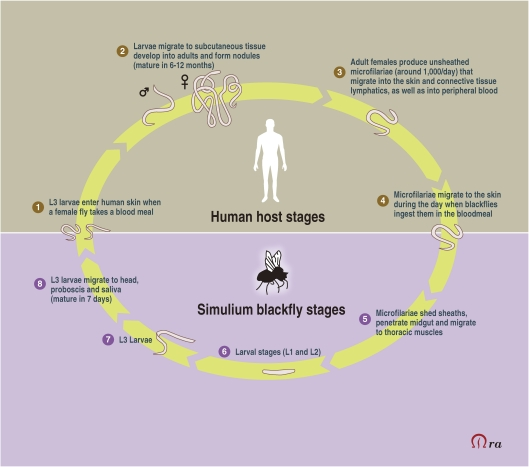
イベルメクチンがヒト用医薬品として開発されたのは、オンコセルカ(Onchocerciasis)(またはリバーブラインドネス)と表裏一体であり、オンコセルカ(Onchocerca volvulus)ワームの感染によって引き起こされるヒトの慢性フィラリア疾患である。この寄生虫は、高酸素濃度で流れの速い河川や水路で繁殖するSimulium属の感染したクロバエに咬まれることで感染する。人体では、寄生虫の未熟な幼虫が皮下組織に結節を作り、そこで成虫に成長する。交尾の後、メスのミミズは、約10-14年の間、1日に1000マイクロフィラリアを放出することができる。これらは体内を移動し、死滅すると、皮膚の発疹、病変、激しいかゆみ、水腫、皮膚の色素沈着などの様々な症状を引き起こす(図2)。また、ミクロフィラリアは眼にも侵入し、視力障害や失明の原因となり、オンコセルカ症は感染症による失明の第2位の原因となっている17)。この病気は、約1~2百万人に視覚障害を引き起こし、そのうち約半数が失明する18) 。
図2 マリ:オンコセルカ症で失明した老人
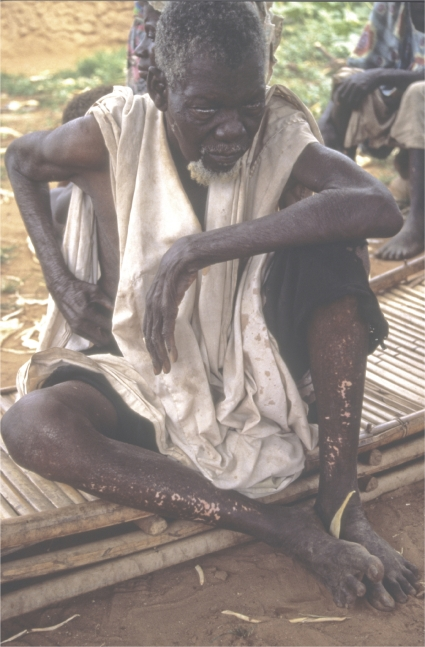
足にはヒョウ皮、腹部には結節がある。クレジット・ライン。WHO/TDR/クランプ。
1970年代初頭には、アフリカの27カ国、アメリカ大陸の6カ国、アラビア半島の1カ国の計34カ国でオンコセルカ症がパンデミックしていた。その後、世界保健機関(WHO)は、全世界で1,770万人が感染し、そのうち約27万人が失明し、さらに50万人が重度の視覚障害者であると推定している。オンコセルカ症は、特にサハラ以南のアフリカの超蔓延地帯で顕著に見られた。これらの地域のコミュニティでは、オンコセルカ症による視覚障害の発生率が高く、地域によっては40%にも達し、個人やコミュニティの健康に計り知れない負の影響を与え、経済的能力と生産性を低下させ、肥沃な農地の放棄につながっていた19) 。
1973年までに、オンコセルカ症は、当時の世界銀行総裁ロバート・マクナマラによって、大規模な保健・社会経済上の重要性を持ち、西アフリカでの対策が切実に必要とされている重大な病気であると認識され、彼は変革のための重要な代理人となった。1974年、アフリカにおけるオンコセルカ症の劇的な影響が国際的に認識され、世界銀行を含む4つの国連機関が西アフリカオンコセルカ症対策プログラム(OCP)を立ち上げた。このプログラムは120万km2をカバーし、11カ国の3,000万人を河川失明症から守りました。
薬物提供
OCPの活動は、10年以上にわたり、ベクタークロバエの幼虫を殺すために、ヘリコプターや航空機を使ってクロバエの繁殖地に殺虫剤を散布することに終始していた。1987年にイベルメクチン(メクチザン®)がヒト用として登録されたのに続き、メクチザン®は製造会社のメルク社からオンコ病治療薬として寄贈された。メクティス®は、製造会社であるメルク社から、必要とされる限り、すべての常在国のオンコセルカ症の治療のために寄贈された。その結果、メクチザンの寄贈プログラムは、最初で最大規模で長期に渡り実施され、最も成功したプログラムとなり、その後の他のすべてのプログラムのモデルとなった。イベルメクチンは1988年に配布が開始され、メルクが設立し資金を提供している独立したメクチザン寄付プログラム(MDP)を通じて運営が行われた。その後、OCP の防除作業は、単独でのベクター防除から、幼虫駆除とイベルメクチン処理を組み合わせたもの、あるいは一部の地域ではイベルメクチン処理のみのものへと変化した。イベルメクチンは、そのユニークで強力な微生物殺虫効果、重篤な副作用がなく、安全性に優れていることから、オンコセルカ症の治療薬として急速に採用されるようになった。現在では、1996年に活動を開始したアフリカオンコセルカ症対策プログラム(APOC)が中心となって、オンコセルカ症が存在するアフリカの他16カ国で、オンコセルカ症の撲滅キャンペーンに使用されている唯一のツールとなっている。イベルメクチンを年間150μg/kgの単回経口投与すると、皮膚のミクロフィラリアのレベルをゼロにすることができ、ミミズの胚発生を阻害することで、新しいミクロフィラリアの発生を最大2年間遅らせることができる。OCPは2002年12月に、内戦により活動が妨げられていたシエラレオネを除くすべての対象国で病気の感染を事実上阻止した後、閉鎖された。
イベルメクチンがオンコッカール・マイクロフィラリアに対する活性を発見してから 1988年以降の配布プログラムの成功に至るまでのプロセスは、簡単でも直接的でもなかった。成功は、画期的で革新的なパートナーシップによって達成された。この道のりは、科学的な不確実性、相反する見解、曖昧さ、フラストレーション、個々のイノベーション、そして予想外の紆余曲折を伴う複雑な事業でした。実際にイベルメクチンが発見されたのは、ユニークで先駆的な公共部門と民間部門のパートナーシップ、そして何人かの重要人物のコミットメントとビジョンを含む国際的なチームの努力によるものであった。イベルメクチンがヒト用医薬品として開発されたのには、組織的、個人的、薬理学的にも多くの変数が関与しているが、それに加えて、運、教育された洞察力、個人的なコミットメントが大きく関わっている。
イベルメクチンの開発
1970年代半ばになると、国際社会は無視された熱帯病の大きな問題に対処するために動員された。1974年にOCPが設立された後、1975年には国連の熱帯病研究・研修特別プログラム(TDR)が設立された20) 。ちょうどその頃、北里研究所から送られてきた微生物サンプルの中から、メルクの研究所の特殊な新規駆虫マウススクリーニングモデルでアベルメクチンが同定され、その中で最も成功したのがイベルメクチンであった。
当時、何世紀にもわたってアフリカを悩ませてきたオンコセルカ症を治療するための安全な薬剤は存在せず、事実上、OCPとそのベクターコントロールに重点を置くことになった。TDRは、バイエル、ホフマン・ラ・ローシュ、CIBA-Geigy、ローヌ=プーランクなど多くの製薬会社がフィラリシド化合物のルーティングスクリーニングを行っていたにもかかわらず、商業市場がないため、適切な抗オンコセルカ剤の開発に関心を持つ企業はなかったことをすぐに発見した。さらに悪いことに、オンコセルカ種はどの齧歯類でも成熟するまでには成長しないため、動物モデルで標的生物に対する化合物のスクリーニングを行うことは不可能であった21) 。これは非常に「垂直的」なプログラムで、主に世界銀行や他の国連機関を通じて調整され、米国に本拠地を置くヘリコプター会社と米国の化学会社が殺虫剤のために数百万ドルの契約を結んでいた。
一方、研究の必要性については、TDRは特に注意を払う必要がある6つの分野を特定しており、効果的で安全な化学療法剤の発見が最優先事項であると考えられてた。1975年当時、オンコセルカ症の治療薬はジエチルカルバマジン(DEC)とスラミンの2種類しかなかった。両者の使用は非常に満足のいくものではなかった。DECはミクロフィラリアを殺すことで知られていたが、ヒトの宿主に暴力的で危険な過敏症反応を引き起こした。眠り病の治療のために50年前に開発されたスラミンは、成虫を殺すために検討された唯一の薬剤でしたが、毒性が強く、しばしば重篤な、時には致命的な反応を引き起こすことがあった。さらに、DECやスラミンを使用して寄生虫学的に治癒させるには、医学的な管理の下で長期間にわたる高価な治療を必要としていた。そこで、産業界を含む世界中の独立した科学者で構成される TDR Scientific Working Group (SWG) は、新規で毒性のないマクロフィラリア剤(成虫を殺傷する)を優先することを決定し、マクロフィラリア剤は未熟な虫を標的とするマイクロフィラリア剤よりも実質的に好ましいと判断した24) 。
1976年のTDRフィラリア症科学運営委員会の第1回会合では、本プログラムのスタッフが主要製薬会社16社を訪問したが、オンコセルカ症に積極的に取り組んでいる会社はなかったと報告された。また、スクリーニングのための有効なモデルも存在しなかった。委員会は,熱帯病治療薬のスクリーニング施設を維持するためのコストが高いことが,産業界の関与を妨げる大きな要因となっていることに同意した25) TDRは,このような状況を是正し,産業界を新薬の探索に参加させるために行動した。残念なことに,O. volvulus の寄生虫が完全に発生するのはヒトと一部の霊長類のみである。幸いなことに、ヒトの寄生虫に最も近いのは、アフリカに限定されている牛に生息するO. ochengiで、これも同じ媒介者によって感染する。O. ochengi ウシモデルは、このようにして、ヒトでは不可能な実験的研究を現場や実験室で行うことを容易にし、寄生虫のライフサイクルの詳細な知識を得ることにつながりました(図3)。1977年以降、TDRはオンコセルカルフィラリシドの包括的なスクリーニングシステムを確立するための技術的・財政的支援を行った。本プログラムでは、一次および二次スクリーニングのための技術的能力と設備を有する5つの学術研究機関および民間研究機関、すなわちジョージア大学(米国)ギーセン大学(ドイツ)ウエルカム財団(英国)ロンドン衛生熱帯医学学校(英国)東京大学(日本)を特定した。TDRは、これらの公的機関に化合物の一次および二次スクリーニングのために約225万ドルを提供し、製薬会社には完全な守秘義務を約束して試験のための化合物の提供を求めた。さらに、TDRは、二次スクリーニングで陽性の結果を示した化合物について、牛を用いた独自の三次スクリーニングを確立した。オーストラリアの北クイーンズランド州のジェームズ・クック大学を拠点としたこのスクリーンは、約43万5千米ドルの費用をかけて、ある化合物がヒトで何をするかを予測する最高のものであった。大手製薬会社からコード化されたサンプルとして供給された約10,000種類の化合物がスクリーニングネットワークを通過し、その中にはメルク社のものも含まれていた26) 。
図3 イベルメクチンのライフサイクル
実際には、イベルメクチンがヒトの医薬品としての役割を果たしたのは、動物用医薬品として市場に出回る数年前の1978年4月からメルク社内で始まっていた。1974年にメルクの研究所に送られてきた東京の北里研究所が分離した生物の発酵ブロスの非常に強力な生理活性が初めて確認されたのは1975年のことであった。この活性化合物は、国際的な学際的共同研究チームによってアベルメクチンとして同定され、その後精製されたイベルメクチン誘導体が開発に最適な化合物に指定された。ウィリアム・キャンベル博士の指導の下、メルクの科学者たちは、この薬剤が家畜やコンパニオンアニマルの幅広い寄生虫に対して有効であることを発見した10)。メルクの研究者であるL.S.ブレア氏の先見の明により、この薬が馬のオンコセルカ属の皮膚に生息する微小フィラリアに対して有効であることが発見された。これらは実際に臨床的な病気を引き起こすものではなかったため、この発見は商業的な意義はほとんどなかった。しかし、O. cervicalisはO. volvulusと同じ属に属しており、キャンベル博士は実験報告書を読んで、後者に対する効果を試験することに何かメリットがあるのではないかと考えた。1978年7月、キャンベル博士はイベルメクチン(コード化されたサンプル)を馬の試験結果とともに、オーストラリアのTDRが支援する第三次家畜スクリーニングに送りました。1978年11月に得られた結果によると、イベルメクチンは「O. gibsoniとO. gutturosaの両方の特許感染を防ぐのに非常に効果的」であることが示された。このことから、キャンベルはイベルメクチンがヒトのオンコセルカ症に有効であるとの考えを強めた。その結果、キャンベルは12月にメルク研究所の研究管理評議会に「アベルメクチンがオンコセルカ症に伴う失明を予防する最初の手段になる可能性がある」と提案し、「医学的、政治的、商業的な観点からこの問題に対する最も適切なアプローチを決定するためにWHOの代表者と議論を行う」ことを提案した27,28) 。
イベルメクチンに関する最初のデータに対する TDR の反応は、特にマクロ殺虫剤を探していたことと、イベルメクチンが成虫にはほとんど影響を与えないように見えたことから、むしろ穏やかなものであった。1979年後半、TDRの関係者がメルクを訪問し、メルクのイベルメクチン研究にTDRが技術的に貢献することになったが、ヒトのオンコセルカ症に使用するためのイベルメクチンの開発に向けた共同研究については、その後の議論はなされなかった。
幸いなことに、1980年1月、メルクは単独で第I相(安全性)試験に進むことを決定した。イベルメクチンの臨床試験は1981年に開始され、セネガルで32人の患者を対象とした第I相試験が行われ、その後パリで西アフリカからの移民20人を対象とした別の試験が行われた。これらの試験はメルクが独自に組織し、資金を提供しており、スタッフのモハメド・アジズ博士(以前はWHOに所属していた)が、温情的献身的な推進力となった。アジズ博士は、安全性を第一に考えてセネガルでの試験を開始した。最初は5μg/kgの非常に低い用量から始め、30μg/kgのイベルメクチンの単回投与で皮膚のミクロフィラリアの数を大幅に減少させることを発見した。また、その効果は少なくとも6ヶ月間持続し、重篤な有害事象は観察されなかったことも確認された。その後のパリでの研究では、これらの結果が確認され、200 µg/kg までの用量は忍容性が高いことが示された29,30) 。
1982 年、メルクの関係者が第 1 相試験の結果を発表するために TDR と OCP を訪問したとき、それぞれの側が計り知れない可能性を認識し、本格的な協力関係が始まりました。
証拠は、イベルメクチンが本当にオンコセルカ症の有効な治療法であることが証明されるのではないかという、お互いの不安、疑念、そして希望を共有する複雑な環境の中で、これらの主要なパートナー間の協力関係が始まったことを示唆している。この状況は、メルクがイベルメクチンを個々の患者の治療に使用される可能性のある商用製品と見なし、その投資からの収益を常に求めて前進していたことによって、さらに複雑なものとなってた。一方、TDRとOCPは、寄生虫の感染を阻止し、それによって風土病の蔓延地域における本疾患の蔓延を減少させることができる新しいコミュニティレベルのツールとしてイベルメクチンを捉えていた。TDRとOCPは、商業的パートナーが好む病院での個別治療とは対照的に、フィールド条件下でのコミュニティベースの試験を大量治療プログラムに向けた重要なステップと考えた。薬剤のコストに関する継続的な交渉は、最終的にメルク社が1985年7月に、メルク社の利益に合致した十分な量と可能な限り低い価格で供給することを約束し、後に「…政府や患者がオンコセルカ症の治療のためにコストをかけずに利用できるようにする」ことを確認する結果となった31)。
イベルメクチンのヒト用正式登録に関しては、単発患者へのアプローチを重視したメルクが独自に進め、最初の1,206人のオンコセルカ症患者を対象とした研究のみに基づいて1987年にフランス保健当局に申請を行い、その年のうちに承認が下りることを期待していたが、その後承認された24,32) 。
登録に先立ち、TDRとOCPは、地域社会の治療プログラムにおけるイベルメクチンの有効性について、非常に高額で大規模な試験を含む実地試験を実施し、治療費を許容できるレベルに引き下げるためにたゆまぬ運動を展開したことで、TDRとOCPの関与が大幅に増加した。フィールドでの薬剤の有効性を試験するための試験(1983年に開始された第II相試験)の間、メルクは、OCPとTDRからの追加の財政支援を受けながら、試験の多くに資金を提供し続けた。幸いなことに、TDRの既存の国際的なネットワークがあったため、メルクはアフリカや南米での活動を行う研究者や機関との間で、実行可能な関係を築くことができた。TDR はまた、試験プロトコルの設計に影響を与え、メルクの専門センターの一つであるガーナのタマレにあるオンコセルカ症化学療法研究センター(OCRC)でのオンコセルカ症治療に関する応用研究を支援することもできた(Kwable Awadzi 博士は、一般的に観察される反応のスコアリングシステムを用いてマイクロフィラリシドに対する臨床反応を定量化する方法を考案していた33)。 これにより、共通の指標を用いてすべての化合物の全身反応の程度を比較することが可能となり、最終的には安全で効果の高いマイクロフィラリア剤としてのイベルメクチンの有望性が確認された。
1987年から 1989年の間に13のコミュニティレベル(第IV相)試験が実施され、12万回以上のイベルメクチンの個別投与が行われた。13のコミュニティ試験のうち、TDRはリベリア、カメルーン、マラウイ、グアテマラ、ナイジェリアの5つの試験に資金を提供し、合計235万米ドルを支出した。この間、TDRは年間予算総額の25~35%をイベルメクチンに関するすべてのフィラリア症研究に費やしていた。OCPは、ガーナ、マリ、トーゴ、ベナン、コートジボワール、ギニア、ブルキナファソ、セネガルの8つの研究に資金を提供した。民間企業であるメルクが、ヒト用イベルメクチンの開発にどのような貢献をしたかは、相当なものではあるものの、不明のままである。
イベルメクチンによるオンコセルカ症治療の利点
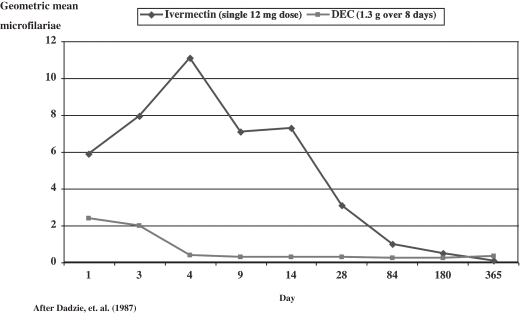
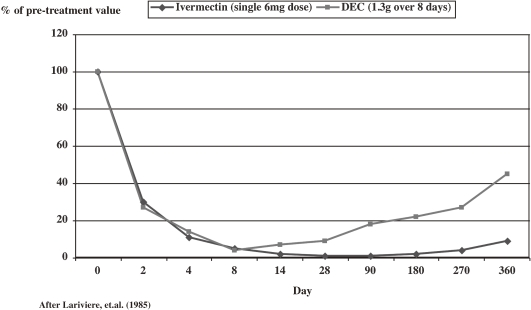
イベルメクチンは、皮膚のミクロフィラリアに起因する皮膚損傷と、目のミクロフィラリアに起因する眼球損傷の 2 つの主な症状を持つオンコセルカ症と闘うために、事実上、専用に作られていることが証明された。イベルメクチンが登場するまでは、DECがオンコセルカ症の治療薬として伝統的に使用されていたが、イベルメクチンには欠点があった。DECは迅速に作用して眼球前室からミクロフィラリアを除去し、1年以上にわたって眼球の透明性を維持する。しかし、クリアランスの速さゆえに、炎症反応が過剰になり眼障害を起こすことが多い。逆に、イベルメクチンは、治療時に眼球内のミクロフィラリアをわずかに増加させ、その後、徐々に減少し、6ヶ月以内にDECと同様にゼロに近い値に達することが証明された(図4 ).4 )。最も重要なことは、結果として生じる眼障害がほとんど、あるいは全くないことである。DECとは異なり、大環状ラクトンであるイベメクチンの分子サイズが大きいために、血液・水溶液のバリアーを越えて前室に入ることができず、ミクロフィラリアに直接作用すると考えられている34) 。
図4 イベルメクチンとジエチルカルバマジン(DEC)の眼球前室のミクロフィラリアに対する効果
同様に、DECとイベルメクチンの真皮ミクロフィラリアに対する影響を評価したところ、両方とも治療後2日以内にほぼ完全なクリアランスを引き起こし、8日以内に負荷を実質的にゼロにまで減少させることが確認された。しかし,両剤ともミクロフィラリアの再出現を長期的に抑制する効果はあるものの,イベルメクチンの方が優れており,実質的にミクロフィラリアを完全に除去し,その状態を約 90 日間維持するのに対し,DEC は 1 週間強で効果が薄れてしまう(図 5 ).このように、イベルメクチンは皮膚病にも理想的な治療法である35) 。オンコセルカ症に完全に適合しているだけでなく、イベルメクチンは他の疾患にも「不思議な薬」として発展している。
図5 皮膚のミクロフィラリアに対するイベルメクチンおよびジエチルカルバマジン(DEC)の効果
他のフィラリア疾患に対する効果
リンパ系フィラリア症は、エレファンティ病としても知られており、80カ国以上で10億人以上の人々を脅かす壊滅的で非常に衰弱した病気である。1億2千万人以上が感染しており、そのうち4千万人が重度の障害を負ったり、体調を崩したりしている。この病気は、Wuchereria bancrofti、Brugia malayi、またはB. timoriというフィラリア原虫に感染することで発症する。この寄生虫は、感染した蚊に刺されることで人に感染し、リンパ管内で成虫に成長し、重度の損傷や腫れ(リンパ浮腫)を引き起こす(図6)。成虫は病気の主な症状の原因となっているが、最も外見的に見えるのは、痛みを伴う足や生殖器の腫れです(図7).7 。この病気に関連した心理的・社会的な汚名は、経済的・生産的損失と同様に計り知れない。
図6 ウクレレリア・バンクロフティのライフサイクル
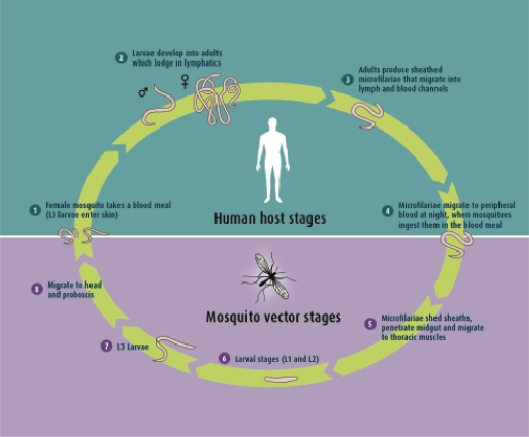
図7 ガーナ:オンコセルカ症とリンパ系フィラリア症を併発した老人

右足にミミズ結節、左足にヒョウ皮がある。左足に象皮症を呈し,大きな水頭症を呈している.Credit line. WHO/TDR/Crump.
リンパ系フィラリア症に対するイベルメクチンの使用に関しては、ここでもメルクが最初の主導権を握り、TDRは研究と臨床試験の組織化、拡大、拡大に関与した。1980年代半ばには、イベルメクチンがオンコセルカ症の治療薬としてヒトへの使用が承認される前に、メルクはリンパ系フィラリア症に対するイベルメクチンの影響を測定し、最適な治療量を見つけるための試験も行っていた36)。一方、TDRはブラジル、中国、ハイチ、インド、インドネシア、マレーシア、パプアニューギニア、スリランカ、タヒチで、イベルメクチン、既存の治療薬であるDEC、および両者の組み合わせを評価するための多施設でのフィールド試験を実施していた。その結果、単回投与のイベルメクチンと単回投与のDECは互いに同等の効果を示した。併用は低用量でもさらに効果的であり,1年後には99%,2年後には96%のミクロフィラリア密度の低下が確認された20,37-39) 。DECは成虫の寄生虫を殺すのにも有効であることがわかった。
これらの知見にもかかわらず、イベルメクチンは数年間、リンパ系フィラリア症の治療薬として登録されていなかった。実際、フランス当局から登録が下りるのは1998年になってからでした。数年前、SmithKlineBeecham社(現GlaxoSmithKline – GSK)が製造したアルベンダゾールもまた、未熟なミミズと成虫の両方を殺すのに有効であることが示されていた。実際、現場試験では、アルベンダゾールと DEC またはイベルメクチンを年 1 回組み合わせて使用すると、治療後少なくとも 1 年間は血液中のミクロフィラリアを駆除するのに 99% の効果があることが確認されている。したがって、感染コミュニティの治療の第一の目標は、感染者の血液中からマイクロフィラリアを排除して感染の伝播を阻止することになった。これは、GSK社がアルベンダゾールの提供に同意したおかげで、この病気を実際に撲滅することが可能になった。1997年、WHOは診断と治療の進歩を受けて、リンパ系フィラリア症を6つの「根絶可能」または「根絶可能性のある」感染症の1つに分類し、加盟国に対し、リンパ系フィラリア症を公衆衛生上の問題として根絶するための措置を開始するよう要請した40) 。その後、1999/2000年にはWHOがリンパ系フィラリア症撲滅世界プログラム(GPELF)を立ち上げた。
要約すると、ヒトのオンコセルカ症の治療薬としてのイベルメクチンのビジョンは、メルクの研究チームから生まれた。TDRは、潜在的な抗オンコセルカフィラリア症薬を特定するための有効なツールがないことを最初に認識し、製薬会社と積極的に関わり、動物モデルやスクリーニングシステムを構築して資金を提供し、研究者や研究機関の国際的なネットワークを動員して関与することで、このビジョンの実現を促進した。熱帯病の研究を調整し、資金を提供することを使命とする国際機関としてのTDRのユニークな立場は、メルクの化合物をアフリカやその他の地域での現場での使用を容易にし、それを可能にした。
作用機序
当初、イベルメクチンの開発に取り組んでいた研究者は、イベルメクチンが神経伝達物質を遮断し、GABAを介したCl-チャネルに作用し、無脊椎動物や哺乳類のGABA受容体を強力に破壊すると考えてた。GABAは、線虫の体性神経筋系における主要な抑制性神経伝達物質として認識されている。その後、イベルメクチンや関連薬剤の標的となるのは、実際にはグルタミン酸チャネル(GUCl-)であることが発見された。イベルメクチンは、線虫では体壁や咽頭筋を麻痺させるが、哺乳類では血液脳関門を越えてGABA受容体のある哺乳類の中枢神経系に入ることができないため、そのような影響を与えることはない。長い間、イベルメクチンは 5 歳未満の子供や体重が 5 kg 未満の子供には禁忌であると考えられてたが、これは神経毒性の恐れがあり、まだ完全には開発されていない血液/脳関門を通過できる可能性があるからである。しかし、おそらくそうではないという証拠が出てきている。)
ヒトの体内では、イベルメクチンはまだ十分に理解されていない特異な効果を発揮する。フィラリア感染に対する免疫反応は複雑で、感染性のL3幼虫やミクロフィラリアに対抗するTh2型システムが関与しているが、成虫の抵抗にはTh1とTh2の組み合わせが関与している。雌の成虫は、おそらくインターロイキン10(IL-10)レベルを介して免疫調節環境を操作し、ミクロフィラリアの子孫の生存を確保することができると考えられている45) 。イベルメクチンは比較的迅速に効果を発揮し、効果が長く持続すると同時に、成虫のメスが追加のミクロフィラリアを放出するのを抑制する。) 皮膚ミクロフィラリア負荷は一般的に、治療後2日以内に78%、2週間後には約98%減少する。彼らは約12ヶ月間、非常に低いレベルにとどまり、雌のワームの70%が治療後3-4ヶ月後にゆっくりとミクロフィラリアの生産を再開するが、元の生産の35%を不可逆的に減少させた47)。) イベルメクチンを定期的に投与することにより,感染症の発生率が低下し,感染が中断され,罹患率や障害が軽減されることが期待されている48) 。しかし,イベルメクチンがオンコナラ菌のミクロフィラリアに効果を発揮する実際のメカニズムは不明である48) 。しかし、培養においては、薬理学的に関連する濃度で投与した場合、イベルメクチンはミクロフィラリアにはほとんど直接的な影響を及ぼさない。現在では、イベルメクトは実際に宿主と寄生虫の基本的な平衡を破壊していると考えられている。イベルメクチンのヒトにおける半減期は 12-36 時間であるが、代謝物は最大 3 日間持続する可能性がある。経皮ミクロフィラリアの最低レベルはこの時間枠の後に十分に発生するため、イベルメクチンの影響を受けたすべてのミクロフィラリアが最初の数日で死滅するわけではないことを示唆している。このことは、イベルメクチンの投与後、ミクロフィラリアが真皮の深部層、皮下脂肪、結合組織、リンパ節に移動したという報告からも裏付けられている49) 。 最近発表された研究では、GUCl 活性はミクロフィラリアの排泄分泌小胞(ES)小胞を取り囲む筋組織にのみ発現しており、ES 小胞に由来するあらゆる化合物がこの活性によって制御されていることが示唆されている。イベルメクチンを添加すると、ミクロフィラリアの ES から放出されるタンパク質(寄生虫が宿主の免疫系から逃れるのを助ける役割を果たすと推測されている)の量が著しく減少する51) 。イベルメクチン治療後のミクロフィラリアの迅速なクリアランスは、薬剤の直接的な影響によるものではなく、宿主の自然免疫防御機構を回避することを可能にするタンパク質を分泌する寄生虫の能力を抑制することによってもたらされるという理論を支持する証拠が増えてきている。
動物モデルでは、Th2応答がL3感染幼虫とミクロフィラリア段階の両方に対して防御免疫を植え付けることが結論的に示されているが、寄生虫は一般的にこれらの応答を回避することができることが示されている。このことは、このプロセスのより包括的な理解が確立されれば、効果的なワクチンの開発が可能になる可能性があることを示している52) 。この概要は、20年以上の定期的なイベルメクチン治療にさらされている個体の寄生虫において、薬剤耐性の発現がないか、あるいは比較的遅いことを説明するのに役立つかもしれない。
薬剤耐性
イベルメクチンの使用が動物の健康のために普及して間もなく、イベルメクチンの耐性が最初は小型反芻動物に現れ始めたが、より顕著に牛の寄生虫、特にCooperia spp.53) にも現れるようになった。イベルメクチンに対する高レベルの耐性が、自由に生きている線虫(Caenorhabditis elegans)に現れることはよく知られている54) 。ありがたいことに、世界中で30年間にわたって継続的に使用されているにもかかわらず、イヌの心臓虫やイヌのStrongyloides寄生虫での耐性の報告はない。さらに重要なことは、ヒトでは約22年間にわたって継続的に単剤療法が行われてきたにもかかわらず、オンコセルカ・ボルブルスにおける耐性の説得力のある証拠はまだ発見されていないことである。)
新しい地平線
イベルメクチンは、人間に使用しても驚くほど安全であることが常に証明されている。実際、イベルメクチンは副作用の少ない安全な薬であるため、医療従事者でなくても、遠隔地の農村地域でも、基本的な適切な訓練を受けていれば、文盲であっても投与することが可能である。この事実は、この薬が世界中の人間の健康と福祉、特にオンコセルカ症と闘うためのキャンペーンに関して、他に類を見ない有益な影響を与えていることに貢献している57)。
今日、イベルメクチンは、ストロンギロイディア症(毎年約 3,500 万人が感染している)疥癬(毎年 3 億人が感染している)ペディキュラ症、 Gnathostomiasis、Myisis などのヒトの他の病気と闘うために世界中で使用されるようになっており、イベルメクチンや他のアベルメクチン誘導体の新たな有望な特性や用途が発見され続けている58) 。 これらには、無視されてきたもう一つの熱帯病であるリーシュマニア症に対する活性が含まれている59,60) 。イベルメクチンを用いたオンコセルカ症の長期治療に関する研究では、イベルメクチンの使用が、土壌伝染性蠕虫寄生虫(アスカリス、トリキュリス、鉤虫を含む)への感染の有病率の有意な減少と関連していることが示されており、これらのほとんどまたはすべてが幼児期の栄養不良や成長不良から生じる罹患率の主な原因であると考えられている61)。 また、頭ジラミの有病率は、イベルメクチン錠を服用している小児において著しく減少していることが知られている62) 、疥癬は定期的に服用している集団において著しく減少している63)。何よりも、イベルメクチンは世界の農村部の貧しい人々に選ばれる薬であることが証明されている。熱帯地域の多くの恵まれない地域では、腸管ミミズと寄生性皮膚疾患が極めて一般的であり、重大な罹患率と関連している。通常、これらの寄生虫は共存しており、多くの人が外寄生虫と内寄生虫の両方に感染している64,65) 。多種類の寄生虫に感染した集団を大量に治療することが最善の対策と考えられており、イベルメクチンはそのような介入に理想的な薬剤である。ブラジルで行われた最近の研究では、地元産のイベルメクチンを使用して、内部の蠕虫や寄生性皮膚疾患への影響を調べた。研究者たちは、「イベルメクチンによる大量治療は、ブラジル北東部の貧しいコミュニティでパンデミックしている寄生虫疾患のほとんどの有病率を減少させる効果的かつ安全な手段であった」と結論づけた。治療効果は長期にわたって持続した」と述べている。この研究は、従来のメーカーであるメルク社が製造していなかったイベルメクチンを用いた人間の医療介入の最初の報告でもある。Inc.が製造していなかったイベルメクチンを用いた初めての医学的介入の報告でもある。)
実際には、過去30年間でますます明らかになった製薬業界の関与を含む熱帯病との戦いへの新たな関心は、何十億人もの人々、特に話題の貧困層や恵まれない人々の命を救い、福祉を向上させていたが、1987年のヒトへの使用のためのイベルメクチンの導入にまで遡ることができる。最近の報告書によると、国際製薬団体連合会(IFPMA)のデータによると 2000年から 2007年の間に世界の製薬業界は、健康への介入(医薬品と機器)だけで92億ドル以上を提供し、世界中の17.5億人に利益をもたらしたことが示されている67) 。
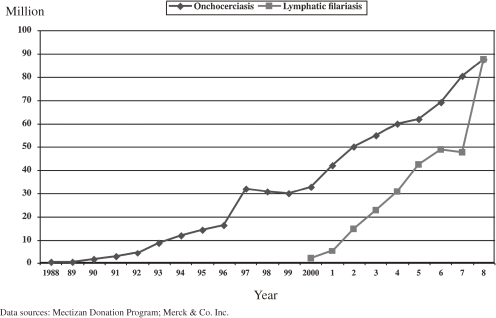
メクチザン寄贈プログラムの開始以来、メルクはオンコセルカ症治療のために25億錠以上のメクチザン®錠を寄贈し、7億錠以上の治療が承認されている。現在、アフリカ、ラテンアメリカ、イエメンでは、年間約8,000万人から9,000万人がMDAを通じてこの薬を服用している。リンパ系フィラリア症に対しては、さらに3億件の治療が承認されており、年間約9,000万件の治療が行われている(図8)。現在、オンコセルカ症には33カ国、リンパ系フィラリア症には15カ国がイベルメクチンの投与を受けている。その結果、これまでに約40億米ドル相当のイベルメクチン錠が寄贈されている。2010,エクアドルはアメリカ大陸で2番目にリバーブラインドネスの感染を阻止した国となった。2012年までに西半球での感染を止めることが期待されているが、これはイベルメクチンを年2回投与するMDAのおかげで達成された目標である。リンパ系フィラリア症は2020年までに世界的に撲滅されることを目標としており、順調にいけばアフリカからオンコセルカ症が撲滅されるかもしれない。
図8 承認されたイベルメクチン治療薬の推移(1988年~2008年)
イベルメクチンが日本の土壌に誕生してから、これまでの道のりは長く険しいものであった。幸いなことに、ほとんどの抗生物質とは逆に、数十年にわたって単剤治療が行われ、一部の個体では時折最適ではない反応が観察されているにもかかわらず、ヒトのオンコッカール寄生虫において薬剤耐性が発現しているという決定的な証拠はない。当然のことながら、世界中の公衆衛生の専門家は、イベルメクチンのより広範な使用を求めている68) 。これを受けて、北里研究所では、現行のイベルメクチン単剤療法に対する抵抗性が現在進行中の病気の撲滅活動を脅かすことになった場合に備えて、イベルメクチン類似体のすべての特性と可能性を個別に、または組み合わせて調査するためのグローバルな共同研究を開始した。
謝辞
W.C. Campbell教授には、本論文の草稿を批判的に読んでいただき、建設的なコメントをいただいたことを含め、貴重な長期にわたる共同研究を行っていただいた。
プロフィール
北里大学名誉教授、天然物からの創薬プロジェクト特別コーディネーター。1935年生まれ。1968年に東京大学で薬学博士号、1970年に東京理科大学で化学博士号を取得。米国ウェスリアン大学客員教授を経て、1975年に北里研究所に戻り、北里大学薬学部教授に就任。1990年から 2008年まで北里研究所理事長を務めた。研究テーマは、微生物からの有用化合物の発見、新規マクロライド系抗生物質の生合成およびハイブリッド生合成、Streptomyces avermectiniusの育種、遺伝子解析、マッピング、新規半合成マクロライドの合成、新規化合物の有機合成などである。これまでに400種類以上の新しい化学物質を発見し、そのうちのいくつかは、世界中の何十億人もの人々の生活と福祉を向上させた代表的な医薬品となっている。日本学士院賞(1990年)ACS中西賞(2000年)ACSアーネスト・グエンター賞(2005年)ICID浜尾梅沢記念賞(2007年)テトラヘドロン賞(2010)など国内外の賞を受賞。ドイツ科学アカデミーレオポルディナ(1992年)アメリカ国立科学アカデミー(1999年)日本アカデミー(2001年)フランス科学アカデミー(2002年)ロシア科学アカデミー(2004年)中国工学院(2005)の会員であり、英国王立化学会名誉会員(2006)。
アンディ・クランプは英国生まれで、英国と米国の大学で生物科学と生態学/人類学の学位を取得して卒業した。アメリカでの最初の生物学的研究は、宇宙飛行のために人間を凍結させて蘇生させる可能性の調査の一環として、国立科学財団から資金提供を受けて、昆虫の耐寒性と過冷却に焦点を当てたものであった。その後、アメリカで教鞭をとり、環境影響評価の仕事をした後、ロンドンのインペリアル・カレッジの生物学者として数年間、英国政府の支援を受けたプロジェクトでツェツェバエの行動と生物防除の研究に従事した。それ以来、ヨーロッパ、北米、アフリカ、アジア、太平洋諸島の数カ国を旅し、観察し、報告していた。
そのキャリアの中で、30年以上にわたり、ビジュアルと文化的リテラシーに特に関心を持ち、コミュニケーションと情報デザインのあらゆる面で専門知識を開発することに専念してきた。彼はアジア、アフリカ、ラテンアメリカ、オセアニアで多くのビデオ、写真、ジャーナリズムのミッションを実施していた。その中には、ロンドンのパノス研究所(1988)の視聴覚コンポーネントの立ち上げの支援を依頼された後に実施されたものや、ジュネーブのWHOのTDRイメージ・ライブラリー(1991)も含まれている。著名な作家でありプロデューサーでもある彼のコミュニケーション、特に科学と健康の分野での仕事は多岐にわたっている。パノス研究所に在籍していた10年以上の間、ユニセフ/UNDP/世界銀行/WHOの熱帯病研究・訓練特別プログラム(TDR)や様々なクライアントのために、彼の仕事は、コンセプトの策定、調査、執筆、スクリプト作成、そして幅広い範囲の書籍や記事の制作に及んできた。科学雑誌、一般紙、参考書、技術雑誌、視聴覚メディアなどの幅広い普及オプションを活用して、あらゆる種類の、さまざまなレベルの視聴者に科学情報を普及させることを目的として、マルチメディア製品やインタラクティブなパッケージを制作している。また、フォトジャーナリズムのプレゼンテーション、展示会、様々な電子出版活動(ビデオ、テレビ、CD-ROM、ウェブサイトのプロジェクトを含む)も行っている。クライアントにはNGO、産業界、学術界、国連機関、EUなどが含まれる。2004年に東京に移住し、北里研究所、北里大学に関わる。現在は、日本初のサイエンス・コミュニケーション講座を導入した北里大学や慶應義塾大学で講義を担当し、複数の国連機関をはじめとする多くの国際的なパートナーやクライアントとの仕事を続け、国際的なパートナーシップを生み出し続けている。
