Contents
Ivermectin for COVID-19 treatment: clinical response at quasi-threshold doses via hypothesized alleviation of CD147-mediated vascular occlusion
papers.ssrn.com/sol3/papers.cfm?abstract_id=3636557
デイビッド・E・シャイム
概要
COVID-19 パンデミックの世界的な広がりにより、SARS-CoV-2 ウイルスに対する活性が確認されている既存の薬剤の臨床試験が進められている。そのような抗マラリア薬の中には,ノーベル賞を受賞した大環状ラクトンであるイベルメクチン(IVM)がある。フロリダ州の4つの病院で、COVID-19患者173人を対象に200μg/kgのIVMを投与した研究では、107人の対照群と比較して死亡率が40%減少した(15.0%対25.2%、p=0.03)。重度の肺疾患を有する患者では、IVM投与により死亡率が52%減少した(38.8%対80.7%、p=0.001)。酸素状態が急速に悪化している患者では、安定化し、その後1~2日で改善することが多かった。
高用量のIVMを投与することで、臨床上の有益性が飛躍的に高まる可能性が提案されている。いくつかの臨床試験では、フロイダ試験の10倍の2,000μg/kgまでのIVMが忍容性を示した。IVMがSARS-CoV-2スパイク蛋白質を遮蔽し、このスパイク蛋白質がCD147膜貫通型受容体およびACE2に結合することを示す研究結果に基づいて、用量反応性の大幅な向上の可能性が評価されている。赤血球上のCD147の豊富な分布は、赤血球が他の赤血球、血小板、白血球、毛細血管壁にウイルスを介して結合することで血流が阻害され、その結果、COVID-19の主要な病的疾患の根底にあると考えられる「キャッチ」と「クランプ」の枠組みを示唆している。
COVID-19のキャッチ&クランプシナリオは、CD147が感染プロセスの中心にあるマラリアにおいても平行して提案されている。重症マラリアの中核的な罹患率は、感染した赤血球を中心とした内皮への同様の塊や癒着によって引き起こされる。COVID-19も同様に、A群またはB群対O群では、重症マラリアの発生率がはるかに高くなっている。この仮説のもとでは、若年者の毛細血管流量が有意に高いと、COIVD-19の重症度の低下を説明できる可能性がある。この仮説とそれに関連して、例えば、COVID-19患者のIVM摂取前後の血流をネイルフォールド毛細血管鏡を用いてモニターすることで、IVMの用量反応性が大幅に向上する可能性を検証することができた。
キーワード
SARS-CoV-2 SARS-CoV-2; COVID-19; イベルメクチン; CD147; Basigin; BSG; EMMPRIN; 赤血球; RBC; 赤血球; ヘマグルチン化; スパイク糖タンパク質; ACE2; ヒドロキシクロロキン; クロロキン; アジスロマイシン; ドキシサイクリン。
序論
イベルメクチン(IVM)は、マラリアに対して活性のあるいくつかの薬剤の一つであり、他にもクロロキン(クロロキン)ヒドロキシクロロキン( ヒドロキシクロロキン)アジスロマイシン(AZ)ドキシサイクリン1-7などがあり、これらの薬剤はSARS-CoV-2,3,7,8 SARS-CoV-19-13や他のウイルスに対しても試験管内試験で阻害活性を示している14-20。COVID-19の治療に使用された最初の薬剤は、中国21,韓国22,およびフランス南東部のマルセイユにあるCOVID-19治療の主要病院23-25で、クロロキンとその水酸基誘導体 ヒドロキシクロロキンであった。これらの臨床応用に関連したクロロキンおよび ヒドロキシクロロキンの研究により、以下に考察するようにCOVID-19とマラリアとの関連性が明らかになり、IVMの生物学的メカニズムの可能性についての洞察が得られた。
マルセイユでの COVID-19 治療では、 ヒドロキシクロロキン が AZ とともに使用された23-25 。この組み合わせによる SARS-CoV-2 に対する相乗効果は、臨床肺組織レベルで試験管内で確立されていた26 。32 経口摂取後、これらは急速に組織に吸収され、酸性の細胞内リソソームおよびエンドソームに隔離される1,32-39。これらのアルカリ剤はこれらの小器官のpHを上昇させ、標的細胞へのSARS-CoV-2ウイルスのエンドサイトーシスを阻害する11,12,14-16,40-45。32,33,35-37,46-49 1日の最大安全用量では、32,35,48,50 有効な抗ウイルス組織レベルの蓄積には5-10日が必要である51 。
COVID-19の患者84人のうち、 ヒドロキシクロロキンとAZを併用して治療した1例では、11%に有意なQTc延長がみられたが、TdP不整脈や心臓関連死は認められなかった。米国心臓協会の臨床循環器評議会のタスクフォースは、「クロロキンは世界中で数億経過が使用されており、世界保健機関(WHO)のモニタリング下では不整脈死の報告がなく、歴史上最も広く使用されている薬剤の1つである」と指摘している61。
イベルメクチン(IVM):臨床転帰、薬理学、最大許容用量
IVM は、河川盲目症やその他の寄生虫疾患、疥癬、マラリアなどの治療に世界中で何億もの症例に使用されている多面的な薬剤である62 。63 COVID-19に対する臨床効果は、フロリダ州の4つの病院で実施されたSARS-CoV-2感染が確認された連続入院患者を対象としたレトロスペクティブコホート研究で検証された。対照群(n=107)は通常のケアを受けた。ほとんどの患者はAZの併用または非併用の ヒドロキシクロロキンも受けており、対照群ではどちらか一方または両方を受けている割合が高かった。IVMコホートでは高血圧の有病率が高かった以外は、年齢、人種、合併症に有意差はなかった。
全死亡率はIVM群で15%であり、対照群の25.2%と比較して40%減少した(p=0.03)。重度の肺疾患(酸素濃度50%以上の酸素投与または人工呼吸)を有する75人の患者(n=46)の死亡率は38.8%で、対照群(n=29)の80.7%の死亡率よりも52%低かった(p=0.001)。安定化とその後の改善は、室内空気から補助酸素を最大50%混合(FiO2≦0.5)で急速に悪化していた患者でも、1-2日で進行することが多かった。
これらのフロリダの患者における酸素状態の低下が1-2日で逆転したことは、経口投与されたIVMが急速に吸収され、組織に分配されたことと一致している。経口摂取後、IVMの血中濃度62,66-74および体内組織中の分布75-77は、通常、経口投与後4-8時間以内にピークレベルに達する。68,69,71,72,78 しかし、抗原性作用は、IVM の単回投与から数日後に観察されており、66,68,79,80 は、IVM の主要代謝物の半減期が 4 倍の約 3 日間であることと一致している。
COVID-19の臨床的有用性は、IVMの高用量またはそれ以上の用量を投与することで向上する可能性があると考えられている。しかし、IVMの血漿中濃度が1.7mg/kgまでの経口投与量に比例していること69,81や、抗ウイルス剤のいくつかの研究では投与量に対する反応が直線的であるか、場合によってはより強固な相関関係を示していることを考えると、この可能性は実現可能である82-84。この 200μg/kg の標準用量は、例えば河川盲目症では年に 1 回から 3 回2,85,疥癬では 1 週間に 2 回投与されている86 。最高用量である120mg(2,000μg/kgまで)を1回、または180mg(3,000μg/kgまで)を1週間かけて分割して投与したある臨床研究では、IVMの忍容性は概ね良好であり、これらの最高用量との間に有害事象の差は見られなかった。
同様に、IVM は 800 µg/kg の単回投与で87,12 週間投与で 1,600 µg/kg88,13 日間投与で 1,600 µg/kg の忍容性を示した。86 IVM の臨床経験のメタアナリシスでは、最大 800 µg/kg の用量と標準用量との間に有害事象の頻度や強度に有意な差は見られなかった。69,70,93 しかし、COVID-19,94の一部の症例では血液脳関門が危険にさらされている可能性があるため、健常者には安全と思われる1,000~2,000μg/kgのIVMの最も積極的な投与量範囲が、この疾患の患者には適切ではないかもしれない。
CD147受容体:SARS-CoV-2ウイルスとマラリア寄生虫の赤血球接着の鍵を握る
COVID-19に対する反応を改善するためにIVMをより積極的に投与する可能性があるかどうかは、IVMがどのような病的疾患を標的とし、どのような生物学的メカニズムに基づいているかにかかっている。これらの病因や機序を考慮することは、この疾患の特徴である呼吸器系と循環器系という二重の感染標的によって混乱を招くことになる。SARS-CoV-2は、前身のSARS-CoV-1,95と同様に、呼吸器系に感染の足場と複製の拠点を得ており、肺が重要な標的となっている96,97。109-111 循環器系の損傷もまた、血管内血栓や末梢性虚血などの特徴を持つ多くの患者に見られる。
SARS-CoV-2に対するIVMの活性のメカニズムとして当初提案されていたのは、インポーチンα/βタンパク質による核輸送の阻害であった8,19,117 。しかしながら、SARS-CoV-2核カプシドタンパク質が感染細胞の核や核小体に局在するかどうかと同様に、臨床組織レベルでのこの効果の適用性には疑問が残る74,118 。このようなIVMのもう一つの可能性は、SARS-CoV-2スパイク蛋白質を宿主細胞の受容体から遮蔽する可能性について100種類以上の薬剤を選択して評価した分子モデリング研究から明らかになった121 。
これらの知見と一致するように、スペインの17の病院でCOVID-19陽性と判定された1735人のCOVID-19患者にヘパリンを投与したところ、死亡率が45%低い340人の対照群に対し、年齢および性別調整後の死亡率オッズ比は0.55であった122。別の研究では、入院中のCOVID-19患者27人に高用量ヘパリンとAZを投与し、そのうち8人は人工呼吸を行っていたが、退院率は81%であり、追跡評価時の死亡はなかった112。しかし、ヘパリンの抗血栓作用は、これらの結果の解釈を混乱させる。また、これらの知見と一致しているのは、同定された最も効率的なSARS-CoV-2ウイルス遮蔽剤であるAZが、試験管内試験および臨床で抗SARS-CoV-2活性を示していることである3,23。
COVID-19の謎に包まれたある側面は、SARS-CoV-2ウイルスとそのスパイク蛋白質から、宿主細胞とその結合部位へと検査の焦点を移すものである。重篤な状態に進行した患者は、発症から約1週間後に急激に酸素状態が低下することが多いのはなぜであろうか?123 酸素状態が急激に低下していたフロリダ州の患者で、IVMを服用してから 24~48時間という比較的短い期間で安定化し、改善したのはなぜであろうか?血液型O群と若年層でCOVID-19の発生率が低下した理由は何であろうか?
COVID-19のこれらの謎に満ちた側面は、上述したように、この呼吸器系疾患に関連した血液に関連した主要な病的疾患の謎をさらに複雑にしている。99 この疾患の血液に関連した特徴についての好奇心を高めているのは、マルセイユの研究チームの研究者が、試験管内で試験した抗マラリア薬のほとんどがSARS-CoV-2ウイルスに対して活性を示すことを観察したことである。実際、COVID-19とマラリアとの間には、血液細胞99,130,特に赤血球に高密度に分布するCD147膜貫通型受容体129を中心とした特異的な関連性があることがわかっている131。SARS-CoV-2 の宿主細胞への結合と浸透の両方の場所を提供する ACE2 受容体に加えて、CD147 受容体(Basigin、BSG、EMMPRIN とも呼ばれる)は、ウイルスが結合するだけで血管系に大惨事を引き起こすことができる可能性がある。
マラリアの感染過程の鍵を握るのは、マラリア原虫による宿主の赤血球への浸透であり、これはこの小さな1細胞生物の表面タンパク質によって促進される。試験したすべての P. falci arum 株について、特定のリガンドと受容体のペア、寄生虫のリガンド pfRh5 と赤血球上の膜貫通受容体 CD147 は、寄生虫が宿主赤血球に結合するために不可欠であることが判明した134,135。試験管内試験ではCD147アンタゴニストが赤血球への寄生虫の浸潤をブロックし134,生体内試験では、組換え抗CD147抗体が確立したマラリア感染症を明らかな毒性を持たずにクリアした135,136。
この同じ膜貫通型受容体である CD147 は、ACE2 とともに SARS-CoV-2 スパイクタンパク質の重要な結合部位であることが確認されている。137 この CD147 へのウイルスの結合は、表面プラズモン共鳴および ELISA アッセイ法により、また抗 CD147 抗体による 試験管内試験 での SARS-CoV-2 の競合的阻害により実証されている。CD147 と結合して活性化するシクロフィリン A および B は、SARS-CoV-2 スパイクタンパク質に結合する際に CD147 の結合パートナーとしても機能する可能性がある。SARS-CoV-2 スパイクタンパク質の分子の CD147 への結合親和性は ACE2 の 12 倍、弱いが、宿主細胞上での CD147 の表面密度(例えば、RBC131 あたり 1,695 個、すべての cll 型での ACE2 の密度99,139,140 に対し数桁低い)は、大きな結合親和性を持つ複数の結合を可能にしていると考えられる。
COVID-19の臨床経過におけるCD147の役割を検証するため、入院中のCOVID-19患者17人に対して、CD147に対するヒト化モノクローナル抗体であるメプラズマブを用いた。症例の重症度と退院までの期間については、治療群では対照群と比較して同様の統計学的に有意な改善がみられた。症例数が少なく、無作為化された対照群がないため、臨床的有効性についての確固たる結論は得られていないが、これらの臨床所見は、CD147がSARS-CoV-2ウイルスの臨床的に関連する結合部位であることを多面的に試験管内試験で示していることと一致している。
CD-147を介したキャッチ&クランプ血管閉塞:仮説
COVID-19の感染標的である呼吸器系と循環器系の二重性を解読するための枠組みは、関連組織におけるACE2とCD147の分布によって示唆される。これらの受容体はいずれも肺組織と血管内皮層に発現している。98-102 しかし、赤血球と白血球にはACE2ではなくCD147のみが存在している。CD147は血球上に高密度に分布しており、SARS-CoV-2 ike roteinと結合していることから、このような結合の格子が形成されるとどのような結果になるのかを探る必要がある。これらの結合は、おそらく細胞内への侵入には及ばず、動的に剥離したり再付着したりする可能性がある99。しかし、このような結合の延長したカスケードが発生し、血流を阻害し、COVID-19で見られた血管病変を引き起こす可能性がある。
図1は、COVID-19におけるCD147が媒介する血管閉塞の仮説的な「キャッチ」と「クランプ」モデルを示している。ウイルス粒子は、赤血球上のCD147受容体に付着しており、他の粒子は毛細血管のe点皮内膜上のCD147またはACE2受容体に付着している。視認性のために、SARS-CoV-2ウイルス粒子(実際のサイズは約0.10-0.12μm147)は、毛細血管断面の直径(これは通常3-10μmである)に対して約6倍の実際の縮尺で示されている。赤血球は、直径約8μm、厚さ約2μmの円盤状の直径を持ち、毛細血管の壁にぴったりと収まっており、しばしばその形状を歪ませ149 、直径2~3μmの小さな毛細血管を流れるようになっている。
赤血球と血小板はともにCD147受容体を持つ150,151が毛細血管を流れる血液中に密に分布しているため、152,153に示されているように、両タイプの細胞がウイルス性に結合したクラスターが形成されることもある。しかし、平均直径6μmの肺毛細血管では、左心室の収縮によって駆動される脈動的な高血流によって、このような抗力が相殺されている154 。しかし、赤血球と白血球の大規模なクラスターは、例えば動脈内に形成される可能性があり、その場合、流れが動脈穴へと進み、毛細血管へと進む際にボトルネックが生じる可能性がある。
図1 血流のキャッチ&クランプインピーダンス
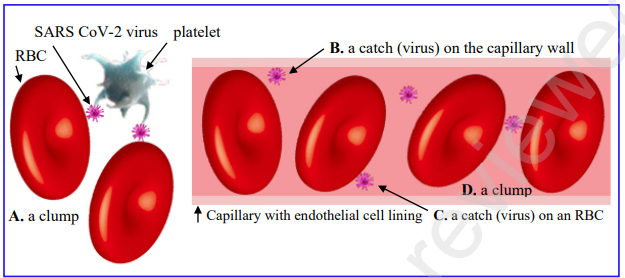
この図は、赤血球または毛細血管壁のいずれかに付着したSARS-CoV-2ウイルス粒子(「キャッチ」)または相互のウイルス付着によって形成された血球の「塊」が、どのように血流を阻害するかを示している。ウイルスと血球との間に示されているすべての付着は、ウイルススパイクタンパク質が細胞上のCD147受容体に結合することによって形成される。各ウイルス細胞のペアの間に複数のこのような結合があると、この結合が強化される。A) 2つの赤血球と血小板の塊で、赤血球はそれぞれウイルス粒子に結合しており、それが血小板に結合している。このような塊は、例えば動脈に形成され、毛細血管に流れ込むときにボトルネックを引き起こす可能性がある。B) 毛細血管の内膜に結合したウイルスで、”キャッチ “と呼ばれるもの。C) ウイルスが赤血球に結合したもの(別の「キャッチ」)で、CD147 または ACE2 の結合を介して毛細血管の壁に引っかかる可能性がある。D)赤血球、ウイルス、および別の赤血球からなる塊。ウイルス粒子は、毛細血管断面の直径(この図では高さ)に対して実際の縮尺の約6倍の大きさで表示されていることに注意してほしい。
SARS-CoV-2ウイルスの存在下では、適度な速度でも毛細血管内を流れる血液は、影響を受けた毛細血管内の流れに何らかの抗力を引き起こすのに十分な結合親和性を持つキャッチや塊を形成する可能性がある。流れが遅くなると、そのような凝集がさらに促進され、ウイルスメディアによるキャッチ&クランピングのカスケードを引き起こす。
先行研究論文158で最初に提案されたこのキャッチ&クランプシナリオがCOVID-19でどのように展開されるかについての洞察は、マラリアの重症症例における類似の現象から引き出すことができる。ここでは、ウイルス粒子ではなく、マラリアに感染した赤血球(IR)が血管障害の結節点となっている。159-162 図2は、重症マラリアにおけるこれらのIR誘導性細胞接着の微視的画像を示している。図3は、これらの細胞接着剤がどのようにして微小血管閉塞を引き起こすかを示している。159,161 これらの細胞接着性病理は、重症マラリアの生命を脅かす合併症の主な原因であることが複数の研究で確認されている。
図2 菌に感染した赤血球のヒト細胞への接着
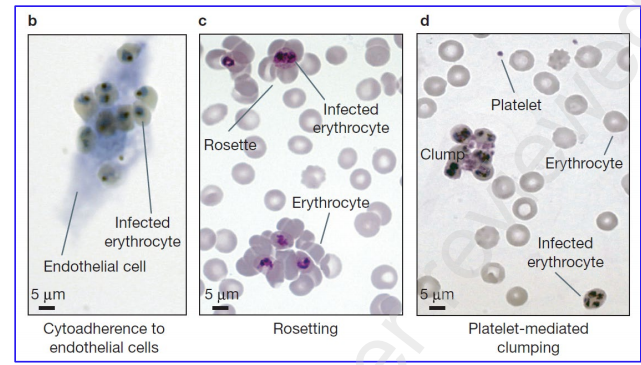
159 (b) 感染した赤血球の体外培養脳内皮細胞へのサイトアドヒアランス、ギムザ染色後の光顕微鏡による可視化。(c) 試験管内試験で検出されたP. falciparum培養物のロゼット、ギムザ染色した薄塗抹を調製し、光顕微鏡で観察した。(d) 試験管内試験で寄生虫培養物を血小板と共培養した後に形成された感染赤血球の血小板介在性クラム(ギムザ染色薄塗抹および光顕微鏡観察)。
図3 寄生原虫によって引き起こされるロゼット化、細胞接着および血管閉塞を描いた模式図(青の楕円)
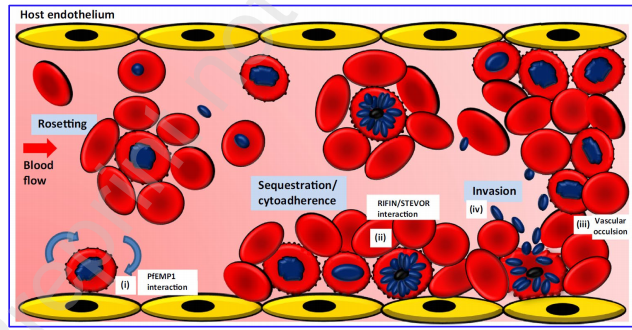
165 PfEMP1,STEVOR、およびRIFINはマラリアに特異的な表面抗原である。
より一般的には、マラリアにおけるこれらのCD-147に基づく細胞接着現象、およびCOVID-19についてここで提案されているように、巻き添え被害を引き起こす免疫防御機構であるように見える。図4に描かれているように、免疫接着またはヘマグルチネーションとして知られているプロセスでは、赤血球は(SARS-CoV-2121のように)エンベロープされたウイルスまたは他の病原体に付着する。これらの複合体は、複数の赤血球と病原体の格子状に広がることができ、白血球に付着して食細胞のクリアランスを大幅に促進することができる。
細菌や真菌の病原体については、抗CD147抗Bodi sによる阻害を通して確認されたように、ヘマグルチネーションはCD147や他の接着分子によって促進されていることがわかった146。初期のコロナウイルス株では、ヘマグルチニン・エステラーゼ(HE)によるヘマグルチン化は、様々なヘマグルチニン・エステラーゼ(HE)糖タンパク質によって媒介されていたが、173-175 の SARS-CoV-2 では、細胞結合機能を持つこのような HE は存在しなかった。 175,176 SARS-CoV-2ウイルスのスパイク蛋白質がCD147に結合していることが実証されていることと、赤血球上のCD147受容体の密度を考慮すると、この結合ペアはCOVID-19におけるヘマグルチン化を促進すると思われる。162,177,178 肝炎ウイルスに対する免疫を獲得したマウスの脳内皮細胞では、ウイルスに曝露した後、CD147の発現が250%増加した。
図4 血糊化プロセスのイメージ図
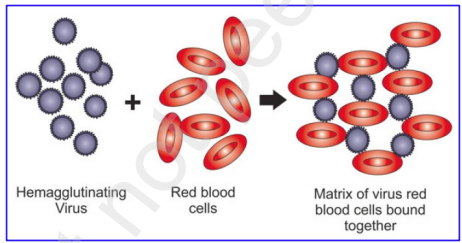
172 血糊化は、エンベロープされたウイルスのいくつかの株に共通しており、広く使用されているウイルスアッセイ技術の基礎となっている。SARS-CoV-2では、ヘマグルチン化は、ウイルスのヘマグルチニン・エステラーゼ糖タンパク質ではなく、v ral sp keタンパク質のCD147への結合によって媒介されている可能性がある。
キャッチ&クランプ血管閉塞の結果としてのCOVID-19の危険因子と特異性
1. 年齢の増加に伴うCOVID-19の発生率の増加。さまざまな組織の血流に関するいくつかの臨床研究では、若年者と高齢者の血流速度がはるかに高いことが明らかになっている。
足の指と指の爪の下の毛細血管の流量については、平均年齢26歳の被験者の流量は、平均年齢63.180歳の被験者の流量のほぼ2倍であった。様々な組織における毛細血管の流れの他の研究では、高齢者は若年者と比較して流速が23%181と40%182減少し、流束振幅が47%減少していた182。高齢者と若年者の動脈の流量の差は有意であったが、顕著ではなかった。若年層の血流率がはるかに高いことは、ウイルススパイク蛋白質の細胞CD147受容体への結合力に対抗するのに十分であり、血球の塊や血管の癒着の発生を防ぐことができる可能性がある。
2. COVID-19患者1,980人を対象としたゲノム関連研究では、年齢と性別を調整した場合、O型の患者は他の血液群の患者に比べてCOVID-19に感染するリスクが35%低いことが明らかになった。125,126 マラリアについては、567人の患者を対象としたマッチドケースコントロール研究で、他の研究と一致する結果が得られている。186,188 臨床研究187 と 試験管内試験189,190 の両研究でも、血液中の A 群と B 群では重症マラリアのリスクの低下が少ないことが示されており、COVID-19 の発生率と同様の結果が得られている。これらのマラリアロゼット形成のA群とB群の危険因子は、赤血球と白血球に見られる接着性三糖類によって媒介されているように思われる159,161。
3. 発症から約1週間後に酸素状態が急速に低下し、体外受精後24~48時間で改善する。COVID-19の発症後、血中の酸素濃度がかなりの程度まで血液凝固を引き起こすのに十分なレベルに達するまでに数日が経過することがある。この過程が始まると、血流を減速させ、さらに毛細血管内での凝集を引き起こすクランピングのカスケードが発生し、酸素状態が急速に低下する可能性がある。IVMは、上述したように、摂取後約4~8時間後にピークのラムと組織レベルに達し、ウイルススパイクタンパク質への結合を動的に剥離し、再付着させるためのCD147とIVMによる競合阻害は、それらの結合と関連する塊を迅速に緩め始める可能性がある。
4. 血栓、末梢性虚血、”COVID趾 “などの血管関連疾患は、当然のことながら血管閉塞に起因するものであろう106,112,113,191に記載されている。上述のように、重症マラリアでは、ロゼットとCOVID-19で提案されている細胞接着剤と類似した内皮結合が、呼吸困難や多臓器不全を含む生命を脅かす合併症160-164の主な原因であることが確認されている159,161。血管閉塞、特に末梢微小血管系における血管閉塞が、COVID-19患者の中には正常に機能しているにもかかわらず、指先パルスオキシメータで通常測定されるような酸素飽和度109-111が著しく低い患者がいる理由を説明することができるかもしれない。
高頻度のIVM投与により臨床反応を改善する可能性がある。
フロリダの臨床試験で使用されたIVMの用量は200μg/kgで、場合によっては週に1回の投与を繰り返すこともあった。しかし、上述したように、IVMは一般的に2,000μg/kgまでの単回投与で良好な忍容性を示し、1週間の間に合計3,000μg/kgまでの分割投与でも良好な忍容性を示している。86 したがって、COVID-19のIVMの高用量レジメン、例えば500μg/kgを使用し、その後3日ごとに250μg/kgを使用することも可能であろう。IVM活性の基礎となる生物学的メカニズムについての理解はまだ不十分であるが、特定の用量反応関係の特定は困難であるが、特定の考慮事項は、IVMの用量を増やした場合に大きな臨床的利益が得られる可能性を示唆している。
標準的なIVMの投与量は200μg/kgで、例えば河川盲目症では年に1~3回2,85,疥癬では1週間間隔で2回投与される。リンパ系フィラリア症は 2015 年に世界で 3,850 万人が罹患した寄生虫疾患で、196 例では、治療 6 ヵ月後のミクロフィラリア密度は、IVM 投与量 100~150 µg/kg、200 µg/kg、400 µg/kg でそれぞれ治療前のレベルの 22.2%、9.3%、2.9%であった。
IVMがミクロフィラリア(通常は成虫ではない)を殺すこのような寄生虫疾患では、2,89,198 の細胞毒性プロセスは不可逆的であることは注目に値する。68 しかし、COVID-19治療では、IVMのような抗ウイルス剤が細胞毒性ではなく細胞静電作用を有する場合、ウイルスは血漿中の薬物濃度が臨界閾値以下に低下すると増殖を再開してしまう。IVMがウイルススパイク蛋白質と競合的に結合すると仮定すると、後者のCD147への結合は、IVMの場合、閾値の血漿レベルでは時間の経過とともに剥離するが、それ以下では再付着するであろう。上述のように、ヒトにおけるIVMの排泄半減期は約18時間68,69,71,72,78であり、主要代謝物の半減期は約3日である。したがって、例えば、100μg/kgのIVMを投与した場合、IVMの代謝物がこのような競合的な結合において親分子と同様の効果を発揮すると仮定した場合、200μg/kgのIVMを単回投与した場合、わずか3日間しか効果が持続しないことになる。
さらに、IVMのモル濃度と血中のCD147受容体のモル濃度を比較することで、さらなる展望を得ることができる。74 IVMはアルブミンや他の血清原体と強く結合し、93%が結合型、7%が非結合型であり、199-201は後者が活性であった。68,73 等価の競合結合活性を仮定すると、150 µg/kg と代謝物を加えた IVM のピーク濃度は、6.24×1015 分子/L と 3 倍になる。200 µg/kg の投与では、この余分な濃度が 8.32×1015 分子/L になる(IVM の血漿中濃度は 1.7 mg/kg69,81 までの経口投与量に比例する)。成人の平均赤血球数が4.8×1012/L(男性では5.1×1012/L、女性では4.5×1012/L)202,赤血球あたりのCD147受容体数が1,695個131であることから 1リットルあたり約8.14×1015個のCD147受容体があるのに対し、IVMでは8.32×1015個/リットルとなる。
血中のIVMとCD147分子の空間的分布が異なることは、結合平衡計算の適用を可能にしている。しかし、これらの分子分布の一対一比から 200μg/kgの用量では、IVMは3日間の排泄半減期の間に力を失い始め、その後はより急激に力を失う可能性があることが示唆されている。同様に、ウイルススパイク蛋白質のACE2受容体への結合に対するIVMの遮蔽効果を推定することは困難であり、その分子量はCD147138の12倍であるが、すべての細胞型におけるACE2の分布はCD147に比べてはるかに粗い。 99,139,140 しかし、低用量のIVMはウイルススパイク蛋白質のCD147への結合を阻害し、高用量ではACE2の結合も阻害する可能性が考えられる。
いくつかの研究では、COVID-19に対するIVMの臨床効果は、抗マラリア活性を有する抗生物質であるアジスロマイシン(AZ)の併用によっても増強されることが示唆されている4-6。AZは炭素数15のマクロライド系抗生物質であり、分子構造は炭素数16の大環状ラクトンIVMと類似している。COVID-19に入院している患者27人(うち8人は人工呼吸器を使用している)を治療するために、高用量ヘパリンとAZを1日目に500mg、2~10日目に250mgの用量で併用した臨床試験では、死亡例はなく、異常に良好な転帰が得られた112。AZはPediculus humanus寄生虫203に対してIVMとの併用で試験管内試験での相乗効果を示し、抗SARS-CoV-2活性を試験管内試験および臨床で示している3,23。
臨床検査の機会
ここで提案された3つの仮説は、臨床的な検証が容易に可能である。
1)末梢微小血管系の不規則性は、呼吸困難や低酸素飽和度などの症状を呈しながらも、臨床的に明らかな循環器系の異常を伴わないCOVID-19の症例に頻繁にみられるであろう。
2) 静脈内投与により、これらの微小血管系の不整脈は、1~2 日間の臨床的改善とともに正常化する。
3) 臨床的改善に伴う微小血管系の不整脈の正常化は、高用量のIVMを投与することにより、より迅速かつ強固に起こる。
末梢の微小血管系の異常は、指や足の指の爪折り毛細血管鏡検査で、毛細血管構造の異常や血流速度の不規則性などを簡単にモニターすることができる。この方法を用いてこれら3つの効果が確認されれば、体外受精の臨床的有効性とその基礎となる生物学的機序について、他の方法では不可能かもしれないより少ない患者数からより明確な結論を導き出すことができるであろう。
