Ivermectin: does P-glycoprotein play a role in neurotoxicity?
www.researchgate.net/publication/8687975_Ivermectin_Does_P-glycoprotein_play_a_role_in_neurotoxicity
ジェフリー・エドワーズ
リバプール大学
ロア糸状虫の風土病地域におけるオンコセルカ症に対するメクチザン®治療後の重大な有害事象に関する科学的ワーキンググループの報告書より シュリグリーホールホテル、マンチェスター、英国 2002年5月28日~30日
公開:2003年10月24日
要旨
大環状ラクトン系イベルメクチン(メクチザン)は、ヒトフィラリア感染症の防除に広く使用されており、特にオンコセルカ症やリンパ系フィラリア症の防除にはドナー品として使用されている。アフリカにおけるリンパ系フィラリア症の防除では、アルベンダゾールとの併用が行われている。オンコセルカ症とロア糸状虫の併存地域では、ロア糸状虫のミクロフィラリア数が明らかに多い患者で重篤な副作用が観察されている。最近の知見によると、イベルメクチン治療後に様々な脊椎動物で見られる重篤な中枢神経系の副作用は、P糖タンパク質の欠如または機能的な欠乏によるものである可能性が示唆されている。P糖タンパク質は脳の毛細血管上皮細胞の先端膜に発現し、様々な化合物の脳への浸透を制限する役割を担っている。一部のコリー犬におけるイベルメクチンの毒性は、フレームシフトをもたらす mdr1 遺伝子の 4-bp 欠失変異により、P糖タンパク質の合成を早期に終了させるストップコドンが生成されることで説明できるかもしれない。さらに、P糖タンパク質の発現レベルが低下していると同定されたCF-1の亜集団は、このトランスポーターの基質に対する毒性の増加を示す。さらに、薬物間相互作用の伝統的な見解は、肝薬物代謝の変化を介した薬物クリアランスの変化であるが、これらの変化のいくつかは、血液-脳関門におけるP糖タンパク質の結合部位の競合によって生じる可能性があり、その結果、細胞外への排出量が減少し、中枢神経系への毒性が増強される。結論として、P糖タンパク質はヒトの血液脳関門の不可欠な構成要素であり、薬物の脳への取り込みを制限する上で中心的な役割を果たしている。P糖タンパク質の発現や機能が変化すると、イベルメクチンの脳内濃度が上昇し、重度の神経毒性を引き起こす可能性が考えられる。これは、P糖タンパク質の遺伝子多型や、この排出トランスポーターを阻害する可能性のある薬剤や食品とのイベルメクチンの共同投与によって生じる可能性がある。
背景
広範囲に使用される駆虫剤イベルメクチンの臨床および獣医学的使用は 1991 年以来、一般的に重篤な有害事象は発生していないが、2~3 日間続く昏睡を含む神経学的症状を伴うか否かを問わず、オンコッカ・ボルビュラスに感染した患者で、高レベルのミクロフィラリアエ(典型的には血液中の 30,000 ミクロフィラリアエ /ml 以上)を伴うロア糸状虫感染症を併発していた患者を対象に、イベルメクチン投与後に多くの臨床例が報告されている [1,2]。因果関係はまだ確立されていないが、何らかの理由でイベルメクチンによる治療を必要とし、西アフリカおよび中央アフリカのロア糸状虫のパンデミック地域にかなりの暴露を受けた人には、ロア症の前治療評価と慎重な治療後のフォローアップを実施することが推奨される。この簡単なレビューの目的は、これらのイベントのいずれかがイベルメクチンの薬理学、特に P糖タンパク質薬物トランスポーターに対する親和性に起因するかどうかを評価することである。
図1 イベルメクチンの化学構造
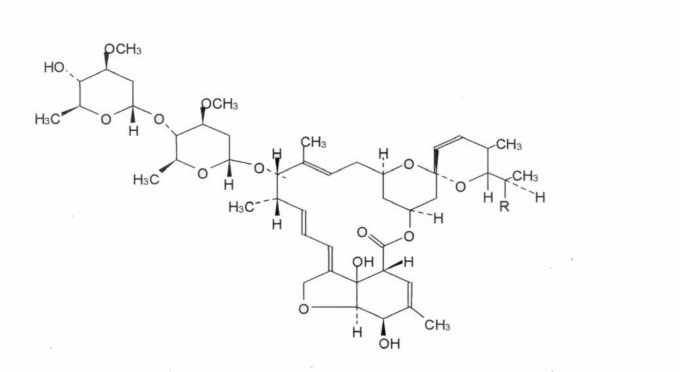
イベルメクチンは、22,23-ジヒドロアベルメクチンB1a(R=CH3)を93%以上含有し、B1aとB1bの和(R=C2H5)を97.B1a、および22,23-ジヒドロアベルメクチンB1(B1a + B1b)の合計が97.0%を下回らないことを特徴とする。
大環状ラクトンの化学・薬理学
大環状ラクトンは、アベルメクチン(例えば、ドラメクチンおよびイベルメクチン;[図1])およびミルベミーシン(例えば、モキシデクチン)からなる。これらは、ストレプトマイセス菌の天然発酵産物である。多くは強力な駆虫性および殺虫性を有しており[3,4]、動物の線虫感染症に選択される薬剤である。イベルメクチンは、オンコセルカ症やその他のヒトフィラリア感染症、例えばウクレリア・バン・クロフティなどに好まれる治療薬である。大環状ラクトンは、体性ミミズの筋肉組織の弛緩性麻痺を生じさせ、咽頭ポンピングの遮断を通じて寄生虫の摂食を阻害する [5-7] ことから、摂食障害がこれらの薬剤の主な作用であることが示唆されている [8]。線虫と発現した受容体を用いた分子遺伝学的研究では、大環状ラクトンは、グルタミン酸によって活性化される無脊椎動物特異的な抑制性塩化物チャネルのファミリーのアゴニストとして作用し、脊椎動物のGABAAゲート塩化物チャネルと系統的に関連していることが示されている[8-11]。イベルメクチンの選択的効果は、無脊椎動物に特有のグルタミン酸作動性塩化物チャネルに作用することで説明できるが、イベルメクチンは高濃度では脊椎動物のGABAA作動性塩化物チャネルを増強する可能性もある。このことから、イベルメクチンおよび関連する薬剤は、脊椎動物の血液脳関門に欠乏している脊椎動物に毒性がある可能性が示唆されている[13]。最近の知見では、イベルメクチン治療後の様々な脊椎動物で見られる重度の中枢神経系の副作用は、P糖タンパク質の欠乏または機能的欠乏によるものである可能性が示唆されている[14]。
血液脳関門とP糖タンパク質
血液脳関門は、緊密な接合部で結ばれた脳毛細血管内皮細胞で構成されており、親油性の物理的障壁を形成し、脳内への物質の受動的な輸送を制限している。血液脳関門の伝染性は親油性の増加とともに増加するが、いくつかの輸送タンパク質が、多くの親油性の低い化合物の伝染を調節することが確認されている。逆に、シクロスポリンやイベルメクチンのような親油性の高い化合物の多くは、血液脳関門への浸透性が予想以上に悪いことがわかっている。現在では、この現象は薬物排出トランスポーターの作用の結果であると考えられている[15,16]。脳毛細血管上皮細胞の先端膜および基底膜に存在する輸送タンパク質の分子解析により、MDR、MRP、OATP [17-20]などの薬物輸送体が同定されているが、最も広く研究されているのはP糖タンパク質である。P糖タンパク質は脳毛細血管上皮細胞の先端膜に発現しており、細胞内から血液中へと有害基質を送り出す方向性を持っている(図2)。P糖タンパク質は、様々な治療クラスの化合物の脳への浸透を制限する役割を担っており、場合によっては、そのような薬剤の臨床使用に関する決定に影響を及ぼす可能性がある。例えば、抗下痢止めアヘン薬のロペラミドは、末梢的には安全で効果的であるが、脳への浸透はp-グリコタンパクの作用によって最小限に抑えられているため、中枢的には作用しない。しかし、ヒトの血液脳関門の機能におけるP糖タンパク質の役割を正確に評価するには、脳内の薬物濃度を容易に測定できないために限界があることは認めなければならない。さらに、脳内での分布の変化は、常に循環血漿濃度の変化としてそれ自体を示すとは限らない。[16]. mdr1の遺伝的多型[21,22]やP糖タンパク質機能の阻害によってもたらされる中枢性媒介作用の発現があったかどうかを判断するには、薬力学的指標が必要であろう。
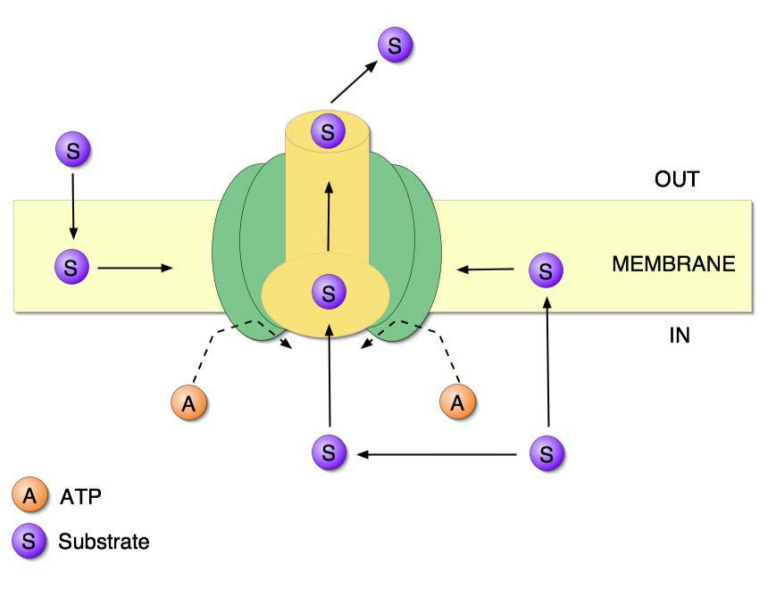
図2 P糖タンパク質の構造と機能を簡略化したアニメ
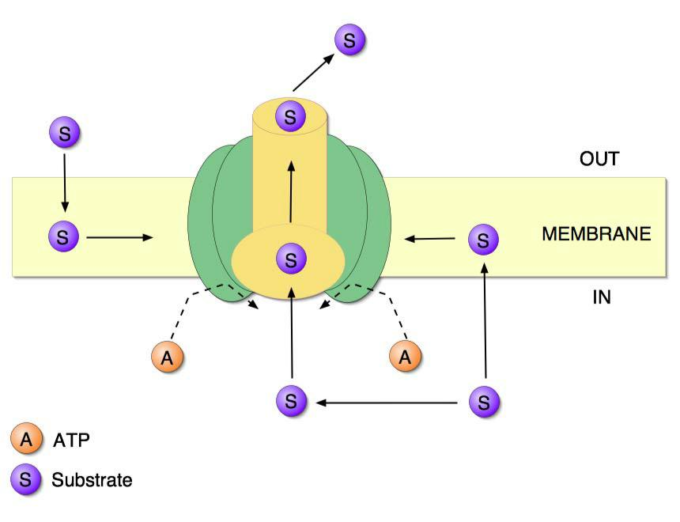
P糖タンパク質の分子は細胞膜にまたがっており、細胞膜だけでなく、細胞の内側と外側にも接触している。このようにして、細胞膜だけでなく、細胞の内外にも接触している。分子球の中央部分は、有害化学物質を環境に送り出すためのチャネルまたは孔である。示されているように、有毒化学物質は、細胞の内部から、またはその膜からのいずれかの輸送孔を入力することができる。ATPのパワーの分子は、ポンプ作用を行う。
イベルメクチンの神経毒性
ラットで見られるイベルメクチンの主な毒性は失調、眼瞼下垂、活動性の低下であり、イヌでは散瞳、振戦、運動失調、食欲不振 [23] であり、血液脳関門が発達しておらず(P糖タンパク質の欠損性に関して)成人ラットよりも高い脳血漿中薬物濃度比を示す乳児ラットでは感受性が高い。メクチザン®の開発中に、イベルメクチンの獣医学的使用と前臨床毒性試験からの2つの報告がメクチザン®の臨床開発に影響を与え、より保守的なアプローチがとられた[24]。まず、コリー犬の亜集団がイベルメクチン誘発性神経毒性に著しく敏感であることが明らかになった[25]。これは、他の犬で毒性を引き起こすのに必要な用量の200分の1の用量で起こる。感受性の高い犬におけるイベルメクチンの神経学的症状には、過唾液分泌、失調、失明、昏睡、呼吸障害、および死亡が含まれる。現在、このようなイベルメクチン感受性コリーは mdr1 遺伝子の 4-bp 欠失変異を示し、フレームシフトを引き起こし、P糖タンパク質の合成を早期に終了させるいくつかの停止コドンを発生させることが知られている。この突然変異のホモ接合体である犬は、イベルメクチン感受性のフェノタイプを示すが、正常またはヘテロ接合体のホモ接合体である犬は、イベルメクチンに対する感受性の増加を示さない[26]。第二に、CF-1マウスのサブ集団は、P糖タンパク質の発現レベルが低下していることが確認され、その中にはP糖タンパク質を産生しない集団も含まれていた(-/-)[27]。野生型(+/-+)または欠損遺伝子型を持つ動物は、イベルメクチン神経毒性に対する感受性と催奇形性が著しく異なり、これは脳と胎児におけるイベルメクチンの蓄積量の違いに起因する。CF1 P糖タンパク質欠損マウスは、実験室で確立されたmdr1aおよびmdr1bノックアウト株と表現型的に同一である [28]。このような系統を用いて、P糖タンパク質野生型マウスと比較した場合、薬物動態や組織分布、特に脳内への蓄積量に違いがあることが実証されている[29,30]。これらの著者らは、mdr1aトランスポーターがこれらの薬剤の経口バイオアベイラビリティーと脳への取り込みを制限する中心的な存在であることを明らかにした。CF-1 マウスのイベルメクチンと P糖タンパク質基質であるシクロスポリン A を用いた研究では、イベルメクチンとシクロスポリン A の静脈内薬物動態に差はなかったが、-/-株ではイベルメクチンとシクロスポリン A の吸収が亢進していることが示された。また,(-/-)マウスと(+/+)マウスの肝薬物代謝能は同程度であった。3H]-ivermectinおよび[3H]-cyclosporin Aの脳内濃度は,経口投与または静脈内投与後,(-/-)マウスでは常に高濃度であったが,肝内濃度は野生型マウスと同程度であった。これらの所見は、(-/-)マウスで観察されたイベルメクチンの体内動態の変化が、薬物代謝の変化というよりも、P糖タンパク質の欠乏によるものであることを明確に示している[14]。
イベルメクチンの薬物間相互作用と神経毒性
臨床的に重要な薬物間相互作用は、他の薬剤との併用投与により薬剤の薬理が変化した場合に生じることがある。駆虫薬間の薬物間相互作用の問題は、まだ十分に解明されていない。これは、抗寄生虫薬に対する抵抗性が高まるにつれ、併用化学療法が普及していることから、重要な問題である。例えば、アルベンダゾールとイベルメクチンは、リンパ系フィラリア症を除去するためにプログラムで併用されている[31]。ヒト肝ミクロソームおよび組換え酵素系での経験から、イベルメクチンとアルベンダゾールは、肝臓と小腸の両方で発現している最も広く分布するヒトP-450であるチトクロームP450(CYP)3A4の基質であることが示されている[32,33]。我々は、アルベンダゾールがヒトの腸組織から調製されたマイクロソームによって、ヒトの主要な血漿代謝物であるアルベンダゾールスルホキシドに変換されることを示してきた[34]。したがって、これらの各部位において、薬物代謝酵素の競合による薬物間相互作用の可能性がある。従来の見解では、薬物間相互作用は肝薬物代謝の変化を介して媒介される薬物クリアランスの変化の結果であるとされている。しかし、これらの変化のいくつかは、輸送タンパク質上の結合部位の競合によって生じる可能性があることが明らかになりつつある。蛍光標識されたイベルメクチン(BOD-IPY-ivermectin)は、濃縮機構により脳の毛細血管から押し出されるが、この押し出し過程は薬物の取り込みに変化はなく、P糖タンパク質の基質により減少する[35]。さらに、BOD-IPY-ivermectinの輸送はP糖タンパク質に限定されており、関連する輸送タンパク質の特異的な阻害剤の影響を受けず、腎尿細管内のP糖タンパク質と特異的に相互作用している[36]。これらの知見は、他のP糖タンパク質基質がこの部位でイバーメクチンと競合し、結果として細胞外への排出量が減少し、中枢神経系の毒性が増強されることを示唆している。このような化合物には、シクロスポリンやHIVプロテアーゼ阻害剤が含まれる[37,38]。マウスにおけるイベルメクチンの神経毒性の増強を伴うイベルメクチン濃度の上昇は、シクロスポリンの存在下ですでに実証されている[39]。イベルメクチンとアルベンダゾールの相互作用は、これらの薬剤がCY3A4の共役体であることに基づいて考えられるが、P糖タンパク質のレベルでの相互作用があることは確立されていない。イベルメクチンは紛れもなくP糖タンパク質の基質であるが、アルベンダゾールについては相反する証拠がある。腸管内でのアルベンダゾールスルホキシドの腸内代謝と腸管腔への分泌が実証されており、p-グリコタンパク質が蠕虫類のアルベンダゾールに対する抵抗性の調節に関与していることが報告されている[40,41]。しかし、Caco-2細胞を用いた実験では、アルベンダゾールがp-グリコタンパク質の基質として、あるいはp-グリコタンパク質を介したジゴキシン輸送の阻害剤として同定されなかったことから 2つの薬剤を組み合わせても、p-グリコタンパク質との相互作用に基づく副作用は生じないことが示唆された[42]。アルベンダゾールスルホキシドまたはスルフォンについては検討しなかった。
結論
P糖タンパク質はヒトの血液脳関門の不可欠な構成要素であり、薬物の脳への取り込みを制限する中心的な役割を果たしている。P糖タンパク質の発現または機能が変化すると、イベルメクチンの脳内濃度が上昇し、重度の神経毒性を引き起こす可能性が考えられる。これは、P糖タンパク質の遺伝的多型、またはこの排出トランスポーターを阻害する可能性のある薬剤または食品とのイベルメクチンの共同投与によって生じる可能性がある。血液脳関門での臨床的に重要な薬物間相互作用の例は比較的少なく、脳内での薬物曝露の増加を伴うものである。前述したように、脳内への取り込みの変化は、全身薬物動態の変化としては明らかではなく、薬力学的評価が行われたときに初めて明らかになることがある[16]。さらに、治療用量では、薬物間相互作用を起こすために十分な高濃度の副基質を得ることができない場合がある。例えば、様々な抗精神病薬、制吐剤、Ca2+遮断剤は、全身循環の中で適切な濃度を達成したにもかかわらず、P糖タンパク質の効果的な阻害に失敗した[43]。おそらく、より重要なことは、臨床的および実験室での所見から、メクチザン®関連のL. loa脳性脳症は、大規模なミクロフィラリア死によって引き起こされた塞栓症の過程と一致していることを示唆していることを覚えておくべきである。また、循環免疫複合体や多型の炎症反応が関与している可能性もある。さらに、重篤な、あるいは致死的な脳脊髄液減少症は、自然発症することもあれば、ジエチルカルバマジンなどの他のマイクロフィラリア剤による治療後に発症することもある[44]。したがって、イベルメクチンの投与に関連した神経学的後遺症のいずれかがこの薬に直接関連しているかどうかは疑問であり、したがって、何らかの理由でイベルメクチンの薬物動態に変化が生じても、より重篤な有害反応を引き起こす可能性は低いと思われる。