Contents
www.ncbi.nlm.nih.gov/pmc/articles/PMC7505114/
Ivermectin, a potential anticancer drug derived from an antiparasitic drug
オンライン 2020年9月21日公開
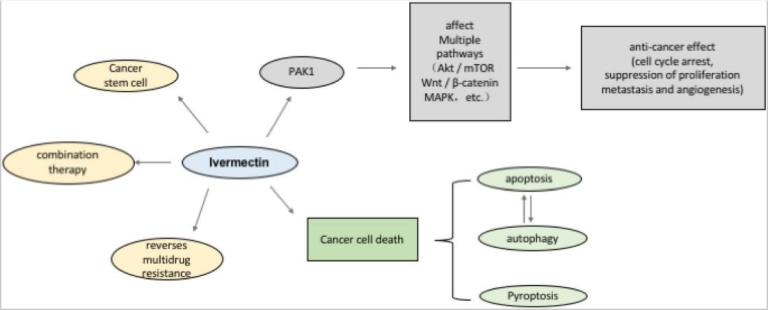
グラフィカルな要旨
イベルメクチンは、さまざまながん細胞において、増殖、転移、血管新生活性の抑制など、強力な抗腫瘍効果を発揮することがわかっている。これは、イベルメクチンがPAK1キナーゼを介して複数のシグナル伝達経路を制御することと関係していると考えられる。一方、イベルメクチンは、アポトーシス、オートファジー、パイロトーシスなどのプログラムされたがん細胞死を促進する。イベルメクチンによるアポトーシス誘導とオートファジーは相互に制御されている。興味深いことに、イベルメクチンは、腫瘍幹細胞の抑制や多剤耐性の回復にも効果があり、他の化学療法薬と併用することで最適な効果を発揮する。
略語
ASC, Apoptosis-associated speck-like protein containing a CARD; ALCAR, acetyl-L-carnitine; CSC, Cancer Stem Cell; DAMP, Damage-associated molecular pattern; EGFR, Epidermal growth factor receptor; EBV, Epstein-Barr virus; EMT, Epithelial mesenchymal-transition; GABA(ガンマアミノ酪酸)GSDMD(ガスダーミンD)HBV(B型肝炎ウイルス)HCV(C型肝炎ウイルス)HER2(ヒト上皮成長因子受容体2)HMGB1(高移動度グループボックス-1タンパク質)HSP27(熱ショックタンパク質27)LD50(中央致死量)LDH(乳酸脱水素酵素)。IVM、イベルメクチン;MDR、多剤耐性;NAC、N-アセチル-L-システイン;OCT-4,オクタマー結合タンパク質4;PAK1,P-21活性化キナーゼ1;PAMP、病原体関連分子パターン;PARP、ポリ(ADP-リボース)ポリメラーゼ;P-gp、P糖タンパク質。PRR(パターン認識受容体)ROS(活性酸素種)STAT3(転写シグナル伝達・活性化因子3)SID(SIN3相互作用ドメイン)siRNA(低分子干渉RNA)SOX-2(Sry-box 2)TNBC(トリプルネガティブ乳癌)YAP1(Yes-associated protein 1)。
この記事で取り上げた化合物:イベルメクチン(PubChem CID:6321424), アベルメクチン(PubChem CID:6434889), セラメクチン(PubChem CID:9578507), ドラメクチン(PubChem CID:9832750), モキシデクチン(PubChem CID:9832912)
キーワード:イベルメクチン、がん、ドラッグリポジショニング
概要
イベルメクチンは,16員環を有するマクロライド系の抗寄生虫薬で,河川盲目症,象皮病,疥癬など多くの寄生虫症の治療に広く用いられている。イベルメクチンの寄生虫疾患に対する優れた有効性を発見したことで、大村智氏とウィリアム・C・キャンベル氏が2015年のノーベル生理学・医学賞を受賞した。近年、イベルメクチンは複数のシグナル伝達経路を制御することで、複数の腫瘍細胞の増殖を抑制することが報告されている。このことは、イベルメクチンが大きな可能性を持つ抗がん剤であることを示唆している。ここでは、イベルメクチンがさまざまながんの発生を抑制し、プログラムされた細胞死を促進する関連メカニズムを概観し、新生物治療のための抗がん剤としてのイベルメクチンの臨床応用の展望について議論した。
1. はじめに
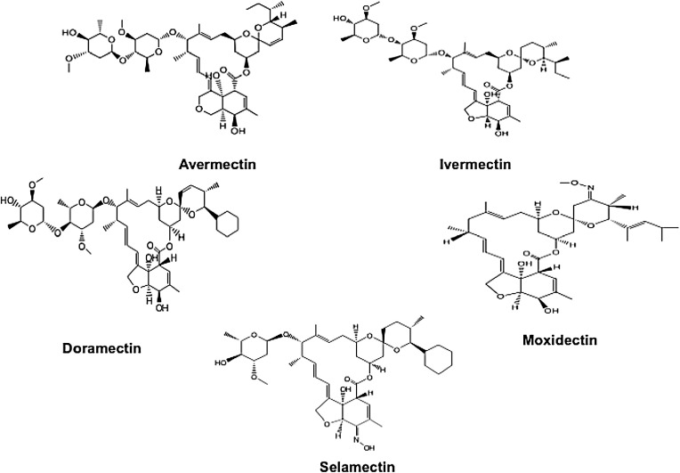
イベルメクチン(IVM)は,22,23-ジヒドロアベルメクチン-B1aが80%,22,23-ジヒドロアベルメクチン-B1bが20%で構成されるアベルメクチン由来の16員環を有するマクロライド系抗寄生虫薬である[1]。現在のエバーメクチンファミリーには、IVMの他に、セラメクチン、ドラメクチン、モキシデクチンがある〔[2], [3], [4], [5]〕。がある(図1 )。IVMは,現在最も成功しているエバーメクチンファミリーの薬剤であり,1978年にFDAからヒトへの使用が承認された[6]。河川盲目症,象皮病,疥癬などの寄生虫症の治療に良い効果を発揮している。IVMの発見者である日本の科学者・大村智とアイルランドの科学者・ウィリアム・C・キャンベルは 2015年にノーベル生理学・医学賞を受賞した[7,8]。IVMは、寄生虫のグルタミン酸ゲート型クロライドチャネルを活性化し、大量のクロライドイオンの流入と神経細胞の過分極を引き起こすことで、γ-アミノ酪酸(GABA)を放出させて神経を破壊し、筋肉細胞の神経伝達により体筋の麻痺を誘発して寄生虫を死滅させる[9,10]。また,IVMは,マラリア[11,12],トリパノソーマ症[13],シストソーマ症[14],トリチノーシス[15],リーシュマニア症[16]など,他の寄生虫疾患に対しても有益な効果を示している。
図1 本レビューにおけるイベルメクチンおよびその他のアベルメクチンファミリー化合物の化学構造
IVMは寄生虫に対して強い効果があるだけでなく、抗ウイルス効果も期待できる。IVMは,NS3ヘリカーゼを標的とすることでフラビウイルスの複製を阻害することができる[17]。また,α/β媒介核輸送に作用することでウイルスタンパク質の核輸送を阻害し,HIV-1ウイルスやデング熱ウイルスに対して抗ウイルス活性を発揮する[18]。また、最近の研究では 2020年に世界的な大パンデミックを引き起こしたSARS-CoV-2ウイルスに対しても有望な抑制効果があることが指摘されている[19]。さらに、IVMは喘息[20]や神経疾患[21]への臨床応用の可能性を示している。近年、科学者たちは、IVMに強い抗がん作用があることを発見した。
1996年にIVMが腫瘍の多剤耐性(MDR)を逆転させるという最初の報告がなされて以来[22]、いくつかの関連研究がIVMの新しいがん治療法としての可能性を強調している。
治療法としてのIVMの可能性が強調されてきた[[23], [24], [25], [26], [27]]。多数の関連研究があるにもかかわらず、まだ解決していない重要な問題がいくつかある。まず、IVMが腫瘍細胞に及ぼす細胞毒性の具体的なメカニズムは不明である。IVMが様々なシグナル伝達経路に及ぼす影響に関連している可能性があるが、全体的にはあまり明確ではない。第二に、IVMは腫瘍細胞に混合細胞死を誘発すると思われるが、これも議論のある問題である。そこで、この総説では、IVMの抗がん作用に関する最新の知見をまとめ、腫瘍の増殖抑制のメカニズムと、IVMが腫瘍のプログラム細胞死を誘導する方法について議論し、IVMを抗がん剤として使用する可能性の理論的根拠を提供した。
新規抗がん剤の研究開発コストが増大する中、ドラッグ・リポジショニングの重要性が高まっている。ドラッグ・リポジショニングとは、臨床使用が承認されている薬剤の適応を新たに開発することを指す[28]。本来の適応症で広く使用されており、臨床データや安全性情報を有する一部の旧薬については、ドラッグ・リポジショニングにより、より安価で迅速なサイクルで開発され、臨床でより効果的に使用されるようになる[29]。ここでは、IVMの抗がん作用とそのメカニズムを体系的にまとめ、IVMのがん治療へのリポジショニングに大きな意味を持たせた。
2. さまざまながんにおけるIVMの役割
2.1. 乳がん
乳がんは、複数の発がん物質によって乳房上皮細胞の遺伝子が変異して生じる悪性腫瘍である。乳がんの発生率は年々増加しており、世界的に見ても発生率の高い女性の悪性腫瘍の一つとなっている。平均すると、世界中で18秒ごとに新しい症例が診断されている[30,31]。IVMを投与したところ、MCF-7,MDA-MB-231,MCF-10などの複数の乳がん細胞株の増殖が著しく低下した。そのメカニズムには、IVMによるAkt/mTOR経路の阻害によるオートファジーの誘導が関与しており、p-21-activated kinase 1(PAK1)が乳がんに対するIVMの標的となってた[32]。さらに,Diaoの研究では,IVMがアポトーシスを増加させることなく細胞周期を阻害することで,イヌの乳房腫瘍細胞株CMT7364およびCIPpの増殖を抑制することが示され,IVMのメカニズムはWnt経路の阻害と関連している可能性があるとされている[33]。
トリプルネガティブ乳癌(TNBC)とは、エストロゲン受容体、プロゲステロン受容体、ヒト上皮成長因子受容体2(HER2)が陰性の癌を指し、乳癌の中でも最も侵攻性が高く、予後が悪いサブタイプである。また、現在、臨床的に適用可能な治療薬も存在しない[34,35]。TNBCを対象とした薬剤スクリーニング研究では,IVMがSIN3-interaction domain(SID)の模倣物として使用でき,SIDとペアリングされたa-helix2との間の相互作用を選択的に阻害することが示された。さらに,IVMは上皮間葉転換(EMT)関連遺伝子であるE-カドヘリンの発現を調節し,TNBC細胞のタモキシフェンに対する感受性を回復させたことから,IVMが癌治療においてエピジェネティックな調節因子として機能している可能性が示唆された[36].
最近の研究では,IVMが乳がんの腫瘍微小環境を調節することで,腫瘍細胞の死滅を促進する可能性も明らかになっている。腫瘍細胞の外側に高濃度のアデノシン三リン酸(ATP)が存在する腫瘍微小環境の刺激下では,IVMはP2×4/P2×7/Pannexin-1を介した高移動度グループボックス-1タンパク質(HMGB1)の放出を促進することができた[37].しかし,大量のHMGB1が細胞外に放出されると,免疫細胞を介した免疫原性死や炎症反応が促進され,腫瘍細胞の増殖を抑制する効果があると考えられる。したがって、IVMの抗がん作用は細胞毒性だけではなく、腫瘍微小環境の調節にも関与していると考えられる。IVMは、腫瘍微小環境を調節し、免疫原性細胞死を媒介することで、今後、抗がん作用のメカニズムを探る研究の新たな方向性を示すことができるかもしれない。
2.2. 消化器系のがん
胃がんは、世界的に最も多い悪性腫瘍の一つである。昨年、世界中で100万人以上の胃がん患者が診断された[38]。Nambaraの研究では、IVMが生体内試験および試験管内試験で胃がん細胞の増殖を有意に抑制し、IVMの抑制効果はYes-associated protein 1(YAP1)の発現に依存することが示された[39]。胃癌細胞株MKN1とSH-10-TCは、MKN7とMKN28細胞よりもYAP1の発現が高いため、MKN1とSH-10-TC細胞はIVMに感受性があり、MKN7とMKN28はIVMに感受性がない。YAP1は、腫瘍形成において発癌性の役割を果たしており、IVMをYAP1阻害剤として癌治療に使用できる可能性を示している[40]。
Wnt経路阻害剤をスクリーニングした研究では,IVMは,Wnt経路を阻害することで,大腸がん細胞株CC14,CC36,DLD1,Ls174 Tなどの複数のがんの増殖を抑制し,アポトーシスを促進した[41]。IVMの介入後,DLD1およびLs174 T細胞のカスパーゼ-3の発現が増加したことから,IVMにはアポトーシス誘導作用があり,Wnt/β-カテニン経路の下流遺伝子であるAXIN2,LGR5,ASCL2の発現を阻害することが示された。しかし、Wnt/β-カテニン経路に影響を与えるIVMの正確な分子標的については、まだ解明されていない。
肝細胞がんは、世界のがん死亡原因の第4位である。肝臓がんの約80%は、B型肝炎ウイルス(HBV)およびC型肝炎ウイルス(HCV)の感染が原因である[42]。IVMは、自然発生的な肝臓がんMob1b-/-マウスにおいて、YAP1活性を阻害することで、肝細胞がんの発生を抑制することができた[43]。胆管がんは、肝臓の内外の胆管に発生する悪性腫瘍である。Intuyodの実験では、IVMがKKU214胆管がん細胞の増殖を用量・時間依存的に阻害することがわかった[44]。IVMは、細胞周期をS期で停止させ、アポトーシスを促進した。驚くべきことに,ゲムシタビン耐性のKKU214細胞がIVMに対して高い感受性を示したことから,IVMは従来の化学療法剤に抵抗性のある腫瘍の治療に可能性を示すことが示唆された。
2.3. 泌尿器系がん
腎細胞がんは、尿細管上皮細胞に由来する尿路系の致死性悪性腫瘍である。その罹患率は世界的に毎年平均2%ずつ増加しており,臨床的な治療効果は満足できるものではない[[45],[46],[47]]。実験では、IVMが正常な腎臓細胞の増殖に影響を与えることなく、5つの腎細胞癌細胞株の増殖を有意に阻害することが確認され、そのメカニズムはミトコンドリア機能障害の誘発に関連していると考えられている[48]。IVMは、ミトコンドリアの膜電位を著しく低下させ、ミトコンドリアの呼吸とATP産生を阻害する可能性があった。ミトコンドリア燃料であるアセチル-L-カルニチン(ALCAR)と抗酸化物質であるN-アセチル-L-システイン(NAC)の存在は,IVMによる阻害を逆転させることができた。動物実験では、IVMを投与した腫瘍組織の免疫組織化学的結果から、ミトコンドリアストレスマーカーであるHELの発現が有意に増加していることがわかり、細胞実験の結果と一致した。
前立腺がんは、前立腺上皮細胞に由来する悪性腫瘍で、欧米諸国の男性では肺がんに次いで罹患率が高いとされる[49]。Nappiの実験では、IVMが前立腺がん細胞株LNCaPにおける抗アンドロゲン薬エンザルタミドの薬効を高め、前立腺がん細胞株PC3のドセタキセルに対する耐性を逆転させることがわかった[50]。興味深いことに,IVMはトリプルネガティブ乳がんの抗エストロゲン薬タモキシフェンに対する感受性も回復させた[36]。このことは,IVMが内分泌療法に用いられる可能性も示唆している。さらに,IVMは前立腺がん細胞株DU145に対しても良好な抑制効果を示すことが判明した[51]。
2.4. 血液学的な癌
白血病は、造血幹細胞の異常によって引き起こされる悪性のクローン性疾患の一種である[52]。白血病の治療薬候補をスクリーニングするためにデザインされた実験では,IVMは低濃度で正常な造血細胞に影響を与えずに白血病細胞を優先的に死滅させた[51].そのメカニズムは,IVMによって細胞内への塩化物イオンの流入量が増加し,その結果,細胞膜が過分極され,活性酸素種(ROS)の産生が誘導されることに関係していた。また、IVMが白血病の治療において、シタラビンやダウノルビシンとの相乗効果を発揮することも証明された。Wangの実験では、IVMがミトコンドリア機能障害と酸化ストレスを選択的に誘発し、慢性骨髄性白血病のK562細胞が正常な骨髄細胞と比較してカスパーゼ依存性のアポトーシスを亢進させることが分かった[53]。また、 IVM は用量依存的に腫瘍の成長を阻害し、 ダサチニブは有効性が向上することが確認された。
2.5. 生殖器系がん
子宮頸がんは、最も一般的な婦人科悪性腫瘍の一つであり、全世界で毎年約53万人の新規症例と27万人の死亡者を出している。子宮頸がんの大部分は、ヒトパピローマウイルス(HPV)の感染によって引き起こされる[54,55]。IVMは、HeLa細胞の増殖と移動を著しく阻害し、アポトーシスを促進することが証明されている[56]。IVMの介入後、HeLa細胞の細胞周期はG1/S期でブロックされ、細胞はアポトーシスに関連する典型的な形態変化を示した。
卵巣がんは、初期の臨床症状に乏しく、治療効果も低い悪性のがんである。診断後の5年生存率は約47%である[27,57]。Hashimoto氏の研究では、IVMが様々な卵巣がん細胞株の増殖を抑制し、そのメカニズムはPAK1キナーゼの阻害に関連していることが明らかになった[58]。shRNAライブラリとCRISPR/Cas9ライブラリを用いて、卵巣がん治療のための潜在的なターゲットをスクリーニングする研究では、がん遺伝子KPNB1が検出された。IVMは卵巣がんにおいて、KPNB1依存的なメカニズムで細胞周期を阻害し、細胞のアポトーシスを誘導した[59]。興味深いことに、IVMとパクリタキセルは卵巣がんに対して相乗効果を発揮し、生体内実験では複合治療により腫瘍の成長がほぼ完全に抑制された。さらに、Zhangの報告によると、IVMはシスプラチンの効果を高めて上皮性卵巣がんの治療効果を向上させることができ、そのメカニズムはAkt/mTOR経路の阻害に関連しているという[60]。
2.6. 脳神経膠腫
神経膠腫は最も一般的な脳腫瘍であり、世界中で毎年約10万人が神経膠腫と診断されている。膠芽腫は最も致命的な神経膠腫であり、生存期間の中央値はわずか14〜17ヶ月である[61,62]。実験では,IVMがヒト神経膠芽腫のU87およびT98 G細胞の増殖を用量依存的に阻害し,カスパーゼ依存的にアポトーシスを誘導することが示された[63].これは,ミトコンドリアの機能障害と酸化ストレスの誘導に関連していた。さらに,IVMはヒト脳微小血管内皮細胞のアポトーシスを誘導し,血管新生を有意に抑制した。これらの結果は、IVMが腫瘍の血管新生や腫瘍の転移に抵抗する可能性を示していた。別の研究では,IVMはAkt/mTOR経路を阻害することで,U251およびC6グリオーマ細胞の増殖を抑制した[64]。
グリオーマでは、miR-21はRas/MAPKシグナル経路を制御し、増殖と浸潤に対する効果を高めることができる[65]。DDX23ヘリカーゼ活性は、miR-12の発現に影響を与える[66]。IVMは、DDX23ヘリカーゼの活性に影響を与えることで、DDX23/miR-12シグナル伝達経路を阻害し、悪性の生物学的行動を抑制する可能性がある。このことは、IVMがRNAヘリカーゼ阻害剤として、腫瘍治療のための新しい薬剤となる可能性を示している。しかし、ここで強調しておきたいのは、IVMは血液脳関門を効果的に通過できないため[67]、グリオーマの治療にIVMを使用する見通しは楽観的ではないということである。
2.7. 呼吸器系の癌
鼻咽頭癌は、鼻咽頭粘膜の上皮細胞に由来する悪性腫瘍である。発生率は明らかに地域性、家族性であり、エプスタイン・バー・ウイルス(EBV)感染が密接に関係している[68]。上咽頭癌の治療薬をスクリーニングした研究では,IVMは,正常な胸腺細胞に毒性を示さない用量で,ヌードマウスにおける上咽頭癌の発生を有意に抑制した[69].さらにIVMは,試験管内試験でさまざまな鼻咽頭がん細胞に対しても細胞毒性を示し,そのメカニズムは,PAK1キナーゼ活性を低下させてMAPK経路を阻害することに関係しているという。
肺がんは、がんの中でも罹患率と死亡率が最も高いがんである[70]。西尾氏は、IVMがYAP1活性を阻害することで、H1299肺がん細胞の増殖を有意に抑制できることを発見した[43]。また、Nappiの実験では、HCC827肺がん細胞において、IVMとエルロチニブを併用することで、EGFR活性を制御し、相乗的な殺傷効果を発揮することが証明された[50]。さらに、IVMはEMTを阻害することで、肺がん細胞の転移を抑えることができた。
2.8. メラノーマ
メラノーマは、最も一般的な悪性皮膚腫瘍であり、高い死亡率を示する。ベムラフェニブ、ダブラフェニブなどのBRAF変異を標的とする薬剤や、ペムブロリズマブ、ニボルマブなどのPD-1モノクローナル抗体は、メラノーマの予後を大きく改善した[71,72]。Gallardoは、IVMでメラノーマ細胞を処理し、メラノーマの活動を効果的に阻害できることを発見した[73]。興味深いことに,IVMはBRAF野生型のメラノーマ細胞に対しても活性を示すことができ,ダパフィニブとの併用で抗腫瘍活性が大幅に向上した。さらに,PAK1がIVMの抗メラノーマ活性を媒介する重要な標的であることが確認されており,IVMは動物実験においてメラノーマの肺転移を有意に減少させることもできる。Dengは,IVMがSK-MEL-28メラノーマ細胞において,TFE3の核内移行を活性化し,TFE3(Ser321)を脱リン酸化することで,オートファジー依存性の細胞死を誘導することを見出した[74]。しかし,NACはIVMの効果を逆転させたことから,IVMは活性酸素シグナル経路を介してTFE3依存性のオートファジーを増加させることが示唆された。
3. IVMが腫瘍細胞にもたらすプログラムされた細胞死とそのメカニズム
3.1. アポトーシス
IVMは、様々な腫瘍細胞に異なるプログラムされた細胞死のパターンを誘導する(表1)。表1に示すように、IVMによるプログラム細胞死の主な形態はアポトーシスである。アポトーシスは、細胞の安定性を維持するために遺伝子によって制御されているプログラムされた細胞死である。アポトーシスは、内因性の小胞体ストレス/ミトコンドリア経路と外因性のデスレセプター経路という2つの活性化経路によって引き起こされる[75,76]。Hela細胞にIVMを投与すると、ミトコンドリアの膜電位が低下し、ミトコンドリアから細胞質にシトクロムcが放出されることが確認されている[56]。さらに、クロマチン凝縮、核の断片化、DNAの断片化、アポトーシス小体の形成など、アポトーシスによる形態的変化が観察された。最後に、IVMはアポトーシスに関連するタンパク質のバランスを変化させ、タンパク質Baxをアップレギュレートし、抗アポトーシスタンパク質Bcl-2をダウンレギュレートすることで、カスパーゼ-9/3を活性化し、アポトーシスを誘導した[48,53,63](図2)。
表1 IVMがプログラムされた細胞死を促進することをまとめたもの
| プログラム細胞死 | 腫瘍細胞株 | 参考文献 |
|---|---|---|
| アポトーシス | HelaColorectal癌(CC14、CC36、DLD1、Ls174 T)卵巣癌(SKOV3、OVCAR3、CAOV3)腎細胞癌(SW-839、Caki-2、786-O、A498、ACHN)白血病(K562、原発性CD34 + CML細胞) 神経膠芽腫(U87、T98 G) |
[ 56 ] [ 41 ] [ 59 ] [ 48 ] [ 53 ] [ 63 ] |
| オートファジー | 神経膠腫(U251、C6)乳がん(MCF-7、MDA-MB-231)黒色腫(SK-MEL-28) | [ 64 ] [ 32 ] [ 74 ] |
| ピロトーシス | 乳がん(MDA-MB-231,4T1) | [ 37 ] |
図2 IVMによるミトコンドリアを介したアポトーシスのメカニズム
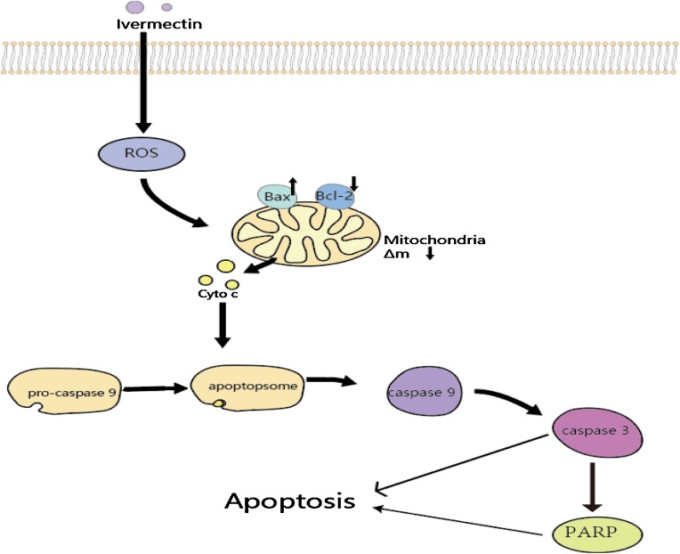
IVMを投与されたがん細胞は、活性酸素を発生させ、ミトコンドリアの膜電位を低下させる。さらに、IVMはBaxを上昇させ、Bcl-2を下降させ、シトクロムCの細胞質への放出を促進し、カスパーゼ-9/3のシグナルカスケードを活性化する。最後に、活性化されたPARPとカスパーゼ-3がアポトーシスを引き起こす。
3.2. オートファジー
オートファジーは、リソソームに依存したプログラムされた細胞死である。オートファジーは、リソソームを利用して、細胞質内の余分な小器官や損傷した小器官を排除し、恒常性を維持する。これは、オートファゴソームとして知られる、細胞質成分を含む二重または多層の液胞構造によって特徴づけられる[77]。
近年、多くの研究により、オートファジーが腫瘍の発生において両刃の剣であることが示されている。一方で,オートファジーは,腫瘍が腫瘍微小環境の栄養不足に適応するのを助け,化学療法や放射線療法によって引き起こされる傷害から腫瘍細胞をある程度保護することができる。その一方で、オートファジー活性化因子の中には、オートファジーを誘導することで、放射線療法や化学療法に対する腫瘍の感受性を高めるものがあり、オートファジーの過剰な活性化は、腫瘍細胞の死につながる可能性もある[[78]、[79]、[80]、[81]]。
総合的に見て、オートファジーが腫瘍の発生を促進するか抑制するかは、腫瘍細胞の特定の環境によって決まり、オートファジーの活性を向上させることもまた、がん治療の新しいアプローチとなっている。
IVM介入後のオートファジーを介したプログラムされた細胞死や、オートファジーを調節することによるIVMの抗がん作用の増強は、興味深いテーマである。乳がん細胞株MCF-7およびMDA-MB-231にIVMを介入させると、細胞内オートファジーフラックスが有意に増加し、LC3,Bclin1,Atg5などの主要なオートファジータンパク質の発現やオートファゴソームの形成が観察される[32]。しかし,オートファジー阻害剤であるクロロキンやワートマニンを用いたり,Bclin1やAtg5をsiRNAでノックダウンしてオートファジーを阻害したりすると,IVMの抗がん作用は著しく低下した。これは、IVMが主にオートファジー経路を介して抗腫瘍効果を発揮することを証明している。さらに研究者たちは、Akt活性化剤CA-Aktを用いて、IVMが主にAktとmTORのリン酸化を阻害することでオートファジーを誘導することも証明した(図3)。IVMがオートファジーを誘導する現象は、グリオーマやメラノーマでも報告されている[ 64,74]。以上の知見はすべて、IVMがオートファジー活性化剤として腫瘍細胞にオートファジー依存性の死を誘導する可能性を示している。
図3 IVMによるPAK1/Akt/mTORを介したオートファジーのメカニズム
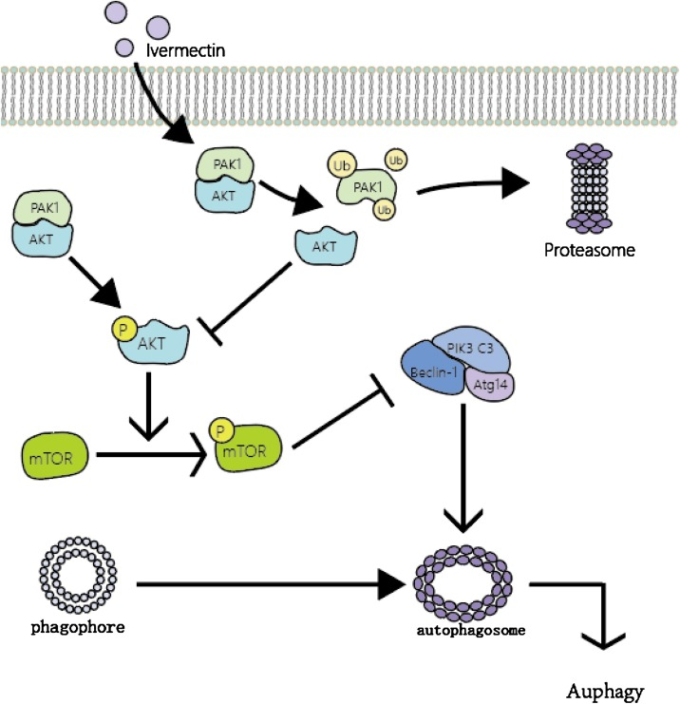 IVMは、ユビキチン化/プロテアソーム経路によるPAK1の分解を促進し、Akt/mTORシグナル経路を阻害する。その後、Akt/mTORシグナルが不活性化されると、Beclin-1複合体の形成が阻害され、オートファゴソームの形成が誘導されることになる。以上のことから、IVMはPAK1/Akt/mTOR経路を介してオートファジーを誘導し、アポトーシスとは独立してがん細胞の増殖を抑制することができる。(Ub:ユビキチン化, P:リン酸化)
IVMは、ユビキチン化/プロテアソーム経路によるPAK1の分解を促進し、Akt/mTORシグナル経路を阻害する。その後、Akt/mTORシグナルが不活性化されると、Beclin-1複合体の形成が阻害され、オートファゴソームの形成が誘導されることになる。以上のことから、IVMはPAK1/Akt/mTOR経路を介してオートファジーを誘導し、アポトーシスとは独立してがん細胞の増殖を抑制することができる。(Ub:ユビキチン化, P:リン酸化)
3.3. IVMで誘導されるアポトーシスとオートファジーのクロストーク
アポトーシスとオートファジーの関係は非常に複雑であり、この2つのクロストークが癌の発生に重要な役割を果たしている[82]。明らかに、既存の結果は、IVMによって誘導されたアポトーシスとオートファジーもクロストークを示すことを示唆している。例えば、SK-MEL-28メラノーマ細胞では、IVMがアポトーシスだけでなく、オートファジーも促進することがわかっている[74]。
オートファジー阻害剤であるバフィロマイシンA1やベクリン1をダウンレギュレートするsiRNAを使用した後、IVMによるアポトーシスが有意に増強されたことから、オートファジーの増強はIVMによるアポトーシスを減少させ、IVMによるオートファジーは腫瘍細胞をアポトーシスから守ることができることが示唆された。しかし、乳がん細胞の実験では、IVMがオートファジーを誘導し、オートファジーを増強することでIVMの抗がん作用を高めることができることもわかった[37]。
最新の研究では、通常の状況では、オートファジーがアポトーシスの誘導を妨げ、アポトーシスに関連するカスパーゼ酵素の活性化がオートファジーを阻害することがわかっている。しかし、特殊な状況では、オートファジーがアポトーシスやネクローシスの誘導を助けることもある[83]。要するに、IVMによるアポトーシスとオートファジーの関係は、複雑な制御メカニズムを含んでおり、その具体的な分子メカニズムはさらなる研究が必要である。私たちは、このメカニズムをより深く探求することで、がん治療におけるIVMの使用をさらに導くことができると考えている。
3.4. パイロトーシス
パイロトーシスは、インフラマソームによって誘導される炎症性細胞死の一種である。フラマソームは、パターン認識受容体(PRR)アポトーシス関連斑点状タンパク質(CARDを含む)(ASC)プロカスパーゼ-1を含む多分子複合体である。PRRは、病原性微生物の表面に構造的に安定で進化的に保存されている病原体関連分子パターン(PAMP)と、損傷を受けた細胞が産生する損傷関連分子パターン(DAMP)を識別することができる[84,85]。インフラマソームは,自己剪断によってプロカスパーゼ-1を活性化カスパーゼ-1に変換することを開始する.活性化されたカスパーゼ-1は、プロ-IL-1βとプロ-IL-18を成熟させ、分泌させる。ガスダーミンD(GSDMD)は、活性化カスパーゼ-1の基質であり、パイロトーシスの実行において重要なタンパク質であると考えられている[86,87]。
Draganovによる実験では、乳がん細胞において、乳酸脱水素酵素(LDH)と活性化カスパーゼ-1の放出が、IVM介入後に有意に増加することが明らかにされた[37]。さらに、細胞の膨潤や破裂といった特徴的なパイロトーシス現象が観察された。著者らは、IVMがP2×4/P2×7/NLRP3経路を介してパイロトーシスの発生を媒介しているのではないかと推測しているが(図4)この推測を証明する具体的な証拠は存在しない。興味深いことに、虚血再灌流実験において、IVMはP2 × 7/NLRP3経路を介して腎虚血を悪化させ、ヒト近位尿細管細胞における炎症性サイトカインの放出を増加させた[ 88] 。
現在のところ、IVMがパイロトーシスを誘導することを示す証拠はほとんどないが、今後の研究で、他のがんにおけるパイロトーシスの誘導におけるIVMの役割を調査し、IVMが異なる種類のがんで異なる種類のプログラムされた細胞死を誘導する可能性があることを認識することが重要である。
図4 IVMが誘導するP2×4/P2×7/NLRP3を介したパイロトーシスのメカニズム
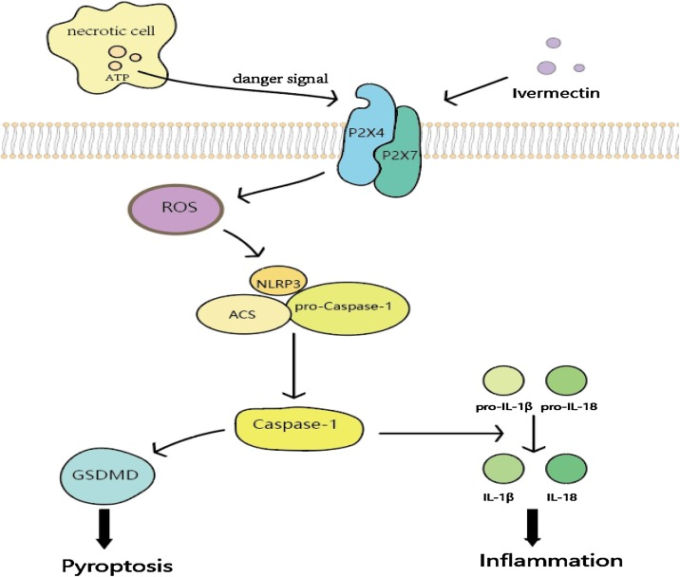
IVMはP2×4/P2×7受容体によってがん細胞の活性酸素の放出を促進する。活性酸素は、ASC、NLRP3,pro-caspase-1を含むNLRP3 Inflammasomeを活性化する。その後、NLRP3 Inflammasomeはpro-caspase-1の自己剪断を開始し、成熟したcaspase-1へと変化する。活性化されたカスパーゼ-1は、炎症性サイトカインであるIL-1βやIL-18の分泌を誘導する。一方、GSDMDによって活性化されたカスパーゼ-1は、アポトーシスとは独立したパイロトーシスを誘発する。
4. IVMの他の経路による抗がん作用
4.1. 癌幹細胞
癌幹細胞(CSC)は、腫瘍組織において自己再生と分化の可能性という特徴を持つ、幹細胞に類似した細胞集団である[89,90]。CSCは機能的には幹細胞に似ているが、幹細胞の自己再生に対する負のフィードバック制御機構がないため、その強力な増殖力と多方向への分化能力には制限がなく、化学療法や放射線療法を受けても一定の活動を維持することができる[[90], [91], [92]]。外部環境が適切であれば、CSCは急速に増殖し、腫瘍の形成と成長を再活性化する。したがって、CSCは、治療後の再発の主な原因として広く認識されている[93,94]。
Guadalupeは、乳がん細胞株MDA-MB-231におけるCSCに対するIVMの効果を評価した[95]。実験の結果、MDA-MB-231細胞において、IVMは他の細胞集団に比べてCSCが豊富な細胞集団を優先的に標的とし、阻害することがわかった。さらに、CSCの幹細胞の自己再生能力や分化能力に密接に関係するホメオボックスタンパク質NANOG、オクタマー結合タンパク質4(OCT-4)SARY-box 2(SOX-2)の発現も、IVMによって有意に抑制された。このことは、IVMがCSCの阻害剤としてがん治療に利用できる可能性を示唆している。さらに、IVMがPAK1-STAT3軸を調節することでCSCを阻害できることが示された[96]。
4.2. 腫瘍の多剤耐性の回復
腫瘍細胞の多剤耐性は、化学療法後の再発や死亡の主な原因である[97]。ATP結合輸送ファミリーを介した薬物排出とP-glycoprotein(P-gp)の過剰発現が、腫瘍のMDRの主な原因であると広く考えられている[[98], [99], [100]]。
いくつかの研究では,IVMがP-gpおよびMDR関連タンパク質を阻害することで,薬剤耐性を回復させることが確認されている[[101],[102],[103]].リンパ性白血病に対するIVMの効果を検証したDidierの実験では、IVMはMDRに影響を与えるP-gpの阻害剤として使用することができた[22]。Jiangの実験では、IVMはビンクリスチン耐性大腸がん細胞株HCT-8,ドキソルビシン耐性乳がん細胞株MCF-7,慢性骨髄性白血病細胞株K562の薬剤耐性を逆転させた[104]。IVMは,EGFRの活性化と下流のERK/Akt/NF-kappa Bシグナル経路を阻害して,P-gpの発現をダウンレギュレートした。先に,ドセタキセル抵抗性の前立腺がん[50]やゲムシタビン抵抗性の胆管がん[44]におけるIVMの役割について言及した。これらの結果は、MDRを有する化学療法患者の治療にIVMを適用することの意義を示している。
4.3. 強化された標的治療と複合治療
肺がんのEGFRや乳がんのHER2など、がんの主要な変異遺伝子を標的とした治療は、強力な臨床効果を得ることができる[105,106]。HSP27は,多くのがんで高発現しており,薬剤耐性や予後不良と関連する分子シャペロンタンパク質である。癌治療の新しいターゲットとして考えられている[107]。
最近の研究では、IVMがHSP27のリン酸化の阻害剤として使用され、EGFR/HER2駆動腫瘍における抗EGFR薬の活性を高めることができることがわかった。ある実験では、IVMが肺がんと大腸がんに対するエルロチニブとセツキシマブの阻害効果を著しく高めることがわかった[50]。先に、シスプラチン[60]、パクリタキセル[59]、ダウノルビシンとシタラビン[51]などの従来の化学療法剤や、ダサチニブ[53]やダパフェニブ[73]などの標的薬剤とIVMを併用すると、がん治療に大きな可能性があると述べた。
薬剤を併用することで、効果的に有効性を高めたり、毒性を抑えたり、薬剤耐性を遅らせたりすることができる。そのため、化学療法では併用療法が最も一般的な方法となっている。
IVMは、さまざまながんに対して異なる作用機序を持っており、併用療法における相乗効果や有効性の向上が期待できることから、私たちは特に関心を持った。IVMの作用機序は他の治療法と重ならないだけでなく、IVMには複数の標的があることから、IVM耐性を作ることは容易ではないと考えられる。したがって、IVMの抗がん作用を最大限に発揮させるためには、安全で効果的な併用療法を継続的に研究・検証することが不可欠である。
5. IVMの抗がん作用に関わる分子標的とシグナル伝達経路
前述のように、IVMの抗がん作用のメカニズムには、Wnt/β-カテニン、Akt/mTOR、MAPKなどのシグナル伝達経路や、PAK1,HSP27などの標的となりうる分子が広く関与している(表2 )。我々は、IVMがほとんどの癌において、PAK1依存的に腫瘍細胞の発生を抑制することを発見した。その結果、PAK1キナーゼの役割と、様々な経路とPAK1のクロストークについて議論することで、IVMの機能のメカニズムに新たな視点を提供することに集中した。
表2 IVMの抗がん作用メカニズムの概要
| 機構 | がんの種類 | 参考文献 |
|---|---|---|
| Wnt経路を阻害する | 乳がん、結腸直腸がん | [ 33、41 ] |
| Akt / mTOR経路を阻害する | 乳がん、卵巣がん、神経膠腫 | [ 32、60、64 ] |
| MAPK経路を阻害する | 上咽頭癌黒色腫 | [ 69、73 ] |
| YAP1タンパク質を阻害する | 胃がん、肝臓がん | [ 39、43 ] |
| PAK1タンパク質を阻害する | 乳がん、卵巣がん、鼻咽頭がん、黒色腫 | [ 32、58、69、73、96 ] |
| HSP27を禁止する | 前立腺がん、肺がん結腸直腸がん | [ 50 ] |
| ミトコンドリア機能障害を誘発する | 腎細胞がん、神経膠腫白血病 | [ 48、53、63 ] |
| がん幹細胞を阻害する | 乳癌 | [ 95、96 ] |
| p糖タンパク質とMDRタンパク質を阻害する | 結腸直腸がん、乳がん白血病 | [ 22、104 ] |
| P2×7受容体を活性化する | 乳癌 | [ 37 ] |
| SIN3ドメインを禁止する | 乳癌 | [ 36 ] |
| DDX23ヘリカーゼを阻害する | 神経膠腫 | [ 66 ] |
| 塩化物チャネルを活性化する | 白血病 | [ 51 ] |
| TFE3アクティビティを増やす | 黒色腫 | [ 74 ] |
| KPNB1タンパク質を阻害する | 卵巣がん | [ 59 ] |
PAK1 は,セリン/スレオニンキナーゼである PAK ファミリーの一員として,細胞の増殖やアポトーシス,細胞運動,細胞骨格の動態,形質転換の制御など,多数の生物学的機能を有している [108]。これまでの研究で、PAK1は、腫瘍形成に関連する複数のシグナル伝達経路の交差点に位置しており、がんのシグナル伝達ネットワークの重要な調節因子であることが指摘されている(図5)。PAK1の過剰な活性化は、さまざまながんの形成、発生、浸潤に関与している[109,110]。PAK1を標的とすることは、がん治療の新規かつ有望な方法であり、PAK1阻害剤の開発が広く注目されている[111]。
IVMは,さまざまな腫瘍におけるPAK1阻害剤であり,IPA-3のような他のPAK1阻害剤と比較して,良好な安全性を有している。メラノーマや鼻咽頭癌では,IVMはPAK1を阻害してMEK1/2やERK1/2の発現を低下させることで細胞増殖活性を抑制した[69,73]。乳がんにIVMを介入させたところ,PAK1の発現も有意に抑制され,腫瘍細胞におけるPAK1の発現をダウンレギュレートするためにsiRNAを使用すると,IVMの抗がん作用が有意に低下した。興味深いことに,IVMはPAK1タンパク質の発現を抑制することができたが,PAK1 mRNAの発現には影響を与えなかった[32]。
プロテアソーム阻害剤であるMG132がIVMの抑制効果を逆転させたことから,IVMは主にプロテアソームのユビキチン化経路を介してPAK1を分解していると考えられた。IVMは、がんの発生に密接に関係する経路を制御することで、さまざまな腫瘍で抗がん作用を発揮していることはすでに述べたとおりである。PAK1はこれらの経路の分岐点に位置している。総合すると、IVMは、ほとんどのがんで抗がん作用を発揮するPAK1の発現を抑制することで、腫瘍細胞の増殖に不可欠なAkt/mTOR、MAPKなどの経路を制御することができると推測される。
図5 PAK1は複数のシグナルパスウェイを相互に制御している
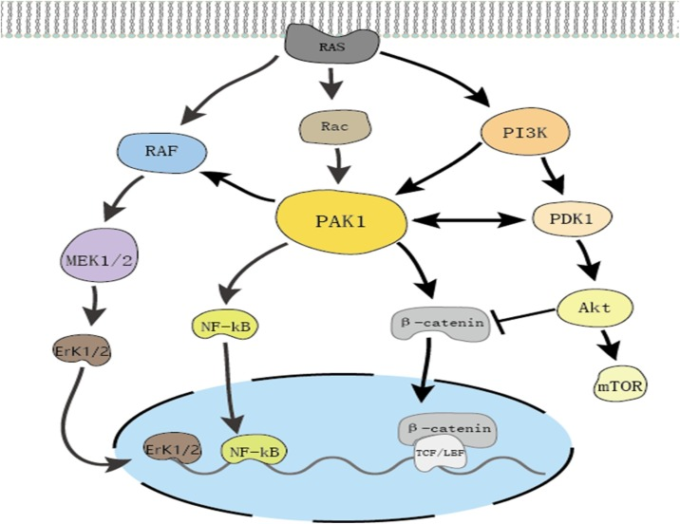
RASの活性化は、PAK1,MAPK、PI3K/Aktの経路を直接開始する。PAK1は、PI3K経路とMAPK経路のクロストークを割り当てる。PAK1は、RAFによるMEK1/2およびERK1/2の活性化を誘導し、PDK1によるPI3K/Aktシグナルを増加させる。また、PAK1は、Wnt/β-カテニンシグナルを促進し、β-カテニンを細胞質に蓄積させ、核に移行させることができる。さらに、Aktはβ-カテニンの核への移行を抑制することができる。
6. まとめと展望
悪性腫瘍は、今日の人類の健康と社会の発展を脅かす最も深刻な疾患の一つであり、化学療法は悪性腫瘍の治療のための最も重要な方法の一つである。近年、多くの新しい化学療法剤が臨床現場に登場しているが、腫瘍細胞は薬剤耐性を持ちやすく、これらの薬剤に対して明らかな副作用を示す。そのため、抵抗性を克服し、抗がん作用を向上させ、副作用を軽減することができる新しい薬剤の開発は、化学療法において解決すべき緊急の課題である。薬剤の再配置は、抗がん剤の開発を加速するための近道である。
前述のように、寄生虫駆除の分野で広く使われている広域抗寄生虫薬IVMは、新しい抗がん剤の候補として開発する価値があることを示唆する多くの利点を持っている。IVMは、正常細胞には毒性のない用量で腫瘍の増殖を選択的に阻害し、腫瘍のMDRを逆転させることができる。
重要なのは、IVMが河川盲目症や象皮病などの寄生虫疾患の治療に使用されている確立された薬剤であることである。長年にわたりヒトに広く使用されており、長期・短期の毒性作用や薬物代謝特性など、さまざまな薬理学的特性が非常に明確である。健康なボランティアでは2mg/Kgまで増量しても重篤な副作用は認められなかったが,マウス,ラット,ウサギなどの動物を用いた試験では,IVMの致死量(LD50)の中央値は10~50mg/Kgであった[112]。 また,IVMは腫瘍組織において良好な伝染性を示すことも証明されている[50]。残念ながら,IVMを抗がん剤として臨床試験を行ったという報告はない。IVMを臨床で使用するためには、研究し解決しなければならない問題がいくつか残っている。
- (1)IVMが腫瘍細胞の複数のシグナル伝達経路に作用し、増殖を抑制することを示す多くの研究結果があるが、IVMは特定の標的を介して腫瘍細胞に抗腫瘍活性をもたらす可能性がある。しかし、現在までのところ、IVMの作用の正確な標的は見つかっていない。
- (2)IVMは、腫瘍微小環境を制御し、腫瘍幹細胞の活動を抑制し、腫瘍の血管新生や腫瘍転移を抑制する。しかし、関連する分子メカニズムについては、体系的で明確な結論は出ていない。したがって、今後の研究では、腫瘍の微小環境、血管新生、EMTの制御に関わるIVMの具体的なメカニズムを引き続き解明する必要がある。
- (3)IVMは、細胞の状態やがんの種類によって、アポトーシス、オートファジー、パイロトーシスなどの混合型の細胞死を誘導することが明らかになってきた。それぞれの癌の種類や環境において、細胞死に優勢な、あるいは最も重要な寄与をする因子を特定することは、IVMを用いた治療法の効果を決定する上で極めて重要である。
- (4)IVMは、化学療法剤の感受性を高め、耐性の生成を抑えることができる。そのため、IVMは他の薬剤と併用して効果を発揮する必要があるが、IVMと他の薬剤を併用する際の具体的な投薬計画についてはまだ検討されていない。
エバーメクチンファミリーで行われてきた抗がん剤研究のほとんどは、これまでエバーメクチンとIVMに焦点を当ててきた。セラメクチン[36,41,113]やドラメクチン[114]などのエバーメクチンファミリーの薬剤も、これまでに報告されているように抗がん作用がある。より効率的で毒性の低いエバーメクチンファミリーの誘導体が開発されているため、誘導体の抗がん作用のメカニズムに関する関連研究には大きな価値がある。既存の研究は、IVMの大きな可能性を示すのに十分であり、さらに研究を進めれば、新規の有望な抗がん剤としての可能性も出てく。近い将来、IVMがさらに開発され、新しいがん治療の一部として臨床導入されることを確信している。