Is There a Link between Bisphenol A (BPA), a Key Endocrine Disruptor, and the Risk for SARS-CoV-2 Infection and Severe COVID-19?
www.mdpi.com/2077-0383/9/10/3296/htm
要旨
重症急性呼吸器症候群(SARS)コロナウイルス-2(SARS-CoV-2)による感染は、新たな疾患(COVID-19)の原因物質である。重症COVID-19のリスクは、喘息、癌、心血管疾患、高血圧、糖尿病、および肥満を含む特定の基礎的な併存疾患によって増加する。
特に、内分泌かく乱化学物質(EDC)と呼ばれるホルモン活性化学物質への暴露は、そのような心代謝性疾患、内分泌関連の癌、および免疫系の制御異常を促進し、したがって、重度のCOVID-19のリスクの増加にも関連している可能性がある。
ビスフェノールA(BPA)は、最も一般的なEDCの一つであり、核内エストロゲン受容体(ERα、ERβ)膜結合型エストロゲン受容体(Gタンパク質共役型受容体30,GPR30)ヒト核内受容体エストロゲン関連受容体γなど、ヒト組織に広く分布する受容体を介してその作用を発揮する。
そこで本論文では,重度の COVID-19 に伴う合併症を促進する BPA の潜在的な役割と,アンジオテンシン変換酵素 2(ACE2)や膜貫通型セリンプロテアーゼ 2(TMPRSS2)などの主要な SARS-CoV-2 感染メディエーターへの BPA 誘導作用に焦点を当てている。
興味深いことに、GPR30 は肺や前立腺などの重要な組織で TMPRSS2 とより大きな共局在性を示しており、BPA 曝露がこれらの SARS-CoV-2 感染メディエーターの局所発現に影響を与えている可能性が示唆された。以上のことから、COVID-19のリスクと重症度に対するBPAの潜在的な役割については、さらなる調査が必要であると考えられる。
キーワード
SARS-CoV-2; COVID-19; BPA; エストロゲン受容体; ACE2; TMPRSS2; 内分泌撹乱因子
1. 序論
新型重症急性呼吸器症候群(SARS)コロナウイルス-2(SARS-CoV-2)による感染は、重症の新疾患、すなわちCOVID-19を引き起こす。2019年末のCOVID-19症例の最初のアウトブレイクに続いて、COVID-19は数ヶ月以内にパンデミック状態に達した[1]。データの増加は、特定の基礎疾患/疾患がCOVID-19の有害な臨床転帰の有意に高いリスクとの直接的な関連性を示していることを示している[1]。実際、慢性呼吸器疾患(例えば、喘息および慢性閉塞性肺疾患)心血管疾患(心血管疾患)高血圧、糖尿病、免疫抑制、および癌は、重度のCOVID-19を発症させる要因となる共存疾患として同定されている[1]。
内分泌かく乱化学物質(EDC)は、動物およびヒトにおける内分泌系の正常な機能をかく乱し、健康への悪影響のリスクを高める外因性物質である[2]。一般的なEDCには、工業用溶剤または潤滑剤とその副産物、殺虫剤、殺菌剤、可塑剤(ビスフェノールA(BPA)やフタル酸塩など)医薬品が含まれる[3]。EDCは環境中に広く分布しており、親油性化学物質の特徴である半減期が長く、体内で代謝できないため、食物連鎖全体に蓄積する可能性がある [4]。米国疾病対策予防管理センター(CDC)のデータによると、ヒトはEDCを含む数百種類の化学物質に曝される可能性があることが示唆されている[3]。注目すべきは、EDCへのヒトの曝露の増加および/または長期化は、心代謝機能障害、生殖系の障害、内分泌関連の癌、および免疫系の調節障害を引き起こす可能性があることが研究で示唆されていることである[5]。
COVID-19に関するより多くのデータが利用可能になるにつれ、肥満[6]や低い社会経済的背景および/または黒人、アジア人、少数民族(BAME)背景[7]などの因子を含む、関連する素因となる危険因子の同定数が増加しており、これらはEDCへの曝露量の増加にも関連している可能性がある[8,9]。実際、最近のレビューでは、混合物中の化学物質への長期暴露や生活習慣が、免疫力の低下と関連している可能性があり、重度のCOVID-19患者で観察される合併症を引き起こす要因となることが提案されている[10]。さらに、計算システム生物学的アプローチにより、EDCによって制御不能になる多くのシグナル伝達経路(例えば、Th17および高度糖化最終産物(AGE)/AGE受容体(RAGE)AGE/RAGE、経路)もCOVID-19の重症度と関連している可能性があることが明らかになった[11]。EDCのこれらの有害作用は重症COVID-19の主要な危険因子と重なっているため、EDCへの曝露もCOVID-19の重症度と関連している可能性があるという仮説は、さらなる調査に値する[12]。
様々なEDCの中でもBPAは、プラスチック、耐熱レシート、アルミ缶のライニングなど、様々な製品に広く使用されている[13]。このため,BPA は環境中で最も頻繁に検出されている汚染物質の一つである[14].そこで本稿では,重症COVID-19のリスクを高める併存疾患の発症を促進するBPAの潜在的な役割と,SARS-CoV-2の感染を媒介する主要な分子標的に対するBPAの影響に焦点を当てた。
2. 重症COVID-19を引き起こすBPAと併存疾患
2.1. BPAと心血管疾患
BPA は,現在,心代謝性疾患の発症に関与する潜在的な追加因子として認識されている[15].実際,BPA は脂肪組織に蓄積し,脂肪細胞の数とサイズを増加させるため,脂肪率の上昇と体重増加に寄与している[16].さらに,関連する疫学的証拠をメタアナリシスした最近のシステマティックレビューでは,BPA 曝露が全身性肥満および中心部/腹部肥満の両方の指標と有意な正の相関を示すことが報告されている[17,18].同様に,システマティックレビューのデータからも,BPA 暴露と 2 型糖尿病(2型糖尿病M)との関連性が示唆されている[19].また,BPA曝露は,小児期および晩年期の脂肪率とも関連している可能性がある[20].さらに,胎児の発育に重要な時期(胎児期など)の低用量BPA曝露と2型糖尿病Mなどの代謝性疾患との間にも正の相関があることが報告されている[21].
疫学的および機序論的研究から得られたデータからも,メタボリックシンドロームの主要な構成要素であり,世界的に主要な 心血管疾患 危険因子である高血圧と BPA 暴露の増加との関連性が示唆されている[22].特に、この正の関連性は、年齢、性別、喫煙、肥満度指数(BMI)糖尿病、コレステロール値などの交絡因子とは無関係に、米国の成人を対象とした多民族サンプルで報告されている[25]。National Health and Nutritional Examination Survey(NHANES)の1380人の被験者において、年齢、性別、人種・民族、糖尿病、喫煙、BMI、血清総コレステロール値などの交絡因子とは無関係に、尿中BPA濃度と高血圧との間に正の相関が認められた[25]。このことは、タイの NHANES の血清サンプル 2588 例を対象とした別の研究でも裏付けられており、BPA は年齢、性別、BMI、糖尿病、エストロゲンレベルとは独立した高血圧症との正の関連を示していた [26]。最後に、ソウルで560人の高齢者を対象にした最近の研究では、BPA曝露は心血管疾患の危険因子である血圧上昇と心拍変動の低下と関連していた[27]。さらに,基礎となるメカニズムについては,多くの研究がBPAの血管機能障害への関与を示唆している.例えば、人口ベースの研究である Prospective Investigation of the Vasculature in Uppsala Seniors studyでは、BPAは頸動脈の動脈硬化性プラークのエコー原性と関連しており、動脈硬化におけるプラーク関連化学物質の役割が示唆されている[28]。さらに、青年および若年成人を対象とした横断的研究では、高濃度の BPA 血清も頸動脈内膜厚の増加と関連していた [29]。これらの知見に関連して,BPA を雄性ラットに投与した 生体内試験 研究では,BPA は酸化ストレス状態を誘発し,フリーラジカルの過剰産生につながる心毒性作用を示すことが示された [30].さらに、心筋芽細胞を用いた最近の研究では、BPA は 心血管疾患 に関与する炎症性インターロイキン(IL)(IL-8,IL-6,IL-1β)を誘導すると同時に、ドキソルビシン誘発性の心毒性現象を促進した[31]。
最後に、BPAと循環アンドロゲンレベルとの間の強い関係が示されており、卵巣機能障害や多嚢胞性卵巣症候群(PCOS)との関連が示唆されている[32]。また、後者は女性のメタボリックシンドローム[33,34]にも強く関連しており、システマティックレビューのデータでは、BPAがPCOSの高アンドロゲン血症とインスリン抵抗性の両方に関与していることが示唆されている[35,36]。
全体的に見ると,心血管疾患 やメタボリックシンドロームのスペクトルに共通して分類されるこれらの慢性疾患(肥満,2型糖尿病M,高血圧など)は,現在では一貫して重度の COVID-19 の素因となる重要な因子として認識されていることは注目に値する[37,38,39,40,41,42].したがって,これらの心代謝性疾患の発症を長期的に促進する BPA 曝露も,特に重症 COVID-19 のリスクが高い高齢者において,間接的に重症 COVID-19 のリスク上昇と関連している可能性がある [43].
2.2. BPA と癌
BPA曝露は、特に前立腺がん、乳がん、卵巣がんなどのホルモン依存性腫瘍の発がん性と関連している [44]。このように、出生前の BPA 曝露は後世の前立腺がんの発生に影響を与え、胎児腺の変化や腫瘍細胞のエストロゲン依存性の増殖を媒介することで乳房腫瘍の発生頻度を増加させる可能性がある[16]。興味深いことに、ヒトの曝露量の範囲内の BPA レベルに曝露した妊娠マウスでは、前立腺の容積が増加し、成人男性の子孫では精子の生産量が減少していた [45,46,47]。さらに、試験管内試験 および動物実験の両方から、低用量であっても BPA 暴露が乳がんに発がん性影響を及ぼす可能性があることを示唆する証拠が増加している [48]。さらに、BPAは子宮内膜症のリスクを高めると考えられており、冠動脈性心疾患と卵巣がんの両方のリスクを高めると考えられている[49,50]。最後に、BPA曝露は子宮内膜間質細胞の浸潤を誘発する可能性があり、腹膜内膜症との間に正の相関があるとされている[51]。
今日までに、メタアナリシスデータを含む証拠が増加しており、がんの併存率がCOVID-19のリスクおよび重症度の両方との関連を示していることが示されている [52]。COVID-19の診断が確定した156人のがん患者を対象とした最近の英国の研究では、がんで長生きしている患者はCOVID-19に関連した死亡だけでなく、感染のリスクも高いことが示されている [53]。注目すべきは、泌尿器系/婦人科系、乳がん、肺がん、および血液学的悪性腫瘍を有するがん患者は、重度のCOVID-19を呈していたことである[53]。前述したように、BPAは特定の癌の発生に関与しており、多くのメカニズムが提案されている。例えば、マウス乳腺腫瘍ウイルス(MMTV)erbB2マウスを子宮内で低用量のBPAに曝露すると、乳腺腫瘍の発生と、エストロゲン受容体(ER)erbB2経路が関与する乳腺上皮のリプログラミングが起こることが示されている[54]。同様に、成体CD-1マウスをBPAに周産期に曝露すると、乳腺管内過形成が誘導されることが示された[55]。さらに、BPA はトリプルネガティブ乳がん細胞の遊走と浸潤を増加させると同時に、マトリックスメタロプロテアーゼ-2(MMP-2)と MMP-9 のタンパク質発現を誘導したという 試験管内試験結果も報告されている[56]。
しかしながら、がん(他の併存疾患を含む)のCOVID-19重症度への影響を報告しているシステマティックレビューでは、高齢、喫煙歴、研究参加者の併存疾患、およびこれらの研究のサンプルサイズなど、多くの交絡因子があるため、この関連性は注意して解釈しなければならないと結論づけられている [42]。したがって、BPA曝露との関連性が知られている内分泌依存性腫瘍(前立腺がん、乳がん、卵巣がんなど)とCOVID-19との間の潜在的な関連性についても、臨床病理学的データだけでなく、試験管内試験および生体内試験モデルを用いた潜在的な分子メカニズムの探索を含めて、さらなる研究が必要である。
2.3. BPAと免疫系応答の変調
また、BPA が免疫系反応の調節に関与している可能性、特に気道炎症や呼吸器アレルギーを促進したり、食事性タンパク質に対する免疫耐性を損なう可能性に注目した研究も増えている[57,58,59,60]。免疫系に対する BPA の潜在的な影響は、関連する受容体(エストロゲン受容体など)や細胞内シグナル伝達経路への直接的な影響、エピジェネティックな影響や腸内マイクロバイオームの変化など、複数のメカニズムが関与していることが示唆されている [57]。全体的に、BPA曝露は適応免疫系細胞と自然免疫系細胞のサブタイプと機能の両方に影響を与え、産生されるサイトカインとケモカインの変化(例えば、インターフェロン-γ(IFN-γ)腫瘍壊死因子α(TNF-α)IL-10,IL-4 などの炎症性サイトカインのアップレギュレーション)と T 調節(Treg)細胞の減少につながる可能性がある [57,58]。興味深いことに、卵巣摘出ラットの経口 BPA 曝露は、成体の雌の子孫に炎症反応を誘発することが示されており、子孫の免疫系に対する BPA の長期的な影響の可能性が示唆されている [61]。
これに関連して、COVID-19 の重症度は、炎症性サイトカインおよびケモカイン(例:TNF-α、IL-1β、IL-6,IL-8,および IL-2)の局所および全身レベルの上昇にも関連していることを強調しておく必要がある [62,63,64]。これは、重度のCOVID-19を有する特定の患者において高炎症性反応の悪循環をさらに誘発し、その結果、有害な臨床転帰を伴う基礎となるサイトカインストームを引き起こす可能性がある[62,63,64]。これらのプロ炎症性経路は、BPAへの曝露の増加および/または長期化によっても引き金となる可能性があるため、BPAは、脆弱な患者、特に低悪性度の慢性炎症を既に様々な程度で示している2型糖尿病M、肥満、高血圧、および心血管疾患を有する患者において、重度のCOVID-19のリスクを増加させる可能性のある間接的な病態生理学的メカニズムを示している可能性がある[62]。しかし、最近、急性呼吸窮迫症候群(ARDS)を有するCOVID-19を有する重症患者は、敗血症や他の重症患者と比較して、循環サイトカインレベルが低いことが示された[65]。このことは、COVID-19患者は炎症性サイトカインレベル(例:IL-16,IL-10,単球化学吸引性タンパク質-1,MCP-1)の上昇を示したが、これらのレベルはサイトカイン放出症候群に苦しむ他のCOVID-19以外の患者ほど高くはなかったことを示すデータによってさらに裏付けられている[66]。したがって、COVID-19における基礎となる「サイトカインストーム」の役割と潜在的な意味合いについては、より高い次元の複雑さがあるように思われ、それはさらなる調査にも値する。これは、BPA と COVID-19 の高リスクとを結びつける潜在的なメカニズムに関与している可能性があるため、免疫における BPA の役割をさらに調査する必要がある [57]。
2.4. BPA と妊娠・胎盤の合併症との関連性
さらに,低用量であっても BPA 曝露がヒトの妊娠の結果に悪影響を及ぼす可能性があり,その結果,母体と子孫の両方に潜在的に有害な状態(胎児の正常な発育に影響を与えたり,後世に問題を引き起こしたりするなど)を引き起こす可能性があることを示す証拠が増えている [67,68,69,70,71,72,73] [67,68,69,70,71,72,73].また,BPA 暴露と妊娠中の子癇前症 [74,75] との間には相関関係があり,新たに診断された高血圧と蛋白尿 [76] が特徴であり,母体の死亡率と後世の子孫の健康問題(肥満や 2型糖尿病M など)のリスクの増加と関連している [76,77].
BPA曝露と子癇前症または胎盤の変化との直接的な関連を証明するには、より多くのデータが必要であるが、重度のCOVID-19を有する妊婦が子癇前症様症候群を発症する可能性があることを考えると、BPAと子癇前症との潜在的な関連性はCOVID-19に関連して特に注目される[78]。これまでのところ、COVID-19が子癇前症または妊娠誘発性高血圧を引き起こした単発例が報告されている[79,80]。さらに、Shanesらは、COVID-19を有する女性の第3期胎盤は、母体の血管の異常や損傷、血管間血栓などの特徴を示し、血管不全の可能性が有意に高いことを発見した[81]。同様に、Baergenらは、COVID-19を有する20人の母親のコホートにおいて、研究された胎盤の半数が、胎児の血管血栓症または胎児の血管不正灌流の証拠を示したことを発見した[82]。別の研究では、COVID-19を有する5人の妊婦で、合併症を伴わずに学期に分娩したが、5人の胎盤すべてに局所的な血管絨毛とより大きな血管の血栓が認められた[83]。妊娠の血栓性の性質に加えて、COVID-19は胎盤[83]と全身感染[84]の両方に血栓性の影響を及ぼすようであることを考えると、子癇前症のリスクがあるCOVID-19を有する女性に予防的アスピリンを継続することが重要とされてきたが、非ステロイド性抗炎症薬がCOVID-19の症状を悪化させるかどうかを疑問視する研究もあった[85]。
全体として、COVID-19の症状が妊婦で悪化するかどうか、またBPAへの暴露が関連リスクをさらに高めるかどうかについては、さらなる調査が必要であり、特に妊娠中の免疫系は常に適応状態にあり、妊婦は呼吸器感染症にかかりやすくなっている[79]。COVID-19が確認された60人の妊婦の臨床転帰に関するスペインの研究では、これらの患者のほとんどが良好な臨床転帰を示し、3分の1が肺炎を発症し、5%が重体に分類されたことが報告されている[86]。COVID-19が確認された妊婦において、重篤な肺炎の症例はなく、母体の死亡もなかったという別の最近の研究でも同様の結果が報告されている[87]。これまでのところ、COVID-19の母親から子供への垂直伝播の可能性に関する証拠は非常に限られており、関連する既存の文献の最近のレビューでは、そのような伝播の証拠はほとんど報告されていない[88]。しかしながら、母親から新生児へのCOVID-19の垂直伝播の症例はまれに報告されている。例えば、妊娠第3期にCOVID-19の影響を受けた22人の女性コホートの新生児からCOVID-19の2例(1例は自然分娩後に膣内で分娩、1例は帝王切開で分娩)が発見された[89]。妊娠と COVID-19 に関するこのような研究は増加しているが、COVID-19 と診断された妊婦とその子孫における BPA の血中/尿中濃度に関する研究は、現在のところ報告されていない。
3. BPAとSARS-CoV-2の主要な分子標的
SARS-CoV-2の標的/宿主細胞への感染は、多くの細胞受容体およびプロテアーゼによって媒介される。そのため、SARS-CoV-2は細胞膜上のアンジオテンシン変換酵素2(ACE2)に高親和性で結合し、ウイルスの宿主細胞への侵入を促進する[90]。さらに、膜貫通型セリンプロテアーゼ2(TMPRSS2)は、細胞膜上にACE2と共発現しており、ウイルスのスパイクタンパク質を誘導し、ウイルスと膜脂質層との融合と宿主細胞への取り込みを仲介している[91]。さらに、カテプシンL(CTSL)はリソソームプロテアーゼであり、ウイルスのスパイクタンパク質を膜融合のためにプライミングすることでエンドソームを介したSARSウイルスの細胞内侵入を媒介することが知られている[92]が、SARS-CoV-2による宿主細胞への感染を促進するようである[91]。同様に、フーリンは、不活性な前駆体タンパク質を生物学的に活性な生成物に切断することで知られるプロテアーゼである[93]。
現在では,SARS-CoV-2 感染における細胞性メディエーターの役割や,その発現・機能に影響を及ぼす可能性のある因子に焦点を当てた研究が増えているため,本レビューでは,これらの主要な SARS-CoV-2 感染メディエーターに対する BPA の潜在的な影響についてもデータを提示する.
3.1. BPA と TMPRSS2 の発現
BPAがTMPRSS2の発現に影響を及ぼす可能性があることは、動物実験から明らかになっている。実際、雄性ラットに1日目から3日目までBPAを皮下投与したところ、内側扁桃体でTMPRSS2の発現が上昇した[96]。新生児雄性ラットの内側扁桃体におけるTMPRSS2免疫反応細胞の密度がBPAによって増加したことは、BPAが中枢神経系(中枢神経系)や神経発達過程を障害する可能性を示唆している[96]。興味深いことに,現在,SARS-CoV-2 などのコロナウイルスの神経トロピズムと,それらの神経病原体や中枢神経系への潜在的な影響に注目が集まっている [97,98].
一方、石川細胞を用いた試験管内試験研究では、様々な化学物質のエストロゲン作用を調べるための試験管内試験モデルとして利用可能なヒト子宮内膜細胞株を用いて、BPA処理がTMPRSS2のダウンレギュレーションを誘導することが示されている[99]。さらに、私たちは最近、非合体化および合体化BeWo細胞を試験管内試験モデルとして使用したヒト胎盤に対する生理的に関連する用量のBPAの影響に関する研究結果を発表した[100]。COVID-19に関連して、これらの実験から得られたマイクロアレイデータを再検討したところ、BPA処理により、非同期化および同期化BeWo細胞ではTMPRSS2発現が適度に増加したが、ACE2およびCTSL発現には影響がないことがわかった(未発表データ)。興味深いことに、我々の実験では、BPA(3 nM)で処理した非共球化BeWo細胞で有意に濃縮されたプロセスの1つは、ウイルスの生命細胞周期の制御に関与しているように見える[100]。
BPAがTMPRSS2の発現に多様な影響を与えることを示唆する利用可能な証拠を考慮すると、この重要なSARS-CoV-2感染メディエーターに対するこのようなBPA誘導効果が、COVID-19の発症リスクとその後の重症度に臨床的に関連する影響を与えるかどうかを調べるためには、さらなる研究が必要である。
3.2. BPA と ACE2 および フーリン の発現
BPA が ACE2 および フーリン の発現に及ぼす影響については,これまでに限られたデータしか得られていない.BPA は男性の生殖障害を促進すると疑われていることから,ラット精細管培養モデルを用いて精子形成に及ぼす BPA の影響を調べるための生体外トキシコゲノミクス研究では,低用量 BPA(1 nM)への曝露は,曝露後 21 日後と 14 日後にそれぞれ ACE2 と furin の発現を低下させることが示されている[101].さらに、成魚オスのレアミノウオ(Gobiocypris rarus. また、BPA 濃度を変化させた(1, 15, 225 μg/L, 7 日間)精巣ステロイド生成の調節因子としてライディッヒ細胞に発現している ACE2 が、BPA 曝露(1 μg/L, 7 日間)後に最も有意に増加したレニン-アンジオテンシン系遺伝子の一つであることが明らかになった[102]。一方,雄性マウスの思春期における BPA 曝露(体重 50 mg/kg,6 週間)の潜在的な悪影響を調べた別の研究では,BPA 曝露マウスの馬尾上体における ACE2 タンパク質発現が有意に減少していることが示されている[103]。男性は女性に比べて重度の COVID-19 の年齢調整リスクが一貫して高く [104] ,ヒトの生殖器系が SARS-CoV-2 感染の新たな標的となっているかどうかについての研究が現在進行中である [105,106,107,108] ことから,今後の研究では,BPA が ACE2 などの主要な SARS-CoV-2 感染メディエーターの局所発現を調節することで COVID-19 関連の合併症に関与しているかどうかについても調査する必要がある.
3.3. SARS-CoV-2 感染メディエーターと BPA の効果を媒介する受容体の共発現
BPA は、遺伝子型-組織発現(GTEx)プロジェクトの利用可能なデータに基づき、核内エストロゲン受容体(ERα、ERβ)膜結合型エストロゲン受容体(G タンパク質共役型受容体 30;GPR30)ヒト核内受容体エストロゲン関連受容体γ(図 1)[100,109,110,111]など、ヒト組織に広く分布している受容体に作用することでその効果を発揮する。
図1.
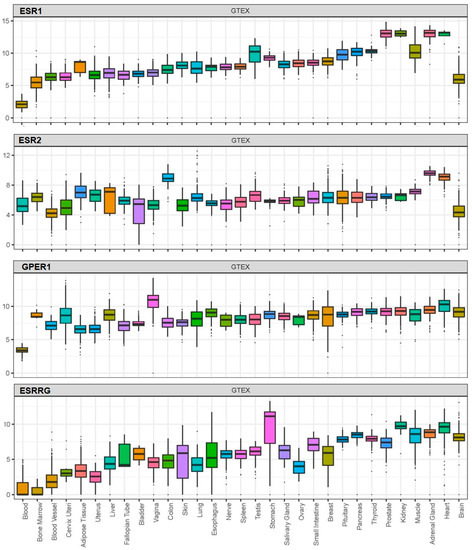
核内エストロゲン受容体ERα(ESR1)とERβ(ESR2)Gタンパク質共役膜結合型エストロゲン受容体(GPR30またはGPER1)およびエストロゲン関連受容体γ(ESRRG)の発現(log2(norm_count+1))は、Genotype-Tissue Expression(GTEx)プロジェクトから入手可能なデータに基づいて、ヒト組織全体での発現。
ここでは、これらのin silico観察をさらに発展させ、BPAの作用を媒介する受容体とSARS-CoV-2感染メディエーターとの共発現を評価した。その結果、BPA の作用を媒介するこれらの受容体のうち、膜結合型エストロゲン受容体 GPR30 は、肺、結腸、胃、小腸、甲状腺、腎臓、肝臓、前立腺で TMPRSS2 と共局在していることが明らかになった(図 2A)。この知見は、BPA曝露がGPR30を介してこれらの組織におけるSARS-CoV-2感染メディエーターに影響を与え、したがって、COVID-19の重症度(例えば、肺におけるSARS-CoV-2感染の結果)に影響を与える可能性があることを示唆している。我々は、これらの遺伝子の発現パターン間の潜在的な相関関係を調べるために、GTExプロジェクトから入手可能なデータを用いて、これらのデータをさらに解剖した。そのために、健康な組織サンプルにおける遺伝子の発現レベル間のピアソン相関係数を計算した。その結果、ACE2とERβ(0.37)とTMPRSS2(0.38)の間には高い相関が、ACE2とERα(0.28)とエストロゲン関連受容体γ(0.23)の間には中程度の相関が見られた(図2B)。これらの遺伝子には相関性のある発現パターンがあることが示唆された。
図2.
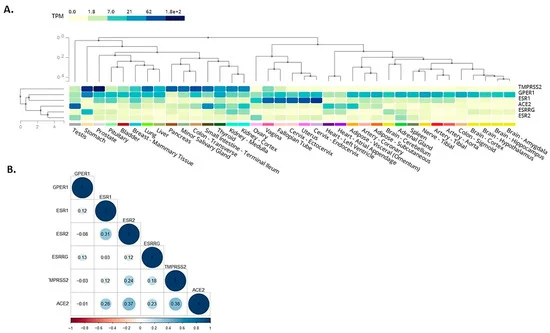
主な既知の受容体、すなわち核内エストロゲン受容体ERα(ESR1)およびERβ(ESR2)膜結合型エストロゲン受容体(Gタンパク質共役型受容体30;GPR30またはGPER1)および主要なSARS-CoV-2感染メディエーター、すなわちビスフェノールA(BPA)の効果を媒介するエストロゲン関連受容体γ(ESRRG)の共発現(A)および相関(B)。アンジオテンシン変換酵素2(ACE2)および膜貫通型セリンプロテアーゼ2(TMPRSS2)の作用を媒介するビスフェノールA(BPA)の効果を、遺伝子型-組織発現(GTEx)プロジェクトの利用可能なデータに基づいて解析した。
4. 結論
最も一般的な EDC の一つである BPA への曝露は、心代謝性疾患、内分泌関連がん、免疫系の異常などの発症を促進し、間接的に重篤な COVID-19 のリスク上昇につながる可能性がある(図 3)。さらに、膜結合型エストロゲン受容体 GPR30 のような BPA の作用を直接媒介する受容体は、ヒト組織に広く分布しており、SARS-CoV-2 感染メディエーターと共局在している可能性がある(例:GPR30 の肺での TMPRSS2 や CTSL との共局在)。したがって、BPAや他の一般的なEDCへの曝露が、SARS-CoV-2感染のリスクやCOVID-19の重症度に影響を及ぼす可能性があることが明らかになった[11,12]。これは発展途上のテーマであり、BPA と COVID-19 との直接的な関連を解明し、関与する可能性のある分子機構を明らかにするためには、試験管内試験、計算、前臨床、および 生体内試験 でのさらなる研究が必要であることは明らかである。最終的には、COVID-19のリスクが高いグループ(例えば、男性や高齢者、2型糖尿病M、高血圧、肥満、心血管疾患などの併存疾患を持つ患者)において、COVID-19に関連するEDC曝露を低減するための新たな枠組みやガイドラインの構築につながる可能性がある。
図3. ビスフェノールA(BPA)が間接的に重度のCOVID-19のリスクを増加させる可能性のあるリンク
BPAへの曝露は、複数の心代謝性疾患および内分泌関連がんの発症を促進する可能性がある(A)。これらの併存疾患はCOVID-19の臨床転帰を悪化させる(B);したがって、BPA曝露は間接的に重症COVID-19のリスクを高める可能性がある。心血管疾患:心血管疾患;COPD:慢性閉塞性肺疾患;COVID-19:コロナウイルス疾患2019。
