Contents
Investigating the human protein-host protein interactome of SARS-CoV-2 infection in the small intestine
www.ncbi.nlm.nih.gov/pmc/articles/PMC7682973/
要旨
研究の目的
本研究では、小腸におけるSARS-CoV-2感染のヒト蛋白質-宿主蛋白質相互作用を明らかにし、そのメカニズムを明らかにするとともに、関連するバイオマーカーや治療戦略を明らかにすることを目的とした。
背景
SARS-CoV-2感染症の組織・臓器間相互作用を解明することは、その潜在的なメカニズムを解明する上で重要である。本研究では、小腸におけるヒトの蛋白質-宿主蛋白質相互作用を調べた。
方法
小腸組織および SARS-CoV-2 感染に関するデータを収集するために、公開データベースおよび論文を用いた。その結果、小腸内での宿主タンパク質の相互作用を示すネットワークを構築した。その結果、関連モジュール、生物学的プロセス、機能的経路、転写制御因子、疾患オントロジーカテゴリ、治療標的となる可能性のある薬剤候補を同定した。
結果
SARS-CoV-2受容体ACE2には、13の主要なタンパク質が隣接していることがわかった。ACE2とその4つのパートナーは高度にクラスター化されたモジュール内に存在し、さらに8つの宿主タンパク質がこのモジュールに属していた。また、ACE2, MEP1A, MEP1B, DPP4, XPNPEP2の遺伝子が濃縮されていることから、タンパク質の消化吸収が重要な経路であることが明らかになった。HNF4A、HNF1A、HNF1Bの転写因子がACE2の発現を調節していることが明らかになった。また、12の疾患との有意な関連を解読し、116の薬物-標的相互作用を同定した。
結論
タンパク質-宿主タンパク質相互作用解析により、小腸におけるSARS-CoV-2感染に重要な要素と相互作用が明らかになり、消化器症状や炎症のメカニズムの解明に有用であることがわかった。これらの相互作用を抗ウイルス剤で標的化することで,COVID-19患者の病態が改善する可能性が示唆された。
キーワード
SARS-CoV-2,小腸,インターアクトーム,タンパク質相互作用ネットワーク,調節ネットワーク,創薬標的
序論
新型β-コロナウイルス感染症としてのCOVID-19病は 2019年12月に中国の武漢で初めて発生し、現在、世界中で急速に拡大している。2019-nCOVにより、現在世界中でCOVID-19病の症例が発生している(1)。2020年8月24日までの間に、COVID-19の累計症例数は2,340万人に達し、全世界で80万9,000人が死亡している。世界保健機関(WHO)は、この病気を世界的な健康上の脅威と認定し、ワクチンを見つけるためのあらゆる研究を支援していた(2)。主な感染経路はヒトからヒトへの感染(3)であり、急速に普及しているにもかかわらず、その詳細な分子機構や病態は不明なままである。
COVID-19症例の主な臨床症状は発熱、咳、咽頭痛である(4)が、特に若年層のCOVID-19症例では下痢、嘔吐、腹痛などの消化器症状が一部の患者(2%~10%)にみられることから、COVID-19は肺組織だけでなく、消化器系もSARS-CoV-2の影響を受ける可能性があることが示唆されている(5,6)。SARS-COV2のヌクレオチド配列がSARS-COVとほぼ86.9%類似していることや、ペアワイズタンパク配列解析の結果から、COVID-19は宿主細胞に侵入するために同様のメカニズムを用いていることが示唆されている(7, 8)。また、これまでの研究では、アンジオテンシン変換酵素2(ACE2)がSARS-COVの主要な受容体であり、SARS-CoV-2ウイルスの宿主細胞への侵入に重要な役割を果たしていることが示唆されている(9)。したがって、ACE2はCOVID-19病治療のワクチンターゲットになり得ると結論づけられる。
ACE2は、肺上皮細胞、腎臓、心臓、血液、小腸などのヒトの臓器で大きく発現している(10)。ACE2が様々な組織で広範囲に発現していることは、COVID-19患者の多臓器機能障害を示唆していると考えられる(11)。興味深いことに、ACE2タンパク質の発現は、宿主がSARS-COVに感染するとダウンレギュレートされる(12)。ACE2の発現レベルの低下は、上皮細胞の損傷による腸内炎症の感受性を高める可能性があり、小腸の表面細胞でのACE2の発現は、ウイルスの侵入、増幅、および消化管炎症の活性化に関与している可能性がある(12)。SARS-CoV-2はSARS-CoVとゲノム的に類似していることから、SARS-CoV-2はACE2の発現も障害している可能性があり、このACE2発現の低下または阻害は消化管の機能障害を引き起こし、COVID-19患者の消化器症状を引き起こす可能性があり、COVID-19患者に出現する消化器症状の分子経路である可能性もある。一方、ACE2はアミノ酸の恒常性維持を含む腸内で重要な役割を果たしている(13)。ACE2が小腸で常時発現していることは、消化器症状や感染経路、ウイルスの病原性に関係している可能性がある(11)。
これまでのところ、SARS-CoV-2に対する有効な抗ウイルス薬やワクチンはなく、これはコロナウイルスの発症経路の分子経路の理解が不十分であることに起因している(14)。COVID-19の病因を理解することはもちろん、COVID-19が我々の体内でどのように消化器症状を引き起こすのかを理解することは重要なポイントであり(15)、小腸内でのACE2と宿主タンパク質の相互作用を検出することは、コロナウイルスの病因経路を発見し、潜在的な薬剤やワクチンの標的を提示することにつながる可能性がある。ウイルスの侵入は、ACE2と宿主細胞タンパク質との相互作用に影響を与える可能性がある。したがって、タンパク質相互作用解析は、COVID-19病因の分子基盤を理解するための更なる洞察を提供する可能性がある。また、ヒトの様々な組織におけるACE2受容体の分布を明らかにすることは、COVID-19感染症の治療法を発見する上で特に重要である。
小腸腸球はACE2 mRNAおよびタンパク質の高発現を示す(16, 17)。本研究では、COVID-19感染による宿主細胞内の生物学的プロセスと経路、および消化管炎症についての見解を提供するために、小腸におけるSARS-CoV-2感染のヒトタンパク質-宿主タンパク質相互作用を、タンパク質相互作用と転写因子制御ネットワークを用いて解析した。さらに、薬物-標的相互作用の可能性を抽出した。
研究方法
本研究は、小腸におけるSARS-CoV-2感染のヒトタンパク質-宿主タンパク質相互作用の可能性を明らかにすることを目的とし、COVID-19病における消化器症状の潜在的なメカニズムを明らかにすることを試みた。
小腸組織とSARS-CoV-2感染に関連するデータ
小腸特異的遺伝子リストは、Tissue-specific Gene Expression and Regulation (TiGER)データベースから検索した(18)。最近の研究では、ACE2(SARS-CoV-2の主要な宿主受容体として)の相互作用ネットワークが提示されており、ウイルス感染後の小腸の腸球でACE2が特異的に発現することが報告されている(17, 19-21)。そこで本研究では、STRINGデータベース(24)の相互作用記録をもとに、UniProtデータベース(22)とGeneCardsデータベース(23)からACE2の最初の相互作用タンパク質近傍を収集した。また、SARS-CoV-2の侵入に必要な宿主因子としてのセリンプロテアーゼTMPRSS2(25)もリストに追加した。SARS-CoV-2のヒト宿主タンパク質は、GordonらおよびKumarら(26,27)による2つの異なる研究から編集された。これらのタンパク質リストを入手した後、タンパク質リストの組織特異的発現解析を、”UNIGENE_EST_QUARTILE “カテゴリを使用して、Database for Annotation, Visualization and Integrated Discovery (DAVID)ウェブサーバを使用して行った(28)。小腸の組織特異的な遺伝子をFDR補正したp値<0.05で選択した。結果として得られた遺伝子リストは、さらなる解析のために使用された。
ネットワーク生成、モジュール検出、機能解析
小腸組織特異的遺伝子をSTRINGデータベースに検索し、関連するタンパク質-タンパク質相互作用(PPI)の情報を収集した(24)。STRINGは、既知および予測されたPPI情報を利用するためのウェブリソースである。複合スコア>0.4がタンパク質相互作用の選択基準とされた。これらの接続は、PPIネットワークを構築するためにCytoscapeソフトウェアにインポートされた(29)。宿主タンパク質は、結果として得られたネットワーク内で異なる色を用いて決定された。結果として得られた小腸組織のネットワークにおけるACE2インタラクトームネットワークは、ACE2,ACE2の第一の相互作用タンパク質の隣人、および第二の隣人のホストタンパク質を用いて提示された。モジュールは、高度に相互作用するタンパク質のクラスターである。Cytoscapeソフトウェア(30)でPPIネットワークの高モジュール性クラスターをスクリーニングするために、分子複合体検出(MCODE)アルゴリズムを採用した。さらに、検出されたモジュールとACE2とのクロストークや相互作用を抽出した。また、高スコアクラスタの機能的役割は、DAVIDデータベース(28)を用いて、遺伝子オントロジー生物学的プロセスエンリッチメント、KEGG (Kyoto Encyclopedia of Genes and Genomes) (31) パスウェイ解析により評価した。
調節ネットワーク構築
GeneTrail2ウェブサービスを用いて、176の小腸特異的タンパク質の上流調節因子の可能性がある転写因子を濃縮した(32)。GeneTrail2はウェブインターフェースとして、生物学的解析や分子シグネチャーの抽出のための様々なツールへのアクセスを提供している。また、転写因子と標的遺伝子の相互作用のうち、q値が0.05以下のものは、GeneTrail2ウェブサービスを利用してTRANSFACデータベースから検索した(33)。転写因子と標的遺伝子の相互作用をCytoscapeにインポートし、制御ネットワークを生成した。
疾患オントロジーアノテーションと疾患遺伝子ネットワーク構築
小腸組織の176の遺伝子と異なる疾患の遺伝子のオーバーラップを、DAVIDデータベース(28)を用いて、GAD(Genetic Association Database)_DISEASEカテゴリを用いてマイニングした。P値<0.05は、GAD_DISEASEオントロジー用語の同定のための特定パラメータと考えられた(34)。疾患遺伝子の関連付けをCytoscapeにインポートし、疾患遺伝子ネットワークを生成した。
薬物-標的相互作用の予測と薬物-タンパク質相互作用ネットワークの生成
KEGGデータベースから、濃縮されたKEGG経路に対応する薬剤を取得した(31)。さらに、176遺伝子リストと重複する疾患については、repoDBの薬剤再配置データベースから検索した(35)。KEGGデータベースとrepoDBの薬剤リストと176遺伝子リストをマージして1つのリストにまとめ、STITCHデータベースにマッピングすることで、薬物-標的相互作用の可能性を同定した(36)。薬物標的相互作用をCytoscapeにインポートし、薬物-タンパク質相互作用ネットワークを構築した。
結果
分析のためのデータ作成
小腸特異的遺伝子101個のリストをTiGERから検索した。ACE2,ACE2の最初の相互作用タンパク質の隣人としての17のタンパク質、およびTMPRSS2が遺伝子リストに追加された。Gordonら(332個の宿主タンパク質)とKumarら(390個の宿主タンパク質)の研究(26, 27)から、508個の宿主タンパク質のリストを作成した。最後に、625個の遺伝子の包括的なリストを作成した。その後、遺伝子リストをDAVIDデータベースに照会し、組織特異的な発現カテゴリを同定したところ、図1に示すように、176個の有意な小腸特異的遺伝子(108個の宿主タンパク質)がFDR補正されたp値=5.10E-12で示された。この176個の遺伝子リストを用いてPPIネットワークを構築した。
図1 FDR補正されたp値<.05の組織特異的発現カテゴリーの上位10個
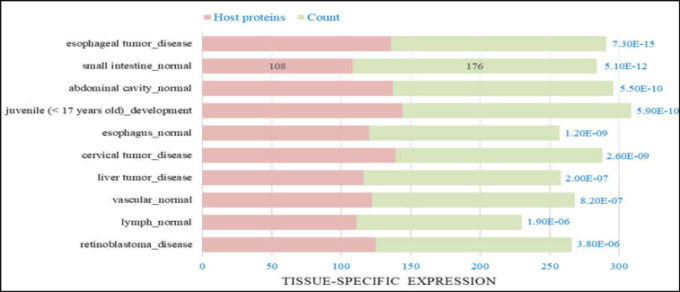
FDR補正したp値=5.10E-12で小腸組織の176遺伝子が濃縮されており、そのうち108遺伝子は宿主タンパク質リストと共通していた
ネットワーク生成、モジュール検出、機能解析
176の小腸特異的遺伝子について、中程度の相関スコアを持つヒトタンパク質相互作用がSTRINGデータベースから採掘された。これらの関連付けはCytoscapeにインポートされ、146のノード(91の宿主タンパク質)と366のエッジを示す0.764のr二乗値を持つスケールフリーのPPIネットワークが構築された(図2. (A)). ACE2と小腸特異的蛋白質との相互作用は13個であった。図2(B)は、ACE2の最初の相互作用タンパク質の隣人(DPP4,MEP1A、MEP1B、AGT、NTS、TFRC、GHRL、NPEPPS、TMPRSS2)を含む、小腸における可能性のあるACE2のインタラクトームを示す。CALM1,CALM2,CALM3,およびXPNPEP2)および第2の相互作用性宿主タンパク質近傍(PLAT、ACTR3,HSPA4,OS9,CCT3,FAR2,CALU、SLC9A3R1,LOX、FKBP10,FAF2,ATP6AP1,HMOX1,DOX41,TPM3,およびGOLGA2)の6つのモジュールが検出された。6つのモジュールがMCODEスコア>3で検出された。図3は、6つのクラスターの骨格構造を示している。最も高いMCODEスコア5.077を有する最初のクラスターは、14のノードと33のエッジを示した。クラスター1では、ACE2とACE2の4つのパートナー(DPP4,MEP1A、MEP1B、XPNPEP2)が見られた。さらに、8つの宿主タンパク質(ACE2,XPO1,DNAJA1,XRN2,CCT3,CCT8,CCT4,NOP56)がCluster1に属していた。その結果、Cluster2のMCODEスコアは3.333,ノード数は10個(ホストタンパク質7個)エッジ数は15個であった。ACE2を介したCluster1と他のクラスタ間のクロストークを調べたところ,CALM1,CALM2,CALM3とCluster2ではACE2が直接的な相互作用を示した。また、Cluster1のACE2とCALM1,CALM2,CALM3との間にはGHRLを介した間接的な相互作用が認められた(図4)。Cluster1の機能解析は、FDR補正されたp値<0.05でタンパク質の消化吸収KEGG経路を富化させた。
図2
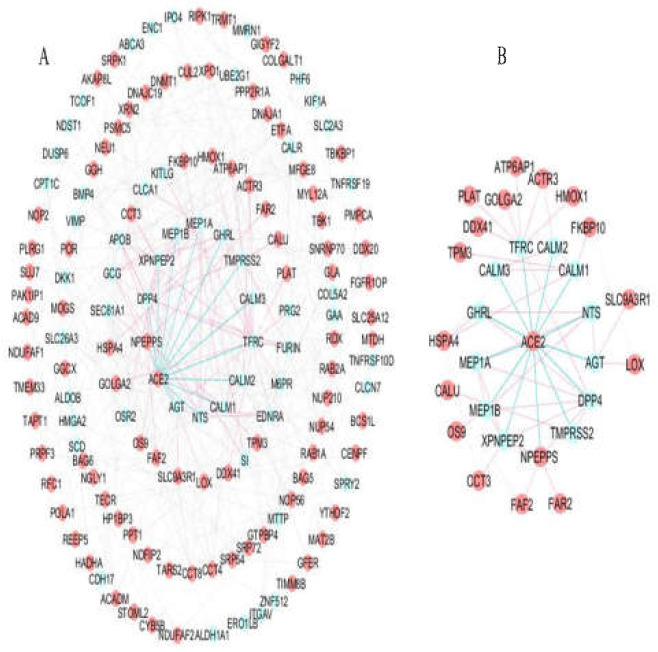
(A). 176個の小腸特異的タンパク質のPPIネットワーク(146個のノードと366個のエッジ)。赤色のノード:宿主タンパク質(91タンパク質)。青色のエッジ。ACE2-ファーストネイバー相互作用。赤色の辺。ACE2-2番目の近傍相互作用。(B). ACE2,ACE2の第一の相互作用タンパク質の隣人(13個のタンパク質)および第二の隣人の宿主タンパク質(16個のタンパク質)を含む小腸内のACE2相互作用ネットワーク
図3 6つのクラスターの骨格構造
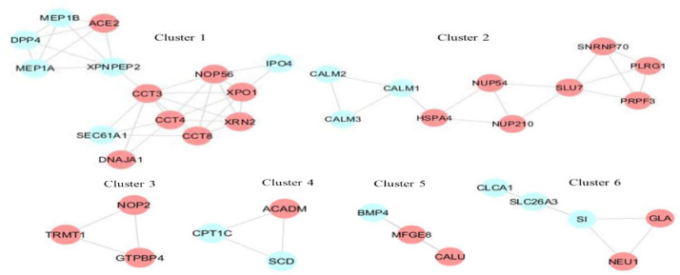
赤色のノード:宿主タンパク質
図4 ネットワーク内のACE2を介したクラスター間のクロストーク
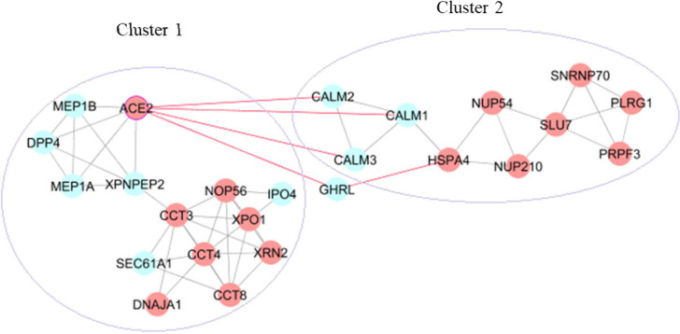
赤色のノード:宿主タンパク質
ACE2とMEP1B、MEP1A、DPP4,XPNPEP2タンパク質は、このKEGG経路に有意に濃縮されていた(表1)。また、遺伝子オントロジー(GO)生物学的プロセスの用語、例えば、毒素輸送、カジャル体へのタンパク質局在化の制御、核体へのタンパク質局在化などが検出された。
表1 Cluster1の遺伝子オントロジーとKEGG経路の解析
| カテゴリー | 期間 | FDR | 遺伝子 |
|---|---|---|---|
| KEGG_PATHWAY | タンパク質の消化と吸収 | 0.0018 | MEP1A、ACE2、MEP1B、DPP4、XPNPEP2 |
| GOTERM_BP_ALL | 毒素輸送 | 2.36E-05 | CCT4、CCT8、DNAJA1、MEP1B、CCT3 |
| GOTERM_BP_ALL | カハール体へのタンパク質局在の調節 | 0.0232 | CCT4、CCT8、CCT3 |
| GOTERM_BP_ALL | カハール体へのタンパク質局在の正の調節 | 0.0232 | CCT4、CCT8、CCT3 |
| GOTERM_BP_ALL | カハール体へのタンパク質の局在 | 0.0298 | CCT4、CCT8、CCT3 |
| GOTERM_BP_ALL | 核体へのタンパク質の局在 | 0.0298 | CCT4、CCT8、CCT3 |
規制ネットワークの構築
176の遺伝子リストから、q値<0.05の8つの転写因子(HNF4A, HNF1A, HNF1B, CDX2, JUN, HIF1A, CREB1, SP3)が25の標的遺伝子に対して濃縮されていた。その結果、8つのTFと25の標的遺伝子の間に45の転写因子-標的遺伝子相互作用が確認された(図5)。HNF4A、HNF1A、HNF1Bを含むHNF因子がACE2標的遺伝子の発現を制御していることがわかった(表2)。
表2 176遺伝子のエンリッチ化転写因子リスト
| N | 転写因子 | q値 | (176個の小腸特異的タンパク質の)標的遺伝子 |
|---|---|---|---|
| 1 | HNF4A | 9.66E-07 | ACE2、AGT、ALDOB、APOB、GFER、HMGA2、HMOX1、MTTP |
| 2 | HNF1A | 3.14E-05 | ACE2、AGT、APOB、CDH17、MTTP、SI |
| 3 | HNF1B | 1.13E-04 | ACE2、APOB、MTTP、SI |
| 4 | CDX2 | 0.0018 | CDH17、DSC2、FURIN、SI |
| 5 | 6月 | 0.0027 | GFER、HMOX1、LOX、MMP10、NTS、PLAT |
| 6 | HIF1A | 0.0092 | AGT、BMP4、HMOX1、KITLG、TFRC |
| 7 | CREB1 | 0.0208 | HMOX1、NTS、PLAT、SLC25A12、SLC39A1 |
| 8 | SP3 | 0.0365 | HMGA2、HMOX1、ITGAV、MAT2B、POLA1、POR |
図5 転写因子-標的遺伝子制御ネットワーク
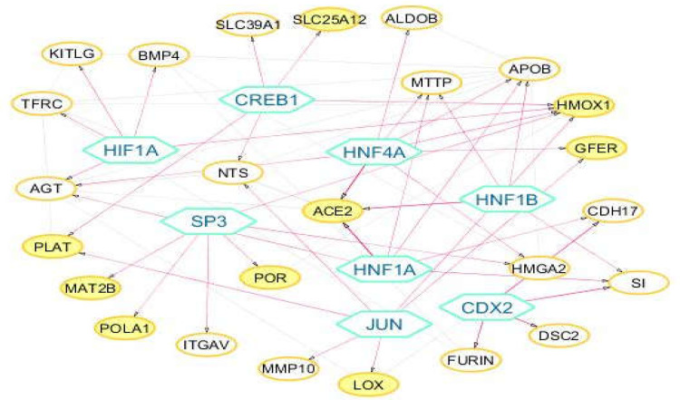
六角形のノードは8つの濃縮された転写因子を表している。黄色のノード:宿主タンパク質
疾患遺伝子ネットワーク構築
176個の遺伝子をさらに分類し、その機能をアノテーションするために、Gアルツハイマー病疾患カテゴリーの関連付けをスキャンした。12のGAD_DISEASEカテゴリーがp値<0.05で見つかった(表3)。COVID-19応答における重要性が強調されている7つのGAD_DISEASEカテゴリー(糖尿病、免疫不全、心血管疾患、高血圧、血圧、大腸がん、腎症)を用いて、疾患遺伝子ネットワークを構築した(図6)。7つのGAD_DISEASEカテゴリー、64の遺伝子、91の関連遺伝子相互作用が疾患遺伝子ネットワークに示されている。また、これらの重複する疾患をrepoDBで検索し、薬剤候補を同定した。
表3 176遺伝子の疾患オントロジー
| カテゴリー | 期間 | カウント | P値 |
|---|---|---|---|
| GAD_DISEASE | 2型糖尿病| 浮腫| ロシグリタゾン | 45 | 7.60E-06 |
| GAD_DISEASE | 血圧、動脈 | 5 | 2.80E-03 |
| GAD_DISEASE | 後天性免疫不全症候群|疾患の進行 | 20 | 3.00E-03 |
| GAD_DISEASE | 心血管疾患| | 5 | 5.30E-03 |
| GAD_DISEASE | 口唇裂|口蓋裂 | 11 | 8.70E-03 |
| GAD_DISEASE | 高脂血症|高血圧 | 3 | 1.00E-02 |
| GAD_DISEASE | 脊髄異形成症 | 4 | 2.50E-02 |
| GAD_DISEASE | プロテインCプロテインS | 2 | 3.10E-02 |
| GAD_DISEASE | 再狭窄 | 4 | 3.20E-02 |
| GAD_DISEASE | 長寿 | 10 | 3.50E-02 |
| GAD_DISEASE | 結腸直腸癌 | 10 | 3.50E-02 |
| GAD_DISEASE | 腎症、糖尿病 | 3 | 4.70E-02 |
図6 疾患-遺伝子ネットワーク
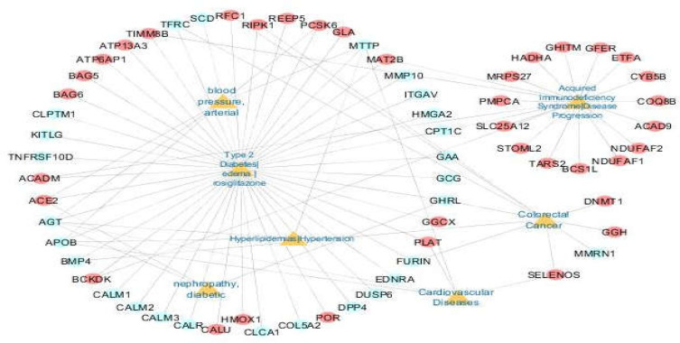
黄色のノードは176の遺伝子を持つ7つの疾患が重複していることを示している。赤色のノード:宿主タンパク質
薬物-タンパク質相互作用ネットワーク
タンパク質の消化吸収KEGG経路(我々の解析アプローチで最も重要な経路が見つかった)のKEGGデータベースに登録されている24種類の薬剤のリストを作成した。
さらに、176の遺伝子と重複する疾患について、レポDBから110の薬剤をマイニングした。その結果、176遺伝子のリストに合致した薬剤をSTITCHデータベースにマッピングした。また、STITCHで予測されたデータリストには、γ-リノレン酸、レチノイン酸、三硝酸グリセリル(ニトログリセリン)の3つの新薬が含まれていることが明らかになった。CytoscapeでSTITCHの結果を用いて薬物-タンパク質相互作用ネットワークを構築したところ、30個のタンパク質(12個の宿主タンパク質)と60個の薬物を含む116個の薬物-タンパク質相互作用が明らかになった。薬物候補の多くは、ACE阻害剤、アンジオテンシン受容体拮抗剤(ARB)カルシウム拮抗剤、グリプチン、スタチンの薬物クラスに属していた(図7,表4)。ACE2は20の薬物相互作用を示した。
表4 この表は、薬剤リストと関連する薬剤クラスを示している
| ドラッグクラス | 薬名 | 創薬ターゲット |
|---|---|---|
| ACE阻害剤 | ベナゼプリル、スピラプリル、トランドラプリル、シラザプリル、フォシノプリル、モエキシプリル、キナプリル | ACE2 |
| カプトプリル | ACE2、AGT、MOGS | |
| エナラプリル、エナラプリラト、ペリンドプリル、リシノプリル | ACE2、AGT | |
| ラミプリル | ACE2、HMOX1 | |
| グリプチン | アナグリプチン、カルメグリプチン、デナグリプチン、エボグリプチン、ゴソグリプチン、リナグリプチン、オマリグリプチン、サクサグリプチン、シタグリプチン、テネリグリプチン、トレラグリプチン、ビルダグリプチン | DPP4 |
| スタチン | アトルバスタチン | ACE2、APOB、BCKDK、DPP4、HMOX1 |
| シンバスタチン | APOB、HMOX1、PLAT | |
| カルシウムチャネル遮断薬。 | カルベジロール | AGT、ETFA |
| フェロジピン、ニカルジピン、ニフェジピン | CALM1、CALM2、CALM3 | |
| ベラパミル | CALM1、CALM2 | |
| アンジオテンシン受容体遮断薬(ARB) | バルサルタン | ACE2、AGT、EDNRA、HMOX1 |
| イルベサルタン、ロサルタン | ACE2、AGT、EDNRA | |
| テルミサルタン、カンデサルタン、オルメサルタン | AGT | |
| オルメサルタン、ヒドロクロロチアジド | ACE2 | |
| アルファ遮断薬 | ドキサゾシン | EPHA7 |
| プラゾシン、テラゾシン | EDNRA | |
| ブプラノロール | DDX41 | |
| アルドステロン受容体拮抗薬 | スピロノラクトン | PLAT |
| 静脈麻酔薬 | プロポフォール | AGT、PLAT、HMOX1 |
| 血管拡張薬 | ニトログリセリン | ALDH1A1、PLAT |
| ヒドララジン | AGT、DNMT1 | |
| アドレナリン作動性遮断薬 | レセルピン | GFER |
| 抗生物質 | ドキシサイクリン | MMP10、HSPA4 |
| エストロゲン | エストラジオール | ALDH1A1、APOB、BMP4、DNMT1、HMOX1、PLAT |
| 脂肪酸、オメガ-6脂肪酸 | ガンマリノレン | HMOX1 |
| 血糖降下剤 | メトホルミン | DPP4、HMOX1、PLAT |
| 非ステロイド性抗炎症薬 | アスピリン(アセチルサリチル酸) | EDNRA、HMOX1、PLAT |
| サリチル酸塩 | SLC26A3 | |
| モノアミン酸化酵素阻害剤 | パルギリン | ALDH1A1 |
| カリウム保持性利尿薬ファミリー | アミロライド | TMPRSS2、NDFIP2、PLAT |
| レニン阻害剤 | アリスキレン | ACE2、AGT |
| 化学療法 | パクリタキセル | FURIN、DNAJA1、KIF1A |
| チアジド系利尿薬 | ヒドロクロロチアジド | ACE2 |
| レチノイド | レチノイン酸 | ALDH1A1、APOB、BMP4、KITLG、PLAT、TFRC |
| アンドロゲン | テストステロン | ALDH1A1、GHRL、HSPA4、TMPRSS2 |
図7 薬物-タンパク質相互作用ネットワーク
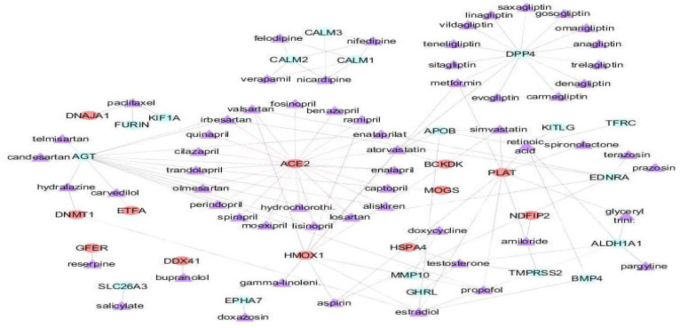
紫のノードは60種類の薬物を表す。赤色のノード:宿主タンパク質
議論
最近の研究で示唆されているように、SARS-CoV-2は、ウイルスがACE2受容体に結合することで宿主細胞に感染する可能性がある。そのため、ACE2はCOVID-19に対する治療標的となる可能性があると考えられる(37)。
これまでの研究では、小腸におけるSARS-CoV-2の宿主細胞受容体としてのACE2遺伝子の発現パターンが報告されている(17)。これまでの研究では、SARS-CoV-2 の宿主細胞受容体としての ACE2 遺伝子の発現パターンが小腸で報告されている(17)。
本研究では、小腸におけるSARS-CoV-2と宿主タンパク質の相互作用を明らかにし、COVID-19病における消化器症状のメカニズムを理解することで、関連するバイオマーカーについての知見を得ることを目的とした。
小腸特異的蛋白質のPPIネットワークにより、小腸における13のACE2相互作用パートナー(DPP4,MEP1A、MEP1B、AGT、NTS、TFRC、GHRL、NPEPPS、TMPRSS2,CALM1,CALM2,CALM3,XPNPEP2)とその機能パスウェイが明らかになった。ACE2とその4つの主要なタンパク質近傍体(DPP4,MEP1A、MEP1B、XPNPEP2)は、タンパク質消化吸収KEGG経路に富む高度にクラスター化されたモジュールに見られた。
ACE2は腸管上皮細胞の内腔表面に豊富に存在し、食物からのアミノ酸や栄養の取り込みのための共受容体として機能している(38)。SARS-CoV-2感染により腸内でACE2が欠乏すると、宿主の栄養状態がさらに損なわれ、バランスのとれた免疫応答を行う能力が低下する可能性がある(39)。また、ACE2は、アミノ酸トランスポーターB0AT1の膜トラフィッキングのシャペロンとしても機能していることがいくつかの研究で明らかになっている(40)。したがって、SARS-CoV-2がACE2を阻害するとB0AT1も阻害され、腸内アミノ酸輸送が遮断されることになる(40)。
B0AT1の変異は、腎臓や小腸を介したアミノ酸の吸着不良を伴うハートヌプ病につながることが示された。Hartnup病の患者はストレス条件下で発疹、小脳失調、下痢などのペラグラ様症状を発症する(39)。ACE2欠損マウスでは、B0AT1は小腸から完全に欠落しているため、トリプトファンのレベルが劇的に低下し、これも大腸炎の原因となる(13, 40)。トリプトファンに富んだペプチドは抗菌ペプチドのサブセットであるため、SARS-CoV-2と腸球ACE2/B0AT1受容体との相互作用は、腸内マイクロバイオームの異常な構成に続いて、小腸における大規模な炎症反応およびサイトカインストームを引き起こす可能性がある(39)。
結果に示されているように、メプリン(MEP1A、MEP1B)は、ACE2の最初の相互作用タンパク質の隣接する。これらは、結合組織の恒常性、腸管バリア機能、および免疫学的プロセスに関与する細胞外プロテアーゼである(41)。MEP1Aは炎症性腸疾患の遺伝的感受性因子として同定されている。MEP1Aは、アスタシン様メタロプロテアーゼであるメプリンαをコードしており、これは腸管腔内に分泌されるか、または膜貫通型のメプリンβと関連してブラシ境界膜に保存される(42)。したがって、メプリンαまたはβ発現の任意の減少は、宿主において同様の欠陥を引き起こす可能性がある。細胞外マトリックスタンパク質、成長因子およびサイトカインを含む様々な基質はメプリンによって切断される。腸管上皮細胞の先端側にあるメプリンβは、細菌の過剰増殖を防ぐために構成粘液を剥離する(41)。メプリンα欠損マウスは、デキストラン硫酸ナトリウムによる実験的大腸炎に罹患しやすく、野生型マウスに比べて大腸障害や炎症が大きかった(42)。メプリンは、微生物と宿主粘膜との間の相互作用を調節することにより、潜在的な毒性ペプチドに対して腸管上皮を維持し、また腸管の常在菌や病原性細菌に対しても防御する粘膜防御機構として機能している可能性がある(42)。
ACE2のもう一つの主要なタンパク質の隣接するジペプチジルペプチダーゼ4(DPP4)(分化クラスター26(CD26)としても知られている)は、肺、腎臓、肝臓、腸、免疫細胞などのいくつかの組織でユビキタスに提示される膜貫通型の糖タンパク質である(43)。セリンエキソペプチダーゼとしてのDPP4は、様々な生理学的プロセスに関与しており、成長因子、ケモカイン、神経ペプチド、血管活性ペプチドを含む幅広い基質を切断することができる。DPP4は、T細胞上の補機分子として機能することで免疫応答を調節し、インクレチンホルモンを分解することでグルコースの恒常性を調節している(43)。DPP-4活性は、腸球表面のペプチダーゼの一つとして、タンパク質消化の最終段階に関与している(44)。最近の研究によると、SARS-CoV-2は、MERS-Co-Vと同様に、ウイルスがACE2を介して細胞内に侵入する際に、DPP4/CD26受容体を共受容体として利用する可能性が示唆されている。S糖タンパク質の受容体としてのACE2とDPP4/CD26の共発現は、様々なヒトCoVが様々なヒト組織の類似した細胞型を標的としているという仮説を立て、様々なCoVに感染した患者における類似した臨床的特徴の出現を説明する可能性がある(45)。
我々の結果では、グレリン(GHRL)がACE2の一次側に位置し、検出された高度にクラスター化されたモジュールのうちの2つのモジュールを連結していることがわかった。グレリンは、主にX/A様胃細胞から分泌されるペプチドホルモンであり、成長ホルモン分泌促進受容体(GHSR)を介して機能し、免疫系において調節的な役割を果たしている(46)。グレリンはまた、小腸および大腸の運動性だけでなく、胃の運動性および空腸を誘導する。グレリンは、炎症性腸疾患、セリアック病、感染症、機能障害、糖尿病胃腸症などの複数の消化器疾患や障害において影響を受けることが示されている。このことは、グレリンが消化器疾患や障害の病態生理に関与していることを示している(47)。
また、ACE2標的遺伝子の発現を調節する転写因子として、HNFタンパク質(HNF4A、HNF1A、HNF1B)を濃縮した。HNF4因子は、ある最近の研究において、腸内のSARS-CoV-2侵入遺伝子の鍵となる転写調節因子として同定された(48)。Chenらは、エピゲノムアプローチとマウス遺伝モデルを用いて、HNF4因子がACE2遺伝子の遺伝子座に結合し、クロマチンループを変化させ、エピジェネティックな修飾を形成し、最終的には転写因子をノックアウトするとACE2遺伝子の発現に劇的な影響を与えることを報告している(48)。我々の予測は、HNF1AとHNF1B因子について、膵島細胞とインスリノーマ細胞でそれぞれACE2の発現を駆動することが実験的に報告されている(49)。最近、Barkerらは、バイオインフォマティクスツールを用いて、大腸組織中のHNF1A転写因子がACE2の発現と高い正の相関を持つことも予測した(50)。CDX2は、本研究で濃縮された別の重要な転写因子であることが判明した。この因子は、腸管上皮細胞分化の間にフーリンの発現を調節することが示された(51)。小腸には、コロナウイルスのSタンパク質を2つの「ピンチャー」(S1および2)に切断することができるセリンプロテアーゼであるフーリンが豊富に存在する。Sタンパク質のS1とS2への切断は、ACE2受容体と細胞膜の両方にウイルスを結合させるために重要である(39)。実際、フーリンは小腸に広く分布する酵素であり、他の腸内毒素の活性化の過程で主要な酵素である(39)。
さらに、本研究では、176遺伝子リストと相互作用する60の薬剤のリストを抽出した。これらの報告された薬剤のいくつかは、COVID-19感染症に対する使用において有益であり得る。
ある予備的臨床研究では、高血圧症を合併した重症のCOVID-19患者に対して、降圧剤としてのレニン阻害剤アリスキレンによる治療が有効で安全であることが報告されている(52)。別の研究では、アリシレンが分子ドッキングにより、COVID-19のメインプロテアーゼMproと共結晶化したリガンドN3よりも高い結合エネルギーを示したことが報告されている(53)。彼らは、アリスキレンがCOVID-19の治療薬として再利用できることを示唆した。
グリプチンはDPP4の酵素活性を阻害することでグルコースの恒常性を制御する抗糖尿病薬である。グリプチンは、血管系に対する抗炎症作用、抗酸化作用、および潜在的な保護作用が報告されていることから、内皮機能を保護することができ、これはCOVID-19との戦いにおいて有益な側面である(54)。グリプチンはまた、宿主細胞へのSARS-CoV-2の結合を抑制するために使用されるかもしれない。宿主細胞へのコロナウイルスの侵入を阻害するDPP4インヒビター能力も調査されている(54)。
もう一つ注目すべき点は、アナグリプチンがDPP4依存性およびグルカゴン様ペプチド1非依存性の腸内コレステロール輸送抑制作用を介してコレステロール低下作用を発揮する可能性があることが最近の研究で報告されていることである(55)。
カンデサルタンは、アンジオテンシン受容体拮抗薬(ARB)として炎症を抑制し、肺や脳の機能を保護する作用があり、最近、COVID-19患者にカンデサルタンが治療効果を発揮し、サイトカインストームを改善することが報告されている(56)。最近の初めての研究では、カンデサルタン投与により高血圧に関連した腸内の病態生理的変化が緩和され、短鎖脂肪酸の微生物産生が増強され、高血圧条件下で腸内乳酸菌が保護されることが示された。これらの情報は、カンデサルタンの薬理学的意味合いに新たな光を投げかけている(57)。ロサルタンやテルミサルタンのような他のARBは、SARS-CoV-2ウイルス感染症の治療薬として我々の研究で濃縮された。これらの薬剤は1990年代以降、高血圧症や腎障害のコントロールに広く臨床で使用されており、有害事象がほとんど発生しない安全な薬剤として知られている(58)。
テルミサルタンは経口投与後によく吸収され、血漿半減期が最も長く(24時間)高い脂質溶解度と高い播種性(500L)を有するため、最高の組織濃度を達成する。この薬剤は、Ang受容体Iに付着した後、よりゆっくりと分離し、明らかに不可逆的なブロックにつながる(59)。最近、Hospital de Clínicas José de San Martín(アルゼンチン、ブエノスアイレス大学医学部)で無作為化オープンラベル対照試験が開始された。健康な症例、または 1 日量 160 mg までの高血圧患者を対象にテルミサルタンの安全性を検討した臨床試験では、テルミサルタン投与群とプラセボ投与群で有害事象の頻度や重症度に差がないことが示された(59)。テルミサルタンは、ラットの実験的炎症性腸疾患モデルにおいて、大腸の炎症、酸化的摂動、アポトーシスを抑制することが報告されている(60)。
バルサルタンは、この研究で濃縮された別のARBである。SARS-CoV-2感染症患者におけるバルサルタンの作用についての論争の中で、期待されていたエビデンスを提供するプロジェクトとして、PRAETORIAN-COVID試験が開始された(61)。
カルベジロールは血管拡張作用を有する薬剤であり、当初は高血圧および冠動脈疾患の管理のために設計された。ACE2の発現を増強するACE阻害薬とは異なり、カルベジロールはACE2の発現を低下させるため、この薬剤はすべてのCOVID-19患者に有用である(62)。カルベジロールは、インターロイキン6(IL-6)抑制作用を有し、COVID-19の炎症性カスケードにおいて主要な役割を果たしているため、別のメカニズムでCOVID-19と戦うことができる(62)。
ガンマ-リノレン酸は、生理活性脂質として、プロ炎症性のIL-6およびTNF-αの産生を抑制し、COVID-19患者に見られるサイトカインストームを治療するために採用される可能性がある。ガンマ-リノレン酸はCOVID-19を含むエンベロープされたウイルスを不活性化することが報告されており、したがって、適切な量のこの酸の注入はCOVID-19を治療する上で重要な治療上の有益性がある(63)。これらのデータによれば、30人のSARS-CoV-2陽性症例を対象とした14日間の前向き二重盲検対照試験が実施されている(Anti-inflammatory/Antioxidant Oral Nutrition Supplementation in COVID-19 [ONSCOVID19]; NCT04323228)。参加者は、介入群(IG)とプラセボ群(PG)の2群(n=15/人)に無作為に割り付けられた。IG群はエイコサペンタエン酸、γ-リノレン酸、抗酸化物質を濃縮した抗炎症・抗酸化経口栄養サプリメント(ONS)を毎日投与され、PG群はイソカロリックプラセボを投与された。感染者の栄養状態をより維持することで、抗炎症抗酸化剤ONSがCOVID-19の重症度の低下に寄与する可能性があると結論づけられる。
ベラパミルは、イオンチャネルを遮断することにより、コロナウイルスの侵入および増幅を妨害することができることが研究で示されている。Verapamilが試験管内試験でRNAウイルスに対して有効であり、細胞培養物およびマウスモデルでのフィロウイルス感染を抑制することが証明されている(64)。興味深いことに、COVID-19が確認された入院患者において、ベラパミルとアミオダロンを通常の治療と比較した無作為化試験が開始されている(Amiodarone or Verapamil in COVID-19 Hospitalized Patients with Symptoms [ReCOVery-SIRIO]; NCT04351763)。
小腸におけるSARS-CoV-2感染のヒト蛋白質-宿主蛋白質相互作用を調べた。その結果、小腸におけるACE2とその相互作用タンパク質が胃腸症状や腸内炎症を説明している可能性が示唆された。この結果は、これらの相互作用を標的とした抗ウイルス薬がCOVID-19患者の状態を改善する可能性を示唆しているが、消化管症状の可能性のあるメカニズムを見つけ出し、関連するバイオマーカーを確認するためには、さらなる研究が必要である。
