Contents
Insights into the Potential Role of Mercury in Alzheimer’s Disease
要旨
非必須元素である水銀(Hg)は、たとえ微量であっても生物系にとっては非常に有毒な汚染物質と考えられている。大気汚染物質である水銀の放出の増加と、水産物中のモノメチル水銀(神経毒性の高い)の蓄積の増加に伴う水銀曝露の増加は、ヒトに対する毒性の可能性を増大させている。
本レビューでは、この分野の既存の文献に基づいて、Hg暴露とアルツハイマー病との間の潜在的な関係を強調することを目的としている。最近の報告では、Hg曝露がアルツハイマー病発症の潜在的リスクを高める可能性があるという仮説が立てられている。また、アルツハイマー病は、細胞外神経斑と細胞内神経原線維のもつれの両方が増加する複雑な神経疾患として知られており、生活習慣や遺伝的変数も関係している可能性がある。
アルツハイマー病とHgとアルツハイマー病の関係に関する研究報告は、セロトニン、アセチルコリン、ドーパミン、ノルエピネフリン、グルタミン酸などの神経伝達物質がアルツハイマー病患者では調節障害を起こしていることを示している。
多くの研究者は、アルツハイマー病患者はHg曝露と毒性を評価すべきであると示唆している。一部の著者は、アルツハイマー病患者のHg濃度をさらに調査することを提案している。
アルツハイマー病とHg暴露における機能不全シグナル伝達経路は、アラキドン酸、ホモシステイン、デヒドロエピアンドロステロン(DHEA)硫酸、過酸化水素、グルコサミン糖鎖、グルタチオン、アセチル-L-カルニチン、メラトニン、HDLなどのいくつかの駆動因子と相互にリンクしているように見える。
この証拠は、アルツハイマー病とHg曝露との関係、およびHg曝露が脳の局所機能に及ぼす影響の基礎となる潜在的なメカニズムをよりよく理解する必要があることを示唆している。
また、不顕性および未治療のHg毒性がアルツハイマー病患者の脳機能に及ぼす長期的な影響を調べるためには、脳機能を評価するさらなる研究が必要である。
序論
アルツハイマー病は、1906年(Alzheimer 1906)にこの致命的な人間の問題を初めて記述したドイツの医師アロイス・アルツハイマー(1864-1915)の先駆的な著作以来、医学の不可解な問題として考えられてきた。この病気は、米国の死亡原因の上位4位以内にランクされており、現在500万人以上が罹患しており、2050年までに約1600万人に増加すると予測されている(Crous-Bou er al)。2017)。高齢者(≧85歳)の中では、先進国では約30~50%の人がアルツハイマー病に苦しんでいる(Reitz et al 2011;Mielke et al 2014)。アルツハイマー病症例の3%から5%の間に遺伝的起源があると考えられている(Breteler er al)。 1992; Li er al 2015)。環境因子は、多くの再調査者によって、アルツハイマー病の発症と進行の主な原因と考えられている。最近の研究では、過去数十年にわたり、アルツハイマー病の発症におけるいくつかの重要な病理学的効果に寄与する因子として、無機水銀(iHg)の役割が強調されてきた(Bjørklund 1991; Bjørklund et al 2017a)。
水銀は、生物学的実体へのいかなる暴露経路においても安全なレベルを有していない(Calabrese and Baldwin 2003)。ほとんどの人々にとって、歯科用アマルガムから放出された Hg は、重量比で約 50%の Hg で構成されており、金属および無機 Hg の主要な暴露である (Bjørklund er al 2017b)。一般人口では、歯科用アマルガムもまた、中枢神経系(中枢神経系)に蓄積されたHgの主要な供給源である(Mortazavi et al 2014; Bjørklund et al 2017c)。ノルウェーとスウェーデンでは、環境上の理由から歯科用アマルガムの使用が禁止されたと報告されている(Bjørklund et al 2017a)。しかしながら、歯科医院でのアマルガムの世界的な日常的な使用は、依然として環境への懸念を生み出している(Bjørklund et al 2017d, 2019)。
環境中のHg曝露は、鉱山リークエイジ及び汚染により発生する可能性がある(Basu er al 2015)。神経毒性があるため、小規模な鉱山コミュニティに存在する Hg 暴露による健康上の懸念が特にある(Nakazawa er al 2016)。Hgへの長期的な環境曝露は、腎、心血管、免疫系において、短期的な職業的曝露から生じるものと類似した健康への悪影響を示している(Bjørklund er al 2017a, b, d; Bodienkova and Boklazhenko 2017)。また、魚介類の多い食生活に大きく依存しているヒトの集団は、魚をめったに摂取しない人よりもリスクが高いことが報告されている(Holmes er al)。 さらに、妊娠初期のHg曝露は、乳児の神経発達に負の関係があることが報告されている(Vejrup er al)。 また、出生前のHg曝露と胎児の成長との関連性を縦断的に評価したところ、妊娠初期には二分子直径の小さな減少が見られたが、他の胎児パラメータでは有意な変化は観察されなかった(Ballester et al 2018)。さらに、ワクチンでよく知られているプレザーバティブ(Guida er al 2016; Bjørklund er al 2017e; Dórea 2017)であるHg含有チオサル(thimero-sal、エチル水銀チオサリチル酸ナトリウム)については、現在進行中の科学的議論がまだ存在する。
生物学的中毒の観点から、あるいは神経炎症メカニズムを誘発するHgの能力の観点から、Hg汚染の役割についての懸念がまだ存在する ;(Alexandrovetal.2018;Calabreseeetal.2018Gnanashanmugam er al 2018)。アルツハイマー病の原因としての水銀毒性は、神経病理学的にいくつかの問題を提起している(Mutter er al)。 毒性は、霊長類では通常230~500日と推定される脳内Hg保持時間についての健全な薬物動態学的研究を含むべきである(Rooney 2014)。水銀の毒性は、多くの場合、Hg濃縮源、特に工業起源のものに関連している(Yang er al 2016; Liang er al 2017; Ren er al 2018; Zhou er al 2018)。しかし、ヒトの脳内でのその高い滞留時間は、Hgの集積効果が神経炎症メカニズムを誘発する可能性を示唆しているはずである(Kern er al)。 脳内のHgの薬物動態に関する更なる研究は、長期的なHgの毒性およびその可能性のあるアルツハイマー病との関係についての洞察力のある手がかりを与えるべきである(Pigatto et al 2018; Yang et al 2018)。
職業曝露に加えて、Hg曝露は、鉱業によって高度に汚染された地域で発生する可能性がある(Black er al 2017)空気や土壌だけでなく、水(Higueras er al 2014; Streets er al 2018)また、食品(Dadar er al 2017)家庭環境(調理鍋、刃物、皮膚クリーム)(Bavec er al 2017)。
アルツハイマー病患者(n = 33)の血液サンプルでは、対照群と比較して、より高いレベルのHg(2倍)が報告された。しかし、若年性アルツハイマー病患者(n = 13)では、アルツハイマー病を発症していないそれぞれの対照群(n = 110)と比較して、さらに高いHg濃度(3倍)が認められた(Hock et al 1998)。
さらに、アルツハイマー病患者は血漿中のHg濃度が著しく高いことが特徴であるのに対し、脳脊髄液(脳脊髄液)中のHg濃度は影響を受けていないことも再報告されている(Gerhardsson et al 2008)。
より高い血漿Hgレベルをアルツハイマー病患者の病因と結びつける証拠が開発されてきた(Basun er al)。 1991; Walach er al 2015; Pigatto er al 2018)。逆に、多くの研究では、アルツハイマー病患者と健常対照者の間で血液中のHgレベル(Fung er al)。 1995; Homme er al 2014)と尿中のHgレベルに有意な差がないことが明らかにされている(Chakraborty 2017; Pigatto er al 2018)。さらに、嗅覚の喪失とその後のアルツハイマー病の発症との間には関連性があり、これはHgの毒性の不顕性と同等のものを示している可能性がある(Haley 2007)。それはまた、水銀汚染がインドのアルツハイマー病 エピデミック(Chakraborty 2017)で重要な役割を果たしているかもしれないと推定される。
水銀は非放射性金属の中でトップランクの毒性物質であり、低レベルの暴露でも多次元的な有害な健康被害を引き起こす。これらには神経変性変化が含まれるが、これに限定されるものではない。本研究では、可能性のある水銀の関与によって引き起こされる可能性のあるアルツハイマー病症例における潜在的な病態生理学的変化を特定することに焦点を当てている(Bjørklund er al 2017a)。
アルツハイマー病における水銀蓄積の証拠
既存のデータは、かなり矛盾しているが、アルツハイマー病患者の臓器内でのHg蓄積を実証している。ある研究では、アルツハイマー病患者の様々な脳構造におけるHgの蓄積が実証されている(表1)。特に、Ehmannら(1986)は、剖検されたアルツハイマー病患者の脳内では、アルツハイマー病なしのコントロール被験者よりも高いレベルのHgが検出された。
Thompsonら(1988)は、マイネルと基底核におけるHgの高レベルを報告し、アルツハイマー病の脳における微量金属のホメオスタシスの有意な不均衡を明らかにした。また、別の研究では、対照値と比較して、全脳組織のHg含有量のほぼ2倍の増加を示した。水銀レベルは、核、ミクロソーム、ミトコンドリア(Wenstrup et al 1990)を含む様々な細胞コンパートメントで増加することが判明した。同時に、その後の研究では、アルツハイマー病の脳構造におけるHgの有意な蓄積を明らかにすることができなかった。
アルツハイマー病患者の脳脊髄液も調査された(表2)。Basunら(1991)は、アルツハイマー病患者における脳脊髄液 Hgの有意な上昇を示した。しかし、患者と対照者の年齢の違いから、この上昇がアルツハイマー病と関連しているのか、それとも進行した年齢と関連しているのかは疑問である。対照的に、スウェーデンからの別の研究では、アルツハイマー病患者と対照群の両方で脳脊髄液中のHgの検出可能なレベルを観察しなかった(Gerhardsson et al 2008)。
アルツハイマー病における血中(血清/血漿/全血)のHg濃度に関するデータも矛盾している(表3)。特に、Basunら(1991)とHockら(1998)は、年齢をマッチさせた対照群のそれぞれの値と比較したときに、アルツハイマー病患者の血漿および血中Hgレベルの有意なほぼ2倍の増加を示した。反対に、(Paglia et al 2016)は、健常な対照群と比較して血清Hg値がほぼ2倍に減少し、さらに主観的な記憶障害や軽度の認知障害を有する患者では、血漿中Hg値がほぼ2倍に減少することを実証した。単層レシーバー操作特性(ROC)曲線分析では、血清Hg値は、アルツハイマー病と健常者の間の判別においては有意な診断力を持っていたが、アルツハイマー病と軽度認知障害の間ではなかった(Paglia et al 2016)。Canadian Study of Health and Agingでは、上位四分位の血中Hg値は認知症リスクの低下と関連していた(Kröger et al 2009)。レビューされた他の研究では、アルツハイマー病と健康な対照者との間の血中(血清/血漿/全血)Hg値に有意差を検出することはできなかった。アルツハイマー病患者の毛髪と爪の分析(表4)も対照群のそれぞれの値と比較したときにHgのレベルが有意に減少したことを実証した。
まとめると、重要な矛盾が存在するが、既存のデータは、アルツハイマー病の脳と一般的に生物におけるHgの蓄積の証拠を提供する。後者は、サンプリング(脳や組織の異なる領域)や分析(ICP-MS、INAAなど)における様々なアプローチや、研究した集団における異なるHgバックグラウンド暴露レベルに起因する可能性がある。アルツハイマー病患者の組織(脳、血液、毛髪)におけるHg分布のパターンを評価するためには、追加の研究が必要である。水銀の化学種分化は、アルツハイマー病発症時の金属の動態と代謝的相互作用の理解に貴重な貢献を提供する可能性がある。
水銀と神経細胞骨格
アルツハイマー型脳は、細胞外(βアミロイド)神経斑と細胞内神経原線維のもつれの量が増加していることが特徴である(Aaseth et al 2016; Bjørklund et al 2017a; Girek and Szymański 2019)。また、アルツハイマー病脳は、グアニシン三リン酸(GTP)アナログを結合するために大幅に減少した(80%以上)能力を持っている0℃への温度低下(PendergrassとHaley 1997)上の正常なマイクロチューブリンとしてチューブリン二量体を放出しない増加した異常に凝集したマイクロチューブリン、と一致している。チューブリン二量体のマイクロチューブリンへの重合にはGTP結合が必要なので、この主要な脳タンパク質がアルツハイマー病患者では機能不全であることは明らかである。ラットをHg蒸気に曝露すると、同様のGTPアナログ結合の減少が誘導される(Pendergrass and Haley 1997)。アルツハイマー病の脳組織で高リン酸化されているタウタンパク質は、軸索構造の神経フィラメントにマイクロチューブリンを付着させるマイクロチューブリン関連タンパク質であることを考慮しなければならない。マイクロチューブリンの異常な凝集は、タウを異常な環境に置くことになり、そのリン酸化状態の変化につながる可能性がある。しかし、ある研究では、Hg曝露が神経細胞死の間にタウの発現に影響を与えなかったのに対し、Pb曝露は影響を与えたことが示されている(Choi et al 2015)。同時に、アルツハイマー病を伴わないコントロールは、高リン酸化されたタウを含むニューロンを特徴としないことが報告されている(Pamphlett and Kum Jew 2015)。
神経原線維性のもつれ(NFT)は、アルツハイマー病の特徴の一つと考えられている。NFTクラスターは、海馬と大脳新皮質の両方で細胞内で観察されている。高リン酸化タウタンパク質の珍しい形がNFTを構成していた。タウタンパク質はチューブリンタンパク質と結合して微小管を形成し、これが神経細胞に栄養分を送るためのチャネルとして機能する。異常なタウプロテインが形成されると、微小管を破壊して神経細胞の変性を引き起こす。NFTは、束になっている微小管支持構造の異常が残っていることを示しているため、特徴的な細長い形状を提供する細胞核を変位させている。Hgはチューブリンに結合し(Syversen and Kaur 2012)タウのリン酸化を増加させるため、Hg曝露は細胞死を伴うNFTの量の増加をもたらす(Olivieri et al 2000; Fujimura et al 2009)。亜毒性濃度(100nM)でのHg曝露はグリア線維形成を誘導することが実証されているが、その効果はアルミニウム(Al)処理細胞でより顕著であった(Toimela and Tähti 2004)。また、Hgへの曝露は、チューブリンと微小管の構造の両方の崩壊を促進し、カタツムリ(Lymnaea stagnalis)の中央環神経節からのペダルAニューロンにおける神経原線維凝集体の形成を増加させることも示されている(Leong er al)。
β-アミロイド生物学における水銀の役割
Hgは、細胞骨格への攻撃に加えて、酸化ストレス誘導や神経毒性による不溶性βアミロイドの生成誘導(図1)にも重要な影響を及ぼすことが報告されており、βアミロイドの沈殿過程はアルツハイマー病の病態形成に重要な役割を果たしている(Monnet-Tschudi er al)。2006; Salinaro er al)。2018)。Kim et al 2014)は、海馬において、Hgは、その後、βアミロイド蛋白質42の蓄積を導くβアミロイド蛋白質のトランスポーターを遅らせることを発見した。褐色細胞腫細胞株12(PC12)細胞をHg塩化物(HgCl2)またはMeHg塩化物(CH3HgCl2)(0-1000 nM)に曝露すると、アミロイドβ40産生が用量と時間に依存して上昇し、アミロイド前駆体タンパク質(APP)の上昇やネプリライシンレベルの低下にも寄与することが報告されている(Song and Choi 2013)。Hgによるネプリリリシン活性の低下は、アミロイドβ42分解の低下につながり、最終的にはアミロイドの蓄積につながる可能性がある(Chin-Chan er al)。 注目すべきは、Hg処理の効果によるβ-アミロイドペプチド1-40および1-42分泌は、SHSY5Y神経芽腫細胞において差があったことである。特に、アミロイドβ1-40の産生はHg曝露4時間後に最大であったのに対し、アミロイドβ1-42の分泌は6時間後に最大であることが明らかになった(Olivieri et al 2000)。また、β-エストラジオール処理により、Hgによるアミロイドβ 1-40とアミロイドβ 1-42の分泌が抑制されたことが確認されている(Olivieri er al)。 さらに、Hgイオンとアミロイド残基との凝集が細胞質だけでなく、細胞核においても観察された(Arnhold er al)。 ガンマ-セクレターゼ酵素は、アルツハイマー病脳におけるβ-アミロイド産生のより高いレベルと何らかの形で直結している(Tabaton and Tamagno 2007)。2つの遺伝子(プレセニリン1とプレセニリン2)がγセクレターゼの状態を制御する責任がある(Raven et al 2017)。若年性アルツハイマー病症例では、通常、プレセニリン1および/またはプレセニリン2遺伝子に変異があるため、γ-セクレターゼによるβアミロイドタンパクの産生が増加している(Xia er al)。 Hg曝露がγ-セクレターゼの活性を直接的に阻害し、それによってβアミロイド蛋白質の生成の増加につながる可能性があることが研究で示されている(Alattia er al)。 一部のアルツハイマー病症例では、APPのDNAのアミノ酸置換が報告されている。このように、γ-セクレターゼモジュレーターは、γ-セクレターゼ複合体によってAPPの処理経路を変化させ、神経毒性アミロイド-βペプタイドアミロイドβ(1-42)の合成の増加を導く(Dimitrov et al 2013)。
同時に、Alattia et al 2011)は、動物モデルおよび試験管内試験細胞モデルにおいて、HgがAPPおよびノッチ処理の変化を導くγ-セクレターゼの強力な阻害剤であることを実証している。しかし、この観察は、Hgによって誘発されたアミロイドβレベルの増加という複数の観察と矛盾している。
βアミロイド切断酵素β-セクレターゼ1(BACE1)は、アルツハイマー病脳における破壊的プラーク形成の調節酵素として考えられてきた(Yan and Vassar 2014; Sadleir et al 2016)。BACE1によるAPPの細胞外切断は99-aaのC末端フラグメント(C99)を生成し、それはさらにγセクレターゼによってβアミロイド画分に分解され、自己凝集を介したプラーク形成を導く(Vassar er al 2009)。Kim et al 2014)は、ラット脳におけるアミロイドβの輸送を阻害することにより、Hgによるアミロイドβ形成が誘発されたことを報告している。さらに、MeHg曝露は、高度な糖化最終生成物(RAGE)の受容体レベルの上昇を引き起こし、アミロイドβタンパク質の輸送およびクリアランスを減少させることが判明した(Kim er al)。
Ββ-アミロイドは、通常、可溶性フラグメントへのスクレプターゼによって分解される親タンパク質APPに由来する。APP分子の非生理的分解または異常は、アルツハイマー病につながるアミロイドカスケード沈殿の機序的原因であるかもしれない(Vassar et al 2009;Hardy 2017)。MeHgへの曝露は末梢神経系の変性をもたらし、その結果、坐骨神経におけるAPP陽性軸索の数の増加に寄与した(Cao er al 2013)。アミロイド前駆体プロテインは、神経細胞の分化に関連する膜タンパク質であり、iHgへの曝露によって減少することが報告されている(Chan er al 2017)。追加の研究はまた、Hgがアミロイドβ前駆体タンパク質の生理的γ-セクレターゼ誘導性形成を強く阻害することを実証した(Alattia er al)。 Olivieri et al 2000)はまた、Hgがタウの細胞内リン酸化を増加させることを発見した。タウは、微小管に関連するタンパク質、いわゆるMAPであり、微小管の組み立ておよび安定化、したがって細胞骨格の完全性に直接関係している。タウの変異は、有害な高リン酸化形態につながる可能性がある。アルツハイマー病症例の脳では、タウタンパク質は、健康な脳と比較して、アミノ酸の高レベルの含有量、セリンによって特徴づけられる(Fontela et al 2017)。蓄積された高リン酸化タウタンパク質は、アルツハイマー病の神経変性に直接関与していると考えられている(Iqbal er al)。 Fujimura et al 2009)およびOlivieri et al 2000)による研究では、Hg曝露によるタウタンパク質の高リン酸化が報告されている。MeHgによるタウの高リン酸化は、大脳皮質におけるc-Jun-N末端キナーゼ(c-JNK)シグナル伝達経路の活性化を介して媒介されていると提案されている(Olivieri et al 2000; Fujimura et al 2009)。また、N-アセチルシステインを投与すると、Hgによるタウのリン酸化が抑制され、このシグナル伝達経路を介した酸化ストレスの関与が示唆されている(Petroni er al)。 ラット大脳皮質の培養ニューロンでは、iHgとMeHgの両方を投与すると神経変性アポトーシス細胞が死滅することが示されており、これはRho Aの抑制と相関している(Fujimura and Usuki 2012)。また、水銀処理は、分化するニューロンにおけるMAP2やタウの発現を低下させることが報告されている(Chan et al 2017)。また、Hg(II)はタウ断片R2(Cys291)(Yang et al 2010)R3(Cys322)(Yang et al 2011)と強固に結合することも報告されている。
水銀と神経伝達物質の代謝
コリン作動性神経伝達との関係
アルツハイマー病 は神経伝達物質の複雑な変化と関連している。特に、アルツハイマー病の主なパターンは、グルタミン酸シグナルの増加と同様にコリン作動性シグナルの減少であると予想される(Francis 2005)。
アセチルコリン(ACh)は、神経系を介して合成され、分子メッセンジャーとして作用する主要な化学物質であり、アルツハイマー病では疾患の重症度に応じて一般的に減少する。AChのレベルの低下は、AChが豊富な前脳の神経細胞の破壊によって明らかにされる。酵素チョーラインアセチルトランスフェラーゼ(ChAT)は、アルツハイマー病患者では90%も低下する可能性がある。AChの低下は、アルツハイマー病患者の大脳皮質と海馬の両方で発生することができる(Darreh-Shori 2016)。アルツハイマー病個体では、前脳のコリン作動性ニューロンの減少したレベルがob-servedされている。強力なコリン作動性システムの存在はまた、非認知行動や感情の調節に関与しており、神経精神医学的なアルツハイマー病のsymp-tomsに責任がある可能性がある(van Dalen et al 2017)。
水銀の毒性は、AChの減少に責任がある。ラットの研究では、MeHgへの暴露が皮質AChのレベルを有意に低下させたことが明らかになっている(Hrdina et al 1976)。水銀暴露はまた、マウスのAChターンオーバーを減少させた(Kumar et al 2014; Islam et al 2016)。注目すべきは、研究されたラットモデルにおけるHg汚染米の投与は、ラットの脳内AChレベルの有意な上昇を示したのに対し、90日の暴露後には有意に減少したことである。また、Hg処理した動物のAChEの変化は、ACh含有量とは逆に関連していた(Ji er al)。 他の研究では、大脳皮質のアセチルコリン受容体(AChR)結合がHg曝露により阻害されることが示されている(Basu er al)。 さらに、Hg曝露は筋管におけるAChRのクラスタリングの頻度を減少させ、これはアグリンによって誘導されるAChR βサブユニットのチロシンリン酸化の減少に関連していると考えられている(Miller and Grow 2004)。また、水銀はリングアザラシの脳のムスカリン性コリン作動性受容体に結合することも示された(Basu er al)。
コリンアセチルトランスフェラーゼ(ChAT)はAChの産生促進過程に関与しており、Hgによって遅延する可能性がある。この現象はAChの欠乏を引き起こす可能性がある。ラットに塩化HgまたはMeHgを水と一緒に経口投与したところ、脳内ChATの有意な阻害が認められ、神経変性を引き起こした(Kumar et al 2014; Islam et al 2016)。非常に低い濃度(マイクロモル)では、MeHgはAChとAChRの結合テンテンシーを阻害し、これらの受容体がHgの潜在的な標的候補であることが示された。さらに、Hgはカルシウム(Ca)依存性のAChの分泌過程を阻害することでコリン作動性の伝達過程を妨害する可能性がある(アミロイドβram and Korossy 1994)。健常者と比較して、アルツハイマー病を持つ個人は通常、ニコチン受容体の数が少ない(LombardoとMaskos 2015)を持っている。Mirzoian and Luetje(2002)は、ラットのニコチン受容体においてHgCl2曝露により二相性調節効果が活性化されることを報告している。受容体の増強が抑制に転じた。水銀は最終的にニコチン性AChRに結合するAChをブロックした(Mirzoian and Luetje 2002)。既存のデータは、アセチルコリンエステラーゼ(AChE)活性がアルツハイマー病と有意に関連していることを示している(Talesa 2001)。
複数のタイプの研究で、AChEに対するHgの阻害的役割が報告されている(Frasco er al)。 特に、Hgは、遺伝子発現に影響を与えることなくAChE活性を有意に減少させ(Richetti et al 2011)一方、亜鉛(Zn)(Franciscato et al 2009)およびSe(El-Ansary et al 2017)は、Hgの阻害効果を減少させることが示された。HgCl2曝露は、金魚の脳におけるAChE活性の顕著な上昇を引き起こすことが実証されている(Yao er al)。 これに対応して、HgCl2処理は、ラットの大脳皮質(22%)と海馬(26%)のAChE活性の上昇をもたらした(Moretto et al 2004)。
水銀、セロトニン変性、アルツハイマー病 可能性のあるつながり?
アミノ酸トリプトファンに由来するセロトニンはモノアミン神経伝達物質であり、覚醒、気分、および痛みのコントロールに複雑に関連している。アルツハイマー病の脳は、セロトニンの明確な赤字を持っていることが示されている(Benhamú et al 2014)。過去の報告では、視床下部のセロトニンレベルの用量依存性の減少は、HgCl2にさらされたティラピア魚の研究で報告された(ツァイ et al 1995)。ゼブラフィッシュを対象とした別の研究では、MeHg がセロトニンの細胞外レベルを低下させることが報告されている(Maximino er al)。 過去の研究では、Oudarら(1989)は、ラット脳内のHgがセロトニンと高親和性受容体との結合阻害を誘導することを報告している(Oudar et al 1989)。しかし、脳内セロトニンレベルに対するHgCl2曝露の有意な効果は、最近、C57BL/6Jマウスにおいて検出されなかった(Wang et al 2013)。
MeHgとiHgの両方がマウス神経芽腫細胞におけるセロトニン誘導電流を不可逆的に阻害したという時代遅れの研究(Uki and Narahashi 1996)は別として、この証拠は、MeHgはまた、隣接するニューロンにおける神経伝達物質のバランスに有意に影響を与える可能性のあるセロトニンのアストロサイトの取り込みを減少させるという観察でも再現された(Maximino er al)。 Hg毒性におけるセロトニン神経伝達の異常とアルツハイマー病との関係はまだ解明されていない。アルツハイマー病を持つ被験者では、血小板セロトニンのレベルの低下が報告されている(Tajeddinn et al 2016)。興味深いことに、過去の研究から浮上しているように、Hgは血小板セロトニンレベルを減少させる(Ally er al)。
セロトニンレベルの低下と酸化されたセロトニン代謝物(トリプタミン-4,5-ジオン)の濃度の低下を特徴とするセロトニン作動系の変化が、ゼブラフィッシュ(Danio rerio)のMeHg誘発神経毒性に重要な効果を示すことが示されている(Maximino er al)。
さらに、セロトニントランスポーター遺伝子(5-HTT)の多型領域(5-HTTLPR)の違いは、水銀による毒性に対する感受性を増加させる可能性がある(Echeverria er al)。 セロトニン受容体に対する血清自己抗体のレベルの増加もまた、III期の慢性Hg中毒患者において、I-II期と比較して観察された(Bodienkova and Boklazhenko 2017)。
グルタミン酸神経伝達への影響
グルタミン酸(Glu)は、ニューロンへの実質的なCaイオンの流れを維持することで、記憶や学習などの認知活動を加速させる興奮性の神経伝達物質として作用することができる。グルタミン酸の過剰生産により、過剰なCaイオンがニューロンに入ることがある。過剰なグルタミン酸は、最終的にはアルツハイマー病患者に見られるものと同様の神経の神経変性にさえつながる反応性フリーラジカルを産生することによって酸化ストレスを引き起こすことが示唆されている(Cassano et al 2016)。
脳の大脳皮質領域の神経伝達物質の約90%はグルタミン酸である。このように、グルタミン酸は脳内で最も顕著な神経伝達物質であり、他の神経伝達物質を制御する機能も発揮する(Schousboe 2017)。
Hgによる神経毒性は、グルタミン酸の興奮毒性機能を介して調節されている可能性が示唆されている(Aschner er al)。 塩化水銀は、アストロサイト(Aschner er al 2000)やニューロン(Fonfría er al 2005)でのグルタミン酸の取り込みを阻害し、グルタミン酸の放出を促進することが報告されている。水銀暴露は、グルタミン酸-アスパラギン酸トランスポーター(GLAST)グルタミン酸トランスポーター-1(GLT-1)およびグルタミン酸トランスポーターの発現に差 異的な影響を与えた(Mutkus er al)。 特にラットの前頭前野にMeHgを灌流すると、細胞外グルタミン酸レベルが有意に上昇することがわかった(Juarez er al 2002)。MeHgとSH-SY5Y神経芽腫細胞のインキュベーションは、細胞死(Ndountseとチャン2008)に続くカスパーゼ-3活性化の過剰発現と一緒にN-メチル-D-アスパラギン酸(NMDA)の発現の顕著な上昇を誘導した。また、NMDA受容体感受性のレベルの上昇は、ペルオキシナイトライトの過剰生産(Miyamoto er al)。 さらに、NMDARアンタゴニストと一酸化窒素合成酵素(NOS)阻害剤の使用は、線条体からのMeHg誘発ドーパミン放出を有意に減少させた(Faro er al)。 NMDARアンタゴニストはまた、Hg誘発性DNA損傷を少なくとも部分的に防止した(Juarez er al)。 また、MeHgへの出生前暴露は、海馬(Baraldi et al 2002)および大脳皮質におけるNMDA受容体NR2Bサブユニットの発現を有意に増加させることも実証されている(Wang et al 2013)。しかし、既存のデータは、かなり議論の余地がある(Liu et al 2009)。注目すべきは、有機Se化合物であるebselenが、減少したグルタミン酸取り込みを逆転させ(Moretto et al 2005)その放出を増加させることが示されたことである(Farina et al 2003)。MeHgとグルタミン酸への同時曝露は、個々の薬剤と比較してタウのリン酸化を増加させることが実証されている。その結果、NMDAとCaシグナル伝達を阻害することにより、MeHgとグルタミン酸の同時曝露による毒性とタウの高リン酸化が有意に減少した(Petroni er al 2013)。
一酸化窒素(NO)は、血管拡張剤として作用し、神経伝達物質(気体)としても考えられている。過剰なレベルのNOは、NOSが産生するアルツハイマー病に影響を与えると考えられている(Dias er al)。2016)。Park and Youn(2013)は、一酸化窒素合成酵素の発現とシクロオキシゲナーゼ-2(Cox-2)発現のアップレギュレーションを介して、Hgが核内因子-κB(NF-κB)の誘導に重要な役割を果たすことを発見した(Park and Youn 2013)。これらのデータは、MeHg 曝露に再反応した場合の脳内 NO レベルと NOS 活性の上昇が c-fos 発現の上昇と関連しているという観察と一致している(Cheng er al 2005, 2009)。また、ラットの線条体核における NO シグナルの阻害が MeHg 誘発ドーパミン放出を有意に減少させることも示されている(Faro er al)。 また、プルキンエ細胞(Himi er al)。 1996)や小脳ニューロン(Herculano er al 2006)においても、MeHgによって誘発されたNOS活性の増加が明らかになった。
水銀は、アルツハイマー病患者で修飾/阻害されていることが確認されている多数の酵素の有意な機能不全を誘発することができる(Ynalvez et al 2016)。特筆すべきことに、クレアチンキナーゼは、正常な脳組織と比較してアルツハイマー病脳組織において98%阻害されており、非常に反応性の高いスルフヒドリルを含むこの酵素のATP結合ドメイン内にある(Olcott et al 1994)。パイサプレセニリン1遺伝子変異は、コロンビアや日本のアルツハイマー病患者に存在すると報告されているγ-セクレターゼを制御していると考えられている(Cordy et al 2011)。しかし、アルツハイマー病発症における環境水銀曝露との関連性の可能性が示されている(Cordy et al 2011)。
図2 グルタミン酸と水銀の神経毒性の相互作用
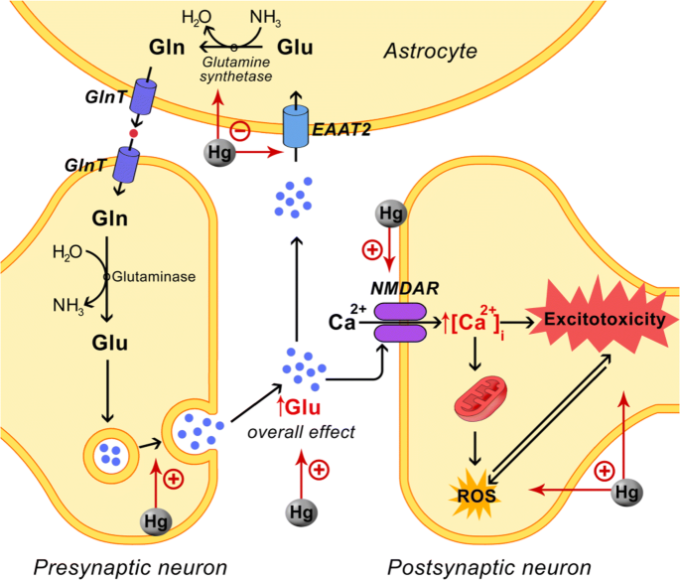
水銀曝露は、アストロサイトのグルタミン酸取り込みを阻害し、その放出を刺激して、最終的には細胞外グルタミン酸の高濃度化につながる(Farina et al. 水銀誘発性 alterationof selenoprotein metabolism と酸化ストレスは、グルタミン酸取り込みを減少させる潜在的なメカニズムとして提案された(Spiller 2018)。
また、EAATを含む細胞タンパク質の酸化もグルタミン酸取り込みを低下させる可能性がある(Kanda et al. 無機Hgはまた、グルタミン酸のグルタミンへの変換を妨げるastrocyte glutamine synthetase(Allen et al. 2001)を阻害する。
また、HgはNMDARを刺激することが示された(Xuら2012)、その結果、シナプス後ニューロンへのCa2+フラックスが増加した。細胞内Ca2+レベルの増加は、最終的にはミトコンドリアでの活性酸素の過剰生産と興奮毒性につながる(Pivovarova andAndrews 2010)。
略語。EAAT、興奮性アミノ酸トランスポーター、GlnT、グルタミントランスポーター、NMDAR、N-メチル-D-アスパラギン酸受容体、ROS、活性酸素種
水銀と神経炎症
アルツハイマー病は通常、免疫反応と炎症を伴い、おそらくは悪化する。補体1の活性化は、アルツハイマー病の炎症を誘発することが提案されており、これは他の炎症性因子の産生を開始させる原因となり得る(Brouwers et al 2012)。ここでは、異なるレベルのHg蒸気にさらされた遺伝的感受性を持つ雌マウスを対象とした実験的研究に注目したい。グラム蒸気曝露とIgG、IgM、補体因子3cの個体値には有意な相関関係が認められた(Warfvinge er al)。
免疫応答を放出することで、脳のグリア細胞内の調節性サイトカインが免疫応答を制御し、炎症や外傷性組織傷害に寄与する役割を果たしている。アルツハイマー病プラークに含まれるβアミロイドは、周囲のミクログリア細胞を引き金にしているように見える。サイトカインは、潜在的にアルツハイマー病の進行を増加/加速する際に修飾的な役割を果たしている(Chong et al 2017);Papadopoulos et al 2017))。Gardner et al 2010)は、Hg暴露された金鉱夫は、Hg暴露されていないダイヤモンドやエメラルドの鉱夫に比べて、プロ炎症性サイトカインのレベルが有意に高いことを報告している(Gardner et al 2010)。さらに、水俣病患者(MeHg中毒)の脳のマクロファージを対象とした研究では、インターロイキン6(IL 6)やIL 8などのサイトカインの発現が有意に高レベルであることが報告されている(Yamamoto er al)。 グリア線維性酸性タンパク質(GFAP)抗体は、GFABとGFAPというタンパク質を標的とした自己抗体であり、アルツハイマー病発症に関連している。そのため、老人性認知症患者ではGFAP自己抗体が認められる。金属曝露によって神経細胞のタンパク質が変化し、抗体が産生され、その抗体が神経系の神経変性を誘導することが提案されている(Crichton er al)。
免疫応答は基本的に炎症を起こすサイトカインであるIL-1を産生する。ミクログリアはIL-1を産生し、これが細胞破壊カスケードを誘導し、βアミロイド前駆体タンパク質の発現のアップレギュレーションを増加させる。IL-1の過剰発現は、アルツハイマー病における神経炎症の引き金となるようであり、神経原線維性タングルおよびβアミロイドプラークの増加した形成を導く(Cai er al 2014)。Gardner et al 2009)は、20人の研究対象者から採取したヒト末梢血単核球のHgCl2処理時に、IL-1 βおよびTNF-α放出の有意な上昇を報告した(Gardner et al 2009)。
多くの自己免疫疾患における炎症は、腫瘍壊死因子(TNF)というサイトカインによって引き起こされている。TNFレベルの異常上昇は、アルツハイマー病脳における神経シグナル伝達を阻害すると考えられている。また、患者さんは脳脊髄液中のTNF-αが高レベルであることがチャラになっている(Dursun er al 2015)。また、飲料水を介してHgへの10週間の暴露は、プレーリーオオカミが彼らの小脳と海馬でTNF-αの上昇レベルを示すことにつながることが明らかにされており、明らかにアルツハイマー病の神経病理学におけるHgの潜在的な影響を示している(Curtis et al 2011)。β-2マイクログロブリン(前駆体タンパク質)への変化は、フィブリル形成とともにタンパク質の凝集を調節することに寄与するかもしれない(Natalello et al 2015)。しかし、この前駆体タンパク質は通常、ペプチド(β-2マイクログロブリン)に分解されて、アルツハイマー病症例のアミロイドのレベルを上昇させる。別の研究では、かなりの量のMeHgを含むマグロとカジキの両方を摂取した被験者の尿中排泄物中にβ-2マイクログロブリンのレベルが上昇したことが示されている(Kumar and Bhattacharya 2000)。
神経炎症のプロセスは、免疫系の助けを借りて始まる。ミクログリア細胞は通常、傷害箇所に集まる傾向がある。ミクログリア細胞の活性化は慢性的な炎症を誘発する可能性がある。サイトカインと補体は、免疫系によって放出される神経毒性化学物質である。アルツハイマー病脳は、プラーク形成領域内/隣接するポイントで炎症の兆候を示している。これらの領域は、ミクログリア細胞の活性化の有意なレベルで高レベルの神経毒性化学物質を含んでいる(HANZEL et al 2014))。Gardner et al 2010)は、Hg曝露労働者の免疫を研究し、Hg曝露を、アルツハイマー病症例で観察されたHg中毒を持つ金鉱夫における炎症の再スポンサードに類似した、ACに付随する炎症を伴う自己免疫機能障害の潜在的な候補としてリンクさせた(Gardner et al 2010)。
シクロオキシゲナーゼ-2(Cox-2)の酵素活性化の亢進は、炎症反応に伴うもので、例えば神経炎症の際に見られる。Cox-2はプロスタグランジンの産生を助け、神経細胞内のグルタミン酸(神経毒)のレベルを上昇させる。Cox-2は、順番にアミロイドペプチド依存性の神経変性を増加させる神経細胞の制御異常で、その結果、アルツハイマー病患者の脳内で過剰発現している(Hoozemans et al 2001)。
Park and Youn (2013)の実験では、HgはNOSだけでなく、cox-2発現のアップレギュレーションも誘発することを発見した。また、ラットを用いたモデル研究では、HgCl2曝露がcox-2の活性を上昇させることが報告されている(Aguado er al)。
水銀曝露とセレン枯渇
脳内伝達物質の機能障害は、チオール基と同様に生物学的セレン基と親電子的なHg化合物の相互作用によって前駆的に引き起こされる可能性がある(Korbas et al 2010; Bjørklund et al 2017b)それによって生物学的に活性なセレン(Se)の枯渇を引き起こす。例えば、元素Hgに曝露された歯科スタッフは、セレノ酵素グルタチオンペルオキシダーゼ(GPx)の活性が低下していることが示されている(Samir and Aref, 2011)。さらに、SeとHgの間の相互作用が人口の健康や人口動態に関連していることが実証されている(Skalny et al 2016)。微量元素Seは脳機能にとって重要であり、重度のSe欠乏は不可逆的な脳損傷を引き起こす(Burk and Hill 2009)。循環Seトランスポーター、セレノプロテインP(SELENOP)は、脳へのSeの配信に特別な役割を持っているように見える。グルタチオンペルオキシダーゼ1および4(GPx1およびGPx4)は、ニューロンにおける重要な細胞内抗酸化性セレノプロテインであり(Zhang et al 2010)Hg曝露はこれらの酵素の活性を低下させる。米国と比較して高濃度セレンの少ないヨーロッパでのヒト研究から得られた証拠は、認知機能の低下に対する保護における高濃度セレンとセレノプロテインの役割を示唆している。65歳以上のイタリア人参加者1012人を対象としたIn CHIANTI共同ホート研究では、血漿中のSe濃度が低い参加者では、高濃度の参加者と比較して、協調性のパフォーマンスベースの評価スコア59が有意に減少した(Shahar er al 2010)。60~70歳の1166人を対象としたフランスのEVAコホートでは、ベースライン時の血漿中Se濃度が低い参加者では、認知機能低下のリスクが4年間にわたって有意に増加していることが再記録されている(Berr er al)。 スペインからは、軽度の認知機能障害を持つ高齢者に比べて、アルツハイマー病患者の血清中のSe濃度が低いことが報告されている(Gonzalez-Dominguez et al 2014)。
マウスを用いた研究では、Seの枯渇は、神経増殖と関連していた、と海馬の形態学的分析は、Seの枯渇は、アルツハイマー病で見られる機能障害に寄与することができるという仮説に沿って、減少した樹状突起の長さと密度を明らかにした(Caito et al 2011)。
Hgによるセレノール基のトラップは、細胞内GPxの合成のためのそのavailabil-ityを減らすことができる(Bjørklund 2015)。グルタチオン(GSH)とともに、これらの神経内セレノレン酵素は細胞内抗酸化物質として作用し、それによってタウの凝集を抑制する(Du er al)。 微小管の保護に対するGPxとその補因子GSHの正確な役割はまだ完全には解明されていない。GPxの最適な機能は、アルツハイマー病を伴う認知機能低下からの保護に必要である。GPxの機能を最適化するためには、特にHg曝露の場合には、公式に推奨されているよりも高いSeの摂取が必要である。
遺伝学、エピジェネティクス、水銀
これまでの研究者たちは、遺伝物質と環境の病因の両方がアルツハイマー病を引き起こす原因になっていると提案していた。アポリポタンパクE対立遺伝子4(APOE 4)は、脳と体内の両方に存在するタンパク質で、通常はアストロサイトによって合成・分泌される。脳細胞内を循環していることが知られており、それぞれのニューロンの損傷時にコリン作動性シナプスの再処理に関与する脳ニューロンの細胞質に存在している。APOE 2-4は、APOEの対立遺伝子変異体である。それぞれの親から少なくとも1つの対立遺伝子を遺伝し、6つの遺伝子型(e2/e2,e2/e3,e2/e4,e3/e3,e3/e4,およびe4/e4)から構成される。アルツハイマー病では、可能性のあるAPOEの約50%がAPOE 4を占めていると考えられている。APOE4は、アミロイドβの結合を促進してプラークの形成を促進する。研究は、APOE対立遺伝子e4/e4を持つ人は、80歳で約95%のアルツハイマー病発症リスクがあることを示している(Roses 1998)。しかし、e2/e2対立遺伝子を有する者は、まれにアルツハイマー病を発症する(Fallin et al 2001; YousufとIqbal 2015)。他の対立遺伝子と比較して、APOE 4はHgなどの金属と結合する親和性が低いことが示唆されており、これがアルツハイマー病発症のリスク因子の高さを説明する可能性がある(Morris er al 2016)。しかしながら、証拠は、Hg誘発損傷がAPOE 4対立遺伝子によってさらに増強されたことを示唆している(Arrifano et al 2018))。Ng et al 2013)は、遺伝的感受性にかかわらず、Hgへの出生前曝露が神経発達に及ぼす可能性のある影響を研究した(Ng et al 2013)。出産時に1人のハンドレッドと68人の被験者を募集し、その後2年間観察した。遺伝的感受性だけでなく、神経発達におけるHg曝露との相互関係の可能性を、臍帯血中のHg濃度を調べることによって評価した。著者らは、APOE多型とHg曝露との関連は、2歳児の神経発達におけるAPOEによる血中Hg効果の潜在的な修飾においても有意であると結論づけている(Ng er al 2013)。他の研究では、少なくともHg結合基を有し得るAPOE e2,e3,およびe4対立遺伝子にシステイン残基を有する可能性が報告されている。APOE e2は2つ、APOE e3は1つのシステイン残基しか持たないが、APOE e4はシステイン残基を持たない。これらの研究者は、APOE e4対立遺伝子を持つ人がアルツハイマー病を発症するのは、APOE e4がHgを無害化するためのシステイン・スルフヒドリル基を持たないからだと考えている(Breteler et al 1992; Morris et al 2016)。601人の被験者を対象とした研究では、出生前のHg曝露と非定型神経発達との間の可能性のある関連が明らかになった。彼らは、少なくとも1つのAPOE 4対立遺伝子を有する子供の認知スコアのHg関連の損失を報告した(Tratnik et al 2017)。
アミロイド前駆体タンパク質遺伝子では、それはアルツハイマー病患者で3つの遺伝的変異が報告されている。プレセニリン1(PS1)とプレセニリン2(PS2)と名付けられた2つの変異。1番染色体上のPS2遺伝子は、自閉症優性アルツハイマー病を誘発する可能性がある。若年性アルツハイマー病の全症例の約30%が14q染色体上のPS1遺伝子と関連している(Somavarapu and Kepp 2016; Le Guennec er al 2017)。水銀は遺伝子変異を引き起こす可能性がある。MeHgに曝露された二本鎖DNAは、対照群よりもmRNA(ポリメラーゼII)の転写速度が高いことがわかった(Frenkel et al 1985)。コロンビアのアンティオキア地方では、世界で最も高いレベルのHg暴露が金鉱夫の間で報告された。彼らのアルツハイマー病発症リスクは、本レビューで以前に報告された日本の同じ変異群よりも早い(Cordy er al 2011)。
α-2 マクログロブリン(A2M)遺伝子は、アルツハイマー病発症の影響を受けやすい遺伝子の一つである。この遺伝子は1番染色体上に位置し、神経細胞によるβアミロイドタンパクの産生速度を制御する因子であると考えられている(Varma et al 2017)。Hgを投与された男性41名と、年齢をマッチさせた55名のHg非投与労働者を対象に、A2Mについて調査を行った。その結果、A2Mレベルは、Hg暴露者の方が対照者に比べて高いことがわかった。水銀吸入はヒトの血清タンパク質を刺激すると考えられており、これはHgのエピジェネティックな影響と関連している可能性がある(Bencko er al)。 1990)。
海馬は記憶系の側頭葉である。アルツハイマー病では、海馬で神経細胞が死滅するため、記憶や学習能力が全滅した(Alkadhi and Dao 2018)。ラットを用いた研究では、MeHgが海馬でのDNA合成を44%阻害するとともに、アポトーシス細胞死を急性に誘発することが報告されている(Falluel-Morel et al 2007)。
Hgのアルツハイマー病への作用と治療法のさらなる課題
βアミロイドタンパク質は血小板から産生され、アルツハイマー病の病因形成に重要な要素である(Gowert et al 2014)。これまでの研究者は、アルツハイマー病患者におけるより高い活性化率は、ビタミンD欠乏症(Keeney and Butterfield 2015)とともに、脂質過酸化のレベルの上昇に起因する可能性があると報告している(Bradley-Whitman and Lovell 2015)。また、血小板活性化の加速速度は、アルツハイマー病におけるアクトミオシン組織のrasホモログ遺伝子fam-family member A(RhoA)依存的な変調を介して誘導され得ると考える著者もいる(Sonkar et al 2014)。過去の報告では、Kostkaら(1997)は、低レベルのHg濃度が、血液凝固に影響を与えるだけでなく、プレートレットの活性化を調節するために、生理的アゴニストとともに作用する可能性があることを報告した(Kostka et al 1997)。また、低濃度のHgと高濃度のHgの両方が血小板の活性化と機能に影響を与える可能性があることも報告されている。低濃度のHgは赤血球の凝固過程を促進することがわかっている(Lim er al)。
Djordjevic et al 2008)は、臭気識別検査は、軽度の認知機能障害からアルツハイマー病の発症の可能性を示すことができることを示唆している。Hgの毒性の1つの症状は、嗅覚の喪失である。嗅覚系による中枢神経系へのiHgの取り込みが示されている。鼻腔内での連続的なHg蒸気曝露は、嗅粘膜で酸化し、球根内のHg濃度を著しく高くする可能性がある。さらに、嗅覚神経経路もまた、脳によるHgの取り込みのための潜在的な経路である可能性がある(Bjørklund et al 2017a)。
研究者らは、潜伏性単純ヘルペスウイルスの存在が、アルツハイマー病脳では対応する脳よりも高いことを報告している。APOE 4対立遺伝子とヘルペスウイルスの典型的な組み合わせは、アルツハイマー病発症の有意なリスクを提示する。1型単純ヘルペスは典型的には冷え性のただれとして現れ、ヘルペスウイルスがアルツハイマー病におけるプラーク形成の原因の1つであるという仮説が立てられた(Bourgade et al 2015)。 βΒアミロイドプラークは抗ウイルス性を有しており、これは単純ヘルペスウイルスからの感染からの防御に利用される可能性がある(Bourgade et al 2016)。単純ヘルペスウイルスが脳内に潜伏したままで、周期的にしか再活性化しない場合には、初期防御が有効である可能性がある。しかし、このウイルスは、継続的なAPPアミロイド生成プロセスを誘発し、最終的には脳内のアミロイドβ沈着につながる可能性がある(Bourgade et al 2016)。西アフリカでは、アルツハイマー病の登録率はアフリカ系アメリカ人(3.96%)よりも低い(1.41%)(Osuntokun et al 1995)。しかし、米国では、アフリカ系アメリカ人は通常、白人に比べてアルツハイマー病の発生率が高い(2倍)とされている(Williams et al 2007)。これは、環境-精神的要因がアルツハイマー病の発症に重要であることを示唆している。ナイジェリアの高齢者を対象とした研究では、APOE 4対立遺伝子はアルツハイマー病とは無関係であることが明らかになった。この研究では、アルツハイマー病患者におけるAPOE 4対立遺伝子の発現率は16.7%と健常者の20.5%に比べて比較的低かったが、APOE 4対立遺伝子の発現率が高いことが報告されている。しかし、アフリカ系アメリカ人では高い相関が報告されている(Osuntokun er al)。 さらに、熱帯アフリカから採取した魚のHg濃度は、他の地域の値と比較して低いことが報告されている(Black er al)。
Sacuiu et al 2016)は、アルツハイマー病の初期段階でうつ病と認知症の同時発生を示した。アルツハイマー病初期の認知症とうつ病を区別するのは、共通する症状があるため難しいかもしれない。例えば、軽度から中等度のアルツハイマー病では、うつ病の発生率は測定可能であるが、重度の場合はその逆になる(Sacuiu er al)。2016)。アマルガムを装着している被験者は、歯科用アマルガムを装着していない被験者に比べて、うつ病に似た症状の発生率が高いことが、レビュー分析で文書化されている(Kern er al)。 慢性高血圧は、アルツハイマー病における記憶障害の危険因子として関連している。Kruyer et al 2015)は、適切な血圧を維持することで、記憶障害を改善することが可能であると報告している(Kruyer et al 2015)。Choi et al 2015)の研究では、血清フェリチンとHgのレベルが高血圧の発生と関連していることが報告されている。歯科用アマルガムが多数ある被験者は、歯科用アマルガムがない被験者に比べて血圧が高いことが判明している(Choi er al)。
細胞外プラークと細胞内神経線維のもつれの形成は、アルツハイマー病の神経病理学的特徴である。ダウン症候群(DS)の患者は、通常、同じ特徴を発症する。35歳以上になると、DSにおけるアルツハイマー病発症のリスクは、一般集団と比較して3~5倍に増加する(Hartley er al)。 また、神経細胞を対象とした研究では、マンガン(Mn)カドミウム(Cd)アルミニウム(Al)鉄(Fe)鉛(Pb)水銀(Hg)のうち、低濃度のHgのみがアルツハイマー病に見られる異常なチューブリン凝集の特徴を誘発することが示されている(Leong er al)。 APOE遺伝子型とDSの認知症リスクとの関連については、まだ十分な検討がなされていない。ある研究では、APOE4保有者とAPOE3/APOE3保有者の認知症のオッズ比は2.74であった。しかし、APOE3対立遺伝子保有者はDSの認知症リスクが低い(Rubinsztein et al 1999)。研究では、DSでAPOE 4対立遺伝子を有する被験者では、後期発症アルツハイマー病のリスクが同様であることが報告されている(Hartley et al 2015)。Hg曝露とAPOE 4との関係については、すでに本文中で議論されている。El-Saeed et al 2016)は、エジプトのDS患者(95例)の血清Hg濃度を健常者(90例)と比較した。その結果、DS群の方がDNAへの著しい損傷を伴う血清中Hg濃度が高いことが明らかになった(El-Saeed et al 2016))。DS患者は、DSなしで年齢をマッチさせた対照群と同程度の量のう蝕を有することが示されている(Moreira et al 2016)。
水銀は、加齢とともに脳内に生物蓄積する可能性のある神経毒性重金属として特徴づけられている(McHuron et al 2016)。Pendergrass and Haley(1997)は、歯科用アマルガムを通してヒトに存在するHgに匹敵するレベルのHg蒸気に曝露したラットの脳を研究した(Pendergrass and Haley 1997)。ラット脳内のHgの上昇レベルは、アルツハイマー病の脳よりも顕著であるが、同一の化学的病変で観察された。この結果は、Hgが微小管を形成するためのチューブリンの処理を阻害する可能性を示している(Pendergrass and Haley 1997)。Guzzi et al 2016)は、18体の死体のHg濃度を調べたところ、アマルガムを装着した被験者で高いHgコン濃度が観察された。
さらに、12個以上の咬合アマルガムを装着した症例では、脳内Hg濃度が高くなることが報告されている(Guzzi et al 2006))。Nylanderら(1987)は、歯科用アマルガム充填数とアマルガムからのHg蒸気による組織へのHgの蓄積との関連性を示した。Hahnら(1989)は、203Hgの放射能にさらされた成羊の肝臓と腎臓に高濃度のHgが蓄積していることを発見した(Hahn et al 1989)。しかし、彼らはヒツジの脳組織を分析していない。
Russell(2017)は、4本以上のアマルガムの詰め物をすると、妊婦の血中Hg濃度が有意に上昇することを報告している(Russell 2017)。Bedir Findik et al 2016)は、アマルガム充填を受けた28人の妊婦の臍帯中のHg濃度が、非アマルガム群(32人の対照群)と比較して有意に高いことを発見した(Bedir Findik et al 2016))。また、Yin et al 2016)は、歯面修復群の血中Hg濃度が、歯面修復をしていない対照群と比較して高いことを報告している。彼らの研究は、歯面修復物の有無にかかわらず、歯面修復物を装着した被験者14,703人(NHANESデータ)を対象に行われた(Yin er al 2016)。血中Hg値は、対照群(65例)に比べてアルツハイマー病初期の被験者(13例)では約3倍、アルツハイマー病全体の被験者(33例)では対照群に比べて約2倍高い結果が得られた(Kim er al)。
(Sun et al 2015)は、台湾の国民健康保険のプログラムの下 2005年と2010年に歯科状態が記録された65歳以上の台湾人対象者207,587人を対象に包括的な調査を行った。対象者のうち、アマルガムを保有している被験者は、アマルガムを保有していない群に比べてアルツハイマー病の発症率が10.5%高かった。女性は13.3%のアルツハイマー病の増加率を持っていたのに対し、男性は7%のアルツハイマー病の高い率を観察した(Sun er al)。
高レベルではあるが毒性のないHgへの長期暴露は、高齢者の認知障害の発症を加速するように見えるが、2,3-ジメルカプト-1-プロパンスルホン酸(DMPS)またはメソ-2,3-ジメルカプトコハク酸(DMSA)のようなHgキレート剤の治療的適用は、そのような治療は効果が低く、副作用のリスクが高いので、一般的に推奨されるべきではない(Gerhardsson and Aaseth 2016)。キレート特性を有する別のチオール誘導体であるα-リポ酸は、長期的なHg曝露において神経保護効果を有するようであり(Rooney 2007)アルツハイマー病患者においても治療の可能性を有すると主張されているが(Holmquist et al 2007; Sharman et al 2019)この後者の効果に関して更なる研究が求められている。
Hgによって引き起こされた場合、アルツハイマー病関連の障害を救済するためにSeとセレン酸塩の能力は、最近、有望な提案として歓迎されている(Aaseth et al 2016)。以前の研究では、Seの補充は、Seの状態が悪い高齢者の認知機能の低下を遅らせることができることが示された(Tolonen et al 1985)。アルツハイマー病発症におけるSeの役割については、最近レビューされている(Farina and Aschner, 2017; Rasinger et al 2017; Liu et al 2018; Solovyev et al 2018)。さらなる解明が必要ないくつかの論争のある問題が存在する。アルツハイマー病における神経変性に対抗するためのSeの能力は、最近、バイオアベイラビリティを増加させ、体内でのSeの制御された放出を可能にするSe濃縮ナノ粒子を使用するための技術的な提案によって支持されている(Nazıroğlu et al 2017)(Hosnedlova et al 2018)。しかし、Seのサプリメントの有効性は、ヨーロッパ地域の人々よりもSeの摂取量が多い米国からの患者でのプラセボ対照研究(PREアルツハイマー病VISE)は、アルツハイマー病プロセス上のSeの肯定的な効果を確認していないように、患者のベースラインのSeの状態に強く依存しているように見える(Kryscio et al 2017)。今日、臨床での使用が承認されている唯一の薬剤は、シナプス座におけるAChのバイオアベイラビリティーを増加させることによって作用するAChE阻害剤である。残念ながら、これらの酵素阻害剤は、アルツハイマー病を逆転させることはできないが、いくつかの症状を緩和する可能性がある(WallaceとBertrand 2013)。別の症状緩和剤であるメマンチンも臨床家によって使用されている。メマンチンはNMDA受容体を遮断することでグルタミン酸系に作用し、神経伝達物質であるグルタミン酸の活性を阻害する(Parsons er al 2007)。
おわりに
我々は、アルツハイマー病 と Hg との間の相互作用を直接および間接的に調査するために、かなりの数の発表された文書をレビューした。ほとんどの研究では、Hgの曝露とアルツハイマー病の発症と進行との間に潜在的な因果関係があることが示されている。Hgは基本的にすべての生化学的経路を強力に阻害するので、これは驚くべきことではない。蒸気(Hgo)と有機Hg(CH3-Hg)を含む様々な形態のHgは、疎水性組織に入り、複数の生化学的経路を阻害することができる。これらの経路のそれぞれが、認知機能の障害につながる中枢神経系へのさまざまな程度の悪化に寄与する可能性がある。本レビューでも文献でも完全にカバーされていないのは、(1)Hgとの相乗的な毒性と、(2)Hg2+によって本質的な酸化還元金属、例えばFe2+が本来の結合部位から変位することによって生じる付加的な損傷の問題である。Hg2+がFe2+を置換したことによるヒドロキシルフリーラジカルの生成は、非酸化還元金属であるHgが脳内で酸化ストレスを誘発するメカニズムを説明するものである。
それは、Hgが神経伝達物質の代謝と神経炎症の促進に重要な役割を果たすことができ、それによってアルツハイマー病の発達を誘発する可能性があることは、レビューされた研究から明らかである。さらに、本レビューでは、Hg曝露とアルツハイマー病の発症を関連づける可能性のある磁気的およびエピジェネティックな影響についても検討した。歯科用アマルガムがアルツハイマー病の脳に影響を与えたり、Hgの血液-脳間輸送を上昇させたりする可能性があるという証拠は、Hgとアルツハイマー病の間の潜在的な関連性を示唆している。アロイス・アルツハイマー(1906)によるアルツハイマー病タイプの脳の最初のケースの観察は、歯科用アマルガムの導入と使用の増加の数十年後に発生したことは関連している。しかし、他の環境毒素も脳の酸化ストレスを引き起こす可能性があり、それらを無視するべきではない。Hg 暴露を含む アルツハイマー病 の病因についての結論は、アルツハイマー病 因果関係のマーカーとしてそのような元の露出を考慮するためにいくつかのタイトなメカニズム論的な証拠を主張する。
