Contents
www.ncbi.nlm.nih.gov/pmc/articles/PMC6077196/
Front Immunol. 2018; 9: 1759.
オンライン公開 2018 Jul 30.
要旨
出生時には多くの重要な出来事が起こる。胎児は、水と温かく、ほぼ無菌状態の保護された子宮内環境から、微生物が繁殖した乾燥した冷たい外界に突然引き離される。
新生児が生きていくためには、国家が友好国と貿易を行い、敵対国の侵入を防ぎ、必要なら戦争をするように、多くの生物と関わり、あるものは利用し、またあるものは積極的に防御することが必要である。
新生児の免疫系は可塑的であるが、妊娠中の胎児の発達と、胎児環境の著しい急変、新しい抗原や腸内細菌とその生成物への膨大な曝露のために、高い耐性を持つ。このような自然免疫系の「静止モード」は、自然免疫系の細胞を通じて効果的に実行される、初期生命の多層的なプロセスのすべての要件を満たすための高度に制御されたプロセスの一部である。
新生児期の自然免疫細胞(好中球や単球など)の多くは、成人期に比べて活性が低く、存在頻度も低い。一方、自然免疫の異なる細胞成分である自然リンパ球(ILC)は、乳児期に後期や成人に比べて高い活性と存在を示すことから、ILCが生涯を通じて特定の状況に対する感受性を変化させる役割を果たすことが示唆される。
本総説では、新生児期の免疫系におけるILCの特性と状態に焦点を当てるとともに、防衛の5つの中核的な作戦要素である5つのD、検出、識別、展開、破壊、解除のすべてについて、特に新生児期と乳児期の自然免疫、母親のサポート、影響に焦点を当て、既知の生物学的対応物を提供し、免疫系との大きな類似点から、国防という観点からも類推するものである。
キーワード:自然免疫、自然リンパ球、新生児免疫、ミルク、マイクロバイオーム
はじめに
新生児はダイナミックに成長する生命体であり、様々な感染症や非感染症に対して脆弱である(1, 2)。このように感受性が高まっているため、適切な識別がなされれば、瞬時に対応し、その力を発揮できるよう準備された警戒部隊を持つ、完全装備の免疫系が必要である。
しかし、新生児の免疫系は発展途上の構造であり、複雑な段階的進化を遂げる(1-4)。乳児期の免疫システムは、まさに精巧なシステムであり、子宮内という友好的な環境から出る一方で、微生物にまみれた敵対的な外界に入り込んでいくからである。
多くの点で、我々が生まれながらにして持っている免疫系は、妊娠中の免疫環境の産物である(1, 4)。免疫系は、妊娠中に絶え間なく改善されながら、一塊り一塊り、一日一日、鍛え上げられていくものなのである。母体の免疫系は、すべての抗原に反応する一方で、胎児がハプロミスマッチ、つまり半同質性(抗原の半分が父方のもので、したがって異物由来)であっても、胎児に寛容でなければならない。
胎児の立場からすると、その免疫系は、自己抗原や母体抗原、さらには未知の将来の常在微生物に対して寛容でありながら、将来の全く未知の病原体を標的とする能力を身につけなければならない(図(Figure1).1)。この結果、妊娠中に免疫調節が行われ、初期生体にまで及んでいる。
当初、新生児免疫の寛容な状態は、乳児期の免疫成分内の未熟さと記憶の欠如に起因するとされていた。この免疫の未熟さの前提は、新生児免疫の免疫逃避的な特性という概念に取って代わられた(1, 5)。しかし、最近の発見に照らし合わせると、乳児期の免疫とは実際には高度に制御された、しかし知性的で、機能的で、ダイナミックな、有能な分子および細胞構成要素のネットワークであるという概念を支持する証拠が増えてきている。
新生児期の免疫系が多くの刺激物に柔軟に反応することを考えると、乳児期の免疫系は未熟というよりむしろ警戒体制が確立されているという考え方を採用するのは、驚くほど簡単なことだ。この覚醒した免疫系は、未熟な、あるいは逸脱した反応を高度に成熟した反応へと促進することによって、成長し発達する乳幼児を病的状態(例えば、炎症状態)から保護し、感染に対して十分かつ適切な防御を行う上で極めて重要な役割を担っている。したがって、新生児免疫のすべての構成要素とそのメカニズムについて探求し、同定し、理解することは、乳幼児医療の推進や新生児疾患の治療のためにますます必要かつ重要となってきている。
図1 新生児自然免疫に影響を与える主な要因の概念図
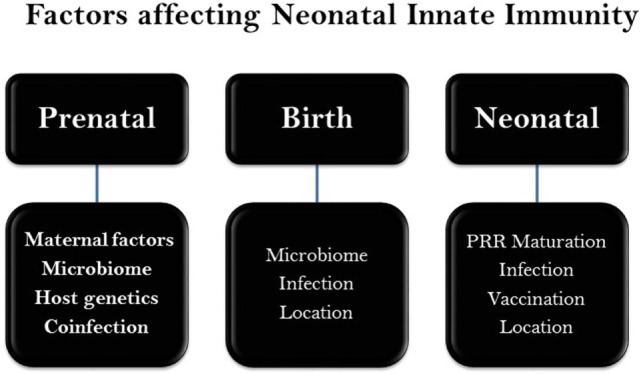
新生児の発達には、妊娠中(prenatal)だけでなく、周産期(perinatal)、新生児期においても、様々な遺伝的、エピジェネティックな要因が影響すると考えられる。要因の間には、もしかしたら重複するレベルもあるかもしれない。
本総説では、新生児と乳児の自然免疫に焦点を当て、特に2010年に発見された組織常在の非BCRおよび非TCR発現リンパ系細胞である自然リンパ系細胞(ILCs)に焦点を当てることにする。ILCの命名法はT細胞のそれと似ており、細胞傷害性細胞とヘルパー様細胞の2つのグループに分けられる。
細胞傷害性T細胞に匹敵するものはナチュラルキラー細胞(NK細胞)、ヘルパー的なものはサイトカイン分泌や転写因子プロファイルからILC1s、ILC2s、ILC3sという3つのサブグループに代表される。ILCは胎生期に出現し、プログラムされていることが注目される(6-9)。
したがって、周産期において乳児の免疫系が発達している間、ILCは、無菌の子宮内環境から複雑な外界への移行に迅速に対応するためのメカニズムおよび機能的ツールを提供し、活発な宿主反応によって排除すべき微生物と許容すべきものを区別して、新生児を守る重要な役割を果たしていると考えることはもっともであろう。
さらに、新生児・乳児が直面する問題を整理し、軍事的なドクトリンに基づいた理論的な解決策を提案する。その目的は、新生児自然免疫のメカニズムレベルでの実用的で深い理解と、必要に応じて戦争と並行させながら、免疫の発生過程を垣間見ることだ。
新生児免疫システムの現状
自然免疫応答は宿主防御の第一線である。胚と新生児は共に複雑な免疫学的条件に直面しているが、しかし、それぞれの段階には固有の明確な要件がある(1, 3, 10)。胎児期には、宿主である母体に対するあらゆる反応に対して、抗炎症反応を高める必要があるが、無菌の子宮内環境から敵対的で多様な外来抗原の世界へ移行する間に、強固な免疫バランスを確立することが新生児の生存にとって非常に重要である(3, 4)。
そのため、新生児免疫は、沈黙の、傍観者の、未熟な配置ではなく、「警戒複合システム」であり、異なる条件に対して迅速だが賢い、選択的な反応を引き出す能力を持っているのである。この免疫反応の多様性は、新生児白血球(例えば、好中球、単球、NK細胞)の機能低下によってよく特徴付けられる。
胎盤のメディエーター(例えば、プロゲステロンやプロスタグランジン)により、胎児期にはTh2型の反応が促進され、それは周産期まで続く(1, 3-5)。実際、いくつかの報告では、胎生期からあらかじめ決定されたこのTh2傾向のために、乳児期の白血球が炎症機能を持たず、免疫不耐性や感染症に対する制御能力が低くなっている可能性が指摘されている。
細胞レベルでは(図2)、好中球の頻度は出生直前に一過性に増加するが、新生児好中球は数が少なく、質も機能も低調であることが示されている。新生児好中球は、好中球細胞外トラップ(NET)を形成することができず、細菌を効果的に殺傷する能力に影響を及ぼしている。
また、新生児好中球は接着分子(L-セレクチン:CD62L、インテグリン:MAC-1など)の発現量が低下し、内皮への結合に影響を及ぼしている。TLR2やTLR4などのTLRの発現低下、貪食、好中球バースト、細胞内感染物質の分解能力の低下など、好中球の免疫生理学的な重要機能の低下も新生児好中球の特徴である。
好中球と同じシナリオは、新生児抗原提示細胞(APC)にも当てはまる。基本的に、マクロファージや樹状細胞(単球)を含む新生児APCは、MHC-IIの発現が低下しており、その結果、機能が不完全になり、不活性化する可能性がある。さらに、新生児APCは、CD80/CD86などの共刺激分子やTLRの発現が低下している(1-5)。
まとめると、新生児の単球(DCおよびマクロファージ)は、MHC-IIの減少、共刺激分子/接着分子の低下、従来のDCに対する形質細胞DCの高い比率、化学走性の低下、血管外遊出の減少、内皮に沿った移動によって、Th2型応答への傾向を示し、その後、炎症反応の低下によって、新生児が感染因子に対して脆弱になる可能性がある。
図2 新生児期における主要な免疫細胞の状態
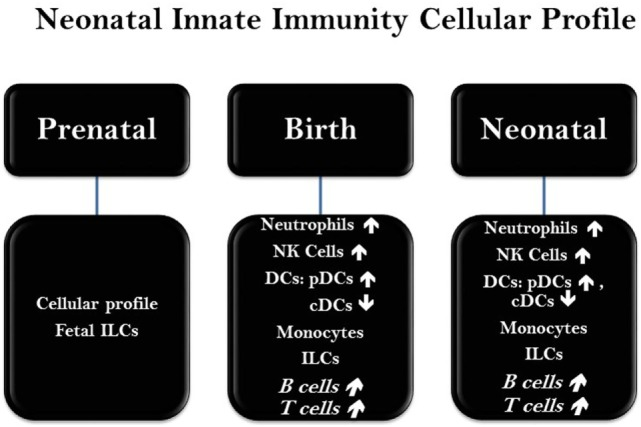
新生児における免疫細胞の存在、頻度、機能は、慢性的に変化しており、生後早期の遺伝的、エピジェネティックな要因に基づくものである。
略語 NK細胞、ナチュラルキラー細胞;DC、樹状細胞;cDC、従来の樹状細胞;pDC、形質細胞様樹状細胞;ILC、自然リンパ系細胞
補体系は、自然免疫のもう一つの重要な構成要素である。新生児の補体系は発達途上であり、その能力を十分に発揮していない。新生児では、C1q、C4、C3、プロペラルディン、B因子などの補体カスケードの主要成分が減少しており、感染症やその他の病的状態にかかりやすくなっている(1, 3)。
* *
ナチュラルキラー細胞は、CD3を欠き、CD56とNKp46を発現するリンパ系細胞であり、ウイルス感染や腫瘍に対する自然免疫系の一部である。妊娠の初期には、NK細胞は高度に制御され、標的細胞に対する反応性が非常に低く、胎児の発育を保護する役割を担っている(11, 12)。
その後、妊娠期間を通じて、NKの細胞溶解機能は初期に比べて増加する。出生時には、NK細胞は高い頻度で提示されるが、毒性は低くなっている。しかし、活性化に対する閾値は低く、抗ウイルス作用がある。新生児期を通じて、また出生後の数日間でさえ、NKの頻度は減少し、5歳までに成体レベルに達する(3, 12)。
重要なことは、NK細胞の受容体の発現が、自己免疫疾患や炎症性疾患に対する宿主の感受性に極めて重要な役割を担っていることだ。NK細胞の受容体(例えば、LY49およびNKG2A)の発現は、個体発生および生涯を通じて高度に制御されていることが報告されている(13)。ヒトと動物の両方の研究から、刺激性受容体と抑制性受容体の間のバランスが、NK細胞の感受性、機能、相互作用、および活性化に中心的な役割を果たすことが示されている(13, 14)。
* *
最も重要なことは、新しい分類のもとで、NK細胞は、ILC1、ILC2、ILC3、およびリンパ組織誘導細胞(LTi)を含むILCとして分類されることだ。NK細胞もILC1もインターフェロンγ(IFN-γ)や腫瘍壊死因子(TNF)を産生するが、NK細胞はILC1や他のすべてのILCと異なり、細胞溶解能を持つ。また、NK細胞は、NKG2D、Ly49またはKIR、CD94-NKG2ヘテロダイマー、自然細胞傷害性受容体などの様々な活性化および抑制性受容体と、共刺激性受容体を発現している(1、3、13)。
* *
胚発生段階を通じて腸組織やリンパ系の形成に関与していることから、ILCが胚発生において基本的な機能を担っていることは明らかである。特に、環境シグナルに迅速に反応し、感染を防ぎ、組織の恒常性を維持する能力を考慮すると、その重要な役割は、出生後、新生児期までさらに拡大されることになる。これらのことは、ILCsの詳細な研究だけでなく、新生児疾患の治療法としてILCsを標的とする可能性を検証する強い根拠を与えている。
自然免疫系リンパ球
自然免疫系リンパ球は、2010年に発表された3つの重要な論文で、炎症反応と抗炎症反応の両方を媒介する新しいクラスの系統陰性(Lin-)リンパ球に属している(6、7、15-17)。Lin- (Lineage negative)でありながら、CD25, CD127, IL-2 R-β, IL-7 R-αを発現している。
特異的な抗原ではなく、病原体の保存された共通の構成要素を標的としているため、メモリー細胞からの組み換えや拡張を必要としない。ILCは、全身の様々な組織に存在することが特定されている。彼らは、ごく初期の胚の段階から生涯を通じて、組織の微小環境、構造、組成、回復の発達に関与している(7, 18-20)。
真のセンチネルと同様に、ILCは数分から数時間という速さで反応する。多くのILCは細胞毒性を持たず、むしろオートおよびパラクライン様式で非常に生理活性の高いメディエーターを放出する。ILCは、そのトランスクリプトームとサイトカインプロファイルから、5つのサブタイプが存在する。
ILC1は、転写因子T-betを発現し、刺激されるとTNFαとIFNγを放出する。CD127レベルに基づいて、グループ1 ILCには、IL-12、IL-18、IL-15で刺激されるとTNFα、IFNγの両方を産生するCD127-と、IL-12とIL-18に反応してIFN-γのみを産生しIL-15には反応しないCD127+の2つのサブタイプがある。
NK細胞は、細胞毒性を有し、パーフォリンとグランザイムを産生することを除いて、サイトカインプロファイルにおいてCD127- ILC1と非常に類似している。ILC2はGATA-3を発現し、2型サイトカインを産生する。IL-4、IL-5、IL-9、IL-13、そしてEGFのホモログであるamphiregulinを産生する。
ILC2は、T細胞非依存的にB細胞を助け、創傷治癒や組織のホメオスタシスに重要であるという点でTh2と類似している。これらの機能のため、グループ2 ILCは蠕虫感染に対する防御において特に適応的である。ILC3はRORγtを発現し、CCR6+であればIL-17AやGM-CSFを産生する。
このサブタイプのILC3は、リンパ組織誘導能(LTi)を持つ。CCR-であれば、ILC3はさらに分化して自然細胞傷害性受容体(NCR)を発現し、TNFα、GM-CSF、IFNγに加え、IL-22を産生するようになる。IL-17とIL-22を作る能力があるため、グループ3のILCは、それぞれILC17とILC22と呼ばれるものである。
* *
新生児の腸は無菌状態であり、自らの微生物叢を培養しなければならないため、ILCは腸内細菌叢と適応免疫の共進化の鍵を握っている(7)。自然免疫系と適応免疫系の交差点に位置するILCは、炎症、免疫、創傷治癒、組織の恒常性の調整において中心的な役割を担っており、代謝から腫瘍防御、肥満まで幅広い影響を及ぼしている(21)。
ILCは、マクロファージや古典的な適応免疫細胞との密接な相互作用を通じて、これらの多様な任務を遂行している。T細胞やB細胞との密接な相互作用によって、これらの多様な役割を果たす。このような機能的な要求と能力から、母体のILCは新生児を助けるのに理想的であると考えられる。
この推測を裏付けるように、ごく最近、ヒトの母乳中にILCが存在することが報告された(22)。我々は、ヒト乳児の口腔上皮におけるILCの存在を調査し、ILC2が優勢であることを発見した(23)。これらの細胞はGTAT-3+であり、2型Tヘルパー細胞と同様のインターロイキンを産生し、細胞外細菌病原体に対する防御に重要であることが知られている。
また、ILC2は、マウスの新生児期のウイルス感染(ライノウイルスなど)でIL-13を発現し、粘液分泌過多を引き起こし、気道反応性を促進することにより、喘息の発症に寄与していることが報告されている。したがって、ILC2が喘息などの新生児呼吸器疾患の治療標的として考えられているのはもっともなことである(24, 25)。
さらに、ILC2sは、IL-33依存的な機序により、極めて早い時期に喘息を促進することが報告されている。これは主に、周産期から生後にかけて、ILC2や肥満細胞、好塩基球、好酸球が肺に集積することに起因していると考えられている。したがって、喘息の発症、進行、治療における免疫療法のターゲットとしてIL-33軸の可能性を探ることはもっともなことである(26-28)。
* *
また、新生児期のILC、おそらくILC3がリンパ球減少症による増殖(LIP)を防ぐ可能性があることも報告されている(29)。LIPは、T細胞の活性化、記憶分化、組織破壊、TCRの多様性の喪失を伴う病態である。新生児マウスにおけるT細胞のホメオスタシスは、成体とは根本的に異なるメカニズムで制御されていることが強く示唆されている。
そこで、IL-7R依存性のILCが、成体マウスではなく新生児マウスのCD8+T細胞のLIPを阻害することが示された。このILCによるLIPの阻害は、リンパ球減少症の新生児において多様なナイーブT細胞プールの生成を保証し、その後のT細胞のホメオスタシスと免疫学的自己寛容の維持に必要である。さらに、新生児のILCは年齢に応じて抑制機能を失っていくという仮説を検証することは妥当であり、より包括的な研究が必要である。
* *
さらに、IL-23を介したILC3の新規な役割が報告されており、新生児腸管炎症の治療においてILC3がバイオセラピーの役割を果たすと考えられる。したがって、いかなる介入(例えば、抗生物質治療)も常在菌叢の変化を引き起こし、肛門に位置するILC3誘導透過性増加領域を通して細菌または細菌産物の侵入を増加させる可能性がある(30)。
このような状態は、制御不能な細菌増殖、サイトカインストーム、および死につながる可能性がある。ILCは、通常のリンパ球のような特異的抗原受容体の再配列を必要としないため、その応答はより迅速で、通常は数分以内に行われる。この見張り機能は、皮膚や航空消化管内部のような微生物との接触が激しい境界付近に存在することでさらに強化されている(図(Figure3)3)。
粘膜や皮膚のバリアは、病原性微生物と常在菌の両方に遭遇する。母乳中に存在する母体ILCは、病原性微生物に対する防御、口腔および腸内マイクロバイオームの形成、未熟な粘膜境界の完全性の維持、新生児免疫系の成熟の調節という4つの重要な機能を乳児に対して果たしている可能性がある。
さらに、母体の観点からは、授乳中の母親は乳房の微生物感染を防がなければならない。母乳育児の早期中断の3分の1は乳房炎が原因である。乳白血球は、このような保護機能を十分に果たしていると考えられる(31)。これらの白血球は乳児のMHCとハプロミスマッチしている。
この白血球がどのようにして拒絶反応を回避しているのか、また細胞傷害性T細胞が乳白血球全体の3%を占めるという移植片対宿主攻撃を乳児がどのようにして回避しているのかは、最も興味深く、ほとんど不明である。
さらに、ミルクが乳児の腸内細菌叢をどのように形成するか、また、乳児のT細胞やB細胞のレパートリーの発達を理解することは臨床的に重要である。さらに、ILCが他の自然免疫系白血球(例えば好中球)を含むかどうかについては、さらなる研究の余地がある。
図3 乳腺における免疫成分の存在
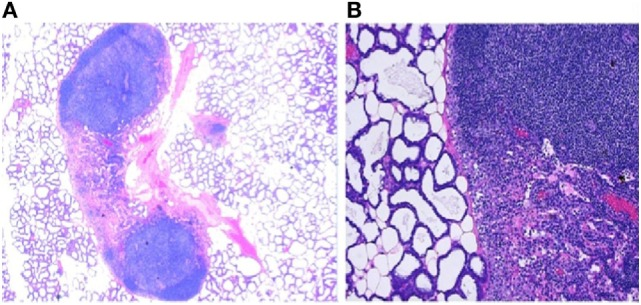
(A)授乳中のマウス(C57BL/6)乳腺の低倍率顕微鏡写真で、肺胞に並置されたリンパ球の集合体を示す。これらの二次リンパ組織(SLT)は、リンパ球の「ベースキャンプ」であり、さらなる分化とサイトカイン産生や細胞傷害性などの機能獲得が行われる。
SLTが乳腺に戦略的に位置することで、リンパ球は授乳中の乳房を守るとともに、ミルクを通じて乳児に展開する。B)授乳中のマウス乳腺組織の高倍率、HおよびE染色。求心性および排水性のリンパ管、毛細管、および濾胞形成に、立方体の歯槽乳腺細胞からなる活発な秘書ユニットの近くに異種小リンパ球が密に詰まっていることが示されている。
これは、何万人もの新兵が訓練を受けている軍事基地の航空写真で、出入りの道路が物資を運び込み、廃棄物を除去しているのと変わらない
乳汁によるメディエーターと細胞の移動:ヒト乳汁中のILCの位置づけ
新生児学者と免疫学者は現在、乳をダイナミックな生体液とみなしており、乳児の要求の変化に合わせて変化させることができる(32)と考えている。ヒトの母乳には、炭水化物から脂質、タンパク質まで少なくとも32の非細胞生物活性要素、そして5種類の細胞が含まれている(33)。
新鮮な未殺菌のヒトおよび動物性ミルク中の細胞の存在は、1960年代後半から特徴づけられており、好中球、マクロファージ、リンパ球、幹細胞、上皮細胞、微生物が含まれている。新生児は1日に推定108個の母体細胞を摂取するが、その80%はマクロファージで、母体の末梢血単球に由来し、おそらく胃腸由来である(34)。
これらの細胞の90%以上が生存している。母親または赤ちゃんの局所的または全身的な感染症があると、この母親の細胞移転は急速に増加し、1日当たり109個を超える。これらの生物活性分子および細胞性ミルク成分は、新生児免疫系の発達と成熟を調節しながら、乳房を感染から守っている(35)。
乳汁中の非細胞性因子の中には、抗菌作用を持つものが多くある。例えば、ラクトフェリンが消化されてできるラクトフェリンBは、グラム陽性菌とグラム陰性菌の両方に対して強力な作用がある。リゾチームとラクトアルブミンが同じようなアミノ酸配列を持つことは、牛乳が抗生物質であるという概念をさらに裏付けるものである(36)。
* *
これらの細胞および生化学的メディエーターは、共に乳児の腸内細菌叢を培養し形成している。内腔粘膜層は特に重要な相互関係を持っており、上皮バリアと内腔マイクロバイオータに影響を与え、また影響を受けている(33)。母乳には、プレバイオティクス(オリゴ糖)と、乳児の腸内コロニー形成に重要な微生物が含まれており、乳児が母乳の栄養成分を消化するのを助けている。
* *
自然免疫系細胞は、適応免疫と自然免疫の間の重要な交差点を占め、脆弱な地域に送り込まれたエリート外国人部隊のように機能して防御力を高め、安全で持続可能な地域環境を確立する(図(図4).4)。ヒトミルクのILCは、新生児免疫を調節することで、乳児や土地の腸内細菌叢を形成している可能性がある。
母親のILCがどのように乳児のILC集団を調節するのかも、まだほとんど分かっていない。新生児の未熟な免疫系は、無菌の子宮内環境から微生物だらけの外界への移行に迅速に対応し、耐えるべきものと、活発な宿主反応によって排除する必要のある微生物とを区別しなければならない。
さらに、授乳中の母親は、乳房への微生物感染を防御しなければならないが、乳汁中の白血球はそのような防御を行う(22)。ミルクILCは、新生児に自然免疫を付与する可能性がある。次のステップは、それらがどのように新生児の免疫とマイクロバイオームを形成するかを調べることだ。
母乳を介した母体細胞の経口移行は明らかに起こっており、これらの細胞(ILCや他の白血球など)は胃のpHを乗り越えて新生児の腸内に6日間も生息する(22)。しかし、乳腺がどのように乳児のマイクロバイオームの変化を感知し、反応するのかは、今のところほとんど不明なままである。
図4 乳幼児および新生児における自然免疫と獲得免疫の構成要素
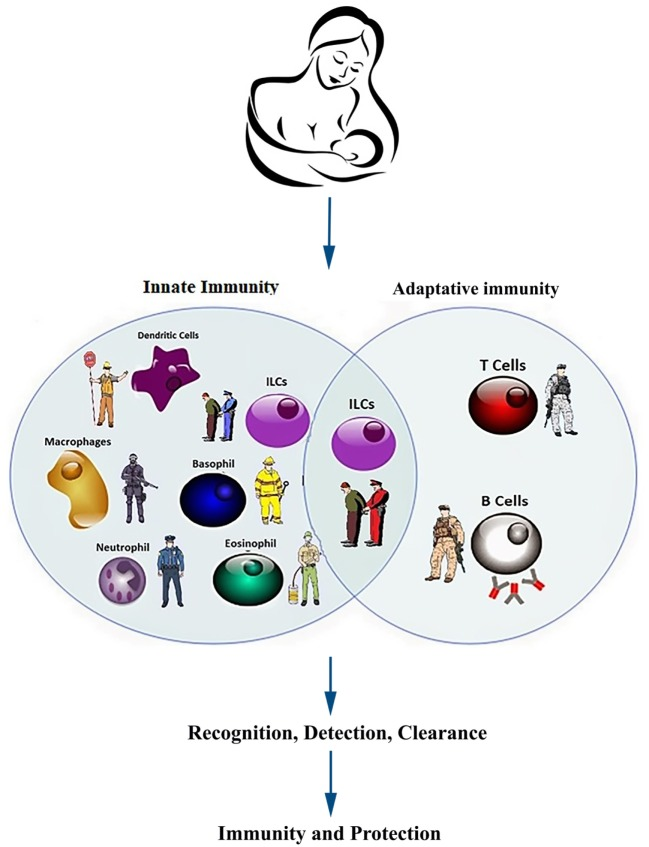
ヒューリスティックに考えると、免疫系は、軍隊や警察が国の安全を守るのと同じように、新生児や乳児を感染症から守っているのである。若い免疫系は、いくつかの外来抗原(病原体)や、まれに異常な自己抗原(腫瘍細胞や自己反応性細胞)に反応するように、また、他の外来抗原(常在微生物)や正常な自己抗原を受け入れるように、de novoで発達しなければならない。
自然免疫系と養子免疫系の複数の構成要素が協力して、堅牢性を確保するために多重の冗長性をもって上記の仕事をこなしている。病原体に対する積極的な防御は、軍隊における多くの共同作戦のように、軍隊の異なる部門からの複数のユニットの協調を必要とする。自然免疫は反応が早い(数秒から数分)が、作用時間は短い(3〜5日)。
一方、適応免疫は、活性化に時間がかかる(4~7日)が、反応はより特異的で持続的(数週間~数年)である
新生児腸内細菌と免疫系
一次リンパ系集合体は、子宮内でリーベルキューンのクリプトの奥深くに形成される。小腸粘膜関連リンパ組織のこれらの初期細胞は、VCAM-1を発現し、CD127+/CD4+である。LTiに属し、ROR-γt+ ILC3との類似性を有する。
胸腺から放出されるリンパポエチンに応答して、LTi細胞は組織化中心を形成し、まもなくCXCL13+線維芽細胞間質細胞とCD11c+細胞の出現が見られる。出生時には、おそらく転写因子ROR-γtの産物により、CD4+およびCD8+T細胞がパイエル板を支配し、CD8+細胞の方が4対1で上回っているが、どちらも抗原性挑戦の経験はない。
母乳白血球は80%が骨髄性、20%がリンパ性で、末梢血白血球に近い比率であり、新生児の粘膜リンパ組織に寄与している。興味深いことに、母乳リンパ球の起源は母体のパイエル板である。乳児パイエル板では、母体由来の細胞のほとんどがCD8+リンパ球であり、腸管ホーミングで知られるCCR9とα4β7インテグリンを発現している。比較的ナイーブな乳児のCD8+ Tリンパ球に比べ、母体由来のCD8+ T細胞をホルボールエステルやアイオノマイシンで刺激すると、TNFα、IFNγ、IL-18を2〜4倍多く産生する(37)。
* *
出生時、新生児の腸は突然、栄養と防御という2つの新しい仕事をするようになる。前者は栄養素の消化・吸収、後者は微生物との出会いのたびに5つのDを行うもので、どちらも生存に欠かせないものである。母親の腸内細菌叢には450種が含まれるが、乳児にははるかに少ない。
経膣分娩された新生児の腸内細菌叢に見られる187種の特異的操作分類単位(OTU)の72%は、母親のOTUと同じである。訓練され経験豊富な」T細胞やB細胞が存在せず、粘膜バリアーが弱く、微生物がほとんど生息していない内腔では、新生児の免疫系は、病原性微生物と常在菌を区別する必要がある。
消化管は、消化吸収の役割を果たしながら、病原体の猛攻にさらされている(38)。ほとんどの乳幼児にとって、消化管はこれらの機能を効率的かつ安全に遂行している。約5%の確率で、特に出生体重が少ない場合、名目上の手術が失敗し、致命的な状態になりうる壊死性腸炎(NEC)を発症する(39)。
母乳がなければ、粉ミルクで育った乳児は母乳を受けた乳児に比べて死亡率がはるかに高くなる。生後2週間の母乳摂取量が100mL/kg増加するごとに、死亡リスクが0.87減少する(40)。母乳に含まれる200以上の糖鎖が特定の微生物と結合できること、そしてラクトフェリンが多く含まれていることが、この大きな死亡率減少に寄与している。
NECの腸管傷害の一部は、戦争で破壊された街のように炎症によるものである。高いTGFβレベルとIL-10は、炎症を抑制することでチェックとバランスを与え、同時に母体のリンパ球の乳児宿主への一過性の耐性と乳児宿主の母体細胞への耐性を提供するのかもしれない。
* *
腸内細菌叢の獲得
乳児の腸内細菌叢は、宿主の遺伝(41)から離乳期の食事(42)まで、多くの要因によって形成される。母親の微生物に最も早く触れるのは子宮内である(38)。微生物は羊水、臍帯、胎盤、そして健康な正期産児のメコニウムから検出されている(43-46)。
腸内細菌叢の獲得について調べたある研究では、妊娠中のマウスに遺伝子標識した微生物を経口接種した。これらのマウスの仔マウスは、分娩予知日の1日前に帝王切開で入手され、標識株はこれらの仔マウスの糞便から分離・同定され、胎内における腸内微生物の垂直伝播を示唆している(47)。
分娩のプロセスは、乳児にとって次に重要な微生物への曝露となる。経膣分娩で生まれた乳児は、母親の膣内微生物群集に近い腸内微生物群集を持つが、帝王切開で生まれた乳児は、皮膚細菌叢に近い腸内微生物群集を持つ(48)。出生直後の乳児の食事(母乳、粉ミルク)は、乳児の腸内細菌叢を形成する次の大きな要因である。
母乳には母体の免疫細胞やサイトカインが含まれるほか、オリゴ糖とその代謝に必要な微生物が含まれており、乳児の腸の健康な発達に最適な接種物となっている(32, 49, 50)。健康な母子107組を対象に、母親の乳輪皮膚および乳汁叢と乳児の腸内細菌叢を比較した臨床研究により、新生児の腸内細菌は母親由来のものであることが明確に示された。
生後1カ月間の新生児腸内細菌叢は、ミルクが27.7%、皮膚絨毛が10.4%を占め、皮膚絨毛は新生児腸内細菌叢を構成していることがわかった。母親はそれぞれ固有の皮膚濾胞とミルク濾胞を持ち、これらの微生物群集は赤ちゃんの腸内細菌叢と用量依存的に相関していることがわかった。
メタゲノム機能解析の結果、母親の細菌叢は炭水化物、アミノ酸、エネルギー代謝に大きな影響を与えることが予想された。このような母親の影響は、固形食を導入した後でも続いていた(32)。
* *
このような早期の微生物への曝露は、乳児の健康や免疫発達に長期的な影響を及ぼす可能性がある。無菌マウスとして知られるグノトビオティックマウスは、パイエル板や腸間膜リンパ節の未発達、抗体産生の欠損、リンパ濾胞の成熟障害など、免疫系の異常発達を示す(51)。
これらの欠損は、腸内細菌叢が正常な免疫の発達に重要な役割を果たすことを示している。また、帝王切開で生まれた乳児の免疫介在性疾患のリスク上昇など、乳児の出産形態およびそれぞれの形態で獲得した関連する微生物群も、長期的な健康影響に関連している(52)。このことは、乳児の健全な免疫発達には、微生物の存在と微生物組成の両方が不可欠であることを示している。
* *
また、特定の菌株や微生物の組み合わせは、宿主の抗炎症性サイトカイン(IL-10)産生の増加やTGFβ発現T細胞の増加にも関連しており、ここでも腸内細菌と宿主免疫系の間で重要な相互作用が起こっていることが示されている(53)。
* *
ILCと微生物叢の間のクロストークは、ILCが恒常性の確立と維持だけでなく、感染に対する初期の抵抗性においても重要な役割を担っていることを実証している。前骨髄球性白血病ジンクフィンガー(PLZF)は、ILCが常在菌に応答し、微生物叢の組成や量を調節するための機構的転写因子の一つであることが示唆されている(54)。
このような細胞・分子的なアプローチを用いて、ヒトの造血細胞におけるPLZFの調節の可能性を(ex vivoモデルやヒト化マウスなどで)検証することは、恒常性の再構築や維持におけるトランスレーショナルな治療方法として想定される。
自然免疫、軍隊の内部 | 軍事的な防衛システムとの類似性
新生児はダイナミックであり、故チャールズ・A・ジェインウェイ・ジュニアが約30年前に正しく提唱したように、微生物抗原を効果的に検出するためには、3つの本質的な特性を備えている必要がある。第一に、侵入者は宿主の抗原とは異なるいくつかの抗原を持ち、自己との区別が可能であること。
第二に、これらの非宿主抗原の一部には保存性があるため、特定の個体識別が不要であり、必要な監視の規模を縮小し、検出効率を向上させることができる。第三に、これらの保存された共通抗原は、侵入者にとって必須であり、侵入者が変異してそれを取り除くことができないからである(55)。
ここから、パターン認識分子と病原体関連分子パターン(PAMP)の概念が発展した。病原体関連抗原と結合する受容体は大きく拡大し、現在では3つの機能グループに分けられた8つの主要なクラスがある。TLR、NLR、RLRは最初のグループを構成し、炎症とアポトーシスを媒介する。
TLR(TOLL様受容体)は進化的に保存された受容体で、細胞表面に存在するもの(TLR1、2、4、6)と、エンドリソゾーム内に存在するもの(TLR3、7、8、9)があり、侵入者の特定の標的部位に作用すると、敵対する物質に対する迅速かつエスカレートした自然免疫防御を誘導する。
このグループの他の2つのメンバーは、ヌクレオチド結合オリゴマー化ドメイン様受容体(NLR)およびRIG-I様受容体(RLR)である。パターン認識受容体の第2グループには、ペントラキシン、コレクチン、フィコリンが含まれる。これらはオプソニン化および補体の活性化を媒介する。
第3のグループはC型レクチンとスカベンジャー受容体で、これらは食作用を媒介する。これらのレセプターは共にインテリジェンスな監視ネットワークを形成し、危険な侵入者がいないかどうか、常に内部および内部領域をパトロールしている。いったん微生物の存在を検出すると、炎症反応と免疫反応をアップレギュレートする複数のフィードフォワードサイクルが存在する。
最初の、迅速な反応は、自然免疫系の責任である。より特異的で持続的な、しかしゆっくりとした反応は、適応免疫系によるものである。
* *
自然免疫系は、パターン認識受容体を通じて適切な識別がなされ、攻撃の指令が出されると、即座に戦力を投入できるように準備された警戒部隊である(TLR結合の下流のシグナルはMyD88とTRIFである)。TLRはヒトで10個、マウスで11個存在する。
この反応の速さは、TLRがレディメイドで安定的にコード化されており、遺伝子の体細胞組み換えや、新しい受容体を作り出すための転写や翻訳を必要としないことも一因となっている。適応免疫では、事前に抗原にさらされ、記憶細胞を形成することによって、T細胞やB細胞の教育を行う必要がある。初期反応は遅いが、これらの伝統的なリンパ球は超可変性組換えにより特異的な受容体を持ち、いったん拡大されると極めて有効な抗体と細胞傷害性T細胞を産生する。
* *
常に存在する微生物侵入の脅威に対する生物による防御は、まさに敵対的侵略者に対する国防と同じである。一人の兵士、あるいは戦闘機から師団、空母戦闘群に至るまで、規模を超えた軍隊による防衛の段階を表す5つのDがある:検出、識別、展開、破壊、解除(図(Figure 5).5)。
この5つのDは、あらゆる免疫系が直面し、遂行する同じタスクである。この5つの段階はそれぞれ、精巧で、複雑で、非常に効果的な生物学的同等物を持っている。妊娠中は、これらのタスクがかなり複雑になる。免疫系は、自己免疫を使わずに自らを守るために、しばしば初めて5つのDを使わなければならない。
さらに、5つのDが完全に発達していないだけでなく、分娩の正確な時期が不明であることも、困難を倍加させている。新生児は抗原提示がうまくできない。TLRが認識できる微生物成分と結合したとき、彼らは同じように強固な反応を示すことはない。
新生児の適応免疫には、識別や特異的免疫に必要な記憶やレパートリーを構築する時間がない。抗原提示の減少に伴い、CD28レベルが低いため、共刺激は弱い。成体が展開する骨髄系細胞防御の最前線である好中球の動員も容易ではなく、微生物侵入場所に存在する好中球は、微生物の貪食や細胞内殺菌の能力も低い。
おそらく、新生児において「良い」唯一のDは、脱スケール:Th1とTh2の比率が低く、FoxP3とTh17の比率が高い非対称な極性化による炎症の抑制であろう。新生児のIL-10レベルは成人の10倍から30倍であり、免疫調節TGFβのレベルも同様である。
図5 自然免疫、それは内部の軍隊

(A)ジェット戦闘機は、接近してくる空や海の船を探知し、敵か味方かを識別し、敵を破壊できる兵器システムを展開し、その後停止しなければならない。敵味方の見間違いは自軍に損害を与えるが、敵の探知や判別に失敗すると侵略者に部隊を破壊される。左翼端のランチャーに搭載された赤外線誘導式AIM-9サイドワインダーミサイルは、遠距離から放出され、標的を追跡して破壊することができる、という抗体と似た性質を持つ(Marian R. Lambert-Yu氏撮影、2016)。
(B)2種類のサイズの金粒子でサイトカインプロファイルを標識した自然リンパ系細胞(ILC)の透過型免疫電子顕微鏡写真。この細胞は、微小環境における病原体の存在を感知し、侵入者に応じて適切なサイトカインを放出することができる、重要な細胞である。マクロファージ、好中球、NK細胞などの自然免疫細胞は、戦闘機と同じように、検出、識別、展開、破壊、脱戦闘機といったタスクを担っている。このILCの「ペイロード」と呼ばれる免疫金球には、腫瘍壊死因子α、INFγ、IL-5、IL-13、IL-17、IL-22など、F-16が搭載するサイドワインダーやスパローミサイルに匹敵するものが多く含まれている。違いは、ILCには「パイロット」がおらず、兵器は自分で作り、その行動は完全にルールベースであることだ
このように免疫状態を抑制する理由の一つは、適応免疫を獲得し構築する重要な発達段階において、一市民が他の市民を攻撃しないように、また国防のための軍隊が自国の民間人を攻撃しないように、自己反応が起きないことを保証するためである。
不正な軍隊が自国民への攻撃を開始した場合、中央政府は、国がそれを迅速に抑制、抑制、あるいはよりよく防止するための十分な政策、手続き、能力を持つことを保証するために、多大な努力をすることになるし、そうしなければならない。
このような自己寛容は、主に胸腺教育の結果であり、自己反応性Tリンパ球は、MHC制限のある方法でアポトーシスを受ける。自然免疫もまた特異性を持っていなければならないが、そのメカニズムは全く異なる。自然免疫細胞に対する胸腺の選択はない。
正常な組織のターンオーバーの間に、死んだ細胞は核酸や他の細胞内内容物を放出する。マクロファージはこの残骸を飲み込み、微生物由来である場合と同様に、エンドソームに留めておく。TNFαの産生は、細菌の核酸がTLR 9と結合したときのみ増加する。マクロファージがどのようにしてこの識別を行うかはまだ不明であるが、文脈依存的であることは確かで、TLR 9の転写制御が関与していると考えられる。
* *
このように、新生児期の防御は、未熟な適応型防御と活発な抑制に直面し、より自然免疫に依存するようになる。このように、自然免疫の後に適応免疫が順次出現するのも、個体発生が系統発生を再現する例である。適応免疫に比べ、自然免疫は非常に初期の真核生物から存在している(56)。
問題の範囲と可能性のある戦略
生物学的プロセスは、生存のための究極の戦争である。戦争では、どのような規模であれ、敵対勢力は非対称性を利用し、自らの戦略的、作戦的、戦術的優位性を拡大する一方で、弱点を最小化しようと努力する。非対称性とトレードオフは不可避かつ動的なものであり、機会が負債に、制約が長所に転じることもある。
非対称性の中には極端なものもあり、新生児の生存にとって極めて重要である。ここでは、サイズ、数、複製時間、適応性、資源消費という5つの主要な非対称性に注目する。新生児のサイズと質量は10-1 m、100.5 kgの範囲であるのに対し、バクテリアの長さと質量は10-6 m、10-13 kgである。
量的には、新生児は1匹だけだが、細菌の数は1012〜1015個である。102W、102J/sのエネルギーを消費する新生児にエネルギーを供給するための物流は、バクテリア1個あたり10-12Wのエネルギーを消費するバクテリアより一桁高い(57)。
新生児は、その内部環境の恒常性を維持するために、資源を供給し、老廃物を排出する効率的な分配フラクタルネットワーク-循環系-を備えている。また、肝や筋肉のグリコーゲンや脂肪組織という形で、エネルギーや物質の蓄えを持っている。
個々の細胞のレベルでは、オートファジーとマイトファジーが、細胞内小器官のリサイクルを通じて、代謝率や必要資源の重要な削減を実現している。細菌はそのサイズが小さいため、複製するのにわずか30分しかかからない。理想的な条件下では、1つの大腸菌が1日で248個、つまり281兆個(2.81×1014)にまで拡大することができる。
また、細菌は非常に適応性が高く、栄養要求量の切り替えや、プラスミドの水平移動によって抗生物質や毒素に対する耐性を獲得することが可能である。その数は、ある閾値を超えると急激に増加する。量には質があり、軍事哲学としてよく受け入れられ(58)、微生物学的に証明された現象である(59)。新生児は複製することができない。
新生児は何十年という単位で世代を重ね、バクテリアの24万倍もの時間をかけて繁殖する。これらの非対称性を考えると、バクテリアは他の微生物とともに、この生存のための永続的な戦争において、新生児よりも大きな優位性を持っていることになる。したがって、ユニセフのデータによれば、2016年でさえ、260万人の赤ちゃんが生後28日間で死亡していることは、それほど驚くべきことではない(60)。
新生児の免疫防御は、何百万、何十億という侵入微生物を破壊することができるが、新鮮な微生物が失われたものと入れ替わり立ち替わり侵入し続ける。1013個の細胞からなる新生児はたった一人であり、当然ながら入れ替わりはない。この10兆個の細胞のうち、一部の細胞は微生物の侵入に対する防御を担う責任と能力を持っている。
この「プロフェッショナル」な防御細胞のうち、あるものは様々な局所組織リンパ節集合体として粘膜や皮質の境界付近に駐屯しているが、他のものは循環している(図(Figure3).3)。これらの局所組織リンパ節は、二次リンパ組織(SLT)と呼ばれ、軍事基地における住居、教育、認証機能と同様に、リンパ球の居住、分化、成熟が行われる「ベースキャンプ」としての重要な機能を担っている。Lin-、CD127+、CD135+の共通リンパ系前駆細胞は、成熟の様々な段階を経て、その機能がより明確になり、多能性が低下していく。
免疫細胞が完全な細胞傷害性を獲得し、IFNγやTNFαのような炎症性サイトカインを産生できるようになるのは、最終成熟のときだけで、新兵が装填したM-16を持てるようになるまで、教室や現場で数週間から数ヶ月の指導と訓練を受けるのとあまり変わりはない。
例えばNK細胞は、Lin-, CD117+ HSCから始まり、成熟したNKG2D+, CD244+CD11b hi Ly49 ± mNKまで5段階の成熟段階を経ている。合計で45の表面マーカーがこの過程を指揮し、各段階でマーカーの数は増加している(61)。
成人の末梢血には5×108個の白血球が循環しているが、乳児の末梢血にはその10分の1の白血球が存在する。骨髄系細胞とリンパ系細胞は、循環白血球を3対1の割合で構成している。これらの細胞、その産物、母体からの移入が新生児防御を構成している(図 4)。
* *
この非対称性を利用して生き残るためには、新生児防御は微小環境を有利に操作する必要がある。そのような利用法は数多く存在するが、ここでは一般的な例をいくつか説明する。新生児には物質とエネルギーの蓄えがあるが、細菌にはないため、必須栄養素や遷移金属イオンなどの微量元素を奪うことは、健全な戦略である。
例えば、バクテリアの亜鉛濃度は非常に重要で、許容範囲は非常に狭い。この範囲外では、バクテリアは生存できない(62)。ラクトフェリンや他のトランスフェリンなどのキレートタンパク質によって、Fe、Mg、Ca、Cu、Znなどの遷移金属のイオンを結合することは、新生児が展開する有効な方法である。
特にラクトフェリンは大きな関心と重要性を持っている。ラクトフェリンは鉄に対して非常に高い親和性を持ち、トランスフェリンの300倍、さらに感染症に伴う低pH条件下ではさらに高い親和性を示す。初乳中のラクトフェリン濃度は、血清濃度が0.4-2 mg/Lであるのに対し、平均7 g/Lと極めて高い(63)。
乳幼児は微生物にとって最適な温度よりも高い温度に耐えることができる。発熱はこのように感染に対する普遍的に展開される防御であり、通常は自然免疫細胞が病原体に遭遇したときに炎症性サイトカイン:IL-6、TNF-α、IFN-γに応答して起こるものである。
しかし、IFN-γのレベルが低いため、新生児超初期における発熱反応はそれほど顕著でない可能性がある(64)。細菌は、たとえ好気性細菌であっても、抗酸化能力は限られている。一方、ミトコンドリア、アスコルビン酸、ビタミンE、グルタチオンなどからなる精巧な抗酸化システムを持つ新生児は、過酸化水素、一酸化窒素、パーオキシンナイトライトを生成する酸化的バーストを起こし耐性を持つことができる。
これらの高度に酸化的な物質は微生物にとって非常に有害である。好中球とマクロファージは、しばしばNADPH依存性の呼吸バーストを通じて、まさにそのようなメカニズムで殺人を行う(65)。
* *
その核心は、速度が戦争の結果を決めるということだ。目標は、相手が再生するよりも早く、相手を破壊することだ。大量生産を行う微生物を破壊するためには、大量破壊が必要である。環境を変えて、温度、酸素分圧、遷移金属イオン濃度などの重要な変数を、細菌にとっては生存可能な範囲外だが宿主にとっては許容できる範囲に移動させれば、微生物の除去速度を繁殖速度より高めることができる。
これが、微小環境を操作することによる宿主防御の本質である。この戦略に組み込まれたのが、自己の保存と非自己の殺害を可能にする5つのDsの弁別のステップである。環境による識別のほかに、細胞レベルでの識別が必要である。この識別のプロセスは複雑かつ重要である。この段階で失敗すると、自己耐性喪失による自己免疫や、抗菌反応不全による劇症感染が引き起こされる。母体からの細胞や物質、そして出生後の微生物の移動は、新生児にとって大きな助けとなる。
健康と病気におけるいくつかの臨床的相関関係
新生児期の免疫系の初期発達と腸内細菌叢の獲得は、個人の将来の健康と疾病に重大かつ長期的な影響を与え、心血管、代謝、腫瘍、神経発達の過程に影響を与える。高血圧、動脈硬化、II型糖尿病、肥満、脂質異常症、セリアック病、乾癬、自閉症スペクトラム、統合失調症、パーキンソン病など、多くの疾患は、自然免疫やマイクロバイオームの異常と関連している。
その正確なメカニズムを解明しようと、多くの熱心な研究が行われてきた(66)。これらの病態の多くが慢性炎症に支えられていることは分かっていても、病気のプロセスを支配している因果関係は依然として不明である。これは、ほとんどの生物学的構造や過程が複雑な適応システム(CAS)であり、慢性炎症もその例外ではないからである。
すべてのCASは、ゆるやかに相互作用する多くの部分を持ち、自己組織化された階層的なシステムを形成している(67)。多くのサブシステムが一緒になって超システムを構成し、多くの超システムが一緒になって超超システムを構成し、さらにその規模を大きくしていく。各サブシステムは多くのサブシステムを持ち、さらにその下にサブシステムを持つというように、スケールダウンしていく。CASには2つの特徴がある。
第一は、初期条件に対する極端な鋭敏さである。もう一つは、スケールに依存しない不変的な性質が現れることである(68)。これらの特徴から、CASはフラクタルを生成し、カオス的に振る舞い、従来の還元的な調査には適さない。自然免疫、腸内細菌叢、エネルギー代謝は、一つのCASを形成する3つの主要な相互作用するサブシステムである。
1つのシステムに摂動が生じると、他の2つのシステムに散逸的に波及し、システムは元の定常状態(アトラクター)に回復する。しかし、時には擾乱が長かったり大きかったりして、システムの応答がフィードフォワードとなり、自己増殖的に、指数関数的に、システムを既存の定常状態から押し出すことがある。
このような場合、系は新しい準安定状態(新しいアトラクター)へとカオス的に変化する。食事脂肪の持続的な増加は、腸内細菌叢の変化(バクテロイデスとファーミキューテスの増加)と腸管上皮の完全性の減少を引き起こす可能性がある。これにより、LPSやCpGなどのTLRリガンドが腸管内腔から全身循環に移行し、末梢血の自然免疫細胞から炎症性サイトカインが放出されるようになる。
このサイトカインの第一波に反応して、さらに自然免疫細胞が自らの炎症性サイトカインを放出し、そのサイクルは拡大する。ILC2やTh2によるTGF-β、IL-4、IL-10などの対抗手段は、システムが定常状態(新しいアトラクター)を見つけるまで炎症反応を抑制するものである。
ノックアウトマウス(IL-10-/-)は、上記の推測を決定的に裏付けている(69)。創発的な性質は、システムが無傷の時にのみ発現する。そのため、in vitroの実験とin vivoの実験が必ずしも一致しない。生物レベルの反応を理解するためには、多くの場合、生物を使う必要がある。
集団レベルの現象には、集団の研究が必要である。とはいえ、疫学研究のようなハイレベルの観察は、構成要素の挙動を支配する可能性のある力学を明らかにすることができ、またしばしばそうすることができる。例えば、1960年代にさかのぼる疫学研究では、風疹の流行後に自閉症スペクトラム障害や統合失調症などの神経心理学的障害が、それぞれ1〜13未満と20%から増加することが記録されている(70)。
妊娠中のマウスにポリノシン酸やリポポリサッカライドを腹腔内注射すると、ヒトの自閉症スペクトラム障害に典型的に見られる社会的行動の異常、ワーキングメモリの欠損、認知柔軟性の低下の特徴を持つ仔が生まれることが知られている。このような子孫の神経心理学的発達の変化は、母性免疫活性化(mIA)に起因するものである。
これらの母親がIL-6やTh17を大量に摂取することで、腸内細菌の変化が起こり、それが免疫活性化の状態を変化させて悪循環を引き起こし、最終的に発達中の脳の前駆細胞に悪影響を与えている可能性がある。
統合失調症患者1000人以上を対象としたゲノムワイド関連研究では、この病気と2つのMHCクラスI対立遺伝子との間に極めて有意な関連性があることが示された。HLA-B*08:01とHLA-A*01:01である(71)。2014年に発表されたより広範な追跡調査においても、MHCと統合失調症の関連は議論の余地がないものであった。
全染色体にわたるバックグラウンドリスクの中で、6番染色体についてはp値10-30という一際高い有意性が見られた。一つの仮説は、ある種のHLAがあると、ある種の病原体にさらされたときに母親の免疫活性化が起こり、炎症反応が増悪して、発達中の脳の重要な領域での神経新生が妨害されるということだ。特定のタイプのILC(おそらくILC3)の相対的な頻度の増加は、その中間段階である可能性がある。
まとめ
我々は、個体にとって重要な移行期であり、将来の健康や病気のための条件を設定する新生児や乳児における免疫防御の個体発生をレビューした。国防と新生児免疫には多くの類似点があるため、軍隊をパラダイムとしたヒューリスティックなアプローチとした。
どちらも、あるものは受け入れ、あるものは徹底的に抑制しなければならない。検知し、識別し、展開し、破壊し、解除することは、軍事システムと免疫システムの両方が行うことだ。生存のために限られた空間と物質を奪い合う生物学的プロセスは、最も純粋な戦争の形態であり、道徳やモラルは全くない。
明らかな違いもある。兵士、水兵、飛行士は感覚を持った存在であり、考え、決断することができるが、マクロファージ、好中球、ILC、大腸菌などの細胞にはそれができない。細胞レベルでは、親和性と反応速度論に支配された生化学的なものである。
しかし、出現する性質は同じである。ILCは、そのエフェクター機能を通じて、微生物叢の組成を調節し、宿主における免疫炎症反応の開始、進行、および調節を制御している可能性がある。タスク、要件、制約、決定要因、およびトレードオフは同じである。
ILCは免疫エフェクター細胞の一種であり、宿主細胞内および/または他の細胞群との間で幅広い機能と相互作用が可能である。ILCは、宿主防御、器官形成、代謝恒常性、組織リモデリング、修復、幹細胞再生において重要な役割を担っている。
胎生期の初期に出現し、胚発生を通じて進化するILCは、宿主の細胞、分子、環境因子に影響を与え、新生児期から老齢期まで免疫系に適応し貢献する能力を持つ、生存可能で強固な可塑性免疫細胞の供給源を宿主に与える。
* *
新生児は胎児の段階から、産道を通って、あるいは帝王切開で子宮を出て、臍帯が切れて自立した生活が始まるまでの5分間で、静止状態から完全に稼働するまでの防御システムを構築しなければならない。その際、ある細菌が常在菌なのか病原性細菌なのかの予備知識なしに、自己と常在のものをすべて受け入れ、それ以外のものを認識し、攻撃し、撃退しなければならない。
さらに、安全保障の場合と同様に、この常在菌か病原体かの状態は、包括的なコンテクストに依存して、時間とともに変化することが、このタスクを複雑にしている。このようなCASでは、類似の創発特性を研究することで、異なる視点が得られ、ある特定の状況下で、ある特定の要求があれば、何が存在しなければならないかを答えられるようになる。
利益相反に関する声明
著者らは、本研究が利益相反の可能性があると解釈される商業的または金銭的関係のない状態で実施されたことを宣言する。
