Contents
Infection of human lymphomononuclear cells by SARS-CoV-2
www.biorxiv.org/content/10.1101/2020.07.28.225912v2.full
ORCIDプロフィールを見るMarjorie C Pontelli、 ORCIDプロフィールを見るItalo A Castro、 Ronaldo B Martins、 Flávio P Veras、 Leonardo La Serra、 Daniele C Nascimento、 ORCIDプロフィールを見るRicardo S. Cardoso. ロベルタ-ロザレス、タイスMリマ、ジュリアーノPソウザ、ディエゴB Caetité、ミカエルH Fデリマ、ジュリアナT川久、マルセラCジャンニーニ、レティシアPボンジョルノ、マリアI Fロペス、サブリナSバタ。李Siyuan、ロドリゴLアサド、セルジオC Lアルメイダ、ファビオラRオリベイラ、マイラNベナッティ、ロレーナL Fポンテス、ロドリゴCサンタナ、フェルナンドCビラル、マリアAマルティンス、チアゴMクーニャ。Rodrigo T Calado、 José C Alves-Filho、 ORCIDプロフィールを見るDario S Zamboni、 Alexandre Fabro、 Paulo Louzada-Junior、 Rene D R Oliveira、 Fernando Q Cunha、 ORCIDプロフィールを見るEurico Arruda
doi: doi.org/10.1101/2020.07.28.225912
この論文はプレプリントであり、査読による認証を受けていない
AbstractFull TextInfo/HistoryMetricsプレビューPDF
要旨
SARS-CoV-2の重症感染は高炎症状態と関連しているが、リンパ球減少症は免疫学的特徴であり、COVID-19の予後不良と相関している。しかし、循環ヒトリンパ球および単球がSARS-CoV-2感染に感受性を有するかどうかは不明のままである。
本研究では、ヒト末梢血単核球(PBMCs)のSARS-CoV-2感染を試験管内試験(in vitro)と生体内試験(in vivo)の両方で検討した。その結果、健康なドナーから採取したPBMCs全体を試験管内試験(in vitro)感染させると、ウイルスの子孫が産生されることがわかった。
その結果、単球はBリンパ球やTリンパ球と同様にSARS-CoV-2の活性感染に感受性があり、二本鎖RNAの検出によりウイルスの複製が示唆された。さらに、フローサイトメトリーおよび免疫蛍光分析の結果、COVID-19患者の単球およびBリンパ球ではSARS-CoV-2が高頻度に検出され、CD4+Tリンパ球ではあまり検出されなかった。
COVID-19患者のPBMCにおけるSARS-CoV-2感染単球の割合は、症状の発症から時間の経過とともに増加した。さらに、SARS-CoV-2陽性単球およびBおよびCD4+Tリンパ球は、死後の肺組織において免疫組織化学的に検出された。COVID-19患者における血中循環白血球のSARS-CoV-2感染は、疾患発症、免疫機能障害、宿主内でのウイルス拡散に重要な意味を持つと考えられる。
序論
2019年12月、コロナウイルス関連疾患2019(COVID-19)と名付けられた重症急性呼吸器疾患の原因として、新たなコロナウイルスが出現した。中国でヒトに流出したウイルスは、コロナウイルス科ベータコロナウイルス属に分類され、SARS-CoVとの類似性から、重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)と命名された[1]。
SARS-CoV-2は出現以来、185の国・地域に広がり、全世界で1、100万人以上に感染し、約50万人の死者を出している。COVID-19の主な臨床症状は発熱、乾いた咳、呼吸困難、筋肉痛であるが、一部の患者は急速に重症の呼吸窮迫症候群に移行する[2]。
これまでの研究では、炎症性サイトカインストームおよびリンパ球減少症が重症COVID-19症例の重要なマーカーであり、TCD4+およびTCD8+リンパ球の重度の機能的枯渇を伴うことが示されている[2-4]。興味深いことに、COVID-19患者の末梢血単核球(PBMC)はオートファジーとアポトーシス経路のアップレギュレーションを示した[5]。
循環リンパ球の減少はCOVID-19の予後不良と関連しているが、リンパ球減少がSARS-CoV-2のリンパ球への感染とそれに伴う細胞死に直接起因するものかどうかはまだ不明である。SARS-CoV-2は、その主要な表面糖タンパク質スパイク(S)と細胞膜に存在するアンジオテンシン変換酵素2(ACE2)との結合を介して標的細胞と相互作用する [6]。ACE2に依存しない細胞侵入も報告されており、ACE2の発現が低い細胞におけるSARS-CoV-2侵入の代替機序である可能性がある[7]。SARS-CoV-2の効率的な侵入にはSタンパク質の切断が必要であり、これは膜貫通型セリンプロテアーゼTMPRSS2によって達成される[6]。
呼吸器疾患に加えて、COVID-19患者は頻繁に消化器症状を発症するが、これは腸球においてTMPRSS2およびACE2の高発現が記録されていることと一致している[8]。さらに、SARS-CoV-2抗原は、死後の脾臓およびリンパ節に病理学的な損傷の徴候が認められた。これらの臓器では、単球にもウイルス抗原が含まれているが、これがウイルスの活発な複製によるものなのか、貪食によるものなのか、単球が二次リンパ組織に到達する前に感染したのかは明らかにされていない[9]。SARS-CoV-2はウイルス感染を起こすが、これまでCOVID-19患者の末梢血からの感染性SARS-CoV-2の分離には成功しておらず、血中のウイルスは細胞関連ウイルスである可能性が示唆されていた[5、 9]。本研究では、ヒト末梢血単核球(PBMC)のSARS-CoV-2に対する感受性と寛容性を調べた。その結果、PBMCは生体内試験(in vivo)とex vivoの両方でSARS-CoV-2感染に対して感受性と寛容性を示し、循環リンパ球の減少に直接的な役割を果たしていると考えられることがわかった。
患者と方法
倫理的発言とCOVID-19の患者さん
本試験は、国立倫理委員会(CONEP、CAAE:30248420.9.0000.5440、31797820.8.0000.5440)により承認された。合計 29 人の入院患者が登録され,全員が COVID-19 の臨床的および放射線学的特徴を有し,呼吸器分泌物中の RT-PCR により SARS-CoV-2 感染が確認され,SARS-CoV-2 に対する特異的 IgM 抗体または IgG 抗体が検出された。臨床的特徴、検査結果、薬物療法については、補足表 1 にまとめた。すべての比較のために、年齢と性別を一致させた 12 名の対照群も登録した。患者と健常対照者の両方について、書面によるインフォームドコンセントを得た。
マウス抗SARS-CoV-2高免疫血清の産生
雄の C57Bl/6 マウスは、サンパウロ大学リベイラオプレト医科大学(FMRP)の動物施設で、特定の病原体のない条件で飼育・管理された。マウス高免疫血清の生産のためのプロトコルは、動物実験における倫理に関する機関のガイドラインに従って8週齢の雄マウスで実施され、動物実験研究のためのサンパウロ大学倫理委員会-CETEA(プロトコル番号001/2020-1)によって承認された。動物を免疫するために、ウイルスストックを最終濃度0.2%になるようにホルムアルデヒドを添加して不活化し、37℃で一晩インキュベートした。次いで、ウイルスを超遠心分離(10%スクロースクッション、159.000×g、1h)により精製した。ペレットをリン酸緩衝生理食塩水(PBS)1xで再懸濁し、-20℃で保存した。不活化を確認するために、5日間培養したVero-E6細胞を用いて、TCID50による滴定とプラークアッセイによる滴定を行ったが、細胞病理学的効果は認められなかった。3匹のC57Bl/6マウスを、PBS中で1:1に希釈した完全フロイントアジュバント(CFA、BD、猫263810)中の不活化SARS-CoV-2の106個のTCID50に相当する量を含むエマルジョンで筋肉内接種した。最初の免疫化後7日目および14日目に、不完全フロイントアジュバント中の不活化SARS-CoV-2(M. tuberculosis、IFA、BD、cat. 263910を含まない)を用いてブーストを与えた。最後の投与の1週間後に、動物を、心臓穿刺による失血に続いて、過剰麻酔薬キシラジン(60mg/kg)およびケタミン(300mg/kg)で安楽死させた。動物の血清転換を、4%パラホルムアルデヒドおよびAlexaFulowor488標識ウサギ抗マウス二次抗体で固定したSARS-CoV-2感染Caco-2細胞のスライド調製物を用いた間接免疫蛍光により評価した。カバースリップを光学顕微鏡(オリンパスBX40)を用いて分析した。
末梢血単核細胞(PBMC)の単離
ヒトPBMCは、以前に記載されているように、Percoll(GEヘルスケア、猫17-5445-01)を使用して密度勾配によってCOVID-19患者または健康なドナーから単離した[10、11]。PBMCを洗浄し、10%ウシ胎児血清(FBS)を補充したRPMI 1640に再懸濁し、さらに使用するまで氷上に保存した。
ウイルスおよび細胞株
サンパウロのCOVID-19患者からVero-E6で得られたSARS-CoV-2 Brazil/SPBR-02/2020分離株のパッセージ1(P1)は、Edison Durigon教授(ICB-USP)のご厚意により提供された。P1をDulbecco’s modified Eagle’s medium (DMEM)で1:1000に希釈し、Vero-E6細胞単層に接種してP2ストックを作製した。ストックの滴定のために、10倍希釈液を連続してVero-E6細胞の4倍体モノレイヤーに接種し、5%CO2中で37℃でインキュベートした。インキュベーションの4日目に、細胞病理効果(CPE)の存在を記録し(補足図1A)、力価をReade-Muench法を用いて、50%組織培養感染用量(TCID50)として表した。SARS-CoV-2の伝播を伴うすべての実験は、バイオセーフティレベル3の実験室で行った。
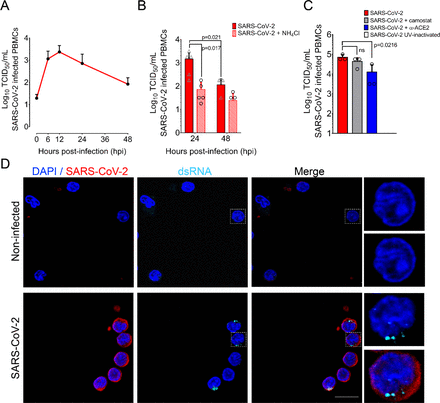
図1. ヒト初代血球は、SARS-CoV-2に対して感受性と寛容性がある。
5人の健康なドナーから血液を採取し、フィコール密度勾配によりPBMCを分離した。細胞をSARS-CoV-2ブラジル/SPBR-02/2020(MOI-1)に感染させ、48時間培養した。 A)SARS-CoV-2に感染したPBMCからの時間外ウイルス前駆体産生。培養PBMCから上清を各時点で採取し、TCID50で滴定した。小記号は個々の値(5人の健康なドナー)を示し、エラーバーは標準偏差を示す。B)20mM NH4Clでの処理の有無にかかわらず、24および48 hpiでの感染PBMCの上清中のSARS-CoV-2子孫価。C)SARS-CoV-2細胞受容体ACE2およびTMPRSS2をブロックすることのウイルス子孫産生に対する効果。感染したPBMCを抗体抗ACE2またはCamostatに曝露し、ウイルス子孫を24 hpiで上清中に滴定した。(D) SARS-CoV-2感染後6時間後にポリリジンコーティングされたカバースリップ上で培養したPBMCsにおけるdsRNAの免疫染色。細胞を固定し、SARS-CoV-2(赤)、dsRNA(シアン)の免疫染色を行い、共焦点顕微鏡で分析した。統計分析は、一方向または二方向ANOVAを用いて行った。Tukeyの後検定またはHolm-Sidakの後検定を適切な場合に適用した。P値<0.05は有意であると考えられた。倍率。63x. スケールバーは10μM。
PBMCsの試験管内試験(in vitro)感染
これらの実験では、5人の健康なドナーからの106個のPBMCを、0% FBSを添加したRPMI中で、軌道撹拌下で1時間RTでSARS-CoV-2(MOI=1)に感染させた。次に、細胞を300×gでペレット化し、接種物を洗浄し、2%FBSを含むRPMIで置換し、細胞を5%CO2中で37℃でインキュベートした。コントロールとして、当量の細胞をUV不活性化SARS-CoV-2に曝露し、同様に処理した。また、感染の20分前から 20mMのNH4Clで処理し、全体のインキュベーション期間を通して維持した細胞からなるコントロールも使用した。PBMCからの上清を、感染後0、6、12、24および48時間で採取し、前に記載したように、TCID50によるウイルス力価を決定するために、連続10倍希釈に供した。並行して、PBMCsを0.5ug/ml Camostat (Sigma Aldrich、 cat.SML005)または10uMの抗ACE2抗体 (Rhea Biotech、 cat.IM-0060)で感染の1時間前から処理した。その後、イノキュラムを洗浄し、異なる処理を含む培地を交換し、PBMCsを5%CO2中、37℃で24時間保存した。
RNA抽出およびリアルタイムRT-PCR
SARS-CoV-2 RNAの検出は、USA-CDCプロトコルに従ってSARS-CoV-2用のプライマー-プローブセットを用いて、ウイルスN1遺伝子を標的とし、コントロールとしてRNAse-Pハウスキーピング遺伝子を用いて、ワンステップリアルタイムRT-PCRにより行った。全RNAを、250μLのホモジナイズされた細胞ペレットおよび試験管内試験(in vitro)アッセイからの上清から、Trizol®(Invitrogen、CA、EUA)を用いて抽出した。すべてのリアルタイムPCRアッセイは、Step-One Plusサーモサイクラー(Applied Biosystems、Foster City、 CA、 USA)で行った。簡潔には、Trizol®抽出後、100 ngのRNAを、N1プライマー(20 µM)およびプローブ(5 µM)、およびTaqPath 1-Step qRT-PCRマスターミックス(Applied Biosystems、Foster City、 CA、 USA)を用いて、以下のパラメータで、25℃で2分間、50℃で15分間、95℃で2分間、その後、94℃で5秒間、60℃で30秒間の45サイクルで、ゲノム増幅に使用した。SARS-COV-2のウイルス負荷は、CDCプロトコル(N1、N2およびN3)によって設計されたプライマー/プローブのセット(N1、N2およびN3)のための3つのすべてのターゲットを含む944bpアンプリコンを含むプラスミドを、TAクローニングベクター(PTZ57R/T CloneJetTM Cloning Kit Thermo Fisher®)に挿入して調製した標準曲線を使用して決定した。ワンステップqRT-PCRによるウイルスRNA定量の結果を、GraphPad® Prism 8.4.2ソフトウェアを用いてプロットした。
SARS-CoV-2感染細胞の間接免疫蛍光染色
ポリリジン0.1%(Sigma-Aldrich、 cat. P8920)で前処理したカバースリップを、患者または健康なドナーから単離されたPBMCと一緒に37℃、20分間インキュベートし、細胞の付着性を調べた。その後、カバースリップ含有細胞をPBS中の4%パラホルムアルデヒド(PFA)で15分間固定し、PBSで3回洗浄した。細胞内のウイルス抗原を検出するために、回収されたCOVID-19患者からの血清を使用したが、これは最初にSARS-CoV-2感染Vero CCL81細胞における免疫蛍光による特異性の試験を行った(補足図1B)。さらに、参照された血清を用いた各実験については、健康なドナーまたは非感染細胞からの細胞を含めた。この血清のアイソタイプコントロールとして、2016年に採取したヒト血清を使用した。ビオチン標識抗ヒトIgG(Sigma-Aldrich、 cat. B-1140)を二次抗体として使用し、次いで、製造業者のプロトコルに従って、TSAシアニン3システム(Perkin Elmer、 NEL704A001KT)を用いて増幅した。SARS-CoV-2感染細胞の表現型を決定するために、CD4(Abcam cat. ab133616)、CD8(Abcam cat. ab4055)、CD14(Abcam cat. ab133335)、CD19(Abcam cat. ab134114)、CD20(Abcam cat. ab103573)の一次抗体を使用した。ウイルス複製の検出には、40bp以上のdsRNAに結合するマウス抗dsRNA J2(dsRNA; English & Scientific Consulting Kft、 Hungary)を用いた。使用した二次抗体は、488(Thermo Fisher cat. A21202)、594(Abcam cat. ab150116)または647(Abcam cat. ab150079)とコンジュゲートしたポリクローナル抗ウサギであった。ゴルジ複合体および核の染色は、マウス抗GM130(BD猫6108222)および4′,6-ジアミノ-2-フェニルインドールジヒドロクロライド色素(DAPI、サーモフィッシャー猫62248)を用いて、それぞれ実施した。
共焦点顕微鏡
確認されたCOVID-19患者および健康な対照ドナーからのPBMCを、SARS-CoV-2に対する抗体を含むヒト血清、および異なる細胞表現型に対する市販の抗体で染色し、その後、適切な二次抗体で染色した。調製物を、ツァイス共焦点780顕微鏡(Taille3×3)で単焦点で分析した。異なる表現型のSARS-CoV-2陽性細胞の量は、ImageJによるフィジーからの分析粒子ツールを使用して定量化した。
フローサイトメトリー
COVID-19患者または健康なドナーから採取した全白血球サンプルを、SARS-CoV-2に試験管内試験(in vitro)感染したCOVID-19患者または健康なドナーから採取した全白血球サンプルを、Fixable Viability Dye eFluor™ 780(eBioscience社製)とCD3(APC eBioscience社製 eBioscience cat. 17-0036-42)、CD4(PerCP-Cy5.5 BD、560650)、CD8(PE-Cy7 BD、557746)、CD19(APC BioLegend、302212)、CD14(PerCP Abcam、ab91146)、CD16(PE eBioscience、12-0168-42)、CCR2(BV BioLegend、357210)に特異的なモノクローナル抗体を用いて、メーカーの指示に従って4℃で30分間染色した。フローサイトメトリーによるSARS-CoV-2の検出は、BD Cytofix/Cytoperm™キットを用いて実施し、この原稿に記載されているように、ホルマリン不活性化SARS-CoV-2に対して発現させたマウスポリクローナル抗体を用いて、細胞内抗原へのアクセスを可能にした。ウイルス検出が細胞内ウイルスの複製に特異的であることを確実にするために、感染細胞の追加の調製物を透過させずに染色した。表面結合ウイルス粒子を除去するために、感染後に氷上で60分間トリプシンで処理することも、第二の対照として含まれた(補足図2)。SARS-CoV-2抗体は、二次抗マウスAlexa488を用いて検出した。表面ホスファチジルセリン(PS)染色は、製造業者のガイドラインに従って、ApoScreeeen AnpnexinV-FITCアポトーシスキット(Suansobiotech cat10010-02)を用いて全血で行った。すべてのデータは、VerseまたはCantoフローサイトメーター(BD Biosciences)を用いて取得し、その後の解析はFlowJo(TreeStar)ソフトウェアを用いて行った。ゲーティング戦略は、補足図3に図示されている。
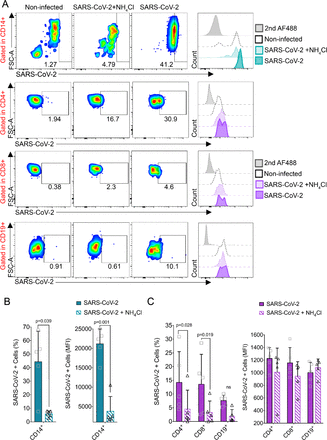
図 2. SARS-CoV-2 は、試験管内試験(in vitro) でヒト PBMCs のサブセットに異なる感染を示す。
A)ライブCD14+、CD4+、CD8+またはCD19+細胞でゲーティングを伴う20mM NH4Clの存在下または非存在下でSARS-CoV-2(24 hpi)に感染したPBMCsの代表的なフローサイトメトリープロット。適切なコントロールと比較した各条件の蛍光の代表的なヒストグラム。灰色の斜線の曲線は、二次抗体Alexa488シグナルバックグラウンドを示し、破線の曲線は、模擬感染細胞におけるバックグラウンドシグナルを示す。明色および暗色の曲線は、それぞれNH4Clの存在下および非存在下で感染した細胞を示す。SARS-CoV-2に感染した単球(B)とリンパ球(C)の割合、右のパネルの平均平均蛍光強度(MFI)と左のパネルのSARS-CoV-2に感染した細胞の頻度(%)を示す。平均±s.d.を棒グラフで示した。有意性は、ボンフェローニの事後検定を用いた一方向ANOVAによって決定した。
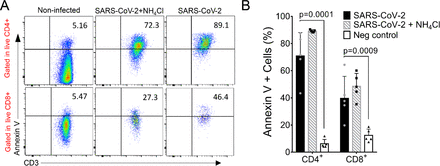
図3. PBMCs への SARS-CoV-2 感染は T リンパ球におけるホスファチジルセリン(PS)の発現を増加させる.
A)SARS-CoV-2感染の24時間後に、5人の発情期ドナーから得たPBMCにおけるアネキシンV染色陽性のライブCD4+およびCD8+ T細胞の代表的なフローサイトメトリープロット(MOI=1)。B)SARS-CoV-2試験管内試験(in vitro)感染後の細胞表面でアネキシンV陽性でPSを発現する生リンパ球の割合。平均±s.d.はすべての棒グラフについて示した。有意性は、一方向ANOVAおよびボンフェローニの事後検定によって決定した。
連続免疫組織化学
2人のCOVID-19致死例から得られたパラフィン包埋肺片からの組織切片を、SARS-CoV-2のin situ検出のための抗SARS-CoV-2ポリクローナル抗体を用いた免疫組織化学(IHC)で検査した。次に、CD4(Abcam cat. ab133616)、CD20(Abcam cat. ab103573)、CD14(Abcam cat. ab133335)およびIL-6(BD cat. 554400)に対する抗体を用いて、SARS-CoV-2感染細胞の免疫表現型を決定するために、シーケンシャルイムノペルオキシダーゼ標識消去法(SIMPLE)[12]を実施した。染色の各ラウンドの後、スライドをVS120スキャンスコープ(オリンパス)を用いて400倍の倍率でスキャンした。画像は、ImageJ v1.50b(NIH、米国)およびAdobe Photoshop CS5ソフトウェア(Adobe Systems、サンノゼ、CA、米国)を使用してヘマトキシリンで染色した準備の最初の画像に擬似着色し、重ね合わせた。2016年のハンタウイルス感染致死例から得られた肺パラフィン包埋組織を、SARS-CoV-2染色のネガティブコントロールとして使用した。
統計的解析
すべての記述統計、患者の層別化、および陽性細胞の頻度は、GraphPad Prismソフトウェアのバージョン6.0を使用して行われた。相関分析、一方向ANOVA、二方向ANOVA、線形回帰、ホルムシダック、ボンフェローニ後検定もGraphPad Prismを用いて行った。すべての図に記載されているように、P <0.05の値は、有意であると考えられた。
結果
ヒトPBMCのSARS-CoV-2感染は生産性が高い
ヒトのリンパ球および単球系が試験管内試験(in vitro)でSARS-CoV-2に感染しやすいことを考慮して、ヒトPBMCの初代培養物も感染するかどうかを調べた。そこで、5人の健康なドナーからのPBMCをMOI=1で試験管内試験(in vitro)感染させた。0、6、12、24および48 hpi後、上清を採取し、ウイルス子孫を滴定した。SARS-CoV-2の力価は6~12 hpiの間にピークを迎え、初期入力の100倍に増加し、その後は順調に減少した(図1A)。予想されたように、NH4Cl処理による細胞内アルカリ化の誘導は、子孫産生を約10倍減少させた(p=0.017)。興味深いことに、NH4Cl処理によってウイルスの子孫産生が完全に抑制されたわけではなく、PBMCsにおけるエンドソーム酸性化に代わる侵入経路が示唆された(図1B)。
一般的にヒトPBMCsではACE2の発現は最小限であるが[13、 14]、我々はACE2とTMPRSS2をブロックした後のウイルス産生を評価した。TMPRSS2をカモスタットで遮断した後に得られたウイルス力価は、処置なしで得られたものと有意差はなかった(図1C)ことから、PBMC感染はTMPRSS2に依存していないことが示唆された。逆に、抗ACE2抗体によるACE2の遮断は、24時間後にSARS-CoV-2の子孫産生の減少をもたらしたが、アブログ化はもたらさなかった(p=0.0216)(図1C)、これは、SARS-CoV-2がACE2とは無関係にヒトPBMCに感染できることを示している。
コロナウイルスの複製は、感染細胞の細胞質に豊富な二本鎖RNA(dsRNA)を形成するため、細胞内での検出はウイルス複製の信頼性の高いマーカーとなる。そこで、感染したPBMCをSARS-CoV-2とdsRNAで染色し、共焦点顕微鏡で解析した。ほとんどのSARS-CoV-2陽性細胞はdsRNAにも陽性であり、感染後6時間後にカウントされた二重陽性細胞の割合は、子孫の蓄積とほぼ一致するパターンに従っていた(図1D)。dsRNAの染色は、SARS-CoV-2感染細胞では、ウイルス工場を示唆するパターンで明確なパンク タとして見られた。
単球およびTリンパ球は、SARS-CoV-2試験管内試験(in vitro)感染の主な標的である。
循環白血球のSARS-CoV-2に対する感受性を決定するために、5人の健康なドナーからのPBMCを感染させ(MOI=1)、フローサイトメトリーでSARS-CoV-2抗原の細胞内発現を分析した。24 hpi後、SARS-CoV-2はすべての免疫フェノタイピングされた細胞で検出された(図2A)。単球は最も感受性の高い細胞型であり、有意なSARS-CoV-2抗原染色を示した(44.3%、p=0.039)(図2B)。単球に加えて、T CD4+(14.2%、p=0.028)、CD8+(13.5%、p=0.019)、Bリンパ球(7.58%)もSARS-2感染に感受性を示した(図2C)。SARS-CoV-2の染色は、NH4Clで処理した細胞で有意に減少しており、PBMCの試験管内試験(in vitro)感染には酸性化が重要であることが示唆された。
Tリンパ球の感染はアポトーシスによる細胞死をもたらす
COVID-19関連のリンパ球減少は,患者の重篤な臨床転帰の強い指標としてよく報告されている.我々は、T CD4+細胞とCD8+細胞の両方が試験管内試験(in vitro)でSARS-2感染に感受性があることを発見したので、我々は、感染後24時間後の細胞表面における転座ホスファチジルセリン(PS)のアネキシンVへの結合を解析することにより、5人の健常ドナーから得たSARS-CoV-2感染PBMCにおける細胞死の有無を調べた(図3)。非感染細胞に見られる基底的なアネキシンV染色(CD4+平均6.24%、CD8+平均12.36%)にもかかわらず(図3A)、ライブT CD4+(70.88%、p=0.0001)およびCD8++リンパ球(39.72%、p=0.0009)の両方で強い染色が観察された(図3B)。細胞をLive/Dead染色とは独立して分析した場合、その差は依然として有意であり、CD8+(59.64%、p=0.0001)についても増加した(補足図4)ことから、アネキシンV陽性CD8+細胞のかなりの割合が既に死んでいることが示唆された。感染時の細胞死については、NH4Clの存在下で感染した細胞と非存在下で感染した細胞との間に有意な差は認められなかった。これらの結果は、SARS-CoV-2によるヒトPBMCへの感染は、Tリンパ球におけるアポトーシスマーカーの発現を急激に増加させることを示していた。
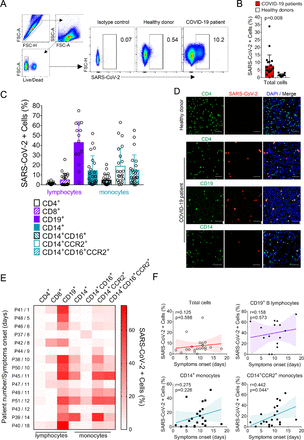
図4. COVID-19入院患者からのPBMCsにおけるSARS-CoV-2の検出。
A)アイソタイプ対照および健康なドナーと比較したCOVID-19患者からのPBMCのSARS-CoV-2陽性を示す代表的なフローサイトメトリープロット。B)COVID-19患者(n=22)からのSARS-CoV-2感染細胞の割合を、健康なドナー(n=12)細胞からのバックグラウンドシグナルと比較した。結果は不対のt検定(p=0.008)で比較した。C)COVID-19患者(n=22)における、異なる免疫表現型を考慮したSARS-CoV-2感染細胞の割合。D)SARS-CoV-2(赤)、核(青)、および免疫表現型CD4、CD19またはCD14(緑)でラベル付けされたCOVID-19患者からのPBMCの免疫蛍光。スケールバー。50 µM (E) ヒートマップは、症状発症からの時間(患者数/症状発症(日))で層別化した各免疫表現型のSARS-CoV-2陽性細胞頻度を示す。データは、分析された各COVID-19患者について個別にプロットされた。F)症状発症後の時間とSARS-CoV-2陽性細胞の頻度との間の相関および線形回帰分析。p’と’r’の両方の値をグラフに示した。ベストフィット線はすべてのグラフに表示され、明るい色の領域は信頼区間を表している。P値<0.05は有意であると考えられた。
COVID-19患者からの循環免疫細胞はSARS-CoV-2に感染している
4月7日から6月18日までの間に、集中治療室(ICU)に入院した中等度から重症のCOVID-19患者22名を登録した。登録された患者の臨床的および人口統計学的特徴を補足表1に示す。ICU 入院時に血液サンプルを採取した。COVID患者のPBMCにおけるSARS-CoV-2感染を調べるために、患者22人および健康なドナー11人の全血から調製したPBMCをフローサイトメトリー(図4A)で分析し、SARS-CoV-2抗原を染色した。COVID-19患者の細胞は、健常者ドナーの細胞と比較して有意にSARS-CoV-2抗原を発現していた(7.68%±1.56 p=0.008)(図4B)。興味深いことに、すべてのCOVID-19患者がSARS-CoV-2の発現を示したわけではなく、SARS-CoV-2陽性細胞の割合は0.16~33.9%であった(図4B)。さらに、15人のCOVID-19患者からのPMBCをリアルタイムRT-PCRでSARS-CoV-2ゲノムの検査を行った。ウイルスゲノムは、15人のPBMCサンプルのうち8人(53.3%)で検出され、平均ウイルス負荷はRNA 1μgあたり3.8×104コピーであった(補足表2)。COVID-19患者の細胞のイムノフェノタイピングを行ったところ、SARS-CoV-2陽性細胞の割合が最も高いのはBリンパ球(42.73%±4.3)であることが示された。試験管内試験(in vitro)感染の影響を受けやすいが、フローサイトメトリーではCOVID-19患者のPBMCには有意な数のSARS-CoV-2陽性T細胞は認められなかった。試験管内試験(in vitro)実験で観察されたものと同様に、患者からの単球(CD14+)は高い割合でSARS-CoV-2陽性であった(14.19%±15.26)。また、炎症性単球(CD14+CCR2+およびCD14+CD16+CCR2+)は、健常対照と比較して有意に高い割合でSARS-CoV-2抗原陽性であった(それぞれ18.73%±18.46および14.78%±15.5)(図4C)。フローサイトメトリーで得られた結果を確認するために、COVID-19患者から分離されたPBMCs中のSARS-CoV-2抗原について免疫蛍光を行った。COVID-19患者から分離したPBMCでは、CD19細胞とCD14細胞にSARS-CoV-2抗原の染色が観察されたが、健常者ドナーから分離したPBMCでは識別可能な蛍光シグナルは観察されなかった(図4D)。FC実験で観察されたことにもかかわらず、CD4 Tリンパ球ではいくつかのIF染色が見られ、広範囲にスクリーニングした結果、ごく少数のT CD8細胞がIF陽性であることが判明した(補足図5)。
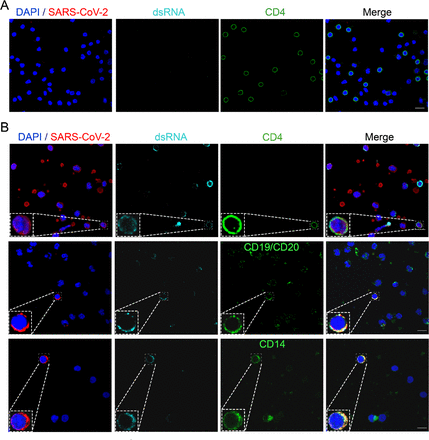
図5.
COVID-19患者からのSARS-CoV-2に自然感染した末梢血細胞は、複製中間体である二本鎖RNAを提示する。
A)健康なドナーまたは(B)COVID-19患者からのPBMCを単離し、ポリリシンで前処理したカバースリップ上に置いた。細胞を固定し、SARS-CoV-2(赤)、CD4、CD19またはCD14(緑)、dsRNA(シアン)および核(青)としての免疫表現型を染色した。共焦点顕微鏡を用いて免疫蛍光を調べた。各チャネルの左下隅には、ラベリング表現型のインセットが示されている。少なくとも2人の患者が分析された各免疫表現型の代表的な画像。倍率63倍。スケールバー10 um。
患者におけるSARS-CoV-2の検出が可変であることが判明したので(図4C)、SARS-CoV-2陽性細胞の割合の個人差を分析するために、15のCOVID症例を選択した。患者を症状発症後のサンプル採取時期に基づいて層別化し、SARS-CoV-2陽性細胞頻度を解析したすべての細胞免疫表現型についてヒートマップ上にプロットした(図4E)。データセット全体を通して、SARS-CoV-2陽性Bリンパ球の割合が高いことが明らかになった。一方、SARS-CoV-2陽性単球の割合は、発症後の時間経過後に高くなっていた(図4E)。SARS-CoV-2陽性細胞の頻度は、症状発症後のCOVID-19の進行時間と正の相関を示し、特に炎症性CD14+CCR2+単球では正の相関を示した(r=0.442 p=0.044)(図4F)。
SARS-CoV-2がCOVID-19患者からのPBMCsにおいて活発に複製されているかどうかを確認するために、異なる免疫表現型のSARS-CoV-2陽性細胞におけるdsRNAの存在を、免疫蛍光および共焦点顕微鏡によって分析した。その結果、CD4+ T リンパ球、B リンパ球、単球など、ほとんどの SARS-CoV-2 陽性細胞サブセットで dsRNA 染色が認められた(図 5)。これらのデータから、SARS-CoV-2がCOVID-19患者の循環白血球に感染し、末梢血中のSARS-CoV-2陽性単球の頻度が症状の発現時間とともに増加することが確認された。
感染した炎症性単球は、COVID-19人の肺組織から死後に検出される。
呼吸器管は哺乳類宿主におけるコロナウイルスの古典的な侵入経路である.そこで我々は、死後に採取したCOVID-19患者の肺の免疫組織化学検査で、PBMCsで検出された感染細胞の免疫表現型と同じものが検出されるかどうかを調べた。COVID-19患者の死後肺標本では、特に気管支血管軸と肺胞毛細血管の全体にSARS-CoV-2の豊富な染色が認められた。対照の肺検体では染色は認められなかった(補足図6)。SARS-CoV-2を染色した後、スライドをスキャンし、染色を消去し、表面抗原CD4、CD20、およびCD14のために順次再染色した。その結果、COVID-19症例の肺では、CD4+ Tリンパ球、Bリンパ球、単球がSARS-CoV-2抗原を発現していることが明らかになった(図6)。さらに、COVID-19症例の肺組織損傷における周知の役割のために、IL-6陽性細胞も探索したところ、興味深いことに、IL-6を発現するいくつかのCD14+単球もSARS-CoV-2に対して陽性であった(図6C-E)ことから、COVID-19症例の肺における炎症性単球もSARS-CoV-2に感染する可能性があることが示唆された。
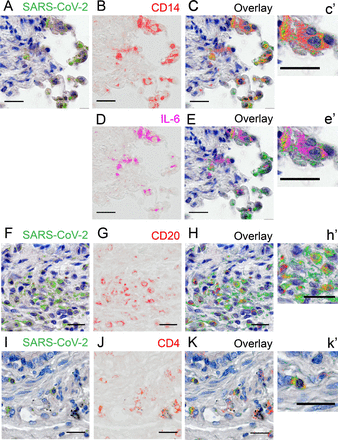
図 6. SARS-CoV-2は、COVID-19肺の多様な免疫細胞型で検出される。
A、FおよびI)ヘマトキシリンカウンター染色と緑でSARS-CoV-2染色偽色。B、G、J)免疫表現型CD14、CD20およびCD4の染色は、それぞれ、赤で仮着色。(D): IL-6の染色、マゼンタ色の仮色。C、E、HおよびK)黄色で示された重ね合わせ染色を有する、前の連続したラウンドの染色からの重ね合わせ層。C’、E’、H’およびK’)それぞれの前のパネルからのインセット。スケールバー。50μM。
議論
感染の初期段階での免疫応答の調節障害と相まって、自然免疫センシングから逃れるためのいくつかのSARS-CoV-2の戦略が、重度のCOVID-19の特徴であるサイトカインストームを駆動することは、よく受け入れられてきた[15-17]。重要なことに、リンパ球減少症もまた、SARS-CoV-2による重症感染の特徴として認識されている。脾臓およびリンパ節の死後検査では、これらの臓器にSARS-CoV-2が存在し、ACE2を発現するマクロファージに感染し、重要な組織障害を引き起こしていることが示された[10]。
呼吸器系の侵入部位から遠く離れた組織でSARS-CoV-2が検出されたことから、SARS-CoV-2は別の方法で標的臓器に到達している可能性が示唆された。一つの可能性として、白血球の感染が考えられるが、この白血球はウイルスを二次感染部位に運ぶ「トロイの木馬」の役割を果たす可能性がある。この点に関して、我々は最近、SARS-CoV-2が好中球に感染することを報告しており、好中球もまた、好中球浸潤組織にSARS-CoV-2を運ぶトロイの木馬として作用する可能性がある[18]。
しかし、SARS-CoV-2が生体内のPBMCsに感染するかどうかはこれまで不明であり、その結果、PBMCsがウイルス拡散のトロイの木馬となる可能性がある。
この疑問を解決するために、我々はまず、健康なドナーのPBMCを試験管内試験(in vitro)でSARS-CoV-2に感染させ、そのウイルスに対する感受性と寛容性を予備的に確認した。PBMCsにおけるウイルス産生は12 hpiでピークを迎え、最初の入力の100倍の力価に達し、その後48 hpiまで着実に減少した。
感染後最初の数時間でSARS-CoV-2に感染したPBMCsにおけるdsRNAの存在は、ウイルスが試験管内試験(in vitro)でPBMCsでわずかではあるが複製することのさらなる証拠を提供している。これらの結果は、ヒト PBMCs における SARS-CoV 感染の報告 [19] と一致している。さらに、pHを上昇させてオルガネラの酸性化を防ぐ塩化アンモニウムでPBMCを処理しても、SARS-CoV-2の複製は有意に減少したが、消失はしなかった。
試験管内試験(in vitro)でSARS-CoV-2に感染したPBMCの免疫フェノタイピングにより、CD14+、CD4+、CD8+およびCD19+細胞が感受性であることが明らかになった。ヒト初代単球はMERS-CoVおよび最近ではSARS-CoV-2に感受性があることが報告されている[20、 21]。
対照的に、最近の別の研究では、PBMCが試験管内試験(in vitro)でSARS-CoV-2に感染したことは報告されていないが、これはおそらく使用したMOIが低かったことに起因している[22]。しかし、我々は、ACE2を遮断することで、感染したPBMCの上清中のSARS-CoV-2の力価が部分的に低下することを発見した。
これは、PBMCの中には、ウイルスの総子孫生産に寄与するACE2発現細胞が存在することを示唆している。しかし、ACE2を遮断してもウイルス産生がなくなるわけではなく、ACE2に依存しない感染メカニズムが存在することを強く示唆している。
最近の報告では、SARS-CoV-2スパイク蛋白質が、SARS-CoVで観察されたのと同様の方法で、代替ウイルス受容体である可能性のある表面CD147と相互作用しうることが示されている[7、 23]。バシニンとしても知られる膜貫通型糖タンパク質CD147は、Tリンパ球のいくつかのサブセットで発現しており[24]、これらの細胞でもSARS-CoV-2の侵入に関与している可能性がある。
末梢血中の激しいT細胞の枯渇は、重症COVID-19患者の最大85%に見られる[2、 25]。さらに、COVID-19患者のT細胞はかなりのレベルの枯渇マーカーを示し[3、 4]、BBMCのトランスクリプトーム解析では、アポトーシスおよびp53シグナル伝達経路に関与する遺伝子のアップレギュレーションが示唆された[5]。
これらのデータは、SARS-CoV-2感染はPBMCsにおいてアポトーシスによる細胞死を誘導する可能性があることを示唆しており、COVID-19患者の炎症を起こした二次感染臓器においても同様のことが起こりうることを示唆している。
注目すべきは、リンパ球減少症は中東呼吸器症候群(MERS)患者でも報告されており、MERS-CoVはヒト一次Tリンパ球に直接感染し、外因性および内因性の経路を介してT細胞のアポトーシスを誘導する可能性がある[20]。
アネキシンV染色により、PBMCsへのSARS-CoV-2感染は、CD4+およびCD8+ Tリンパ球の細胞表面へのホスファチジルセリン(PS)の転座の増加を引き起こしたことが示された。PSの転座とそれに続く脂質膜の非対称性のスクランブルは、後期のアポトーシスを示している[26]。
重要なことは、NH4Clの存在下では、SARS-CoV-2感染はアネキシンVのラベリングを有意に増加させ、複製レベルが低下していても、SARS-CoV-2はリンパ球のアポトーシスを誘発しうることを示唆している。これらのデータから、SARS-CoV-2のリンパ球への感染は細胞死を引き起こすことが示唆され、これは観察されたリンパ球減少症と一致している可能性がある。
リンパ球減少と予後不良との関連は、特定のT細胞サブセットの死と関連している可能性があり、これは免疫応答調節成分の喪失をもたらし、好中球NETosisとクロストークするサイトカインストームを引き起こす可能性がある[27]。また、IL-6およびFas-FasL相互作用の増加[10]に関連して、重度のリンパ組織の変化をもたらす可能性がある[28]。
試験管内試験(in vitro)感染に加えて、SARS-CoV-2はCOVID-19患者のPBMCsにおいても検出され、Bリンパ球および単球の亜集団においてより顕著に検出された。生体内でのSARS-CoV-2感染の標的細胞としてのBリンパ球の優位性は、試験管内試験(in vitro)感染したPBMCで見られたものとは対照的であり、自然なSARS-CoV-2感染における異なるリンパ球サブセットの感受性は、ACE2に依存しない代替ウイルス侵入メカニズムに依存している可能性が示唆された。
これらの知見は、SARS-CoVが抗体の存在によって促進されるFcγRII依存性経路を介してBリンパ球および単球由来細胞に侵入するという以前の観察結果を裏付けるものである[29、 30]。今回の結果は、COVID-19の進化の異なる時期に登録された患者の1回限りのサンプリングに基づいて得られたものであり、このことが、患者間で観察された異なる免疫表現型のSARS-CoV-2陽性細胞の割合の不均一性を説明している可能性がある。
このことから、PBMCsにおけるSARS-CoV-2感染は、症状発症からの時間とPBMCsにおけるSARS-CoV-2陽性細胞の頻度との間に正の相関関係があることから示唆されるように、まだ同定されていない宿主因子に依存して変動するか、あるいはCOVID-19の後期にのみ存在する可能性があることが示唆された。
経時的にSARS-CoV-2感受性細胞が増加することの説明として考えられるのは、タイプI IFN [31]によって誘発されたACE2発現の増加であろう。この文脈では、PBMCsにおけるSARS-CoVの複製が長期間持続しなかったことは注目に値する[19、 32]。
我々の知る限りでは、これはSARS-CoV-2陽性の循環リンパ系細胞の最初の報告であり、dsRNAの存在は、これらの細胞がウイルス複製の標的であることを示している。このことは、COVID-19の間に細胞の免疫能力にかなり影響を与え、細胞に関連したSARS-CoV-2の二次感染部位への拡散を助ける可能性がある。
SARS-CoV-2は、肺に重要な炎症性浸潤を募り、肺細胞や肺胞マクロファージなどのSARS-CoV-2感染肺細胞と密接に接触している多様な免疫細胞型を含んでいる[33]。今回の研究では、CD4+ TおよびBリンパ球、さらに重要なことに、SARS-CoV-2陽性のIL-6発現炎症性単球がCOVID-19の致死例の肺組織に浸潤していることが明らかになった。
SARS-CoV-2陽性のリンパ単核球が肺で感染するのか、それともすでにウイルスを含んでいる血流から感染組織に侵入するのかを明らかにするためには、さらなる研究が必要である。免疫細胞がどこでSARS-CoV-2に感染するかにかかわらず、末梢血中の免疫細胞の存在はウイルスの伝播に直接影響を与え、感染ウイルスを二次感染部位に送り込むことができる。
炎症性単球はCOVID-19の免疫病理学において重要な役割を果たしており[15、16]、ICU患者は循環CD14+CD16+炎症性単球のレベルが高く、これは好ましくない転帰と相関している[34、35]。単球によるCCR2および他の炎症性マーカーの発現の増加は、対応するCCL2ケモカインの高発現を伴う組織への浸潤をもたらす[15]。
興味深いことに、重度のCOVID-19患者の気管支肺胞洗浄液には、同じプロファイルを持つ炎症性単球が豊富に存在していた[36]。このことから、我々のデータは、CD14+CCR2+およびCD14+CD16+CCR2+感染単球がトロイの木馬として機能し、SARS-CoV-2が重篤な組織損傷を引き起こす二次感染部位へウイルスを輸送する可能性を示唆している。損傷を受けた組織へのリンパ球の追加的なリクルートは、リンパ球減少症をさらに助長する可能性がある[9]。
全体として、COVID-19患者からの末梢血中のSARS-CoV-2によるリンパ単核細胞の感染は、免疫細胞機能の低下の可能性、および免疫優位の二次感染部位へのウイルスの到達を助けることを含む、この多面的な疾患の病態形成に重要な結果をもたらす。
利益相反
著者は何も宣言していない。
図の凡例
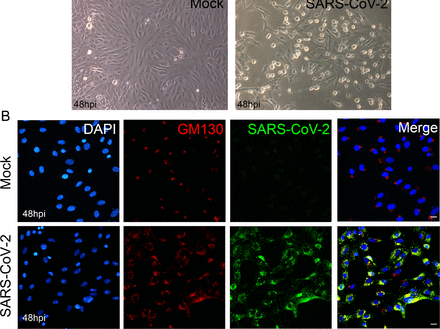
図 S1. ヒトの回復期血清を用いたSARS-CoV-2検出の検証。
Vero細胞をSARS-CoV-2(MOI=1)または模擬感染させ、48時間インキュベートした。A)未感染(左図)とSARS-CoV-2に感染したベロ細胞単層の位相差顕微鏡による細胞病理学的効果を示す。倍率400×。B)SARS-CoV-2に感染したベロ細胞または模擬感染したベロ細胞を固定し、GM130(赤)、ウイルス(緑)および核(DAPI)を染色した48hpiでの免疫蛍光。スケールバー10μm。
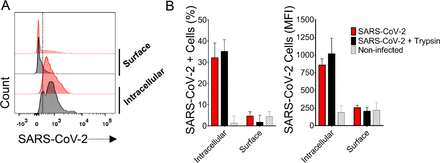
図S2. SARS-CoV-2を標識した健常者からのSARS-CoV-2感染PBMCsのフローサイトメトリー(FC)。
試験管内試験(in vitro)感染した健康なドナー(MOI=1)からのPMBCを、細胞透過の有無にかかわらず、マウスポリクローナル抗SARS-CoV-2を用いてFCで分析した。表面結合ウイルス粒子を除去するためのトリプシン処理は、追加のコントロールとして使用した。A)赤でSARS-CoV-2に感染した細胞と黒でトリプシン処理した感染細胞と、SARS-CoV-2の表面および細胞内染色の代表的なヒストグラム。B)トリプシンで処理した感染細胞とトリプシンで処理していない感染細胞、および非感染細胞の細胞内および表面染色を、左の割合で比較し、右のMFI。
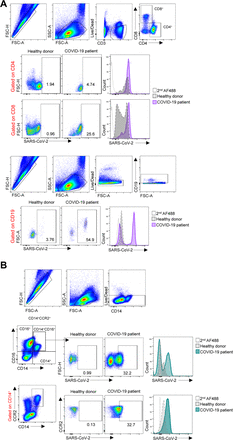
図S3. SARS-CoV-2感染細胞の免疫フェノタイピングに用いたゲーティング戦略。
A)細胞は、最初に、ライブ/デッドAPC/H7およびCD3染色を用いて、ダブレットを除外し、死細胞を除外するためにゲーティングした。次に、生きたTリンパ球におけるSARS-CoV-2抗原の検出を、バックグラウンド二次抗体シグナル(Allexa488)および健康なドナーで得られたシグナルに基づいて定義した(フロープロットおよび代表的なヒストグラム)。CD19+ Bリンパ球についても同様の戦略を用いた。B)生きた単球を、リンパ球について記載したように最初にゲートした。次に、CD14およびCD16の発現を、循環単球亜集団を定義するために使用した。CD14+およびCD14+CD16+細胞によるCCR2の発現を、炎症性単球を定義するために使用した。すべての定義されたサブ集団の中で、SARS-CoV-2抗原の発現を、二次抗体バックグラウンドおよび健康なドナーの染色と比較して定義した(フロープロットおよび代表的なヒストグラム)。
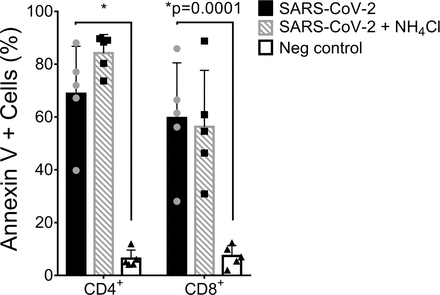
図S4. SARS-CoV-2の試験管内試験(in vitro)感染後の表面にホスファチジルセリン(PS)を
発現するリンパ球の割合。
細胞は、Live/Dead APC/H7染色とは独立して分析した。平均±s.d.を全ての棒グラフで示した。有意性は、一元配置ANOVAにより決定し、ボンフェローニの事後検定を適用した。
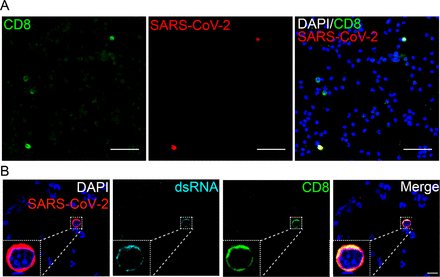
図S5. T CD8リンパ球は、SARS-CoV-2ではほとんど検出されない。
A)COVID-19患者からのPBMCを、ポリリシンで前処理したカバースリップ上に置き、固定し、SARS-CoV-2(赤)、CD8(緑)および核(青)を染色した。カバースリップをエピ蛍光顕微鏡で分析した。倍率400倍。スケールバー20μm。B)CD8細胞におけるdsRNAの検出。PBMCを(a)で述べたように標識し、抗J2抗体を用いてdsRNA(シアン)を検出した。左下にインセットを示す。カバースリップを共焦点顕微鏡で分析した。倍率63倍。スケールバー10μm。
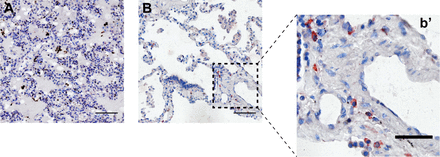
図S6。COVID-19からの死後肺におけるSARS-CoV-2抗原の免疫組織化学。
A)SARS-CoV-2染色のネガティブコントロールとして、2016年に得られたハンタウイルス致死症例からの死後肺断片。B)COVID-19致死例からの肺におけるSARS-CoV-2の染色。(b’) SARS-CoV-2抗原に対する強い細胞質染色を詳細に示す個々の細胞。スケールバー。50μM。
