Increased mTOR activation in idiopathic multicentric Castleman disease
www.ncbi.nlm.nih.gov/pmc/articles/PMC7205815/
オンラインで公開2020年5月7日
キーポイント
iMCDではmTOR経路の活性化が亢進しており、新規治療ターゲットの候補となっている。
iMCDではmTOR活性化が亢進し、mTOR主導の自己免疫性リンパ増殖症候群と同程度になる。
要約
特発性多中心キャッスルマン病(iMCD)は、リンパ節腫脹、全身性炎症、細胞減少、および生命を脅かす多臓器不全を特徴とする稀な血液疾患であり、十分に理解されていない。インターロイキン-6(IL-6)阻害は、患者の約3分の1を効果的に治療する。インターロイキン-6阻害薬が奏効しない患者に対する選択肢は限られているが、その病因、調節障害された細胞型、シグナル伝達経路が不明であるためである。我々は以前に、mTOR活性化が亢進した3例の抗IL-6非奏効例を報告しており、sirolimusによるmTOR阻害に反応した。我々は、iMCD患者と対照者の組織と血清プロテオームにおけるmTORシグナル伝達を調査した。mTOR活性化は、mTORC1活性化のエフェクターとして知られているpS6,p4EBP1,p70S6Kの免疫組織化学(IHC)により、対照リンパ節と比較してiMCDリンパ節(N = 26)の毛包間空間で増加していた。また、pS6のIHCでは、ホジキンリンパ腫、全身性エリテマトーデス、反応性リンパ節と比較してiMCDではmTOR活性化が増加しており、iMCDにおけるmTOR活性化は単なるリンパ増殖/炎症性リンパ節症の産物ではないことが示唆された。さらに、iMCDにおけるmTOR活性化の程度は、自己免疫性リンパ増殖性症候群と同程度であり、sirolimus治療に反応するmTORの過剰活性化によって引き起こされる疾患であることが示唆された。iMCD患者(n = 88)と対照群(n = 42)の血清プロテオームデータの遺伝子セットの濃縮解析では、有意に濃縮されたmTORC1シグナリングが示された。最後に、機能研究の結果、iMCD寛解サンプルから得られた末梢単球とT細胞のベースラインのmTOR経路活性化が健常対照と比較して増加していることが明らかになった。IL-6刺激はiMCD患者のmTOR活性化を増大させたが、JAK1/2阻害によりその活性化は抑制された。これらの知見は、mTOR活性化がiMCDの新規治療標的として支持されており、現在sirolimus(NCT03933904)の試験を通じて研究が進められている。
ビジュアルアブストラクト
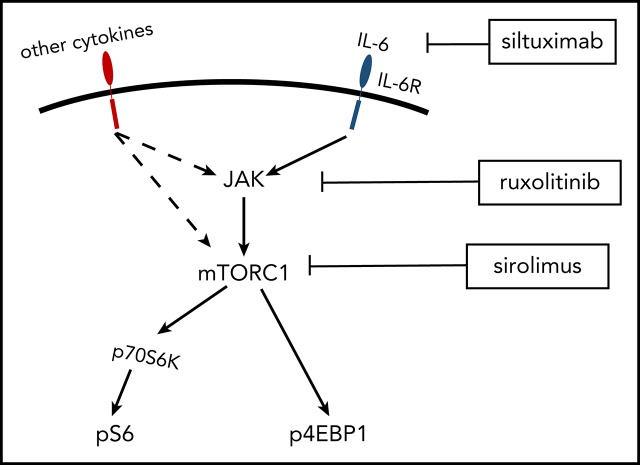
序論
特発性多中心キャッスルマン病(iMCD)は、サイトカイン誘発性リンパ増殖を伴う稀で致命的な血液疾患である1。一部の患者では、血小板減少、アナサーカ、発熱、骨髄線維化、腎機能障害、臓器巨大症、および正常な免疫グロブリン値を呈し、TAFRO(血小板減少、アナサーカ、発熱/上昇したC反応性蛋白、網状筋線維症、腎機能障害、および臓器巨大症)の臨床サブタイプ基準(iMCD-TAFRO)を満たす。その他には、軽度の表現型、血小板症、高ガンマグロブリン血症を示すものもあり、iMCDと呼ばれている(iMCD-NOS)。
iMCDは、3つのサブタイプのキャッスルマン病(CD)の1つであり、異形性生殖中心、拡大したマントルゾーン、過血管性、および毛包間形質細胞症を含む特徴的なリンパ節の病理組織学を示する1。他の2つのサブタイプには、手術で治癒することが多い単心性CD(UCD)2,3 と、制御不能なヒトヘルペスウイルス8(HHV-8)感染による多心性サブタイプ(HHV-8-associated MCD)があり、リツキシマブで良好に制御されている4-6。
インターロイキン-6(IL-6)は、iMCD の一部の症例では病原因子として確立されており7 、抗 IL-6 モノクローナル抗体であるシルツキシマブは、米国食品医薬品局(FDA)が承認している唯一の iMCD 治療薬である8,9 。
最近、3人の抗IL-6抵抗性iMCD患者のサイトカインレベル、末梢血単核細胞、血清プロテオミクスを調査した予備的なデータから、ホスファチジルイノシトール3キナーゼ(PI3K)/Akt/mTORシグナル伝達経路が治療標的の候補として同定された11。11 リンパ節組織の免疫組織化学(IHC)により、この小規模な治療抵抗性患者のmTOR活性化の増加が明らかになり、mTOR阻害剤(mTOR-I)であるシロリムスによる治療は臨床的に有益な反応を誘導した。これらのデータは有望であるが、mTOR-Iを臨床に応用するためには、iMCDにおけるmTOR活性化のより包括的な評価が必要である。
PI3K/Akt/mTORはタンパク質合成、細胞増殖、代謝の中心となるシグナル伝達経路である。mTORはセリン-スレオニンキナーゼであり、mTORC1とmTORC2の2つのタンパク質複合体を介して機能している。mTORC1は、4E-BP1とリボソームタンパク質70S6キナーゼ(70S6K)という2つのよく知られた下流分子を含む複数の経路を介してタンパク質合成と細胞増殖を制御している13。 13 活性化されると、mTORC1は4E-BP1(p4EBP1)と70S6K(p70S6K)をリン酸化し、その後、リボソームタンパク質S6(pS6)をリン酸化する。 14-16 pS6,p70S6K、およびp4EBP1の発現は、mTOR活性化の確立されたリードアウトである。mTORC1の機能は密接にPI3K/Aktとアミノ酸の可用性によって制御され、mTORC2は成長因子に敏感であるが、シロリムスに急性に抵抗性であり、慢性的な投与に部分的に敏感であるのに対し、シロリムスに敏感である。mTORは、増殖、血管新生、T/B細胞活性化を含む多くの細胞過程で活性化される。
mTOR-Is は、ホジキンリンパ腫(HL)全身性エリテマトーデス(SLE)自己免疫性リンパ増殖性症候群(ALPS)など、iMCD と臨床病理学的に重複する治療抵抗性の悪性腫瘍や自己免疫症候群に効果的に使用されている。3 人の患者における予備的なデータ11 と他のリンパ増殖性疾患における mTOR の役割 24-32 に基づいて、我々は iMCD における mTOR シグナルの制御異常と創薬標的の候補であるという仮説を立てた。
この仮説を検証するために、我々はiMCDにおけるmTORシグナル伝達を調査した。その結果、iMCDのリンパ節組織では対照と比較してmTORの活性化が増加していることが明らかになった。HHV-8 は他の疾患において mTOR を直接活性化することが知られているが、本研究は HHV-8 関連の MCD における mTOR の活性化を定量化した初めての研究である。また、iMCDにおけるmTOR活性化は、反応性リンパ節やHLやSLEのリンパ節と比較して増加しており、リンパ節腫脹を伴う可能性があり、mTOR-Isに敏感な2つの疾患である22,23,34,35。さらに、iMCDにおけるmTORの活性化の程度は、mTORの過剰活性化によって駆動されることが知られており、mTOR-Isによる治療に成功したALPSと類似していた21。これらの結果は、iMCDにおける治療標的としてのmTORを支持しており、iMCDにおけるsirolimusを用いた臨床試験(NCT03933904)の開発につながり、他のリンパ増殖性疾患や孤児疾患における個別化医療の発見への道筋を明らかにした。
研究方法
患者サンプル
リンパ節組織サンプルは、ペンシルバニア大学のACCELERATE Natural History Registry(NCT02817997)およびCDバイオバンクの一部として、CD患者から収集した。すべての被験者が書面によるインフォームドコンセントを行い、研究はヘルシンキ宣言および良好な臨床実践ガイドラインの規定に従って、現地の機関審査委員会によって承認された。サンプルは診断リンパ節生検から採取し、ホルマリン固定パラフィン埋込法(FFPE)に従って調達した。各FFPEサンプルに関連する相関臨床データを検索した。臨床データおよび病理組織学的報告のレビューは、CD.1と一致していた。
転移陰性の乳がん患者から切除されたリンパ節組織は、正常対照(センチネル)を表すために選ばれた。センチネル、SLE、ALPS、HL、および反応性リンパ節のサンプルは、ペンシルバニア大学病理部門から調達した。
IHC
厚さ5μmのFFPEリンパ節スライドのIHC染色は、フィラデルフィア小児病院の病理コアで、ライカボンドマックス自動染色システム(ライカバイオシステムズ)を用いて、ボンドインテンスR染色キット(ライカバイオシステムズDS9263)を使用して実施した。各抗体(pS6,p6EBP1,およびp70S6K)の具体的な情報は、補足方法S1.1(血液のウェブサイトで入手可能)に記載されている。スライドを、Aperio ScanSope CS-Oスライドスキャナ(Leica Biosystems)上で、×20倍の倍率でデジタルスキャンした。
生殖中心とマントルゾーン、および毛包間空間を含む各二次卵胞の領域を、盲検でAperio ImageScopeを使用してアノテーションした。アノテーションはその後、2 人目の研究者によって監査および検証された。各 IHC 染色について、Image Analysis Toolkit ソフトウェア(カラーデコンボリューション v9 アルゴリズム)を使用して、ピクセルの染色強度を推定した。各領域について、染色がない、弱い、中程度、および強い領域の割合を取得した。
統計的分析
被験者と対照との間で IHC 染色割合を統計的に比較するために組成分析を行った。プロポーションデータは、セントロメトリック対数比変換を用いて変換した。組成分析は,0から1にバインドされ、1.36-39に合計する複数の割合を比較する場合に最適である。変換の前に、測定値の最大分解能は、プロービング光の波長のために〜1μmであるため,0の割合は、1μm2を注釈領域(μm2の単位で)で割ったものに置き換えられた。
最初に、染色強度を無視して、正に染色された領域と非染色領域の間の単純な比較を実行した(”2組成 “分析)。第二に、総染色割合の有意差を有する比較のために、陰性、弱、中、および強染色の違いを探索した(”4-compositional “分析)。被験者と対照を比較するためにノンパラメトリックMann-Whitney U検定を使用した。我々は、発現の増加があるだろうと先験的に仮説を立てた実験には、1サイドU検定を使用した;これは、センチネルと反応性のコントロールにiMCDを比較する各実験の場合でした。他のすべての比較については、有意差を評価するために2側検定を使用した。効果の大きさの方法論は、補足方法S1.4に示されている。
免疫蛍光とプロテオミクス分析
coimmunofluorescence(coIF)プロテオミクス、およびphospho-flow cytometryの方法論の詳細は、補足的な方法S1に記載されている。
結果
iMCD-TAFROの毛包間空間ではpS6発現が有意に増加している。
mTOR活性化がiMCDリンパ節組織で増加しているという我々の仮説を調べるために、最も重篤な臨床表現型を示すiMCD-TAFRO患者のリンパ節組織におけるpS6のIHCを行った(表1)1。
表1. iMCDコホートの臨床的特徴
| iMCD-TAFRO、コホート1(N = 10) | iMCD-TAFRO、コホート2(N = 10) | iMCD-NOS(N = 6) | |
|---|---|---|---|
| 年齢、y; 平均(範囲) | 30(1-65) | 38(17-67) | 46(30-62) |
| 性別、女性:男性 | 3:7 | 5:5 | 2:4 |
| TAFRO基準、現在/評価済み | |||
| 血小板減少症 | 10/10 | 10/10 | 0/6 |
| 全身浮腫または浮腫 | 10/10 | 10/10 | 0/6 |
| 憲法上の症状 | 10/10 | 10/10 | 6/6 |
| 細網骨髄線維症 | 7/8 | 4/5 | 3/3 |
| 腎機能障害 | 4/10 | 5/10 | 1/6 |
| 肝腫大および/または脾腫 | 8/10 | 10/10 | 3/5 |
| 炎症と臓器機能障害 | |||
| CRP、mg / L | N = 7 | N = 8 | N = 3 |
| 平均(SD) | 140(66) | 134(123) | 89(79) |
| IL-6 / ULN | N = 7 | N = 3 | |
| 平均(SD) | 2.3(1.29) | 7(7) | NA |
| VEGF / ULN | N = 7 | N = 4 | N = 4 |
| 平均(SD) | 4(2) | 8(10) | 3(4) |
| IgG、mg / dL | N = 9 | N = 7 | N = 4 |
| 平均(SD) | 1040(571) | 1500(820) | 3900(2780) |
| アルブミン、g / dL | N = 10 | N = 9 | N = 6 |
| 平均(SD) | 2.5(0.5) | 2.2(0.8) | 3.1(0.8) |
| クレアチニン、mg / dL | N = 10 | N = 10 | N = 6 |
| 平均(SD) | 1.3(0.9) | 1.6(1.3) | 0.9(0.2) |
すべての患者についてすべての症状および検査値が評価されたわけではない;したがって、評価された症状と評価された症状の比率はTAFRO基準で示され、特定のサンプルサイズは、提供された各検査値について示されている。
IgG、免疫グロブリンG;SD、標準偏差;ULN、正常値の上限;VEGF、血管内皮増殖因子。
正に染色された面積に基づいて、pS6発現は、マントルゾーン(P = 0.038)およびiMCD-TAFROリンパ節組織の毛包間空間(P = 0.003)の両方で有意に上昇した。取るに足らないほどの発現の増加が、毛包および生殖細胞中心で観察された(図1A)。次に、毛包間空間におけるiMCD-TAFROとセンチネルリンパ節との間に様々な染色強度の違いがあるかどうかを調べた。同様にiMCD-TAFRO症例では、毛包間空間における中・強染色が有意に高く、mTOR活性化が亢進する方向にシフトしていることがわかった(図1B)。
図1 リンパ節組織におけるpS6染色
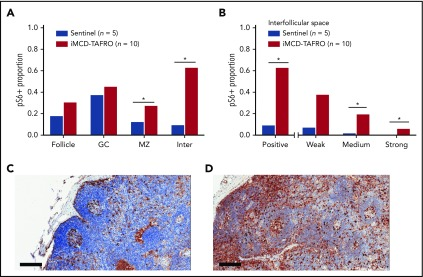
A)センチネルリンパ節の対照群(n = 5)と比較したiMCD-TAFRO患者の最初のコホート(コホート1,n = 10)の異なるリンパ節構造で染色されたpS6領域の割合。アスタリスクで示された統計的有意性は、割合のセントロメトリック対数変換の2成分分析を用いて計算した。マントルゾーン(P = 0.038)および毛包間空間(P = 3.3 × 10-4)においてpS6染色の有意な増加があり、卵胞全体(P = 0.050)および生殖中心(P = 0.19)においては有意ではない増加があった。B)コホート1と対照群の毛包間空間の様々な染色強度の割合の比較。その結果、iMCD-TAFRO症例では、中程度(P=3×10-4)および強程度(P=6×10-4)の染色が有意に高かった。C-D)センチネルリンパ節(C)とiMCD-TAFROリンパ節(D)のpS6(茶色)染色の代表画像。ヘマトキシリンカウンターステインは、細胞および組織の形態を評価するための青い核染色を提供する。スケールバー、200μm。*P < 0.05,**P < 0.01。GC、生殖中心;Inter、毛包間空間;MZ、マントルゾーン。
pS6発現は、iMCDのサブタイプ間で一貫しており、UCDと比較して増加する傾向にある。
最初のiMCD-TAFROコホート(コホート1)でmTOR活性化の増加を実証した後、すべてのCDサブタイプにわたってpS6の発現を研究した。10人のiMCD-TAFRO症例(コホート2)6人のiMCD-NOS、4人のHHV-8関連MCD、7人のUCD症例からなる第2のコホートにおいて、pS6のリンパ節組織発現を比較した。iMCDの両方の臨床サブタイプ、およびHHV-8関連MCDと同様に、pS6の類似の発現があった(図2A)。UCD症例では、iMCD-TAFROとiMCD-NOSを組み合わせたサブグループと比較して、マントルゾーン(P = 0.065)と毛包間空間(P = 0.089)でpS6の染色が減少する傾向が見られた。注目すべきは、iMCD-TAFRO症例のこの別個のコホート(コホート2)からの染色面積の割合は、iMCD-TAFROとセンチネルリンパ節のみを比較した実験では、コホート1と同様であり、前のコホートで観察された増加したmTOR活性化を検証した。
図2 CDサブタイプと他のリンパ増殖性疾患をまたいだpS6染色の比較
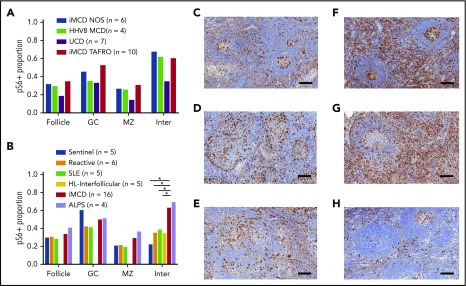
A)異なるCDサブタイプにわたるpS6。iMCD-TAFRO患者の第2コホート(コホート2,n = 10)を、iMCD-NOS(n = 6)HHV-8関連MCD(HHV8 MCD、n = 4)およびUCD(n = 7)と比較した。pS6染色の割合は、iMCDとHHV-8関連MCDの両方の臨床サブタイプで類似していた。iMCDを合併した症例(n = 16)とUCDを合併した症例(n = 4)を比較すると、生殖中心(P = 0.17)マントルゾーン(P = 0.065)および毛包間空間(P = 0.089)のpS6染色の有意な増加は認められなかった。注目すべきは、iMCDとUCDの毛包間空間での発現を比較する1-tailed検定は有意であったであろうが、先験的仮説は、方向性の違いではなく、違いの検定を含んでいた。B)iMCD-TAFRO患者とiMCD-NOS症例の第二コホートを組み合わせて、センチネルリンパ節の対照群、反応性リンパ節の第二の対照群、およびリンパ増殖と炎症性リンパ節症を伴う他の3つの疾患(SLE、HL、およびALPS)と比較した。ALPSとiMCDは同様のpS6染色を有していた;iMCD群は、SLE、HL、反応性リンパ節、センチネルリンパ節と比較して、毛包間空間で有意に高い染色を有していた(P = 0.001,0.01,0.032,および0.019,それぞれ)。C-H)(C)反応性リンパ節、(D)SLE、(E)HL、(F)iMCD-TAFRO、(G)ALPS、および(H)UCDのpS6染色(茶色)リンパ節組織(青色ヘマトキシリンカウンターステイン付き)の代表画像。スケールバー、200μm。*P < 0.05,**P < 0.01。
iMCDにおけるpS6発現はALPSと同様であり、他のリンパ増殖性疾患と比較して増加している。
これらのiMCD患者で観察されたmTOR活性化の増加が非特異的リンパ増殖の産物であるかどうかを評価するために、我々は、反応性リンパ節、iMCDと臨床病理学的に重複することを示し、リンパ増殖(HL)と炎症性リンパ節症(SLE)を含む2つの疾患からのリンパ節、およびmTORの過剰活性化によって駆動され、mTOR-Is(ALPS)でファーストライン治療された1つのリンパ増殖性疾患からのリンパ節に対してiMCDのpS6発現を比較した。 21,23 iMCD-TAFRO(コホート2)とiMCD-NOS間で同様のpS6染色を示した前の結果に基づいて、前の実験で16例のiMCD症例を組み合わせて、SLE5例、HL5例、ALPS4例、反応性6例、およびセンティネル5例と比較した。iMCDリンパ節組織は、反応性リンパ節と比較して毛包間空間でのpS6発現が増加し、他のリンパ増殖性疾患と同様の発現を示すだろうという仮説を立てた。予想通り、反応性リンパ節と比較して、iMCDリンパ節の毛包間空間ではpS6発現が増加していた(P = 0.013)。驚くべきことに、iMCD患者は、HL(P = 0.019)およびSLE(P = 0.032)と比較して、有意に毛包間のpS6発現が増加していた(図2B)。さらに、iMCDにおけるpS6発現のレベルは、ALPSと同様であった。これらの結果の臨床的な相関関係を調べるために、抗IL-6療法に反応性のあるiMCD患者(n = 11)と非反応性の患者(n = 7)のpS6発現を比較した。有意な差はなかったが、非反応者の卵胞ではpS6の染色が増加するという有意でない傾向が見られた(P = 0.097)(補足図1A)。これらの結果は、iMCDにおけるpS6発現の増加、したがってmTORの活性化は、非特異的なリンパ増殖の産物ではなく、iMCDにおけるmTORの病原性の役割を示唆している可能性がある。
他のmTORエフェクターとmTOR活性化のリードアウト、p4EBP1とp70S6Kもまた、iMCDで上昇している。
iMCDにおけるmTOR活性化を直交する方向から調べるために、他の2つのmTORC1活性化のリードアウトであるp4EBP1とp70S6Kの発現を調べた(図3A)。最初の実験では、コホート1の10名のiMCD-TAFRO患者、5名のセンチネルリンパ節、4名の反応性コントロールのリンパ節組織をp4EBP1で染色した(図3B)。染色は、センチネルおよび反応性コントロール群と比較して、毛包間空間のiMCD-TAFRO患者で有意に高かった。p4EBP1染色はまた、反応性リンパ節と比較して、マントルゾーン、生殖細胞中心、および卵胞で有意に増加した。p4EBP1の増加は、最も顕著に毛包間空間で、直交するデータセットを提供し、iMCDにおけるmTOR活性化の増加を示している。
図3 他のmTORエフェクターの検討
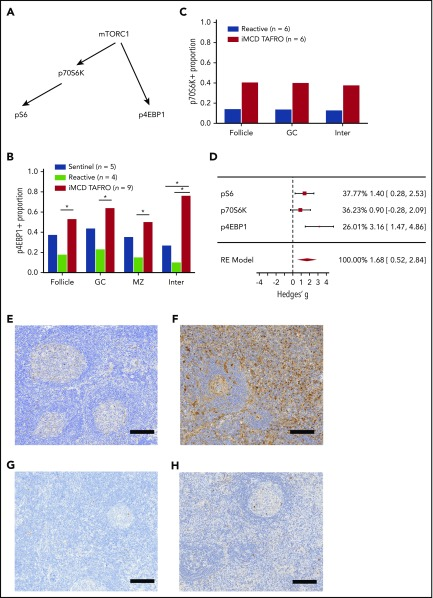
A)mTORC1の3つの主要なエフェクターの簡略化された図。(B) iMCD-TAFRO患者の最初のコホートの異なるリンパ節領域で染色されたp4EBP1面積の割合は、2つの対照群と比較して:反応性とセンチネルリンパ節。濾胞間空間での染色された面積割合は、反応性リンパ節およびセンチネルリンパ節よりも有意に高かった(P = 0.0034および0.0013,それぞれ)。C)iMCD(n = 6)対反応性リンパ節のp70S6K染色面積割合の比較。卵胞、生殖細胞中心、および毛包間空間全体でiMCDのための有意ではない上昇があった(3つの比較すべてでP = 0.17)。D)3つのmTORC1エフェクター間の効果の大きさの比較。iMCD-TAFROと反応性リンパ節の比較について、毛包間空間の3つの染色について、偏差で標準化した平均差を利用した効果量であるHedges’gを算出した。mTOR活性化に関連する効果を検証しているため、3つの結果をランダム効果(RE)モデルで合成した。REモデルによる合成では、1.68 [95% CI, 0.52-2.84, Q(df=2)=4.7, I2 =56%]の有意な効果サイズが得られた。比較のために、個々のpS6実験におけるALPSのためのHedges’ gは1.64 [0.18,3.09]であった。E-F)反応性リンパ節(E)およびiMCD-TAFRO(F)に対するp4EBP1染色(茶色)の代表画像を示す。G-H)反応性リンパ節(G)およびiMCD-TAFRO(H)に対するp70S6K染色(茶色)の代表画像を示す。すべての代表画像は、核染色としてヘマトキシリンカウンターステイン(青)を有する。バー=200μm。*P < 0.05,**P < 0.01。
次に、iMCD-TAFRO患者(コホート1および2の両方の間で分割)からの6つのリンパ節サンプル中のp70S6K発現を、6つの反応性リンパ節と比較して、S6.15をリン酸化する、mTORC1のもう一つの標的であり、mTOR活性化のリードアウトであるp70S6Kを調査した(図3C)。iMCD-TAFRO患者のp70S6K染色領域は、サンプルサイズが小さく、有意ではなかったが、対照群と比較して増加傾向にあった(P =.089)。この結果は、2つの独立したコホートにおけるp4EBP1発現の増加と同様に、pS6発現の増加を示した別の実験の文脈で、mTOR活性化の増加を支持するものである。3つの抗体染色の効果量分析では、3つのすべてに匹敵する効果と、有意な複合効果量が示されている(図3D)。
濾胞間空間の複数の細胞集団が pS6 を発現している
iMCDリンパ節組織の毛包間空間におけるmTOR活性化の増加が明らかになった後、我々はmTOR活性化の増加をもたらす細胞タイプを特定することを試みた。我々は、リンパ節内の位置とiMCDにおけるT細胞の拡大と活性化の報告から、T細胞が毛包間空間におけるpS6+細胞の最大の割合を占めるであろうと仮説を立てた11。サンプルサイズが小さいにもかかわらず、我々は、T細胞などの単一の細胞タイプがpS6の増加に関与しているかどうかを決定することができると期待していた。驚くべきことに、これら4人の患者の毛包間空間におけるpS6+細胞の2%から10%をT細胞が占めていた(図4A)。ほとんどのpS6+細胞はCD45+であり、造血系であることを示していた。実行された細胞特異的染色(CD3,CD20,CD68,およびCD138;図4B)の組み合わせの割合は、CD45+細胞のおおよその割合に加算され、内部的な品質管理を提供した。さらに、活性化されたT細胞、B細胞および血漿細胞上で発現している転写因子MUM1は、T細胞、B細胞および血漿細胞マーカーを合わせたものとほぼ同じ割合のpS6+細胞を有しており、別の内部品質管理を提供した。血漿細胞(CD138;N = 4;P = 0.029)およびマクロファージ(CD68;N = 4;P = 0.029)の割合はともにT細胞よりも高く、B細胞(N = 3;P = 0.10)と比較して増加する傾向にあった。このサンプルサイズは、最も多くのpS6+細胞を代表する細胞タイプを特定するには小さすぐが、これらの結果は、複数の細胞集団がiMCDの毛包間空間でpS6を発現していることを示している。
図4 mTOR活性化が増加した細胞型の同定
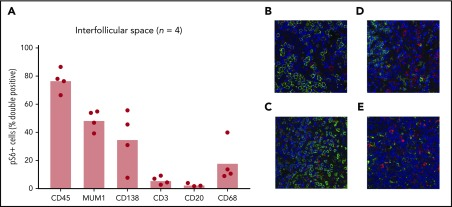
A)CD45,MUM1,CD138,CD3,CD20およびCD68のCo-IFを行い、4つのiMCD-TAFRO症例でpS6を発現する細胞型を同定した(CD20染色は3症例のみ)。代表的な画像(×20)をパネルB-Eに示し、pS6は赤色に、細胞特異的マーカーは緑色に染色した。B)CD138,(C)CD3,(D)CD20,(E)CD68。標識された細胞は、pS6+細胞の割合を評価するために手動で計数した。pS6+細胞の大部分は造血系(CD45+)であった。pS6+細胞のごく一部(2%〜10%)だけがT細胞(CD3+)であった。大部分の細胞は、活性化B細胞、T細胞、血漿細胞に発現する転写因子MUM1を発現していた。また、血漿細胞(CD138+)とマクロファージ(CD68+)もpS6+細胞の大部分を占めていた。
iMCDにおけるmTORC1の血清プロテオーム解析結果
次に、iMCD患者の血清中にmTORC1シグナルが増加しているかどうかを調べるために、直交法を適用した。iMCDは全身性の炎症性疾患であるため、iMCD患者の血清中にはmTORC1シグナルに関連するタンパク質が健常者と比較して濃縮されているのではないかという仮説を立てた。この仮説を検証するために、iMCD患者88名と健常者42名の血清分析物1139種類を定量したプロテオミクス研究のデータをもとに、mTORC1シグナル伝達に特異的な遺伝子セット富化解析(GSEA)を行った。別の研究(S.K.P.とD.C.F. 2020年1月提出原稿)では、これらのプロテオミクスデータを包括的に解析したが、すべてのiMCD患者と健常対照者を比較したmTORC1シグナル伝達経路やその他についてのGSEA解析は含まれていなかった。その結果、iMCD患者ではmTORC1シグナル伝達経路に関与する遺伝子が健常者と比較して有意に濃縮されていた(偽発見率[FDR],0.243)(図5)。これらのデータは、iMCDにおけるmTOR活性化の役割を支持している。
図5 血清プロテオミクスにおけるmTORC1遺伝子セットの濃縮度
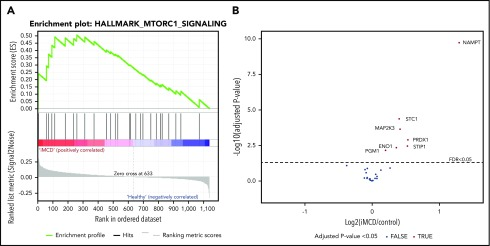
(A)健常対照42名と比較した88名のiMCD患者の血清プロテオミクスデータのGSEA。iMCDでは、mTORC1シグナル伝達経路に関与する遺伝子が、FDR設定値0.25よりも有意に濃縮されていた(FDR,0.243)。このmTORC1シグナル伝達経路の標的化GSEAは、共著者(S.K.P.とD.C.F. 2020年1月提出原稿)が行った包括的なプロテオミクス解析に加えて、mTORC1シグナル伝達経路やその他について、すべてのiMCD患者を健常対照と比較したGSEA解析を行わなかった場合とは別個に行われた。B)SOMAscanプラットフォームで定量したmTORC1遺伝子/タンパク質のiMCD対コントロールのボルケーノプロット。有意性のカットオフを点線で示す(FDR≦0.05)。7つの有意差のある遺伝子はすべて標識されており、健康なコントロールと比較してiMCDで増加している。すべての正の倍変化値は、健康なコントロールと比較してiMCD群で増加しているタンパク質に属する。
iMCD群のpS6+循環単球とT細胞の割合は、ベースラインで増加し、IL-6刺激によりJAK1/2依存的な方法で増加した。
iMCD で観察される mTORC1 活性化の亢進の機序を調べるために、寛解期の iMCD-TAFRO 患者 8 例と健常対照 8 例の末梢血単核球サンプルを用いて機能研究を行った。iMCD患者の中にはIL-6が病原体であり、mTOR活性化を誘導する可能性があることから、末梢血単核球をIL-6で刺激し、CD14+単球、CD4+T細胞、CD8+T細胞のpS6発現をホスホ・フローサイトメトリーで測定した。ベースラインにおいて、iMCD患者のpS6+単球(P = 0.005)とCD4+ T細胞(P = 0.014)の割合は健常対照と比較して増加したが、CD8+ T細胞に差はなかった(P = 0.32)(図6A-C)。IL-6で刺激すると、pS6+細胞の割合はすべての時点でiMCDで有意に高かった。すべての時間ポイントとiMCD/健康なコントロールのメンバーシップを因子として使用して、分散組成分析の二元分析(図6A-C)は、すべての3つの細胞集団のすべてで健康なコントロールと比較してiMCDのpS6+細胞の有意に高い割合があったことを示した。CD14+単球(P = 5.8×10-8)CD4+T細胞(P = 4.6×10-7)およびCD8+T細胞(P = 4.2×10-6)。ベースラインとIL-6刺激の120分間の間のペア分析は、iMCD患者におけるCD4+(P = 0.004)およびCD8+(P = 0.004)のT細胞に対するpS6+細胞の割合が有意に増加し、健常対照では増加しなかったことを明らかにした(図6E-F)。同様の傾向は、iMCD患者のIL-6刺激単球にも見られた(P = 0.13)(図6D)。これらの結果は、IL-6に対する過剰反応性が、iMCDで観察されたmTOR活性化の増加の根底にある可能性を示唆している。
図6 ベースラインおよびIL-6による刺激時のmTORシグナル伝達の増加
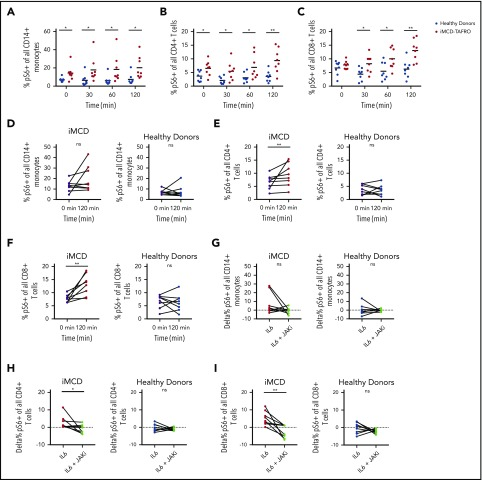
8人の健康なドナーおよび寛解中の8人のiMCD-TAFRO患者からのPBMCを、未処理のまま、25 ng/mLのIL-6で処理したか、またはIL-6およびJAK阻害剤ルキソリチニブ(1μM)で処理した。A-C)健康なドナー(青)と寛解中のiMCD患者(赤)からのCD14+単球(A)CD4+ T細胞(B)およびCD8+ T細胞(C)におけるIL-6を介したS6タンパク質のリン酸化のキネティクス。中心対数変換された割合の分散分析(組成分析)の混合分析は、pS6+細胞の割合は、健康なコントロールと比較して、iMCDの時間測定にわたってCD14+単球(P = 6.0×10-8)CD4+ T細胞(P = 4.6×10-7)およびCD8+ T細胞(P = 4.2×10-6)のために高いことが得られた。また、各時間に特異的な組成分析は、非対照 1-tailed Mann-Whitney U 検定を用いて計算し、有意性はパネル A-C にアスタリスクで示した。(D-F) iMCD患者(赤)と健康なドナーサンプル(青)について、IL-6による刺激の0分(黒)と120分におけるpS6+単球、CD4+T細胞、およびCD8+T細胞の頻度のペア比較。変換された割合のWilcoxon符号付き順位検定からのP値。<1%の確率で<.05(個人のタイプIエラー)を持つ2つのイベントが被験者のみで2回発生し、コントロールではないので、結果は、P値調整近似を必要とせずに統計的に有意であると考えられた。(G-I) iMCD患者および健康なドナーサンプルについて、IL-6単独での治療後、またはIL-6およびJAK阻害剤ルキソリチニブとの治療後のpS6+単球(G)、CD4+T細胞(H)、およびCD8+T細胞(I)の頻度を対にした比較。*P < 0.05, **P < 0.01,Wilcoxon 符号付き順位検定による。
iMCD寛解サンプルにおいて、IL-6媒介によるpS6の増加した誘導が観察されたので、次に、S6のこの増加したリン酸化が、IL-6駆動のSTAT3およびmTORシグナル伝達の確立された媒介者であるJAK1/2シグナル伝達に依存しているかどうかを尋ねた。iMCDと健康なドナー末梢血単核細胞(PBMCs)をJAK1/2阻害剤ルキソリチニブで処理した。iMCDでは、pS6+ CD8+ (P = 0.004)およびCD4+ (P = 0.039) T細胞の頻度の有意な減少が観察され、CD14+ (P = 0.13)単球の有意でない減少が観察された(図6G-I)。健康なドナーPBMCsについては、有意な減少は観察されなかった。これらのデータは、iMCD患者で観察されたmTORシグナル伝達の増加は、JAK依存性IL-6シグナル伝達に対するベースラインの過剰反応によって駆動される可能性があることを示唆している。
考察
本研究は、iMCDにおける病原性シグナル伝達経路の候補を系統的に調査した最初の研究であり、CDリンパ節組織の最大のサンプルが公表されている。また、複数のリンパ増殖性疾患のリンパ節におけるmTOR活性化の比較も初めて発表された。その結果、iMCDリンパ節組織の毛包間空間の細胞では、複数の対照群と比較してmTORC1の2つの主要エフェクター(pS6とp4EBP1)の発現が有意に上昇していることから、mTOR活性化が増加していることが示された。さらに、mTORC1の第三のエフェクターであるp70S6Kの有意でない上昇(P = 0.08)は、より小さなサンプルセット(n = 6)で観察された。24,46 重要なことに、pS6発現はiMCD患者において、反応性リンパ節やHLやSLEのリンパ節と比較しても増加しており、iMCDと臨床病理学的に重複しており、mTOR活性化に関与し、mTOR-Isに敏感であることが知られている2つの疾患であった。これらの結果は、iMCDにおけるmTOR活性化の増加レベルは、単に非特異的なリンパ増殖や炎症の産物ではないことを示している。しかしながら、我々のデータはまた、mTOR活性化がiMCDのみに特異的ではないことを示している。実際、pS6の発現は、mTORの過剰活性化によって駆動され、mTOR-Isに敏感であることが知られているALPSに類似していた。これらのデータは、特に抗IL-6抵抗性のiMCDで観察されたmTOR阻害に対する最近の臨床反応を考慮すると、iMCDにおけるmTOR活性化の類似した病原性の役割を支持するものである。血清プロテオミクスデータに基づくmTORC1シグナルの濃縮度の増加は、iMCDにおけるmTOR活性化の増加をさらに支持するものである。
iMCDにおけるmTOR活性化の亢進のメカニズムを調べるために、IL-6に応答してmTOR活性化を評価した。IL-6は、JAK/STAT3,マイトジェン活性化プロテインキナーゼ、PI3K/Akt/mTORを介してシグナルを伝達する多形性サイトカインであり、iMCD患者の血清中で上昇し、一部の患者ではiMCDのドライバーとして確立されている。しかし、IL-6がiMCDの発症に関与するメカニズムやmTORの活性化のメカニズムは、現在のところ不明である。機能研究では、寛解期にあるiMCD患者のPBMCsにおいて、ベースラインでのmTOR活性化とIL-6刺激に対する反応性の亢進が明らかになった。興味深いことに、JAK1/2の阻害は、IL-6刺激時にiMCDサンプルで観察されたmTOR活性化の増加を抑制することが可能であった。JAK1/2阻害剤がiMCDにおいて果たす役割については、さらなる研究が必要である。
この研究には、いくつかの重要な臨床的意味合いがある。これらのデータは、mTOR活性化の亢進がiMCDでは一般的であり、潜在的な治療標的であることを示唆する我々の予備的なデータを拡張したものである。これらのデータにより、抗IL-6抵抗性のiMCDを対象としたsirolimusの進行中の臨床試験が開始された(NCT03933904)。これは、アンメットニーズの高い患者集団である抗IL-6難治性iMCDの治療薬を対象とした今日までの最初の臨床試験である。さらに、iMCD組織の濾胞間空間におけるmTOR発現の上昇は、iMCDの診断バイオマーカーとして機能する可能性がある。現在のところ、診断用バイオマーカーが存在しないため、診断は非常に困難である。iMCDと病理組織学的に重複する他の疾患との鑑別因子としてのpS6発現を調べるためには、さらなる研究が必要である。本研究のもう一つの重要な臨床的意義は、臨床試験で我々の仮説と一致するデータが得られれば、リンパ節の pS6 染色は、将来的にはシロリムスに対する反応の予測バイオマーカーとして、また、抗IL-6 治療の可能性のある治療法として使用される可能性があるということである。最後に、UCDとiMCDの間でmTOR活性化の違いが見られる傾向は、UCDとiMCDの間で異なる病原性のある細胞内シグナル伝達機構の最初の指標であり、UCDとiMCDを異なる治療アプローチを必要とする可能性のある別の疾患と考えることを支持する。しかし、iMCD群とUCD群には差があるものの、UCDとiMCDの分布はわずかに重複しており、UCD群はmTOR-Isに感受性の高いHLやSLEと同様のpS6発現を示していることに注意が必要である。したがって、UCDにおけるmTOR阻害、特にiMCDでmTOR-Isが活性化された場合には、さらなる研究が必要である。
また、iMCD症例とHHV-8関連のMCD症例との間でmTORの活性化レベルが類似していることから、治療上の意味合いもあると考えられる。最近、mTORC1の阻害因子であるCASTOR1のマイクロRNAによる阻害を介して、HHV-8によるmTORの活性化が起こるメカニズムが明らかになっていた。HHV-8関連MCD、iMCD、ALPSの間で同様のレベルでmTOR活性化が増加していることは、少なくとも3つの理由から重要である。
(1) リツキシマブに失敗した HHV-8 関連 MCD 患者における sirolimus の使用についての更なる研究を示唆するものであること、
(2) HHV-8 関連 MCD と iMCD の間で初めて共有された細胞内シグナル伝達異常と機序的リンクを提供するものであること、
(3) iMCD の将来の研究のための候補遺伝子と microRNA を特定するものであること。
また、これらのデータは、iMCDの病態生理に関する潜在的な知見を提供している。具体的には、iMCD の病理組織学的特徴は、萎縮性または退行性の生殖中心の存在であり、この生殖中心は B 細胞が豊富に存在し、しばしば拡大したマントルゾーンに囲まれている。最近の研究では、正常な生殖中心の形成と発達における mTORの重要な役割が同定されている20 。シロリムスは、本研究で観察されたmTOR活性化の亢進を阻害することでその効果を発揮する可能性があるが、iMCDでは形態異常や制御異常のある胚性中心の形成を阻害している可能性がある。また、生殖中心形成の阻害と高mTOR活性化細胞の阻害の両方がsirolimusの有効性に寄与している可能性も考えられる。iMCDにおけるmTOR活性化と生殖中心の生物学については、さらなる研究が必要である。
mTOR活性化の亢進を明らかに内包している単一のリンパ節細胞型が存在しないことは、驚くべき結果であった。我々は、iMCDにおける循環で活性化されることが知られ、活性化のためにmTORに依存することが知られている毛包間空間の一次的な細胞型であるT細胞が、一次的なpS6+細胞型であると仮定した。さらに、循環T細胞はALPSにおいてmTORの活性化が亢進している細胞集団である。しかしながら、CD3+ T細胞は、iMCD症例のサンプルでは、毛包間空間に存在するpS6+細胞の10%未満であり、この割合はCD138+血漿細胞やCD68+マクロファージよりも有意に低かった。この割合は、CD138+血漿細胞およびCD68+マクロファージよりも有意に低く、連続的なco-IFが可能な十分な組織を有する症例数が限られていたため、最も有意なpS6+染色を有する細胞タイプを自信を持って同定できるほどの大規模なサンプルは得られなかった。MUM1+ pS6+集団の大部分を占めるCD138+血漿細胞とCD68+マクロファージが、pS6+細胞の中央値で2番目に大きな割合を占めていた。本研究で陽性とみなされる閾値以下のT細胞のmTOR活性化レベルは、まだ臨床的に意味のあるものである可能性があり、mTOR阻害はこれらのT細胞に対して治療効果を有する可能性がある。それにもかかわらず、閾値以上のpS6発現を有する細胞の中で、本研究は、iMCDの毛包間空間に複数のpS6+細胞タイプが存在する可能性があることを明らかにした。さらなる研究が必要である。
本研究の最大の限界は、この稀な疾患ではサンプルの調達が困難であり、将来の臨床ケアのために患者組織を保存する必要があるため、サンプルサイズが比較的小さいことである。それにもかかわらず、本研究は、iMCD患者からのリンパ節を体系的に評価した最大の発表されたシリーズである。高品質で臨床的にアノテーションされたサンプルへのアクセスは、希少疾患研究が直面する最大の課題の一つである。Castleman Disease Collaborative NetworkとACCELERATE Natural History Registryを通じた患者と医師のネットワークは、これらのサンプルとデータの調達を可能にした。もう一つの限界は、乳がん患者のセンチネルリンパ節を対照として使用したことである;これらのサンプルは転移や異常の証拠を示さなかったにもかかわらず、健康な集団を真に代表するものではないかもしれない。しかしながら、健常者からリンパ節を摘出することは臨床的に推奨されていない。さらに、これらのサンプルを使用することにバイアスがあるとすれば、乳がん患者に存在する炎症性サイトカインが増加しているため、センチネルリンパ節がmTORの活性化を増加させているのではないかという仮説が立てられる51,52 。関連して、センチネルリンパ節はすべて女性から採取されたものであるため、性差が生じる可能性がある。しかし、我々は、男性と女性のiMCD患者の間でpS6の発現に差がないことを発見した(補足図1B)。もう一つの関連する限界は、iMCDは非常にエピソード性であり、寛解期の患者から組織が切除されていないため、リンパ節のサンプルは活動期の間にのみ利用可能であった。もし将来的にサンプルが得られれば、mTORC1の活性化が疾患活動と類似しているのか、それとも疾患の構成的な側面なのかを知ることができ、有益な情報となるであろう。BAFF、JAK、腫瘍壊死因子型刺激、リンパ節線維芽細胞網状細胞ネットワークの活性化など、PI3K/Akt/mTOR経路の上流の活性化因子の候補についても、今後の研究が必要である。リンパ節線維芽細胞網状細胞ネットワークの活性化とリンパ節の腫瘍壊死因子型刺激は、我々の研究で観察されたようなパターンを生み出す可能性がある53,54。しかし、現在のところ、組織や試薬の入手可能性によって研究は制限されている。
最後に、iMCD症例におけるmTOR活性化の増加は、必ずしもiMCDにおけるmTOR-Isの広範な有効性を意味するものではないことに注意することが重要である。他の上流または下流の経路の調節障害が発生する可能性があり、現在のところ、PI3K、Akt、PKA、またはアミノ酸センシング経路のタンパク質がmTORの上流で調節障害されているかどうかは不明である。さらに、iMCD中の細胞はPI3K/Akt/mTORをバイパスする経路をアップレギュレートまたはダウンレギュレートし、mTOR-Isに対する抵抗性につながる可能性がある。iMCDにおけるmTOR-Isの有効性を示した3人の患者における我々の予備的なデータは、これが作用可能な病原性メカニズムであることを示唆している。さらに、88名のiMCD患者を対象とした大規模な研究で得られた血清プロテオームにおけるmTORC1シグナル伝達遺伝子セットの濃縮は、mTOR活性化がiMCDの病態形成に役割を果たしていることを支持するものである。
本研究で得られた CD の病態生理に関する知見は、sirolimus の臨床試験を通じた直接的な臨床的意味合いと、将来的には CD 患者のための潜在的な意味合いを持っている。本研究の結果に基づいて、新規診断バイオマーカー、sirolimusに対する反応予測バイオマーカー、および新規治療アプローチの可能性について、さらなる検討が必要である。
