Contents
Incomplete Healing as a Cause of Aging: The Role of Mitochondria and the Cell Danger Response
www.ncbi.nlm.nih.gov/pmc/articles/PMC6627909/
ロバート・K・ナヴィオー
要旨
生物学的老化の速度は、環境条件の変化と、それらの変化を感知して対応する発生制御された生物学的システムに応答して、周期的かつエピソード的に変化する。ミトコンドリアと代謝は基本的な調節因子であり、細胞は老化の基本的な単位である。
しかし、老化は解剖学的にはすべてのレベルで起こる。細胞より上のレベルでは、異なる組織の老化は質的、量的、年代的に区別される。例えば、心臓の老化は腎臓よりも早く、またその逆の場合もある。普遍的な老化の2つの多細胞的特徴は以下の通りである。
(1)生理的予備能の低下
(2)細胞と臓器システム間の機能的なコミュニケーションの低下であり、死に至る
予備能力の低下とコミュニケーションの低下は、新しい損傷の後の治癒速度に運動的な制限を課し、非同期的で不完全な治癒をもたらする。
運動はこれらの損失を軽減するが、回復に要する時間は加齢とともに増加し続ける。完全治癒前の再受傷は、治癒の不完全なサイクルを積み重ねることになる。
発達が遅れて停止した細胞は、治癒サイクルを構成する細胞危険応答(CDR1,2,3)の3つの段階に蓄積される。CDRで動けなくなった細胞は、以前は隣接していた、相乗効果のある、代謝的に相互依存していた細胞の間に、物理的、代謝的な分離、つまりコミュニケーションの減少したバッファゾーンを作り出す。
誤った修復や老化細胞が蓄積し、不完全な治癒サイクルが繰り返されることで、老化組織の細胞モザイクが徐々に機能不全に陥っていく。ミトコンドリアと核の間、そしてメタボカインと呼ばれるシグナル分子を介した近隣細胞と遠隔細胞の間の代謝クロストークが、治癒の完全性を調節している。
この過程で重要な役割を果たしているのが、プリン作動性シグナルとスフィンゴ脂質である。治癒サイクルの分子的特徴を背景に見た場合、不完全治癒モデルは老化の特徴を理解するための新たな枠組みを提供し、新たな治療法のための多くの検証可能な仮説を生み出している。
キーワード
細胞危険応答、治癒サイクル、ミトコンドリア、プリン作動性シグナル、メタボカイン、スフィンゴ脂質、統合的細胞ストレス反応、脱酵素、カブリツリー効果、パスター効果
1. はじめに
老化の生物学に関する最も古い文献 [1] や最近の科学論文 [2,3] では、栄養と代謝に重点を置いた研究が行われている。ミトコンドリアは、細胞代謝の車輪のハブに位置している。ミトコンドリアのプロテオームは、組織固有のニーズ[4]に応じて転写および転写後制御されており、約1300個のタンパク質[5]から構成され、傷害[6]、食品の品質[7]、運動[8]、環境汚染[9]に応答し、細胞の危険応答(CDR)[10]を調整する。CDRは2014年に造語された用語であるが[10]、ヒポクラテスの時代(紀元前460~370)以前から研究されてきた炎症と治癒の要素を含む[11]。CDRは進化的に保存された多細胞生物の多系統応答であり、脅威や傷害からの管理や治癒に用いられる。CDRは、電子利用と細胞酸素消費の分子制御から、マイクロバイオーム、肥満細胞、免疫系の変化を経て、自律神経系、腸管神経系、神経内分泌回路に至るまで、入れ子になった層で構成される段階的な応答であり、応答の全身統合に必要とされる。分子レベルおよび単細胞レベルで解析すると、CDRの広く研究されている構成要素は、統合細胞ストレス応答(ICSR)として知られている[12,13,14]。
2. 細胞ストレスの定義
本論文では、「ストレス」という言葉は特定の科学的な意味を持っている。ストレスとは、細胞機能を乱すように作用する力、状態、化学物質、病原体、またはその他の刺激であり、細胞を刺激前の状態または新たな定常状態に戻すためにエネルギーと資源の支出を必要とするものである。驚くべきことに、心理的ストレス、特に早期生活ストレス(ELS)は、微生物病原体、身体的傷害、中毒、および他の多くのタイプの逆境から細胞を防御するために使用されるのと同じ代謝および遺伝子発現ネットワークのいくつかを調節する[15,16,17]。大うつ病性障害の場合、自然免疫/抗炎症遺伝子発現は増加し、適応免疫/抗炎症/抗分解遺伝子発現は減少する [18]。より大きなストレスは、細胞膜チャネルを介して比例してより多くのヌクレオチドと代謝物の放出を刺激し [19]、より大きなメタボカインとプリン作動性シグナル伝達につながる [20,21]。学習と発達は、意識的なストレスと潜在意識的な化学的ストレスの両方から生じる。ストレスは、細胞や組織が以前に遭遇した条件に対する将来の反応を改善するのに役立つ代謝記憶につながる[22]。スーパーオキシドや過酸化水素などの活性酸素種(ROS)一酸化窒素(NO)やペルオキシナイトライト(ONO2-)などの活性窒素種(RNS)活性アルデヒド(RA)溶存酸素そのものなどのミトコンドリアや細胞内の活性酸素源の一過性の増加は、細胞の酸化還元を調節するのに役立つ。レドックスは、次に、レドックス応答性のシステインジスルフィド残基を含む膜チャネルおよびトランスポーターを介して、細胞からの代謝物の流出を調節する [23]。溶存酸素のパルスは、炭水化物を多く含む食事で発生するが、これは、Crabtree効果によって生じるミトコンドリアに対するグルコースの一過性の抑制効果のためである[24]。活性酸素、インスリン、およびIL1βもまた、すべての食事によって自然に刺激され、食事の栄養素含有量に応じてその大きさが変化することがある[25]。細胞内の溶存酸素濃度が上昇すると、パスツール効果により解糖が抑制され、食事に伴うグルコースとクラブツリー効果によるミトコンドリアのオックスホスの無抑制に自然なブレーキがかかるようになる。しかし、グルコース、酸素、活性酸素、ROS、RNS、およびRAは、細胞の反応性、エピジェネティックなマーキング、および遺伝子発現を制御するために使用される多面的な代謝シグナル伝達ネットワークの一部に過ぎない。100以上の化学感覚性Gタンパク質共役受容体は、ストレスや傷害後に放出されるメタボカインやペプチドに反応し、治癒サイクルを調節している[11]。
3. 治癒サイクル
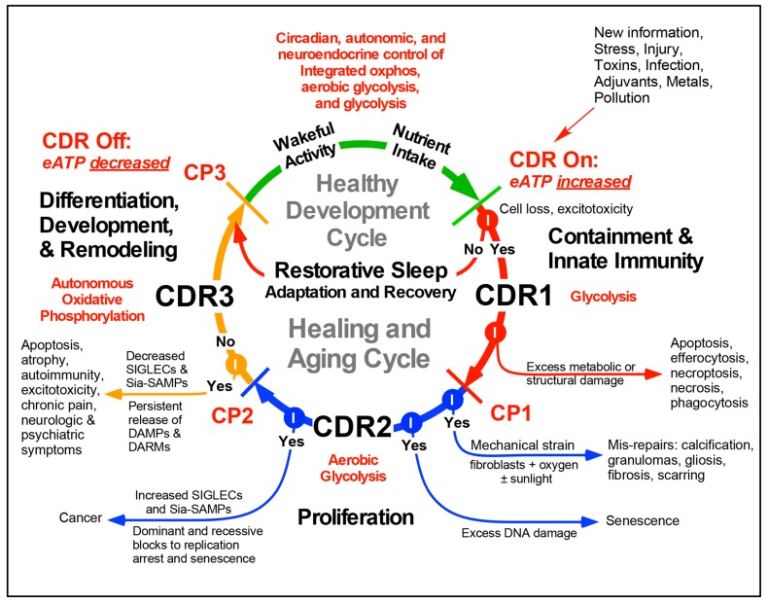
CDR を開始し維持するミトコンドリア応答は、傷害や脅威の後の治癒 [6] や再生 [26] に必要な細胞のバイオエネルギー、酸素利用、酸化還元シグナル伝達、代謝を制御するために使用される。CDRの段階を図1に示す。覚醒した状態での活動と栄養摂取、それに続く回復期の睡眠は、健康に不可欠な要素である。これらの活動は、代謝シグナル伝達によって局所的に制御され、中枢神経系(中枢神経系)によって全身的に制御される3つの代謝状態の統合的な組み合わせを刺激する。健康的な全身機能は、エネルギーと代謝のために、細胞固有の(1)解糖、(2)好気性解糖、(3)酸化的リン酸化の調整と利用を必要とする(図1)。栄養摂取、脳活動、基礎代謝、および自然な子供の遊びや大人の運動から追加された身体活動に関連付けられた化学活動は、細胞外ATPおよび関連するヌクレオチドの段階的な放出につながり、細胞膜内のストレスゲートP2X7-パネキシンおよび他のチャネルを介してグルタミン酸の放出に[27,28] [19]。細胞外に出ると、ATPと関連するヌクレオチドは、プリン作動性シグナル伝達に参加する。ATPおよびADPへの受容体の結合は、IP3-ゲートされた細胞内カルシウム放出につながり[29]、自己分泌および副分泌シグナル伝達経路を介した遺伝子発現の文脈的変化につながる[30]。CD73およびCD39による細胞外代謝の後、ATPはADP、AMP、および過剰な化学刺激を抑制するように作用するアデノシンに変換され、P1/アデノシン/アルツハイマー病ORA A2ARおよびA1R受容体に結合することにより、睡眠の開始および維持に重要な役割を果たしている[31]。これは、図1の回復睡眠サイクルとして図示されている。
図1 健康と癒しのサイクルの代謝の特徴
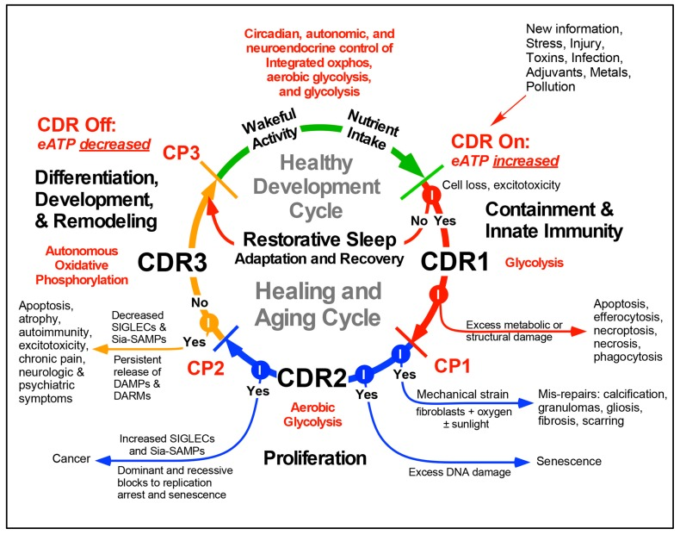
略語。CDR-細胞危険応答、eATP-細胞外ATP、CP1-3-チェックポイント1,2,および3,DAMP-損傷関連分子パターン、DARM-損傷関連反応性代謝物、SIGLEC-シア脂酸結合免疫グロブリン型レクチン、例えば、CD33関連SIGLECs(CD33r-SIGLECs)Sia-SAMP-シアログリカン自己関連分子パターン。
ストレスが細胞死を引き起こすのに十分な大きさの場合、より多くのATPが放出され、プロ炎症性損傷関連分子パターン(DAMP)として作用する。増加した細胞外ATPは、治癒サイクル(図1)のCDR1段階にエントリをトリガする。CDRがトリガされると、3つの異なる代謝段階が治癒するための順序で活性化する必要がある。治癒は、この代謝制御サイクルの活性化なしに発生することはできない。CDR1は、嫌気性解糖のアップレギュレーションと、正常な分化組織機能を犠牲にして、防御、損傷封じ込め、自然免疫、修復のための細胞資源の再配分を特徴としている。損傷によって組織構造が破壊されると、細胞間のギャップジャンクションが減少または消失し、細胞の自律的機能が一義的になり、隣接する細胞間の代謝協力が低下または中断する。血小板や好中球は傷害や感染の部位にリクルートされる。CDR2は好気性解糖を利用して、CDR1で失われた細胞のバイオマス置換に必要な幹細胞のリクルートと細胞分裂をサポートする。細胞損失が置換されない場合、加齢に伴う萎縮およびサルコペニアが発生する。CDR2で細胞に過剰なDNA損傷が持続すると、複製性の老化が起こる[32]。老化へのブロックが破壊されると、癌が発生する可能性がある。酸素レベルが高く、かなりの機械的緊張が存在する場合、組織の線維化または創傷瘢痕化が刺激される(図1)。線維化は、老化の症状[33,34,35]に寄与するいくつかの異なるタイプの誤修復のうちの1つである(図1,図2,図3)。
図2
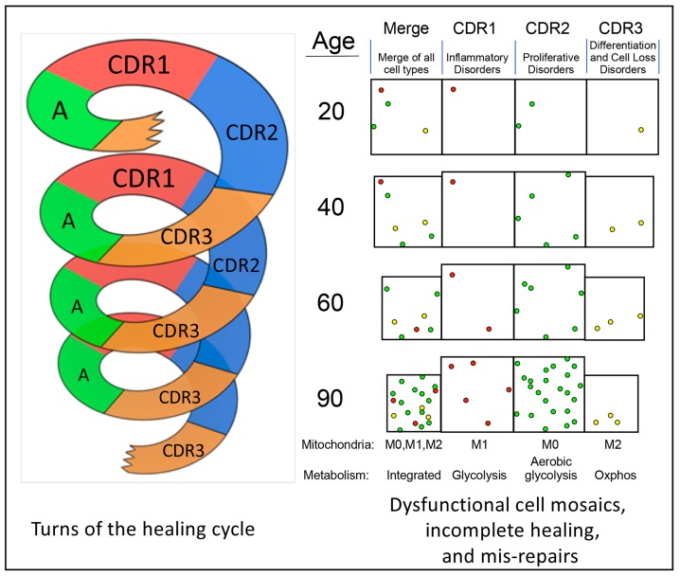
不完全な治癒のサイクルが繰り返されると、老化や加齢に伴う病気につながる。螺旋は、生涯を通じた治癒サイクルの連続的な回転を表している。右側のボックス内の色のついた細胞は、治癒サイクルのある段階で遅延したり、停止したりしている細胞を表している。いくつかの箱のサイズが小さくなっているのは、細胞の損失と萎縮による組織の容積の損失を表している。この例では、60年後と90年後の右のマージでは、ほとんどの逮捕または遅延した細胞はCDR2(緑)にある。これにより、糖尿病、心臓病、癌などの増殖性障害のリスクが高まることになる。カラーコードである。CDR1細胞-赤、CDR2細胞-緑、CDR3細胞-黄。略語。A-覚醒時の活動量と栄養摂取量。細胞防御、活性酸素、窒素、アルデヒド産生に適応したM1-ミトコンドリア、細胞増殖とWarburg代謝に適応したM0-ミトコンドリア、酸化的リン酸化(oxphos)に適応したM2-ミトコンドリア。
図3 不完全治癒と細胞危険応答の自然産物としての老化の証[3,39]

黒いフォント:老化に反対する特徴。赤色のフォント:老化を促進する特徴。略語。CDR-細胞危険応答、IGR-統合細胞ストレス応答、DDR-DNA損傷応答、BMR-基底代謝率、T°-基底体温、HIF1α-hypoxia inducible factor 1α、PARP-ポリADPリボースポリメラーゼ。NAD+-ニコチンアミド-アデニンジヌクレオチド、ADPR-アデノシン二リン酸リボース、SAM-S-アデノシルメチオニン、AcCoA-アセチルCoA、α-KG-αケトグルタル酸塩、SAH-S-アデノシルホモシステイン、PPi-ピロリン酸塩、NUDIX-ヌクレオシド二リン酸Xヒドロラーゼ、e. g., NUDT5,ECM-細胞外マトリックス。
CDR3では、CDR2で生まれた新しい細胞が回復した組織に定着し、CDR1およびCDR2で防御および成長に使用される遺伝子発現プログラムを消滅させ、正常な分化した細胞、組織および器官の機能を回復させるために必要とされる新しい組織特異的接触およびギャップジャンクションを確立すると、ミトコンドリアの酸化的リン酸化による細胞の自律的な好気性代謝が徐々に回復する。ダメージ関連分子パターン(DAMP)およびダメージ関連反応性代謝物(DARM)の放出が持続する場合[36]、または活性酸素産生が早期に消滅する場合[37]、自己免疫を発症する可能性がある[38]。適応免疫応答はCDR3で制御されている。持続的なDAMPおよびDARMの放出は、治癒細胞の非同期モザイク内のCDR1およびCDR2の段階にある細胞の興奮毒性を刺激することができる。CDR3が完了すると、細胞外空間におけるメタボカインおよびDAMPSの濃度は、細胞の特殊化の回復および代謝的に最適化された細胞ネットワークへの細胞の再統合に適合するレベルまで積極的に減少する。再統合と再専門化は、覚醒活動と回復期の睡眠の概日パターンへの応答性を再確立するために、最近CDRから抜け出した細胞に必要である(図1)。
治癒サイクルのシーケンスと段階は高度に保存されており、厳密に振り付けられている。病理的ストレスや細胞死が発生すると、治癒サイクルの同じ段階が活性化され、回復可能な損傷の後も正常な機能が回復する(図2)。必然的に、一部の細胞は治癒サイクルを完了することができず、サイクルのターンのたびに取り残される。これらの停止した細胞や遅延した細胞は、正常な代謝や、分化した細胞や臓器の機能を最大限に発揮させるために必要な遺伝子発現パターンに戻ることができない(図2)。治癒サイクルの不完全な段階で非分化細胞や線維化などの誤修復が蓄積されると、組織のピーク性能が時間の経過とともに低下し、加齢性疾患のリスクが高まる。
4. ミトコンドリアの3つの機能的に分極された形態がCDRに利用されている
60年以上前から、ミトコンドリアは、酸化的リン酸化によるエネルギー生産から活性酸素生産に移行したり、炭素骨格を燃焼してCO2と水に変換したり、新しい炭素骨格を合成して細胞の成長に必要なビルディングブロックとして輸出するように移行したりすると、「損傷している」または「機能不全」と考えられていた。しかし、ミトコンドリアは生涯を通じてこれらの状態の間を定期的に、そして必然的ミトコンドリアの代替的な分化状態を理解するための簡単な方法は、ミトコンドリアを、食物中の炭素-炭素結合を分解することで得られる電子の代謝ゲートキーパーと見なすことである。このスキームでは、ミトコンドリアで電子を利用することができる。1)完全に細胞の危険な応答の第三段階であるCDR3と健康状態で酸化的リン酸化によってATPを作るために放出された化学エネルギーを取り込みながら、水(H2O)に酸素(O2)を減らすために、(2)部分的にスーパーオキシドラジカル(O2-)と過酸化水素(H2O2)に酸素を減らすためにCDR1と細胞防御のATP合成のための嫌気性解糖に頼っている間。または(3)電子を使用して新しい炭素-炭素結合を合成して、細胞膜脂質合成のためのクエン酸塩、ピリミジン合成のためのオロチン酸などのビルディングブロックを生産し、輸出するために、まだ水を作るために酸素を消費しながら、CDR2と細胞の成長における好気的な解糖によってATPを作る(図1)。
新しい命名法は、CDRのミトコンドリアのこれら3つの、機能的に分極された形態を記述するために2017年に導入された[11,29]。ミトコンドリアの3つの「種」はすべて、すべての多細胞生物の発生と老化を通して、細胞内に異なる割合で共存している。状態間の遷移は、栄養と代謝の相互作用、生物の発生と年代、細胞の危険信号と治癒の最近の状態、および周囲の環境条件によって決定される。ミトコンドリアの分化状態の命名は、M1マクロファージとして知られるマクロファージのプロ炎症性状態が、そのミトコンドリアの活性酸素産生能力と解糖によるエネルギー産生に対応しているという認識に基づいていた[40]。抗炎症性/プロ分解性のM2マクロファージは、酸化的リン酸化に適応したミトコンドリアを含んでいることが判明した(Oxphos)。M0マクロファージは、まだ完全なM1またはM2表現型にコミットしておらず、M1とM2の中間的なミトコンドリアを含んでいる。治癒サイクルでは、CDRの各段階の専門的なニーズを満たすために、3つの異なるミトコンドリア分化状態が使用される。CDR1ではM1ミトコンドリアが使用される。M0ミトコンドリアはCDR2で使用され、M2ミトコンドリアはCDR3で使用される(図1および図2,表1)。
表1 動物細胞ミトコンドリアの表現型特性
| 番号。 | 特性 | ミトコンドリア表現型[ 40、41、43 ] | ||
|---|---|---|---|---|
| M0 | M1 | M2 | ||
| 1 | 細胞のエネルギー代謝 | 好気性解糖 | 解糖 | 酸化的リン酸化 |
| 2 | ミトコンドリアDNAのコピー数 | 中級 | 低 | 高い |
| 3 | 優勢な形態 | 中級 | 点状 | フィラメント状 |
| 4 | 細胞複製の可能性 | 高(ウォーバーグ) | 中級 | 低 |
| 5 | 細胞の多系統再生の可能性 | 高い | 低 | 低 |
| 6 | 細胞分化の可能性 | 低 | 中級 | 高い |
| 7 | 細胞がんの可能性 | 高い | 中級 | 低 |
| 8 | 炎症の可能性 | 中級 | 高い | 低 |
| 9 | アポトーシスによる死滅に対する細胞の感受性 | 低 | 中級 | 高い |
| 10 | 誘導性オルガネラ品質管理 | 中級 | 低 | 高い |
| 11 | ベースラインの酸素消費量 | 低 | 低 | 高い |
| 12 | ベースラインを超えるストレス(非結合)酸素消費量(予備呼吸容量) | 中級 | 低 | 高い |
| 13 | ROSプロダクション | 中級 | 高い | 低 |
| 14 | NLRP3インフラマソームアセンブリ | 低 | 高い | 低 |
| 15 | 細胞からの乳酸放出 | 中級 | 高い | 低 |
| 16 | ペントースリン酸経路(PPP) | 高-生合成と細胞増殖のためのNADPH | 中級-NOXのNADPH | 中級-レドックスのNADPH |
| 17 | 脂肪酸酸化(FAO)の使用 | 成長のための脂肪酸合成> FAO | ROSおよびNLRP3アクティベーションの場合 | oxphosの場合 |
| 18 | ブドウ糖の使用 | 解糖とPPP | 解糖と乳酸の放出 | 酸化的リン酸化のためのPPPとピルビン酸 |
| 19 | グルタミンの使用 | 高:ATPクエン酸リアーゼおよびアセチルCoAのクエン酸 | 低 | 高:α-ケトグルタル酸を介した酸化的リン酸化 |
| 20 | 治癒サイクルと細胞危険応答における最大の使用段階 | CDR2 | CDR1 | CDR3 |
試験管内試験プロトコルは最近、ミトコンドリアの表現型に基づいて実験的にM1,M0,およびM2マクロファージを区別することが開発されている[41]。M1ミトコンドリアは少量の酸素を消費し、予備呼吸能力(SRC、または生理的予備能力)が低く、脂肪酸をROS産生およびNLRP3アセンブリに利用でき[42]、グルタミンに依存しておらず、M1ミトコンドリアを含む細胞は多量の乳酸を産生する。対照的に、M2ミトコンドリアはベースラインでより多くの酸素を消費し、ピルビン酸に酸化されたグルコースと脂肪酸の両方をオックスホスに使用することができ、より高いSRCを有し、完全に分化した表現型のためにグルタミンに依存しており、細胞は少量の酸を産生する。M0,非コミットまたは多能性ミトコンドリアは、M1と同様に低い基底酸素消費量を持ち、NADPHとビルディングブロック産生のために一部のグルコースをペントースリン酸経路(PPP)にシャントし、M2とM1の間の中間のSRCを持ち、M2と同様に少量の細胞外酸を産生する[41] (表1)。
M0,M1,およびM2ミトコンドリアの表現型は、固体組織でも発生し、形態学的基準によって部分的に認識することができる。ミトコンドリアは、スパゲッティ(糸状)およびミートボール(パンク状)の勾配に沿って分布しているように非公式に記述することができる。M2のミトコンドリアは糸状であり、相互に連結しており、分裂後の組織やゆっくりと再生する組織で優勢である。M1ミトコンドリアはパンク状であり、M0ミトコンドリアは中間的な形態であり、短いフィラメントとパンク状の小器官の両方がプロテオバクテリアの祖先のコッカス菌の形態を連想させる[44]。ミトコンドリアの融合・分裂ダイナミクスは、細胞の成長と代謝特性に応じて、融合・伸長したミトコンドリアと断片化・分裂したミトコンドリアのバランスを自然に調節している[45]。化学療法剤や毒素に曝露された後に生存する細胞では、M0,未コミット、または茎状のミトコンドリアが優勢である[46]。このような条件下でのM2ミトコンドリアは、DRP1依存性の分裂/分断によって枯渇し、アポトーシスによって細胞が除去される前にM1オルガネラへと変換される。リポ多糖(LPS)やインターフェロンγ(IFN-γ)などの炎症性誘因による治療前後の脳アストログリアでも、ミトコンドリアの構造と機能の類似した変化が容易に示されている[43]。
ミトコンドリアの総バイオマスは、毒素[46]、身体的傷害[6]、感染、または治癒サイクルを活性化するトリガー[11]によって細胞危険応答(CDR)を誘発した後、自然に減少する。ミトコンドリアバイオマスはまた、ミトコンドリアポリメラーゼγ(POLG1)のD1135A対立遺伝子のドミナントネガティブ発現によって実験的に減少させることができ、ミトコンドリアDNAコピー数を約50%減少させることができる[47]。このマウスモデルは、老化のよく知られた特徴であるミトコンドリアの欠陥を模倣している [48]。このモデルで発見された老化の表現型には、NF-κBおよびマトリックスメタロプロテアーゼ9(MMP9)発現の増加、炎症の増加、シミ、しわのある皮膚、および早発性脱毛が含まれていた。これらの転写および解剖学的な老化の徴候は、mtDNA合成のブロックを解除し、正常なmtDNAコピー数を回復させることにより、マウスでは治療後1ヵ月以内に逆転した[47]。
5. ヌクレオチドとプリン作動性シグナリングの重要性
推定1300個のミトコンドリアタンパク質をコードする遺伝子のうち、1158個がMitoCarta v2.0でカタログ化されている[5]。13個のミトコンドリアタンパク質のみがミトコンドリアDNA(mtDNA)によってコードされている。残りの1145個は、組織特異的な遺伝子発現プログラムに従う核内遺伝子によってコードされている。少なくとも789個のミトコンドリアタンパク質(1158個の68%)は、酵素コミッション(EC)番号が割り当てられた触媒機能を有する酵素であるか、または呼吸鎖複合体I、II、III、IV、およびVのような多タンパク質酵素複合体のサブユニットをコードするか、またはATPを使用するトランスポーター、またはキナーゼである(表S1)。これらのタンパク質の少なくとも433個(789個のうち55%)は、ATP、GTP、UTP、NAD(P)+、または家族性アルツハイマー病などのプリンおよびピリミジンヌクレオチドの利用可能性によって、基質として、またはアロステリック調節因子として調節される(表S1)。ヌクレオチドほどミトコンドリアプロテオームを制御している分子は他にない。さらに、核内ミトコンドリア遺伝子の未知の部分は、全組織に広く分布する12個のGタンパク質共役受容体(GPCR;4個のP1Rおよび8個のP2YR)および7個のイオントロピー性受容体(P2XR)を介したプリン作動性シグナル伝達によって転写的および後転写的に制御されている[49]。いくつかのプリン受容体は、ミトコンドリア、リソソーム、核などの細胞内コンパートメントにも発現している[50]。例えば、P2X6受容体は、年齢に依存して核に転座し、mRNAスプライシング因子3A1と相互作用し、mRNA処理を低下させ、老化に寄与している[51]。
6. 治癒と老化における栄養の重要性
子供の発育、人間の老化、および運動能力の異なる段階では、それぞれの段階で最高の結果をもたらす異なる特定の栄養素とカロリーを持っている[52,53,54]。M1,M0,およびM2オルガネラ(表1)間のミトコンドリア基質嗜好の測定された違いに基づいて、それは治癒サイクルの各ステージ-図1のCDR 1,2,および3,さらにはCDR [11]の3つのステージのいずれかで立ち往生した特定の慢性疾患-も、最適な結果のための異なるステージ固有の栄養ニーズを持つことになるという仮説が立てられている。基質供給とメタボカイン[11]を介した代謝物シグナリングからの化学的質量作用の両方が、メカニズム論的に重要である可能性が高い。老化、ミトコンドリア、および治癒と栄養を結びつける最も広範な手がかりのいくつかは、カロリー制限の研究から得られている[3]。自然老化は、ミトコンドリアのターンオーバー速度の低下(ミトコンドリア生合成、または「ミトコンドリア生合成」)およびミトコンドリアタンパク質合成、ミトコンドリアバイオマス、呼吸予備能、およびオックスホス機能の低下をもたらす[55](図3)。一方、カロリー制限は、AMPK刺激オートファジーおよびマイトファジーに関連する経路を介してミトコンドリアのターンオーバーを刺激する[56]。これは、改善されたミトコンドリアの品質管理、オックスホス機能、および予備能につながるが、mtDNAコピー数として測定されるミトコンドリア全体のバイオマスを増加させない[57]。カロリー制限はまた、循環甲状腺ホルモンの減少、安静時エネルギー消費量(REE)の減少、およびIGFI、インスリン、ヒト成長ホルモン、テストステロンなどの循環同化ホルモンの減少をもたらす[58]。進化の観点から見ると、この代謝低下反応は、季節的な苦難の時期の体重減少に対抗しながら、消費されるカロリーを少なくすることを可能にする。
カロリー制限は、線虫Caenorhabditis elegansのダウアーと呼ばれる可逆的でストレス耐性のある非生産的な段階の古典的なトリガーである。ダウアーは多くの長寿遺伝子の発見の源となっており、寿命と健康寿命の延長の違いについての生産的な議論を刺激してきた [59]。ダウアーは、通常の寿命である2週間の代わりに、過酷な環境下で最大4ヶ月間生きることを可能にする。しかし、ダウアーでの長寿は、機能の大幅な低下と、感覚解剖学[60]、反復行動[61]、代謝[62]の変化に関連した多くの変化を犠牲にしている。カロリーは、ダウアーで動物に復元されると、彼らはステージを終了し、彼らは、彼らがダウアー[63]で過ごした時間の間に生物学的老化が発生していなかったかのように、彼らが去った場所を拾って、彼らの通常のライフサイクルを再入力する。
栄養供給におけるより特異的な変化もまた、老化と治癒に重要な役割を果たしている。マウスの1日のカロリー摂取量の約1%に相当する1.5g/kg/日のレベルでの枝鎖アミノ酸の食事補給は、寿命を約10%延長することが示されている[64]。この効果には、内皮一酸化窒素合成酵素(eNOS)による一酸化窒素(NO)の正常な産生が必要であった[64]。分岐鎖アミノ酸を含む必須アミノ酸(EAAs)を化学量論的に混合したものを選択的に添加しても、形質転換した細胞では増殖抑制とアポトーシスを促進するが、正常細胞では促進しないことから、抗がん作用があるとされている[65]。また、EAAは初期の段階では炎症を緩和し、治癒の後期では組織のリモデリングに必要なTGFβを維持することで創傷治癒を促進した[66]。この後期の効果は、ここで紹介するモデルではCDR3と呼ばれるものにある(図1)。興味深いことに、TGF β (DAF-7) シグナルは、C. elegansにおけるダウアーからの回復と正常な発生の再確立においても重要な役割を果たしている[67]。
7. 漸進的に機能不全に陥った細胞モザイク
70kgの成人男性の核化細胞の数は約5×1012である。非核化赤血球は5倍の量(2.5×1013)であるが、成人の総質量のわずか6.5%を占めるだけである[68]。成人のヒト細胞の総数は3.0×1013である。また、典型的な成人の体内には3.8×1013個の細菌細胞が存在する[68]。細胞は毎日死滅し、入れ替わる必要がある。成人はアポトーシス[69]によって、約1×1010(100億個;約10グラム)の細胞を1日あたり1個めくっていると推定されている。これは、アポトーシスによって除去される核化細胞の約500個に1個/日に相当する。細胞のターンオーバーの分布は非常に不均一である。ほとんどの自然死、または生理学的な細胞死は、骨髄、腸、皮膚、毛包などの短命細胞で発生するが、その機能は、継続的な細胞増殖と用途に依存した細胞の起源のコンパートメントからの除去または排出によって生じる組織構造の空間的変化に寛容である。これらの急速に分裂し、構造的に可鍛性のある組織は、年に数回ターンオーバーすることができ、これらのコンパートメント内の細胞のほぼ100%が数日から数週間または数ヶ月でターンオーバーする。他の組織は、よりゆっくりとターンオーバーする。脂肪組織は年に10%の割合で細胞が入れ替わる[70]が、約10年で完全にターンオーバーする。骨格筋は年間6.6%の割合でターンオーバーする [71]。筋繊維の喪失は60歳を過ぎると加速し、サルコペニアに至る[72]。腎臓の体重はそれぞれ約150グラムで、約1.7×106個/日の上皮細胞が尿中に排出される [73] が、この損失およびその他の損失は、リクルートされた幹細胞からの細胞分裂およびリモデリングによって置換される [74]。成人肝臓の重量は約1400グラムで、約2.4×1011個の細胞からなり、若い成人では年間約1.8%の細胞が入れ替わるが、年齢とともに肝臓の大きさが小さくなるにつれて入れ替わる細胞は少なくなる[75]。心臓の細胞は25歳で年間1%の割合で入れ替わるが、75歳では年間0.45%に低下する [76] 、膵島のβ細胞は寿命が長く、30歳を過ぎると入れ替わらない [77]。
身体的傷害、毒素、または感染症への曝露は、上述の生理学的細胞死の基礎レベルに病理学的細胞死を加える。細胞がアポトーシスによって生理的に死滅すると、CDR1に関連する炎症反応は回避される。その代わりに、組織は、失われた細胞を置換し、正常な代謝および組織特異的な遺伝子発現パターンを回復するために、CDR2およびCDR3にスキップする(図1)。典型的なウイルスまたは細菌感染の間に病理学的に死ぬ細胞の数は、微生物病原体のタイプおよび感染の重症度に依存するが、典型的な感染の過程で失われた正確な細胞数は知られていない。平均的な小児では、最初の5年間は毎年5~6回のウイルス感染または細菌感染が認められ、その後は成人期を通じて毎年2~3回の感染が認められている[78]。感染、毒素、または傷害によって引き起こされる病理学的細胞死は、CDR1を活性化することによって炎症を誘発し、治癒サイクルに入る。思考実験として、アポトーシスによる1日あたりの基底損失に等しい数である1×1010個の細胞(約10グラム、またはティースプーン2杯)を殺す可能性のある全身性ウイルス感染を想像することができる。体細胞のDNA突然変異率は、細胞分裂あたりの典型的な10,000bp、タンパク質をコードする遺伝子座あたり約2.7×10-5である[79]。この例では、治癒サイクルが1回転すると、27万個の細胞(1010個の細胞が入れ替わる×2.7×10-5変異/遺伝子/分裂=27万個の細胞)が、その細胞を組織内の隣の細胞とは異なる細胞としてマークする突然変異を維持することになる。有糸分裂的な組換えエラーや染色体のマイクロアネロディ [80]、リクルートされた幹細胞におけるレトロエレメント [81]や内因性レトロウイルス [82]の動員、潜伏DNAウイルス感染の再活性化と抑制サイクル [83]などが、生涯にわたるCDRの反復的な活性化によって生じる遺伝的変異に寄与するだろう。DNAの突然変異に加えて、細胞の発生に変化をもたらす転写、転写後、代謝の特徴に、より多くの誘導的で確率的な変化が生じることになる。
治癒サイクルの一回転ごとに、好中球などの細胞は毛細血管から組織内に移動し、NOX2などの活性化されたNADPH酸化酵素を介して活性酸素を放出する。時間の経過とともに、この周期的なプロセスは、活性酸素、代謝、自然免疫、炎症性防御の潮の流れを作り出し、これらは怪我をすると上昇し、健康な状態になると下降し、治癒サイクルのターンのたびに潮の満ち引きを繰り返する。シアル酸結合免疫グロブリン型レクチン(SIGLECs)には、好中球、ナチュラルキラー(NK)マクロファージ、およびT細胞上で発現するCD33関連分子が含まれ、これらの分子は、シア-SAMPs(シアログリカン自己関連分子パターン)への結合時に、活性酸素産生、自然免疫細胞、および適応性T細胞活性を調節する [84]。種を超えて、CD33r-SIGLEC遺伝子の数は「ウェルダーリー」の健康的な老化と関連しており、数の減少はマウスモデルにおいて加齢に関連した症状を加速させる [85]。多くの癌は、SIGLEC-9などの抑制性SIGLECを関与させることにより、免疫応答を減衰させる効果を有する超巨大化した細胞場から出現する[86]。組織区画への自然免疫細胞の移動と組織区画からの移動の絶え間ない潮汐または波は、治癒サイクルの一回転ごとに、生涯を通じて継続し(図1および図2)図2に示されているような進行性の機能不全のモザイクに寄与している。
脳では、グリア-リンパ系(グリンパ系)の潮汐流の代償システムが、代謝の概日変化によって制御される細胞量の調節された変化によって発生する[87]。このグリンパ性潮流の毎日のサイクルは、CDR活性化の副産物として蓄積されるタウとβアミロイドの凝集体を除去するのに役立つが、これは通常の学習や、加齢とともに徐々に増加するミクログリアやシナプトソームの自然免疫活性化からの副産物である。興味深いことに、mTORやCDRの他の代謝面を制御する多くの分子が、最近、動物モデルでアルツハイマー型認知症の加齢に関連するマーカーから保護すると同時に、老化プロセスを遅らせ、長寿を延長することが発見されている[88]。これらの「ジェロニューロ保護」薬は、クルクミンやフィセチンなどのポリフェノールに類似した植物由来の天然物であった。これらの薬剤の治癒サイクルを促進する特性は、これらの薬剤がタンパク質マーカーに特異的に作用しなかったにもかかわらず、アルツハイマー型認知症のタウおよびβアミロイドマーカーの蓄積を抑制した[88]。
老化における自然免疫活性化と治癒の重要性は、ヴェルナー症候群における最近の発見によって強調されている。ヴェルナー症候群は、ヴェルナーヘリカーゼ(WRN)の変異によって引き起こされる劣性遺伝性の成人早老症症候群である。WRNの突然変異によるゲノム不安定性に加えて、このタンパク質は、ケモカインIL8のNF-κB依存性発現の転写コアクチベーターとして、自然免疫において重要な役割を果たしていることが最近発見された[89]。ヴェルナー変異はNF-κBおよびIL8依存性の活性酸素産生を阻害する。活性酸素産生は、効果的なCDR1(図1)の必須要素であるだけでなく、長期的な抗酸化防御および解毒防御のNRF2誘導にも重要である[90]。さらに、WRNタンパク質は、CDR2の間、組織再生[26]に必要なHIF1の安定化[91]に重要である(図1)。
治癒サイクルの各ターンでは、転写および代謝変化とDNA損傷応答の誘導された組み合わせにより、一部の損傷を受けた細胞および新たに置換された細胞は、サイクルの正常な段階を完了することができなくなる。病的細胞死の後に交換されなければならない1010個の細胞のうち、おそらく0~100万個の細胞が、CDR1,CDR2,CDR3の3つの段階のいずれかに取り残されたり、動けなくなったり、遅れたりしているかもしれない。損傷によって機能が一時的に変化したが、死ななかった細胞は、治癒サイクルの段階で取り残された細胞にさらに多く貢献するだろう。このプロセスは、図2のスパイラルの右側にある、徐々に機能不全のモザイクとして示されている。特定の環境障害(栄養ストレス、病原体、毒素、または物理的傷害)と与えられた個人の遺伝的遺伝子型の生態学的相互作用は、CDRの3つの異なる段階でどのように多くの細胞が遅延または失われるかを決定する。老化細胞モザイクの例は、20歳、40歳、60歳、および90歳で図示されている(図2)。不完全に分化した遅延・停止した細胞は、物理的・代謝的に分離したバッファーゾーンを形成し、原子炉の制御棒のような役割を果たし、信号を吸収し、以前は隣接していた、相乗効果のある、代謝的に相互依存していた細胞間のコミュニケーションを阻害する。機能的ギャップジャンクションを介した細胞の連結性の喪失は、生理的予備能を低下させ、ストレスに関連した細胞死に対する脆弱性を増大させる [92]。
イノシトール三リン酸(IP3)を介した細胞内カルシウム貯蔵量の放出を介した組織内の細胞から細胞へのカルシウム波の伝播は、神経内分泌シグナル伝達に対する協調応答の一般的な例であり、完全に分化したミトコンドリア機能に大きく依存している[93]。CD38は年齢とともに増加し[94]、IP3応答性カルシウムシグナル伝達が低下すると、NAD+から環状アデノシン二リン酸リボース(cADPR)を、NADP+からニコチン酸アデニンジヌクレオチドリン酸(NAADP)を合成するために細胞によって使用される[95]。NAD+およびNADP+は、老化の過程でCD38によって枯渇する [94]。NAD+とNADHの細胞内枯渇は、ミトコンドリア電子輸送の減少をもたらし、老化の一因となるミトコンドリア電子輸送の漸進的な低下をもたらす[96]。動物モデルにおけるNAD+前駆体であるニコチンアミドリボシド(NR)の補給は、細胞の分化を改善し、組織内のラミニンスカフォールドとより正常な細胞モザイクを回復し、老化細胞の形成を減衰させ、寿命を約10%増加させる [98]。移植された老化細胞の効果に関する最近の研究では、著者らは、体内の全細胞10,000個のうち1個以上の老化細胞(0.01%)または特定の組織の正常細胞350個に1個以上(0.28%以上)が、機能不全の細胞モザイクと、握力や運動能力の低下などの測定可能な機能的欠陥をもたらすのに十分であることを明らかにした[99]。
8. 機能障害の原因としての脱分化
複雑な生命システムは、少なくとも7つの離散的なサブシステムで構成されている。(1) 分子。(2)アミノ酸、単糖、ヌクレオチド、アセチル、イソプレンなどのモノマーからなるタンパク質、多糖類、核酸、脂質などの合成に必要なエネルギーを必要とする高分子。(3) 水性マトリックス中で膜や脂質液滴などの自由エネルギーの低い構造を形成する荷電性・中性脂質や疎水性タンパク質など、自発的に集合するポリマー、(4) 小器官、(5) 細胞、(6) 組織、(7) 器官。正常な発生、健康、病気、老化に関連する表現型の多くは、サブシステムの機能、配置、および相互作用に依存するが、定性的、定量的、および年代的には、単一のサブシステムとは異なる創発的な特性である。例えば、長期記憶は、脳を構成するすべてのサブシステムのいくつかの側面を変化させる新しいタンパク質合成を必要とする創発的な特性であるが、サブシステムのいずれかの知識だけでは長期記憶を説明するには不十分である。健康の他の創発的特性には、歩行能力、会話能力、思考能力、食事能力、排泄能力、免疫反応の発現能力、生殖能力、毒素や損傷を検出して反応する能力、治癒能力などがある。老化は、これらの能力のそれぞれを低下させる。健康が創発的な表現型の集合体として考えられるならば、病気や老化は、代謝や細胞の秩序や、健康と環境変化に対する回復力を定義するサブシステムの相互作用の低下から生じる創発的な特性の漸進的な衰退、または脱離と考えることができる。図2に示されている機能不全が進行している細胞モザイクの画像は、問題の一つのレベル、すなわち細胞レベルを示しているに過ぎない。機能不全のモザイクは、7つのサブシステムのすべてで発生しており、治癒サイクルを繰り返すたびに、各レベルでの誤修復が蓄積されていく。
9. 不完全な治癒の結果として現れる老化の特徴
老化の分子、細胞[2,3,48]および遺伝子発現のホールマーク[39]は、治癒サイクルおよび多系統CDR[10,11,29]の段階におけるそれらの使用に応じて整理することができる(図3)。これらの特徴は、ミトコンドリアストレス[13,17,100]、統合細胞ストレス応答(IGR) [12,101,102]、およびCDR[10,11,29,103]の分子理解の向上に自然につながっている老化の研究で同定されてきた。これらの特徴に関連する形質は、治癒サイクルに必要とされる分子的特徴の活性化から自然に生じ、その後、CDRの正常な機能または遺伝子発現状態が必要とされなくなると、この正常な機能または遺伝子発現状態を消滅させることができなくなる。治癒サイクルが一巡した後の老化の特徴の持続性(図2)は、他の5つの方法でも発生する可能性がある。(1) 細胞があまりにも多くの遺伝的損傷を受けて老化する場合、(2) 取り除かれた細胞が入れ替わらずに組織の萎縮を引き起こす場合、(3) 細胞は入れ替わったが、組織の分化したニーズに応じて再分化しない場合、(4) 線維化や瘢痕化 [104] のような誤った修復がリモデリングによって除去できない場合、(5) 遺伝子や代謝の変化が老化を迂回して癌に至る場合である(図1)。これらのイベントのそれぞれの遺産は、図2に示されている機能不全のモザイクに追加される。
脳、筋肉、神経、内分泌系の組織は、再生能力が限られていることと、臓器の最適な機能に必要な高度な空間組織であることから、一度死んで除去された細胞が不完全に置換されてしまうと、特に影響を受けやすい。これらの組織の機能は、細胞モザイクの空間的組織化および代謝の相補性に大きく依存している。この相補性は、細胞の特殊化および隣接する細胞間の化学的協調性によってのみ達成することができ、その結果、長期間にわたって固定されたままでなければならない細胞の層および列の相対的な位置および構造に依存する。大脳皮質や脳の他の部分で接続された細胞のチェーンから細胞を除去するコストは、簡単に別の場所から幹細胞を募集することによって返済することができない高い価格を持っている。しかし、350個の正常細胞に1個だけでは組織の機能を低下させるのに十分であるため、細胞を過分泌細胞の表現型に変換するコストはさらに高くなる[105]。加齢とともにほとんどの組織で発生する細胞の集合体の体積が小さくなっていることが図2に示されている。マージ」および「CDR3」とラベル付けされた列の組織の減少する体積は、治癒サイクル(図1および図2)を通じた不完全な進行に伴って生じる細胞損失(萎縮)の影響を表している。図2に示された例では、60歳および90歳までに、より多くの細胞がCDR2(緑色で示されている)に蓄積されている。CDR2における細胞の蓄積は、CDR2で停止または遅延した細胞がその増殖能力を維持するため、糖尿病、心臓病、および癌などの疾患のリスクを増加させる[11](図1)。CDR2の細胞は、Warburg代謝に適応した多能性M0ミトコンドリアをより多く含んでいるため、増殖能力は部分的に維持される(表1)。ミトコンドリア内のp53およびPOLGと相互作用するREクロロキンL4ヘリカーゼにおける遺伝的変異は、CDR2に関連する好気性解糖を増加させ、癌のリスクの増加、およびロスムント-トムソン症候群として知られる早老症の形態につながる[106,107,108]。
10. 結論
不完全治癒のサイクルが繰り返された結果として老化を再定義する新しいモデルが提示されている。このモデルでは、不完全治癒のサイクルが時間の経過とともに積み重なり、加齢とともに徐々に機能不全に陥る細胞モザイクにつながる(図2)。細胞危険応答(CDR)の3つの段階のうちの1つに蓄積する細胞は、加齢に伴う疾患の特定のリスクにつながる。CDR1における細胞の蓄積は、慢性炎症性および疼痛症候群を引き起こし、根絶のために適応性T細胞免疫を必要とする慢性ウイルス、細菌、真菌感染症への感受性をもたらす[11]。CDR2における細胞の蓄積は、糖尿病、心臓病、うっ血性心不全、末梢血管疾患、線維性疾患、および癌リスクにつながる。CDR3における細胞の蓄積は、自己免疫疾患、免疫抑制または欠乏、神経障害性疼痛症候群、行動・精神障害、または神経発達・神経変性疾患につながる[11]。モザイク内の逮捕された細胞のブロックを解除し、治癒サイクルの完了を可能にすることができる薬剤、装置、または手順は、現在のところ不明である。しかし、ニコチンアミドリボシドや必須アミノ酸などの特定の栄養介入は、動物モデルにおいて治癒[66]、長寿[98]、またはその両方[64,66]を促進することがわかっている。不完全治癒モデルの予測は、CDRの各段階に分化チェックポイントが存在し(図1)治癒の完了を促進するために細胞が自然に使用する分子シグナルが、加齢に関連した症状や疾患の予防と治療の両方に新たな手がかりを提供する可能性があるということである。身体的・心理的な幸福度を向上させ、死亡率を低下させ、加齢に伴う疾患のリスクを低下させることはよく知られているが、その一つが運動である[109,110]。運動の効果は多面的であるが、オートファジーの増加とミトコンドリアネットワークのリモデリングが、質の制御の適応的改善と予備能の増加につながり、重要な役割を果たしている可能性がある[111]。ゲロニューロ保護剤[88]と化学的運動模倣薬[112]の探索はすでに始まっている。しかし、治癒サイクルの完了を制御するシグナル伝達分子であるメタボカイン[11]や、エクセルカインやエクソソーム[113,114,115]によって制御される分子としての天然代謝物の役割をより深く理解することは、老化の影響の一部を予防し、遅らせ、おそらくは逆転させる[47]ための可能性を秘めている。すべてのミトコンドリアタンパク質の半分以上がATP、NAD+、および関連するヌクレオチド(表S1)によって制御されており、老化の分子的特徴の多くは、プリン、ミトコンドリア、スフィンゴ脂質[117,118]、および核[119]の間の相互作用にトレースまたは制御されているので、プリン作動性[20]とスフィンゴ脂質[116]のシグナル伝達経路を利用した介入は、特に強力であるかもしれない。