Contents
Imperfect Vaccination Can Enhance the Transmission of Highly Virulent Pathogens
www.ncbi.nlm.nih.gov/pmc/articles/PMC4516275/
オンラインで2015年7月27日公開
Andrew F. Read, 1 , 2 ,* Susan J. Baigent, 3 Claire Powers, 3 Lydia B. Kgosana, 3 Luke Blackwell, 3 Lorraine P. Smith, 3 David A. Kennedy, 1 , 2 Stephen W. Walkden-Brown, 4 and Venugopal K. Nair 3
概要
ワクチンの中には、より病原性の高い病原体の進化を促すものがあるのではないか?従来の常識では、宿主が死亡して感染が大幅に減少すれば、自然淘汰によって致死性の高い病原体が除去されると考えられている。しかし、宿主を生かしながら感染を可能にするワクチンは、非常に強い病原体を集団内に循環させる可能性がある。ここでは、マレック病ウイルスに対するニワトリの免疫が、より毒性の強い株の適合性を高め、高病原性株の感染を可能にすることを実験的に示している。直接のワクチン接種または母親のワクチン接種によって誘発される免疫は、宿主の生存期間を延長するが、感染、ウイルスの複製、および感染を防ぐことはできない。そのため、他の方法では存続できないほど致死的な株の感染期間を延長する。我々のデータは、感染を防止しない抗疾患ワクチンが、ワクチンを接種していない宿主に、より重篤な疾患を引き起こす病原体株の出現を促進する条件を作り出すことを示している。
著者の概要
ある種のワクチンは、より病原性の高い(「ホットな」)病原体の進化を促す可能性があるという理論的な期待がある。この考えは、宿主を殺してしまうほど「ホット」な病原体株は自然淘汰され、その結果、自分自身も死んでしまうという考え方に基づいている。ワクチンは、宿主を生存させるものの、病原体の拡散を防ぐことができないため、この淘汰を緩和し、よりホットな病原体の進化を可能にする。この種のワクチンは、しばしばリーキー・ワクチンと呼ばれる。ヒトに使用されているほぼすべてのワクチンのように、ワクチンが感染を防いでいる場合には、このような病原性の向上に向けた進化は阻止される。しかし、ワクチンが漏れて、少なくとも病原体の感染を許してしまうと、ホットな株が出現し、持続するような生態学的条件を作り出すことができるのである。この理論は、10年以上前に初めて提案されたときには大きな議論を呼んだが、今回、家禽のマレック病ウイルスを用いた実験で、現代の市販のリーキー・ワクチンがまさにこの効果を持つことを報告する。つまり、リーキー・ワクチンは、そうでなければ致死量を超えて存続できないような株の伝播を可能にするのである。このように、リーキーワクチンの使用は、ワクチンを受けていない宿主が重篤な疾患にかかるリスクを高める病原体株の進化を促進する可能性がある。今後の課題は、動物やヒトに使用されている他の種類のワクチンでも、このような進化上のリスクを引き起こす可能性があるかどうかを明らかにすることである。
はじめに
感染症の病原体は、健康への介入に応じて急速に進化することがある[1]。ここでは、ワクチンを接種した宿主に対する病原体の適応が、より病原性の高い病原体(ここでは、ワクチンを接種していない宿主に、より多くの、あるいはより早く死亡させる病原体と定義する)の進化につながるかどうかを検討する。
ワクチン接種は、次のような方法でより毒性の強い病原体の進化を促す可能性がある。通常、より強い病原体の進化を妨げる主な要因は、病原体が宿主を殺してしまい、その結果、自分の感染期間が短くなってしまうことだと考えられている。もしそうであれば、病気を減らすことはできても、感染、複製、伝播を防ぐことができないワクチン(いわゆる「不完全な」ワクチン)で宿主を生かすことで、より強靭な株が流通する可能性がある。宿主が死ななくても感染力が強かったり、宿主の免疫を克服する能力が高かったりすれば、自然淘汰はさらにその循環を促進するであろう。このように、命を救うワクチンは、(ワクチンを接種していない宿主で測定した)病原体集団の平均疾患毒性を高める可能性がある [2-4]。
この考え(以下,「不完全ワクチン仮説」と呼ぶ)の妥当性は,数理モデルによって確認されている[2,5-9].有効性と作用機序が鍵となる。ワクチンが殺菌作用を持つものであれば、感染が止まるので、進化は起こらない。しかし,ワクチンが非滅菌性で,免疫を受けた人から自然に病原体が感染するようなものであれば(以下,「リーキー」ワクチンと呼ぶ),自然淘汰されたはずの状況でも病原株が流通することになる[2]。このように、抗疾患ワクチン(宿主内での複製や病原性を低下させるもの)は、人や動物の福祉に有害な進化を生み出す可能性があるが、感染や伝播を阻止するワクチンはそうではない[2-9]。ワクチンが引き起こす病原性の進化の可能性は、ワクチンが引き起こすエピトープの進化(抗原性の逃避)とは概念的に異なることに注意してほしい。エスケープ変異体の進化は頻繁に観察されている[4,10]。
不完全ワクチン仮説は議論を呼んだが [11-14]、その理由の一つは、ヒトのワクチンが標的となる病原体の毒性を明らかに増加させていないからである。しかし、ほとんどのヒト用ワクチンは、殺菌作用(感染を阻止する作用)があったり、広く使われていなかったり、最近導入されたばかりだったりする[4]。さらに、菌株の病原性やワクチン接種による感染への影響を明確に比較するには、自然宿主での実験感染が必要であるが、これはヒトの病気では明らかに不可能である。しかし,獣医師による感染症の場合は状況が異なる。ここでは,マレック病ウイルス(MDV)を用いた実験について報告する。MDVは,非常に感染力の高いがん原性ヘルペスウイルスで,世界の養鶏産業に毎年20億米ドル以上の損害を与えている[15]。この実験では,不完全ワクチン仮説の重要な予測である,ワクチン接種によって強毒株の体力が弱毒株の体力を上回ることを検証した。
MDVは、感染した鳥の羽毛から排出されたウイルスに汚染された粉塵を吸い込むことで、ニワトリに感染する。汚染された鶏舎では、ヒナは孵化後すぐに感染し、生涯にわたって感染し続ける[16]。ウイルスは家禽の埃の中で何カ月も感染力を維持する[17,18]。当初、マレック病(MD)は高齢の鳥の麻痺であったが、1950年代には、若い鳥の多臓器のリンパ腫を特徴とする「急性MD」が発生した。これがMDの主流となり、病原性が増し、より重篤なリンパ腫とますます早い年齢での死亡を特徴とし、状況によっては、リンパ腫形成のかなり前の生後数週間で麻痺と死亡が発生することもあった[15,19]。
MDVは、1970年に最初のワクチンが導入されて以来、漏れなく抗病性ワクチンで免疫された家禽で進化してきた[15,19-24]。すべてのMDワクチンは18日齢の胚または孵化直後に投与される生ウイルスであり,ワクチンを接種された鳥は感染して野生型ウイルスを排出する可能性がある[25-28].野生型のMDウイルスは,いわゆるセロタイプ1のウイルスである。第一世代のワクチンには、HVTと呼ばれる七面鳥の血清型3のヘルペスウイルスが含まれ、第二世代のワクチンには、HVTと血清型2の分離株であるSB-1の組み合わせが用いられる。第3世代ワクチンは、弱毒化した血清型1型ウイルス分離株CVI998をベースにした、いわゆるRispensワクチンである[15,19-24]。
結果
ウイルスの排出量
最初の3つの実験では、ロードアイランドレッド(RIR)鶏を用った。この品種は、現代の商業用鶏の特徴である集中的な選択的繁殖や交配を受けていない。特定病原体不使用(SPF)の親鳥はワクチンを接種していないため、最初の2つの実験で使用した子鳥には母親由来の抗体はなかった。最初の実験では,生後8日目のヒナに,Witterら[21,29]が定義した毒性スペクトラムを満たすように選択した5株のMDVを感染させた。ウイルス株は、ワクチンを接種していない鳥の60%が2ヶ月間で死亡した病原性の低いHPRS-B14から、ワクチンを接種していない鳥が10日間ですべて死亡した致死性の高いMd5および675Aまで様々であった(図1,上段)。同年齢の鳥に、商業的に使用されている最初のMDVワクチンであるHVTを8日前に接種したところ、生存率は劇的に向上し、数羽の死亡は実験の後半になってから、しかも最も毒性の強い株に感染した鳥にのみ発生した(図1,上段)。
図1 MDVの5つの株の死亡率とウイルス排出量に対するワクチン接種の影響
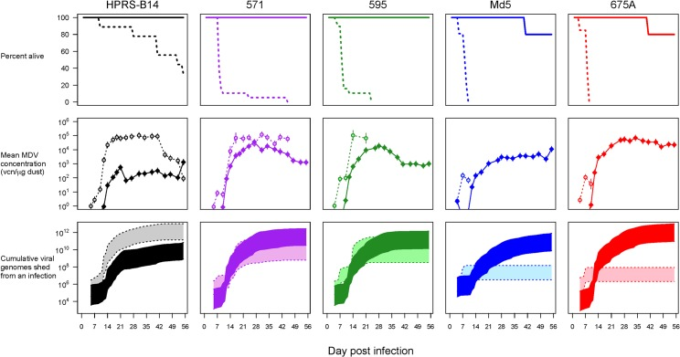
実験1. 20羽のロードアイランドレッドニワトリのグループは、生後1日目にワクチン未接種(点線、淡い陰影)またはHVTワクチン接種(実線、濃い陰影)を受け、8日後にウイルス株HPRS-B14(黒)571(紫)595(緑)Md5(青)675A(赤)でチャレンジした。ワクチンを接種していない宿主ではウイルス株の病原性が異なり、ワクチンを接種することで死滅を防ぐことができる(上のパネル、左から病原性の高い順に株を並べた)。ワクチンを接種すると、塵埃中のウイルス濃度は抑えられるが、宿主を生かすことで高病原性MDVの感染期間が長くなる(中段)。つまり、1羽あたりのウイルスゲノムコピー(VCN)の累積排出数は、ワクチン接種によって、最も毒性の低い株では抑制され、最も毒性の高い株では数桁増加することになる(下段)。エラーバーと斜線部分は95%信頼区間(c.i.)を示す。生データは dx.doi.org/10.5061/dryad.4tn48 に掲載されている。
感染した鳥を収容したアイソレーターから塵埃を採取し,リアルタイムPCR法により塵埃中のウイルスゲノム濃度を測定した。同時期にワクチンを接種した鳥は、同じウイルス株に感染したワクチンを接種していない鳥に比べて、ウイルスゲノムの排出量が少なかった(図1,中段)。これらのパターンは、羽毛のウイルス量を反映している(S1図)。肝心なことは、ワクチンを接種していない鳥が最も強い2つのウイルス株に感染した場合、宿主が急速に死亡したため、感染期間は1週間に満たなかったことである。その間、ウイルスはほとんど排出されなかった(図1,中段)。対照的に、最も毒性の低い株の感染期間は、実験全体(約2ヶ月)にわたって続いた。このように、ワクチンを接種していない鳥から排出されるウイルス量は、強毒株よりも数桁多いことがわかった(図1,下段)。死を防ぐことにより、ワクチン接種は最も毒性の強い株の感染期間を大幅に延長し、排出されるウイルスの総量を数桁増加させ、最も毒性の弱い株のウイルス量よりも増加させた(図1,下段)。このように、ワクチン接種が宿主の生存率と日々の排出率の両方に及ぼす正味の効果は、強毒株が環境中に排出するウイルス量を大幅に増加させることであった。
外部への感染
環境中に排出されたウイルスが、鳥から鳥への全体的な感染可能性の確実な代用品であることを確認するために、最も毒性の強い3つの株に感染した鳥と、免疫学的にナイーブなセンチネル鳥を同居させた(実験2)。ワクチンを接種していない鳥が2つの最も致死性の高い株(Md5と675A)に感染した場合、ウイルスの排出が本格的に始まる前の10日以内に全員が死亡した(図2A)。その結果、これらの隔離施設のセンチネル鳥は感染せず(図2B)死亡した鳥もいなかった(図2C)。一方、HVTワクチンを接種した鳥がこれらの高病原性株のいずれかに感染した場合、鳥は30日以上生存し(図2A)ウイルスの大量排出が可能となった(S2図)。その結果、同居していたセンチネルはすべて感染し(図2B)MDVに感染して死亡した(図2C)。このように、不完全ワクチン仮説に基づき、ワクチンを接種することで、本来ならば致死量に達していないウイルスの感染が可能となり、ワクチンを接種していない人は重症化して死亡するという大きなリスクを負うことになったのである。
図2 ワクチン接種は高病原性MDVの感染を促進する
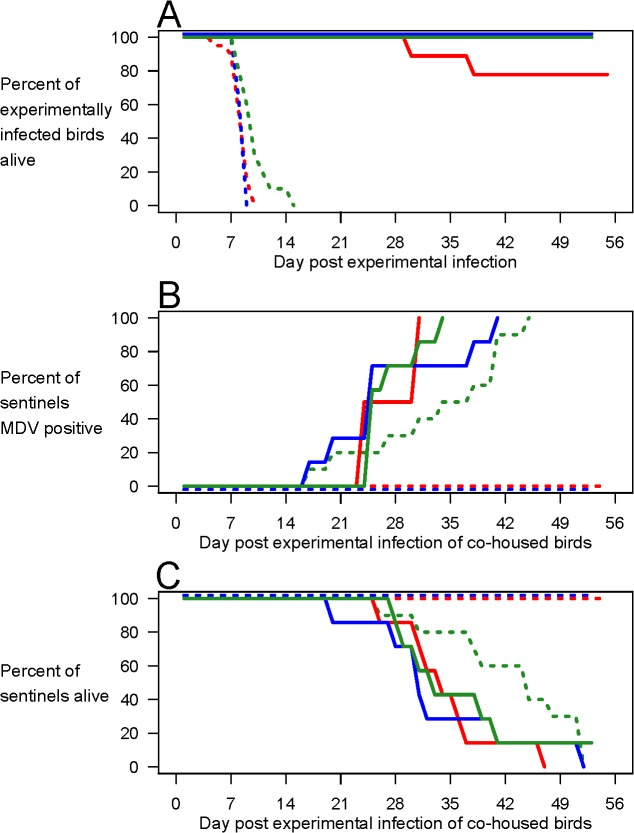
実験2. 10羽の鳥のグループにHVTワクチンを接種(実線)または非接種(点線)し、実験的に595(緑)Md5(青)675A(赤)の3種類の最も病原性の高いMDV株のうちの1つに感染させ、ワクチンを接種していない10羽のセンチネル鳥と同居させた。ワクチンを接種すると、実験的に感染した鳥の生存期間が延長し(A)歩哨鳥が感染し(B)その結果、死亡した(C)ことが確認された。BおよびCにおいて、実線はワクチン接種を受けた実験感染鳥と同居しているセンチネルを、点線はワクチン接種を受けていない実験感染鳥と同居しているセンチネルを示す。生データは dx.doi.org/10.5061/dryad.4tn48 で見ることができる。
興味深いことに、ウイルス株595は他の2つのウイルスよりもわずかに毒性が弱かった(ワクチン未接種の鳥の半数を殺すのに1日、全員を殺すのに6日かかった)(図2A)。この死亡率の低下により、ワクチンを接種していない鳥からのウイルス排出が長期化し、595に感染したコホートから環境中に排出されたウイルス量は、致死率の高い2種類のウイルスに感染したコホートから排出されたウイルス量の約100倍に達した(S2図)。同居していたセンチネルはいずれも感染し(図2B)やがて死亡した(図2C)ことから、感染には十分であったと考えられる。このように、致死率がわずかに低下するだけで、感染は十分に可能である。しかし、595株であっても、ワクチンを接種した場合には見守り鳥への感染が急速に進み(図2B;陽性になるまでの時間の中央値は、ワクチンを接種していない鳥よりも9日早い、p<0.05)その結果、パンデミックが拡大した場合にウイルスの体力と症例の発生率の両方を決定する重要な要素である二次症例の発生率が上昇した。
母体由来の抗体
ワクチンを接種していない鶏が最も強いウイルス株に感染して高い死亡率を示したのは、麻痺、見当識障害、摂食と移動ができない状態が急速に発生し、その後死に至る早期死亡症候群によるものである[30-33]。今日の近代的な産業では、親鳥はほとんどの場合、MDVに対するワクチン接種を受けており、その結果、母親の抗体がヒナに移ることになる。これらの抗体は、早期死亡症候群に対して保護的であると考えられる[30-33]。このことから、産卵鶏にワクチンを接種することで、他の方法では致死率が高すぎて子孫に伝わらないようなウイルス株を、子孫に伝えることができるのではないかと考えられる。この可能性を検証するために、最も毒性の高いウイルス株(675A)と最も毒性の低いウイルス株(HPRS-B14)を用いて、再びロードアイランド・レッド種の鳥を使った実験を行った。
鶏にワクチンを接種すると、HRPS-B14に実験的に感染させた子孫の生存率が向上した(図3A、p<0.05)。母体由来の抗体は、羽の先端でのウイルス株の複製には検出可能な影響を及ぼさず(S3図パネルA、p>0.05)感染初期に環境中に排出される感染性ウイルスの量を幾分抑制したが(図3B3BおよびS3B)歩哨鳥がHRPS-B14に感染する割合には影響を及ぼさず(図3C、p>0.05)歩哨鳥の死亡はほとんどなかった(図3D)。このように、母親の保護は、最も毒性の低い株の感染成功率にほとんど影響を与えなかった。
図3 母方のワクチン接種は、高病原性MDVのウイルス排出とその後の感染を促進する
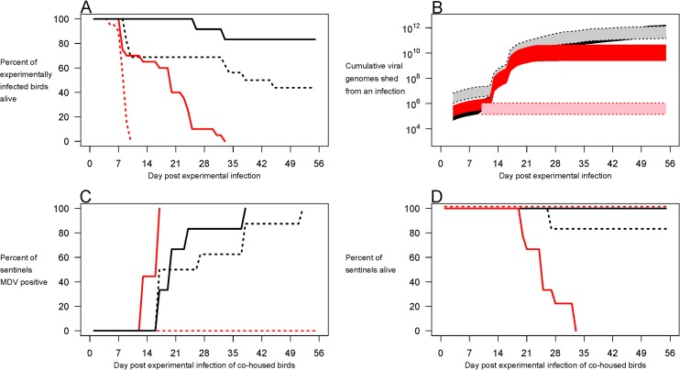
実験3. Rispensワクチンを接種した鶏(実線)または接種していない鶏(点線)から産まれたワクチン未接種のヒナ10羽のグループに、ウイルス株HPRS-B14(黒)または675A(赤)を感染させ、同じ母体抗体の状態にあるセンティネルと同居させた。母方の抗体は、実験的に感染させた鳥の生存期間を延長し(A)高病原性株から環境中に排出されるウイルス量を増加させ(B)最も毒性の強い株をセンチネルに感染させ(C)死に至らせることができた(D)。網掛け部分は、ワクチン未接種者(明)とワクチン接種者(暗)の95%C.I.を示す。生データは dx.doi.org/10.5061/dryad.4tn48 にある。
しかし、母親の抗体の存在は、最も毒性の強い株(675A)の感染成功に大きく影響した。予想通り、ワクチンを接種した鶏の子は、母方の抗体陰性のヒナに比べて、675Aウイルス感染後の生存期間が長くなった(図3A、p<0.05)。最初の2つの実験で判明したように、免疫保護を受けていない鳥が死ぬまでに排出された強毒性株はごくわずかであった(図(3B3BおよびS3))。その結果、センチネルは感染しなかった(図3C)。しかし、母親の保護を受けた鳥はより長く生存し、より多くのウイルスを排出したため(図3A、3B、S3B)すべてのセンチネル鳥が感染し(図3C)死亡した(図3D)。母鳥へのワクチン接種は、子鳥への直接ワクチン接種ほどの防御効果はなかった(図3A、図2Aおよび図1の上段参照)。それにもかかわらず、産卵鶏へのワクチン接種は、子孫へのワクチン接種と同様に、子孫から高病原性株の感染を可能にした(図3C)。これらのデータは、不完全ワクチン仮説と一致している。
市販の鳥の間での感染
上述の実験では、鳥への直接ワクチン接種や親鶏へのワクチン接種により、本来ならば致死的なウイルス株の伝播が可能となり、ワクチン未接種者は重篤な疾患や死亡のリスクが高まることが示された。しかし、現代の商業ブロイラーでは、群れを構成するすべての鳥がワクチン接種を受けた鶏の子孫であり(つまり、母方由来の抗体が陽性である)かつワクチン接種を受けている。そこで我々は,最も強い病原性を持つ株が,ワクチン接種を受けたモニタリング員に感染するかどうかを調べることにした(実験4)。現在の商業ブロイラーの状況を模して,Rispensワクチンを接種した鶏から得た最新の商業ブロイラー鳥を入手し,生後1日目に,実験的に感染させるすべての鳥にHVTワクチンを接種した。そして、これらの鳥を8日齢で最も毒性の強いウイルス株(675A)に感染させた。実験的に感染させた鳥と、HVTワクチンを接種したかしていないかのセンチネル鳥を同居させた。この実験は2回行った。規制要件の変更に対応するため(「方法」を参照)1回目は生後35日までアイソレーターで飼育し、その後11週齢まで床に移した鳥(実験4a)2回目は生後1日から7週齢まで床のペンで飼育した鳥(実験4b)で行った。
ワクチン接種の有無にかかわらず、すべてのセンダイムシが感染した(図4A)。このように、ワクチンを接種した母体抗体陽性の商業鳥は、野生型ウイルスを排出し、ワクチンを接種した母体抗体陽性の鳥と、ワクチンを接種していない母体抗体陽性の鳥の両方に感染を引き起こした。ワクチンを接種しても、センチネル鳥が獲得した感染症のウイルス複製はわずかに抑制されただけであった(図4B)。重要なのは、ワクチンを接種したものもしていないものも、すべての歩哨鳥が羽毛の中でウイルス陽性になったことで、歩哨鳥自身が排出を始めたことである。ワクチンを接種することでセンチネルの鳥は死から守られ(図4C)感染期間は約2週間延長された(図4D;差の標準誤差±3.2d、F1,36 = 19.9,p < 0.0001)。このように、我々が開発した最も病原性の高い株は、ワクチンを接種すると最新の市販ブロイラー間で感染するだけでなく、感染連鎖の次のステップである脱落期間もワクチン接種によって長くなるのである。
図4 現代の商業用鳥類への過敏性MDVの感染

実験4. Rispensワクチンを接種した鶏から生まれた現代の商業用ブロイラーヒナ10羽のグループに、生後1日目にHVTワクチンを接種し、実験的に強毒型MDV 675A株に感染させた。実験的に感染させた鳥は、HVTワクチンを接種した(実線)または接種していない(点線)同じ商業銘柄(つまり、同じくRispensワクチン接種鶏由来)のセンチネル鳥10羽のグループと同居させた。実験は2回行われた(実験4a、赤;実験4b、青)。ワクチン接種の有無にかかわらず、すべての立哨鳥が感染し(A)羽毛の毛根で高レベルのウイルス複製が見られた(B)。ワクチンを接種することで、前哨鳥の生存期間が延長され(C)その結果、感染期間も延長された(D)。パネルDでは、”x “はMDVによる死亡を示す。エラーバー、95% c.i.。生データは、http://dx.doi.org/10.5061/dryad.4tn48 で見ることができる。
考察
MDVは、20世紀後半に病原性を増していった[19,21-24]。1950年代まで、養鶏場で流通していたMDV株は、病変が主に末梢神経組織に限定され、軽度の麻痺性疾患を引き起こしていた。死亡することは比較的まれであった。今日では、高病原性株が世界中に存在している。これらの株は、広範囲の臓器にリンパ腫を引き起こし、ワクチンを接種していない鳥の死亡率は100%に達する。我々が知る限り、今日の商業(ワクチン接種)家禽から致死性でないMDV株を分離することはできなかった[19,23]。何がこのウイルスの進化を促したのかは不明である。効果的なワクチンが次々と強毒性のウイルス株に打ち負かされてきたという観察結果から、多くのMDV専門家は、ワクチン接種が重要な推進要因である可能性を示唆しているが[19-24,34-37]、関与する進化圧力を特定することは困難であることが判明している。マレック病では、より毒性の強い株によるワクチンの突破が、株特異的な免疫の克服(例えば、エピトープの進化)と関係しているという証拠はない。毒性の異なる株の遺伝学的および免疫学的な比較から、候補となる毒性決定因子は抗原ではなく、宿主細胞の相互作用やウイルスの複製に関連していることが示唆されている[19]。免疫化がMDVの病原性の進化を促進する進化的メカニズムとして,不完全ワクチン仮説が提案されているが[2],実験的に確認されたことはない。我々のデータによると、宿主の生存率を高める一方でウイルス排出を防ぐことができないため、MDVワクチンを鶏や子孫に接種すると、高病原性株の感染期間が大幅に延長され、その結果、環境中に排出されるウイルス量も増加する。
今回のデータは、ワクチン接種がMDVの高病原性株の進化に関与していることを証明するものではなく、そもそもなぜ高病原性株が進化したのかについては、はっきりとはわからないかもしれない。養鶏業の拡大に伴い、病原性に関連する多くの生態学的圧力が変化したことは明らかである。例えば、家禽産業の拡大に伴い、ブロイラーの占める割合が非常に大きくなり、動物遺伝学や飼育学の進歩によりブロイラーの寿命が半分になった。他の条件が同じであれば、これはより強い病原性を持つ株に有利に働くだろうし[28]、群れの遺伝的同質性の向上[38]や高密度の飼育条件[13]、あるいはワクチン接種前の時代に家禽産業の拡大に伴いMDVの自然感染がより一般的になった場合には、母体由来の抗体の頻度が増加する可能性もある(図3)[39]。しかし、そもそも病原性の高い株が進化した原因が何であれ(多くの原因があるかもしれない)我々のデータは、今日の家禽群において高病原性株を維持するにはワクチン接種で十分であることを示している。感染した鳥を生かしておくことで、ワクチンを接種していない集団では存続できないほど致死的なウイルス株の感染成功率が大幅に高まり、その結果、ワクチン接種前の時代には自然淘汰されていたはずのウイルス株が広がっているのである。
今回の実験で明らかになった高病原性株に対する自然淘汰の緩和は、ワクチン接種によって宿主の生存率が向上することに起因する。ネズミのマラリアを用いた連続継代実験では,寄生体全体への免疫[40]や組換え抗原を用いたワクチン接種[10]によって誘導された免疫も,病原性の進化を促進した。しかし、これらの実験では、宿主の死が病原体の体力に影響を与えないように設計されていたため、病原性の向上に向けた進化は別の方法で推進された。明らかに、このシステムでの免疫は、病原性の低い株に対して不均衡に効果的である。MDVの実験では、宿主内の選択を調べるようには設計されなかったが、ワクチンで誘導された免疫は、毒性の低い株の複製をよりよく制御していたことが示唆されている(図11およびS1)。原理的には、これらの2つの進化圧力(免疫を回避する能力を持つ病原性変異体を好む宿主内選択と、病原性に対する宿主間の選択を緩和するワクチン誘導)が相まって、より病原性の高い株に対する非常に強力な選択を生み出す可能性がある[4]。宿主内での菌株間の競争は、より高い病原性に対する選択をさらに強める可能性がある[41,42]。
MDV以外にも、ネコカリシウイルス[43]や家禽の伝染性嚢病ウイルス[44]など、少なくとも2つのウイルスについて、病原体に直面した際のワクチンの失敗が記録されている。この2つのケースは、漏れのある抗疾患ワクチンの長期使用にも関連している。また、今回のデータは、よく研究されている2つの野生動物系における病原性の増加を説明すると称される仮説とも一致している。まず、北米のハシビロコウにおける家禽病原体Mycoplasma gallisepticumの株が病原性を増しているが、これはおそらく、1990年代にこの細菌がハシビロコウの個体群に出現した後、部分的に免疫を持つ鳥の発生率が高まったためである[45]。第二に、オーストラリアで生物防除剤として放出された後、毒性が低下したことが十分に証明された後、ミクソーマ・ウイルスの毒性が強まった。この毒性の進化は、ウイルスによって課せられた自然選択に応じて野ウサギの遺伝的抵抗力とそれによる生存率が増加した結果である可能性が高い[46]。どちらのケースでも、自然免疫(フィンチ)または遺伝的耐性(ウサギ)によって引き起こされた抗病防御が、そうでなければ非常に致死性の高い株の感染期間を延長させた。これらの事例や我々のデータは、病気を改善する薬剤[7,47]や宿主の抵抗力を高める遺伝子[48]など、さまざまな病気緩和技術が病原性の進化を促進する可能性があることを示唆している。ワクチン接種が可能であることを示したように、これらの技術が高病原性株の感染期間を延長するならば、致死性の高い株の出現に有利な条件を作り出す可能性もある。しかし、代替手段が限られている場合は特に、こうした技術を避けるべきであるということではない。ワクチン接種は、進化にもかかわらず、MDによる収量損失を大幅に削減した [49]。しかし、すべての個体を保護することが不可能な場合や、進化が進行している場合には、衛生状態の改善など、感染を阻止するための追加的な介入を行うことが不可欠となる可能性がある。
我々は、病原体の伝播を防ぐことなく宿主の生存率を向上させるような疾病対策を行う場合には、高病原性株の発生リスクを考慮することを提案する。このような状況には、家禽のニューカッスル病 [50]や鳥インフルエンザに対するワクチン接種 [51-53]、家畜のブルセラ菌に対するワクチン接種 [54]、さらには、魚や家禽を含む農業動物の遺伝子強化などが含まれる。リーキー・ヒューマン・ワクチンが、より病原性の高い株が増殖する条件を作り出すかどうかは、とりわけ、ヒト集団における高病原性株の出現を現在妨げている選択的要因にかかっている。今回のデータは、ワクチンが病原体に与える影響を包括的に理解するには、第3相臨床試験や抗原性や血清型の頻度に関する実施後の研究だけでは終わらないことを強調している[2,4,10,55]。
材料と方法
ワクチンウイルス株およびチャレンジウイルス株
HVTワクチンウイルス株FC126は、市販のHVTワクチン(Poulvac, Fort Dodge Animal Health)の第2ニワトリ胚線維芽細胞(CEF)継代株であった。市販の CVI988/Rispens ワクチンウイルス(Nobilis Rismavac)は Intervet 社のものであった。チャレンジウイルス株(7th duck embryo fibroblast passage stock)は、Dr. A. M. Fadly (Avian Disease and Oncology Laboratory, United States)からの贈り物である。MDVの文献では,病原性(パスタイプ)はワクチンのブレークスルーの観点から定義されており[21,27,29],ウイルス株はマイルド,病原性,非常に病原性,非常に病原性プラス(mMDV, vMDV, vvMDV, vv+MDV)と表記されるパスタイプに分類されている。今回の実験では、このスペクトルをカバーするように選ばれた最大5種類の菌株を使用した。用いた菌株は、HPRS-B14,571,595,Md5,675Aである。HPRS-B14は、正式なパスタイプが決定されていないが、おそらくvMDVの下位に分類されると思われる。残りの4株はそれぞれvMDV、vvMDV、vvMDV、vv+MDVとパスタイプされている[21]。ただし、本稿では、ワクチン耐性の観点から病原性を定義すると、意味的に回りくどいことになるので注意が必要である。そのため、本文および以下の内容では、毒性を免疫学的にナイーブな鳥における致死性として明確に定義(測定)している。
ウイルス株を増幅し、実験間でウイルスの通過履歴にばらつきがないことを確認するために、5日齢のロードアイランドレッド(RIR)ニワトリに、1,000プラーク形成単位(pfu)のウイルスを腹腔内投与した。感染後14日目(dpi)に採取した脾臓から分離したリンパ球を初代CEF細胞とともに7日間培養したところ、サイトパシー効果が明らかに見られた。この細胞をCEFでさらに2回継代し、ウイルスストックを作成した。細胞に付着したウイルスストックを滴定し、液体窒素で保存した。CVI988/RispensおよびHVTワクチンを皮下投与(頸部)し、チャレンジウイルスを腹腔内投与した。
実験用ニワトリおよび実験デザイン
動物を用いたすべての研究および手順は、プロジェクトライセンスPPL 30/2621およびPPL 30/3169の権限の下、欧州および英国内務省の規制および1986年動物(科学的手順)法修正規則2012に厳密に従った。鳥はウィングバンドで個別に識別され、水と野菜ベースの飼料を自由に摂取できた。人道的終点に達したと判断された鳥はすべて淘汰された。本文中では、人道的終点は「感染による死亡」が発生した時点とした。5-10dpi(早期死亡期)に人道的終点に達したニワトリは、麻痺、見当識障害、給餌を嫌がる、動きたがらない、体重増加の減少などが急速に現れた。我々の経験では、このエンドポイントは自然死よりも2時間以内に先行する。15dpi以降に人道的エンドポイントに達したニワトリは、餌を食べたがらない、無気力、体重増加の減少が徐々に始まった。我々の経験では、このエンドポイントは死に先立って24時間以内に発生する。これらのエンドポイントと、ウイルスによる死に関するこれらのタイミングの推定値は、小規模なパイロット実験から得られたもので、ウイルスによる死が急速に発生するため、綿密なモニタリングが必要であると判断した。死亡が確認された鳥はすべて英国内務省に報告された。淘汰された鶏の大部分は、脾臓の肥大とリンパ系の病変を示した。内臓病変の有病率は、試験鶏の品種や母体の抗体状態の違い、ウイルス株の継代数のわずかな違いにもかかわらず、対応するパスタイプの株についてWitter(1997年、同表4)が記述したものとほぼ一致していた。
実験1-3では、ピルブライト研究所で飼育されている特定の病原体を持たない群の卵から、近縁種のロードアイランド・レッド(RIR)種の鶏を孵化させた。ワクチンを接種していない鶏の卵から孵化したヒナは、MDVに対する母体由来の抗体を持たないとみなされ、以下、MtAb-negヒナと呼ぶことにする。MDVに対する母親由来の抗体を持つヒナ(MtAb-pos)は、RIR鶏がNobilis Rismavac CVI988/Rispens MDVワクチン(Intervet社)を1回接種してから4-5週間後に採取した卵から孵化させた。
実験1-3では、Pirbright Institute, ComptonのExperimental Animal House内の正圧、高効率微粒子空気(HEPA)フィルター付きの鳥類用アイソレーター(Controlled isolation Systems, US)にヒヨコを収容した。ニワトリは1日4回までモニターされ、人道的な終点に達したと思われるニワトリは頸椎脱臼により淘汰された。実験を終了する際には、生き残っている鶏はすべて淘汰された。淘汰された鶏はすべて死後検査を行い、マレック病の肉眼的病変の有無を記録した。
アイソレータは、生後1日のニワトリ20羽または成体ニワトリ5羽を収容できるように設計されている。感染後の死亡率が低いグループでは、一部の鳥を淘汰することで、アイソレーター内の混雑を解消することが必要であった。このような場合、淘汰される鳥は無作為に選択され、淘汰される感染鳥とセンチネル鳥の数は、適切な感染:センチネルの比率を維持するように調整された。混雑を緩和する目的で淘汰された鳥は、生存率データの計算に含まれなかった。
実験4aおよびbでは、「Aviagen slow growing broiler line」の商業ブロイラー種のヒナを、Aviagenから提供された卵から孵化させた。卵はCVI988/Rispensワクチンを接種した鶏のものであり、従って、使用した全ての鳥はELISAで確認したようにMtAb-posであった(下記参照)。実験4では、実験1~3とは異なる飼育方法を採用した。これは、研究の過程で規制要件が変化し、成鳥をアイソレーターで飼育することが強く推奨されなくなったためである。実験4では、少なくとも実験4の一部で鳥を床飼いにしたが、これは養鶏業界の飼育環境により近い条件である。実験4aでは、鳥は35日齢になるまでアイソレーターで飼育された後、別の実験室内のフロアペンに移された。フロアペンは、金属製の棒状のケージパネルで構成されており、鳥が大きくなったときにペンの面積を広げるために、レイアウトにセクションを追加することができた。敷料には圧縮ワラペレットを使用した。実験4bでは、鳥は生後1日目から別の実験室のフロアペン内で飼育された。最初の数週間はホコリやフケの拡散を制限するために、最初のフロアペン(1m×1m)は、パースペックスシートをワイヤーケージに取り付けて部分的に収容し、端が開いた立方体のハウジングを形成した。鳥のサイズが大きくなるにつれ、最初の立方体にパースペックスで覆われていないケージを追加して、ペンの面積を増やした。
実験1:5系統のMDVの排出に対するHVT-ワクチン接種の効果
200羽(n=200)のMtAb-negの1日齢のヒナを10グループに無作為に割り振り、各グループ20羽のヒナを別々のアイソレーターに収容し、1部屋あたり2つのアイソレーター(AおよびB)を使用した(S1表)。各部屋では、1つのアイソレーター(A)のヒナには生後1日目にHVTを接種し、2つ目のアイソレーター(B)のヒナにはワクチンを接種しなかった。ワクチン接種後8日目(dpv)に、すべてのヒナに5種類のMDV株のうちの1つをチャレンジさせ、それぞれの株を用いて、ワクチン未接種のヒナのグループと、HVTワクチン接種のヒナのグループに感染させた(S1表)。ワクチンおよびチャレンジウイルスの投与量は、ニワトリ1羽あたりそれぞれ約1000pfuおよび300〜600pfuであった。
各群から、事前に選択した10羽のヒナを、55dpiまで、または人道的な終点に達するまで、週2回羽毛サンプリング[56,57]した。また、各アイソレーターから週2回、あるいはニワトリがいなくなるまでダストサンプルを採取した。ダストサンプルを採取するたびに、アイソレーターの排気口のプレフィルターを取り外し、新しい清潔なフィルターと交換した。アイソレーター内では、取り除いたフィルターをポリ袋に入れて振って鶏の「ほこり」を集め、チューブに移して-20℃で保存した。
実験2:3系統のMDVの感染に対するHVT-ワクチン接種の効果
MtAb-negの生後1日目のヒナ120羽(n=120)を6つのグループに無作為に割り振り、各グループ20羽ずつを別々のアイソレーターに収容し、1部屋に2つのアイソレーター(AとB)を設置した(S2表)。各グループにおいて、10羽のニワトリを無作為に選んで「シェダー」(実験的に感染させた)鳥とし、残りの10羽を「接触したセンチネル鳥」とした。各部屋の1つのアイソレーター(Aアイソレーター)では、シェダー鳥は生後1日目にHVTを接種した。Bのアイソレーターでは、排出鳥はワクチン接種を受けなかった。生後8日目に、すべての排出鳥にMDVの3つの系統のうちの1つを接種した。センチネルはワクチン接種もチャレンジも行わなかった。ワクチンおよびチャレンジウイルスの投与量は、鶏1羽あたりそれぞれ約2,750pfuおよび1,000~1,500pfuであった。
自然感染率を直接測定するためにはセンチネルが必要であるが、センチネル自身が感染してしまうと、実験的に感染させた鳥から排出されたウイルスの量を判断することが難しくなる。そこで、675Aの研究では、MtAb陰性の生後1日目のヒナ20羽(n = 20)を2つのアイソレーターに無作為に割り振り、一方のアイソレーターの10羽には上記のようにワクチンを接種し(Aアイソレーター)もう一方のアイソレーターの10羽にはワクチンを接種しなかった(Bアイソレーター)ことで、2つの処理群を追加した(グループ4Aおよび4B、S2表)。これらの追加の20羽は、上記のように8dpvで実験的に感染させた。この2つのグループがあることで、実験的に675Aに感染させた鳥のウイルス排出率を、舎人からのウイルス汚染の問題なしに推定することができた。しかし、Md5および595については、同様の追加グループを実施するリソースがなかったため、これらの株の塵埃データ(S2図)には、最初のセンチネルが感染を開始した実験感染後約20日以降にウイルスを含む可能性のあるセンチネル鳥から排出された塵埃が含まれている(図2,S2図)。
センチネルと同居しているすべての排出鳥から週2回、52dpiまで、あるいは人道的な終点に達するまで羽毛サンプルを採取した。3日目以降、生存者がいない場合を除き、同じ時点で、すべてのセンチネルから 150μLの血液サンプルを採取し、3%クエン酸ナトリウムに浸した。同じ時期に、上述のように塵埃を採取して保存した。675Aデータの解析には、ワクチン状態が同一の実験感染鳥20羽すべての生存データ(すなわち、グループ1およびグループ4分離者のをプール)グループ4分離者の塵埃データ(S2図パネルB)およびグループ1分離者の羽毛データ(S2図パネルA)を使用した(S2表にグループを定義)。
実験3:2種類のMDV株の排出と感染に対する母方由来の抗体の効果
MtAb-negの1日齢のヒナ60羽(n=60)とMtAb-posの1日齢のヒナ60羽を無作為にグループ分けし、各グループを別々のアイソレーターに収容し、1部屋につき2つのアイソレーター(20羽のヒナを収容したAと10羽のヒナを収容したB)を用意した(S3表)。Aのアイソレーターでは、10羽のニワトリを無作為に選んでシェダーバード(すなわち、実験的に感染させた)とし、残りの10羽を接触したセンチネルとした。生後9日目に、すべての排出鳥にMDVの2つの系統のうちの1つを感染させたが、送り出し鳥には感染させなかった。それぞれのBアイソレーターでは、10羽のニワトリすべてに2種類のMDVのうちの1種類をチャレンジし、これらのアイソレーターは、10羽の感染ニワトリからのMDVの排出量を、非感染の送り出し人からのダストによる「希釈」なしに正確に測定できるように、ダストの収集に使用した。チャレンジウイルスの投与量は、ニワトリ1羽あたり100〜500pfuであった。
血液(150μL)は、チャレンジの前に、Bアイソレーターのそれぞれから事前に選択した5羽のニワトリから採取した。血清は-20℃で保存した。羽毛サンプルは、52dpiまで、または人道的終点に達するまで、週2回、Aアイソレーターのすべてのシェダー鳥から採取した。3dpi以降は、これらの同じ時間点で、すべてのセンチネル鳥から血液サンプルを採取した(または、ニワトリがいなくなるまで)。上記の各時点で(または、鶏がいなくなるまで)Bアイソレーターから塵埃を採取し、上記のように保存した。
MtAb-neg群のすべての試験鶏は、抗MDV抗体(ELISAによってアッセイされた;下記参照)に対して陰性であり、一方、MtAb-pos群のすべての試験鶏は、母体抗体に対して陽性であった。
実験4aおよびb:商業用鳥類間の感染
実験4aおよび4bでは、CVI988/Rispensワクチンを接種した鶏が産んだ卵から40羽(n=40)の市販ブロイラー種のヒナを孵化させたため、すべてのヒナがMtAb陽性となった。実験4aおよびbの基本的な実験計画は同じであり、年齢を一致させた4つの試験群、MtAb-pos、HVTワクチン接種、実験的に感染した排出鳥として機能する2つの群、およびワクチン接種状況、すなわちHVTワクチンを接種したか否かが異なるMtAb-posセンチネル鳥の2つの群のうちの1つを独立して収容した(S4表参照)。
実験4aおよび4bでは、生後1日目のヒナ40羽を、4つのアイソレーターにまたがる4つのグループに無作為に配置した(S4表)。各実験では、ワクチン未接種の各センチネルグループ内の10羽を除くすべての鳥に、約1,500pfuのHVT FC126を生後1日目に皮下注射で接種した。生後8日目に、シェダーとなる2つのグループにvv+ MDV 675Aを腹腔内投与で約725pfu接種した。血液(150μL)と羽毛のサンプルは、21dpiまでは週2回、それ以降は週1回、すべての鳥から採取した。塵埃サンプルは、上記と同様に、ハウジングの空気抽出フィルターから毎週採取した。
PBL、羽毛、および塵埃試料のDNAおよびリアルタイムPCRの調製
ウイルスの力価は、以下のようにPCRによって間接的に測定した。末梢血リンパ球(PBL)および羽の先端のサンプルは、以前に記載されたように調製した[56,57]。各ダストサンプルは、3回に分けて5mgのアリコートにした。DNeasy-96キット(Qiagen)を用いて、細胞(PBL)または組織(フェザーチップおよびダスト)からのDNA抽出に関する製造者の指示に従って、PBL、フェザーおよびダストの各サンプルから全DNAを調製した。MDV-1のmeq遺伝子およびニワトリのオボトランスフェリン(ovo)参照遺伝子を増幅するリアルタイム定量二重PCR(q-PCR)を、既述の通りMDVゲノムの絶対定量に用いた[56]。このアッセイでは、HVTワクチンウイルスは検出されない。標的DNAとして羽毛チップまたはダストサンプルを用いたすべての反応には、メラニン色素の阻害効果を克服するため、10μgのウシ血清アルブミンが含まれていた[56]。MDV1感染CEF(meq反応)および非感染CEF(ovo反応)からのDNAの10倍連続希釈液を用いて作成し,既知の標的遺伝子コピー数のプラスミドコンストラクトに対して正確に較正した標準曲線を用いて,104細胞当たりまたはμgダスト当たりのMDVゲノムを定量した。
MDVに対する母体由来の抗体の測定
孵化したヒナの血清サンプル中のMDVに対する母体由来の抗体を測定するために,酵素結合免疫吸着法(ELISA)を実施した[58]。血清サンプルは、MDV感染または非感染の細胞溶解物でコーティングされたELISAプレート上で、1:100の希釈で二重に試験した。ネガティブコントロールとして非感染ニワトリの血清を、ポジティブコントロールとしてMDV1感染ニワトリの血清を使用した。
統計解析
すべてのデータおよびすべての図を作成するために使用したRコードは、Dryadリポジトリに預けられている: dx.doi.org/10.5061/dryad.4tn48 [59]。
ニワトリのグループについて、PBL、羽の先端またはダストのウイルスゲノムコピー数の平均値は、個々のサンプルについてlog10変換したコピー数を用いて決定した。羽根の先端のデータについては、t-分布を用いて平均値の95% c.i.を計算した。塵埃のデータについては、平均データの95%C.I.を±2標準誤差に近似した。粉塵中のウイルス濃度のプロット値は、前回のプロットされたサンプル(フィルターを最後に交換したとき)からの累積粉塵量に基づいたサンプルのものである。各センチネルニワトリについて、PBLからqPCRによりMDVが初めて検出された時刻(Time to positivity)を記録した。陽性化までの時間は、連続した時間ポイントでq-PCR Meq Ct値が40未満となった最初のサンプリング時間とした。生存期間または陽性になるまでの期間の統計的比較は、GraphPad Prism v5を用いてプロットしたKaplan-Meier生存曲線にMantel-Cox検定を適用して行った。
ウイルスの感染力の重要な要素である感染力を評価するために、感染期間中の累積ウイルスゲノムコピー数(VCN)の排出率を算出した。羽根から排出されるウイルスは感染性MDVの唯一の供給源であり,MDVに汚染された塵埃は何ヶ月も感染力を維持するため,累積VCN排出量は感染力の良い代用となる[16-18]。VCNの累積排出量は、1羽から排出される塵埃の時間的変化、排出される塵埃1個あたりのVCN濃度の時間的変化、そして感染の寿命の3つの要素から一意に決定することができる。実験1-3では,後者2つの値を直接測定し,前者の値は以前に推定されたものである[28].これらの指標を用いて累積VCNを算出した方法の詳細は,S1プロトコルに記載した。
実験4では,前哨鳥の羽毛嚢中のウイルスゲノム濃度を推定した。センチネル鳥は、実験感染した鳥と同居していたため、ウイルス陰性の羽毛軸が感染した鳥の粉塵で汚染される可能性がある。そこで、S2プロトコルに記載されているように、羽毛のパルプ中のウイルス陽性度の定量的な閾値を設定した。感染期間(図4D)は、ウイルス力価が初めてこの閾値を超えてから鳥が死亡するまでの期間とした。
