Contents
Impact of COVID-19 on Alzheimer’s Disease Risk: Viewpoint for Research Action
www.mdpi.com/2227-9032/8/3/286/htm
要旨
コロナウイルス感染症19(COVID-19)発生の真っ只中にあって、科学界の主な努力は、急性の重篤な症状を治すための効率的な薬理学的治療法の特定と信頼性の高いワクチンの開発に集中している。
一方で、重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)陽性者では、ウイルス感染が長期的な影響を及ぼし、認知症や神経変性疾患などの慢性疾患につながる可能性があることを排除することはできない。
SARS-CoV-2感染者の年齢を考慮すると、神経侵襲性は神経変性疾患の発症につながる可能性がある。本研究では、SARS-CoV-2感染とアルツハイマー病リスクとの関連性を解析し、疾患発症の根底にある可能性のあるメカニズムを仮説化した。
このことから、明日に備えて、今日からアルツハイマー病とCOVID-19の関連性を実験的に検討する必要があると考えられる。
キーワード
SARS-CoV-2感染;神経浸潤;ACE2;アルツハイマー病リスク
1. 序論
認知症は、世界中の高齢者の間で障害や依存症の主な原因の一つとなっている。影響を受けた人だけでなく、その介護者や家族にとっても負担が大きく、直接的・間接的な医療費の負担が非常に大きい。世界認知症観測所の推計によると、世界では約5000万人が認知症に罹患しており、毎年1000万人近くが新たに発症しているという。
認知症患者の総数は、2030年には8200万人、2050年には152人に達すると予測されている[1、2]。さらに最近では、世界保健機関(WHO)が認知症を公衆衛生上の優先事項として認めている。2017年5月、世界保健総会は、行動のための包括的な青写真を提供するために、「認知症への公衆衛生対応に関する世界行動計画2017-2025」を承認した。
診断、治療とケア、介護者への支援、研究とイノベーションなど、さまざまな分野の政策・公衆衛生機関の中から数名のスピーカーが参加した[3]。認知症の中でもアルツハイマー病(AD)は最も一般的な認知症であり、症例の60~70%を占めると考えられている[1、4]。
その最初の記述から100年以上が経過した今でも、アルツハイマー病は診断と治療の両面で、管理する上で大きな課題となっている。これまで有効な治療法は発見されておらず、その主な理由は、その原因の多くの暗部が解明されていないことにある。一方、科学的な研究は、ある種の病的事象の発生の早さを明らかにするという重要な成果をあげている。
現在では、症状が現れる少なくとも10~20年前に疾患が始まることが十分に確立されており[5、6]、正確な分子変化(すなわち、βアミロイド負荷およびリン酸化タウ)と生物学的プロセス(すなわち、神経炎症、ミトコンドリア機能不全、酸化ストレス)が存在する[7、8、9、10、11]。
2. アルツハイマー病のウイルス脳感染説
アルツハイマー病と感染症理論の間のリンクは、クラミジア肺炎、ボレリアスピロケテス、ヘリコバクターピロリ、単純ヘルペスウイルス(HSV)[12]を含む病原体のAD死後脳での存在の証拠によって提起された。単純ヘルペスウイルス1型(HSV1)とADリスクとの間の強い関連はまた、アポリポ蛋白E遺伝子(APOE-ε4)の4型対立遺伝子のキャリアにおける中枢神経系(中枢神経系)の高い感染率によって示唆されている、よく認知された遺伝的ADリスク[13、14]は、血管内のペリサイトを損傷することによって血液脳関門の破壊を加速することができることも発見された[15]。
WozniakとItzhakiは、APOE-ε4キャリアの脳内に潜伏しているHSV1が、免疫抑制、末梢感染、炎症などのイベントによって断続的に再活性化され、最終的にはADの発症に至ることを示した[16]。さらに、1000人以上のアルツハイマー病患者の死後脳組織において、健常高齢者や別の神経変性疾患を有する患者の脳組織と比較して、ヒトヘルペスウイルス6A(HHV-6A)およびヒトヘルペスウイルス7(HHV-7)のレベルの上昇が認められている[17]。
広く受け入れられていないADのウイルス説に関連した未解決の疑問の一つは、ウイルス感染と慢性的な神経機能障害との間の因果関係の承認が十分に認められていないことである。しかし、脳に感染するウイルスの生物学的動態とその結果として生じる宿主の反応は、診断ツールの改良と動物モデルから得られた教訓を合わせると、より多くのより微妙な神経学的状態のウイルスの因果関係の可能性を提起している。
ウイルスはニューロンに損傷を与え、ニューロンの機能不全(すなわち、神経伝達物質の放出に影響を与える)、あるいは死滅(すなわち、サイトメガロウイルスで起こるように細胞を溶解させたり、小水疱性口内炎ウイルスで示されるようにアポトーシスを誘導したりする)を引き起こしたり、あるいは間接的に感染細胞に対する免疫反応を活性化させたりして、神経変性プロセスを開始させる可能性がある[18]。
3. SARS-CoV-2の脳内感染による神経症状の発現
2019年12月下旬から、陽性鎖RNAウイルスである重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)による新規感染が100カ国以上に広がり始めた[19、20]。2020年3月、世界保健機関(WHO)は、世界的に70万人以上の死者を出したパンデミックの発生を宣言した。当初、コロナウイルス疾患19(COVID-19)は重度の呼吸器症候群を引き起こす気道に限定されていると考えられていたが、すぐに、ウイルスが中枢神経系を含む他の臓器に侵入する可能性があることが明らかになった。
Maoらは、214人のCOVID-19患者を対象とした最初の研究の1つで、重症患者のうち36.4%が急性脳血管障害や意識障害を含む神経学的症状を示したことを明らかにした[21]。さらに、最近ではCOVID-19との神経学的関連性に関する文献が更新されつつある[22、23、24、25]。
SARS-CoV-2が細胞内に侵入するメカニズムは、アンジオテンシンIおよびIIをより小さなペプチドであるAng(1-9)およびAng(1-7)に切断する膜貫通型プロテアーゼであるアンジオテンシン変換酵素2(ACE2)との結合を媒介としている[26]。ACE2は主に気道上皮、肺実質、血管内皮、腎臓、小腸、脳に存在する[27、28]。
SARS-CoV-2がどのようにして中枢神経系に侵入するかはまだ明らかにされていないが、重症急性呼吸器症候群コロナウイルス(SARS-CoV)や中東呼吸器症候群コロナウイルス(MERS-CoV)など、他のコロナウイルス(CoV)との類似性がいくつか見出されている。
増加している証拠は、CoVが最初に末梢神経末端に侵入し、その後シナプス接続ルートを介して中枢神経系にアクセスする可能性を示している[29、30、31]。さらに、トランスジェニックマウスを用いた実験研究では、CoVが経鼻的に投与されると嗅神経を介して脳に到達することがさらに明らかになっている[32、33]。
興味深いことに、COVID-19の軽度から中等度の疾患例では、患者は嗅覚(85.6%)および味覚(88.0%)の機能障害を報告した。重要なことに、約11%の患者では、他の臨床症状の前に無呼吸が起こっていた[34]。
宿主受容体の組織分布は、一般的にウイルスのトロピズムと一致していると考えられている[35]。この目的のために、最近、RNA-seqライブラリーを解析し、健康なヒトドナーの複数の組織から得られた単細胞RNAシーケンスデータにおけるウイルス侵入関連遺伝子の発現を調べた研究が行われている[36、37]。その結果、SARS-CoV-2の侵入受容体ACE2が鼻杯細胞と繊毛細胞で高発現していることが明らかになった[37]。
脳内でのACE2の分布は完全には明らかにされていないが、Doobayらはマウスの脳内にACE2タンパク質とmRNAが存在し、主に神経細胞に存在することを示した[38]。彼らは選択的抗体を用いて、ACE2が脳全体に広く分布しており、脳幹の心肺ニューロンなどの心血管機能の中枢制御に関わる核や、運動野やラペーなどの非心血管領域にも存在していることを発見した[38]。
最近、Chenらは、公開されている脳トランスクリプトームデータベースのデータを解析して、ヒトの脳におけるACE2の発現を調べた[39]。この空間分布解析によると、ACE2は比較的高発現で、黒質や脳室などの特定の脳領域に選択的に発現していることが明らかになった。
さらに、細胞型分布解析では、アストロサイト、オリゴデンドロサイト、ミクログリア細胞など、多くの神経細胞や非神経細胞、ヒトの中側頭回や後帯状皮質でACE2が発現していることがわかった。前頭前野や海馬では、ACE2を発現する細胞は比較的少なかった[40]。
SARS-CoVのもう一つの潜在的な経路は、脳室の脈絡叢全体で脳脊髄液(脳脊髄液)に入り込み、脳に広がることであると考えられる。実際、マウスの脳では、側脳室の脈絡膜叢でACE2の発現が比較的高いことが確認されている。最近では、日本の24歳男性COVID-19患者の脳脊髄液サンプルからもSARS-CoV-2が遺伝子配列決定により発見されている[41]。
4. SARS-CoV-2感染がアルツハイマー病増悪に及ぼす影響の可能性
SARS-CoV-2感染が、顕在化する前に数十年続く神経変性プロセスを黙って開始または加速する可能性があるという懸念は、すぐにアルツハイマー病を想起させるかもしれないし、我々は次の10-15年に推測しなければならない可能性のある新しい症例の推定である。
現在のところ、COVID-19とAD発症との間の相関関係を示唆する証拠はない。現在は、将来的に実験的に証明されなければならない様々な可能性のある仮説を描くことしかできない。
βアミロイド(Aβ)がAD発症の重要な因子であることはよく知られている[42、43、44]。これは、膜貫通タンパク質であるアミロイド前駆体タンパク質(APP)の切断に由来する。AβとADの間の関連は、最初に、3つの遺伝子、すなわち、アミロイド前駆体タンパク質(APP)、プレセニリン1、プレセニリン2に関連する変異の家族例での発見によって示唆されており、すべてがAβの蓄積につながっている。
ADのβアミロイド説は、さまざまな生体内試験(in vivo)実験モデルやヒト臨床試験によってさらに裏付けられている。薬理学的研究は現在、主にAβ負荷の低減に焦点を当てている。
増え続ける証拠は、Aβ負荷が脳のAD関連分子の変化の中で最も早いものの一つであり、症状が現れる20年前から始まっていることを示している。さらに最近では、ウイルス感染とβアミロイドとの間の興味深い関係が提案されている。
Sosciaらは、抗菌ペプチド(AMP)としてのAβの生体内試験(in vivo)での機能を支持するデータを提供した[45]。著者らは、ADの全脳ホモジネートにおいて、年齢をマッチさせた非ADサンプルと比較して有意に高い抗菌活性を示し、AMP作用がAβレベルと相関していることを示した。
Aβを介在する活性と一致し、増加した抗菌作用は、抗Aβ抗体を用いたAD脳ホモジネートの免疫除去によって抑制された。これらの知見によれば、ウイルスの一過性感染は、脳内のAβ蓄積を開始または加速させ、ADにつながる可能性がある。
また、一過性のウイルス感染によって活性化された中枢神経系の陽性炎症反応は、脳内Aβの持続的な蓄積によって、異常な自己永続性の自然免疫反応に発展する可能性があると考えられる。神経炎症は、ADのもう一つの初期の特徴である。
ACE2を発現する組織に対するウイルスのトロピズムを考えると、脳レベルでもACE2の発現をアップレギュレートするすべての条件は、ウイルス侵入のリスクを高め、神経変性につながる分子過程の活性化に寄与する可能性がある。
例えば、レニン-アンジオテンシン系(RAS)を標的とした降圧薬の血圧降下作用や心血管疾患の改善作用の一つとして、中枢神経系でもACE2/Ang-(1-7)/Mas軸の活性化が考えられている。実際、ACE2経路は心臓の圧反射機構のニューロモジュレーターとして極めて重要な役割を果たしており、このシステムの感度向上につながっている[46、47]。
また、中枢性Ang-(1-7)は、高血圧ラットにおいてノルエピネフーリン放出を抑制し[48]、抑圧反応を誘導し[49、50、51]、ブラジキニンレベルを上昇させ[52]、ブラジキニンの血圧降下作用を増強し[53]、バソプレシン[54]および一酸化窒素(NO)放出を増加させ[55]、心筋梗塞の発症を抑制することが知られている。
一方、ACE2/Ang-(1-7)/Mas軸は、脳卒中や認知機能障害モデルを含む脳損傷の様々な実験パラダイムにおいて、神経保護的な役割を示した[56、57、58]。ACE2神経保護は、ACE1活性の低下、Ang-IIレベルの低下、AT1R発現の低下などのRASシグナル伝達の低下[59、60、61]、酸化ストレスや神経炎症の低下と関連している。
さらに、Ang-(1-7)は、齧歯類において、長期電位とシナプス可塑性を仲介し、Mas受容体の活性化後に認知を改善することが示されているが、この保護効果はMas KOマウスでは廃止された[62、63]。
RASを標的とした降圧薬で治療された被験者で見られるADの発生率の低下は、脳内ACE2の発現の増加に起因していた [64、65、66、67、68]。中年(13-14ヶ月)の症候性AD Tgマウスでは、ジミナゼンアセツル酸塩(DIZE)投与によりACE2/Ang-(1-7)/Mas軸が活性化され、海馬のAβ、神経炎症が低下し、認知機能が回復した[69]。
したがって、これらの知見は、分子病理学的事象が確立されたADにおいても、中枢神経系でのACE2過剰発現の有益な効果を裏付けるものである。
一方で、RAS を標的とした降圧薬の使用は、最終的には神経炎症や Aβ負荷を引き起こす可能性のある脳ウイルスの侵入にさらされた場合に、長期的な AD 関連の病理学的プロセスを誘発する両刃の武器になる可能性がある。
また、上述したように、ACE2の増強は脳内のNOの増加を誘導し、生理学的レベルでは神経調節や免疫調節にプラスの効果があるが、比較的大量に産生されると神経毒性となり、ADの発症に関与している[70、71]。
アストロサイト、ミクログリア、および血液由来のマクロファージもまた、持続的な感染に応答してNO放出に関与しているか、あるいは炎症を誘発するメディエーターの継続的な沈着にも関与しており、ADの文脈ではAβ(可溶性およびフィブリル型の両方)[72、73、74、75]であるかもしれない。
これらの薬剤の使用と急性呼吸窮迫症候群の発生率の増加または悪化との間には、現在のところ関連性が見出されていないことに言及しなければならない。しかし、これらの薬剤が中枢神経系レベルで長期的な影響を及ぼす可能性を先験的に排除することはできない。
CoV感染の持続はまた、神経免疫応答を誘発する可能性があり、したがって、SARS-CoV-2の中枢神経系のマクロファージ、ミクログリアおよびアストロサイトに感染する可能性のある能力は、特に重要である。
神経刺激性ウイルスはグリア細胞を活性化し、炎症促進状態を誘導することができる[76]。サイトカインストームの重要なメンバーであるインターロイキン(IL)-6は、COVID-19の症状の重症度と正の相関がある[77]。
脳内に常駐する自然免疫細胞であるミクログリアは、神経変性疾患の病理学に長い間関与してきた。蓄積された証拠は、活性化されたミクログリアが、プロ炎症性メディエーターや活性酸素/窒素種を含む複数の神経毒性因子の慢性的な供給源となり、進行性の神経細胞障害を引き起こすことを示唆している。
ミクログリアは、病原体感染などの単一の刺激、または複数の刺激への暴露によって慢性的に活性化され、時間の経過とともに累積的なニューロン損失を引き起こす可能性がある [78]。さらに、脳を標的としたSARS-CoV-2感染は、脳内で活性化したミクログリアを誘導し、最終的には慢性炎症と神経変性を引き起こすという仮説も立てられる。
APOEε4は、より一般的なAPOEε3(APOE3)対立遺伝子と比較して、用量依存的にADリスクの増加と関連していることがよく知られている[79、80]。APOE4の2コピーの継承は、APOE3の2コピーを持つ人のリスクと比較して、ADを発症する確率を12倍に増加させ、一方、APOE4の1コピーはADの確率を3倍に増加させ、平均発症年齢を76歳に低下させる[79]。
最近、英国バイオバンク・コミュニティ・コホート(n = 451、367)では、ApoE e4e4(ホモ接合体)遺伝子型もまた、既往の認知症、心血管疾患、および2型糖尿病とは無関係に、重度のCOVID-19感染のリスクの増加と関連していることが明らかになった[81]。
ApoE遺伝子型とCOVID-19の重症度との関連性の生物学的メカニズムをより深く理解するためには、さらなる研究が必要であるが、APOE4の比較的研究が進んでいないいくつかの役割を強調することは重要である。
新しい知見は、APOE4がAβ病理や脂質の恒常性に影響を与えるというよく知られた役割を超えて、神経細胞の炎症に強い影響を与え、病理学的なタンパク質を脳内に拡散させる可能性があることを示している。ヒトの死後の研究では、CD68、Human Leucocyte Antigen-DRアイソタイプ、CD64を含む複数の活性化マーカーを用いて脳の異なる領域で定量化した場合、グリオシスはAPOE4キャリアと有意に関連していることが明らかになった[68、69]。
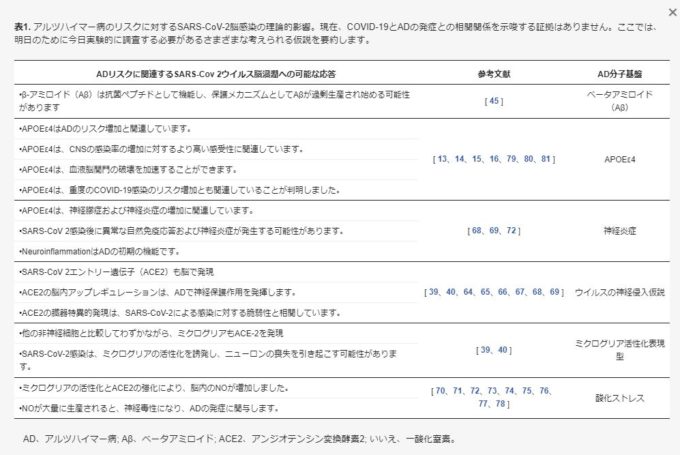
したがって、アストロサイトやミクログリア細胞などのウイルス感染後の脳内自然免疫応答とAPOEε4表現型との相互作用は、神経炎症を持続させ、AD増悪に導く原動力として、十分に研究されるべきである。SARS-CoV-2脳感染がアルツハイマー病リスクに与える理論的影響に関するこれらの仮説をすべて表1にまとめた。
表1. SARS-CoV-2脳感染がアルツハイマー病リスクに与える理論的影響。
現在のところ、COVID-19とAD発症との間の相関関係を示唆する証拠はない。ここでは、明日に備えて今日実験的に調査する必要があるさまざまな可能性のある仮説をまとめている。
5. 研究への示唆
ADの主要な原因の理解と効果的な治療法の特定のための進歩を含む、ADと戦うためにいくつかの研究と資金援助の努力が配置されている。しかし、ADの引き金となる分子の変化は、病気が悪化する何年も前から脳内に蓄積され始めるため、AD研究はいくつかの合併症に直面しなければならない。
神経変性、炎症、酸化ストレスは、症状が起こる前の長い時間の間、脳に亜種的な打撃を与えるため、脳を標的とした新たなダメージを与える侮辱は、脳の変化をさらに悪化させる可能性がある。
このように、研究の観点から、世界で2200万人が罹患した新しい一過性の感染症とADリスクとの関連性を無視しないことが重要であり、さらにSARS-CoV-2罹患患者におけるACE-2とAβとの関連性を調べることを支持することが重要である。
薬理学的治療と非薬理学的治療の両方を予測した予防戦略[82、83、84、85、86]は、この観点からの支援となるであろう。