IGF-1: The Jekyll & Hyde of the aging brain
www.ncbi.nlm.nih.gov/pmc/articles/PMC5988994/
要旨
IGF-1シグナル伝達経路は、げっ歯類からヒトに至るまで、老化プロセスの主要な調節因子として浮上している。しかし、IGF-1の多元的作用を考えると、脳の老化におけるIGF-1の役割は複雑であり、論争の的となっている。IGF-1は中枢神経系の正常な発達に不可欠であることは明らかであるが、認知機能や脳血管障害、神経変性疾患との関係については、前臨床研究やヒトの研究から相反する証拠が出てきている。
本レビューでは、前臨床研究と臨床研究を網羅して、加齢脳におけるIGF-1の役割を検討しているエビデンスの現状を掘り下げていく。データを幅広く検討した結果、IGF-1は脳の老化において、基礎となる病態や状況に応じて、実際に相反する役割を果たしている可能性があることが示された。
アルツハイマー病のように脳内に異常なタンパク質沈着を示す神経変性疾患では、IGF-1シグナルを減少させることで、疾患の進行を遅らせ、細胞の恒常性を維持するために病理学的タンパク質のクリアランスを増加させることで、保護的な役割を果たす可能性があることを示唆する証拠もある。
一方、IGF-1欠乏症を引き起こすと、認知機能や神経血管系の機能障害にも関与することが示唆されており、正常な脳機能にはIGF-1シグナル伝達が必要である可能性が示唆されている。さらに、成長、修復、生存のシグナルを必要とする急性神経細胞損傷の状態は、通常、その文脈でIGF-1の好ましい効果を示している。
加齢脳におけるIGF-1の「ジキル博士」と「ハイド氏」という相反する特性を理解することで、IGF-1の影響を理解し、より的を絞ったIGF-1関連の介入策を考案することが可能になるだろう。
キーワード
アルツハイマー病、認知、パーキンソン病、中枢神経系
序論
成長ホルモン/インスリン様成長因子-1(GH/IGF1)シグナル伝達経路は、ソマトトロピック軸とも呼ばれ、老化過程に広く関与している(Bartke, er al 2003; Barzilai, er al 2012; Brown-Borg and Bartke 2012; Kenyon 2010)。この保存されたシグナル伝達経路の減衰は、多数のげっ歯類モデルにおいて、加齢に伴う疾患の発生を減少させ、生存期間を延長することが実証されている(Brown-Borg, er al)。 1996; Ikeno, er al 2003; Kinney, er al 2001a; Kinney, er al 2001b)。
驚くべきことに、この経路はまた、IGF-1シグナル伝達の減衰をもたらすIGF-1Rの機能的変異が百歳代の女性に多く見られることから、ヒトの老化にも関連しているようである(Suh, er al 2008; Tazearslan, er al 2011)一方で、IGF-1レベルによって非百歳代の女性を層別化すると、IGF-1が低い女性では生存率が高いことが明らかになった(Milman, er al 2014)。
同様に、血清IGF-1レベルの低さは、女性の間で100年目の後半に認知障害からの保護と関連していた(Perice, er al 2016)。
中枢神経系(CNS)におけるIGF-1の役割は、IGF-1が中枢神経系機能および疾患リスクに対する好影響、有害影響、無関心影響にリンクしている証拠があり、論争の的になっているとはいえ、特に興味をそそられる研究領域である。
このレビューでは、前臨床研究と臨床研究から明らかになった矛盾点と論争点に特に焦点を当てて、加齢脳におけるIGF-1の役割を検討している証拠の現状を掘り下げていきたい。
IGF-1と脳
内分泌 vs. 自分泌 IGF-1
他の多くの組織と同様に、脳は内分泌と自己分泌の2つのIGF-1の供給源にさらされている。成長ホルモン放出ホルモン(GHRH)とグレリンに反応して下垂体から分泌されるGHパルスの制御下にあるIGF-1の内分泌産生の制御は、主に古典的な負のフィードバックループで構成されており、他の場所で広範囲に記述されている(Berelowitz, er al)。 1981)。
要するに、GHはGH受容体に結合して主に肝臓でIGF-1産生を刺激し、循環IGF-1レベルが上昇すると、下垂体と視床下部でIGF-1受容体(IGF-1R)への結合が亢進し、それぞれGHとGHRHの分泌が抑制される。
肝由来の IGF-1 は、循環する IGF-1 総量の約 70%を占めており(Ohlsson, er al)。 早期には、IGF-1は中枢神経系全体に豊富に発現し、正常な脳の発達に不可欠である。
神経細胞の発達における自家分泌IGF-1の重要な役割は、グローバルなIGF-1の欠損または不感症をもたらす突然変異が、小児における小頭症および認知欠損として現れるという知見によって証明されている(アミロイドβuzzahab, er al 2003; Netchine, er al 2011; Woods, er al)。 1996)。
対照的に、GH欠損または抵抗性をもたらす突然変異は、正常な認知能力を示すことが多い(Kranzler, er al)。 1998)ことから、これらの個体では自家分泌脳IGF-1産生が維持されている可能性が示唆されている(Joseph D’Ercole and Ye 2008)。” 循環では、ほとんどのIGF-1はIGF結合タンパク質(IGFBP)に結合しており、IGFBP-3が最も多く、したがって不活性である(Baxter 2000; Holly and Perks 2012; Rajaram, er al)。 1997)。IGF-1は、細胞表面上の高親和性IGF-1Rに結合することにより、組織内でその作用を発揮する(Holly and Perks 2012);
特筆すべきことに、IGF-1はインスリン受容体にも結合するが、親和性ははるかに低い(Novosyadlyy and Leroith 2012)。IGF-1とIGF-1Rとの結合は、インスリン受容体基質(IRS)分子のリン酸化と、それに続くホスホイノシチド3-キナーゼ-タンパク質キナーゼB(PI3K-Akt)およびそれを調節するマイトジェン活性化タンパク質キナーゼ(MAPK)経路の活性化を含む複雑な細胞内シグナル伝達カスケードを開始する。
いくつかの下流エフェクターのうち、ラパマイシンの機械的標的(mTOR)活性とフォークヘッドボックスO(FoxO)転座(Taniguchi, er al 2006). これらの経路を介したシグナル伝達は、オートファジー、成長、ストレス抵抗性、酸化ストレス、寿命に影響を与える(Barzilai er al)。
IGF-1と脳の老化
脳では、自己分泌性のIGF-1産生は発達期にピークを迎えると考えられている(Joseph D’Ercole and Ye 2008)。一方、IGF-1の内分泌産生、およびおそらく中枢神経系へのIGF-1の入力は、初期の間は高いままで、思春期にピークを迎え、この時期は細胞の急速な増殖と直線的な成長と一致している(Yamamoto, er al)。 3年目までにIGF1産生量は急激に減少し、その後も加齢に伴って着実に減少していくため、脳の老化現象におけるIGF-1レベルの低下の潜在的な役割について疑問が呈される(Yamamoto er al)。
IGF-1の内分泌低下は、加齢に伴って観察されるGHパルスの振幅と頻度の低下に起因しているが、その原因の少なくとも一部は、成長ホルモン分泌促進受容体(GHSR)へのグレリン結合が減少したことにある(Sun, er al 2004);したがって、高齢者ではGHの分泌は安定しているが低レベルである(Carlson, er al)。
限られた証拠は、脳内IGF-1産生がGHの調節とは独立して作用すると考えられているにもかかわらず、全身性IGF-1レベルの低下と同時に、脳脊髄液および脳組織レベルによって評価される局所産生も、加齢とともに低下することを示唆している(Ashpole, er al 2015)。
実際、老化したげっ歯類モデルからの観察では、IGF-1の利用可能性が低下している状況下で脳のIGF-1シグナル伝達を維持するための代償的な試みとして、脳の海馬および皮質領域においてIGF-1R転写が年齢とともに増加することが示されている
;しかしながら、この反応は、IGF-1を若々しいレベルに戻すのには不十分であり、老化した動物の脳におけるIGF-1レベルは、若い動物と比較して低いままである(Ashpole, er al 2015)。加齢に伴う局所的および全身的なIGF-1レベルの低下に加えて、老化した脳がIGF-1シグナル伝達に抵抗性である可能性があるという証拠もある(Muller, er al 2012)。
加齢とともに自己分泌系および内分泌系のIGF-1レベルが低下しているという観察結果と、加齢が認知機能の低下や脳に影響を及ぼす疾患のリスクの増加と関連しているという知見から、IGF-1が脳の老化に関与しているのではないかという疑問が湧いてくる。
IGF-1と認知
疫学的・臨床的研究
加齢に伴う認知機能の低下は、より進行性の形態では、脳血管虚血やアルツハイマー病などの原因に起因する軽度認知障害(MCI)または二次的な認知症を特徴とすることがあり、ますます高齢化が進む人口にとって大きな負担となっており、その発症を遅らせたり予防したりするために、これらの状態の根本的な要因を特定することが急務となっている(Langa, er al 2017; Prince, er al 2016; Wu, er al 2017)。
IGF-1と認知領域との間に考えられる関係について、ヒトおよびげっ歯類を用いた研究が行われており、時には相反するとはいえ、興味深い関連性を明らかにしている(Frater, er al 2017)。
中高年成人を対象とした多くの横断的研究により、IGF-1レベルと認知との間に正の相関があることが明らかにされている(Al-Delaimy, er al 2009; Doi, er al 2015; Wennberg, er al 2018)。しかし、この観察は常に男女間で一貫していたわけではなく、有意な所見は異なる研究において男性または女性に限定されていた(Al-Delaimy et al 2009;Wennberg et al 2018)。
一方、別の横断的分析では、60歳以上の男性においてIGF-1と認知処理能力との間に逆の関係が認められた(Tumati, er al 2016)。同様に、例外的に長寿のコホートでは、IGF-1レベルが低い方の女性は、IGF-1レベルが高い方の女性と比較して、認知機能障害の有病率が50%近く低かった(Perice er al 2016)。
同様に、プロスペクティブ研究では、この論争に決着をつけることはほとんど行われていない。ある研究では、ベースラインの血清IGF-1レベルと高年齢女性の将来の認知能力との間に正の関連があることが示された(Okereke, er al 2007)が、別の研究では男性では関連がないことが示された(Green, er al 2014)。
しかし、別のプロスペクティブ解析では、8年間の追跡調査後にベースラインのIGF-1レベルが最も高かった男性で認知スコアが低いことが示された(Tumati et al 2016)。血清IGF-1レベルの高値はまた、認知症のない中高年の成人においてMRI上の脳の総体積が大きいことと相関していたが、海馬体積との関係は指摘されなかった(Westwood, er al)。
臨床試験は、IGF-1の認知における役割に関する不確実性をさらに煽っている。20週間の介入試験では、健常者またはMCIを有する高齢者において、GHRH投与による認知機能への有益な効果が示された(Baker, er al 2012)。しかし、高齢女性における末梢性IGF-1の1年間の実験的な置換試験では、認知転帰において識別可能な有益性を達成することができなかった(Friedlander, er al)。 ヒトを対象とした研究から得られた結果は、加齢に伴う認知機能におけるIGF-1の役割についての決定的な解決策を提供するものではないが、コホート間の実質的な不均質性、認知評価ツール、および認知機能の定義を考慮して解釈されるべきである。より正確な特徴付けを行うために、長期的な追跡調査を行うことで、将来的にはこの不確実性を明らかにすることができるかもしれない。
分子および動物実験
げっ歯類では、加齢に伴う認知を対象とした研究はほとんど行われていない。しかしながら、老齢雄性フィッシャーブラウンノルウェー(FBN)ラットに1ヶ月間にわたってIGF-1を脳室内(ICV)注入により投与することの潜在的な治療効果を探った1つの研究では、空間参照記憶および作業記憶の点で認知機能が改善されたことが示された(Markowska、他、1998;Pardo、他 2018)。また、高齢の雄性FBNラットでは、記憶領域の獲得に重要な脳領域である海馬で新たに生成される細胞の数が減少し、ニューロンに分化する新生細胞が有意に減少することが示されている(Lichtenwalner, er al 2001)。
しかし、IGF-1のICV投与は、前駆細胞の分化や新生細胞の生存には影響を与えずに、海馬の神経新生を有意に回復させたが、これは、以前にこの系統のラットで観察された認知機能の改善に関連している可能性がある(Lichtenwalner er al 2001)。
さらに、IGF-1を発現するアデノウイルスをICVに注入した古い雌のSprague-Dawleyラットは、脳脊髄液中のIGF-1レベルの増加、およびバーンズ迷路によって評価された神経新生および空間記憶の回復をもたらした(Pardo er al 2018; Pardo, er al 2016)。このモデルでは、シナプス機能および神経新生に関連する遺伝子の転写がアップレギュレートされた(Pardo et al 2018)。
生後3〜4ヶ月でのIGF1R遺伝子のアストロサイト特異的ノックアウトは、マウスのワーキングメモリの障害をもたらした;しかしながら、この介入がより高い年齢でどのような効果をもたらすかは知られていない(Logan, er al 2018)。
興味深いことに、循環性GHおよびIGF-1欠損を特徴とする長生きエイムズドワーフマウスの雄および雌の両方は、年齢をマッチさせた対照と比較した場合、記憶試験のパフォーマンスに基づいて、年齢とともにより良好に維持される正常な認知機能を有する(Kinney et al 2001b)。これらの動物における局所的なIGF-1産生が亢進していることを示すいくつかの証拠があるが(Sun, er al 2005)、自分泌IGF-1産生が認知機能の健康に重要な貢献をしている可能性を示唆しているが、その後の研究では、これらの結果は確認されておらず、これらのマウスの大脳皮質および海馬におけるIGF-1レベルが野生型のコントロールと比較して低いことが認められた(Puig, er al 2016)。
逆に、全身性IGF-1レベルが約70%減少している肝臓特異的IGF-1欠損(LID)マウスは、自己分泌性IGF-1産生が維持されているにもかかわらず、空間学習および記憶(Water Mazeによって評価される)の減少を含む初期の海馬依存性認知障害(Trejo、他 2007)を発現する(Svensson、他 2006; Trejo他 2007)。しかしながら、これらのマウスはまた、IGF-1によるフィードバック阻害の欠如のために、著しく上昇したGHレベルを呈し、インスリン抵抗性をもたらし(Haluzik, er al 2003)GHおよびインスリンにおけるこれらの摂動もまた、このモデルで観察される神経細胞および血管機能障害に直接寄与する可能性がある(Bailey-Downs, er al 2012; Talbot, er al 2012)。
IGF-1とアルツハイマー病
疫学的・臨床的研究
記憶力の漸進的な低下と自立した機能の喪失によって特徴づけられるアルツハイマー病は、高齢者、その家族、および医療システムにとって大きな負担となっている(Callahan 2017)。
IGF-1はアルツハイマー病患者において広範囲に調査されているが、研究のほとんどは観察的なものであり、疫学的文献ではこのトピックを取り囲む実質的な論争が続いている。
9件の症例対照研究のメタアナリシスでは、IGF-1レベルとアルツハイマー病との間の関連を見つけられず、個々の研究では、対照と比較してアルツハイマー病患者の血清IGF-1レベルが高い、類似している、低いことが示されている(Ostrowski, er al 2016)。
一方、プロスペクティブ研究では、ベースラインの血清IGF-1レベルとアルツハイマー病リスクとの間に逆相関があることが示され(Westwood et al 2014年)アルツハイマー病患者の分析では、ベースラインの血清IGF-1レベルの低下が2年間の認知機能低下のより速い進行と関連していることが報告されている(Vidal et al 2016)。
さらに、アルツハイマー病の進行に対するGH分泌促進剤の効果を評価した臨床試験では、より高いIGF-1レベルを達成したにもかかわらず、有効性の欠如が明らかになった(Sevigny et al 2008)。
興味深いことに、専用のアッセイを用いたIGF-1Rの高い測定刺激活性は、認知症の有病率および発生率の増加に関連していた(de Bruijn, er al 2014)。IGF-1のバイオアベイラビリティはIGFBPsによって厳密に制御されており、遺伝的または後天的な条件がIGF-1抵抗性の素因となる可能性があることを認識している(Suh er al 2008; Tazearslan er al 2011)。
分子および動物実験
アルツハイマー病における身体刺激性シグナル伝達の役割に光を当てようとする分子および動物研究もまた、論争がないわけではなかった。多くのげっ歯類研究は、相対的な IGF-1 欠乏および/または IGF-1 シグナル伝達の低下が、アルツハイマー病 病態の進行に対する保護をもたらすことを示唆している。
例えば、ヒト変異型アミロイド前駆体タンパク質(APP)およびプレセニリン-1(PS1)を発現するエイムズドワーフマウスは、対照よりも低い脳IGF-1レベルを示し、アミロイドプラーク沈着を減少させた(Puig et al 2016)。同様に、同様のADモデルにおけるIGF1Rのヘテロ接合体欠失は、年齢をマッチさせた対照と比較して、12〜13ヶ月齢のマウスにおいて、アルツハイマー病様症状、神経炎症、神経細胞の喪失、および遅延性タンパク質毒性から保護された(Cohen, er al 2009)。
神経細胞のIGF1RまたはIGF-1Rの下流でシグナルを発するIRS2の削除は、APPおよびAPP/PS1モデルにおいて、アミロイドプラーク蓄積の減少、神経炎症の減少、空間記憶の改善および遅延死を実証した(Freude, er al 2009; Gontier, er al 2015)。
しかし、アルツハイマー病の進行モデルではIGF-1シグナル伝達を減少させることには利益がなく(George, er al 2017)介入のための限られたウインドウ期間があるかもしれないことを示唆している。
神経細胞においてIGF1Rを特異的に欠失させた成人発症の場合も、ソーマと樹状突起への変化を介して神経細胞のサイズを減少させた(George et al 2017;Gontier et al 2015)ことから、体積が大きいことが必ずしもより良い機能と等しいとは限らないことが示唆された(Westwood et al 2014)。注目すべきことに、3xTg-ADマウスを、循環IGF-1レベルを30〜70%減少させるタンパク質制限サイクルにさらすと(Parrella et al 2013)ワーキングメモリおよび短期空間記憶障害の症状が緩和され、また、アルツハイマー病を有するヒトの認知障害に関連する海馬のタウリン酸化が減少した(Parrella et al 2013)(de Leon et al 2006)。
IGF-1がアルツハイマー病の病理学における有害なプレーヤーであることを示唆する証拠とは対照的に、IGF-1の加齢に伴う減少は、ADマウスモデルにおける脳代謝不全と関連しており(Carro, er al 2002; Trueba-Saiz, er al 2013)IGF-1の治療は、アミロイドペプチドの毒性効果から海馬ニューロンを保護することが示されている(Dore, er al)。 1997)。しかしながら、IGF-1の末梢投与が高齢ラットおよび変異マウスにおいてアミロイドβアミロイドのクリアランスを促進することを示した結果(Carro, er al)。
興味深いことに、ヒトAD脳における研究では、インスリン受容体基質-1(IRS-1)およびIGF-1R/IRS-2の下流シグナル伝達のそれぞれの活性化の減少を介して、インスリンおよびIGF-1抵抗性を文書化した(Tallbot et al 2012)。同様の知見がげっ歯類モデルで観察されている(Muller et al 2012;Trueba-Saiz et al 2013)。
IGF-1に対する脳の抵抗性が病理学的特徴なのか、それとも保護的適応なのかは不明である。しかしながら、早期アルツハイマー病のニューロンとIGF1Rノックアウトニューロンを比較した最近のゲノムワイドマイクロアレイ解析では、非常に類似したトランスクリプトームシグネチャーが示され、アルツハイマー病ニューロンにおけるIGF-1抵抗性は、さらなる損傷からニューロンを保護することを意図した適応応答である可能性を示唆している(George er al 2017)。
対照的に、いくつかの研究者は、関連ホルモンであるインスリンの中枢神経系入力の減少が認知障害の根底にあるかもしれないと提案しており、インスリンの経鼻送達がMCIまたは早期アルツハイマー病を有する個体において認知を改善することをデータが実証している(Claxton, er al 2015)。この後者の観察は、ADモデルから得られた結果とはやや矛盾しているように思われるが、介入試験のデータがMCIまたは早期アルツハイマー病の個人から得られたものであることに注意することが重要である。したがって、インスリンとIGF-1シグナル伝達と認知との関係は、疾患の感受性や重症度に応じて異なる可能性があり、その可能性を確認するためにさらなる研究が必要である。
メカニズム的には、多くの潜在的な経路やプロセスがIGF-1の影響を受けており、脳の老化、認知機能の低下、およびアルツハイマー病に影響を与えるために、中枢神経系に有益な効果と有害な効果の両方を持つ可能性がある。確かに、IGF-1は、神経新生、軸索および樹状突起の成長、シナプス形成、骨髄化、および神経細胞の生存に関連している(Liang, er al 2007; Nieto-Estevez, er al 2016)。
一方、増加したIGF-1シグナル伝達は、アルツハイマー病からの保護を付与することが示されている細胞プロセスであるニューロンにおけるマクロオートファジーを損なう可能性がある。マクロオートファジーは、オートファゴソーム内での隔離に続いて、リソソームとの融合に伴う分解を介して細胞成分を排除するプロセスであり、細胞にダメージを与えうる誤った折り畳まれたまたは凝集したタンパク質を排除する上で重要な役割を果たしている。このプロセスは、加齢だけでなく、パーキンソン病や散発性および家族性アルツハイマー病を含む加齢に関連した神経変性疾患においても機能不全であることが示されている(Lee, er al 2010; Martinez-Vicente and Cuervo 2007)。
実際、減少したソマトトロピックシグナル伝達は、マクロオートファジーの増加に関与している。線虫では、IGF-1シグナルの損失は、このモデルで観察された寿命延長に必要な経路であるオートファジーの改善と関連していた(Melendez, er al)。 ニューロンにおけるIGF1Rのノックアウトは、より良好なオートファジーおよびアミロイドβプラークのクリアランスをもたらした(Gontier et al 2015)
一方、IGF-1への長期暴露は、ヒト線維芽細胞におけるオートファジーの減少をもたらした(Bitto et al 2010)。オートファジーはまた、IGF-1Rの下流でシグナルを発する分子であるmTORまたはAMPKの阻害によっても誘導された(SamariおよびSeglen 1998; SchmelzleおよびHall 2000)。要約すると、実験的証拠のほとんどは、IGF-1がアルツハイマー病の進行において「ミスターハイド」として作用することを示唆している。しかし、IGF-1シグナル伝達が発症前にどのような役割を果たしているのかは、まだ確定的に決定されていない。
IGF-1とパーキンソン病
疫学的・臨床的研究
パーキンソン病(PD)は進行性の神経変性疾患であり、臨床的には安静時振戦、硬直、徐行性振戦を特徴とし、病理学的には大脳基底核の黒質(SN)のドーパミン作動性(DA)ニューロンの破壊によって特徴づけられる(Forno 1996)。しかしながら、パーキンソン病は、しばしば、他のタンパク質の間でα-シヌクレインを含む脳全体のレビー小体の蓄積と同様に、いくつかの他の認知機能および神経精神機能障害を伴うことが多く、神経変性プロセスが他の脳領域も標的としていることを示唆している(Mu、他 2017;Schappira、他 2017)。
循環IGF-1は、パーキンソン病の潜在的なバイオマーカーとして提案されている。薬物治療を受けた安定したパーキンソン病患者では、GHレベルの上昇を伴わないIGF-1レベルの有意に持続的な上昇が、健康な対照群と比較して認められた(Godau, er al 2010)。同様に、薬物治療を受けていない少数の患者では、対照群と比較して血清IGF-1レベルが上昇していることが示された(Godau, er al)。
IGF-1値の上昇は、パーキンソン病の罹病期間が短い患者でも認められ、罹病期間が長くなるにつれて低下し(Numao et al 2014)時にはコントロールに近いレベルに達することもあった(Godau et al 2010)。このことは他の研究でも確認されており、IGF-1,GH、IGFBP-3の上昇は、疾患期間が長く、より進行したパーキンソン病患者ではあまり顕著ではないことが指摘されている(Tuncel, er al)。
興味深いことに、パーキンソン病の診断基準を満たしていなくても、経頭蓋超音波検査で運動障害やSN異常を認めた患者でも、異常のない対照群と比較してIGF-1値が高いことが示された(Godau et al 2011)。実際、早期パーキンソン病患者を最大2年間追跡したプロスペクティブ研究では、ベースラインIGF-1値が上位4分の1の患者では、下位4分の1の患者と比較して、研究期間中ずっと運動障害とパーキンソン症状が悪化していたことが明らかになった(Picillo, er al)。 また、パーキンソン病患者では、対照群と比較して血清IGF-1およびIGFBPレベルの上昇が認められただけでなく、脳脊髄液中のこれらのタンパク質のレベルも上昇していたことが指摘されている(Mashayekhi, er al 2010)パーキンソン病では循環IGF-1がBBBを横断することが示唆されている。しかしながら、パーキンソン病が全身性IGF-1レベルの上昇と関連しているのか、自己分泌性IGF-1レベルの上昇と関連しているのか、あるいはその両方と関連しているのかについては、まだ解明されていない。
血清中IGF-1レベルは、パーキンソン病の他の症状との関連性も研究されている。パーキンソン病患者は一般集団と比較して認知症発症リスクが約6倍に増加している(Aarsland, er al 2001)。上記の報告とは対照的に、ベースラインのIGF-1レベルが高いパーキンソン病患者では、2年後の追跡調査で注意力および実行機能がより良好であることが示された(Pellecchia, er al)。 さらに、初期の薬物ナイーブパーキンソン病患者の大規模コホートを対象とした最近の研究では、IGF-1レベルが最も低い四分位にある人の間で、より悪い実行機能、注意力、および言語記憶が認められた(Picillo, er al 2017)。これらの観察結果は、IGF-1レベルが高い方が実際にはPD関連の認知機能低下に対して保護的であることを示しているかもしれないが、逆の因果関係を否定することはできず、IGF-1レベルが低い患者は、上記の研究で示唆されたように、実際には、より重度の認知障害を伴うより進行した持続性のあるパーキンソン病を有する可能性がある。
分子および動物実験
IGF-1とDAニューロンおよびパーキンソン病との関連性を示唆するいくつかの初期の証拠は、中高年の成人のSNに中程度の密度でIGF-1Rが存在することを示すオートラジオグラフィー研究から得られたものである(De Keyser, er al)。 ヒトおよび動物の細胞培養物を含む実験では、DAニューロンに対するIGF-1の神経保護作用が実証されている(Offen, er al 2001; Sun, er al 2010; Zawada, er al)。 1996)。E15ラット腹側中脳から得られた細胞培養物をIGF-1で処理すると、DAニューロンの数が2倍も保存される結果となった。追跡研究では、ラット小脳顆粒ニューロンへのIGF-1投与により、B細胞リンパ腫-2(Bcl-2)のタンパク質発現が増加し、この強力な細胞生存因子がIGF-1シグナル伝達の下流に位置し、DAのアポトーシスからの保護を提供することがさらに明らかになった(Offen et al 2001)。
IGF-1シグナル伝達の役割は、いくつかのPDモデルにおいても調査されている。そのようなモデルの一つは、神経毒である1-メチル-4-フェニルピリジニウム(MPP+)のプロドラッグである1-メチル-4-フェニル-1,2,3,6-テトラヒドロピリジン(MPTP)を用いて、パーキンソン病に特徴的なDA細胞傷害を誘導するものである。MPTP中毒は、IGF-1Rレベルの上昇をもたらしたが、Aktリン酸化レベルの変化を伴わなかった(D’Astous, er al 2006)。同じPDモデルを用いた別の研究では、MPTPの腹腔内注射により、対照と比較してIGF-1Rハプロインフレーション不全マウスでより重篤な病変が生じたことが明らかになり(Nadjar, er al 2009)さらにIGF-1シグナル伝達がこの傷害によって誘発された抗炎症およびプロオキシダント効果に対抗する可能性が示唆された(Nadjar er al)。 6-ヒドロキシドパミン(6-OHDA)を用いた別のPDモデルでは、ラットの片側性腓腹黒質病変を用いて、IGF-1を末梢または中央に投与することで、神経細胞の損失が減少し、運動機能が持続することが示された(Quesada and Micevych 2004)。興味深いことに、この研究では、末梢投与されたエストロゲンも保護作用を示したが、IGF-1RアンタゴニストはエストロゲンとIGF-1の両方の神経保護作用をブロックし、エストロゲンの神経保護作用はIGF-1シグナル伝達を介して媒介されている可能性が示唆された。
まとめると、IGF-1の中枢投与と末梢投与の両方で、動物PDモデルにおける神経保護効果が得られている。しかしながら、上記の参照された研究は、急性傷害戦略を用いてSN病変を導入したPDモデルを用いており、これは、α-シヌクレインなどのタンパク質の異常沈着を伴うゆっくりとした進行性の神経変性変化を特徴とするヒト疾患の病因とは異なることに注意することが重要である。
例えば、ショウジョウバエおよびC. elegansにおいて、IGF-1/インスリン様シグナル伝達(IIS)の低下は、パーキンソン病の特徴である神経毒性の低下およびαシヌクレインのミスフォールディングをもたらした(Knight, er al)。 さらに、IGF-1によって阻害されるプロセスであるオートファジー機能の障害は、パーキンソン病の病因に暗示されている(Menzies, er al 2017)。したがって、IGF-1の役割は、ヒトの疾患をよりよく表すPDモデルにおいてさらに調査される必要がある。
IGF-1と脳血管疾患
疫学的・臨床的研究
IGF-1の循環レベルが脳血管イベントのリスクと関連しているかどうかは、いささか曖昧なままである。Framinghamコホートの高齢者を対象とした最近の前向き研究では、ベースラインのIGF-1が最も低い5分位にある人の間で脳卒中の偶発症が2.3倍に増加したことが示された(Saber, er al)。 遊離IGF-1はまた、頸動脈内膜厚と逆相関していた(Schwab, er al)。 1997; Van den Beld, er al 2003);しかしながら、IGF-1,IGFBP-3,およびIGF-1:IGFBP-3モル比と、Cardiovascular Health Studyの高齢者参加者における脳卒中リスクとの間には関連性は確認されなかった(Kaplan, er al 2007)。一方、入れ子になった症例対照解析では、IGFBP-3の最下位4分の1の人で脳卒中リスクの増加が認められたが、IGF-1と脳卒中との関連は、IGFBP-3レベルを調整した後では有意ではなかった(Johnsen, er al)。
多くの研究で、脳卒中を持続した患者のIGF-1レベルと神経学的転帰における予後の役割が調査されている。初期の研究の1つでは、急性虚血性脳卒中患者のIGF-1およびIGFBP-3レベルは、非虚血性神経疾患を有する年齢をマッチさせた被験者と比較して、急性虚血性脳卒中発症後24時間以内の患者では低く、この差は発症後少なくとも10日間は持続することが明らかになった(Schwab et al 1997)。
他のいくつかの研究でも、同様に急性虚血性脳卒中患者(Denti et al 2004)および出血性脳卒中患者において血清IGF-1およびIGFBP-3レベルの低下が認められ(Fu et al 2002;磯 et al 2012)一方で、脳卒中後の血清IGF-1およびIGFBP-3レベルも梗塞容積と逆相関していた(Schwab et al 1997;Tang et al 2014)。
しかし、すべての結果が一貫しているわけではない。ある研究では、虚血性脳卒中発症後最初の10日以内にIGF-1レベルが高く、発症から3ヵ月後も高値を維持していたと報告されている(Åberg, er al)。 別の研究では、脳卒中発症から6時間以内に得られたIGF-1レベルと脳卒中重症度との関連は認められなかった(De Smedt, er al)。 しかし、同じ研究では、脳卒中急性期およびリハビリテーション期間中のIGF-1レベルの上昇は、脳卒中後の認知機能および機能回復の改善と関連していた。Åbergらは、急性期および脳卒中後3ヵ月のIGF1値の高さが、3ヵ月から24ヵ月の間の機能回復の改善と正の相関があることを示した(Åberg et al 2011)。脳卒中後のリハビリテーション中の患者の血清IGF1レベルの高さは、認知機能および機能回復の改善と関連していた(Bondanelli, et al 2006)。
一方、入院時の血清IGF-1レベルの低下は、急性虚血性脳卒中後の好ましくない機能的転帰と関連している(Klionsky、他 2016)。同様に、6ヵ月以上の持続性慢性片麻痺を有する患者から得られた血清サンプルは、IGF-1およびIGFBP-3の血清レベルが低いことを示した(Silva-Couto、他 2014)。
機能的転帰に加えて、IGF-1レベルは、脳血管イベント後の生存および退院との関係が調査されている。IGF-1血清レベルの低下は、虚血性脳卒中後90日目の死亡と関連している(Tang et al 2014)。虚血性脳卒中後24時間後に測定された60ng/mL未満のIGF-1レベルは、6ヵ月間の死亡率の上昇と関連していたが、神経障害の重症度とは関連していなかった(Denti er al 2004);しかしながら、研究されたコホートは実質的に高齢であったため、IGF-1の低値、および死亡率の高さは、高齢に起因している可能性がある。
対照的に、別の報告では、脳卒中後72時間以内および1週間以内に測定した血清IGF-1レベルおよびIGF-1/IGFBP比の低下が、入院期間の短縮と関連していることが示されている。しかし、血清IGF-1値が高い患者では梗塞が大きく、その高値はより強固な代償的防御反応を反映している可能性がある(Mattlage, er al)。
分子および動物実験
虚血性神経損傷の設定では、IGF-1は神経栄養活性および神経保護活性を有することが実証されている(Chung, er al 2007; Gluckman, er al)。 1992; Hu, er al 2009; Knusel, er al)。 1990)。BBBを横断することができる循環IGF-1(De Geyter, er al 2016)および増殖ミクログリアによって産生される局所IGF-1は、脳卒中後の神経学的回復を促進することに暗示されている(Lalancette-Hébert, er al 2007; Ploughman, er al 2005; Thored, er al 2009)。ラットの中大脳動脈閉塞(MCAO)後、IGF-1の発現は虚血性ペンブラ周辺のアストロサイトおよびニューロン前駆細胞で増加していることがわかった(Yan, er al 2006);一方、IGF1中和抗体の投与は前駆細胞の増殖を有意に減少させることから、IGF-1が脳卒中後のニューロン回復に重要な成長因子である可能性が示唆された。また、物理療法の文脈における神経学的および機能的回復が、梗塞周囲領域におけるIGF-1および下流のAktシグナル伝達の著しい活性化と関連していることを示す証拠も示されている(Zheng, er al 2014)。一方、マウスのMCAO処置前の血清IGF-1レベルの上昇は、より大きな梗塞サイズと相関していた(Endres, er al 2007)。
脳血管機能の障害は、いくつかのGHおよび/またはIGF-1欠損モデルでも実証されている。そのようなモデルの一つがルイスドワーフラットであり、遺伝的なGH欠損は、他の転帰の中でも特に晩期の脳卒中の発生率を増加させる結果となっている(Sonntag, er al)。 同様に、IGF-1のノックダウンされた発育後の肝臓のマウスモデルにおける研究は、IGF-1欠損が高血圧に対する脳血管適応に負の影響を及ぼし、この機能不全は、BBB破壊に関連している可能性が高く、神経炎症と同様に、老化表現型を模倣していることを示している(Toth、他 2014)。さらに、活性化されたニューロンのエネルギー要求に局所脳血流を調整するプロセスである神経血管結合は、加齢とともに減少することが知られている(Toth, er al 2015)。同じIGF-1欠損マウスモデルを用いて、Tothらは、循環するIGF-1欠損が、加齢とともに見られるものに類似した、神経血管障害およびそれに伴う認知機能の低下をもたらしたことを示した(Toth et al 2015)。したがって、これらの研究は、循環IGF-1が脳微小血管機能に支持的かつ保護的な効果を有するという主張を支持するものである。
GH/IGF-1が関与するいくつかの治療的介入が、虚血性脳卒中モデルにおいて研究されている。酸素と栄養分が奪われた海馬細胞培養において、IGF-1とIGFBP-リガンド阻害剤は細胞死を予防した(Mackay, er al 2003)。同様に、IGF-1をICVで投与すると、動脈結紮によって誘導された低酸素性虚血性脳損傷のいくつかのげっ歯類モデルにおいて、神経細胞の損失が減少し、神経学的転帰が改善された(Guan, er al 2001; Guan, er al)。 1993; Mackay, er al 2003; Schäbitz, er al 2001)。同様の結果は、脳虚血にさらされた羊の胎児においても報告されている(Johnston, er al)。 1996)。ラットのエンドセリン誘発脳卒中において、ICVによるGH投与は運動機能を改善した(Pathipati, er al 2009)。神経虚血性障害後のIGF-1の投与経路として、経鼻投与(Fletcher, er al 2009; Lin, er al 2009; Liu, er al 2001)、皮下投与(Schäbitz, er al 2001)、筋肉内投与(Chang, er al 2010)、静脈内投与(Rizk, er al 2007)などの他の方法も有効であることが示されている。興味深いことに、ヒト骨髄間質細胞の投与は、MCAO誘発性虚血性梗塞のラットにおける機能回復を改善し、虚血境界および脳室下帯の細胞におけるIGF-1 mRNA発現およびIGF-1R免疫反応性の増加と関連していた(Zhang, er al 2004)。
IGF-1の投与はまた、中年ラットにおける虚血性脳卒中に対するエストロゲンの負の効果を改善した(Selvamani and Sohrabji 2010)。ヒトIGF-1を含むアデノ随伴ウイルスベクターのICV注入は、マウスにおける虚血性傷害後の機能回復の延長および強化された神経新生を促進することが示されている(Liu, er al 2017; Zhu, er al 2008)。別の研究では、IGF-1シグナル伝達関連miRNAを標的としたアンタゴニストは神経保護を促進した(Selvamani, er al 2012)。IGF-1と脳血管疾患との関連性を検討したエビデンスは、ヒトではやや曖昧なものであったが、分子研究や動物研究と組み合わせると、IGF-1が脳血管系にとって有益な因子である可能性が高く、虚血性障害後の神経細胞の回復を助けることが示された。
老化する脳のIGF-1の “奇妙なケース” ジキル博士かハイド氏か?
図1にまとめられているように、脳の老化とその関連疾患におけるIGF-1の役割を検討している証拠の幅広さと深さを考慮すると、中枢神経系におけるこの多能性ホルモンに関連する多くの側面を取り巻く実質的な不確実性は依然として存在している。
動物実験やヒト実験で報告されているこれらの相反する知見の多くをどのように調整するかはまだ完全には明らかになっていないが、微妙ではあるが重要なニュアンスや矛盾点を詳しく見ていくことで、この問題に何らかの光を当てることができるかもしれない。
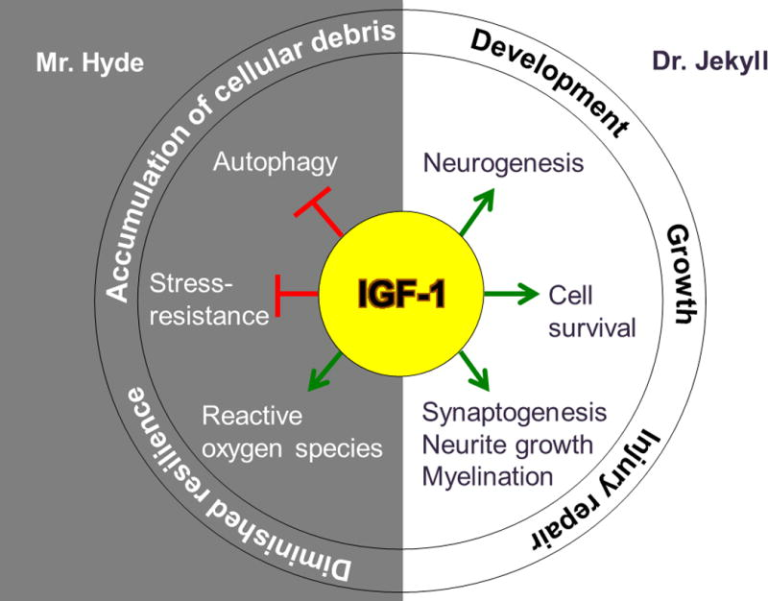
図1 脳内でジキル博士とハイド氏の役割を演じるIGF-1
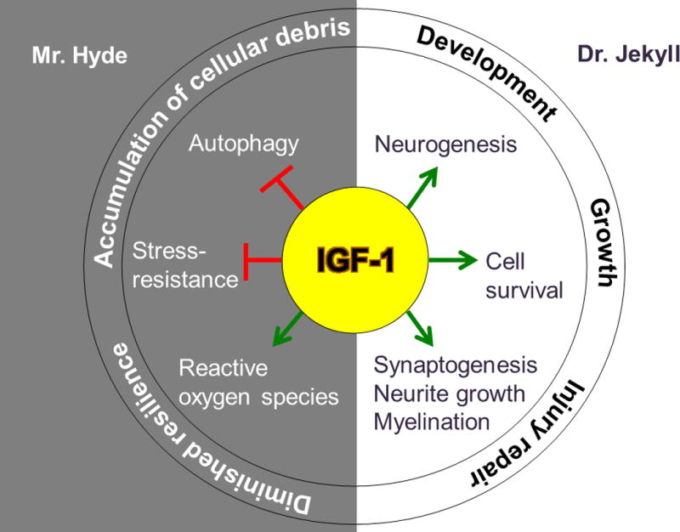
IGF-1は、神経新生、シナプス形成、ニューライト成長、骨髄化、細胞生存の促進を刺激することにより、脳に有益な効果を発揮する。これらのプロセスは、脳の適切な発達と成長のために早期に重要であるが、加齢に伴い、脳卒中のような損傷を受けた神経組織の修復に寄与する。
一方、IGF-1の脳への悪影響には、活性酸素の発生、オートファジーとストレス応答の両方の阻害がある。これらの機能が阻害されると、細胞の回復力が低下し、細胞デブリが蓄積され、アルツハイマー病やパーキンソン病などの加齢に伴う神経変性疾患に特徴的な症状が現れる。
加齢による脳への影響
IGF-1が正常な脳の発達に必要であることは十分に確立されているが(アミロイドβuzzahab er al 2003; Kranzler er al)。 1998; Netchine er al 2011; Woods er al)。 1996)加齢脳におけるIGF-1の役割はあまり明らかにされていない。
げっ歯類モデルから得られたほとんどの証拠は、脳内のIGF-1レベルを上昇させる介入が、そうでなければ健康な老化脳に有益であることを示唆しているが、ヒトや疾患モデルを用いた研究では一貫して確認されていない。
早期に発生した後、中枢神経系は成長と拡張から保存に優先順位を移す。したがって、発育期と同様に生涯を通じてIGF-1シグナル伝達の頑健性を維持することは、実際には逆効果であるか、あるいは有害でさえある可能性がある。
加齢は、アルツハイマー病やパーキンソン病のような異常なタンパク質沈着を伴う神経変性疾患の最大の危険因子であることから(Kaushik and Cuervo 2015; Martinez-Vicente and Cuervo 2007)加齢に伴うIGF-1の生理的低下は、機能不全タンパク質のクリアランスおよび細胞維持に有利な環境を促進することにより、これらの疾患に対する保護的役割を果たす可能性がある。
一方、高齢者では、脳卒中や外傷性脳損傷などの急性神経損傷の状況下では、神経再生が維持よりも優先されるため、IGF-1の一時的な上昇が恩恵を受ける可能性がある(Bianchi, er al 2017)。
この仮説は、アルツハイマー病のほとんどのモデルがIGF-1シグナル伝達の減少から利益を得るという知見によって支持されている。逆に、急性虚血性障害のモデルでは、より高いIGF-1は回復を改善する(Åberg et al 2011;Bondanelli et al 2006)。
しかし、PDモデルは注意して解釈する必要がある。黒質突起損傷を誘発するモデルでは、IGF-1はDAニューロンの損失に対して保護的であるようであるが、このアプローチは、ヒトのパーキンソン病に特徴的な進行性のニューロン変性というよりは、突然の虚血性または外傷性損傷で起こる急性ニューロン損傷を連想させるものである。
興味深いことに、無脊椎動物におけるIISを介したシグナル伝達の減少は、異常なα-シヌクレイン蓄積からの保護を付与した(Knight et al 2014)。したがって、パーキンソン病におけるIGF-1の役割は、パーキンソン病のより代表的なモデルでさらに調査されるべきである。
ヒト観察研究の限界
体性軸を含む内分泌経路は、動的で適応性があり複雑である。したがって、所望の恒常性を維持するために、ホルモン分泌およびバイオアベイラビリティーは生理学的ストレス因子に反応して大きく変化する可能性がある。これは、IGF-1レベルの軌跡が絶対レベルよりも死亡率を予測した研究によって強調された(Sanders, er al 2017)。ストレスや病気は、GH脈動性およびGH抵抗性の変化を介して、体性シグナリングを減衰させることができる(Van den Berghe 2001)。
あるいは、低IGF-1レベルは、神経変性疾患患者の視床下部にアミロイドプラークと神経原線維のもつれが蓄積し、内分泌機能を混乱させるという証拠があるので、アルツハイマー病またはパーキンソン病の結果であり、より重篤な疾患のマーカーとして役立つかもしれない(Ishii and Iadecola 2015)。さらに別の説として、IGF-1の減少は、神経細胞の機能を維持するために、増殖から細胞維持へと資源をシフトさせるために体が採用している代償メカニズムではないかという説もある(George er al 2017)。
一方、低IGF-1レベルは、遺伝的変異体の存在による生涯低IGF-1を反映している可能性がある。同様に、IGF-1レベルの上昇は遺伝する可能性がある(Suh er al 2008)。さらに、末梢レベルは、脳内の脆弱な細胞を保護するために誘導される適応応答のために、中枢神経系シグナル伝達との関連性を持たない可能性がある(George er al 2017; Talbot er al 2012)。
対照的に、IGF-1レベルは、損傷した神経組織を修復する努力のために、神経細胞の損傷に応答して上昇する可能性がある。これらの生物学的シナリオは、同じ測定されたIGF-1レベルが異なる生理学的プロセスを反映している可能性があり、長期的な追跡調査および遺伝学的研究によってのみ区別できることを示している。
IGF-1レベル対機能
ほとんどの臨床観察研究は、体性軸シグナリングのサロゲートとして、IGF-1のレベルなどの単一の分子表現型に焦点を当てている(Al-Delimy er al 2009; Doi er al 2015; Ostrowski er al 2016; Tumati er al 2016; Westwood er al 2014)。しかしながら、経路の複雑さおよびその多くの相互作用成分を考慮すると、経路の機能は、単にIGF-1レベルを測定するだけでは確実に解釈できないことが明らかである。
例えば、このようなアプローチは、IGF-1R抵抗性のためにIGF-1レベルを上昇させる機能的なIGF1R変異を有する個体では誤解を招く可能性があり、それによってIGF-1シグナル伝達が低下しているのではなく、むしろ増強していると誤分類される(Suh et al 2008;Tazearslan et al 2011)。
同様に、特定の疾患状態に伴う脳内のIGF-1RおよびIRS-2のレベルでのIGF-1抵抗性は、血清IGF-1で観察される代償的な上昇を説明する可能性がある(Talbot er al 2012; Trueba-Saiz er al 2013)。
ヒトの研究におけるIGF-1シグナル伝達のより正確な特徴付けは、ソマトトロピック経路の主要な中間体をコードする遺伝子の機能的な遺伝子変異を考慮し、機能的な研究を行うことによって達成することができる。
おわりに
実験モデルにおける内分泌系GH/IGF-1シグナル伝達の遺伝子的障害は、健康寿命と寿命を延長させていることは疑いようがない。脳の老化モデルはより複雑であるが、老化脳におけるIGF-1の役割の理解には大きな進歩があった。脳の老化に対するIGF-1の効果を最終的に決定するのは、あらゆるダイナミックな生物学的システムで起こるプロセスである。それは、変化する生理学的環境に適応してIGF-1シグナルを調節する細胞の能力である。
このように、中枢神経系におけるIGF-1の機能は、寿命や異なる病理学的条件によって異なる可能性が高い。以上の結果から、アルツハイマー病やパーキンソン病などの加齢に伴う神経変性疾患の原因となる細胞ゴミや損傷が蓄積しやすい加齢ニューロンを長期的に維持するには、IGF-1シグナル伝達の低下が有効であることが示唆された。
一方、脳卒中などの急性神経障害からの回復は、IGF-1が高い場合に増強される。このような証拠は、IGF-1が加齢に伴う脳の老化において、状況に応じて善玉の役者であったり、悪玉の役者であったりする二重の役割を果たしていることを示している。このような複雑さを受け入れることは、最終的には、脳の老化に役立つような状態を対象としたより良い治療法につながる可能性がある。
しかし、そのような治療法が検討される前には、まだ多くの重要な疑問が残っている。その中には以下のようなものがある。
- 高齢化した中枢神経系における自己分泌系と内分泌系由来のIGF-1の相対的な寄与度は?
- ミクログリア、平滑筋細胞、内皮細胞、アストロサイトなどの中枢神経系に存在する他の細胞に対するIGF-1の影響は、ニューロンに対するものと比較してどのようなものか。
- 加齢脳におけるIGF-1の急性上昇と慢性上昇の影響はどのようなものか。
- IGF-1の低値は老化の加速の兆候なのか、それとも遺伝的にエンコードされた老化防御機構なのか。
- いくつかの研究が示唆しているように、老化脳における性とIGF-1との間には相互作用があるのか?
- アルツハイマー病とパーキンソン病の現在の実験モデルは、ヒトの病態生理をよく表しているのか?
- インスリン受容体を介したIGF-1シグナリングの効果は何か?
- GH/IGF-1シグナル伝達の生涯にわたる障害の現在の遺伝モデルは、加齢に伴うIGF-1の低下を代表するものか?
- GHとIGF-1の差動効果は何か?
- IGF-1が低いか高いかは、病気の原因なのか、病気への適応なのか、あるいは結果なのか?
しかし、他の多くの疑問については、動物モデルを用いて答えを得る必要がある。したがって、IGF-1と脳の老化および中枢神経系疾患との関係を理解しようとする試みは、老化した脳におけるIGF-1のハイド氏の資質ではなく、ジキル博士の資質をどのように呼び起こすかについて、より大きな洞察を得るための重要な課題と機会を提供するものである。
関連論文
アルツハイマー病におけるインスリン様成長因子I受容体刺激活性とアポリポ蛋白Eの役割の再検
要旨
背景インスリン様成長因子I(IGF-I)シグナル伝達の変化は、認知症やアルツハイマー病と関連し
ている。IGF-Iレベルと認知症リスクとの関連についての研究は、これまで結論が出ていない。我々は、IGF-I受容体刺激活性のレベルが高いほど認知症の有病率と発症率が高いことを先に報告している。
目的本研究では、フォローアップ期間を 16 年に延長し、IGF-I 受容体刺激活性と認知症との関連
性の頑健性を検証し、アポリポ蛋白質 E(ApoE)による効果修飾の可能性を検討した。
方法方法:Rotterdam Study の高齢者 1,014 名を対象に、ベースライン時に IGF-I キナーゼ受容体
活性化(KIRA)法を用いて循環 IGF-I 受容体刺激活性を測定した。認知症はベースライン(1997~1999)から 2015年1月の追跡調査まで評価した。IGF-I受容体刺激活性と認知症発症との関連をCox比例ハザードモデルを用いて評価した。
結果
10,752人年の追跡期間中に174人が認知症を発症した。追跡期間を延長したところ、IGF-I受容
体刺激活性と認知症リスクとの間に用量反応関係は認められなかった[調整オッズ比1.11;95%信頼区間(CI)0.97-1.28]。興味深いことに、我々はApoE-ε4とIGF-I受容体刺激活性の三位一体との間に相互作用の証拠を見いだした。中央値および上位のIGF-I受容体刺激活性は、ApoE-ε4対立遺伝子のヘテロおよびホモ接合体における認知症発症率の増加と関連していたが、ApoE-ε4対立遺伝子を持たない人では認知症リスクとの関連は示さなかった(ApoE-ε4キャリアにおける調整オッズ比中位 vs 低IGF-I受容体刺激活性:1.45;95%信頼区間(CI)1.00-2.12)。これらの知見は、ApoE-ε4キャリアにおける閾値効果を示唆している。IGF-Iシグナル伝達のダウンレギュレーションは認知症リスクの増加と関連しているという仮説に沿って、認知症を発症していないApoE-ε4ホモ接合体は、ヘテロ接合体および非キャリアと比較して低いレベルのIGF-I受容体刺激活性を示した。
結論
本知見は、IGF-Iシグナル伝達と認知症の神経病理との関連性に新たな光を当てるものであり、認知症リスクの推定マーカーとして血清中の総量ではなくIGF-I受容体刺激活性を用いて、他のコホートでの再現性を求めるものである。
www.ncbi.nlm.nih.gov/pmc/articles/PMC6380107/